制造抗原特异性t淋巴细胞的方法
1.本发明涉及制造抗原特异性t淋巴细胞(celltrag)的方法以用于其在免疫治疗中的临床用途。以这种方式产生的celltrag适用于治疗自身免疫性疾病,包括例如多发性硬化症、类风湿性关节炎、1型糖尿病,以及用于抑制不良免疫反应,如移植物排斥、过敏反应和移植物抗宿主病gvhd。
2.treg淋巴细胞约占所有外周血淋巴细胞的1%,但对于维持其自身组织的耐受性很重要(trzonkowski p 2009)(vignali da 2008)(yi s 2012)。缺乏调节性t细胞会导致许多自身免疫性疾病和超敏反应,如x连锁免疫缺陷综合征、多内分泌病变和肠病变(ipex)患者的情况所见(gambineri e 2003)。treg淋巴细胞可以被称为“智能类固醇(intelligent steroids)”,因为作为类固醇,它们抑制炎症反应并发挥免疫抑制作用,而相比之下,treg细胞的生理抑制作用仅涉及病理反应(例如针对其自身组织的病理反应)。包括我们的观察结果在内的临床试验结果表明,treg淋巴细胞治疗是安全的,不会损害针对外来危险抗原(病毒、细菌、癌细胞)的免疫反应(marek-trzonkowska n 2012)(marek-trzonkowska n 2014)(martelli mf2014)(bluestone ja 2015)。
3.我们的研究团队对treg淋巴细胞的生物学和临床应用进行了10多年的研究。我们首次使用体外扩增的treg细胞来治疗成人移植物抗宿主病(gvhd)(nkebn/458-310/2008)(trzonkowski p 2009)以及儿童1型糖尿病(t1d)(tregvac isrctn06128462;tregvac2.0eudract:2014-004319-35)(marek-trzonkowska n 2012)(marek-trzonkowska n 2014)和多发性硬化症(tregsm eudract:2014-004320-22)(trzonkowski p 2015)。目前,世界上的其他中心也进行了使用treg细胞的临床试验,使用treg细胞的临床试验涉及gvhd的治疗/预防(di ianni m 2011)、成人t1d治疗(nct01210664)以及肾移植(nct02091232和nct02129881)和肝脏(thril nct02166177和nct01624077)的耐受性的诱导。近年来,使用treg淋巴细胞作为治疗工具的细胞疗法的动态开发已经开始。目前,世界上大约有40项临床试验使用这些细胞进行。所有这些项目都以一个目标为指导,即智能免疫抑制,这将抑制不需要的免疫反应而不损害生理免疫反应(trzonkowski p 2015,gliwi
ń
ski m 2017)。
4.在上述研究中,treg淋巴细胞取自患者外周血或脐带血单位。最好的分离方法是使用分选仪,这会产生这些细胞的非常纯的(97-100%)群。通常,分离具有cd3 cd4 cd25high表型或cd3 cd4 cd25highcd127表型或cd3 cd4 cd25highcd127low表型的淋巴细胞(application p.399447)(trzonkowski p 2009)(marek-trzonkowska n 2012)(marek-trzonkowska n 2014)(trzonkowska p 2015)。然后将分离的细胞活化以进行10-14天的强增殖以获得足以施用于患者的量。有效扩增必须在维持完整表型(特别是包括foxp3因子高表达)的条件下进行,这取决于特定的实验室活动(marek n 2011、 k 2013、marek-trzonkowska n 2017)。此外,由于treg淋巴细胞制剂被归类为先进治疗药物(atmp)并受制药法和欧洲议会第1394/2007号的“关于先进治疗药物产品”的条例制约,这种临床应用方案中的扩增必须按照良好生产规范(gmp)的标准进行。
5.使用根据上述方案产生的细胞意味着它们的多特异性——它是一组对许多不同
抗原具有特异性的淋巴细胞,因此它们在施用后的有效性是有限的。当然,以下事实会影响多特异性(多克隆)产品的高效率:所有treg淋巴细胞都具有炎症部位趋向性、调节“旁观者”类型的能力以及在感染耐受性的基础上将其他细胞转化为调节表型的能力。然而,这种产品的有效性可以通过将细胞靶向特定抗原来提高。这样,这种抗原特异性treg淋巴细胞只能迁移到发生这种抗原表达的部位,并选择性地抑制仅在由这种抗原刺激引起的炎症反应部位处识别这种抗原的病理效应细胞的活性。在自身免疫疾病的情况下,可以抑制对受影响器官的破坏(例如,1型糖尿病中产生胰岛素的胰岛或多发性硬化症中的髓鞘)。同时,它会限制treg淋巴细胞的全身副作用,treg淋巴细胞不会环绕整个淋巴系统,只会对表达它们敏感的特定抗原的部位表现出趋向性。
6.开发一种安全、使用简单同时经济可行的方法来增殖具有特定抗原特异性和高抑制潜力的稳定treg淋巴细胞对于使用treg细胞作为治疗工具的临床试验的开发和成功至关重要。
7.另一个问题似乎是过度的免疫反应,也称为对过敏原的超敏反应。大多数这些疾病都成功地使用现有药物对症治疗。然而,某些形式的超敏反应会导致严重的残疾,甚至导致死亡的并发症。疾病过程通常会随着时间的推移而发展,炎症加剧,导致气道的永久性结构变化,并且使用的药物不再有效(panettieri ra jr 2008)(barbaro mp 2014)。在这种情况下,抗原特异性treg淋巴细胞也可能成为现代抗过敏药物。
8.总之,用于治疗自身免疫性疾病、过敏症和移植物接受者的安全有效的药物是那些最大限度地选择性调节免疫系统对明确定义的负责不需要的免疫反应(例如,自身免疫性疾病或过敏、排斥器官、移植物抗宿主病)的抗原的反应,同时不损害对外来和危险抗原的生理免疫反应的药物。这种智能免疫抑制的机会正是抗原特异性treg淋巴细胞。然而,treg细胞临床治疗成功的条件是开发一种患者安全的方案来扩增这些淋巴细胞,这将保证大量的抗原特异性细胞,同时在整个培养过程中保持其稳定性和抑制活性(tang q 2013)。本专利申请中描述的方法满足上述要求。
9.具体而言,本发明提供了制备用单克隆抗体标记并分选的抗原特异性t淋巴细胞的方法,其中淋巴细胞:
10.a)通过使用载有抗原的自体单核细胞而产生;
11.b)使要产生的调节性t淋巴细胞或效应性t淋巴细胞悬浮在pbs中并用荧光染料在细胞内染色;
12.c)接着避光孵育淋巴细胞;
13.d)随后将淋巴细胞用培养基强力洗涤数次;
14.e)使用细胞内荧光染料染色的调节性t淋巴细胞或效应性t淋巴细胞悬浮在载有抗原的经伽马射线辐照的自体cd14 单核细胞的培养基中;
15.f)将调节性t淋巴细胞或效应性t淋巴细胞与cd14 单核细胞的共培养物与抗cd154和抗cd28抗体共同孵育;
16.g)将共培养物在培养基中孵育;和
17.h)将孵育后的抗原特异性t淋巴细胞基于低强度的细胞内染料进行分类,其中低强度的荧光是抗原特异性的标志,因为荧光损失与增殖强度相关。
18.在如上定义的方法中,优选调节性t淋巴细胞或效应性t淋巴细胞以以下浓度悬
浮:1
×
106个细胞/ml pbs。
19.在如上定义的方法中,优选淋巴细胞用以下荧光染料之一染色:终浓度为1-5μm的cfse或violet blue。
20.在如上定义的方法中,优选将淋巴细胞在室温或37℃下孵育20分钟。
21.在如上定义的方法中,优选自体单核细胞以1:1的单核细胞:淋巴细胞最终比率添加到共培养物中。
22.在如上定义的方法中,优选单核细胞经伽马射线辐照。
23.在如上定义的方法中,优选单核细胞和淋巴细胞的共培养物与终浓度为5μg/ml的抗cd154抗体和终浓度为5μg/ml的抗cd28抗体一起孵育。
24.在如上定义的方法中,优选共培养物在37℃下在5%co2中孵育。
25.在如上定义的方法中,优选在功能测试中评估对抗原的特异性,该功能测试中抗原特异性t淋巴细胞,特别是基于细胞内染料的低荧光而分选的t淋巴细胞,比非特异性t淋巴细胞,特别是基于保留细胞内染料的高荧光而分选的t淋巴细胞更具活性,其中,在调节性t淋巴细胞的情况下,活性被定义为对效应性t淋巴细胞功能的抑制,而在效应性t淋巴细胞的情况下,活性被定义为增殖强度提高和细胞因子和细胞毒性因子的产生强度提高。
附图说明:
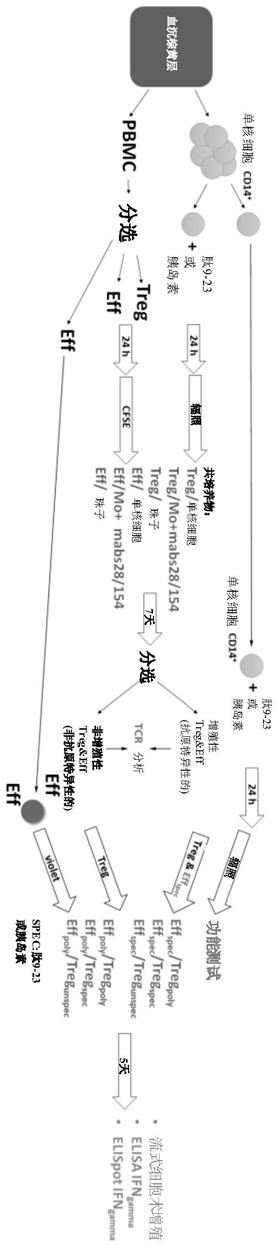
26.图1
–
展示了实验方案。血沉棕黄层被分离为单核细胞和淋巴细胞。淋巴细胞被分选为调节性t细胞(treg)和效应性t细胞(eff),用cfse染色并用预载有肽(胰岛素或肽9-23)的经辐照的单核细胞刺激。使用抗cd3/抗cd28珠子产生多克隆treg和eff。共培养7天后,使用图2c和2d中所示的方案,根据cfse的稀释荧光将细胞分选为抗原特异性和非特异性细胞。然后在功能测试中测试获得的treg多克隆(treg
poly
)、抗原特异性(treg
spec
)和非特异性(treg
unspec
)亚群,其中响应物是violet染色的自体效应性t细胞,无论该自体效应性t细胞是多克隆的(eff
poly
)或是抗原特异性的(eff
spec
)。使用预载有抗原的经辐照的单核细胞进行刺激,制备eff
spec
。
27.图2
–
展示了抗原特异性调节性t细胞分选方法。为了将tregs与其他细胞区分开来(a),特别是与刺激期间使用的抗原呈递单核细胞区分开来,将它们用荧光染料染色(b)。共培养结束后,将识别排列在荧光减弱场(p1门)中的抗原的treg淋巴细胞分类为单独的抗原特异性群体。
28.图3
–
展示了与单核细胞的共培养物中响应抗原的treg的百分比。分析涵盖了与呈递抗原(胰岛素或肽9-23)的单核细胞共培养的treg细胞。在一些培养物中,添加单克隆抗体抗cd28和抗cd154(mabs28/154)以提供第二信号。评估了增殖性(抗原特异性)treg的百分比(a)和表达高强度foxp3表达(高)和增殖性(浅蓝色)或非增殖性(深蓝色)treg的百分比(b)。结果表示为平均值 /-sd。在图表c中的点图中显示来自用装载有胰岛素的单核细胞刺激的共培养物的分析实例,图表d中的点图显示来自用载有肽9-23的单核细胞刺激的共培养物的分析实例。点图中cd4对violet的门显示左侧为增殖性(spec)抗原特异性treg而右侧为非增殖性(unspec)非特异性treg。箭头链接到显示foxp3表达的相应点图。上方的门代表细胞的foxp3
high
亚群,下方的门代表foxp3
low
亚群。
29.图4
–
展示了treg淋巴细胞克隆性。通过单个类别的tcr受体(vβ链)的表达来测量
treg淋巴细胞的克隆性。培养前的(“treg poly”)和与呈递抗原(胰岛素或9-23肽)的单核细胞共培养后的treg淋巴细胞克隆分析的示例,共培养后的treg淋巴细胞根据增殖能力进行分选:增殖细胞(“treg specific”)和非增殖细胞('treg unspecific')。在箭头上,克隆确定为在共培养期间优先刺激增殖(共培养后相对于“treg poly”的百分比明显增加)。在所进行的每一次培养中,都有具有不同vβ表达的克隆,在每次培养中优先增加不超过一或两个克隆,并且生长不超过百分之几。
30.图5-展现了功能测试-抑制效应性t淋巴细胞增殖。生成的treg亚群(tregs),例如多克隆(tregs poly)细胞、对胰岛素或肽9-23具有抗原特异性(treg spec)的细胞和非特异性(treg unspec)细胞与自体效应性t细胞(effector)以图底部给出的比例共培养。效应性细胞被视为响应物,无论该效应性细胞是多克隆的(上图表a)或是抗原特异性的(下图表b)。然后用预载有胰岛素或肽9-23的经辐照的单核细胞刺激共培养物。读数是对响应物的增殖的抑制。结果仅按照响应物的培养物建立索引,其增殖总是被视为100%。结果显示为平均值 /-min.-max。显著差异用/*和p值标记。
31.图6-展示了功能测试-效应性t淋巴细胞对ifnγ的产生的抑制(elisa)。生成的treg亚群(tregs),例如多克隆(tregs poly)细胞、对胰岛素或肽9-23具有抗原特异性(treg spec)的细胞和非特异性(treg unspec)细胞与自体效应性t细胞(effector)以图底部给出的比例共培养。效应性细胞被视为响应物,无论该效应性细胞是多克隆的(上图表a)或是抗原特异性的(下图表b)。然后用预载有胰岛素或肽9-23的经辐照的单核细胞刺激共培养物。读数是响应物对ifnγ的产生的抑制。结果仅按照响应物的培养物建立索引,其增殖总是被视为100%。结果显示为平均值 /-min.-max。显著差异用/*和p值标记。
32.图7-展示了功能测试-效应性t淋巴细胞对ifnγ的产生的抑制-elispot。生成的treg亚群(tregs),例如多克隆(tregs polyclonal)细胞、对胰岛素或肽9-23具有抗原特异性(treg specific)的细胞和非特异性(treg unspecific)细胞与作为响应物的自体效应性t细胞共培养,无论该自体效应性t细胞是多克隆的或是抗原特异性的。treg与效应性细胞以图顶部给出的比例共培养。然后用预载有胰岛素或肽9-23的经辐照的单核细胞刺激共培养物。读数是响应物对ifnγ的产生的抑制。结果显示为特定孔中的培养物和斑点数量的图片。
33.本发明通过以下实施例进行说明,但不限于此。
34.材料和方法
35.方法和功能分析的概述如图1所示。
36.献血者
37.血沉棕黄层从格但斯克(gda
ń
sk)的地区血液捐献和治疗中心获得。
38.b:9-23胰岛素肽和胰岛素
39.b:9-23胰岛素肽在lipopharm(波兰格但斯克)合成为白色粉末,使用hplc方法测得纯度》90%。将肽溶解在去离子高压灭菌水中,最终浓度为0.5μg/μl,并在-70℃下储存不超过3个月。
40.测试中使用的胰岛素是市场上可买到的(novo nordisk a/s),并储存在2-8℃的冰箱中。
41.细胞分离和分选
42.调节性t细胞和效应性t细胞
43.图2展示了细胞制备和分选的概述。通过ficoll-hypaque梯度离心从健康志愿献血者获得的血沉棕黄层中分离外周血单核细胞(pbmc),并新鲜使用。根据我们之前描述的方案,treg和teff是新鲜分离的。简而言之,根据制造商的说明,使用easysep人cd4 t细胞富集试剂盒(stemcell technologies)通过阴性选择来分离cd4
t细胞。随后,cd4
t细胞用对以下抗原具有特异性的单克隆抗体(mab)染色:cd3、cd4、cd25和cd127。然后,用facs ariaiiu分选仪(bd biosciences,usa)将细胞分选为以下表型:treg:cd3
cd4
cd25
high
cd127-/
low
lin-doublet-,和teffs:cd3
cd4
cd25-cd127
high
lin-doublet-。分离的treg淋巴细胞和teff细胞在单独的板上培养,并在37℃下在符合gmp标准的培养基x-vivo20(lonza)中孵育。培养基中添加了热灭活的人ab血清(10%)、白细胞介素2(il-2;2000u/ml;proleukin;加州圣地亚哥chiron)、青霉素(100u/ml)和链霉素(100mg/ml)24小时。
44.单核细胞
45.根据制造商的说明,使用easysep
tm
人cd14阳性选择试剂盒ii(stemcell technologies)通过阳性选择分离自体cd14 细胞,纯度高于95%。然后培养分离的单核细胞(106个细胞/孔)并在37℃下在符合gmp标准的培养基x-vivo20(lonza)中孵育。添加先前预先制备的肽溶液(25μg/孔/ml)或胰岛素(100μl/孔/ml)24小时。我们准备了三种条件:单核细胞用b:9-23胰岛素肽(mo
9-23
)、胰岛素(mo
ins
)来刺激或无刺激(mo)。
46.染料标记和细胞扩增
47.单核细胞
48.孵育24小时后,从孔中收集单核细胞并用伽马射线辐照(在如对血液制剂进行辐照的标准条件下),计数并以1
×
106个细胞/ml的终浓度重悬于新鲜培养基(x-vivo20)中。
49.treg细胞和teff细胞
50.分选后24小时,从孔中收集调节性t淋巴细胞,用pbs洗涤以去除影响染色的血清。然后将细胞以1
×
106个细胞/ml的浓度重悬于pbs中,并以1μm至5μm的最终cfse浓度用cfse(cell trace cfse细胞增殖试剂盒,life technologies)染色。将细胞在37℃避光孵育20分钟,然后用pbs接着用培养基(x-vivo20 10%血清 青霉素/链霉素)强烈洗涤数次。效应性t细胞也以类似的方式染色。
51.可替代地,两种淋巴细胞群均以上述方式用violet(cell trace violet细胞增殖试剂盒,life technologies)以1μm至5μm的最终浓度染色。
52.在流式细胞仪(fortessa,bdbioscience)上进行染色对照。
53.多克隆刺激
54.染色步骤后,用含有10%人灭活血清和抗生素青霉素/链霉素(sigma aldrich)的新鲜培养基(x-vivo20,lonza)使部分细胞悬浮。接下来,将细胞接种在96孔板(1
×
105个细胞/孔)上,并用包被有抗cd3和抗cd28抗体(treg expansion kit,miltenyi biotech)的磁珠以1:1的比例(珠子:细胞)刺激,并培养7天。我们准备了两种多克隆细胞条件——treg
poly
和teff
poly
。
55.抗原刺激
56.染色步骤后,用含有10%人灭活血清和抗生素青霉素/链霉素(sigma aldrich)的
新鲜培养基(x-vivo20,lonza)使部分细胞悬浮。接下来,将细胞接种在96孔板上(1
×
105个细胞/孔),并用载有抗原(b:9-23胰岛素肽(mo
9-23
)或胰岛素(mo
ins
))的单核细胞以1:1的比例(mo:细胞)来刺激。随后,将无菌抗cd154(纯化的na/le小鼠抗人cd154;bd biosciences)和抗cd28(纯化的na/le小鼠抗人cd28;bd biosciences)添加至共培养物中,最终浓度为5μg/ml。制备的共培养物在37℃下在5%co2培养基(x-vivo20 10%血清 青霉素/链霉素)中孵育。我们准备了两种细胞条件——treg
9-23/ins cd28cd154
和teff
9-23/ins cd28cd154
。同时,我们制备了用载有抗原但没有抗-cd28和抗-cd154-treg
9-23/ins
和teff
9-23/ins
的单核细胞刺激的细胞。作为阴性对照,我们使用没有单核细胞的细胞(未刺激、未增殖)。作为阳性对照,我们使用多克隆细胞(索引poly)。细胞培养7天。
57.分选抗原特异性细胞
58.在扩增的第7天,收集细胞并用新鲜培养基(x-vivo)洗涤。使用facs ariaiiu分选仪(bd biosciences,usa)分选细胞,针对cell trace cfse细胞增殖试剂盒(life technologies)由ssc-a点图(侧向散射)相对于488nm通道进行分选,或针对cell trace violet细胞增殖试剂盒(life technologies)由ssc-a相对于450nm通道进行分选。响应于单核细胞呈递的抗原,增殖细胞(索引pro)被鉴定为荧光比阴性对照细胞更低的细胞[分选门截止值假定为荧光强度低于阴性对照峰,目标包含不超过5%的具有最低荧光的阴性对照峰事件]。非增殖细胞(索引non)是指其荧光与来自阴性对照的细胞荧光相当的细胞[分选门假定为阴性对照峰的荧光强度,目标包含不低于80%的阴性对照峰事件]。对获得的细胞进行质量控制(表型控制、抑制增殖和产生干扰素γ的功能测试)或以1:1比例(细胞:珠子)添加抗cd3和抗cd28(miltenyi biotec)抗体包被的磁性微球来进一步培养以获得尽可能多的抗原特异性调节性t淋巴细胞。
[0059]
质量控制
[0060]
表型检查
[0061]
在扩增的第7天,将treg和teff的样品使用针对以下抗原(ag)的ab进行标记:cd4、cd25、cd127、cd45ra(bd biosciences,usa)、cd62l(life technologies,usa)、foxp3(使用foxp3染色缓冲液套件(ebioscience,usa)),并用流式细胞仪(fortessa,bd biosciences,usa)进行分析。
[0062]
增殖抑制试验
[0063]
在扩增的第7天,我们进行了抑制干扰素-γ(ifn-γ)产生的功能测定。treg和teff细胞用pbs缓冲液洗涤,通过磁体从用于刺激的微球中纯化并计数。然后将细胞重悬于含有抗生素和人热灭活的人ab血清(10%)的新鲜培养基中。在接下来的两天里,来自各个条件的细胞仍然单独培养。在此期间不添加il-2和活化微球。48小时后,用pbs缓冲液洗涤teff细胞并计数。teff细胞用cfse(cell trace cfse细胞增殖试剂盒,life technologies,1μm,15分钟,37℃)或violet(cell trace violet细胞增殖试剂盒,life technologies,1μm;15min,37℃)染色以分析它们在存在treg淋巴细胞的情况下的增殖。染料选择由先前的treg淋巴细胞染色确定-如果treg用cfse染色,则teff细胞用violet染色,反之亦然。
[0064]
标记的自体teff细胞(响应物)与treg细胞(特异性、非特异性和多克隆)按以下比例混合:1:1、1:1/2、1:1/4和1:1/8。每次teff细胞的数量是恒定的,而treg淋巴细胞的数量是
可变的。将细胞悬浮于含有热灭活的人ab血清(10%)、白细胞介素2(il-2;100u/ml)和抗生素(青霉素(100u/ml)和链霉素(100mg/ml))的新鲜培养基中。作为刺激物,我们使用载有抗原(mo
9-23
或mo
ins
)的经辐照的自体单核细胞,这些单核细胞与teff以1:1的比例添加。作为阳性对照,我们使用用单核细胞(mo
9-23
或mo
ins
)刺激的teff(不含treg细胞)或包被有抗cd3和抗cd28抗体的微球。作为阴性对照,我们使用没有刺激的teff细胞(参考细胞仪读数)。另外的对照是在没有teff细胞的情况下培养的未染色treg细胞。
[0065]
细胞在37℃下5%co2中于培养基(x-vivo20 10%血清 p/s)培养6天。此后,收集细胞并使用流式细胞仪(fortessa,bd biosciences)进行分析。在没有treg细胞的情况下培养的未刺激的teff细胞被用作背景并被用作100%,这意味着100%的细胞没有分裂。在没有treg细胞的情况下培养的受刺激的teff细胞被用作0%,这意味着增殖没有受到抑制。
[0066]
用treg细胞培养的teff细胞抑制inf-γ产生
[0067]
收集来自每种培养条件的treg淋巴细胞样品进行功能测试,以确认treg细胞对自体teff细胞分泌ifn-γ的抑制作用。同时,收集teff淋巴细胞样品,这些样品先前在与测试的treg相同的条件下扩增,作为增殖抑制试验中的响应物。这样,可以作为响应物进行两个系列的测试:多克隆teff(teff
poly
)和抗原特异性(增殖性)teff(teff
9-23_pro
或teff
ins_pro
)。
[0068]
打算测试的细胞(treg和teff)用pbs洗涤,从用于刺激的微球中纯化并计数。接下来,将细胞悬浮于含有热灭活的人ab血清(10%)和抗生素(青霉素/链霉素)的新鲜培养基中。在接下来的两天里,来自各个条件的细胞仍然单独培养。在此期间不添加il-2和活化微球。
[0069]
标记的自体teff细胞(响应物)与treg细胞按以下比例混合:1:1、1:1/2、1:1/4和1:1/8。每次teff细胞的数量是恒定的,而treg淋巴细胞的数量是可变的。将细胞悬浮于含有热灭活的人ab血清(10%)、白细胞介素2(il-2;100u/ml)和抗生素(青霉素(100u/ml)和链霉素(100mg/ml))的新鲜培养基中。作为刺激物,我们使用载有抗原(mo
9-23
或mo
ins
)的经辐照的自体单核细胞,这些单核细胞与teff以1:1的比例添加。作为阳性对照,我们使用用单核细胞(mo
9-23
或mo
ins
)刺激的teff(不含treg细胞)或包被有抗cd3和抗cd28抗体的微球。作为阴性对照,我们使用没有刺激的teff细胞(参考细胞仪读数)。另外的对照是在没有teff细胞的情况下培养的未染色treg细胞。
[0070]
细胞在37℃下在5%co2中于培养基(x-vivo20 10%血清 p/s)培养6天。此后,从培养基中收获上清液,并根据制造商的说明(人ifn-γopteia kit ii,bd biosciences)通过elisa测定ifn-γ水平。
[0071]
inf-γ
–
elispot
[0072]
teff淋巴细胞(响应物)与treg淋巴细胞的共培养物在特殊的elispot板上培养48小时。这种方法可以准确地确定有多少细胞产生了细胞因子(inf-γ)。孵育后,将板的细胞进行洗涤并根据制造商的说明(mabtech)对板进行染色。在elispot读板器(immunospot 5,ctl)中进行读取。
[0073]
结果
[0074]
获得用展示抗原的单核细胞以及抗cd28和抗cd154抗体刺激的抗原特异性调节性t细胞的有效性
[0075]
对通过自体抗原呈递单核细胞产生的treg(即抗原特异性调节性t细胞)百分比的
分析表明,当将抗cd28和抗cd154抗体添加到共培养物中时,特别是对于与胰岛素的共培养物,这些细胞的增殖更高(没有抗体/添加抗体的t检验差异:胰岛素p=0.041,肽9-23p=0.044)。(图3a)
[0076]
比较使用的肽对自体抗原呈递单核细胞产生的tregs增殖的影响,我们已经表明,与胰岛素相比,呈递的肽9-23明显更强烈地增加了这些细胞在没有抗cd28和抗cd154抗体的培养物中的百分比(t-检验p=0.032)。在共培养中使用抗cd28和抗cd154抗体导致两个队列中增殖性treg淋巴细胞的百分比相似(t检验p=0.54)。
[0077]
图3c、3d展示了点图示例和分析方法。
[0078]
用呈递抗原的单核细胞和抗cd28和抗cd154抗体刺激的抗原特异性调节性t淋巴细胞的foxp3转录因子的表达
[0079]
在整个实验的所有培养物中,表达foxp3的淋巴细胞的百分比不低于90%。
[0080]
与相应的非特异性/非增殖treg淋巴细胞相比,对于抗原特异性/增殖性群体,显示由自体抗原呈递单核细胞刺激的foxp3转录因子高表达(即cd3 cd4 cd25highcd127-foxp3high表型)的treg细胞百分比显著更高(所有t检验p《0.05)(图3b-d)。
[0081]
当将抗cd28和抗cd154抗体添加到抗原特异性/增殖性treg细胞的共培养物中时,显示foxp3转录因子高表达的treg细胞百分比显著增加(有/无抗体的t检验差异:胰岛素p=0.002,肽9-23p=0.042),与非特异性/非增殖性treg淋巴细胞的情况一样(无/有抗体的t检验差异:胰岛素p=0.034,仅对肽9-23趋向p=0.063)。
[0082]
基于treg淋巴细胞tcr库的克隆性分析
[0083]
对抗原特异性/增殖性treg淋巴细胞群中tcr受体克隆性变化的分析表明,在每种培养物中,每次具有不同tcrβ特异性的一到两个克隆的百分比增加。然而,这些增加不超过所有增殖细胞的百分之几十(图4)。
[0084]
功能测试-抑制效应性t淋巴细胞增殖
[0085]
增殖抑制试验中的免疫反应分析证实了研究的所有treg淋巴细胞亚群的抑制作用(anova,p《0.05)(图5)。
[0086]
肽的功效
[0087]
比较分析显示,当实验中的被抑制的响应物是多克隆效应性t细胞(anova,f=8.03p=0.047)(图5a)和对测试的抗原具有特异性的效应性t细胞(anova,f=20.40p=0.045)(图5b)时,与用于测试的对胰岛素具有特异性的treg相比,对肽9-23具有特异性的treg性能在统计学上显著更高。
[0088]
多克隆对比特异性
[0089]
与多克隆treg相比,特异性treg的测试中增殖抑制的有效性更高,但在任何测试中均未达到统计学意义(anova,p《0.05)。
[0090]
然而,已经表明特异性tregs的成分主要负责测试中的抑制作用。在将特异性treg(增殖性)与非特异性treg(非增殖性)分离后,与非特异性treg相比,特异性treg抑制显著更多的效应性t细胞反应。这种显著性涉及其中响应物是多克隆效应性t细胞的测试(仅对肽9-23显著:anova,f=8.21p=0.028,对于胰岛素:anova,f=1.31p=0.33),以及其中响应物是特异性效应性t淋巴细胞的测试(对于肽9-23:anova,f=186.32p=0.005,对于胰岛素:anova,f=22.47p=0.041)。
[0091]
功能测试-干扰素分泌抑制
[0092]
干扰素γ抑制测定中的免疫反应分析证实了研究的所有treg淋巴细胞亚群的抑制作用(anova,p《0.05)(图6和7)。
[0093]
肽的功效
[0094]
比较分析显示,当实验中抑制的响应物是多克隆效应性t细胞时,9-23肽特异性treg的性能高于全胰岛素特异性treg(anova,f=5.78p=0.025)(图6a和7)。当实验中抑制的响应物是测试抗原的特异性效应性t细胞时,观察到类似的差异,但差异没有达到统计学显著(anova,f=1.86p=0.22)(图6b和7)。
[0095]
多克隆对比特异性
[0096]
与多克隆treg相比,在特异性treg的测试中,反应抑制效率更高,但在任何测试中均未达到统计学显著(anova,p《0.05)。
[0097]
然而,在肽9-23刺激的情况下,已经表明在测定中主要是特异性tregs成分负责抑制作用。在从非特异性treg(非增殖性)中分离出特异性treg(增殖性)后,已经表明,与非特异性treg相比,9-23肽的特异性treg在统计学上更显著地抑制效应性t细胞反应。这种显著性涉及其中响应物是多克隆效应性t细胞(anova,f=5.3p=0.031)以及9-23肽的特异性效应性t细胞(anova,f=111.84p=0.0004)的测试。
[0098]
当响应物是对胰岛素具有特异性的效应性t细胞时,与非特异性treg相比,在胰岛素特异性treg的情况下也观察到更强的抑制作用。仅在一些实验和事后分析中观察到效果的统计学显著性,但整体分析证明在统计学上不显著(anova,f=0.31p=0.56)。对于多克隆响应物,胰岛素特异性treg和非特异性treg之间没有差异(anova,f=0.0004p=0.94)。
[0099]
讨论
[0100]
本文的主题是获得抗原特异性调节性t细胞的体外方法,从而允许临床使用这些细胞治疗自身免疫性疾病,例如:多发性硬化症、类风湿性关节炎、1型糖尿病和抑制不需要的免疫反应,如移植排斥反应、过敏反应和移植物抗宿主病(gvhd)。今天,治疗中使用的调节性t细胞是多克隆的,这意味着它们识别许多不同的抗原,因此它们的有效性可能受到限制(marek-trzonkowska n 2014)(trzonkowski p 2013)(marek-trzonkowska n 2013)(marek-trzonkowska n 2012)(hoffmann p 2009)(trzonkowski p 2009)(di ianni m 2011)(bluestone ja 2015)(stelmaszczyk-emmel a 2015)(vignali da 2008)(geem d 2015)。该方法允许将treg淋巴细胞靶向表达特定抗原的组织,并针对负责针对特定抗原的炎症反应的特定自身反应性淋巴细胞。使用抗原特异性treg将允许更精确的治疗和减少treg剂量。因此,它将提高治疗的有效性并减少可能的副作用。
[0101]
此类抗原特异性treg淋巴细胞的用途已在动物模型中进行了描述,几年前首次尝试在人体中获得此类细胞。最初,它涉及相当诱导性的treg淋巴细胞和tr1细胞,然后是天然treg淋巴细胞。在treg的情况下,这些方法基于使用天然存在的抗原呈递细胞或从呈递特定抗原的细胞系中适当制备的细胞。最近,也已经尝试过修改基因,包括将调节受体插入针对特定抗原具有特异性的人工淋巴细胞(所谓的treg car淋巴细胞)。
[0102]
从治疗的角度来看,免疫反应的抗原特异性调节的可能性很重要。在生理上,免疫系统识别并破坏外来和危险的抗原,同时容忍自身交叉反应(weavings)。然而,在自身免疫性疾病(例如多发性硬化症(ms)、1型糖尿病(dm1)、银屑病、系统性红斑狼疮(sle)或类风湿
性关节炎(ra))的情况下,这种机制则受到损害(s
éné
cal v 2015)(trzonkowski p 2015)(marek-trzonkowska n 2012)(pujol-autonell i 2013)(lima xt 2015)(mu q 2015)(orent w 2015)。效应性淋巴细胞开始破坏自己的器官,将构建自己组织的自身抗原视为外来物。这个过程会导致不可逆转的变化。目前,自身免疫疾病的治疗通常简化为药物免疫抑制和炎症反应抑制。然而,随着时间的推移,这种疗法被证明是无效的。尽管有初步的改善,但不可能完全阻止疾病的进展,并且它的中断通常与疾病的恶化有关。这种治疗也与免疫力严重下降有关(gupta s 2012)。因此,患者变得容易感染,在接受免疫抑制药物的患者中,感染病程比健康人更严重。非特异性免疫抑制也会增加癌症发展的风险(在接受免疫抑制药物的患者中,病例百分比更高)(andr
é
s a 2005)(rama i 2010)。
[0103]
从移植学的角度来看,免疫反应的抗原特异性调节也是一个重要问题。器官移植通常是一种挽救生命的手术,但它与需要不断服用强效免疫抑制药物有关。治疗中止与对移植器官组织的免疫反应增加有关,这会在短时间内导致其破坏。免疫抑制药物的使用,如在自身免疫性疾病的情况下,与严重不良副作用的发生有关。此外,这组药物中的某些药物虽然保护移植器官免受患者免疫系统的破坏性影响,但同时对移植物或其他组织具有毒性作用。这里的一个例子是用于肾移植中的钙调神经磷酸酶的肾毒性抑制剂(环孢菌素和他克莫司)(pr
ó
kai 2015)或会损害移植细胞的作用的用于胰岛接受者的雷帕霉素(zhang n1 2006)(berney 2009)。免疫抑制和免疫反应的调节问题也与骨髓移植密切相关。器官移植和骨髓移植的主要区别在于,前者的药物试图保护移植器官免受接受者免疫系统的破坏性影响,而在第二种情况下,没有移植排斥的风险,但这种移植的骨髓是攻击接受者身体并可能导致其死亡的细胞的来源(di ianni m 2011)(zhao k 2015)。无论攻击患者身体的免疫系统细胞的来源如何,对过度免疫反应的对抗也减少了非特异性免疫抑制的使用。在这两种情况下,即同种异体实体器官移植和骨髓造血细胞,同种异体抗原都被严格定义为其刺激免疫系统反应,并且其作用可以由抗原特异性treg淋巴细胞调节。
[0104]
在这项研究中,我们决定使用载有抗原的单核细胞作为抗原呈递细胞(apc))将抗原特异性调节性t细胞与所有多克隆treg体外分离。展示的整个实验的示意图如图1所示。
[0105]
与展示特定抗原(例如胰岛素或肽9-23胰岛素β链)的γ辐照的自体单核细胞一起生长的具有cd3 cd4 cd25highcd127表型的多克隆treg细胞,仅当它们对单核细胞呈递的抗原具有特异性时才会增殖。
[0106]
许多抗原对treg淋巴细胞没有亲和力(这些细胞是免疫无能的),或者在刺激期间可能会发生表型变化和失去其调节特性。因此,进行共培养的条件是重要的,一方面,导致特异性treg细胞的增殖,另一方面,维持它们的调节和抑制特性。在向共培养物中添加抗cd28和抗cd154抗体后,这两个条件都得到满足,这为treg细胞提供了缺失的第二个信号。在抗cd28和抗cd154抗体存在的情况下,对呈递抗原具有特异性的treg淋巴细胞开始增殖,而不失去定义为foxp3因子表达的稳定性(它甚至增加了该因子的表达)和功能性抑制中的活性(图5-7)。
[0107]
使用facs细胞分选仪对纯抗原特异性tregene淋巴细胞群进行分选。分选在实验室条件下(aria iiu分选机,bdbiosciences)或在允许生产先进治疗产品的清洁实验室条件下进行(符合良好生产规范(gmp)条件的influx分选机)。由于预先用荧光染料(cfse或violet)对多克隆treg淋巴细胞进行染色,因此分选是可能的。响应于存在的抗原而增殖的
treg细胞,即抗原特异性treg,开始稀释/失去荧光强度,随着随后的每次细胞分裂,荧光强度降低约一半。基于荧光的这种变化,可以分离和分选低荧光增殖细胞(抗原特异性treg淋巴细胞)和高荧光非增殖性细胞(非特异性treg淋巴细胞)(图2)。此类分选的细胞可以进一步生长并用于功能测试。
[0108]
所提出的方法允许获得具有保留的调节性细胞表型的抗原特异性treg淋巴细胞,这些细胞由foxp3转录因子的表达证实,并且它们在功能测定中的活性(抑制增殖和抑制干扰素γ产生)高于开始的多克隆t细胞群。
[0109]
应该强调的是,获得的结果并不表明获得的特异性细胞的克隆性高。对tcr库的分析未显示表达特定类别tcr受体的treg淋巴细胞百分比显著增加(图5)。
[0110]
与多克隆treg淋巴细胞相比,foxp3的高表达(foxp3
high
)可以解释抗原特异性treg淋巴细胞的优越的抑制特性。众所周知,foxp3
high
细胞是最活跃的抑制性treg细胞部分,因为它们的免疫调节活性与foxp3因子的表达强度呈正相关(marek n 2011)(ryba m 2011)。抗原特异性诱导高百分比foxp3
high
细胞这一事实解释了使用此类细胞的治疗效果更高。细胞似乎只被特定的抗原激活,它们的作用仅限于表达该抗原的组织。在功能测试中,我们分析了treg细胞对效应性t淋巴细胞增殖和产生干扰素γ(ifn-γ)的影响。获得的结果表明,与多克隆treg淋巴细胞相比,抗原特异性treg淋巴细胞倾向于抑制teff淋巴细胞增殖和由这些细胞产生ifn-γ(图5-7)。这种抑制指的是对于测试期间使用的与treg相同的抗原的多克隆teff淋巴细胞(图5a、6a、7)和抗原特异性teff淋巴细胞(图5b、6b、7)。该系统特别重要,因为它涉及疾病期间的体内情况,其中抗原特异性teff淋巴细胞(自身反应性淋巴细胞)主要负责自身免疫过程中对组织的破坏或器官排斥。
[0111]
我们创造的抗原特异性treg淋巴细胞能够抑制特定淋巴细胞这一事实应该对治疗的有效性产生显著影响。
[0112]
结论
[0113]
使用这种方法,我们能够产生抗原特异性调节性t细胞。方案中使用的单核细胞载有特定的抗原。使用抗cd28和抗cd154抗体的组合来活化抗原释放的自体单核细胞刺激的抗原特异性treg淋巴细胞的增殖
[0114]
作者贡献
[0115]
di-g、mg和pt撰写了这篇文章。pt设计并对实验做了计划。di-g、mg和pt进行并分析了实验。
[0116]
资金
[0117]
该工作得到波兰国家研究与发展中心的支持:
[0118]
lider/160/l-6/14/ncbr/2015和strategmed1/233368/1/ncbr/2014和波兰基础设施部项目:poltreg s.a.的poir.01.01.01-00-0769/15-01
[0119]
缩写
[0120]
a factt,一项欧洲网络行动,旨在关注和加速基于细胞的耐受诱导疗法;ag,抗原;apc,抗原呈递细胞;cfse,羧基荧光素二乙酸琥珀酰亚胺酯;cost,欧洲科技合作委员会;elisa,酶联免疫吸附测定;elispot,酶联免疫斑点;ifn-γ、干扰素γ;ins,胰岛素;mo,单核细胞;non,非增殖性(非特异性);pbmc,外周血单核细胞;poly,多克隆;p/s,青霉素-链霉素;pro,增殖性(抗原特异性);treg,调节性t细胞;teff,效应性t细胞(响应物);t1d,1型
糖尿病
[0121]
参考文献
[0122]
andr
é
s a(2005)."cancer incidence after immunosuppressive treatment following kidney transplantation."crit rev oncol hematol 56(1):71-85.
[0123]
barbaro mp,spanevello a,palladino gp,salerno fg,lacedonia d,carpagnano ge,(2014)."exhaled matrix metalloproteinase-9(mmp-9)in different biological phenotypes of asthma."eur j intern med 25(1):92-96.
[0124]
berney t,secchi a(2009)."rapamycin in islet transplantation:friend or foe?"transpl int 22(2):153-161.
[0125]
bluestone ja,buckner jh,fitch m,gitelman se,gupta s,hellerstein mk,herold kc,lares a,lee mr,li k,liu w,long sa,masiello lm,nguyen v,putnam al,rieck m,sayre ph,tang q,(2015)."type 1 diabetes immunotherapy using polyclonal regulatory t cells."sci transl med 7(315):315ra189.
[0126]
bluestone ja,trotta e,xu d,(2015)."the therapeutic potential of regulatory t cells for the treatment of autoimmune disease."expert opin ther targets 19(8):1091-1103.
[0127]
di ianni m,falzetti f,carotti a,terenzi a,castellino f,bonifacio e,del papa b,zei t,ostini ri,cecchini d,aloisi t,perruccio k,ruggeri l,balucani c,pierini a,sportoletti p,aristei c,falini b,reisner y,velardi a,aversa f,martelli mf,(2011)."tregs prevent gvhd and promote immune reconstitution in hla-haploidentical transplantation."blood 117(14):3921-398.
[0128]
fontenot jd,gavin ma,rudensky ay,(2003)."foxp3 programs the development and function of cd4 cd25 regulatory t cells."nat immunol 4(4):330-336.
[0129]
gambineri e,torgerson tr,ochs hd,(2003)."immune dysregulation,polyendocrinopathy,enteropathy,and x-linked inheritance(ipex),a syndrome of systemic autoimmunity caused by mutations of foxp3,a critical regulator of t-cell homeostasis."curr opin rheumatol 15:430-435.
[0130]
geem d,harusato a,flannigan k,denning tl,(2015)."harnessing regulatory t cells for the treatment of inflammatory bowel disease."inflamm bowel dis 21(6):1409-1418.
[0131]
gupta s,(2012)."immunotherapies in diabetes mellitus type 1."med clin north am 96(3):621-634.
[0132]
hoffmann p,boeld tj,eder r,huehn j,floess s,wieczorek g,olek s,dietmaier w,andreesen r,edinger m,(2009)."loss of foxp3 expression in natural human cd4 cd25 regulatory t cells upon repetitive in vitro stimulation."eur j immunol 39(4):1088-1097.
[0133]
krzystyniak a, k,witkowski p,trzonkowski p,(2014)."islet cell transplant and the incorporation of tregs."curr opin organ transplant 19(6):
associated rbpj polymorphism alters memory cd4 t cells."hum mol genet doi:10.1093/hmg/ddv474.
[0145]
panettieri ra,jr covar r,grant e,hillyer ev,bacharier l,(2008)."natural history of asthma:persistence versus progression-does the beginning predict the end?"j allergy clin immunol 121(3):607-613.
[0146]
pr
ó
kaicsoh
á
ny r,sziksz e,pap d,balicza-himer l,boros s,magda b,vannaykis-petik k,fekete a,peti-peterdi j,szab
ó
aj,(2015)."calcineurin-inhibition results in upregulation of local renin and subsequent vascular endothelial growth factor production in renal collecting ducts."transplantation doi:10.1097/tp.0000000000000961.
[0147]
pujol-autonell i,ampudia rm,monge p,lucas am,carrascal j,verdaguer j,vives-pi m,(2013)."immunotherapy with tolerogenic dendritic cells alone or in combination with rapamycin does not reverse diabetes in nod mice."isrn endocrinol 2013(id 346987):1-5.
[0148]
rama i,griny
ó
jm(2010)."malignancy after renal transplantation:the role of immunosuppression."nat rev nephrol 6(9):511-519.
[0149]
ryba m,marek n,hakrybarczyk-kapturska k, m,trzonkowski p, j,(2011)."anti-tnf rescue cd4 foxp3 regulatory t cells in patients with type 1 diabetes from effects mediated by tnf."cytokine 55(3):353-361.
[0150]séné
cal v,deblois g,beauseigle d,schneider r,brandenburg j,newcombe j,moore cs,prat a,antel j,arbour n,(2015)."production of il-27 in multiple sclerosis lesions by astrocytes and myeloid cells:modulation of local immune responses."glia doi:10.1002/glia.22948.
[0151]
stelmaszczyk-emmel a(2015)."regulatory t cells in children with allergy and asthma:it is time to act."respir physiol neurobiol 209:59-63.
[0152]
tang q,bluestone ja(2013)."regulatory t-cell therapy in transplantation-moving to the clinic."cold spring harb perspect med 3(11):pii:a015552.
[0153]
trzonkowski p,bacchetta r,battaglia m,berglund d,bohnenkamp hr,ten brinke a,bushell a,cools n,geissler ek,gregori s,marieke van ham s,hilkens c,hutchinson ja,lombardi g,madrigal ja,marek-trzonkowska n,martinez-caceres em,roncarolo mg,sanchez-ramon s,saudemont a,sawitzki b,(2015)."hurdles in therapy with regulatory t cells."sci transl med 7(304):304ps18.
[0154]
trzonkowski p,bieniaszewska m,j,dobyszuk a,krzystyniak a,marek n, j,hellmann a,(2009)."first-in-man clinical results of the treatment of patients with graft versus host disease with human ex vivo expanded cd4 cd25 cd127-t regulatory cells."clin immunol 133(1):22-26.
[0155]
trzonkowski p,dukat-mazurek a,bieniaszewska m,marek-trzonkowska n,
dobyszuk a, j,dutka m,j,hellmann a,(2013)."treatment of graft-versus-host disease with naturally occurring t regulatory cells."biodrugs 27(6):605-614.
[0156]
trzonkowski p,szary
ń
ska m,j, a,(2009)."ex vivo expansion of cd4( )cd25( )t regulatory cells for immunosuppressive therapy."cytometry a 75(3):175-188.
[0157]
vignali da,collison lw,workman cj,(2008)."how regulatory t cells work."nat rev immunol 8(7):523-532.
[0158]
wang ym,zhang gy,wang y,hu m,wu h,watson d,hori s,alexander ie,harris dc,alexander si,(2006)."foxp3-transduced polyclonal regulatory t cells protect against chronic renal injury from adriamycin."j am soc nephrol 17(3):697-706.
[0159]
xiao f,ma l,zhao m,huang g,mirenda v,dorling a,lechler r,lombardi g,(2014)."ex vivo expanded human regulatory t cells delay islet allograft rejection via inhibiting islet-derived monocyte chemoattractant protein-1 production in cd34 stem cells-reconstituted nod-scid il2rγnull mice."plos one.2014 mar 3;9(3):e90387.9(3)::e9038.
[0160]
yi s,ji m,wu j,ma x,phillips p,hawthorne wj,o'connell pj,(2012)."adoptive transfer with in vitro expanded human regulatory t cells protects against porcine islet xenograft rejection via interleukin-10 in humanized mice."diabetes 61(5):1180-1191.
[0161]
zhang n,su d,qu s,tse t,bottino r,balamurugan an,xu j,bromberg js,dong hh,(2006)."sirolimus is associated with reduced islet engraftment and impaired beta-cell function."diabetes 55(9):2429-2436.
[0162]
zhao k,ruan s,yin l,zhao d,chen c,pan b,zeng l,li z,xu k,(2015)."dynamic regulation of effector ifn-γ-producing and il-17-producing t cell subsets in the development of acute graft-versus-host disease."mol med rep 2016 feb;13(2):1395-403.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。