表面展示非洲猪瘟病毒抗原p30蛋白的重组杆状病毒、制备方法及其应用
技术领域
1.本发明为重组蛋白诊断试剂和疫苗领域,涉及一种表面展示非洲猪瘟病毒抗原p30蛋白的重组杆状病毒、制备方法及其应用。
背景技术:
2.非洲猪瘟(african swine fever,asf)是由非洲猪瘟病毒(african swine fever virus,asfv)感染家猪、野猪而引发的一种高传染性、强致死性的急性发热性传染病。1921年,asf在非洲肯尼亚被首次报道,由于该疾病难以控制,经历近一个世纪蔓延至世界诸多国家,世界动物卫生组织(oie)将其列为法定报告动物疫病。
3.asfv的cp204l基因编码的内囊膜蛋白p30,蛋白大小为23.6kd,在感染早期持续表达,参与病毒入侵宿主细胞。已有研究表明p30蛋白具有极高的特异性、灵敏性以及较强的免疫原性而且在asfv感染4h后就可检测到,具有开发成asfv感染早期诊断试剂或asf疫苗的巨大潜力([1]栾宇轩,张毫,王承宝.非洲猪瘟血清学诊断和疫苗研究进展[j].动物医学进展,2021,42(03):78-82.)。oie推荐的酶连免疫吸附实验(elisa)检测asfv,但该方法受限于血清灵敏度。而在asfv感染早期病毒滴度较低,一般的血清学检测方法并不能起到理想的确诊效果。此外,asfv具有庞大的基因组,变异迅速而且其免疫逃逸机制尚不明确,因此需要研发出检测特异性强、灵敏度高的检测试剂来应对asfv的传播。
[0004]
在各种杆状病毒中,核型多角体病毒(autographa californica multicapsid nucleopolyhedrovirus,acmnpv)是研究最广泛的,其中基因ie1、gp64在acmnpv复制的早期晚期都表达,多角体蛋白基因polh在感染晚期和极晚期表达。已有研究指出在acmnpv的启动子pie1与p
ph
的组合下杆状病毒表面展示的重组外源蛋白不仅表达水平较高而且表达的重组蛋白可诱导高滴度的特异性抗体产生([2]hu zp,yin j,zhang yy,et al.characterization of the immune responses elicited by baculovirus-based vector vaccines against influenza virus hemagglutinin[j].acta pharmacol sin.2012,33(6):783-90.),同时具有表达多个外源基因的能力使得acmnpv应用在真核生物的体外或体内生产复杂蛋白质,并且还结合表面展示技术应用于疫苗开发。
[0005]
近年来,利用传统的pfastbac1载体构建的p30重组载体生产的p30蛋白抗原诱导产生的血清抗体特异性较强,但敏感性不足,而且非组合启动子作用使得外源蛋白表达量受限([3]徐黎晖,迟立超,王雨佳,等.非洲猪瘟病毒p30蛋白的真核表达及间接elisa抗体检测方法的建立[j].中国预防兽医学报,2021,43(04):382-387.)。于浩洋等构建的asfvp30重组载体生产的单克隆抗体敏感性和特异性俱佳,但其筛选制备、纯化步骤繁琐且周期较长,增加了检测试剂或疫苗生产的成本([4]于浩洋,王彩霞,吴绍强,等.非洲猪瘟病毒p30蛋白单克隆抗体的制备及阻断elisa检测方法的建立[j/ol].中国兽医科学:1-10[2021-12-02].https://doi.org/10.16656/j.issn.1673-4696.2022.0001.)。因此,需要构建一种独特的抗原重组载体使得表达的asfvp30蛋白抗原具备优良的免疫原性,其可诱
导产生的血清敏感性可以媲美单克隆抗体同时具备较强的特异性。
技术实现要素:
[0006]
本发明的目的之一在于提供一种含非洲猪瘟病毒抗原p30蛋白的重组蛋白gp64-fp30。
[0007]
本发明所述的重组蛋白gp64-fp30由非洲猪瘟病毒抗原p30蛋白的n-端连接杆状病毒囊膜糖蛋白gp64的n端信号肽sp,c-端连接杆状病毒囊膜糖蛋白gp64的融合结构域tmd构成;所述的非洲猪瘟病毒抗原p30蛋白的氨基酸序列如seqid no.2所示,杆状病毒囊膜糖蛋白gp64的n端信号肽sp的氨基酸序列如seqid no.4所示,杆状病毒囊膜糖蛋白gp64的融合结构域tmd的氨基酸序列如seqid no.6所示。
[0008]
本发明的目的之二在于提供上述含非洲猪瘟病毒抗原p30蛋白的重组蛋白gp64-fp30的编码基因,由seqid no.3所示的杆状病毒囊膜糖蛋白gp64的n端信号肽sp的编码基因、seqid no.1所示的非洲猪瘟病毒抗原p30蛋白的编码基因和seqid no.5所示的杆状病毒囊膜糖蛋白gp64的融合结构域tmd的编码基因依次连接构成。
[0009]
本发明的目的之三在于提供一种表面展示非洲猪瘟病毒抗原p30蛋白的重组杆状病毒,由上述重组蛋白gp64-fp30的编码基因插入到重组载体pfpg中构建重组表达载体pfpg-gp64-fp30,并将重组表达载体pfpg-gp64-fp30转化dh10bac,获得重组bacmid质粒,然后将重组bacmid质粒转染sf9昆虫细胞,在sf9昆虫细胞内包装获得所述的表面展示非洲猪瘟病毒抗原p30蛋白的重组杆状病毒。
[0010]
本发明中,所述的重组蛋白gp64-fp30的编码基因在重组载体pfpg中的插入位点为杆状病毒多角体蛋白启动子pph后。
[0011]
本发明的目的之四在于提供上述表面展示非洲猪瘟病毒抗原p30蛋白的重组杆状病毒的制备方法,包括以下步骤:
[0012]
(1)分别pcr扩增杆状病毒囊膜糖蛋白gp64的n端信号肽sp的编码基因,非洲猪瘟病毒抗原p30蛋白的编码基因和杆状病毒囊膜糖蛋白gp64的融合结构域tmd的编码基因,分别克隆至pmd19-t载体中构建重组质粒t-psp、t-fp30和t-tmd,然后分别经ecorⅰ/salⅰ、salⅰ/xbaⅰ、xbaⅰ/pstⅰ双酶切,再利用t4 dna连接酶,并克隆至pmd19-t载体,构建重组质粒t-gp64-fp30;
[0013]
(2)对重组质粒t-gp64-fp30和重组载体pfpg同时用ecorⅰ/pstⅰ双酶切后,酶连转化dh10bac感受态菌株,经过蓝白斑筛选、pcr验证得到成功构建的重组表达载体pfpg-gp64-fp30;
[0014]
(3)将重组表达载体pfpg-gp64-fp30转化dh10bac,获得重组bacmid质粒;
[0015]
(4)将重组bacmid质粒转染sf9昆虫细胞,培养,收集上清,获得表面展示非洲猪瘟病毒抗原p30蛋白的重组杆状病毒。
[0016]
本发明的目的之四在于提供上述表面展示非洲猪瘟病毒抗原p30蛋白的重组杆状病毒在制备asfv诊断试剂或asf疫苗中的应用。
[0017]
与现有技术相比,本发明具有以下优点:
[0018]
(1)将非洲猪瘟保守结构蛋白p30的基因序列插入到杆状病毒囊膜糖蛋白gp64的n端信号肽sp序列与融合结构域tmd之间构建融合基因gp64-fp30,既利于fp30基因成功转入
sf9细胞,又可实现fp30的大量表达;
[0019]
(2)将融合基因gp64-fp30构建在杆状病毒多角体蛋白启动子pph后,由于启动子pph在sf9细胞中作用强烈,实现重组蛋白gp64-fp30的大量表达;
[0020]
(3)借助构建的特定表达载体pfpg-gp64-fp30转化dh10bac后转染、感染sf9细胞可以实现p30蛋白的sf9细胞表面展示,而通过表面展示制备的p30蛋白抗原免疫小鼠的血清效价可以达到1:12800,通过血清的westernblot及ifa试验表明表面展示制备的p30蛋白抗原刺激试验动物产生的血清抗体对p30蛋白具有优良的特异性;同时间接elisa证明其血清灵敏性优于传统方法制备的蛋白抗原,适用于制备asfv诊断试剂或asf疫苗;
[0021]
(4)本发明方法简单快速,适用于大规模工业生产。
附图说明
[0022]
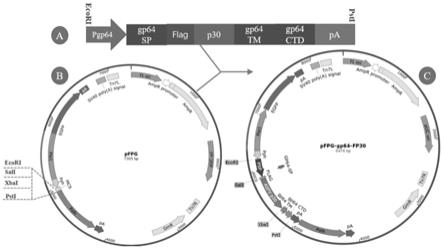
图1为重组表达载体pfpg-gp64-fp30的构建示意图。a:融合基因gp64-fp30的物理质谱图,融合基因前后分别带有ecori、psti酶切位点;b:空表达载体pfpg物理质谱图,在其mcs的前端、后端分别是ecori、psti;c:构建成功的重组表达载体pfpg-gp64-fp30物理质谱图。
[0023]
图2为各目的片段连入t载体后的双酶切鉴定电泳图。其中m:dna marker(dl-5000);1-4:ecorⅰ/salⅰ双酶切t-psp;5-8:salⅰ/xbaⅰ双酶切t-tmd;9-11:xbaⅰ/pstⅰ双酶切t-fp30。
[0024]
图3为基因片段psp、fp30、tmd在t4 dna连接酶作用后连入t载体后带有融合基因的菌液pcr鉴定。其中m:dna marker(dl-5000);1-4:以pspf/tmdr为引物,菌液为模板的pcr电泳结果。
[0025]
图4为ecorⅰ/pstⅰ双酶切鉴定重组表达载体pfpg-gp64-fp30。其中m:dna marker(dl-10000);1-2:ecorⅰ/pstⅰ双酶切pfpg-gp64-fp30。
[0026]
图5为显微镜观察重组病毒reacmnpv-gp64-fp30转染的sf9细胞。其中a:健康sf9细胞生长状态;b:重组病毒转染sf9细胞的体积膨大,且细胞内观察到黑色颗粒,箭头所示;c:倒置荧光显微镜下观察到大量绿色荧光蛋白的表达。
[0027]
图6为重组病毒感染sf9细胞的细胞裂解物及细胞膜蛋白提取物的western blot。其中m:protein marker;s:上清;e1-e4:细胞膜提取物;l1-l4:细胞裂解物。以flag小鼠单抗为一抗,ap标记的羊抗鼠igg作为二抗。
[0028]
图7为抗原p30蛋白的共聚焦细胞定位。其中a:重组病毒感染sf9细胞96h时,倒置荧光显微镜观察;b:共聚焦显微镜cy3红光检测;c:共聚焦显微镜dapi蓝光检测;d:共聚焦显微镜红蓝光共检测。
[0029]
图8为鼠源血清为一抗,ap标记的羊抗鼠igg作为二抗的免疫血清western-blot检测结果。
[0030]
图9为间接elisa测定免疫血清抗体效价的结果。加入终止液后5min时,450nm处阳性血清包被孔与阴性对照血清包被孔的od值之比(p/n),*:p《0.05。
[0031]
图10为免疫血清的间接免疫荧光(ifa)分析(100x)。其中a:健康的sf9细胞,光学显微镜观察结果;b:重组杆状病毒颗粒感染细胞4d后细胞发生明显病变情况;c:以免疫感染野毒的sf9细胞的细胞破碎液的小鼠阴性对照血清抗体经过沉降处理为一抗,cy3(红)标
记的山羊抗小鼠抗体为二抗时的ifa结果;d:带有gfp基因的重组毒粒感染细胞4d后的倒置荧光显微镜镜检结果;e、f:以免疫小鼠沉降处理的血清抗体为一抗,cy3(红)标记的山羊抗小鼠抗体为二抗时的ifa结果。
具体实施方式
[0032]
下面结合具体实施方式和附图对本发明作进一步说明。除非另有限定,本发明所用所有技术和科学术语都具有为本发明所属领域普通技术人员所普遍理解的含义。
[0033]
实施例1抗原p30蛋白的表达与分析
[0034]
1.构建重组表达载体pfpg-gp64-fp30
[0035]
根据ncbi,查询获得asfv p30的基因cp204l序列561bp(af462271.1)及acmnpv的全基因组序列中gp64基因序列1539bp(kf022001.1),对p30基因片段进行人工合成分析,利用oligo7软件设计了3组特异性引物,采用pcr方法采用50μl的pcr反应体系,以94℃预变形8min,94℃变性40s,56℃退火40s,72℃延伸1min,扩增30个循环,72℃再延伸8min的条件对各目的片段进行扩增,从acmnpv dna中扩增出gp64带有启动序列的psp以及tmd(包含gp64基因的融合结构域tm、胞质结构域ctd),将它们分别克隆至pmd19-t载体中,构建重组质粒t-psp、t-fp30、t-tmd,测序验证后,提取质粒分别经ecorⅰ/salⅰ、salⅰ/xbaⅰ、xbaⅰ/pstⅰ双酶切(如图2),利用t4 dna连接酶将他们连接到一起,并克隆至pmd19-t载体,构建重组质粒t-gp64-fp30(如图1a),经过特异性引物pspf/tmdr的pcr鉴定(如图3)及双酶切验证后,提取质粒。以商业化的pfastbac1载体为骨架,将p
ph
基因序列前特定序列同源重组为pie1和egfp的串联序列,具体为将pie1和egfp的串联序列与商业化pfastbac1载体的限制性位点bamhⅰ和hindⅲ之间的区段同源重组构建重组载体pfpg(如图1b),核苷酸序列如seqid no.7所示。对t-gp64-fp30和重组载体pfpg同时用ecorⅰ/pstⅰ双酶切后,酶连转化dh10bac感受态菌株,经过蓝白斑筛选、pcr验证得到成功的重组表达载体pfpg-gp64-fp30(如图1c)。
[0036]
设计的引物序列为:
[0037]
fp30f(seqid no.8):
[0038]
fp30r(seqidno.9):5
’‑
ctctagattttttttttaaaagtttaatgaccatgag-3’,
[0039]
pspf(seqidno.10):5
’‑
ggaattcgagcgtccgtgttcatgatc-3’,
[0040]
pspr(seqidno.11):5
’‑
cgtcgaccatttgcgcgttgcagtg-3’,
[0041]
tmdf(seqidno.12):5
’‑
ctctagactcataaccaccatggag-3’,
[0042]
tmdr(seqidno.13):5
’‑
actgcagttaatattgtctattacggtttctaat-3’。
[0043]
粗下划线为限制性内切酶的酶切位点,双细下划线为flag标签的dna序列;pspf、pspr分别为psp基因的上下游扩增引物,引入的酶切位点分别为ecorⅰ、salⅰ;fp30f、fp30r分别为fp30基因的上下游扩增引物,引入的酶切位点分别为salⅰ、xbaⅰ;tmdf、tmdr分别为tmd基因的上下游扩增引物,引入的酶切位点分别为xbaⅰ、pstⅰ。
[0044]
2.抗原p30蛋白的表达与鉴定
[0045]
利用ecorⅰ、pstⅰ对重组表达载体pfpg-gp64-fp30进行双酶切验证(如图4),随后将成功构建的重组表达载体转化dh10bac感受态菌株,37℃摇床培养4h,划线涂布含抗生素
及iptg、x-gal的lb固体平板,37℃恒温培养箱中静置48h后挑取白色单菌落,对菌落进行pcr鉴定正确、纯化,最终获得纯化的重组bacmid,并进一步扩摇,提取大量重组bacmid质粒dna。用dotap真核细胞转染试剂将重组质粒转染sf9昆虫细胞,于倒置荧光显微镜下观察细胞状态(如图5)。转染、感染4d后,收集培养细胞液,用western及ip细胞裂解液裂解细胞,2000rpm,5min离心分别收集裂解细胞液上清和细胞沉淀,进行sds-page鉴定与western-blot实验(如图6),得到一条23.6kda的清晰蛋白条带,与预期p30蛋白条带大小一致,且证实在重组病毒感染sf9细胞96h时融合蛋白表达量最高。
[0046]
3.抗原p30蛋白浓度测定
[0047]
通过bradford蛋白浓度测定法测定重组病毒在感染sf9细胞96h时的蛋白浓度。先将20mg/ml的牛血清蛋白(bsa)原液配制成1mg/ml的母液。准备1mg/ml的母液10ml,再向母液中加入pbs稀释液。具体滴加母液与pbs的于4ml的ep管中,体积方案如下:
[0048][0049]
每管取100μl加入2ml g250 bradford染色工作液中,轻柔颠倒混匀,室温静置5min,将待测fp30蛋白液0.2ml用pbs稀释到20ml,加入2ml g250 bradford染色工作液中,使用紫外分光光度计测定a595nm吸光度,测得融合蛋白gp64-fp30的od595=0.251,对应的蛋白浓度是0.24mg/ml。
[0050]
4.重组蛋白gp64-fp30的细胞定位分析
[0051]
为了验证重组蛋白fp30展示在细胞表面,利用重组病毒感染的sf9细胞,感染后48h(moi=5)开始荧光显微镜观察,待出现大量绿色荧光,将感染细胞经固定、封闭,一抗结合,cy3(红)标记的二抗结合,dapi(蓝)核染,封片等操作处理,于蔡司lsm510共聚焦显微镜对样品63x/1.40(油镜)放大进行分析,可以清晰地观察到重组蛋白gp64-fp30表达锚定在sf9细胞表面(如图7)。
[0052]
二、抗原p30蛋白抗原性检测
[0053]
1.免疫血清的western-blot检测
[0054]
为了评估gp64-fp30的免疫原性,将抗原与弗式佐剂等体积混合配制成抗原液,用于balb/c鼠的免疫研究。以100mg/kg的剂量加强免疫两次后在第2周收集血清样品1000倍稀释液作为一抗,与佐剂混合的野毒免疫鼠血清作为阴性对照,ap标记的羊抗鼠igg作为二抗进行western-blot检测(如图8),实验组均有一条颜色较深的特异性条带出现,对照组未见特异性条带出现。这表明表面展示的gp64-fp30具有优良的免疫原性,可以诱导产生鼠源抗体与体外表达的gp64-fp30蛋白发生强烈的特异性结合。
[0055]
2.间接elisa测定免疫血清抗体效价
[0056]
采用间接elisa方法测定免疫小鼠血清抗体效价(如图9),断尾采血血清为待检阳性,空白小鼠血清为阴性对照,以hrp标记的羊抗鼠igg为二抗,采取“方阵法”滴定检测阳性血清的抗体效价。将表面展示的融合蛋白gp64-fp30以1:100稀释后包被固定于96孔酶标板。将抗血清按照1:200,1:800,1:1600,1:3200,1:6400,1:128000,1:25600,1:51200的比例稀释,阴性血清1:200稀释作为一抗,然后按照顺序加入到酶标板中,每个梯度做4孔重
复,37℃孵育2h;以hrp标记的羊抗鼠igg(1:500稀释)二抗,37℃孵育1h;加入tmb避光显色反应5min,随后加入2m h2so4反应终止液终止反应。将酶标板放置在多功能微孔板检测仪中检测od
450
值。空白对照孔调零,若实验组od
450
值(p)大于等于阴性对照(n)2.1倍,即p/n≥2.1可判定为阳性。免疫小鼠血清在1:12800的稀释度时阳性血清与阴性对照血清的od值之比(p/n)均超过2.1,此外在1:25600时阳性血清的od
450
=1.828,与1:12800的od
450
差异显著,而且6组重复实验组间各梯度包被血清孔对应的od值的变异系数均在5%以内,说明数据结果稳定性好,实验数据具有较好的重复性。免疫鼠阳性血清效价为1:12800,构建的杆状病毒表面展示的p30蛋白具有优良的抗原灵敏性,可以检测高梯度的稀释抗体。
[0057]
3.免疫血清的间接免疫荧光(ifa)分析
[0058]
重组杆状病毒感染sf9细胞4d后,收集细胞,用pbs清洗后用4%多聚甲醛,37℃固定细胞20min;加0.2%triton-x-100封闭液室温封闭30min;加入用封闭液1:1000稀释沉降处理的血清抗体,37℃作用1h;洗涤后避光加入以二抗稀释液1:500稀释的含有cy3(红)标记的山羊抗小鼠抗体的二抗稀释液,室温作用1h;洗涤后,在载玻片上滴一滴抗荧光淬灭液并将盖玻片倒扣在载玻片,用指甲油封片后在倒置荧光显微镜下进行荧光图像分析(如图10)。所有试验孔的间接免疫荧光(ifa)结果均呈现出明亮的红色,对照孔表现为黑背景,这表明免疫后产生的血清抗体与表面展示的p30蛋白发生强烈的抗原抗体反应,杆状病毒表面展示p30蛋白具备优良的免疫原性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
![作为MAGL抑制剂的4,4A,5,7,8,8A-六吡啶并[4,3-B][1,4]噁嗪-3-酮化合物的制作方法](/upload/img/20220402/1p2akdvb1.jpg)