biotechnol.2012jul10;30(7):658-70”)。肿瘤细胞中异常的ras、tp53、rb1、pten、wnt等信号传导途径影响了细胞自身的抗病毒机制,使得病毒在肿瘤细胞中更容易复制,是形成肿瘤选择性的主要原因(参见文献“nat rev cancer.2017 11;17(11):633”)。除了本身的溶瘤作用外,溶瘤病毒还可以改变肿瘤组织的微环境,主要是通过诱导分泌细胞因子,吸引天然免疫细胞,释放肿瘤抗原,提供免疫危险信号等,从而增强肿瘤局部的抗肿瘤免疫反应(参见文献“j.clin.invest.2018;128,1258-1260”)。腺病毒作为载体是较早被研发的溶瘤病毒,基于e1b55k gene缺陷的ad5型腺病毒h101是第一个批准上市的溶瘤病毒产品(参见文献“hum gene ther.2018feb;29(2):151-159”)。腺病毒的分子结构和生物特性的研究比较深入,使得腺病毒更容易通过基因工程改造成为溶瘤病毒。溶瘤病毒的基因组常被修饰以提高溶瘤病毒的肿瘤细胞的选择性。另外,利用肿瘤特异性基因启动子来驱动腺病毒复制所必需的基因也可以提供肿瘤的选择性。
5.然而,对溶瘤病毒基因组的修饰势必会影响病毒在细胞内的转录复制以及裂解细胞的能力,使得被病毒感染的肿瘤细胞不能被裂解。另外,溶瘤病毒完成复制周期需要依赖宿主肿瘤细胞的大量细胞组分的参与并受特有的分子机制调控(参见文献“j virol.2008 aug;82(15):7252-63”),而每个肿瘤细胞的基因调控和蛋白表达各异,决定了不同生长状态和性质的肿瘤细胞被溶瘤病毒感染后,有些肿瘤细胞不能完成复制周期并裂解细胞(参见文献“nat rev cancer.2002;2(12):938-950”)。另外,宿主产生的针对溶瘤病毒的中和抗体以及肿瘤组织对病毒颗粒扩散的限制都可降低溶瘤病毒的溶瘤作用。
6.因此,目前仍迫切需要提高过继转输t细胞的抗肿瘤疗效和溶瘤病毒的抗肿瘤疗效。
技术实现要素:
7.为解决上述现有技术中所存在的问题,本发明提出,采用溶瘤病毒联合应用过继t细胞,以增强过继t细胞的杀瘤功能和适用范围,以及通过t细胞来清除不能完成病毒复制周期的肿瘤细胞。为此,本发明进一步提供能够在肿瘤细胞中有效表达被特异性t细胞所识别的靶抗原的溶瘤病毒,并能够联合应用过继tcr-t细胞疗法,以进一步增强实体肿瘤免疫治疗的疗效。
8.具体而言,为解决上述现有技术中所存在的问题,本发明提供了分离的用于表达外源基因的溶瘤腺病毒、载体、治疗剂及其用途。
9.具体而言,本发明提供了:
10.(1)一种分离的用于表达外源基因的溶瘤腺病毒,其中所述溶瘤腺病毒为对腺病毒进行基因改造而得到的选择复制型重组溶瘤腺病毒,该重组溶瘤腺病毒的基因组具有以下特征:
11.1)包含e1b基因调控元件,该元件包括e1b启动子和e1b与pix共用的多聚腺苷酸添加信号序列;
12.2)缺失了e1b基因编码区,并且,当需要插入所述外源基因时,在该e1b基因编码区位点插入所述外源基因,并且该外源基因位于所述e1b启动子之后,并受所述e1b基因调控元件的控制;
13.3)在所述外源基因的上游,包含转录e1a 13s mrna的e1a的cdna序列,并且该cdna
为野生型或rb蛋白结合区域缺失型,该rb蛋白结合区域缺失型为所述野生型cdna去除了如seq id no.7所示的核苷酸序列,或该rb蛋白结合区域缺失型编码突变的e1a蛋白,所述突变的e1a蛋白如seq id no.6所示。
14.(2)根据(1)所述的溶瘤腺病毒,其中所述e1b启动子的核苷酸序列如seq id no.1所示,所述e1b与pix共用的多聚腺苷酸添加信号序列如aataaa所示。
15.(3)根据(1)所述的溶瘤腺病毒,其中所述e1b基因包括e1b-55k基因和e1b-19k基因。
16.(4)根据(1)所述的溶瘤腺病毒,其中所述e1b基因编码区的核苷酸序列如seq id no.3所示。
17.(5)根据(1)所述的溶瘤腺病毒,其中所述外源基因的起始位点包含kozak序列,优选地,所述kozak序列如seq id no.4所示。
18.(6)根据(1)所述的溶瘤腺病毒,其中所述野生型e1a cdna的核苷酸序列如seq id no.5所示。
19.(7)根据(1)所述的溶瘤腺病毒,其中所述转录e1a 13s mrna的e1a的cdna位于所述e1b启动子的上游,并且与所述e1b启动子的核苷酸序列部分重合。
20.(8)根据(1)所述的溶瘤腺病毒,其中所述转录e1a 13s mrna的e1a的cdna序列在内源性e1a启动子/增强子的控制下,或者在外源启动子的控制下;优选地,所述内源性e1a启动子/增强子的核苷酸序列如seq id no.8所示。
21.(9)根据(1)所述的溶瘤腺病毒,其中所述转录e1a 13s mrna的e1a的cdna序列在外源启动子的控制下,所述重组溶瘤腺病毒的基因组中去除了如seq id no.9所示的核苷酸序列,并且在该去除的位点处插入所述外源启动子核苷酸序列。
22.(10)根据(8)或(9)所述的溶瘤腺病毒,其中所述外源启动子包括ef-1α启动子、cmv启动子、pkg启动子、e2f启动子、afp启动子和tert启动子。
23.(11)根据(1)所述的溶瘤腺病毒,其中所述外源基因包括:hla蛋白编码序列,标记性多肽编码序列,hla蛋白编码序列及标记性多肽编码序列,hla蛋白编码序列及β2-微球蛋白编码序列,或hla蛋白编码序列、β2-微球蛋白编码序列及标记性多肽编码序列。
24.(12)根据(11)所述的溶瘤腺病毒,其中所述hla蛋白包括hla i类分子,该hla i类分子包括hla-a、hla-b和hla-c。
25.(13)根据(12)所述的溶瘤腺病毒,其中所述hla-c包括野生型分子,或以下突变中的至少一种:1)第2位精氨酸突变为丙氨酸;2)编码该hla-c蛋白的核苷酸序列的第4位核苷酸由c突变为g,第5位核苷酸由g突变为c;3)第362位异亮氨酸突变为苏氨酸;4)第359位谷氨酸突变为缬氨酸。
26.(14)根据(11)所述的溶瘤腺病毒,其中所述标记性多肽包括可操作地连接的、依次串联的以下氨基酸序列:n端信号肽的氨基酸序列、一个或多个抗原表位多肽的氨基酸序列、可任选的c端内质网滞留信号的氨基酸序列,其中当所述标记性多肽包括多个所述抗原表位多肽的氨基酸序列时,每两个相邻的所述抗原表位多肽的氨基酸序列之间由可切割性连接多肽的氨基酸序列连接;优选地,所述可切割性连接多肽是furin酶切识别多肽。
27.(15)根据(14)所述的溶瘤腺病毒,其中所述抗原表位多肽的氨基酸序列来源于自然界存在的蛋白的氨基酸序列,或者为人工合成的自然界不存在的氨基酸序列;优选地,所
述自然界存在的蛋白包括人源蛋白和除人以外的其它物种的蛋白。
28.(16)根据(14)所述的溶瘤腺病毒,其中所述抗原表位多肽的氨基酸序列来源于肿瘤相关抗原或肿瘤特异性抗原的氨基酸序列。
29.(17)根据(16)所述的溶瘤腺病毒,其中所述肿瘤相关抗原选自ny-eso-1 157-165、ny-eso-1 1-11、ny-eso-1 53-62、ny-eso-1 18-27、her2/neu 369-377、ssx-2 41-49、mage-a4 230-239、mage-a10254-262、mage-c2 336-344、mage-c2 191-200、mage-c2 307-315、mage-c2 42-50、mage-a1 120-129、mage-a1 230-238、mage-a1 161-169、kk-lc-1 76-84、p53 99-107、prame 301-309、甲胎蛋白158-166、hpv16-e6 29-38、hpv16-e7 11-19、ebv-lmp1 51-59、ebv-lmp1 125-133、kras:g12d 10-18、kras:g12d 8-16、kras:g12d 7-16、kras:g12c 8-16、kras:g12a 8-16、kras:g12s 8-16、kras:g12r 8-16、kras:g12v 8-16、kras:g12v 7-16、kras:g12v 5-14、kras:g12v 11-19、kras:g12v 5-14、kras:q61h 55-64、kras:q61l 55-64、kras:q61r 55-64、kras:g12d 5-14、kras:g13d 5-14、kras:g12a 5-14、kras:g12c 5-14、kras:g12s 5-14、kras:g12r 5-14、kras:g12d 10-19、tp53:v157g 156-164、tp53:r248q 240-249、tp53:r248w 240-249、tp53:g245s 240-249、tp53:v157f 156-164、tp53:v157f 149-158、tp53:y163c 156-164、tp53:r248q 247-255、tp53:r248q 245-254、tp53:r248w 245-254、tp53:g245s 245-254、tp53:g249s 245-254、tp53:y220c 217-225、tp53:r175h 168-176、tp53:r248w 240-249、tp53:k132n 125-134、cdc73:q254e 248-256、cyp2a6:n438y 436-444、ctnnb1:t41a 41-49、ctnnb1:s45p 41-49、ctnnb1:t41a 34-43、ctnnb1:s37y 30-39、ctnnb1:s33c 30-39、ctnnb1:s45p 40-49、egfr:l858r 852-860、egfr:t790m 790-799、pik3ca:e542k 533-542、pik3ca:h1047r1046-1055、gnas:r201h 197-205、cdk4:r24c 23-32、h3.3:k27m26-35、braf:v600e 591-601、chd4:k73rfs 141-148、nras:q61r55-64、idh1:r132h 126-135、tvp23c:c51y 51-59、tvp23c:c51y 42-51和tvp23c:c51y 45-53。
30.(18)根据(14)所述的溶瘤腺病毒,其中所述抗原表位多肽为如seq id no.10所示的ny-eso-1 157-165或如seq id no.11所示的kras:g12d 10-18。
31.(19)一种用于制备(1)-(18)中任一项所述的溶瘤腺病毒的载体,其中所述载体包含所述e1b基因调控元件、缺失了所述e1b基因编码区、并且在所述外源基因的上游包含所述的转录e1a 13s mrna的e1a的cdna序列。
32.(20)一种用于治疗肿瘤和/或癌症的治疗剂,包含:
33.(a)第一组合物,其中该第一组合物包含位于第一可药用载体中的第一活性成分,该第一活性成分包括或含有用于导入肿瘤细胞和/或癌细胞的根据(1)-(18)中任一项所述的溶瘤腺病毒;和
34.(b)第二组合物,其中该第二组合物包含位于第二可药用载体中的第二活性成分,该第二活性成分包含t细胞受体修饰的免疫细胞。
35.(21)根据(20)所述的治疗剂,其中所述第一组合物和所述第二组合物各自独立地存在于所述治疗剂中而互不混合。
36.(22)根据(20)所述的治疗剂,其中所述免疫细胞包括原始t细胞或其前体细胞,nkt细胞,或t细胞株。
37.(23)根据(20)所述的治疗剂,其中所述第一组合物包含治疗有效量的所述溶瘤腺
病毒。
38.(24)根据(20)所述的治疗剂,其中所述第二组合物包含治疗有效量的所述的t细胞受体修饰的免疫细胞。
39.(25)根据(20)所述的治疗剂,其中所述溶瘤腺病毒配制成通过瘤内注射给药、腹膜内给药、蛛网膜下腔内给药、或静脉给药。
40.(26)根据(20)所述的治疗剂,其中所述免疫细胞配制成通过动脉、静脉、皮下、皮内、瘤内、淋巴管内、淋巴结内、蛛网膜下腔内、骨髓内、肌肉内或腹膜内给药。
41.(27)根据(1)-(18)中任一项所述的溶瘤腺病毒在制备用于治疗肿瘤和/或癌症的药物中的用途。
42.(28)根据(27)所述的用途,其中所述肿瘤和/或癌症包括:乳腺癌,头颈部肿瘤,滑膜癌,肾癌,结缔组织癌,黑色素瘤,肺癌,食管癌,结肠癌,直肠癌,脑癌,肝癌,骨癌,绒毛膜癌,胃泌素瘤,嗜铬细胞瘤,催乳素瘤,von hippel-lindau病,zollinger-ellison综合征,肛门癌,胆管癌,膀胱癌,输尿管癌,神经胶质瘤,神经母细胞瘤,脑膜瘤,脊髓肿瘤,骨软骨瘤,软骨肉瘤,尤文氏肉瘤,原发部位不明癌,类癌,纤维肉瘤,佩吉特病,宫颈癌,胆囊癌,眼癌,卡波西氏肉瘤,前列腺癌,睾丸癌,皮肤鳞状细胞癌,间皮瘤,多尖端骨髓瘤,卵巢癌,胰腺内分泌瘤,胰高血糖素瘤,胰腺癌,阴茎癌,垂体癌,软组织肉瘤,视网膜母细胞瘤,小肠癌,胃癌,胸腺癌,滋养细胞癌,葡萄胎,子宫内膜癌,阴道癌,外阴癌,蕈样真菌病,胰岛素瘤,心脏癌,脑膜癌,血液癌,腹膜癌和胸膜癌。
43.(29)根据(20)-(26)中任一项所述的治疗剂在制备用于治疗肿瘤和/或癌症的药物中的用途。
44.(30)根据(29)所述的用途,其中所述肿瘤和/或癌症包括:乳腺癌,头颈部肿瘤,滑膜癌,肾癌,结缔组织癌,黑色素瘤,肺癌,食管癌,结肠癌,直肠癌,脑癌,肝癌,骨癌,绒毛膜癌,胃泌素瘤,嗜铬细胞瘤,催乳素瘤,von hippel-lindau病,zollinger-ellison综合征,肛门癌,胆管癌,膀胱癌,输尿管癌,神经胶质瘤,神经母细胞瘤,脑膜瘤,脊髓肿瘤,骨软骨瘤,软骨肉瘤,尤文氏肉瘤,原发部位不明癌,类癌,纤维肉瘤,佩吉特病,宫颈癌,胆囊癌,眼癌,卡波西氏肉瘤,前列腺癌,睾丸癌,皮肤鳞状细胞癌,间皮瘤,多尖端骨髓瘤,卵巢癌,胰腺内分泌瘤,胰高血糖素瘤,胰腺癌,阴茎癌,垂体癌,软组织肉瘤,视网膜母细胞瘤,小肠癌,胃癌,胸腺癌,滋养细胞癌,葡萄胎,子宫内膜癌,阴道癌,外阴癌,蕈样真菌病,胰岛素瘤,心脏癌,脑膜癌,血液癌,腹膜癌和胸膜癌。
45.(31)一种治疗肿瘤和/或癌症的方法,包括对肿瘤和/或癌症患者施用根据(1)-(18)中任一项所述的溶瘤腺病毒。
46.(32)根据(31)所述的方法,其中所述肿瘤和/或癌症包括:乳腺癌,头颈部肿瘤,滑膜癌,肾癌,结缔组织癌,黑色素瘤,肺癌,食管癌,结肠癌,直肠癌,脑癌,肝癌,骨癌,绒毛膜癌,胃泌素瘤,嗜铬细胞瘤,催乳素瘤,von hippel-lindau病,zollinger-ellison综合征,肛门癌,胆管癌,膀胱癌,输尿管癌,神经胶质瘤,神经母细胞瘤,脑膜瘤,脊髓肿瘤,骨软骨瘤,软骨肉瘤,尤文氏肉瘤,原发部位不明癌,类癌,纤维肉瘤,佩吉特病,宫颈癌,胆囊癌,眼癌,卡波西氏肉瘤,前列腺癌,睾丸癌,皮肤鳞状细胞癌,间皮瘤,多尖端骨髓瘤,卵巢癌,胰腺内分泌瘤,胰高血糖素瘤,胰腺癌,阴茎癌,垂体癌,软组织肉瘤,视网膜母细胞瘤,小肠癌,胃癌,胸腺癌,滋养细胞癌,葡萄胎,子宫内膜癌,阴道癌,外阴癌,蕈样真菌病,胰岛素
瘤,心脏癌,脑膜癌,血液癌,腹膜癌和胸膜癌。
47.(33)一种治疗肿瘤和/或癌症的方法,包括:
48.对肿瘤和/或癌症患者施用根据(20)-(26)中任一项所述的治疗剂中的第一组合物;和
49.对所述肿瘤和/或癌症患者施用根据(20)-(26)中任一项所述的治疗剂中的第二组合物。
50.(34)根据(33)所述的方法,包括以下依次进行的步骤:
51.1)对所述肿瘤和/或癌症患者施用所述第一组合物;和
52.2)在施用所述第一组合物之后,对所述肿瘤和/或癌症患者施用所述的治疗剂中的第二组合物。
53.(35)根据(34)所述的方法,其中所述肿瘤和/或癌症包括:乳腺癌,头颈部肿瘤,滑膜癌,肾癌,结缔组织癌,黑色素瘤,肺癌,食管癌,结肠癌,直肠癌,脑癌,肝癌,骨癌,绒毛膜癌,胃泌素瘤,嗜铬细胞瘤,催乳素瘤,von hippel-lindau病,zollinger-ellison综合征,肛门癌,胆管癌,膀胱癌,输尿管癌,神经胶质瘤,神经母细胞瘤,脑膜瘤,脊髓肿瘤,骨软骨瘤,软骨肉瘤,尤文氏肉瘤,原发部位不明癌,类癌,纤维肉瘤,佩吉特病,宫颈癌,胆囊癌,眼癌,卡波西氏肉瘤,前列腺癌,睾丸癌,皮肤鳞状细胞癌,间皮瘤,多尖端骨髓瘤,卵巢癌,胰腺内分泌瘤,胰高血糖素瘤,胰腺癌,阴茎癌,垂体癌,软组织肉瘤,视网膜母细胞瘤,小肠癌,胃癌,胸腺癌,滋养细胞癌,葡萄胎,子宫内膜癌,阴道癌,外阴癌,蕈样真菌病,胰岛素瘤,心脏癌,脑膜癌,血液癌,腹膜癌和胸膜癌。
54.本发明与现有技术相比具有以下优点和积极效果:
55.本发明构建的用于表达外源基因的溶瘤腺病毒能够选择性地在肿瘤细胞和/或癌细胞中复制,并且更加高效地表达外源基因。具体地,本发明利用溶瘤病毒基因组中自身的e1b基因调控元件来调控外源基因的表达,避免插入的外源基因调控元件对病毒基因组表达所造成的可能干扰,而影响病毒的有效复制,以及下游基因的表达。另外,也可以增加插入的外源基因片段的长度,使得溶瘤病毒载体可以携带更多外源基因负荷。另一方面,本发明构建的溶瘤腺病毒缺失了e1b基因编码区。e1b-19k蛋白可以抑制通过肿瘤坏死因子和fas通路所诱导的细胞凋亡,使得感染的细胞耐受t细胞的杀伤作用。去除e1b-19k基因可以增加被感染的肿瘤细胞对杀伤性t细胞的敏感性。去除e1b-55k基因可以增加溶瘤腺病毒的肿瘤细胞溶瘤选择性。另外,本发明发现,在溶瘤腺病毒的基因组中,通过在外源基因的上游设计转录e1a-13s mrna的e1a的cdna序列而不是e1a基因组基因,使得本发明可以只转录e1a-13s而避免转录e1a-12s,从而增加外源基因的表达,以及加强病毒基因组的复制。
56.本发明构建的用于表达外源基因的溶瘤腺病毒通过巧妙的设计,比现有技术中类似的用于表达外源基因的溶瘤腺病毒能够更加有效地实现将具有标记性多肽编码序列的核酸导入肿瘤细胞和/或癌细胞,并更加高效地在肿瘤细胞和/或癌细胞内表达外源标记性多肽,尤其来源于基因突变的新生抗原(neo-antigen)的表位多肽,使其进入mhc i类抗原提呈途径,肿瘤细胞表面hla/抗原表位多肽复合物的表达量得到了显著增加,由此进一步增强了所述t细胞受体修饰的免疫细胞对肿瘤细胞和/或癌细胞的识别敏感性。另外,通过融瘤病毒载体携带的异种hla i类分子(allo-hla class i)来标记肿瘤细胞,也大大增加了过继t细胞疗法的适用范围。
57.本发明所构建的用于表达外源基因的溶瘤腺病毒可更加高效地在肿瘤细胞内表达外源抗原表位肽、β2-微球蛋白和/或外源mhc i类分子,以显著加强肿瘤细胞表面的抗原表位肽/mhc i类分子复合物的数量,并且可以采用特异性针对该抗原表位肽的tcr修饰的免疫细胞进行联合治疗。当通过所述溶瘤腺病毒作为载体介导外源抗原表位肽、β2-微球蛋白和/或外源mhc i类分子在肿瘤细胞内的表达时,溶瘤病毒对肿瘤的杀伤与tcr修饰的免疫细胞对肿瘤的杀伤还能够产生协同治疗效果。
58.本发明通过所构建的溶瘤腺病毒将标记性多肽、β2-微球蛋白和/或hla蛋白编码核酸导入肿瘤细胞和/或癌细胞,在发挥溶瘤病毒杀伤肿瘤细胞和/或癌细胞的作用的同时,进一步增强了上述显著加强外源抗原表位肽在肿瘤细胞表面的提呈与t细胞受体修饰的免疫细胞联合所达到的协同治疗效果。另外,溶瘤病毒在杀伤肿瘤的同时还可以缓解肿瘤微环境的免疫抑制状态,提高t细胞受体修饰的免疫细胞的归巢;此外,t细胞受体修饰的免疫细胞还可以有效清除被溶瘤病毒感染后,不能完成复制周期并产生足够数量的子病毒而发生裂解的肿瘤细胞;由此实现了进一步的协同作用。此外,被溶瘤病毒裂解的肿瘤细胞所释放的抗原可进一步激活机体自身的抗肿瘤免疫,从而可实现比单独使用溶瘤病毒或t细胞受体修饰的免疫细胞更好的肿瘤杀伤效果,实现了协同治疗效果。
59.定义
60.在本发明中,词语“肿瘤”、“癌症”、“肿瘤细胞”、“癌细胞”涵盖本领域通常认为的含义。
61.本文所用的词语“溶瘤病毒”是指能够选择性地在肿瘤细胞中复制并裂解肿瘤细胞的病毒。
62.本文所用的词语“治疗有效量”是指功能药剂或药物组合物能够表现出可检测的治疗效果或抑制效果的量,或者起到抗肿瘤效果的量。所述效果可以通过本领域任何已知的检验方法检测。
63.本文所用的词语“给药”或“施用”是指向受试者提供化合物、复合物或组合物(包括病毒和细胞)。
64.本文所用的词语“患者”是指人或非人类生物。因此,本文所述的方法和组合物适用于人类疾病和兽类疾病。在一些实施方案中,患者患有肿瘤。在一些例子中,患者同时患有一种或多种类型的癌症。
65.本文所用的词语“协同效果”是指两种或多种药剂共同起到的效果,该效果大于其中各药剂的单独效果的总和。
66.根据本发明,“异常表达”或“异常表达”是指与非致瘤性正常细胞或健康个体(即,没有疾病的个体)相比,表达被改变,优选增加与某些蛋白质,例如肿瘤相关抗原的异常或异常表达有关。表达的增加是指增加至少10%,特别是至少20%,至少50%或至少100%或更多。在一个实施方案中,仅在患病组织中发现表达,而在健康组织中表达被抑制。
67.如本文所用,术语“大约”是指在20%之内,或在某些情况下在10%之内,或在某些情况下在5%之内,或在某些情况下在1%之内,或在某些情况下在0.1之内给定值或范围的%,因为这样的变化适合于执行所公开的方法或适合于所公开的组合物的预期目的。
68.术语“活性成分”是指药物产品组合物中具有生物活性或具有预期药物作用的成分。
69.术语“过继细胞转移”或“过继细胞疗法”或“act”是指这样的免疫疗法,其中收集受试者或患者自身的免疫细胞(例如自体t细胞)或来自健康供体的免疫细胞(例如同种异体t细胞),以治疗其癌症。tcr-t细胞疗法是act的一种。
70.本文中所使用的术语“和/或”包括“和”,“或”和“由所述术语连接的元件的所有或任何其他组合”的含义。
71.术语“抗肿瘤”是指可以通过各种方式表现的生物学效应,包括但不限于例如肿瘤体积的减少,肿瘤细胞数量的减少,肿瘤细胞转移的数量的减少,预期寿命的增加,肿瘤细胞增殖的减少,肿瘤细胞存活率的降低或与癌症状况相关的各种生理症状的改善。“抗肿瘤作用”也可以通过本发明的肽,多核苷酸,细胞和抗体首先预防肿瘤发生的能力来表现。
72.如本文所用,术语“抗体”是指衍生自与抗原特异性结合的免疫球蛋白分子的蛋白质或多肽序列。抗体可以是多克隆或单克隆,多链或单链或完整的免疫球蛋白,并且可以衍生自天然来源或重组来源。抗体可以是免疫球蛋白分子的四聚体。
73.如本文所用,术语“抗原”或“ag”被定义为引起免疫应答的分子。这种免疫应答可能涉及抗体的产生,或特定免疫学上具有免疫力的细胞的激活,或两者都涉及。技术人员将理解,任何大分子,包括实际上所有的蛋白质或肽,都可以用作抗原。此外,抗原可以衍生自重组dna或基因组dna。本领域技术人员将理解,包含编码引发免疫应答的蛋白质的核苷酸序列或部分核苷酸序列的任何dna均编码本文所用术语“抗原”。此外,本领域技术人员将理解抗原不必仅由基因的全长核苷酸序列编码。显而易见,本发明包括但不限于使用一个以上基因的部分核苷酸序列,并且这些核苷酸序列以各种组合排列以编码引发所需免疫应答的多肽。此外,技术人员将理解,抗原根本不需要由“基因”编码。显而易见的是,抗原可以合成产生或可以源自生物样品,或者可以是多肽以外的大分子。这样的生物样品可以包括但不限于组织样品,肿瘤样品,细胞或具有其他生物成分的流体。
74.术语“抗原提呈机制”(或“抗原呈递机制”)是指加工和制备抗原以呈递给t淋巴细胞的免疫分子或细胞。抗原提呈机制涉及两种不同的途径,用于处理来自生物体自身(自身)蛋白质或细胞内病原体(例如病毒)或吞噬细胞的病原体(例如细菌)的抗原;这些抗原在i类或i类主要组织相容性复合物(mhc)分子上的后续呈递取决于所使用的途径。mhc i类和ii类都必须先结合抗原,然后才能在细胞表面稳定表达。mhc i抗原提呈通常涉及抗原加工的内源性途径,而mhc ii抗原提呈涉及抗原加工的外源性途径。
75.术语“自体的”是指源自同一个体的任何材料,随后将其重新引入该个体。
76.术语“β2-微球蛋白”或“β
2-微球蛋白”是mhc i类分子的组分,mhc i类分子具有存在于所有有核细胞(不包括红细胞)上的α1,α2和α3蛋白。在人类中,β2微球蛋白由b2m基因编码。
77.术语“c末端”(也称为c末端,羧基末端,羧基末端,c末端尾部,c末端或cooh末端)是指氨基酸链的末端(蛋白质或多肽),以游离羧基(-cooh)终止。当蛋白质从信使rna翻译时,是从n端到c端产生的。编写肽序列的惯例是将c-在右侧的末端插入从n端到c端的序列。
78.如本文所用,术语“组合”是指各种组分(例如溶瘤病毒和一种或多种在抗癌疗法中有效的物质)可能的任何布置。这样的布置包括所述组分的混合物以及用于同时或顺序施用的单独的组合。本发明包括具有不同有效剂量的组合。应当理解,组合的每种成分的最佳剂量可以由本领域技术人员确定。
79.如本文所用,术语“组合物”或“药物组合物”是指适合于以预期的药物作用(例如,预防和治疗作用)施用于受试者或患者的化学和/或生物学组合物。适合于此类治疗应用的组合物的实例包括用于肠胃外,皮下,经皮,皮内,肌内,冠状内,心肌内,脑内,肿瘤内,腹膜内,静脉内(例如可注射)或气管内给药的制剂,例如无菌混悬剂,乳剂和气溶胶。气管内给药可涉及使肺组织(例如肺泡)接触或暴露于治疗剂,所述治疗剂包含处于药物载体中的治疗有效量的核酸和/或免疫细胞(例如t细胞(例如tcr修饰的t细胞))。在一些情况下,适合于治疗应用的药物组合物可以与一种或多种药学上可接受的赋形剂,稀释剂或载体(如无菌水,生理盐水,葡萄糖等)混合。
80.如本文所用,当用于定义产品,组合物和方法时,术语“包括”,“具有”,“包含”或“含有”是开放式的,不排除其他未引用的元素或方法步骤。因此,当氨基酸序列可能是多肽的最终氨基酸序列的一部分时,该多肽“包含”该氨基酸序列。这样的多肽可以具有多达数百个额外的氨基酸残基。“基本上由...组成”是指排除任何具有重要意义的其他组分或步骤。因此,基本上由所述组分组成的组合物将不排除痕量污染物和药学上可接受的载体。当存在这样的氨基酸序列时,该多肽“基本上由”氨基酸序列组成,最终仅具有几个额外的氨基酸残基。“由...组成”是指排除其他组分的痕量元素或步骤。例如,当多肽除列举的氨基酸序列之外不包含其它任何氨基酸时,该多肽“由”氨基酸序列组成。
81.术语“有条件复制能力的病毒”或“有条件复制病毒”或“crv”或“选择复制型病毒”是指病毒被设计为能够在肿瘤细胞中选择性复制,导致其破坏,同时保留正常细胞。
82.术语“组成型启动子”是指核苷酸序列,当其与编码或指定基因产物的多核苷酸可操作地连接时,导致在细胞的大多数或全部生理条件下在细胞中产生该基因产物。
83.术语“死亡受体”是指肿瘤坏死因子受体超家族的成员,其特征在于称为“死亡域”的细胞质区域,当与同源配体结合时,该细胞质区域使受体能够启动细胞毒性信号。
84.术语“获自”,“起源自”或“衍生自”用于鉴定组分(例如多肽,核酸分子,氨基酸序列)的原始来源,但无意限制制备组分的方法,该方法可以是例如通过化学合成或重组手段的方法。
85.术语“可药用的”或“药学上可接受的”是指适合用于给予患者或受试者以达到预期的药物或药物作用而没有不适当的不利副作用(例如毒性,刺激和过敏),例如,具有合理的收益/风险比。
86.如本文所用,“可药用载体”或“药学上可接受的媒介物”或“药学上可接受的载体”是指用于给予治疗剂的媒介物或载体,所述治疗剂适合于人和/或哺乳动物而没有过度的不利副作用((例如毒性,刺激性和过敏性),并具有合理的收益/风险比。如本文所用,“可药用载体”包括可用于递送和/或表达核酸的任何媒介物或载体,包括纳米颗粒,脂质,质粒,病毒或细胞。
87.当应用于多核苷酸时,术语“编码”是指如果在其天然状态或通过本领域技术人员公知的方法操作时可以“编码”多肽的多核苷酸,其可被转录和/或翻译以产生用于多肽和/或其片段的mrna。反义链是这种核酸的互补物,并且可以从其推导编码序列。“编码”肽的核酸或核酸序列是指包含该肽的编码序列的核酸。“编码”肽的氨基酸序列是指含有肽序列的氨基酸序列。
88.术语“内质网保留信号序列”(“内质网滞留信号序列”)是指在折叠成er驻留蛋白
后使蛋白质保留在内质网或er中的信号序列。经典的er保留信号是c端kdel(lys-asp-glu-leu)序列。
89.术语“抗原表位”,“表位”或“抗原决定簇”是指被免疫系统(特别是抗体,b细胞或t细胞)识别并结合的抗原部分。术语“表位肽”或“抗原表位肽”是指呈肽形式的表位或抗原表位。
90.当在本文中使用时,术语“赋形剂”或“添加剂”旨在表示药物制剂中不是活性成分的所有物质,例如载体(例如载体dna,质粒,载体病毒),结合剂,润滑剂,增稠剂,表面活性剂,防腐剂,乳化剂,缓冲剂,调味剂或着色剂。
91.术语“外源的”是指从生物,细胞,组织或系统引入或在生物,细胞,组织或系统外部产生的任何材料。例如,本文使用的术语“外源hla蛋白”是指来自受试者或患者外部的hla蛋白,并且“外源hla蛋白”可以由受试者或患者的细胞或组织产生或可以不产生。
92.术语“内源的”是指来自生物体,细胞,组织或系统内部或在其内部产生的任何材料。
93.如本文所用,“表达”是指多核苷酸被转录成mrna的过程和/或转录的mrna随后被翻译成肽,多肽或蛋白质的过程。如果多核苷酸衍生自基因组dna,则表达可包括在真核细胞中剪接mrna。
94.如本文所用,“基因表达”是指将基因中的遗传信息,dna碱基对的序列制成功能性基因产物(例如蛋白质或rna)的过程。基本过程是将dna转录为rna,然后将rna翻译为蛋白质。
95.术语“人类白细胞抗原(hla)”是指编码人类主要组织相容性复合物(mhc)蛋白的基因复合物或系统,也称为“hla蛋白”。mhc蛋白是负责调节人体免疫系统的细胞表面蛋白。hla基因复合体位于6p21号染色体上3mbp的片段上,具有高度多态性,这意味着它们具有许多不同的等位基因,从而可以微调适应性免疫系统。hla对应mhc i类(a,b和c),从细胞内部到t淋巴细胞都提呈外源抗原(例如病毒抗原),hla i类/抗原肽复合物可以刺激细胞毒性t细胞(也称为ctl),从而反过来杀死靶细胞。
96.术语“hla i类蛋白”是指人mhc i类蛋白或分子。mhc i类分子是跨膜蛋白,由单个α链组成,并与β2-微球蛋白缔合,可正确折叠并运输到细胞表面。
97.术语“免疫细胞”是指免疫系统的细胞,其可以被分类为淋巴细胞(t细胞,b细胞和nk细胞),嗜中性粒细胞和单核细胞/巨噬细胞。这些是所有类型的白细胞。
98.术语“免疫危险信号”是指当组织细胞由于损伤,感染等而陷入困境时,它们开始在其表面上分泌或表达表示“危险”的分子,或者入侵生物的成分(例如,病毒dna或rna)也被免疫系统敏化为危险信号。
99.术语“免疫原”是指能够引发免疫应答的特定类型的抗原。
100.术语“肿瘤微环境(tme)”或“免疫抑制性肿瘤微环境”是指肿瘤周围的环境,包括周围的血管,免疫细胞,成纤维细胞,信号分子和细胞外基质(ecm)。肿瘤与周围的微环境密切相关并不断相互作用。肿瘤可以通过释放细胞外信号来抑制免疫反应,促进肿瘤血管生成并诱导外周免疫耐受,从而影响微环境,而微环境中的免疫细胞可以影响癌细胞的生长和进化。
101.诸如“增加”或“增强”的术语优选地涉及增加或增强约至少5%,优选至少10%,优
选至少20%,优选至少30%,更优选至少40%,更优选至少50%,甚至更优选至少80%,还优选至少100%。这些术语也可能与以下情况有关,其中在零时没有某种化合物或条件的可检测信号,而在特定时间点晚于零时有某种化合物或条件的可检测信号。
102.术语“诱导型启动子”是指核苷酸序列,当其与编码或指定基因产物的多核苷酸可操作地连接时,基本上仅当对应于启动子的诱导剂存在于细胞时才导致在细胞中产生基因产物。
103.如本文所用,术语“分离的”是指从其天然环境中移去的细胞,蛋白质,多肽,肽,多核苷酸,载体等(即与至少一种其他组分分离,该其他组分与它是自然关联或在自然界中发现的)。
104.慢病毒载体是一种逆转录病毒,其可以感染分裂细胞和非分裂细胞,因为它们的整合前复合物(病毒“壳”)可以穿过靶细胞核的完整膜。慢病毒载体衍生自人免疫缺陷病毒。
105.如本文所用,“接头肽”或“接头序列”是指连接两个其他氨基酸序列的氨基酸序列。例如,hla i类蛋白的一部分可以通过接头序列与一部分肿瘤相关抗原序列,例如表位序列连接。
106.术语“杂合性丧失”或“loh”是指一个亲本对细胞的贡献的丧失,可能是由于直接缺失,由于不平衡的重排,基因转化,有丝分裂重组α或染色体丢失(单染色体)引起的。
107.术语“主要组织相容性复合物”或“mhc”是指一组基因,其编码对于获得的免疫系统识别脊椎动物中的外来分子而言必不可少的细胞表面蛋白,这反过来决定了组织相容性。mhc分子与病原体产生的抗原结合并在细胞表面展示,以被适当的t细胞识别,mhc分子介导白细胞(wbc)与其他白细胞的相互作用。mhc决定供体器官移植的相容性,以及通过交叉反应免疫对自身免疫疾病的敏感性,人类mhc也称为hla(人类白细胞抗原)复合物(通常简称hla)。mhc是使免疫系统(更具体而言是t细胞)结合,识别和耐受自身(自动识别)的组织抗原。mhc还是作为潜在的外源抗原与mhc结合并提呈给t细胞受体(tcr)的细胞内肽的伴侣分子。mhc与tcr及其共受体相互作用,以从抗原结合亲和力和特异性以及信号转导效率的角度优化tcr-抗原相互作用的结合条件。
108.术语“mhc i类蛋白”或“mhc i类分子”是指主要的组织相容性复合体(mhc)分子或糖蛋白或蛋白质的两个主要类别之一(另一类为mhc ii类),存在于脊椎动物体内所有有核细胞的细胞表面。mhc i蛋白在机体大多数有核细胞上形成功能性受体。主要的组织相容性复合体(mhc)i类分子负责将肽表位呈递给细胞毒性t细胞。在人类中,人类白细胞抗原(hla)系统是编码i类和mhc类mhc分子的基因位点。hla-a,-b和-c基因编码mhc i类(mhci)蛋白。通常长度为8-11个氨基酸的肽将通过与位于反平行β折叠上方的两个α螺旋形成的凹槽相互作用而结合mhc i分子。肽-mhc i类(pmhci)分子的加工和呈递涉及一系列连续阶段,包括:a)蛋白酶介导的蛋白质消化;b)由与抗原加工(tap)相关的转运蛋白介导的肽转运进入内质网(er);c)使用新合成的mhc i分子形成pmhci;d)将pmhci运输到细胞表面。在细胞表面,pmhci将通过t细胞受体(tcr)与细胞毒性t细胞相互作用。在复杂的pmhci-tcr相互作用之后,非自体抗原的鉴定可能通过一系列由相关酶,共受体,衔接子分子和转录因子介导的生化事件导致细胞毒性t细胞活化。活化的细胞毒性t细胞将增殖,以产生大量的效应t细胞,这些t细胞表达对所鉴定的免疫原性肽表位具有特异性的tcr。对鉴定出的非自身
表位具有tcr特异性的t细胞的扩增会导致免疫介导的细胞凋亡,从而显示出活化的非自身表位。
109.术语“mhc蛋白”是指由mhc基因编码的蛋白。
110.免疫抑制肿瘤微环境(tme):肿瘤促进耐受性微环境的能力以及多种免疫抑制机制的激活,这些机制可能共同作用以抵消有效的免疫反应,例如肿瘤引起的抗原提呈受损,负性共刺激信号的激活以及复杂化免疫抑制因子。
111.术语“突变体”或“突变体类型”是指由突变实例产生或产生的菌株,基因或特征,其通常是生物体的基因组或染色体的dna序列的改变。
112.术语“n-末端信号肽”是指存在于大多数新合成的蛋白质的n末端的信号肽(通常长16-30个氨基酸),这些蛋白质预定朝向分泌途径。这些蛋白质包括驻留在某些细胞器(内质网,高尔基体或内体)中,从细胞分泌或插入大多数细胞膜中的蛋白质。信号肽的功能是促使细胞将蛋白质易位,通常转移至细胞膜。
113.术语“新抗原”是指以前未被免疫系统识别的新形成的抗原。例如,新抗原可以源自由于肿瘤基因改变而形成的改变的肿瘤蛋白,包括点突变,插入/缺失,扩增/融合,翻译后修饰,或源自病毒蛋白。
114.如本文所用,“核酸”与术语“多核苷酸”可互换,并且通常是指任何多核糖核苷酸或多脱氧核糖核苷酸,其可以是未修饰的rna或dna或修饰的rna或dna或任何它们的组合。“核酸”包括但不限于单链和双链核酸。如本文所用,术语“核酸”还包括含有一个或多个修饰碱基的如上所述的dna或rna。因此,具有因稳定性或其他原因而修饰的主链的dna或rna是“核酸”。本文所用的术语“核酸”包括核酸的这种化学修饰、酶促修饰或代谢修饰形式,以及病毒和细胞(包括例如简单和复杂细胞)特有的dna和rna的化学形式。“核酸”或“核酸序列”还可包括单链或双链rna或dna或任何组合的区域。
115.如本文所用,术语“编码核酸”,“编码核酸分子”,“dna序列编码”和“dna编码”是指沿着脱氧核糖核酸链的脱氧核糖核苷酸的顺序或序列。这些脱氧核糖核苷酸的顺序决定了沿着多肽(蛋白质)链的氨基酸顺序。因此,核酸序列编码氨基酸序列。
116.如本文所用,术语“溶瘤病毒”是指能够在体外或体内,在肿瘤细胞(例如,诸如癌细胞的增殖性细胞)中选择性复制以减慢所述分裂细胞的生长和/或裂解的病毒,而在正常细胞中则没有或只有很少的复制。通常,溶瘤病毒包含包装到病毒颗粒(或病毒粒子)中的病毒基因组并且具有感染性(即能够感染并进入宿主细胞或受试者)。如本文所用,该术语涵盖dna或rna载体(取决于所讨论的病毒)以及由其产生的病毒颗粒。
117.术语“一个或多个”是指一个或大于一个的数字(例如2、3、4、5等)。
118.短语“可操作地连接”或“可操作地连接”是指两个或更多个多核苷酸(例如,dna)区段之间的功能关系。通常,它是指转录调节序列与转录序列的功能关系。例如,如果启动子或增强子序列在合适的宿主细胞或其他表达系统中刺激或调节编码序列的转录,则将其与编码序列可操作地连接。通常,与转录序列可操作连接的启动子转录调控序列在物理上与该转录序列邻接,即它们是顺式作用的。但是,某些转录调控序列,例如增强子,在物理上不必是连续的或位于其增强转录的编码序列的附近。
119.术语“多肽”,“肽”和“蛋白质”是指氨基酸残基的聚合物,其包含通过肽键结合的多个氨基酸。该聚合物可以是直链,支链或环状的,并且可以包含天然存在的和/或氨基酸
类似物,并且可以被非氨基酸中断。
120.术语“质粒”是指在细胞中发现的“额外的”自我复制遗传元件。质粒用于基因工程中以产生重组dna,并作为在生物体之间转移基因的机制。
121.点突变或取代是遗传突变,其中单个核苷酸碱基从dna或rna序列中被改变,插入或缺失。
122.术语“多聚腺苷酸添加信号”或“多聚腺苷酸添加信号序列”或“多聚腺苷酸化信号”或“多聚腺苷酸化信号序列”或“多聚腺苷酸信号”或“多聚腺苷酸信号序列”是指由rna切割复合物识别的序列基序,其在真核生物组之间变化。大多数人聚腺苷酸化信号包含aauaaa序列。
123.如本文所用,术语“预防”是指旨在抑制不希望的生理变化或病症或病状发展的预防或预防措施。预防疾病或病状可以包括在疾病或病状(或其症状)出现或存在之前的时间开始施用根据本文提供的方法获得的t细胞,使得不会出现疾病或病状,或其病理特征,后果或不良影响。
124.术语“启动子”是指被细胞的合成机制或引入的合成机制识别的,启动多核苷酸序列的特异性转录所需的dna序列。
125.如本文所用,术语“受体”是指在细胞表面表达的分子,其中所述分子能够结合细胞配体。当合适的配体与受体结合时,本文所用的受体-配体结合优选能够初始化或抑制生化途径和/或信号级联。
126.术语“重组”是指涉及或表示使用重组技术形成的生物,细胞,蛋白质,遗传材料,dna或rna。
127.术语“重组dna”是指通过组合来自两种或更多种来源的dna制成的dna或rdna。使用限制性内切酶(也称为限制性内切核酸酶)将dna片段从染色体的正常位置切下,然后使用称为连接酶的酶将其插入其他染色体或dna分子中。
128.术语“重组tcr”是指通过重组技术制备的tcr。
129.如本文所用,术语“具有复制能力”或“具有复制能力的病毒”是指具有复制能力的病毒或其复制取决于癌细胞中的因子(例如上调因子)的病毒。
130.在本说明书的上下文中,术语“具有复制能力的病毒”是指具有在体外和体内在细胞中复制的所有必需机制的病毒,即无需包装细胞系的辅助。在本文中,能够在互补包装细胞系中复制的病毒载体(例如至少在e1a区域中缺失的病毒载体),不是具有复制能力的病毒。
131.在本说明书的上下文中,术语“复制缺陷型病毒”是指需要包装细胞系(包含转基因)复制的病毒。
132.术语“逆转录病毒载体”是指可以容纳目的基因以允许将两者掺入靶细胞的前病毒序列。载体还可以包含病毒和细胞基因启动子,例如cmv启动子,以增强目的基因在靶细胞中的表达。
133.术语“自切割接头肽”是指存在于蛋白质(例如重组蛋白)中的短肽(例如18-22个氨基酸长的肽),在细胞中其可以触发蛋白质的自切割。裂解在蛋白质翻译后开始。自切割接头肽的确切分子机制仍不确定。然而,据信其涉及甘氨酰脯氨酰肽键形成的核糖体“跳跃”而不是真正的蛋白水解切割。
134.自灭活慢病毒载体已用于将基因导入成熟的t细胞中,以通过递送嵌合抗原受体(cars)或克隆的t细胞受体产生对癌症的免疫力。
135.术语“自身蛋白质”是指通常由特定生物体产生的蛋白质。特定生物体的免疫系统应能耐受自身蛋白质。如果没有,则有自身免疫。
136.如本文所用,术语“沉默子”是指能够结合转录调节因子的dna序列,称为阻遏物。dna包含提供产生信使rna(mrna)模板的基因。然后将该mrna翻译成蛋白质。当阻遏蛋白结合至dna的沉默子区域时,可防止rna聚合酶将rna序列转录为rna。由于转录受阻,因此无法将rna翻译成蛋白质。因此,沉默子阻止基因被表达为蛋白质。
137.术语“实体瘤”是指通常不包含囊肿或液体区域的组织或肿瘤的异常块。实体瘤可能是良性的(非癌性)或恶性的(癌性)。
138.如本文所用,术语“受试者”或“患者”可互换使用,并且可涵盖任何脊椎动物,包括但不限于人,哺乳动物,爬行动物,两栖动物和鱼类。然而,有利地,受试者或患者是诸如人的哺乳动物,或诸如驯养的哺乳动物(例如狗,猫,马等)或家畜(例如牛,绵羊,猪等)的哺乳动物。在示例性实施方式中,受试者是人。如本文所用,短语“需要”表示受试者的状态,其中需要治疗或预防措施。这样的状态可以包括但不限于患有诸如癌症的疾病或状况的受试者。
139.术语“自杀基因”是指编码能够将药物前体转化为细胞毒性化合物的蛋白质的基因。自杀基因包括但不限于编码具有胞嘧啶脱氨酶活性,胸苷激酶活性,尿嘧啶磷酸核糖基转移酶活性,嘌呤核苷磷酸化酶活性和胸苷酸激酶活性的蛋白质的基因。下表中公开了自杀基因和包含一个核碱基部分的药物的相应前体的实例。
140.术语“表面表达”是指目的蛋白与宿主细胞的天然表面蛋白的融合体。这导致重组蛋白被运输到宿主表面并随后展示在宿主表面上。
141.术语“t细胞”是指在胸腺中发育的一种淋巴细胞(因此得名),并在免疫应答中起关键作用。通过t细胞受体在细胞表面上的存在,可以将t细胞与其他淋巴细胞区分开。“细胞毒性t细胞或cd8 t细胞或杀伤细胞能够直接杀死被病毒感染的细胞以及癌细胞。cd8 t细胞还能够利用称为细胞因子的小信号蛋白在免疫接种时募集其他细胞。辅助性t细胞或cd4 t细胞通过间接杀死被识别为外来的细胞而发挥功能:它们确定免疫系统的其他部分是否以及如何响应特定的感知威胁。
142.短语“串联”是指两个或多个实体(例如多核苷酸(例如dna)和多肽)之间的空间关系,其排列方式使得它们一个接一个地放置。
143.如本文所用,术语“靶标”是指免疫应答所针对的分子(例如蛋白质或肽),细胞或组织或生物。
144.术语“靶抗原”是指期望针对其产生免疫应答的任何物质,但是通常,靶抗原是蛋白质或肽。靶抗原可以包含诱导免疫应答的全长蛋白质或其片段(即,免疫原性片段)。可以修饰靶抗原或其片段,例如以降低靶抗原的一种或多种生物学活性或增强其免疫原性。
145.术语“靶细胞”是指期望对其产生免疫应答或可以被免疫细胞例如(t细胞)特异性识别的任何细胞。
146.如本文所用,术语“t细胞受体”或“tcr”是指在t细胞或t淋巴细胞表面上发现的分子,其负责将抗原片段识别为与主要组织相容性复合物(mhc)分子结合的肽。
147.除非另有说明,否则根据常规用法使用本文的技术术语。分子生物学中常用术语的定义可以在以下文献中找到:本杰明
·
莱温的《基因vii》,牛津大学出版社出版,1999年;kendrew等编辑,《分子生物学百科全书》,blackwell science ltd.出版,1994年;和罗伯特
·
迈耶斯(robert a.meyers)编辑,《分子生物学和生物技术:综合参考书》,由vch publishers,inc.出版,1995年;和其他类似参考。
148.本文所用的术语“治疗的”是指治疗。通过减少,抑制,缓解,减轻,预防或根除疾病状态可获得治疗效果。
149.如本文所用,术语“治疗有效剂量”或“治疗有效量”或“有效量”或“有效剂量”是指单独或与其他剂量组合导致所需反应或在治疗特定疾病或特定病症的情况下,期望的反应与疾病进展的抑制有关,这可能包括疾病进展的减速,特别是对疾病进展的破坏。治疗疾病或病症的所需反应还可以是延迟疾病或病症的发生或抑制疾病或病症的发生。有效量的本发明组合物取决于状况或疾病,疾病的严重程度,患者的各个参数,包括年龄,生理状况,身高和体重,持续时间治疗,可选的伴随疗法的类型,具体的给药途径和类似因素。如果患者对初始剂量的反应不充分,则可以采用多剂量或更高剂量(或更高的有效剂量,可以通过更局限的给药途径实现)。
150.术语“疗法”(以及疗法的任何形式,例如“治疗”)是指治疗和预防或预防措施,其目的是预防或减缓(减轻)不希望的生理变化或病理性疾病。治疗癌症可包括但不限于减轻一种或多种临床适应症,降低肿瘤生长或肿瘤细胞增殖,降低一种或多种癌症病症的临床适应症的严重性,减轻病症的程度,稳定受试者的疾病状态(即不恶化),延迟或减慢,停止或逆转癌症进展,并实现部分或完全缓解。如果与根据标准医学实践(而不结合根据本文提供的方法获得的t细胞)进行治疗的预后相比,治疗癌症还包括将生存期延长几天,几周,几个月或几年。需要治疗的受试者可以包括已经患有或被诊断出患有癌症的受试者,以及易于,可能发展或怀疑患有癌症(例如淋巴瘤或多发性骨髓瘤)或感染的受试者。
151.术语“肿瘤抗原”是指在肿瘤细胞中产生的抗原性物质,即它在宿主中触发免疫反应。肿瘤抗原是用于通过诊断测试鉴定肿瘤细胞的有用肿瘤标志物,并且是用于癌症治疗的潜在候选物。
152.术语“肿瘤相关抗原”是指存在于一些肿瘤细胞以及某些正常细胞上的抗原。
[0153]“肿瘤浸润淋巴细胞(til)”是指已经浸润了受试者肿瘤的受试者自身的天然t细胞。可以将其收获,激活,扩展和重新引入(例如重新输注)到受试者中,在那里其可以寻找并消灭肿瘤,作为癌症或肿瘤治疗的一部分。
[0154]
术语“肿瘤特异性抗原”是指存在于肿瘤细胞上而不存在于任何其他细胞上的抗原。
[0155]
术语“载体”是指能够转运已与其连接的另一核酸的核酸分子。术语“表达载体”包括任何载体(例如质粒,粘粒或噬菌体染色体),其包含基因构建体,其形式适合于细胞表达(例如,与启动子连接)。在本说明书中,“质粒”和“载体”可互换使用,因为质粒是载体的常用形式。此外,本发明旨在包括具有等效功能的其他载体。
[0156]
术语“病毒载体”定义为病毒或病毒颗粒,其包含待体内,离体或体外递送至宿主细胞的多核苷酸。病毒载体的实例包括逆转录病毒载体,慢病毒载体,腺病毒载体,腺伴随病毒载体,α病毒载体等。还开发了α病毒载体,例如基于塞姆利基森林病毒的载体和基于
sindbis病毒的载体,用于基因治疗和免疫治疗。参见文献:“schlesinger and dubensky(1999)cur.opin.biotechnol.5:434-439”;以及“ying,et al.(1999)nat.med.5(7):823-827”。
[0157]
术语“vp/天”是指每天的病毒颗粒。
[0158]
术语“野生的”或“野生型”是指与非典型突变体类型不同的,在自然条件下普遍存在的品系,基因或特征。
附图说明
[0159]
图1a显示了本文所述的重组溶瘤腺病毒构建体的示意图。padeasy-ny-a2(也即padeasy-ef1α-ny-a2)代表复制缺陷型腺病毒载体,其表达所述标记性多肽和hla-a2蛋白,该标记性多肽包含ny-eso-1 157-165表位肽。该构建体的主链衍生自具有e1区缺失(e1 del)和e3区缺失(e3 del)的5型腺病毒基因组dna。在e1a区域中,结合了表达单元。该表达单元包含标记性多肽编码序列和hla-a2蛋白,该标记性多肽编码序列包括insl5信号肽(insl5 sp),通过furin蛋白酶切割位点连接的三个ny-eso-1 157-165表位肽(ny表位x3),接头肽(furin-f2a),表达单元的两侧是ef1α启动子(ef1αpro)和sv40 poly(a)信号序列(sv40 pa)。litr和ritr分别代表左端反向末端重复序列(itr)和右端反向末端重复序列。pad-ef1α-e1a-a2-f2a-ny(也即pad-ef1α-e1ad24-a2-f2a-ny)和pad-ef1α-e1a-a2-f2a-bm(也即pad-ef1α-e1ad24-a2-f2a-bm)代表有条件复制能力的腺病毒载体,分别包含hla-a2基因和编码所述含有ny-eso-1 157-165表位肽的标记性多肽,或带有人β2-微球蛋白基因。这些构建体的骨架是带有e1和e3区缺失的5型腺病毒的基因组dna。在e1a区域并入具有122-129缺失的突变e1a基因(e1a del24),并在两侧分别具有ef-1α启动子和内源e1a多聚a信号(e1a pa)。编码hla-a2和带有er保留信号(kdel)的标记性多肽的表达单元的两侧是5'端内源性e1b启动子(e1b pro)和3'端pix基因区域,包括内源性e1b/ix poly a信号序列(e1b/ix pa)。另一方面,e1b基因区域被删除。
[0160]
图1b显示了用于表达tcr的慢病毒载体的示意图。pcdh-ef1α-tcr-ny代表一种基于hiv的慢病毒载体,表达特异性针对ny-eso-1 157-165表位肽的tcr。u3区增强子的缺失(u3 del)确保了慢病毒构建体的自我灭活。tcr基因编码具有可变序列(tcr-βv)和鼠恒定序列(鼠tcr-βc)的β链和具有可变序列(tcr-αv)和鼠恒定序列(鼠tcr-αc)的α链),两侧是ef1α启动子和慢病毒wpre区。
[0161]
图1c显示了用pshuttle载体转染后293t细胞的hla-a2表达,该载体表达了所述包含ny-eso-1 157-165表位肽的标记性多肽和hla-a2蛋白。293t细胞用fitc标记的抗hla-a2抗体染色,并用流式细胞仪分析。深色粗线显示了在用编码hla-a2蛋白的载体转导的293t细胞上hla-a2的表达。浅灰线是用空载体转导的对照293t细胞。门控群体(gated population)的平均荧光强度(geom均值)显示在流式细胞仪图上。左图显示pshuttle-ef1α-ny-a2转导的293t细胞的hla-a2表达,中间图显示pshuttle-ef1α-e1ad24-a2-f2a-ny转导的293t细胞的hla-a2表达,右图显示了pshuttle-ef1α-e1ad24-a2-f2a-bm转导的293t细胞中hla-a2的表达。
[0162]
图1d显示了在慢病毒转染后,jrt细胞表达了ny-eso-1特异性tcr,所述慢病毒在hla-a2的背景下表达了对ny-eso-1 157-165表位肽具有特异性的不同tcr。将jrt细胞转染
重组慢病毒并在7-10天内进行分析。jrt细胞用apc标记的抗cd8抗体和pe标记的ny-eso-1 157-165/hla-a2四聚体染色,并通过流式细胞仪进行分析。在流式细胞仪图上显示了门控jrt细胞群中四聚体阳性细胞的百分比。从左自右第1图示出的对照组是未用慢病毒转导的jrt细胞。从左自右第2图示出的“tcr-ny-ly”组是用由pcdh-ef1α-tcr-ny-ly产生的慢病毒转染的jrt细胞。从左自右第3图示出的“tcr-ny-ae”组是用由pcdh-ef1α-tcr-ny-ae产生的慢病毒转染的jrt细胞。从左自右第4图示出的“tcr-ny-li”组是用由pcdh-ef1α-tcr-ny-li产生的慢病毒转染的jrt细胞。
[0163]
图2a显示了ny-eso-1特异性tcr可以识别hla-a2在t2细胞上呈递的ny-eso-1 157-165表位肽。由pcdh-ef1α-tcr-ny-ly(jrt-tcr-ny-ly),pcdh-ef1α-tcr-ny-ae(jrt-tcr-ny-ae)或pcdh-ef1α-tcr-ny-li(jrt-tcr-ny-li)产生的重组慢病毒转导的jrt细胞与t2细胞一起培养,该t2细胞用从1μg/ml开始10倍稀释的ny-eso-1 157-165表位肽系列稀释液浓度加载处理16小时。收获细胞并用抗cd69抗体染色以通过流式细胞术分析cd69的表达。x轴是用一系列浓度的ny-eso-1 157-165肽浓度加载处理的t2靶细胞,y轴是门控jrt细胞中cd69
细胞的百分比。
[0164]
图2b显示表达含有ny-eso-1 157-165表位肽的标记性多肽和hla-a2的293t细胞可以激活jrt细胞上的ny-eso-1特异性tcr。在重复的孔中,将用重组慢病毒转导以表达对ny-eso-1特异性的不同tcr的jrt细胞与用pshuttle-ef1a-ny-a2或pshuttle-ef1a-e1ad24-a2-ny转导的293t细胞孵育持续16小时,收获细胞并用抗cd69抗体染色以通过流式细胞术分析cd69的表达。x轴显示jrt细胞表达特异性针对ny-eso-1的不同tcr,包括jrt-tcr-ny-ly,jrt-tcr-ny-ae和jrt-tcr-ny-li。y轴是门控jrt细胞中cd69
细胞的百分比(平均值
±
sd;n=2)。“对照”代表用空pshuttle载体转导的293t靶细胞;“pshuttle-ef1a-ny-a2”代表用pshuttle-ef1a-ny-a2载体转导的293t靶细胞;“pshuttle-ef1a-e1ad24-a2-ny”代表用pshuttle-ef1a-e1ad24-a2-ny载体转导的293t靶细胞。用student's t检验分析数据,**代表p《0.01,*代表p《0.05。
[0165]
图2c显示外源性hla-a2可以呈递源自ny-eso-1蛋白的ny-eso-1 157-165表位肽,以激活jrt细胞上的ny-eso-1特异性tcr。在重复的孔中,将用表达全长ny-eso-1蛋白的pcdna3.3载体(pcdna3.3-ny)和表达外源hla-a2蛋白的pshuttle载体(pshuttle-ef1a-e1ad24-a2-f2a-bm)共转染的293t细胞用作靶细胞以刺激用ny-eso-1特异性tcr转导的jrt细胞。单独用pcdna3.3-ny或pshuttle-ef1a-e1ad24-a2-f2a-bm转导的293t细胞为阴性对照。单独用pshuttle-ef1a-e1ad24-a2-f2a-bm转导并以1μg/ml的ny-eso-1 157-165表位肽浓度加载处理的293t细胞作为阳性对照。在16小时内收获细胞,用抗cd69抗体染色并通过流式细胞术分析。x轴显示jrt细胞表达对ny-eso-1特异性的不同tcr,包括jrt-tcr-ny-ly,jrt-tcr-ny-ae和jrt-tcr-ny-li。y轴是门控jrt细胞中cd69
细胞的百分比(平均值
±
sd;n=2)。“pcdna3.3-ny”代表仅用pcdna3.3-ny转导的293t靶细胞;“pshuttle-ef1a-e1ad24-a2-f2a-bm”代表仅通过pshuttle-ef1a-e1ad24-a2-f2a-bm转导的293t靶细胞;“pshuttle-ef1a-e1ad24-a2-f2a-bm pcdna3.3-ny”代表用pshuttle-ef1a-e1ad24-a2-f2a-bm和pcdna3.3-ny共转导的293t靶细胞;“pshuttle-ef1a-e1ad24-a2-f2a-bm ny-eso-1多肽”代表用pshuttle-ef1a-e1ad24-a2-f2a-bm转导并用ny-eso-1 157-165肽浓度加载处理的靶293t细胞。用student's t检验分析数据,**代表p《0.01,*代表p《0.05。
[0166]
图2d显示了重组溶瘤腺病毒dna中编码外源肽和蛋白质的核酸可以转导293t细胞以表达包含ny-eso-1 157-165表位肽的标记性多肽和外源hla-a2。用重组溶瘤腺病毒载体pad-ef1a-e1ad24-a2-ny和pad-ef1a-e1ad24-a2-bm转导293t细胞,并将其用作靶细胞刺激表达ny-eso-1特异性tcr的jrt细胞。在重复的孔中,将混合培养的细胞温育16小时,并收集以通过流式细胞术分析cd69的表达。x轴显示jrt细胞表达特异性针ny-eso-1的不同tcr,包括jrt-tcr-ny-ly和jrt-tcr-ny-ae。y轴是门控jrt细胞中cd69
细胞的百分比(平均值
±
sd;n=2)。“对照”是没有转染的293t细胞;“pad-ef1a-e1ad24-a2-f2a-ny”和“pad-ef1a-e1ad24-a2-f2a-bm”代表分别用pad-ef1a-e1ad24-a2-f2a-ny或pad-ef1a-e1ad24-a2-f2a-bm转导的293t靶细胞。“pad-ef1a-e1ad24-a2-f2a-bm pcdna3.3-ny”代表用pad-ef1a-e1ad24-a2-f2a-bm和pcdna3.3-ny共转导的293t靶细胞;“pad-ef1a-e1ad24-a2-f2a-bm ny-eso-1多肽”代表用pad-ef1a-e1a d 24-a2-f2a-bm转导并用ny-eso-1 157-165肽浓度加载处理的293t靶细胞。用student's t检验分析数据,**代表p《0.01,*代表p《0.05。
[0167]
图3显示可以通过jrt细胞上的ny-eso-1特异性tcr识别包含ny-eso-1表位肽的标记性多肽和外源性hla-a2来敏化肿瘤细胞。用pshuttle-a2-f2a-ny或pshuttle-a2-f2a-bm转导肿瘤细胞系a375,skov3和skov3-ny(用pcdna3.3-ny转导并稳定表达ny-eso-1蛋白的skov3细胞),并用作刺激jrt细胞的靶细胞,所述jrt细胞表达ny-eso-1特异性tcr。在重复的孔中,将肿瘤细胞和jrt细胞混合培养16小时,收集细胞以通过流式细胞术分析cd69的表达。x轴显示jrt细胞表达对ny-eso-1有特异性的不同tcr,包括jrt-tcr-ny-ly和jrt-tcr-ny-ae。y轴是门控jrt细胞中cd69
细胞的百分比(平均值
±
sd;n=2)。“a375”,“skov3”和“skov3-ny”代表未转导的靶细胞;“a375-pshuttle-a2-f2a-bm”,“skov3-pshuttle-a2-f2a-bm”和“skov3-ny-pshuttle-a2-f2a-bm”代表用pshuttle-a2-f2a-bm转导的肿瘤靶细胞;“a375-pshuttle-a2-f2a-ny”,“skov3-pshuttle-a2-f2a-ny”和“skov3-ny-pshuttle-a2-f2a-ny”代表用pshuttle-a2-f2a-ny转导的肿瘤靶细胞。用student's t检验分析数据,**代表p《0.01,*代表p《0.05。
[0168]
图4a显示,在hla-a2的背景下,用编码ny-eso-1特异性tcr的重组慢病毒转染的pbmc可以表达特异性针对ny-eso-1157-165肽的tcr。用编码不同ny-eso-1特异性tcr(包括tcr-ny-ly(左图),tcr-ny-ae(中图)和tcr-ny-li(右图))的新鲜制备的慢病毒感染pbmc细胞。在7-10天内收获细胞,用apc标记的抗cd8抗体和pe标记的ny-eso-1 157-165/hla-a2四聚体染色,并通过流式细胞术进行分析。流式细胞术图显示了基于前向散射和侧向散射的门控淋巴细胞群中cd8
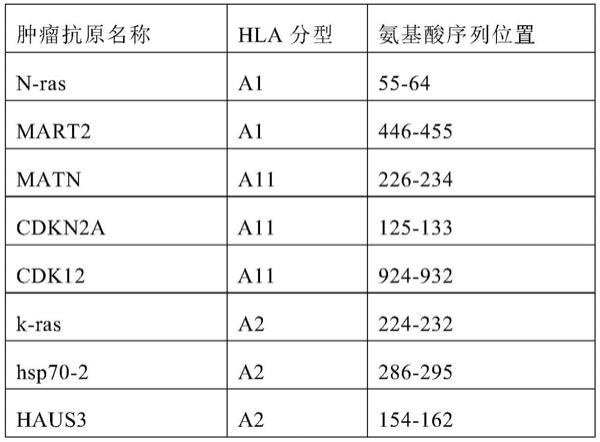
,四聚体
细胞和cd8-且四聚体
细胞的百分比。
[0169]
图4b显示可以通过包含ny-eso-1表位肽的标记性多肽和/或外源性hla-a2敏化肿瘤细胞,以被初级t细胞上的ny-eso-1特异性tcr识别。用pshuttle-a2-f2a-ny或pshuttle-a2-f2a-bm转导了肿瘤细胞系a375,skov3和skov3-ny,并将其用作靶细胞来刺激表达ny-eso-1特异性tcr的hla-a2-pbmc细胞。在重复的孔中,将肿瘤细胞和pbmc细胞混合培养24小时,e:t比为10:1。温育后,收集上清液以评估t细胞分泌ifn-γ。x轴显示表达针对ny-eso-1的不同tcr的pbmc细胞,包括pbmc-tcr-ny-ly,pbmc-tcr-ny-ae和pbmc-tcr-ny-li。y轴显示由特异性t细胞产生的ifn-γ的浓度(平均值
±
sd;n=2)。“a375”,“skov3”和“skov3-ny”代表未转导的靶细胞;“a375 a2bm”,“skov3 a2bm”和“skov3-ny a2bm”代表用pshuttle-a2-f2a-bm转导的肿瘤靶细胞;“a375 a2ny”,“skov3 a2ny”和“skov3-ny a2ny”代表用
pshuttle-a2-f2a-ny转导的肿瘤靶细胞;“a375 a2bm ny多肽”,“skov3 a2bm ny肽”和“skov3-ny a2bm ny多肽”代表用pshuttle-a2-f2a-bm转导并用1μg/ml的ny-eso-1 157-165肽浓度加载处理的肿瘤靶细胞。用student's t检验分析数据,**代表p《0.01,*代表p《0.05。
[0170]
图4c显示,更多的肿瘤细胞系可被含有ny-eso-1表位肽的标记性多肽和外源性hla-a2敏化,并被原代t细胞上的ny-eso-1特异性tcr识别。用pshuttle-ny-a2转导肿瘤细胞系a549,h1299和hos-c1(分别得到“a549-ny”,“h1299-ny”和“hos-ny”),并将其用作靶细胞以刺激用ny-eso-1特异性tcr基因转导的pbmc细胞。在一式三份的孔中,将肿瘤细胞和pbmc细胞混合培养24小时,e:t比为5:1。温育后,收集上清液以评估t细胞分泌ifn-γ。x轴显示效应细胞和靶细胞的组合,y轴显示特定t细胞产生的ifn-γ的浓度(平均值
±
sd;n=3)。模拟效应细胞是用空的慢病毒转导的pbmc细胞。其他效应细胞是用tcr-ny-ly基因转导的pbmc和用tcr-ny-li转导的pbmc。用student's t检验分析数据,**代表p《0.01,*代表p《0.05。
[0171]
图5示出本发明实施例5中,用不同moi的重组溶瘤腺病毒oad-ny/a2感染skov3细胞48小时后,通过流式细胞术检测细胞表面hla-a2表达的结果。横坐标为重组溶瘤腺病毒oad-ny/a2的moi,纵坐标为hla-a2的表达百分比。
[0172]
图6示出本发明的实施例6中,mock-t或靶向ny-eso-1的tcr-t与skov3或重组溶瘤腺病毒oad-ny/a2感染的skov3共培养后,释放的ifn-γ的结果。图6a为人黑素瘤细胞株a375(ny-eso-1阳性和hla-a2阳性)的结果,图6b为人肺癌细胞株h1299(ny-eso-1阳性和hla-a2阴性)的结果,图6c为人卵巢癌细胞株skov3(ny-eso-1阴性和hla-a2阴性)的结果,图6d为人骨肉瘤细胞株hosc1(ny-eso-1弱阳性和hla-a2阳性)的结果。图中“mock-t”表示表达gfp的t细胞组(对照组),“tcr-t”表示表达靶向ny-eso-1 tcr的t细胞组。图中横坐标代表不同实验组,纵坐标代表ifn-γ的浓度(pg/ml)。
[0173]
图7示出本发明实施例7中重组溶瘤腺病毒oad-ny/a2和靶向ny-eso-1的tcr-t对人卵巢癌细胞株skov3的体外联合杀伤结果。图7a为实时杀伤的结果,横坐标为肿瘤细胞铺板后(即实验开始后)的时间,以小时(h)计,纵坐标为归一的细胞指数,图中垂直向下的箭头所指分别为加入oad-ny/a2以及mock-t或tcr-t的时间点。图7b是对图7a实验终点(90.8小时)各组的细胞指数进行分析,计算出的肿瘤生长抑制率,横坐标为不同实验组,纵坐标为肿瘤生长抑制率ir(%)。
[0174]
图8示出本发明实施例8中重组溶瘤腺病毒oad-ny/a2和靶向ny-eso-1的tcr-t对人肺癌细胞株h1299的体外联合杀伤结果。图8a为实时杀伤的结果,横坐标为肿瘤细胞铺板后(即实验开始后)的时间,以小时(h)计,纵坐标为归一的细胞指数,图中垂直向下的箭头所指分别为加入oad-ny/a2以及mock-t或tcr-t的时间点。图8b是对图8a的第61.14小时各组的细胞指数进行分析,计算出的肿瘤生长抑制率,横坐标为不同实验组,纵坐标为肿瘤生长抑制率ir(%)。
[0175]
图9示出本发明实施例9中重组溶瘤腺病毒oad-ny/a2和靶向ny-eso-1的tcr-t对人骨肉瘤细胞株hos c1的体外联合杀伤结果。图9a为实时杀伤的结果,横坐标为肿瘤细胞铺板后(即实验开始后)的时间,以小时(h)计,纵坐标为归一的细胞指数,图中垂直向下的箭头所指分别为加入oad-ny/a2以及mock-t或tcr-t的时间点。图9b是对图9a的第64.44小
时各组的细胞指数进行分析,计算出的肿瘤生长抑制率,横坐标为不同实验组,纵坐标为肿瘤生长抑制率ir(%)。
具体实施方式
[0176]
以下通过具体实施方式的描述并参照附图对本发明作进一步说明,但这并非是对本发明的限制,本领域技术人员根据本发明的基本思想,可以做出各种修改或改进,但是只要不脱离本发明的基本思想,均在本发明的范围之内。
[0177]
本发明提供了一种分离的用于表达外源基因的溶瘤腺病毒,其中所述溶瘤腺病毒为对腺病毒进行基因改造而得到的选择复制型重组溶瘤腺病毒,该重组溶瘤腺病毒的基因组具有以下特征:
[0178]
1)包含e1b基因调控元件,该元件包括e1b启动子和e1b与pix共用的多聚腺苷酸添加信号序列;
[0179]
2)缺失了e1b基因编码区,并且,当需要插入所述外源基因时,在该e1b基因编码区位点插入所述外源基因,并且该外源基因位于所述e1b启动子之后,受所述e1b基因调控元件的控制;
[0180]
3)在所述外源基因的上游,包含转录e1a 13s mrna的e1a的cdna序列,并且该cdna为野生型或rb蛋白结合区域缺失型,该rb蛋白结合区域缺失型为所述野生型cdna去除了如seq id no.7(即ac_000008.1nt 923-nt 946)所示的核苷酸序列(所述ac_000008.1为ncbi(即,美国国立生物技术信息中心,网址:https://www.ncbi.nlm.nih.gov)的genbank编号),或该rb蛋白结合区域缺失型编码突变的e1a蛋白,所述突变的e1a蛋白如seq id no.6所示。
[0181]
研究发现,5型腺病毒的e1a基因内含子2的部分序列和下游e1b启动子重合,而e1a mrna的通读转录(read-through transcription)是病毒感染早期e1b启动子活化所必需的。如果终止e1a基因的通读转录,会大大降低下游e1b基因的顺式(in cis)表达。因此,本发明利用溶瘤病毒基因组中自身的e1b基因调控元件来调控外源基因的表达,避免插入的外源基因调控元件对病毒基因组表达所造成的可能干扰,而影响病毒的有效复制。另外,也可以增加插入的外源基因片段的长度,使得溶瘤病毒载体可以携带更多外源基因负荷。另一方面,本发明构建的溶瘤腺病毒缺失了e1b基因编码区。e1b-19k蛋白可以抑制通过肿瘤坏死因子和fas通路所诱导的细胞凋亡,使得感染的细胞耐受t细胞的杀伤作用。去除e1b-19k基因可以增加被感染的肿瘤细胞对杀伤性t细胞的敏感性。去除e1b-55k基因可以增加溶瘤腺病毒的肿瘤细胞溶瘤选择性。另一方面,在腺病毒感染早期,e1a基因mrna转录物的不同剪接会合成两种主要的e1a蛋白e1a-12s(243r)和e1a-13s(289r)。e1a-13s(289r)蛋白在保守区(cr3)具有特有的46个氨基酸,尽管e1a-12s(243r)和e1a-13s(289r)非常相似,但两者在生物学活性方面显示出显着差异。e1a-13s是主要的病毒蛋白,通过其cr3与多种转录因子相互作用参与激活病毒基因表达。和表达e1a-12s的腺病毒相比,表达e1a289r的病毒能够更有效地驱动病毒基因和蛋白质表达,并且能够更快且更多地复制其基因组。另外,共表达e1a-12s(缺少cr3)可抑制e1a-13s的转录激活功能,而e1a-12s对转录的抑制作用作用在其n末端,并与结合p300/cbp的能力相关。本发明发现,在溶瘤腺病毒的基因组中,通过在外源基因的上游设计转录e1a-13s mrna的e1a的cdna序列而不是e1a基因组基因,使得本
发明可以只转录e1a-13s而避免转录e1a-12s,从而增加外源基因的表达,以及加强病毒基因组的复制。
[0182]
腺病毒e1a蛋白结合rb蛋白的核心位点是leu-122-x-cys-x-glu(x表示任何氨基酸残基)。缺失这段氨基酸序列的e1a蛋白不能结合rb蛋白,导致溶瘤腺病毒选择性地在rb/e2f1通路缺陷的肿瘤细胞中复制并裂解肿瘤细胞。因此,在本发明的重组溶瘤腺病毒的基因组中,当转录e1a 13s mrna的e1a的cdna序列为rb蛋白结合区域缺失型时,在一个实施方案中,该rb蛋白结合区域缺失型为所述野生型cdna去除了如seq id no.7(即ac_000008.1nt 923-nt 946)所示的核苷酸序列。相应地,所述rb蛋白结合区域缺失型cdna所编码的e1a蛋白的氨基酸序列缺失的是l-t-c-h-e-a-g-f(leu-thr-cys-his-glu-ala-gly-phe)。在另一个实施方案中,该rb蛋白结合区域缺失型编码突变的e1a蛋白,所述突变的e1a蛋白如seq id no.6所示,其中突变位点为l122v、c124s和e126d。
[0183]
优选地,所述腺病毒为人c型腺病毒,包括人2型腺病毒和人5型腺病毒。
[0184]
在本发明一个优选的具体实施方案中,所述e1b启动子的核苷酸序列如seq id no.1(即ac_000008.1nt 1336-nt 1702)所示,所述e1b与pix共用的多聚腺苷酸添加信号序列(即e1b/pix多聚腺苷酸添加信号序列)如seq id no.2(即ac_000008.1nt 4038-nt4043)所示。
[0185]
在本发明中,优选地,缺失e1b基因编码区包括缺失e1b-55k基因和e1b-19k基因的编码区。
[0186]
更优选地,所述e1b基因编码区的核苷酸序列如seq id no.3(即ac_000008.1nt 1714-nt 3509)所示。
[0187]
优选地,所述外源基因的起始位点包含kozak序列,优选地,所述kozak序列如seq id no.4(即gccrccatgg,r为嘌呤(a or g))所示。
[0188]
优选地,所述野生型cdna的核苷酸序列如seq id no.5(即ac_000008.1nt 560-nt 1545去除nt 1113-nt 1228)所示。
[0189]
在本发明一个优选的具体实施方案中,所述转录e1a 13s mrna的e1a的cdna位于所述e1b启动子的上游,并且由于e1b启动子内包含内源的e1a基因的添加pa信号序列(ac_000008.1nt 1611-nt1616)和pa添加位点(ac_000008.1nt 1632),以及部分e1a基因序列(nt 1336-nt 1552),因此,该转录e1a 13s mrna的e1a的cdna与所述e1b启动子的核苷酸序列部分重合。在一个实施方案中,重组溶瘤腺病毒的基因组包含如seq id no.2所示的核苷酸序列:
[0190]
atgagacatattatctgccacggaggtgttattaccgaagaaatggccgccagtcttttggaccagctgatcgaagaggtactggctgataatcttccacctcctagccattttgaaccacctacccttcacgaactgtatgatttagacgtgacggcccccgaagatcccaacgaggaggcggtttcgcagatttttcccgactctgtaatgttggcggtgcaggaagggattgacttactcacttttccgccggcgcccggttctccggagccgcctcacctttcccggcagcccgagcagccggagcagagagccttgggtccggtttctatgccaaaccttgtaccggaggtgatcgatccacccagtgacgacgaggatgaagagggtgaggagtttgtgttagattatgtggagcaccccgggcacggttgcaggtcttgtcattatcaccggaggaatacgggggacccagatattatgtgttcgctttgctatatgaggacctgtggcatgtttgtctacagtcctgtgtctgaacctgagcctgagcccgagccagaaccggagcctgcaagacctacccgccgtcctaaaatggcgcctgctatcctgagacgcccgacatcacctgtgtctagagaatgcaatagtagtacggatagctgtgact
ccggtccttctaacacacctcctgagatacacccggtggtcccgctgtgccccattaaaccagttgccgtgagagttggtgggcgtcgccaggctgtggaatgtatcgaggacttgcttaacgagcctgggcaacctttggacttgagctgtaaacgccccaggccataaggtgtaaacctgtgattgcgtgtgtggttaacgcctttgtttgctgaatgagttgatgtaagtttaataaagggtgagataatgtttaacttgcatggcgtgttaaatggggcggggcttaaagggtatataatgcgccgtgggctaatcttggttacatctgacctc(seq id no.2)。
[0191]
其中,如seq id no.2所示的核苷酸序列包含:rb蛋白结合区域缺失型的转录e1a 13s mrna的e1a的cdna(用下划线标记),以及e1b启动子(用斜体标记)。并且,如seq id no.2所示的核苷酸序列位于在内源性e1a启动子/增强子或外源启动子的位点与所述外源基因的起始位点之间。
[0192]
在本发明的一些实施方案中,所述转录e1a 13s mrna的e1a的cdna序列在内源性e1a启动子/增强子的控制下,或者在外源启动子的控制下;优选地,所述内源性e1a启动子/增强子的核苷酸序列如seq id no.8(即ac_000008.1nt 1-nt 499)所示。
[0193]
在本发明的另一些实施方案中,所述转录e1a 13s mrna的e1a的cdna序列在外源启动子的控制下。在具体的实施方案中,由于溶瘤腺病毒基因组的起始位置(例如ac_000008.1nt 1-nt 375)包含病毒的itr、adψ和包装元件,因此,在这些位置之后插入外源启动子。在人5型腺病毒的实施方案中,所述重组溶瘤腺病毒的基因组中去除了如seq id no.9(即ac_000008.1nt 376-nt 559)所示的核苷酸序列,并且所述外源启动子由该去除的位点插入所述基因组。
[0194]
优选地,所述外源启动子包括ef-1α启动子、cmv启动子、pkg启动子、e2f启动子、afp启动子和tert启动子。
[0195]
在本发明优选的实施方案中,所述外源基因包括:hla蛋白编码序列、标记性多肽编码序列、hla蛋白编码序列及标记性多肽编码序列、hla蛋白编码序列及β2-微球蛋白编码序列、或hla蛋白编码序列、β2-微球蛋白编码序列及标记性多肽编码序列。
[0196]
本发明在提及“hla蛋白编码序列及标记性多肽编码序列”、“hla蛋白编码序列及β2-微球蛋白编码序列”和“hla蛋白编码序列、β2-微球蛋白编码序列及标记性多肽编码序列”时,是指在所述溶瘤腺病毒的基因组中同时插入hla蛋白编码序列和标记性多肽编码序列,或者同时插入hla蛋白编码序列和β2-微球蛋白编码序列、或者同时插入hla蛋白编码序列、β2-微球蛋白编码序列和标记性多肽编码序列。
[0197]
优选地,所述hla蛋白包括hla i类分子,该hla i类分子包括hla-a、hla-b和hla-c。
[0198]
优选地,hla蛋白是hla-a*02:01蛋白,并且氨基酸序列(含信号肽序列)如seq id no.12所示。
[0199]
hla-c在细胞表面的表达较低,为了增加hla-c的表达,对插入的外源hla-c进行以下突变中的至少一种:1)第2位精氨酸突变为丙氨酸。这样去除起始子甲硫氨酸后,n端的ala就会乙酰化,使得新合成的hla-c更稳定而不被降解。2)编码该hla-c蛋白的核苷酸序列的第4位核苷酸由c突变为g,第5位核苷酸由g突变为c,这样可形成强的kozak序列(gccrccatgg,r为嘌呤(a or g),以增强蛋白的翻译和表达。3)第362位异亮氨酸突变为苏氨酸;4)第359位谷氨酸突变为缬氨酸。hla-c蛋白的c端包含二疏水(dihydrophobic,li)内在化和溶酶体靶向信号(dxsli),并且第362位的异亮氨酸是影响该基序活性的关键氨基
酸。因此,将hla-c尾部的362位的异亮氨酸更改为hla-a和b尾部中的苏氨酸(i362t),和/或将第359位谷氨酸突变为缬氨酸,可提高hla-c的表面表达。由于这些突变不是位于抗原多肽提呈区域,因而不会影响抗原多肽的提呈和tcr的识别。
[0200]
优选地,hla蛋白是具有i362t点突变的hla-c。更优选地,hla蛋白是hla-c*08:02蛋白,其氨基酸序列包含r2a点突变、i362t点突变和e359v点突变,其氨基酸序列如seq id no.13所示。
[0201]
其他hla蛋白包括但不限于hla-a*01:01蛋白,hla-a*02:03蛋白,hla-a*02:06蛋白,hla-a*03:01蛋白,hla-a*11:01蛋白,hla-a*24:02蛋白,hla-a*30:01蛋白,hla-a*68:01蛋白,hla-b*08:01蛋白,hla-b*14:02蛋白,hla-b*1501,hla-b*58:01,hla-c*07:01蛋白,hla-c*01:02蛋白。
[0202]
hla蛋白的编码序列在任选的外源基因表达调控元件的控制下表达,所述调控元件包括启动子,增强子,增强子,沉默子和聚腺苷酸化信号,或可药用载体自身的基因表达调控元件。
[0203]
通常,表达在细胞浆内的抗原蛋白可进入mhc i类抗原提呈途径,经系列蛋白酶水解后,形成的短肽(含有抗原表位多肽)通过内质网膜上的tap分子转导进入内质网内,并与其中的hla蛋白和β
2-微球蛋白形成三聚体后被提呈在细胞表面(其中hla蛋白和β
2-微球蛋白配对形成mhc i类分子),从而被免疫细胞识别。由于肿瘤细胞中常发生mhc i类抗原提呈途径的功能缺失,导致细胞浆内表达的肿瘤抗原不能有效形成表位多肽或进入内质网并与hla和β2-微球蛋白结合形成复合物。
[0204]
在本发明中,通过将所述具有标记性多肽编码序列的核酸导入肿瘤细胞和/或癌细胞,表达在肿瘤细胞和/或癌细胞内的外源标记性多肽可进入mhc i类抗原提呈途径,从而增加了肿瘤细胞表面hla/抗原表位多肽复合物的表达量,由此增强了所述t细胞受体修饰的免疫细胞对肿瘤细胞和/或癌细胞的识别敏感性。
[0205]
优选地,所述标记性多肽包括可操作地连接的、依次串联的以下氨基酸序列:n端信号肽的氨基酸序列、一个或多个抗原表位多肽的氨基酸序列、可任选的c端内质网滞留信号的氨基酸序列,其中当所述标记性多肽包括多个所述抗原表位多肽的氨基酸序列时,每两个相邻的所述抗原表位多肽的氨基酸序列之间由可切割性连接多肽的氨基酸序列连接;所述抗原表位多肽的氨基酸序列和可任选的c端内质网滞留信号的氨基酸序列可以由可切割性连接多肽的氨基酸序列连接。优选的是,所述标记性多肽包括所述c端内质网滞留信号的氨基酸序列。优选地,所述可切割性连接多肽是furin酶切识别多肽。
[0206]
所述抗原表位多肽的氨基酸序列可以来源于自然界存在的蛋白的氨基酸序列,或者为人工合成的自然界不存在的氨基酸序列。优选地,所述自然界存在的蛋白包括人源蛋白和除人以外的其它物种的蛋白。更优选地,所述抗原表位多肽的氨基酸序列来源于肿瘤相关抗原、肿瘤特异性抗原、和含有突变点的肿瘤新抗原(neo-antigen)的氨基酸序列。
[0207]“肿瘤相关抗原”通常指来源于自身的正常蛋白,但在肿瘤细胞中过度表达或异常表达,其包括癌胚抗原、肿瘤-睾丸抗原(ct抗原)等。
[0208]“肿瘤特异性抗原”通常指来源于自身的突变蛋白,或异体的与肿瘤发生和发展相关的病毒蛋白。
[0209]
在本发明中,有时将“肿瘤相关抗原”和“肿瘤特异性抗原”笼统地称为“肿瘤抗
原”。
[0210]
所述肿瘤抗原可以是如癌症抗原性多肽数据库(cancer antigenic peptide database)(网址https://caped.icp.ucl.ac.be)中所述的肿瘤抗原。优选的是,所述肿瘤抗原可以是如下表1中所述的肿瘤抗原。
[0211]
所述抗原表位多肽可以是能够被mhc i类分子提呈的具有8-11个氨基酸的肽段。所述抗原表位多肽可以是如癌症抗原性多肽数据库(cancer antigenic peptide database)(网址https://caped.icp.ucl.ac.be)中所述的抗原表位多肽。优选的是,所述抗原表位多肽可以是如下表1中所述的抗原表位多肽。在其它实施方案中,所述抗原表位多肽为与如下表1中所述的抗原表位多肽具有4-9个连续的相同氨基酸(例如,4、5、6、7、8或9个连续的相同氨基酸)的抗原表位多肽,并且这些多肽的长度为8-11个氨基酸。
[0212]
表1优选的肿瘤抗原及抗原表位多肽表
[0213]
[0214]
[0215]
[0216][0217]
在某些实施方案中,每个所述抗原表位多肽的两端具有柔性连接片段,作为细胞浆内蛋白水解酶的酶切位点,以释放出该抗原表位多肽。所述柔性连接片段包括gsgsr、agsgsr和agsgs。
[0218]
在某些实施方案中,所述标记性多肽在所述一个或多个抗原表位多肽氨基酸序列
的氨基端具有可把该标记性多肽导入内质网的信号肽。信号肽的核心含有长段疏水性氨基酸,形成单个α-螺旋。信号肽氨基端常以短的带正电荷的氨基酸序列开始,信号肽末端通常存在一段被信号肽酶识别和切割的氨基酸切割位点。所连接的外源多肽进入内质网后,信号肽被信号肽酶识别和切割,在内质网内释放出外源多肽。因此,携带信号肽的标记性多肽可以不通过mhc i类抗原提呈途径中的蛋白酶水解以及tap分子的转运,即可直接进入内质网。所述信号肽可以为由胰岛素样蛋白(insl5)氨基端第1-22氨基酸所组成的信号肽(seq id no.14)。
[0219]
在所述标记性多肽具有多个所述抗原表位多肽的情况中,每两个所述抗原表位多肽可由可切割性连接多肽所连接。可切割性连接多肽包括furin酶切识别多肽,其具有可被furin酶切割的标准的四氨基酸基序,即r-x-[kr]-r氨基酸序列(参见文献“molecular therapy 2007;vol.15no.6,1153
–
1159”)。优选的是,所述可切割性连接多肽的氨基酸序列为r-r-k-r。所述标记性多肽被上述信号肽导入内质网后,由r-x-[kr]-r氨基酸序列连接的抗原表位多肽被内质网中的furin酶切割水解,释放出抗原表位多肽,与内质网中的hla和β
2-微球蛋白形成抗原复合物。内质网内的氨肽酶和羧肽酶也可能参与抗原表位多肽的酶解和释放(参见文献“j immunol.2009 november 1;183(9):5526
–
5536”),因此,可切割性连接多肽还可以包括氨肽酶和羧肽酶酶切识别多肽。
[0220]
为了使被信号肽导入内质网的标记性多肽能够滞留在内质网腔内,以利于释放出抗原表位多肽并与hla和β2-微球蛋白结合形成抗原复合物,在某些实施方案中,所述标记性多肽在所述一个或多个抗原表位多肽氨基酸序列的羧基端具有内质网滞留信号肽。可溶性多肽(即非跨膜蛋白)的内质网滞留信号(er retention signal)的氨基酸序列是kdel,er膜蛋白的内质网滞留信号是kkxx(参见文献“molecular biology of the cell.2003;14(3):889
–
902”)。在本发明中,所述标记性多肽是可溶性多肽。因此优选的是,所述内质网滞留信号肽是由赖氨酸-天冬氨酸-谷氨酸-亮氨酸残基组成的k-d-e-l片段。
[0221]
更优选的是,所述肿瘤相关抗原选自ny-eso-1 157-165、ny-eso-1 1-11、ny-eso-1 53-62、ny-eso-1 18-27、her2/neu 369-377、ssx-2 41-49、mage-a4 230-239、mage-a10 254-262、mage-c2 336-344、mage-c2 191-200、mage-c2 307-315、mage-c2 42-50、mage-a1 120-129、mage-a1 230-238、mage-a1 161-169、kk-lc-1 76-84、p53 99-107、prame 301-309、甲胎蛋白158-166、hpv16-e6 29-38、hpv16-e7 11-19、ebv-lmp1 51-59、ebv-lmp1 125-133、kras:g12d 10-18、kras:g12d 8-16、kras:g12d 7-16、kras:g12c 8-16、kras:g12a 8-16、kras:g12s 8-16、kras:g12r 8-16、kras:g12v 8-16、kras:g12v 7-16、kras:g12v 5-14、kras:g12v 11-19、kras:g12v 5-14、kras:q61h 55-64、kras:q61l 55-64、kras:q61r 55-64、kras:g12d 5-14、kras:g1 3 d 5-14、kras:g12 a 5-14、kras:g12 c 5-14、kras:g12 s 5-14、kras:g12 r 5-14、kras:g12d 10-19、tp53:v157g 156-164、tp53:r248q 240-249、tp53:r248w 240-249、tp53:g245s 240-249、tp53:v157f 156-164、tp53:v157f 149-158、tp53:y163c 156-164、tp53:r248q 247-255、tp53:r248q 245-254、tp53:r248w 245-254、tp53:g245s 245-254、tp53:g249s 245-254、tp53:y220c 217-225、tp53:r175h 168-176、tp53:r248w 240-249、tp53:k132n 125-134、cdc73:q254e 248-256、cyp2a6:n438y 436-444、ctnnb1:t41a 41-49、ctnnb1:s45p 41-49、ctnnb1:t41a 34-43、ctnnb1:s37y 30-39、ctnnb1:s3 3c 30-39、ctnnb1:s45p 40-49、egfr:l858r 852-860、
30-39、egfr:t790m 790-799、gnas:r201h 197-205、cdk4:r24c 23-32、h3.3:k28m 27-36、tvp23c:c51y 51-59或cdc73:q254e的标记性多肽;hla-a-03:01蛋白与包含抗原决定簇肽kras:g12v 8-16、kras:g12v 7-16、ctnnb1:s45p 41-49、ctnnb1:s45p 40-49、braf:v600e 591-601或tp53-v157g 156-164的标记性多肽;hla-a11:01蛋白与包含抗原决定簇肽kras:g12d 8-16、kras:g12d 7-16、kras:g12c 8-16、kras:g12a 8-16、kras:g12s 8-16、kras:g12r 8-16、kras:g12v 8-16、kras:g12v 7-16、tp53:r248q 240-249、tp53:r248w 240-249、tp53:g245s 240-249、tp53:v157f 156-164、tp53:v157f 149-158、tp53:y163c 156-164、ctnnb1:t41a 41-49、ctnnb1:s45p 41-49、egfr:l858r 852-860或pik3ca:e542k 533-542的标记性多肽;hla-a24:02蛋白与包含抗原表位肽tp53:k132n 125-134的标记性多肽;hla-a68:01蛋白与包含抗原表位肽tp53:r248w 240-249的标记性多肽;hla-b-08:01蛋白与包含抗原表位肽chd4 k73rfs 141-148的标记性多肽;hla-b-15:01蛋白与包含抗原表位肽tvp23c:c51y 42-51或idh1:r132h 126-135的标记性多肽;hla-b58:01蛋白与包含抗原表位肽tvp23c:c51y 45-53的标记性多肽;包含i362t和e359v突变的hla-c-01:02蛋白与包含抗原表位肽kras:g12v 11-19的标记性多肽;包含i362t和e359v突变的hla-c-07:01蛋白与包含抗原表位肽pik3ca:h1047r 1046-1055的标记性多肽;包含i362t和e359v突变的hla-c-08:02蛋白与包含抗原表位肽kras:g12d 10-19或kras:g12d 10-18的标记性多肽。
[0228]
当所述外源基因包括所述hla蛋白编码序列及β2-微球蛋白编码序列时,所述hla蛋白编码序列与所述β2-微球蛋白编码序列分别在各自的启动子控制之下,或者该hla蛋白编码序列与所述β2-微球蛋白编码序列在同一启动子控制之下,并且该hla蛋白编码序列通过可切割性连接多肽编码序列与所述β2-微球蛋白编码序列可操作地连接。
[0229]
该实施方案适用于β2-微球蛋白表达缺失的肿瘤。
[0230]
所述启动子可以是真核细胞启动子,包括持续表达启动子和可诱导表达启动子,包括(例如):pgk1启动子、ef-1α启动子、cmv启动子、sv40启动子、ubc启动子、cag启动子、tre启动子、camkiia启动子、人β肌动蛋白(human beta actin)启动子。
[0231]
连接所述hla蛋白与所述标记性多肽之间的所述可切割性连接多肽的例子是本领域已知的,例如2a多肽,2a多肽包括但不限于来自微小核糖核酸病毒的f2a多肽、以及来自其它病毒的相似的2a类多肽;还可以是furin-f2a连接片段。
[0232]
优选地,所述β2-微球蛋白是人源蛋白或鼠源蛋白。
[0233]
还优选地,所述β2-微球蛋白的氨基酸序列如seq id no.17所示。
[0234]
本发明还提供了一种用于制备所述的溶瘤腺病毒的载体,其中所述载体包含所述e1b基因调控元件、缺失了所述e1b基因编码区、并且在所述外源基因的上游包含所述的转录e1a 13s mrna的e1a的cdna序列。在一个实施方案中,所述载体可以以pshuttle为骨架。pshuttle质粒来源于pbr322质粒,包含源自pzero 2.1的卡那霉素抗性基因以及插入外源基因的多克隆位点。多克隆位点两端为5型腺病毒基因组的同源重组序列。左端同源重组序列为5型腺病毒核酸序列34,931
–
35,935。右端同源重组序列为5型腺病毒核酸序列3,534
–
5,790。在一个实施方案中,所述e1a 13s序列上游为所述外源启动子。
[0235]
本发明构建的溶瘤腺病毒可作为肿瘤疫苗单独使用,也可联合t细胞受体修饰的免疫细胞使用。
[0236]
在溶瘤腺病毒作为肿瘤疫苗单独使用时,优选地,所述溶瘤腺病毒的所述外源基
因选自标记性多肽编码序列、和hla蛋白编码序列及标记性多肽编码序列。
[0237]
本发明还提供了一种用于治疗肿瘤和/或癌症的治疗剂,包含:
[0238]
(a)第一组合物,其中该第一组合物包含位于第一可药用载体中的第一活性成分,该第一活性成分包括或含有用于导入肿瘤细胞和/或癌细胞的根据本发明所述的溶瘤腺病毒;和
[0239]
(b)第二组合物,其中该第二组合物包含位于第二可药用载体中的第二活性成分,该第二活性成分包含t细胞受体修饰的免疫细胞。
[0240]
优选地,在所述溶瘤腺病毒表达hla蛋白、和表达hla蛋白及β2-微球蛋白的情况中,适用于本发明的治疗剂的肿瘤和/或癌症应表达提供抗原表位多肽的内源性肿瘤抗原,表达或不表达能提呈该抗原表位多肽的内源性hla蛋白。
[0241]
优选地,在所述溶瘤腺病毒表达标记性多肽的情况中,适用于本发明的治疗剂的肿瘤和/或癌症应表达能提呈所述标记性多肽中的抗原表位多肽的内源性hla蛋白,表达或不表达能提供该抗原表位多肽的内源性肿瘤抗原。
[0242]
优选地,在所述溶瘤腺病毒表达hla蛋白及标记性多肽的情况中,以及在所述溶瘤腺病毒表达hla蛋白、β2-微球蛋白及标记性多肽的情况中,适用于本发明的治疗剂的肿瘤和/或癌症表达或不表达提供抗原表位多肽的内源性肿瘤抗原均可,并且表达或不表达能提呈该抗原表位多肽的内源性hla蛋白均可。
[0243]
在一些优选的实施方案中,所述溶瘤腺病毒载体的外源基因选自标记性多肽编码序列和hla蛋白编码序列及标记性多肽编码序列,所述标记性多肽具有一个或多个抗原表位多肽的氨基酸序列,所述抗原表位多肽能够被mhc i类分子提呈在所述肿瘤细胞和/或癌细胞表面;并且所述t细胞受体修饰的免疫细胞能够特异性识别并结合被所述mhc i类分子提呈的所述抗原表位多肽。
[0244]
优选地,所述第一组合物和所述第二组合物各自独立地存在于所述治疗剂中而互不混合。
[0245]
在本发明所述的治疗剂中,被t细胞受体修饰的所述免疫细胞包括原始t细胞或其前体细胞,nkt细胞,或t细胞株。
[0246]
所述t细胞受体包括α链和β链中的至少一者,所述α链和β链均包含可变区和恒定区,所述t细胞受体能够特异性识别肿瘤细胞和/或癌细胞表面上的所述抗原表位多肽。
[0247]
tcrα链和β链的可变区用于结合抗原多肽/主要组织相容性复合体(mhc i),分别包括三个超变区或称为互补决定区(complementarity determining regions,cdrs),即,cdr1、cdr2、cdr3。其中cdr3区域对特异性识别被mhc分子提呈的抗原多肽至关重要。tcrα链是不同的v和j基因片段重组而成,β链则是不同的v、d和j基因片段重组而成。特定基因片段重组结合所形成的相应cdr3区域,以及结合区域回文以及随机插入的核苷酸(palindromic and random nucleotide additions)形成了tcr对抗原多肽识别的特异性(参见文献“immunobiology:the immune system in health and disease.5
th edition,chapter 4,the generation of lymphocyte antigen receptors”)。所述mhc i类分子包括人hla。所述hla包括:hla-a、b、c。
[0248]
t细胞表达的外源tcrα链和β链有可能和t细胞本身tcr的α链和β链发生错配,不仅会稀释正确配对的外源tcr的表达量,错配tcr的抗原特异性也不明确,因而有识别自身抗
原的潜在危险,因此优选将tcrα链和β链的恒定区修饰以减少或避免错配。
[0249]
在一个实施方案中,所述α链的所述恒定区和/或所述β链的所述恒定区来源于人;优选地,本发明发现所述α链的所述恒定区可以全部或部分地被来源于其它物种的同源序列所替换,并且/或者所述β链的所述恒定区可以全部或部分地被来源于其它物种的同源序列所替换。更优选地,所述其它物种为小鼠。
[0250]
所述替换可以增加细胞中tcr的表达量,并且可以进一步提高被该tcr修饰的细胞对her2/neu抗原的特异性。
[0251]
所述α链的所述恒定区可以修饰有一个或多个二硫键,并且/或者所述β链的所述恒定区可以修饰有一个或多个二硫键,例如1个或2个。
[0252]
在具体的实施方式中,制备了两种不同方式修饰的tcr,一种方式是通过点突变在tcr恒定区增加一个二硫键,方法在文献“cancer res.2007apr 15;67(8):3898-903.”中描述,其全文通过引用方式并入本文。用小鼠tcr恒定区序列置换相应的人tcr恒定区序列的方法在文献“eur.j.immunol.2006 36:3052
–
3059”中描述,其全文通过引用方式并入本文。
[0253]
优选地,所述第一组合物包含治疗有效量的所述溶瘤腺病毒。优选地,所述溶瘤腺病毒的施用剂量为5
×
10
7-5
×
10
12
vp/天,每天1-2次,连续施用1-7天。
[0254]
还优选地,所述第二组合物包含治疗有效量的所述的t细胞受体修饰的免疫细胞。优选地,包含每个疗程总剂量范围为1
×
10
3-1
×
109个细胞/kg体重的所述t细胞受体修饰的免疫细胞。
[0255]
所述溶瘤腺病毒可以配制成通过瘤内注射给药、腹膜内给药、蛛网膜下腔内给药、或静脉给药。
[0256]
所述免疫细胞可以配制成通过动脉、静脉、皮下、皮内、瘤内、淋巴管内、淋巴结内、蛛网膜下腔内、骨髓内、肌肉内或腹膜内给药。
[0257]
优选地,所述治疗剂由所述第一组合物和所述第二组合物组成。
[0258]
本领域的技术人员可以理解,本发明的治疗剂还可包含合适的可药用的辅料,包括药用或生理载体、赋形剂、稀释剂(包括生理盐水、pbs溶液)、以及各种添加剂,包括糖类、脂类、多肽、氨基酸、抗氧化剂、佐剂、保鲜剂等。
[0259]
本发明还提供了一种用于治疗肿瘤和/或癌症的具有协同作用的联合药物的药盒,包括:
[0260]
第一容器,该第一容器装有根据本发明所述的治疗剂中的第一组合物;
[0261]
第二容器,该第二容器装有根据本发明所述的治疗剂中的第二组合物,其中所述第一容器和所述第二容器是独立的;以及
[0262]
载明给药时机和给药方式的说明书。
[0263]
本发明还提供了本发明所述的溶瘤腺病毒在制备用于治疗肿瘤和/或癌症的药物中的用途。
[0264]
在一些实施方案中,所述溶瘤腺病毒的所述外源基因选自hla蛋白编码序列,标记性多肽编码序列,hla蛋白编码序列及标记性多肽编码序列,hla蛋白编码序列及β2-微球蛋白编码序列,或hla蛋白编码序列、β2-微球蛋白编码序列及标记性多肽编码序列。
[0265]
所述肿瘤和/或癌症包括:乳腺癌,头颈部肿瘤,滑膜癌,肾癌,结缔组织癌,黑色素瘤,肺癌,食管癌,结肠癌,直肠癌,脑癌,肝癌,骨癌,绒毛膜癌,胃泌素瘤,嗜铬细胞瘤,催乳
素瘤,von hippel-lindau病,zollinger-ellison综合征,肛门癌,胆管癌,膀胱癌,输尿管癌,神经胶质瘤,神经母细胞瘤,脑膜瘤,脊髓肿瘤,骨软骨瘤,软骨肉瘤,尤文氏肉瘤,原发部位不明癌,类癌,纤维肉瘤,佩吉特病,宫颈癌,胆囊癌,眼癌,卡波西氏肉瘤,前列腺癌,睾丸癌,皮肤鳞状细胞癌,间皮瘤,多尖端骨髓瘤,卵巢癌,胰腺内分泌瘤,胰高血糖素瘤,胰腺癌,阴茎癌,垂体癌,软组织肉瘤,视网膜母细胞瘤,小肠癌,胃癌,胸腺癌,滋养细胞癌,葡萄胎,子宫内膜癌,阴道癌,外阴癌,蕈样真菌病,胰岛素瘤,心脏癌,脑膜癌,血液癌,腹膜癌和胸膜癌。
[0266]
本发明还提供了本发明所述的治疗剂在制备用于治疗肿瘤和/或癌症的药物中的用途。
[0267]
所述肿瘤和/或癌症包括:乳腺癌,头颈部肿瘤,滑膜癌,肾癌,结缔组织癌,黑色素瘤,肺癌,食管癌,结肠癌,直肠癌,脑癌,肝癌,骨癌,绒毛膜癌,胃泌素瘤,嗜铬细胞瘤,催乳素瘤,von hippel-lindau病,zollinger-ellison综合征,肛门癌,胆管癌,膀胱癌,输尿管癌,神经胶质瘤,神经母细胞瘤,脑膜瘤,脊髓肿瘤,骨软骨瘤,软骨肉瘤,尤文氏肉瘤,原发部位不明癌,类癌,纤维肉瘤,佩吉特病,宫颈癌,胆囊癌,眼癌,卡波西氏肉瘤,前列腺癌,睾丸癌,皮肤鳞状细胞癌,间皮瘤,多尖端骨髓瘤,卵巢癌,胰腺内分泌瘤,胰高血糖素瘤,胰腺癌,阴茎癌,垂体癌,软组织肉瘤,视网膜母细胞瘤,小肠癌,胃癌,胸腺癌,滋养细胞癌,葡萄胎,子宫内膜癌,阴道癌,外阴癌,蕈样真菌病,胰岛素瘤,心脏癌,脑膜癌,血液癌,腹膜癌和胸膜癌。
[0268]
本发明还提供了本发明所述的药盒在制备用于治疗肿瘤和/或癌症的药物中的用途。
[0269]
所述肿瘤和/或癌症包括:乳腺癌,头颈部肿瘤,滑膜癌,肾癌,结缔组织癌,黑色素瘤,肺癌,食管癌,结肠癌,直肠癌,脑癌,肝癌,骨癌,绒毛膜癌,胃泌素瘤,嗜铬细胞瘤,催乳素瘤,von hippel-lindau病,zollinger-ellison综合征,肛门癌,胆管癌,膀胱癌,输尿管癌,神经胶质瘤,神经母细胞瘤,脑膜瘤,脊髓肿瘤,骨软骨瘤,软骨肉瘤,尤文氏肉瘤,原发部位不明癌,类癌,纤维肉瘤,佩吉特病,宫颈癌,胆囊癌,眼癌,卡波西氏肉瘤,前列腺癌,睾丸癌,皮肤鳞状细胞癌,间皮瘤,多尖端骨髓瘤,卵巢癌,胰腺内分泌瘤,胰高血糖素瘤,胰腺癌,阴茎癌,垂体癌,软组织肉瘤,视网膜母细胞瘤,小肠癌,胃癌,胸腺癌,滋养细胞癌,葡萄胎,子宫内膜癌,阴道癌,外阴癌,蕈样真菌病,胰岛素瘤,心脏癌,脑膜癌,血液癌,腹膜癌和胸膜癌。
[0270]
本发明还提供了一种治疗肿瘤和/或癌症的方法,包括对肿瘤和/或癌症患者施用根据本发明所述的溶瘤腺病毒。
[0271]
优选地,所述溶瘤腺病毒的所述外源基因选自hla蛋白编码序列,标记性多肽编码序列,hla蛋白编码序列及标记性多肽编码序列,hla蛋白编码序列及β2-微球蛋白编码序列,或hla蛋白编码序列、β2-微球蛋白编码序列及标记性多肽编码序列。
[0272]
所述肿瘤和/或癌症包括:乳腺癌,头颈部肿瘤,滑膜癌,肾癌,结缔组织癌,黑色素瘤,肺癌,食管癌,结肠癌,直肠癌,脑癌,肝癌,骨癌,绒毛膜癌,胃泌素瘤,嗜铬细胞瘤,催乳素瘤,von hippel-lindau病,zollinger-ellison综合征,肛门癌,胆管癌,膀胱癌,输尿管癌,神经胶质瘤,神经母细胞瘤,脑膜瘤,脊髓肿瘤,骨软骨瘤,软骨肉瘤,尤文氏肉瘤,原发部位不明癌,类癌,纤维肉瘤,佩吉特病,宫颈癌,胆囊癌,眼癌,卡波西氏肉瘤,前列腺癌,睾
丸癌,皮肤鳞状细胞癌,间皮瘤,多尖端骨髓瘤,卵巢癌,胰腺内分泌瘤,胰高血糖素瘤,胰腺癌,阴茎癌,垂体癌,软组织肉瘤,视网膜母细胞瘤,小肠癌,胃癌,胸腺癌,滋养细胞癌,葡萄胎,子宫内膜癌,阴道癌,外阴癌,蕈样真菌病,胰岛素瘤,心脏癌,脑膜癌,血液癌,腹膜癌和胸膜癌。
[0273]
优选地,所述肿瘤和/或癌症可表达提供抗原表位多肽的内源性肿瘤抗原,同时可表达提呈该抗原表位多肽的内源性hla-i类分子。
[0274]
所述溶瘤腺病毒的施用剂量为治疗有效量。优选地,所述溶瘤腺病毒的施用剂量为5
×
10
7-5
×
10
12
vp/天,每天1-2次,连续施用1-7天。
[0275]
所述溶瘤腺病毒可以配制成通过瘤内注射给药、腹膜内给药、蛛网膜下腔内给药、或静脉给药。
[0276]
本发明还提供了一种治疗肿瘤和/或癌症的方法,包括:
[0277]
对肿瘤和/或癌症患者施用根据本发明所述的治疗剂中的第一组合物;和
[0278]
对所述肿瘤和/或癌症患者施用根据本发明所述的治疗剂中的第二组合物。
[0279]
所述治疗剂中的第一组合物和第二组合物可以同时(例如,作为混合物同时瘤内注射)、分开但同时(例如,分别通过瘤内和静脉注射给药)或依次施用(例如,首先施用第一组合物,然后施用第二组合物;或者首先施用第二组合物,然后施用第一组合物)。
[0280]
优选地,所述方法包括以下依次进行的步骤:
[0281]
1)对所述肿瘤和/或癌症患者首先施用所述第一组合物;和
[0282]
2)在施用所述第一组合物之后,对所述肿瘤和/或癌症患者施用所述的治疗剂中的第二组合物。
[0283]
优选地,在首先施用所述第一组合物之后的第1-30天,对所述肿瘤和/或癌症患者施用所述的治疗剂中的第二组合物。
[0284]“在首先施用所述第一组合物之后的第1-30天,对所述肿瘤和/或癌症患者施用所述的治疗剂中的第二组合物”是指首次第二组合物的施用与首次第一组合物施用的时间间隔为1-30天(例如,1,2,3、4、5、6、7、8、9、10、11、12、13、14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30天),或首次第二组合物的施用与在其之前最相邻一次的所述第一组合物施用的时间间隔为1-30天(例如,1,2,3、4、5、6、7、8、9、10、11、12、13、14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30天)。优选地,首次第二组合物的施用与在其之前最相邻一次的所述第一组合物施用的时间间隔为3-14天(例如,3、4、5、6、7、8、9、10、11、12、13、14天)。
[0285]
在本发明的一个优选实施方案中,第一组合物包含所述溶瘤腺病毒,所述溶瘤腺病毒的施用剂量为5
×
10
7-5
×
10
12
vp/天,每天1-2次,连续施用1-7天,或上述范围间的任何值。
[0286]
在本发明的一个优选实施方案中,所述t细胞受体修饰的免疫细胞的施用剂量为,每个疗程总剂量范围为1
×
10
3-1
×
109个细胞/kg体重。优选地,1天施用1-3次,连续施用1-7天。
[0287]
在某些实施方案中,所述治疗肿瘤和/或癌症的方法还包括对患者施用其它用于治疗肿瘤和/或癌症的药物,和/或用于调节患者免疫系统的药物,以增强所述t细胞受体修饰的免疫细胞在体内的数量和功能。所述其它用于治疗肿瘤和/或癌症的药物包括但不限
于:化疗药物,例如环磷酰胺、氟达拉滨(fludarabine);放疗药物;免疫抑制剂,例如环孢素、硫唑嘌呤、甲氨蝶呤、麦考酚酯(mycophenolate)、fk50;抗体,例如抗cd3、il-2、il-6、il-17、tnfα的抗体。
[0288]
在某些实施方案中,所述治疗肿瘤和/或癌症的方法还包括对患者施用其它用于治疗肿瘤和/或癌症的药物,和/或用于调节患者免疫系统的药物,用于当所述t细胞受体修饰的免疫细胞产生严重毒副作用时,清除携带自杀基因的所述t细胞受体修饰的免疫细胞在体内的数量和功能。所述其它用于治疗肿瘤和/或癌症的药物包括但不限于:化学诱导二聚化(cid)药物、ap1903、磷酸化更昔洛韦(ganciclovir)、抗cd20抗体、抗cmyc抗体、抗egfr抗体。
[0289]
所述溶瘤腺病毒可以配制成通过瘤内注射给药、腹膜内给药、蛛网膜下腔内给药、或静脉给药。
[0290]
所述t细胞受体修饰的免疫细胞可以配制成通过动脉、静脉、皮下、皮内、瘤内、淋巴管内、淋巴结内、蛛网膜下腔内、骨髓内、肌肉内或腹膜内给药。
[0291]
所述肿瘤和/或癌症包括:乳腺癌,头颈部肿瘤,滑膜癌,肾癌,结缔组织癌,黑色素瘤,肺癌,食管癌,结肠癌,直肠癌,脑癌,肝癌,骨癌,绒毛膜癌,胃泌素瘤,嗜铬细胞瘤,催乳素瘤,von hippel-lindau病,zollinger-ellison综合征,肛门癌,胆管癌,膀胱癌,输尿管癌,神经胶质瘤,神经母细胞瘤,脑膜瘤,脊髓肿瘤,骨软骨瘤,软骨肉瘤,尤文氏肉瘤,原发部位不明癌,类癌,纤维肉瘤,佩吉特病,宫颈癌,胆囊癌,眼癌,卡波西氏肉瘤,前列腺癌,睾丸癌,皮肤鳞状细胞癌,间皮瘤,多尖端骨髓瘤,卵巢癌,胰腺内分泌瘤,胰高血糖素瘤,胰腺癌,阴茎癌,垂体癌,软组织肉瘤,视网膜母细胞瘤,小肠癌,胃癌,胸腺癌,滋养细胞癌,葡萄胎,子宫内膜癌,阴道癌,外阴癌,蕈样真菌病,胰岛素瘤,心脏癌,脑膜癌,血液癌,腹膜癌和胸膜癌。
[0292]
优选地,在所述溶瘤腺病毒表达hla蛋白、和表达hla蛋白及β2-微球蛋白的情况中,适用于本发明的治疗剂的肿瘤和/或癌症应表达提供抗原表位多肽的内源性肿瘤抗原,表达或不表达能提呈该抗原表位多肽的内源性hla蛋白。
[0293]
优选地,在所述溶瘤腺病毒表达标记性多肽的情况中,适用于本发明的治疗剂的肿瘤和/或癌症应表达能提呈所述标记性多肽中的抗原表位多肽的内源性hla蛋白,表达或不表达能提供该抗原表位多肽的内源性肿瘤抗原。
[0294]
优选地,在所述溶瘤腺病毒表达hla蛋白及标记性多肽的情况中,以及在所述溶瘤腺病毒表达hla蛋白、β2-微球蛋白及标记性多肽的情况中,适用于本发明的治疗剂的肿瘤和/或癌症表达或不表达提供抗原表位多肽的内源性肿瘤抗原均可,并且表达或不表达能提呈该抗原表位多肽的内源性hla蛋白均可。
[0295]
可以根据肿瘤和/或癌症患者的自身实际情况,为患者提供本发明范围内的方法。
[0296]
为了选择适用于上述溶瘤腺病毒、治疗剂和药盒治疗的患者,可以在使用上述治疗前对患者进行hla-i分型和肿瘤抗原表达检测。
[0297]
检测hla-i类分子的配型可采用现有技术,例如,血清学配型、pcr-ssp(序列特异性priming pcr)、pcr-ssop(序列特异性寡核苷酸探针)、pcr-rflp(限制性片段长度多态性)、pcr-sbt(基于测序的分型)、pcr-rsca(参考链介导的构像分析)、以及基于下一代测序(ngs)的hla分型。
[0298]
检测肿瘤抗原表达可采用现有技术,例如,检测特定肿瘤抗原的基因过度表达的qpcr和fish(荧光原位杂交)等、检测特定肿瘤抗原的蛋白过度表达的免疫组化、流式细胞等检测手段。检测是否携带含特定点突变的肿瘤新抗原主要通过基于下一代测序(ngs)技术,包括全基因组测序和/或rna测序,通过对比肿瘤组织和对应正常组织的序列获得somatic变体,以确定肿瘤是否携带和表达含有特定突变点的新抗原(frnt.immunol 2019,(24);10:1392)。
[0299]
以下通过例子的方式进一步解释或说明本发明的内容,但这些例子不应被理解为对本发明的保护范围的限制。
[0300]
例子
[0301]
除非特别说明,否则以下例子中所用实验方法均使用生物工程领域的常规实验流程、操作、材料和条件进行。例如,重组质粒和病毒载体,或多肽和蛋白质可以使用标准重组方法(green and sambrook,分子克隆:实验室手册,第4版,冷泉港出版社,冷泉港,ny,2012)使用本文所述的核酸重组产生。
[0302]
以下除非特别说明,否则各试剂的百分浓度(%)均指该试剂的体积百分浓度(%(v/v))。
[0303]
实施例1-4所用材料和方法如下:
[0304]
1.细胞系:
[0305]
用于制备慢病毒颗粒或用作靶细胞的细胞系是293t细胞(atcc crl-3216)。用于呈递抗原肽的呈递细胞系是t2细胞(174xcem.t2,atcc crl-1992)。用于tcr基因表达和功能分析的细胞系是jrt细胞(j.rt3-t3.5,tib-153)。用作靶细胞的肿瘤细胞系包括:人黑素瘤细胞系a375(atcc crl-1619),人纤维肉瘤细胞系ht1080(atcc ccl-121),人卵巢癌细胞系skov3(atcc htb-77),人肺癌细胞系h1299(atcc crl-5803),人骨肉瘤细胞系hos-c1(atcc crl-1547),人肺癌细胞系a549(atcc ccl-185)。采用常规方法由pcdna3.3质粒(thermo fisher k830001)构建得到编码ny-eso-1蛋白的质粒pcdna3.3-ny或编码kras g12d蛋白的质粒pcdna3.3-kras/g12d,分别转染skov3细胞,并用500μg/ml遗传霉素(thermo fisher 10131027)进行选择,可以生成表达ny-eso-1蛋白或具有g12d点突变的kras突变蛋白的skov3细胞系。ny-eso-1(或ctag-1b)是一种众所周知的癌-睾丸抗原(cta),在多种癌症类型中均过表达。下文描述了制备pcdna3.3-ny的方法。
[0306]
2.细胞培养基:
[0307]
293t细胞在补充有10%胎牛血清,2mm l-谷氨酰胺的高葡萄糖(vwr目录号vwrl0101-0500)的dulbecco改良eagle培养基(dmem)中培养。其他细胞系在补充胎牛血清(atcc 30-2020),2mmol/l l-谷氨酸,1
×
必需氨基酸50
×
(invitrogen 11130-051),1
×
链霉素/青霉素100
×
(invitrogen 15140-122),1
×
丙酮酸钠100
×
(invitrogen 11360-070)和1
×
2-巯基乙醇1000
×
(thermo fisher 21985023)的rpmi-1640完全培养基(lonza,目录号12-115f)中培养。
[0308]
3.外周血:
[0309]
健康供体的人外周血产物来自斯坦福血液中心。根据制造商的说明,使用ficoll-paque plus密度梯度介质(ge healthcare17144002)通过提取法(lrs小室,产品代码a1012)从残留的白细胞中产生外周血单核细胞(pbmc)。
[0310]
4.表达外源蛋白的靶细胞的制备:
[0311]
根据制造商的说明,用lipofectamine 3000(thermo fisher l3000015)转染293t细胞或肿瘤细胞。表达质粒包括编码所述标记性多肽,外源hla蛋白或本技术中描述的氨基酸序列的质粒。制备质粒的方法描述如下。如果将含有腺病毒基因组的质粒用于转染293t细胞,则用paci酶(new england biolabs,r0547s)预先消化该质粒,以释放腺病毒基因组。转染后48-72小时,瞬时表达外源蛋白的细胞可用作靶细胞。为了产生表达ny-eso-1蛋白或具有g12d点突变的突变kras蛋白的稳定skov3细胞系,在用编码相应蛋白质的质粒转染后72小时,将skov3细胞与补充500μg/ml遗传素的培养基一起培养。
[0312]
5.表达重组tcr的t细胞的制备:
[0313]
为了产生表达tcr的活化的人t细胞,将24孔板中的pbmc细胞与补充有2μg/ml抗人cd3抗体(biolegend 317303)和2μg/ml抗人cd28抗体(biolegend 302914)的rpmi-1640完全培养基一起培养,持续24小时,或根据制造商的说明书用人t-cd3/cd8磁珠(thermo fisher 11131d)处理pbmc。24小时后,将细胞用补充有il-2 100iu/ml,il-7 5ng/ml,il-15 5ng/ml的rpmi-1640完全培养基培养。为了产生用于表达tcr的t细胞系,将来自jurkat细胞系的β链缺陷突变体jrt(j.rt3-t3.5)细胞与rpmi-1640完全培养基一起培养。为了用编码所述tcr的慢病毒感染t细胞,将活化的pbmc或jrt细胞用1ml新鲜制备的慢病毒上清液重悬于24孔板中,并在25℃下加入polybrene(santa cruz biotechnology sc-134220)。最终浓度为5
–
8μg/ml。将细胞在1000g和32℃下离心2小时。6小时后,将培养基更换为补充有il-2 100iu/ml,il-7 5ng/ml,il-15 5ng/ml的rpmi-1640完全培养基。也可以根据制造商的说明,使用retronectin皿(retronectin预涂皿,35mmφ)(takara t110a)转染细胞。
[0314]
6.通过流式细胞术的细胞表型分析:
[0315]
为了分析用编码外源tcr的慢病毒转染的pbmc或jrt细胞表达tcr,将细胞重悬于含1%fbs的dpbs缓冲液(2.7mm kcl,1.5mm kh2po4、136.9mm nacl,8.9mm na2hpo4·
7h2o,ph 7.4)中,并用apc标记的抗人cd8抗体(biolegend 300912)和itag四聚体/pe-hla-a*02:01ny-eso-1(sllmwitqc)(mbl international tb-m011-1)染色。流式细胞仪为macsquant analyzer 10(miltenyi biotec corporation),并且通过flowjo软件(flowjo corporation)分析结果。为了分析转染了编码hla-a2蛋白的质粒的293t细胞的hla-a2表达,将细胞用fitc抗人hla-a2抗体(biolegend 343303)染色并通过流式细胞术进行分析。
[0316]
7.t细胞功能分析:
[0317]
为了评估由jrt细胞表达的tcr的特异性和功能,根据本领域的方法,通过流式细胞术评估抗原刺激后的cd69表达(参见文献“cytometry.1996;26(4):305-10”)。简而言之,在96孔板的重复孔中,将tcr基因修饰的jrt细胞与靶细胞共培养16小时,例如,与以不同浓度的抗原肽浓度加载处理的t2细胞、用本技术中描述的核酸转导的293t细胞或肿瘤混合培养。将细胞用抗cd69抗体(biolegend310905)染色,并根据制造商的说明通过流式细胞仪分析cd69
jrt细胞的频率。为了评估转导到pbmc中的tcr的特异性和功能,通过ifn-γelisa(酶联免疫吸附测定)测量了抗原刺激后特定t细胞的ifn-γ分泌。简而言之,在96孔板的一式两份或一式三份的孔中,将tcr基因修饰的pbmc与上述靶细胞共培养。在18-24小时内收集细胞上清液,以使用ifn-gamma elisa read-set-go试剂盒(ebioscience 88-7316)或人ifn-gamma duoset elisa试剂盒(r&d systems dy285b)根据制造商的说明进行ifn-γ
elisa分析。
[0318]
8.重组tcr慢病毒载体的制备:
[0319]
将所述tcr基因克隆到复制缺陷型慢病毒载体pcdh-ef1α-mcs-pgk-gfp(system biosciences cd811a-1)中。通过去除载体pcdh-ef1α-mcs-pgk-gfp上的pgk启动子和gfp基因,产生了没有gfp的载体pcdh-ef1α-mcs。根据在专利申请公开us8143376b2、wo2018099402a1或参考文献“j immunol 2010;184(9),4936-46”中描述的序列确定在hla-a*02:01背景下对ny-eso-1 157-165表位肽特异的tcr-α-v-d-j区域和tcr-β-v-d-j区域的序列(对于us8143376b2表示为tcr-ny-ly,对于wo2018099402a1表示为tcr-ny-li,对于参考文献j immunol 2010;184(9),4936-46表示为tcr-ny-ae)。在hla-c*08:02的背景下,对kras:g12d 10-18肽具有特异性的tcr-α-v-d-j区和tcr-β-v-d-j区的序列是根据专利申请公开wo2018026691(表示为tcr-ras g12d)确定的。根据参考序列(分别为genebank ku254562和ef154514.1)确定小鼠tcr-α恒定链和小鼠tcr-β恒定链的序列。针对ny-eso-1 157-165的tcr-ny-ly、tcr-ny-ae和tcr-ny-li的核酸序列,针对kras:g12d 10-18的tcr-ras-g12d的核酸序列(分别包含具有小鼠tcr-β恒定链的tcrβ链、具有小鼠tcr-α恒定链的tcrα链、编码furin蛋白酶切割肽的接头核酸、以及tcrα和β链之间的f2a肽的核酸)分别显示在seq id no.18、19、20或21中,并且由integrated dna technologies或lifesct llc合成。根据制造商的说明,将合成的核酸克隆到慢病毒载体pcdh-ef1α-mcs-pgk-gfp或pcdh-ef1α-mcs(不含gfp)的ef-1α启动子下游的多克隆位点。表达针对ny-eso-1 157-165表位的tcr的慢病毒载体称为pcdh-ef1α-tcr-ny。对插入的核酸进行测序,未发现错误和突变。将慢病毒载体质粒转化到感受态细菌stellar(takara bio,636763)中,以制备用于制备慢病毒颗粒的质粒储备液。
[0320]
9.重组tcr慢病毒颗粒的制备:
[0321]
tcr慢病毒颗粒是由293t或293ft细胞(thermo fisher r70007)产生的,所述细胞被含有所述tcr基因的慢病毒载体质粒转染。简而言之,按照制造商的说明,使用lipofectaine 3000转染试剂(invitrogen,11668019),用tcr慢病毒载体质粒和ppackh1-lentivector包装试剂盒(system biosciences lv500a-1)共转染6孔板中生长的293t或293ft细胞。培养48小时后,收集上清液并通过0.4μm滤膜过滤。根据制造商的说明,用lenti-x
tm
浓缩器(takara,631231)浓缩病毒上清液。新鲜制得的tcr-慢病毒用于感染jrt细胞或活化的pbmc。
[0322]
10.编码ny-eso-1蛋白或突变体kras g12d蛋白的表达载体的制备:
[0323]
将根据制造商的说明,使用purelink
tm
rna mini试剂盒(thermo fisher 12183020)从ht1080细胞(ny-eso-1 ,kras野生型)中纯化的总rna用作使用primescript
tm
rt-pcr试剂盒(takara rr014a)产生rt-pcr产物的模板。ny-eso-1全长基因是通过以下pcr引物对产生的:5'-tatataagagcagagctgccaccatgcaggccgaaggccggggca-3'(seq id no.22)和5'-tgattgtcgacgcccttagcgcctctgccctgagggaggctg-3'(seq id no.23)。kras g12d全长基因是通过以下pcr引物对产生的:5'-atgactgaatataaacttgtggtagttggagctgacggcgtaggcaagagtgccttg-3'(seq id no.24)和5'-tgattgtcgacgcccttacataattacacactttgtctttgacttc-3'(seq id no.25)。根据制造商的说明,将所得基因克隆到pcdna3.3载体(thermo fisher k830001)的topo克隆位点。根据制造商的说明,使用
high-fidelity 2x pcr master mix(new england biolabs m0541l)进行本技术中描述的pcr。
[0324]
11.编码所述标记性多肽和/或外源hla i类分子的复制缺陷型重组腺病毒质粒的制备:
[0325]
本技术中描述的复制缺陷型重组腺病毒系统基于adeasy系统(nature protocols 2007;2:1236-1247)。ef1α启动子的核酸通过以下pcr引物对从pcdh-ef1α-mcs-pgk-gfp质粒(system biosciences,cd811a-1)中克隆,引物对为:5'-ctcatagcgcgtaatggctccggtgcccgtcagtgggcag-3'(seq id no.26)和5'-gaattcgctagctctagatcacgacacctgaaatggaag-3’(seq id no.27),并且将其整合到pshuttle-cmv载体(agilent technologies,目录号24007)中以取代cmv启动子以产生pshuttle-ef1α载体。编码全长hla-a*02:01的cdna(如seq id no.28中所示)和编码人β2-微球蛋白的cdna由t2细胞产生,并根据制造商的说明克隆到pcdna3.3-topo载体中。seq id no.29所示的编码包含3个抗原表位肽ny-eso-1 157-165的标记性多肽的核酸和seq id no.30所示的编码接头肽的核酸由integrated dna technologies合成。为了制备如seq id no.31所示的编码将hla-a*201蛋白与接头肽连接的标记性多肽的核酸,进行如下步骤:使用合成的编码标记性多肽的核酸作为模板,用引物对5'-agagctagcgaattcaacatgaaaggttccatcttcac-3'(seq id no.32)和5'-acactgtgtaatccacatcaatagcgatctctttc-3'(seq id no.33)进行pcr,以产生编码带有ny-eso-1 157-165的标记性多肽的核酸片段(表示为ny);使用合成的编码接头肽的核酸作为模板,以以下引物对进行pcr:5'-tggattacacagtgtcgtcgtaagcgatccggaagcgcg-3'(seq id no.34)和5'-cgccatgacggccatgggcccagggttggactcgacgtc-3'(seq id no.35),以生成编码接头肽的核酸;然后使用编码全长hla-a*02:01的cdna对5'-atggccgtcatggcgccccga-3'(seq id no.36)和5'-tcacactttacaagctgtgagagacac-3'(seq id no.37)引物进行pcr生成hla-a*201基因(称为a2)。混合以上纯化的pcr产物作为模板,以使用以下引物对进行pcr:5'-atgaaaggttccatcttcacattgtttttgttc-3'(seq id no.38)和5'-cgccatgacggccatgggcccagggttggactcgacgtc-3'(seq id no.39),以生成编码将hla-a*201蛋白与接头肽连接的标记性多肽的核酸。用本领域常规基因克隆技术将所得核酸克隆到pshuttle-ef1α载体的多克隆位点,以产生pshuttle-ef1α-ny-a2。
[0326]
12.重组腺病毒质粒的制备
[0327]
pshuttle载体用pmei(neb biolabs,r0560s)线性化。纯化后,按照生产商的说明在bio-rad gene浓度加载发生器电穿孔仪中以2500v,200ω和25μf的频率输送浓度加载,将载体转入具有电活性的bj5183-ad-1细菌菌株(agilent technologies,200157)。用paci(neb biolabs r0547s)限制性消化以筛选潜在的腺病毒重组体。正确的重组体通常会产生一个较大的片段(约30kb),和一个3.0或4.5kb的较小片段。
[0328]
13.编码所述标记性多肽和/或外源性hla i类分子的有条件复制能力的腺病毒质粒的制备:
[0329]
为了产生pshuttle载体,其包含由外源启动子驱动的腺病毒e1a基因和由天然e1b启动子驱动的编码与所述标记性多肽结合的hla分子或与β2-微球蛋白结合的hla分子的核酸的pshuttle载体,进行如下程序:由integrated dna technologies合成如seq id no.2所示的序列,其中包含天然e1b启动子序列和编码含有24个碱基对缺失(e1a122-129缺失)
的e1a-13s蛋白核酸序列(具有e1a polya添加位点的天然e1a polya信号序列)。以合成的基因序列作为模板,使用以下引物对进行pcr:5'-atgagacatattatctgccacggag-3'(seq id no.46)和5'-catggtggcgaggtcagatgtaac-3'(seq id no.47),获得包含具有24个碱基对缺失的e1a-13s核酸序列和天然e1b启动子序列的基因片段(表示为e1ad24)。使用编码全长hla-a*02:01的cdna或编码人β-2微球蛋白的cdna作为模板进行pcr(此时引入kozak序列),获得了hla-a*02:01基因片段(表示为a2)和β-2微球蛋白基因片段(表示为bm)。合成的突变hla-c*08:02基因如seq id no.49所示(表示为c08),合成的核酸编码包含3个ny-eso-1 157-165表位肽的标记性多肽,如seq id no.29所示(表示为ny),或编码包含3个kras:g12d 10-18表位肽的标记性多肽,如seq id no.50所示(表示为ras),或合成的核酸编码接头肽,如seq id no.30(表示为f2a),将其用作模板以进行pcr以获取相应的基因片段(将突变hla-c*08:02基因用作模板进行pcr时引入kozak序列)。根据制造商的说明,使用in-fusion hd cloning plus试剂盒(takara 638909)生成包含e1ad24-a2-f2a-ny,e1ad24-c08-f2a-ras,e1ad24-a2-f2a-bm和e1ad24-c08-f2a-bm的核酸片段的组合。将所得基因组合克隆到pshuttle-ef1α载体中ef1α启动子的下游,以生成pshuttle-ef1α-e1ad24-a2-f2a-ny,pshuttle-ef1α-e1ad24-c08-f2a-ras,pshuttle-ef1α-e1ad24-c08-f2a-bm和pshuttle-ef1α-e1ad24-a2-f2a-bm。为了产生重组腺病毒质粒,如上所述,通过在bio-rad gene浓度加载电穿孔仪中以2500v,200ω和25μf的频率输送浓度加载,将pshuttle载体用pmei线性化并转入具有电活性的bj5183-ad-1。所得重组溶瘤腺病毒质粒表示为pad-ef1α-e1ad24-a2-f2a-ny,pad-ef1α-e1ad24-c08-f2a-ras,pad-ef1α-e1ad24-c08-f2a-bm,和pad-ef1α-e1ad24-a2-f2a-bm。
[0330]
14.编码所述标记性多肽和/或外源hla i类分子的重组腺病毒的制备:
[0331]
将采用上述方法得到的复制缺陷型重组腺病毒质粒和有条件复制能力的重组溶瘤腺病毒质粒,通过本方法制备得到相应的重组腺病毒。
[0332]
用pac i(neb biolabs r0547s)消化重组腺病毒质粒以释放腺病毒基因组dna。线性化的质粒通过苯酚/氯仿提取进行纯化,并根据制造商的说明用lipofectaine 3000转染试剂(thermo fisher l3000001)转染adeno-x 293细胞(takara 632271)。转染的细胞在37℃,5%co2的培养箱中保持14
–
20天,直到观察到细胞病变效应(cpe)。进行四个冻融涡旋循环以从细胞中释放腺病毒并获得病毒颗粒。通常需要两到四轮扩增才能生成大规模制备的高滴度病毒。制备大规模腺病毒的程序遵循参考文献中所述的方法(nat protoc 2007;2(5),1236-47)。腺病毒滴度由adeno-x gostix试剂盒(takara 632270)根据制造商的说明确定。为了用重组腺病毒感染靶细胞,基于确定的moi(感染复数,指每个细胞感染的病毒颗粒的数量)确定病毒滴度的数量和靶细胞的数量。通常,感染后3-4天可以检测到外源基因的表达。
[0333]
实施例5-9和制备例1所用材料和方法如下:
[0334]
人卵巢癌细胞株skov3、人肺癌细胞株h1299、人骨肉瘤细胞株hos c1购自atcc;
[0335]
人黑素瘤细胞株a375购自中国科学院细胞库;
[0336]
人ifn-gamma elisa试剂盒购自r&d公司;
[0337]
xcelligence rtca s16实时无标记细胞功能分析仪购自acea bio公司;
[0338]
apc结合的抗人hla-a2的抗体购自bd公司,pe结合的抗人cd3的抗体购自bd公司;
[0339]
dynabeads
tm
human t-activator cd3/cd28购自thermofisher公司;
[0340]
hril-2购自金丝利公司,hril-7和hril-15购自近岸蛋白公司;
[0341]
流式细胞仪novocyte购自acea bio公司。
[0342]
实施例1
[0343]
该实施例证明,外源基因可以通过本技术中描述的基因构建体有效表达,所述构建体包括包含编码所述标记性多肽和/或外源hla i类分子的核酸的腺病毒载体;以及包括编码t细胞受体的核酸的慢病毒载体。图1a示出了本技术中描述的构建体的示意图。padeasy-ef1α-ny-a2是复制缺陷型腺病毒载体,表达如seq id no.51所示的所述标记性多肽,其中包含3个furin蛋白酶切位点所联接的ny-eso-1 157-165表位肽,以及如seq id no.12所示的hla-a2蛋白。标记性多肽和hla-a2基因之间有f2a序列所连接。所述标记性多肽的表达单元的两侧是外源ef-1α启动子和sv40 poly(a)信号序列。pad-ef1α-e1a-a2-f2a-ny是有复制能力的腺病毒载体,其包含编码hla-a2基因和3个ny-eso-1 157-165表位肽的所述标记性多肽的核酸。pad-ef1α-e1a-a2-f2a-bm是具有复制能力的腺病毒载体,其包含编码hla-a2基因和人β2-微球蛋白的核酸。pad-ef1α-e1ad24-a2-f2a-ny和pad-ef1α-e1ad24-a2-f2a-bm构建体均包含编码e1-13s突变蛋白的核酸(即转录e1a 13s mrna的e1a的cdna序列),该e1a蛋白含有24个残基的缺失,如seq id no.43所示。所述e1a-13s基因两侧为分别为外源ef-1α启动子和天然e1a poly(a)信号序列。在这两个有复制能力的构建体中,删除了e1b基因区域,并插入所述编码标记性多肽和其他外源基因的核酸到该区域中,并利用天然e1b调控元件,包括天然e1b启动子和e1b/ix poly(a)信号,驱动外源基因的表达。图1b为慢病毒载体pcdh-ef1α-tcr-ny-ly,pcdh-ef1α-tcr-ny-ae和pcdh-ef1α-tcr-ny-li的示意图,其中包含编码各ny-eso-1特异性tcrβ链和α链多肽的核酸(所述多肽分别如seq id no.52、53、54所示)。tcrβ链和α链的恒定区均被鼠tcr恒定区序列取代。tcrβ链和α链用多肽furin蛋白酶切点和f2a联接序列所联接,其两端是ef-1α启动子和慢病毒转录后调控元件(wpre)。
[0344]
为了评估重组构建体是否可以表达外源基因,用包含表达单元的pshuttle-ef1α-ny-a2,pshuttle-ef1α-e1ad24-a2-f2a-ny或pshuttle-ef1α-e1ad24-a2-f2a-bm(它们的两侧分别是与5型腺病毒同源的基因组序列)转染hla-a2阴性293t细胞。用抗hla-a2抗体对细胞染色,并通过流式细胞术评估hla-a2的表达。图1c显示,用包含hla-a2基因的所有三种构建体转染的293t细胞可以表达hla-a2,表明构建体中的调控元件具有驱动外源蛋白表达的功能,并且通过furin蛋白酶和f2a联接序,hla-a2蛋白可以被分离出来并表达在细胞表面。pshuttle-ef1α-ny-a2转导的293t细胞中hla-a2表达的荧光强度低于pshuttle-ef1α-e1ad24-a2-f2a-ny和pshuttle-ef1α-e1ad24-a2-f2a-bm转导的293t细胞的荧光强度,表明天然e1b启动子和e1b poly(a)信号可能在腺病毒基因组的背景下更有效地驱动外源基因的表达。
[0345]
为了评估所构建的重组慢病毒载体是否表达tcr,通过pcdh-ef1α-tcr-ny载体转染的293t细胞制备表达ny-eso-1特异性tcr的慢病毒颗粒,并用于感染j.rt3-t3.5细胞(jrt细胞,atcc tib153)。感染的jrt细胞用抗cd8抗体和ny-eso-1 157-165/hla-a2四聚体染色,该四聚体可以特异性结合可特异性识别被hla-a2提呈的ny-eso-1 157-165表位多肽的tcr。图1d显示用慢病毒转染的jrt细胞表达能够结合ny-eso-1 157-165/hla-a2四聚体
的不同tcr,这表明重组慢病毒表达由tcrα和β链组成的特异性tcr。α和β链通过包含的鼠恒定区配对以形成tcr/cd3复合物并在jrt细胞的表面表达。
[0346]
实施例2
[0347]
该实施例证明,所述构建体载体一旦表达标记性多肽和外源hla i类蛋白,抗原表位肽便可以从标记性多肽中释放并由外源hla i类分子呈递,形成抗原肽/hla i类复合物,该复合物可被特异性tcr识别。
[0348]
为了评估jrt细胞所表达的特异性tcr识别由外源hla i类分子提呈的抗原表位肽的能力,首先用重组慢病毒转染jrt细胞,所述重组慢病毒由共转染pcdh-ef1α-tcr-ny-ly,pcdh-ef1α-tcr-ny-ae或pcdh-ef1α-tcr-ny-li和上述包装载体的293t细胞产生。将表达特异性tcr的jrt细胞与hla-a2阳性的t2细胞共培养,在培养孔中加入从1μg/ml开始的10倍稀释系列的ny-eso-1 157-165多肽。抗原刺激16-24小时后,通过流式细胞术分析cd69阳性的jrt细胞的百分比。图2a显示,表达特异性tcr的jrt细胞在用抗原肽刺激后表达cd69,表明jrt细胞被hla-a2呈递的ny-eso-1 157-165肽所激活,其活性表现出抗原剂量依赖的关系。另外,也显示出不同tcr对ny-eso-1 157-165抗原表位识别敏感性的差异,tcr-ny-ly和tcr-ny-ae识别活性相似,但tcr-ny-li对ny-eso-1 157-165抗原表位多肽的敏感性低约10倍。
[0349]
用ny-eso-1 157-165抗原多肽特异性tcr转染的jrt细胞作为效应细胞,用pshuttle-ef1a-ny-a2或pshuttle-ef1a-e1ad24-a2-ny转染hla-a2阴性和ny-eso-1阴性的293t细胞作为靶细胞,用空的pshuttle载体转导的293t细胞用作对照靶细胞,以评估转染表达标记性多肽和外源hla-a2的载体的靶细胞是否在靶细胞表面表达被特异性t细胞所识别的抗原表位多肽。图2b显示pshuttle-ef1a-ny-a2或pshuttle-ef1a-e1ad24-a2-ny转染的293t细胞均可激活表达不同的ny-eso-1 157-165多肽特异性tcr的jrt细胞。与用空的pshuttle载体转导的对照靶293t相比,针对表达上述标记性多肽和hla-a2的293t靶细胞,cd69 jrt细胞的百分比显着增加(学生t检验,p《0.01)。结果显示标记性多肽和外源hla-a2在293t细胞中分别表达,并形成可被特异性tcr所识别的hla—a2/ny-eso-1 157-165多肽复合物。在表达tcr-ny-ly和tcr-ny-ae的jrt细胞为效应细胞的组中,与pshuttle-ef1α-ny-a2转染的靶细胞相比,用pshuttle-ef1α-e1ad24-a2-f2a-ny转染的靶细胞能够诱导出更多的cd69 jrt细胞(学生t检验,p《0.05)。此结果与pshuttle-ef1α-e1ad24-a2-f2a-ny转染293t细胞后hla-a2的高表达相一致,这表明腺病毒基因组dna中,天然的e1b启动子和e1b poly(a)信号可以有效地驱动外源基因的表达。
[0350]
为了评估所述构建体表达的外源hla i类分子提呈来自内源性抗原蛋白的抗原表位肽的功能,将293t细胞共转染pcdna3.3-ny和pshuttle-ef1a-e1a d 24-a2-f2a-bm,并用作靶细胞。pcdna3.3-ny编码全长ny-eso-1蛋白,使293t细胞表达ny-eso-1蛋白作为内源性肿瘤抗原,从而产生ny-eso-1 157-165表位肽。如果ny-eso-1蛋白可以通过hla i类抗原加工途径提供ny-eso-1 157-165表位多肽,并被外源性hla-a2所提呈,则靶细胞可以被表达特异性tcr的jrt细胞所识别。用只转染pcdna3.3-ny或pshuttle-ef1a-e1ad24-a2-f2a-bm的293t细胞为阴性对照。图2c显示,单独用pshuttle-ef1a-e1a 24-a2-f2a-bm转导的293t细胞不能激活表达ny-eso-1特异性tcr的jrt细胞。然而,当靶细胞被1μg/ml浓度的ny-eso-1 157-165表位多肽加载处理时,可以诱导大量表达各种tcr的jrt细胞表达cd69,这表明外
源性hla-a2在靶细胞中表达,并可呈递抗原多肽以激活t细胞。此外,与阴性对照靶细胞相比,当靶细胞同时表达ny-eso-1蛋白和hla-a2分子时,表达ny-eso-1特异性tcr的jrt细胞混合培养物,可以诱导出更多的cd69 jrt细胞(学生t检验,p《0.05)。结果表明,ny-eso-1 157-165表位多肽可以通过内源性hla i类加工机制产生,并由外源性hla-a2提呈后被特异性tcr所识别。因此,将外源性hla i类分子作为同种异体hla(allo-hla)引入肿瘤细胞,以提呈来自内源性蛋白的抗原表位肽是可行的。所述产生抗原表位多肽的内源性蛋白可以是过度表达的肿瘤相关抗原或由突变蛋白产生的肿瘤新生抗原(neo-antigen)。
[0351]
为了进一步评估在重组腺病毒基因组dna框架内编码标记性多肽和/或hla i类分子的核酸是否可以表达外源多肽和蛋白质,腺病毒载体pad-ef1a-e1ad24-a2-ny用paci消化,以获得重组腺病毒基因组dna,包含外源的编码hla-a2蛋白和具有ny-eso-1 157-165表位多肽的标记性多肽的核酸。pad-ef1a-e1a d 24-a2-bm也用paci消化,以获得表达外源hla-a2和β2-微球蛋白的腺病毒基因组dna。用腺病毒dna转染293t细胞,48小时后用作靶细胞,以刺激表达ny-eso-1特异性tcr的jrt细胞。图2d显示pad-ef1a-e1ad24-a2-bm在293t细胞中表达外源hla-a2,并且不仅能够提呈以1μg/ml浓度所加载的ny-eso-1 157-165表位多肽,而且还能够提呈来自ny-eso-1蛋白的ny-eso-1 157-165表位多肽。与仅转染pad-ef1a-e1ad24-a2-bm的对照靶细胞相比,cd69 jrt细胞的百分比显著增加(学生t检验,p《0.01)。转染pad-ef1a-e1ad24-a2-ny的腺病毒dna的293t细胞同时表达带有ny-eso-1 157-165表位的标记性多肽和外源性hla-a2,也可以激活表达ny-eso-1特异性tcr的jrt细胞。与同时转染pcdna3.3-ny/pad-ef1a-e1ad24-a2-bm的靶细胞相比,转染pad-ef1a-e1ad24-a2-ny的靶细胞活化jrt-tcr-ny-ly细胞的能力相似。尽管更多的jrt-tcr-ny-ae细胞被pad-ef1a-e1ad24-a2-ny的靶细胞所激活,但两组之间没有显著性差异。这些结果表明,如果在靶细胞中的hla i类抗原加工和呈递机制和功能完整,则抗原表位肽可以由内源性蛋白质所产生,被所述载体引入靶细胞的外源hla i类分子有效呈递,并被特异性t细胞所识别。外源hla i类分子可以是自体hla(auto-hla)也可以是异体hla(allo-hla)
[0352]
实施例3
[0353]
该实施例证实了当用含有编码所述标记性多肽和hla i类蛋白的核酸的基因构建体转导肿瘤细胞时,抗原表位肽可由肿瘤细胞中的外源hla i类分子呈递。无论肿瘤细胞是否表达特定的肿瘤抗原或具有提呈特定抗原表位多肽的hla i类等位基因,表达所述标记性多肽和外源hla i类分子可以使肿瘤细胞成为被特异性t细胞识别的靶细胞。此外,表达外源的异体hla i类蛋白,不仅可以增加肿瘤细胞的免疫原性,还可以提呈来自内源性肿瘤抗原的抗原表位肽,并激活hla限制的抗原表位多肽特异性的tcr。
[0354]
a375是人黑素瘤细胞系,代表hla-a2
和ny-eso-1
肿瘤细胞。skov3是人类卵巢癌细胞系,代表hla-a2-和ny-eso-1-双阴性肿瘤细胞。转导pcdna3.3-ny并稳定表达ny-eso-1蛋白的skov3细胞代表hla-a2阴性和ny-eso-1阳性肿瘤细胞。用pshuttle-ef1a-e1ad24-a2-ny或pshuttle-ef1a-e1ad24-a2-bm转染这些肿瘤细胞,用作靶细胞,与表达ny-eso-1特异性tcr的jrt细胞共培养。
[0355]
图3显示jrt-tcr-ny-ly和jrt-tcr-ny-ae均可被a375细胞激活,这表明可由内源性ny-eso-1蛋白产生ny-eso-1 157-165表位肽,并由其自身的hla-a2分子所提呈。尽管用pshuttle-ef1a-e1ad24-a2-bm转染的a375细胞表达的hla-a2较多,但不能显著提高该细胞
d24-a2-bm的a375和skov3-ny细胞均可以被表达特异性tcr的t细胞所识别。而skov3细胞只有转染同时表达hla-a2分子和ny-eso-1 157-165表位肽的pshuttle-ef1a-e1ad24-a2-ny时才能被表达特异性tcr的t细胞所识别。结果证实,所述表达含抗原表位肽的标记性多肽以及外源hla i类分子的溶瘤病毒载体不仅可以使肿瘤细胞被表达特异性tcr的jrt细胞所识别,还可以被表达特异性tcr的原代t细胞所识别。
[0360]
为了评估是否可以通过用编码所述标记性多肽和/或外源hla i类分子的核酸转导其他类型的肿瘤细胞,人肺癌细胞系h1299(ny-eso-1
/hla-a2-),人骨肉瘤细胞系hos-c1(ny-eso-1低/hla-a2
)和人肺癌细胞系a549(ny-eso-1-/hla-a2-)用pshuttle-ny-a2载体转导并用作靶细胞。用表达tcr-ny-ly或tcr-ny-li的重组慢病毒转染的pbmc作为效应细胞。空白对照效应细胞是用空的慢病毒转染的pbmc。将效应细胞或空白对照细胞与靶细胞以e:t=5:1的比例孵育24小时。用elisa检测上清液中ifn-γ的分泌。如图4c所示,与用空白对照t细胞的对照组相比,表达tcr-ny-ly或tcr-ny-li的特异性t细胞产生了大量的ifn-γ(学生t检验,p《0.01),表明所测试的肿瘤细胞都能够被表达含ny-eso-1 157-165抗原表位肽的标记性多肽和外源性hla-a2蛋白所标记并被表达ny-eso-1特异性tcr的t细胞所识别。
[0361]
实施例5:重组溶瘤腺病毒oad-ny/a2感染skov3细胞后hla-a2的表达
[0362]
下文所述重组溶瘤腺病毒“oad-ny/a2”均是根据前述方法,将质粒pad-ef1α-e1ad24-a2-f2a-ny包装得到的重组溶瘤腺病毒。
[0363]
本实施例验证了重组溶瘤腺病毒oad-ny/a2感染肿瘤细胞后,细胞表面可以表达hla-a2。第0天,按照5
×
104个skov3细胞/孔接种24孔板。第1天,分别按照5、10、20、50、100moi向skov3细胞中加入重组溶瘤腺病毒oad-ny/a2。继续培养48小时后,收获细胞。用apc偶联的抗人hla-a2抗体(bd公司)(1:50稀释)进行染色,使用流式细胞仪novocyte(购自acea bio公司)检测细胞表面hla-a2的表达。
[0364]
结果如图5所示,可成功地检测到hla-a2的表达,并且随着moi的增加,hla-a2的表达比例也增加。
[0365]
制备例1:mock-t和靶向ny-eso-1的tcr-t细胞的制备
[0366]
t细胞培养液为aim v 5%fbs 100iu/ml hril-2 10ng/ml hril-7 10ng/ml hril-15。第0天,复苏人pbmc(得自杭州康万达医药科技有限公司),按照5
×
105个细胞/ml将pbmc接种至24孔板的一个孔中,1ml/孔,按照t:珠子=1:1加入dynabeads。活化6小时后,按照moi=5加入gfp慢病毒或tcr-ny-ae慢病毒,分别用于制备下述实施例中的mock-t和靶向ny-eso-1的tcr-t细胞。第3天,更换全部培养基,按照5
×
10
5-1
×
106个细胞/ml调整细胞密度。之后每隔1-2天,补液,按照5
×
10
5-1
×
106个细胞/ml调整细胞密度。培养到第10天,收获全部细胞,计数,通过流式细胞术检测mock-t以及tcr-t细胞中gfp的表达比例,利用pe结合的抗人cd3抗体检测mock-t以及tcr-t细胞中cd3的表达比例。
[0367]
实施例6:靶向ny-eso-1的tcr-t与重组溶瘤腺病毒oad-ny/a2感染标记的肿瘤细胞共培养后细胞因子的分泌
[0368]
本实施例通过elisa检测了靶向ny-eso-1的tcr-t细胞与重组溶瘤腺病毒oad-ny/a2感染标记的肿瘤细胞共培养过夜后,ifnγ的分泌。检测的肿瘤细胞株包括人黑素瘤细胞株a375,人肺癌细胞株h1299,人卵巢癌细胞株skov3,人骨肉瘤细胞株hosc1。第0天,按照1
×
105个肿瘤细胞/孔接种12孔板。第1天,向相应的肿瘤细胞中加入80μl的重组溶瘤腺病毒oad-ny/a2。第2天,用胰蛋白酶将肿瘤细胞以及重组溶瘤腺病毒oad-ny/a2感染标记的肿瘤细胞消化计数,按照1
×
105个肿瘤细胞/孔接种于96孔板。将靶向ny-eso-1的tcr-t细胞或mock-t细胞(表达gfp,作为tcr-t的阴性对照组)按照3
×
105个/孔接种于96孔板相应的孔中,上述效应细胞与靶标细胞的个数比例(e:t)为3:1,每组3个复孔。共培养过夜后,用人ifn-γduoset elisa(购自r&d公司)检测培养上清中ifnγ的含量。
[0369]
如图6a所示,由于a375细胞是ny-eso-1阳性和hla-a2阳性,与阴性对照组的mock-t(图中显示为a375 mock-t)相比,靶向ny-eso-1的tcr-t细胞(图中显示为a375 tcr-t)受到a375刺激后,可以分泌ifnγ。重组溶瘤腺病毒oad-ny/a2感染a375不会引起ifnγ的分泌。如果将t细胞与重组溶瘤腺病毒oad-ny/a2感染的a375细胞共培养,受到oad-ny/a2感染标记的a375刺激后,与阴性对照组的mock-t(图中显示为a375 mock-t oad-ny/a2)相比,靶向ny-eso-1的tcr-t细胞(图中显示为a375 tcr-t oad-ny/a2)可以分泌更多的ifnγ。如图6b所示,由于h1299细胞是ny-eso-1阳性和hla-a2阴性,与阴性对照组的mock-t(图中显示为h1299 mock-t)相比,靶向ny-eso-1的tcr-t细胞(图中显示为h1299 tcr-t)受到h1299刺激后,没有分泌ifnγ。重组溶瘤腺病毒oad-ny/a2感染h1299也不会引起ifnγ的分泌。如果将t细胞与重组溶瘤腺病毒oad-ny/a2感染的h1299细胞共培养,受到oad-ny/a2感染标记的h1299刺激后,与阴性对照组的mock-t(图中显示为h1299 mock-t oad-ny/a2)相比,靶向ny-eso-1的tcr-t细胞(图中显示为h1299 tcr-t oad-ny/a2)可以分泌更多的ifnγ。如图6c所示,由于skov3细胞是ny-eso-1阴性和hla-a2阴性,与阴性对照组的mock-t(图中显示为skov3 mock-t)相比,靶向ny-eso-1的tcr-t细胞(图中显示为skov3 tcr-t)受到skov3刺激后,没有分泌ifnγ。重组溶瘤腺病毒oad-ny/a2感染skov3也不会引起ifnγ的分泌。如果将t细胞与重组溶瘤腺病毒oad-ny/a2感染的skov3细胞共培养,受到oad-ny/a2感染标记的skov3刺激后,与阴性对照组的mock-t(图中显示为skov3 mock-t oad-ny/a2)相比,靶向ny-eso-1的tcr-t细胞(图中显示为skov3 tcr-t oad-ny/a2)可以分泌更多的ifnγ。如图6d所示,由于hosc1细胞是ny-eso-1弱阳性和hla-a2阳性,与阴性对照组的mock-t(图中显示为hosc1 mock-t)相比,靶向ny-eso-1的tcr-t细胞(图中显示为hosc1 tcr-t)受到hosc1刺激后,tcr-t分泌少量的ifnγ。重组溶瘤腺病毒oad-ny/a2感染hosc1也不会引起ifnγ的分泌。如果将t细胞与重组溶瘤腺病毒oad-ny/a2感染的hosc1细胞共培养,受到oad-ny/a2感染标记的hosc1刺激后,与阴性对照组的mock-t(图中显示为hosc1 mock-t oad-ny/a2)相比,靶向ny-eso-1的tcr-t细胞(图中显示为hosc1 tcr-t oad-ny/a2)可以分泌更多的ifnγ。
[0370]
靶向ny-eso-1的tcr识别的是靶细胞表面hla-a2及其呈递的ny-eso-1短肽分子。如果肿瘤细胞本身是hla-a2阳性以及ny-eso-1阳性,重组溶瘤腺病毒oad-ny/a2感染标记后,可以在一定程度上提高靶向ny-eso-1的tcr-t对靶细胞的识别。如果肿瘤细胞本身是hla-a2阴性或ny-eso-1阴性或双阴性,重组溶瘤腺病毒oad-ny/a2感染标记肿瘤细胞后,可以使原本的tcr-t无法识别靶细胞变成可以识别并对肿瘤细胞发起攻击。
[0371]
实施例7:重组溶瘤腺病毒oad-ny/a2与靶向ny-eso-1的tcr-t对skov3的体外联合杀伤
[0372]
本实施例通过rtca实时杀伤监测的方法检测了重组溶瘤腺病毒oad-ny/a2与靶向
ny-eso-1的tcr-t细胞对人卵巢癌细胞株skov3的体外联合杀伤效果。第0天,按照5
×
103个肿瘤细胞/孔接种至16孔e-plate中。第1天,向相应的孔中加入重组溶瘤腺病毒oad-ny/a2,moi为10。第2天,向相应的孔中按5
×
103个t细胞/孔加入靶向ny-eso-1的tcr-t细胞或mock-t细胞(表达gfp,作为tcr-t的阴性对照组),每组2个复孔。通过xcelligence rtca s16实时无标记细胞功能分析仪监测skov3细胞的生长。
[0373]
如图7a所示,skov3细胞接种后持续生长(图中显示为skov3),只加入重组溶瘤腺病毒oad-ny/a2没有影响skov3细胞的生长(图中显示为skov3 oad-ny/a2),只加入靶向ny-eso-1的tcr-t细胞或mock-t细胞对skov3细胞的生长有微弱的影响(图中显示为skov3 mock-t或skov3 tcr-t)。重组溶瘤腺病毒oad-ny/a2和mock-t联合作用(图中显示为skov3 oad-ny/a2 mock-t)可以减缓skov3细胞的生长,而重组溶瘤腺病毒oad-ny/a2和靶向ny-eso-1的tcr-t细胞联合作用(图中显示为skov3 oad-ny/a2 tcr-t)对skov3细胞体现出非常显著的杀伤作用,使skov3细胞数量显著减少。对实验终点90.8个小时的细胞生长指数进行分析,计算肿瘤生长抑制率(ir%),公式为:100%
×
(实验组细胞指数-skov3细胞指数)/skov3细胞指数(细胞指数(cell index)由rtca仪得到)。结果如图7b所示,重组溶瘤腺病毒、mock-t或tcr-t单独作用,仅对skov3细胞的生长产生了微弱的抑制作用,重组溶瘤腺病毒和mock-t联合作用对skov3细胞的生长产生了更大的抑制作用,而重组溶瘤腺病毒和tcr-t联合作用组可以显著减少skov3细胞的数量,其杀伤的效果大于重组溶瘤腺病毒和tcr-t单独作用的效果的叠加,因此产生了协同杀伤的效果。
[0374]
实施例8:重组溶瘤腺病毒oad-ny/a2与靶向ny-eso-1的tcr-t对h1299的体外联合杀伤
[0375]
本实施例通过rtca实时杀伤监测的方法检测了重组溶瘤腺病毒oad-ny/a2与靶向ny-eso-1的tcr-t细胞对人肺癌细胞株h1299的体外联合杀伤效果。第0天,按照5
×
103个肿瘤细胞/孔接种至16孔e-plate中。第1天,向相应的孔中加入重组溶瘤腺病毒oad-ny/a2,moi为10。第2天,向相应的孔中按1
×
104个t细胞/孔加入靶向ny-eso-1的tcr-t细胞或mock-t细胞(表达gfp,作为tcr-t的阴性对照组),每组2个复孔。通过xcelligence rtca s16实时无标记细胞功能分析仪监测h1299细胞的生长。
[0376]
如图8a所示,h1299细胞接种后持续生长(图中显示为h1299),只加入重组溶瘤腺病毒oad-ny/a2几乎没有影响h1299细胞的生长(图中显示为h1299 oad-ny/a2),只加入靶向ny-eso-1的tcr-t细胞或mock-t细胞对h1299细胞的生长有显著的影响(图中显示为h1299 mock-t或h1299 tcr-t)。重组溶瘤腺病毒oad-ny/a2和mock-t联合作用(图中显示为h1299 oad-ny/a2 mock-t)可以有效的杀伤h1299细胞,而重组溶瘤腺病毒oad-ny/a2和靶向ny-eso-1的tcr-t细胞联合作用(图中显示为h1299 oad-ny/a2 tcr-t)对h1299细胞体现出非常显著的杀伤作用,使h1299细胞数量更加显著减少。对实验节点61.14个小时的细胞生长指数进行分析,计算肿瘤生长抑制率(ir%),公式为:100%
×
(实验组细胞指数-h1299细胞指数)/h1299细胞指数。结果如图8b所示,重组溶瘤腺病毒、mock-t或tcr-t单独作用,仅对h1299细胞的生长产生了一定的抑制作用,重组溶瘤腺病毒和mock-t联合作用可以减少h1299细胞的数量,而重组溶瘤腺病毒和tcr-t联合作用组可以显著减少h1299细胞数量,其杀伤的效果大于重组溶瘤腺病毒和tcr-t单独作用的效果的叠加,因此产生了协同杀伤的效果。
[0377]
实施例9:重组溶瘤腺病毒oad-ny/a2与靶向ny-eso-1的tcr-t对hosc1的体外联合杀伤
[0378]
本实施例通过rtca实时杀伤监测的方法检测了重组溶瘤腺病毒oad-ny/a2与靶向ny-eso-1的tcr-t细胞对人骨肉瘤细胞株hos c1的体外联合杀伤效果。第0天,按照5
×
103个肿瘤细胞/孔接种至16孔e-plate中。第1天,向相应的孔中加入重组溶瘤腺病毒oad-ny/a2,moi为30。第2天,向相应的孔中按1.5
×
104个t细胞/孔加入靶向ny-eso-1的tcr-t细胞或mock-t细胞(表达gfp,作为tcr-t的阴性对照组),每组2个复孔。通过xcelligence rtca s16实时无标记细胞功能分析仪监测hos c1细胞的生长。
[0379]
如图9a所示,hos c1细胞接种后持续生长(图中显示为hos c1),只加入重组溶瘤腺病毒oad-ny/a2微弱地影响hos c1细胞的生长(图中显示为hos c1 oad-ny/a2),只加入靶向ny-eso-1的tcr-t细胞或mock-t细胞对hos c1细胞的生长也有一定的抑制(图中显示为hos c1 mock-t或hos c1 tcr-t)。重组溶瘤腺病毒oad-ny/a2和mock-t联合作用(图中显示为hos c1 oad-ny/a2 mock-t)可以使hos c1的细胞数量减少,而重组溶瘤腺病毒oad-ny/a2和靶向ny-eso-1的tcr-t细胞联合作用(图中显示为hos c1 oad-ny/a2 tcr-t)对hos c1细胞体现出非常显著的杀伤作用,使hos c1细胞数量显著减少。对实验终点61.14个小时的细胞生长指数进行分析,计算肿瘤生长抑制率,公式为:100%
×
(实验组细胞指数-hos c1细胞指数)/hos c1细胞指数(ir%)。结果如图9b所示,重组溶瘤腺病毒、mock-t或tcr-t单独作用,仅对hos c1细胞的生长产生了微弱的抑制作用,重组溶瘤腺病毒和mock-t联合作用可以微弱的减少hos c1的细胞数量,而重组溶瘤腺病毒和tcr-t联合作用组可以显著减少hos c1细胞的数量,其杀伤的效果大于重组溶瘤腺病毒和tcr-t单独作用的效果的叠加,因此产生了协同杀伤的效果。
[0380]
结论
[0381]
一旦将编码所述外源抗原表位肽或hla i类蛋白的核酸通过载体(载体可以是质粒载体,重组病毒,纳米颗粒或裸露的dna或rna)递送入肿瘤细胞,所述包含抗原表位肽和/或外源hla i类分子的标记性多肽即可以使肿瘤细胞被表达特异性tcr的t细胞所识别。如本技术中所建议的,用于治疗实体瘤的联合疗法可以使过继t细胞疗法的应用范围得到扩展,通常可能不被纳入试验的患者,例如其hla类型不匹配(尽管其肿瘤细胞表达特定的肿瘤抗原)的患者也可接受治疗而获益。理论上,无论肿瘤细胞的hla i类的配型和肿瘤细胞中的抗原表达水平如何,将编码包含抗原表位的标记性多肽和可以呈递该抗原表位肽的hla i类分子的核酸递送入肿瘤细胞中,并使其被过继转输的特异性t细胞所识别,可以成为一种治疗各种实体肿瘤的通用方法。然而,如果正常细胞也被标记性核酸所标记并成为过继转输t细胞的靶标,就可能会产生脱靶毒副作用。如果递送载体可以在肿瘤细胞中选择性地表达标记性表位多肽或外源hla分子,例如使用如本技术中所建议的具有肿瘤细胞选择性复制能力的溶瘤病毒,则该风险可以避免或可控。另外,针对肿瘤细胞中常发生的抗原加工和呈递机制的缺陷,本发明所述的溶瘤病毒载体使肿瘤细胞直接表达所述包含抗原表位以及可以呈递抗原表位肽的hlai类分子的标记性多肽,并使之成为过继转输t细胞的靶标。另外,如本发明所建议的,将同种异体hla i类分子递送到携带最常见的肿瘤驱动基因突变(例如kras或p53突变)的肿瘤细胞中,使之提呈不能被内源性hla i类分子所提呈的肿瘤抗原新表位,并被过继转输的特异性t细胞所识别并清除。这种联合疗法是使更多癌症患
者受益的颇具前途的治疗方法。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。