一种mdm2抑制剂类小分子化合物及用途
技术领域
1.本发明属于医药技术领域,具体涉及一种mdm2抑制剂类小分子化合物及用途。
背景技术:
2.恶性肿瘤已成为严重危害人类健康的重大疾病之一,尽管对于恶性肿瘤的治疗已发展出如手术治疗、放疗、化疗、免疫疗法等多种治疗方法,在临床也取得不错的效果。但恶性肿瘤的死亡率仍居高不下,仅次于心脑血管疾病,仍需研发新型的治疗方法和药物。化疗药物在恶性肿瘤的治疗历史起到非常重要的作用,在很多国家,化疗药物仍然在临床肿瘤治疗药物中占有较高比例,但其存在了很多缺点如抑制肿瘤细胞生长的同时,也使得正常细胞的增殖收到影响,产生严重的副作用。因此,发展新的技术如靶向技术等降低传统化疗药物的毒副作用显得尤为重要。
3.mdm2蛋白在多种肿瘤高表达,与肿瘤的发生和发展息息相关。mdm2蛋白与抑癌基因p53蛋白形成负反馈调节,阻断p53-mdm2相互作用可以上调p53水平,导致肿瘤细胞凋亡,从而实现对肿瘤的靶向治疗。p53蛋白与mdm2蛋白相互作用是近年来研究较多的抗肿瘤靶标,针对该靶标研发多个小分子药物进入临床研究。然而由于p53-mdm2蛋白相互作用的特殊性,使得小分子抑制剂的开发具有较大的困难,目前仍未有该靶标的上市药物。
技术实现要素:
4.本发明的第一目的是提供一种mdm2抑制剂类小分子化合物。
5.本发明的第二目的是提供一种所述mdm2抑制剂类小分子化合物在制备抗肿瘤药物、抗炎药物中的应用。
6.为了实现上述目的,本发明采用的技术方案如下:
7.本发明的第一方面,提供了一种mdm2抑制剂类小分子化合物或其药用盐,结构如通式i所示:
8.x-y
9.i
10.x为p53-mdm2小分子抑制剂;
11.y为药物;
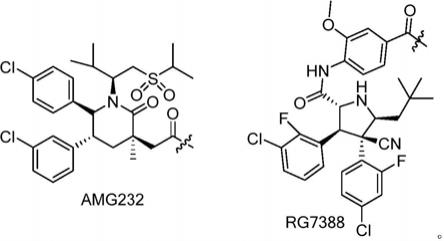
12.所述p53-mdm2小分子抑制剂选自:
[0013][0014]
所述y为能够调节或改变细胞功能的分子,包括药物活性化合物,这些药物可通过
活性基团如羟基、氨基等与x的羧基基团连接。所述药物活性化合物可为本领域已知药物或其衍生形式,所述药物为细胞毒性、提高肿瘤通透性、抑制肿瘤细胞增殖、促进细胞凋亡、降低细胞中抗凋亡活性、增强细胞坏死的药物。适用本发明的药物包括但不限于激素、抗生素、抗微生物药、抗病毒药、抗癌药。所述细胞毒性的药物例如:环丙基苯并[e]吲哚酮类似物或其衍生物、开环-环丙基苯并[e]吲哚酮类似物、o-ac-开环-环丙基苯并[e]吲哚酮类似物或其衍生物、dolastatins类、auristatin类、tubulysin类、combretastatin类、美登素类、dm1、埃博霉素类、紫杉醇及其衍生物、长春碱及其类似物、喜树碱及其类似物、秋水仙碱及其类似物、daunorubicin类、rhizomycin类、环磷酰胺、甲氨喋呤、博来霉素类、temsirolimus类、丝裂霉素类、微管抑制剂、吡咯并苯二氮杂卓(pyrrolobenzodiazepines,pbd)二聚体类、环丙基苯并[e]吲哚酮类、calicheamicin类、沙蟾毒精及其衍生物、蟾毒灵及其衍生物。其他可适用于本发明的药物包括大环内酯类抗肿瘤药物,化疗药如烷化剂氮芥、亚硝基脲、白消安、苯丙酸氮芥、卡铂、顺铂和其他铂类化合物,抗代谢药如阿糖胞苷、嘌呤类似物、嘧啶类似物及青霉素、头孢菌素、万古霉素、红霉素、克林霉素、利福平、氯霉素、氨基糖苷类抗生素和阿昔洛韦、三氟尿苷、更昔洛韦、齐多夫定、金刚烷胺、利巴韦林、吉西他滨和任何本领域认可的抗微生物化合物。
[0015]
进一步的,本发明所述y为temsirolimus类、开环-环丙基苯并[e]吲哚酮类似物、吡咯并苯二氮杂卓(pyrrolobenzodiazepines,pbd)二聚体类、calicheamicin类、喜树碱及其类似物、紫杉醇及其衍生物、长春碱及其类似物、dolastatins类、auristatin类、tubulysin类、combretastatin类、美登素类、dm1、埃博霉素类、丝裂霉素类、daunorubicin类化合物、沙蟾毒精及其衍生物或蟾毒灵及其衍生物。
[0016]
更进一步的,本发明所述y为开环-环丙基苯并[e]吲哚酮类似物、吡咯并苯二氮杂卓(pyrrolobenzodiazepines,pbd)二聚体类、calicheamicin类、喜树碱、7-乙基-10-羟基喜树碱(sn-38)、依喜替康(exatecan)及其衍生物、7-环己基-21-氟喜树碱、davlbh、tubulysin b、mmae、mmaf、mmaf衍生物、dm1、紫杉醇及其衍生物、埃博霉素b、丝裂霉素c、沙蟾毒精及其衍生物、蟾毒灵及其衍生物、长春新碱、柔红霉素、多柔比星或表柔比星。优选的,本发明所述y选自以下结构中的一种:
[0017][0018]
最优选的,所述mdm2抑制剂类小分子化合物的结构选自以下结构的一种:
[0019][0020]
本发明的mdm2抑制剂类小分子化合物可按照常规方法制备为药用盐的形式。
[0021]
本发明所述mdm2抑制剂类小分子化合物的药用盐,由药学上可接受的无机酸和有机酸所形成的盐,其中较优的无机酸包括:盐酸、氢溴酸、磷酸、硝酸、硫酸;较优的有机酸包括:甲酸、乙酸、丙酸、丁二酸、萘二磺酸(1,5)、亚细亚酸、甘珀酸、甘草次酸、齐墩果酸、山楂酸、熊果酸、科罗索酸、白桦酸、乳香酸、草酸、酒石酸、乳酸、水杨酸、苯甲酸、戊酸、二乙基乙酸、丙二酸、琥珀酸、富马酸、庚二酸、己二酸、马来酸、苹果酸、氨基磺酸、苯丙酸、葡糖酸、抗坏血酸、烟酸、异烟酸、甲磺酸、乙磺酸、对甲苯磺酸、柠檬酸、氨基酸。
[0022]
本发明的第二方面提供了一种所述mdm2抑制剂类小分子化合物或其药用盐在制备抗肿瘤药物、抗炎药物(rialdi a,et al,science,2016,352,6289;pan p,j med chem,2018,61,8613.)中的应用。
[0023]
本发明化合物的药理活性使其可以用于制备抗肿瘤、治疗心血管疾病、抗炎及抗神经系统疾病的药物(rialdi a,et al,science,2016,352,6289;pan p,j med chem,2018,61,8613.)。
[0024]
本发明的mdm2抑制剂类小分子化合物具有抗肿瘤活性,所述肿瘤包括食道、胃、肠、直肠、口腔、咽、喉、肺、结肠、乳腺、子宫、子宫内膜、卵巢、前列腺、睾丸、膀胱、肾、肝、胰
腺、骨、结缔组织、皮肤、眼、脑和中枢神经系统等部位发生的癌症,以及甲状腺癌、白血病、霍金氏病、淋巴瘤和骨髓瘤等;尤其是结肠癌、肺癌、乳腺癌、骨肉瘤。
[0025]
本发明的第三方面提供了一种药物组合物,包括所述mdm2抑制剂类小分子化合物或其药用盐,所述mdm2抑制剂类小分子化合物或其药用盐作为药物活性成分;或所述药物组合物还包括至少一种治疗剂,如化学治疗剂、免疫检查点抑制剂、炎症调节剂、抗高胆固醇血症剂、抗感染剂或放疗药物等(fang d.,et al.j immunother cancer,2019,7,327;yi h.et al.j exp clin cancer res,2018,37,97)。
[0026]
所述药物组合物可以是固体形式或是液体形式,还可用于制备下列药物:心脑血管疾病、炎症和神经系统疾病的治疗药物等(rialdi a,et al,science,2016,352,6289;pan p,j med chem,2018,61,8613.)。
[0027]
本发明的第四方面提供了一种药物制剂,包括所述mdm2抑制剂类小分子化合物或其药用盐。
[0028]
本发明所述mdm2抑制剂类小分子化合物可以和药剂学上的常规药用辅料制成药物制剂。
[0029]
所述药物制剂为:小容量注射剂、中容量注射剂、大容量注射剂、粉针注射剂、注射用乳剂、片剂、丸剂、胶囊剂、膏剂、霜剂、贴剂、搽剂、粉剂、喷雾剂、植入剂、滴剂、栓剂、软膏剂;各类纳米制剂;脂质体;相应的脂质体主要地制成以上所提及的注射剂。
[0030]
本发明的第五方面提供了一种所述mdm2抑制剂类小分子化合物或其药用盐作为mdm2抑制剂或topo i抑制剂的用途。
[0031]
由于采用上述技术方案,本发明具有以下优点和有益效果:
[0032]
本发明的化合物不仅具有抗肿瘤活性,而且可作为p53-mdm2小分子抑制剂,从而起到双重抗肿瘤作用。
附图说明
[0033]
图1是实施例2制备的化合物i-2的topo i抑制活性测试结果示意图(200μm)。
[0034]
图2是实施例2制备的化合物i-2对mdm2蛋白调节的蛋白免疫印迹试验结果示意图。
具体实施方式
[0035]
为了更清楚地说明本发明,下面结合优选实施例对本发明做进一步的说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
[0036]
实施例1
[0037]
化合物i-1的制备
[0038]
[0039]
将rg7388(20mg,平湖正远公司)、edci(19mg)和dmap(4mg)加入到5ml单口瓶中,然后加入3ml干燥的二氯甲烷搅拌15mins后成澄清溶液。加入紫杉醇(56mg)室温反应过夜。蒸去溶剂后柱色谱分离得21mg白色固体i-1(二氯甲烷:甲醇=100:2),收率为41.7%。1h nmr(300mhz,dmso-d6)δ:10.54(s,1h),9.30(d,j=9.5hz,1h),8.40(d,j=8.5hz,1h),7.95(d,j=7.3hz,2h),7.85(d,j=7.1hz,2h),7.78
–
7.64(m,3h),7.63
–
7.43(m,10h),7.38(dd,j=12.4,9.0hz,3h),7.25(t,j=7.1hz,1h),6.31(s,1h),5.84(dd,j=18.1,9.2hz,2h),5.46(dd,j=20.5,8.0hz,2h),4.94(t,j=7.3hz,2h),4.70(s,1h),4.61(d,j=7.7hz,2h),4.41(s,1h),4.01(dd,j=33.3,23.6hz,4h),3.78(s,3h),3.62(d,j=7.1hz,1h),2.29(s,3h),2.10(s,3h),1.98(d,j=13.8hz,1h),1.85(s,3h),1.73
–
1.58(m,3h),1.51(s,3h),1.37
–
1.24(m,6h),1.09
–
0.91(m,13h).esi hrms calcd c
78h78
cl2f2n4o
17
[m h]
m/z,1451.4707;found 1451.4780.
[0040]
实施例2
[0041]
化合物i-2的制备
[0042][0043]
参考实施例1的方法,以7-乙基-10-羟基喜树碱代替紫杉醇,得26mg白色固体i-2,收率为37.8%。1h nmr(600mhz,dmso-d6)δ:10.61(s,1h),8.52(d,1h,j=8.4hz),8.26(d,1h,j=9.0hz),8.20(s,1h),7.89(d,1h,j=8.4hz),7.82(m,2h),7.76(t,1h,j=14.4hz),7.60(d,1h,j=12.6hz),7.56(t,1h,j=15.0hz),7.43(t,1h,j=16.8hz),7.37(m,3h),6.55(s,1h),5.45(m,2h),5.34(s,2h),4.66(m,2h),4.44(t,1h,j=20.4hz),4.02(d,4h,j=15.6hz),3.21(m,2h),1.89(m,2h),1.68(m,1h),1.31(m,4h)0.91(t,3h,j=14.4hz).
13
c nmr(150mhz,dmso)δ172.87,171.90,164.65,160.81,159.14,157.24,156.85,155.21,152.43,150.44,149.81,148.15,147.02,146.31,145.86,135.20,132.48,131.74,131.38,130.48,129.00,127.55,126.20,125.73,124.11,119.92,119.48,117.92,115.99,111.93,97.10,72.80,65.69,65.06,63.68,56.49,50.58,49.97,44.33,30.74,30.52,29.93,22.67,14.29,8.17.hrms(esi,positive)m/z calcd for c
53h47
cl2f2n5o8[m h]
:990.2848;found 990.2841.
[0044]
实施例3
[0045]
化合物i-3的制备
[0046][0047]
参考实施例1的方法,以蟾毒灵代替紫杉醇,得10mg白色固体i-3,收率为30.8%。
[0048]1h nmr(300mhz,dmso-d6)δ:10.51(s,1h),8.39(s,1h),7.94(s,1h),7.74(s,1h),7.69
–
7.50(m,4h),7.37(s,3h),7.19(s,1h),6.30(d,j=10.2hz,1h),5.28(d,j=29.4hz,2h),4.61(s,2h),4.42(s,1h),4.19(s,1h),3.94(s,4h),2.00(s,4h),1.70(d,j=43.0hz,9h),1.32(d,j=12.5hz,10h),0.98(s,9h),0.87(s,3h),0.61(s,3h).
[0049]
实施例4
[0050]
化合物i-4的制备
[0051][0052]
参考实施例1的方法,以多柔比星代替紫杉醇,得9mg橘红色固体i-4,收率为23.9%。
[0053]1h nmr(600mhz,dmso-d6)δ:14.06(s,1h),13.29(s,1h),10.39(s,1h),8.28(d,j=8.5hz,1h),7.93(d,j=12.0hz,3h),7.72(t,j=7.0hz,1h),7.65(d,j=9.6hz,1h),7.60
–
7.50(m,3h),7.46(d,j=8.4hz,1h),7.37(ddd,j=12.1,10.6,7.0hz,4h),5.51(s,1h),5.29(s,1h),4.99(s,1h),4.87(t,j=6.3hz,2h),4.58(dd,j=11.2,6.5hz,4h),4.36(s,1h),4.24(d,j=6.8hz,2h),4.02
–
3.87(m,7h),3.56(s,1h),3.00(q,j=17.9hz,2h),2.25(d,j=12.2hz,1h),2.19
–
2.05(m,2h),2.03
–
1.95(m,2h),1.34(d,j=9.1hz,3h),0.96(s,9h).esi hrms calcd c
58h56cl2
f2n4o
14
[m h]
m/z,1141.3138;found 1141.3207.
[0054]
实施例5
[0055]
本发明化合物的体外抗肿瘤活性试验
[0056]
对本发明实施例1~4制备的化合物进行了肿瘤细胞增殖抑制试验,试验方法采用cck-8法。
[0057]
细胞株hct116(人结肠癌细胞)、a549(人肺癌细胞)、mcf-7(人乳腺癌细胞)、sw1990(人胰腺癌细胞)和sjsa-1(人骨肉瘤细胞)购自上海美轩科技有限公司(来自atcc细胞库),由第二军医大学药物化学教研室冻存和传代。
[0058]
用dmso(merck)溶解样品(实施例1~4制备的化合物),配制成10mm的浓度,最后用dmem或mccoy's 5a 1640培养基三倍稀释成8个浓度梯度。
[0059]
细胞培养符合测试要求时收集细胞培养液,取10μl于细胞计数板上涂布均匀,然后在显微镜下进行计数3次,取平均值计算出细胞密度;取96孔板(corning,#3599),按6
×
103个/孔的细胞浓度,每孔各加200μl进行细胞接种,将接种后的96孔板置于37℃,含5%co2的细胞培养箱中培养24h。
[0060]
吸除旧培养基,每孔加入含起始浓度10μmol/l经3倍稀释的样品dmem或mccoy's 5a 1640培养基200μl,控制dmso的含量为1%,置三个副孔,pbs作为空白对照,置上述培养箱中孵育72h。
[0061]
将96孔板中的原有dmem或mccoy's 5a 1640培养基以及最后一排的pbs缓冲液吸出,加入配制好的cck-8溶液(90%的dmem或mccoy's 5a 1640培养基 10%的cck-8),置于孵育箱孵育,用biotek酶标仪读取吸光度值。细胞生长抑制率ic%=(空白对照孔od值-给
药孔od值)/空白对照孔od值
×
100%。根据各个浓度的ic%值,用graphpad软件进行线性回归,计算各化合物抑制细胞生长50%的药物浓度,即ic
50
。
[0062]
试验结果见表1和表2,其中,样品是指相应实施例中制备的化合物。
[0063]
表1化合物体外抗肿瘤活性
[0064][0065][0066]
表2化合物i-2体外抗肿瘤活性
[0067][0068]
以上实验结果表明,本发明的化合物具有良好的抗肿瘤活性,并且对肺癌、乳腺癌、结肠癌、胰腺癌以及骨肉瘤等细胞株均显示出优秀的活性,因此本发明化合物及其盐类可以用于制备抗肿瘤药物。
[0069]
实施例6
[0070]
本发明化合物i-2的体内抗肿瘤活性试验
[0071]
动物:balb/c裸鼠(spf级),雄性,18-20克。
[0072]
取生长良好的人结肠癌细胞hct116瘤块,无菌条件下切割成约3mm大小的均匀小块,用套管针每只小鼠右腋皮下接种一块。接种后第9天见瘤块体积平均约130mm3,根据肿瘤大小重新分组,淘汰肿瘤过大和过小的动物,每组肿瘤平均体积基本一致,开始按以下方案给药,给药体积为0.2ml/20g体重。自接种第9天起每周2次用数显电子卡尺测量肿瘤长径a(mm),及相垂直的肿瘤短径b(mm),肿瘤体积计算公式为:tv=ab2/2,相对肿瘤体积计算公式为:rtv=vt/vo,vo为分笼时(即d1)测量所得肿瘤体积,vt为每一次测量时的肿瘤体积。给药14天后处死动物,称体重,解剖取瘤块,称瘤重,结果判定根据以下公式:
[0073]
肿瘤抑制率(%)=(对照组平均rtv-给药组平均rtv)/对照组平均rtv
×
100%
[0074]
表3化合物i-2体内抗肿瘤活性
[0075]
[0076][0077]
以上实验结果表明,本发明的化合物无论静脉还是口服给药均具有良好的体内抗肿瘤活性。因此本发明化合物及其盐类可以用于制备抗肿瘤药物。
[0078]
实施例7
[0079]
本发明实施例2制备的化合物i-2的topo i抑制活性试验
[0080]
小牛胸腺dna topo i、负超螺旋dna质粒pbr322,均购自takara。凝胶扫描定量采用tanon 2500成像系统,hh-2恒温水浴锅。
[0081]
将实施例2制备的化合物用dmso(merck)溶解,配成10mmol/l的样品备用,根据测试所需浓度再用双蒸水进行稀释。
[0082]
实验操作:
[0083]
第一步,称取1.5g琼脂糖用tea配成1%的琼脂糖凝胶溶液置微波炉中,中火加热两次,每次15min。
[0084]
第二步,依次向1.5ml ep管中加入10μl水,2μl 0.1%bsa,小牛胸腺dna topo i 0.5u,0.5μl dna,所有测试药物及对照药物0.02μl,定容到20μl。
[0085]
第三步,将第一步配制的琼脂糖凝胶溶液趁热倒进电泳槽,同时,将齿梳插进琼脂糖凝胶溶液。将第二步的样品管置于37℃水浴中,加热30min。
[0086]
第四步,将3.5μl loading buffer加入上述第三步加热后的样品管中,吸取样品加入对应的齿槽中。
[0087]
第五步,110v电泳40-60min,用溴化乙锭(etbr)染色30min,凝胶成像系统观察电泳结果。
[0088]
实验结果如图1所示,图1是实施例2制备的化合物i-2的topo i抑制活性测试结果示意图(200μm)。图中,lane 1,supercoiled plasmid dna;lane 2,dna topo i;其他泳道分别是dna topo i 化合物。从图中可以看出,本发明的化合物具有良好的topo i抑制活性,化合物i-2在200μm时对topo i具有显著的抑制活性,因此本发明化合物及其盐类可以用于制备topo i抑制剂类药物。
[0089]
实施例8
[0090]
本发明实施例2制备的化合物i-2对mdm2蛋白调节的蛋白免疫印迹试验
[0091]
人结肠癌细胞(hct116)培养,待细胞生长至70-80%时,加药处理。药物处理不同时间后,0.25%胰酶消化,离心收集细胞,胞浆蛋白核蛋白裂解液4℃裂解提取胞浆蛋白及核蛋白。采用12%sds-page凝胶电泳,将蛋白转移到固相支持膜上(pvdf膜),封闭液室温封闭1-2h,tbst洗膜5min,洗3次。采用tbst稀释抗体,4℃孵育过夜,tbst洗膜5min,洗3次。然后用tbst稀释hrp标记的二抗,室温孵育1h,tbst洗膜5min,洗3次。暗室内采用ecl显色,x光片曝光成像。以gapdh为内参照,分析成像光片灰度值,并以control对照组为基准进行量
化。
[0092]
结果如图2所示,图2是化合物i-2对mdm2和p53蛋白的蛋白免疫印迹实验结果示意图。从图中可以看出,化合物能呈浓度梯度的上调p53蛋白,对mdm2蛋白也有一定的调节作用,表明化合物能抑制p53-mdm2蛋白相互作用,可作为p53-mdm2抑制剂。
[0093]
以上所述仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭露如上,然而并非用以限定本发明,任何熟悉本专利的技术人员在不脱离本发明技术方案范围内,当可利用上述提示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明方案的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。