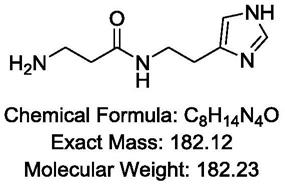
1.本发明属于免疫学领域,具体涉及一种全能核酸酶的单克隆抗体。本发明还涉及该单克隆抗体的制备方法及其用途。
背景技术:
2.supernuclease是一种来自于粘质沙雷氏菌(serratia marcescens),经基因工程改造的核酸内切酶。supernuclease可降解双链、单链、线状、环状的dna和rna,完全将核酸降解成3~5个碱基长度的5'-单磷酸寡核苷酸。因其能高效降解任何形式的dna和rna,又被称为“全能核酸酶”(sm2)。
3.全能核酸酶单体含有245个氨基酸残基,分子量为30kda,两个单体由两个二硫键连接成为具有活性的二聚体结构。全能核酸酶是一种核酸内切酶,它能高效降解任何形式(包括双链、单链、线状、环状)的dna和rna成为2~5个碱基的5’单磷酸核苷酸。全能核酸酶能有效降低蛋白样品粘度,去除蛋白样品中核酸的污染。在降低粘性的同时,也具有多种其他用途,如:减少了样品处理时间,增加了蛋白产量,离心时使沉淀和上清分离的更彻底,更便于溶液的离心(尤其是超滤);提高色谱纯化的效率等。
4.检测全能核酸酶的残留也是重要环节,因此,开发出一个高灵敏性、高特异性的检测抗全能核酸酶的单克隆抗体迫在眉睫。
技术实现要素:
5.本发明目的在于提供特异性结合全能核酸酶的分离的抗体或其抗原结合片段,用于检测全能核酸酶的残留。
6.本发明的第一方面,提供一种分离的抗体或其抗原结合片段,其包含:
7.(a)重链可变结构域(vh),所述重链可变结构域包含:
8.seq id no:1所示氨基酸序列的重链互补决定区1(hcdr1),seq id no:2所示氨基酸序列的hcdr2,和seq id no:3所示氨基酸序列的hcdr3;以及
9.(b)轻链可变结构域(vl),所述轻链可变结构域包含:
10.seq id no:4所示氨基酸序列的轻链互补决定区1(lcdr1),seq id no:5所示氨基酸序列的lcdr2,和seq id no:6所示氨基酸序列的lcdr3;
11.其中所述抗体或其抗原结合片段能够特异性地结合至全能核酸酶,优选的所述全能核酸酶包含seq id no:11所示氨基酸序列。
12.在一些实施方案中,所述的分离的抗体或其抗原结合片段,其中所述vh包含seq id no:7所示氨基酸序列,并且所述vl包含seq id no:8所示氨基酸序列。
13.在一些实施方案中,所述的分离的抗体或其抗原结合片段,所述分离的抗体或其抗原结合片段是啮齿动物的、嵌合的、人的、部分人源化的、或完全人源化的。
14.在一些实施方案中,所述的分离的抗体或其抗原结合片段,所述分离的抗体或其抗原结合片段是鼠源的。
15.在一些实施方案中,所述的分离的抗体或其抗原结合片段,其包含seq id no:9所示氨基酸序列的重链恒定结构域(ch)和seq id no:10所示氨基酸序列的轻链恒定结构域(cl)。
16.本发明第二方面,提供制备第一方面所述的分离的抗体或其抗原结合片段的方法。
17.在一些实施方案中,所述通过使用全能核酸酶作为抗原对小鼠进行免疫获得小鼠脾细胞之后进行杂交瘤融合,获得杂交瘤细胞,筛选能够分泌表达结合全能核酸酶的抗体的杂交瘤细胞;对杂交瘤细胞进行测序,获得抗体的可变结构域及恒定结构域氨基酸序列和核酸序列,根据上述序列信息重组表达所需抗体。
18.在一些实施方案中,所述全能核酸酶的氨基酸序列如seq id no:11所示。
19.本发明第三方面,提供一种试剂盒,其包含本发明第一方面所述分离的抗体或其抗原结合片段,并且包含能够结合所述全能核酸酶的第二分离的抗体或其抗原结合片段;其中,所述第二分离的抗体或其抗原结合片段与所述分离的抗体或其抗原结合片段结合在所述全能核酸酶的不同表位。
20.在一些实施方案中,所述的分离的抗体或其抗原结合片段包含:(a)重链可变结构域(vh),所述重链可变结构域包含:seq id no:1所示氨基酸序列的重链互补决定区1(hcdr1),seq id no:2所示氨基酸序列的hcdr2,和seq id no:3所示氨基酸序列的hcdr3;以及(b)轻链可变结构域(vl),所述轻链可变结构域包含:seq id no:4所示氨基酸序列的轻链互补决定区1(lcdr1),seq id no:5所示氨基酸序列的lcdr2,和seq id no:6所示氨基酸序列的lcdr3;其中所述抗体或其抗原结合片段能够特异性地结合至全能核酸酶,优选的所述全能核酸酶包含seq id no:11所示氨基酸序列。
21.在一些实施方案中,所述vh包含seq id no:7所示氨基酸序列,并且所述vl包含seq id no:8所示氨基酸序列。
22.在一些实施方案中,所述的分离的抗体或其抗原结合片段,还包含seq id no:9所示氨基酸序列的重链恒定结构域(ch)和seq id no:10所示氨基酸序列的轻链恒定结构域(cl)。
23.本发明的第四方面,提供另一种试剂盒,其包含第一方面所述分离的抗体或其抗原结合片段,并且包含能够结合所述全能核酸酶的第二分离的抗体或其抗原结合片段;其中,所述第二分离的抗体或其抗原结合片段与所述分离的抗体或其抗原结合片段非竞争性地结合所述全能核酸酶。
24.在一些实施方案中,所述的分离的抗体或其抗原结合片段包含:(a)重链可变结构域(vh),所述重链可变结构域包含:seq id no:1所示氨基酸序列的重链互补决定区1(hcdr1),seq id no:2所示氨基酸序列的hcdr2,和seq id no:3所示氨基酸序列的hcdr3;以及(b)轻链可变结构域(vl),所述轻链可变结构域包含:seq id no:4所示氨基酸序列的轻链互补决定区1(lcdr1),seq id no:5所示氨基酸序列的lcdr2,和seq id no:6所示氨基酸序列的lcdr3;其中所述抗体或其抗原结合片段能够特异性地结合至全能核酸酶,优选的所述全能核酸酶包含seq id no:11所示氨基酸序列。
25.在一些实施方案中,所述vh包含seq id no:7所示氨基酸序列,并且所述vl包含seq id no:8所示氨基酸序列。
26.在一些实施方案中,所述的分离的抗体或其抗原结合片段,还包含seq id no:9所示氨基酸序列的重链恒定结构域(ch)和seq id no:10所示氨基酸序列的轻链恒定结构域(cl)。
27.本发明的第五方面,提供一种检测mrna疫苗制备过程中全能核酸酶残留的方法,其采用上述分离的抗体或抗原结合蛋白、上述试剂盒对全能核酸酶残留进行检测。
28.本发明的第六方面,提供上述抗体或抗原结合蛋白、含上述抗体或抗原结合片段的试剂盒在mrna疫苗生产中的应用。本发明所述的mrna疫苗生产中的应用,指的是疫苗生产的各个环节中的应用,包括但不限于生产过程中、生产结束,任何生产环节涉及全能核酸酶残留的情况都可以应用本发明的抗体或抗原结合片段及其试剂盒对残留全能核酸酶进行去除。
29.本发明的第七方面,提供前述试剂盒在酶联免疫反应中的用途。
30.本发明还提供编码所述的分离的抗体或其抗原结合片段的核酸;本发明还提供包含所述核酸的载体,其能够表达所述的分离的抗体或其抗原结合片段的核酸;本发明还提供包含所述载体的宿主细胞。
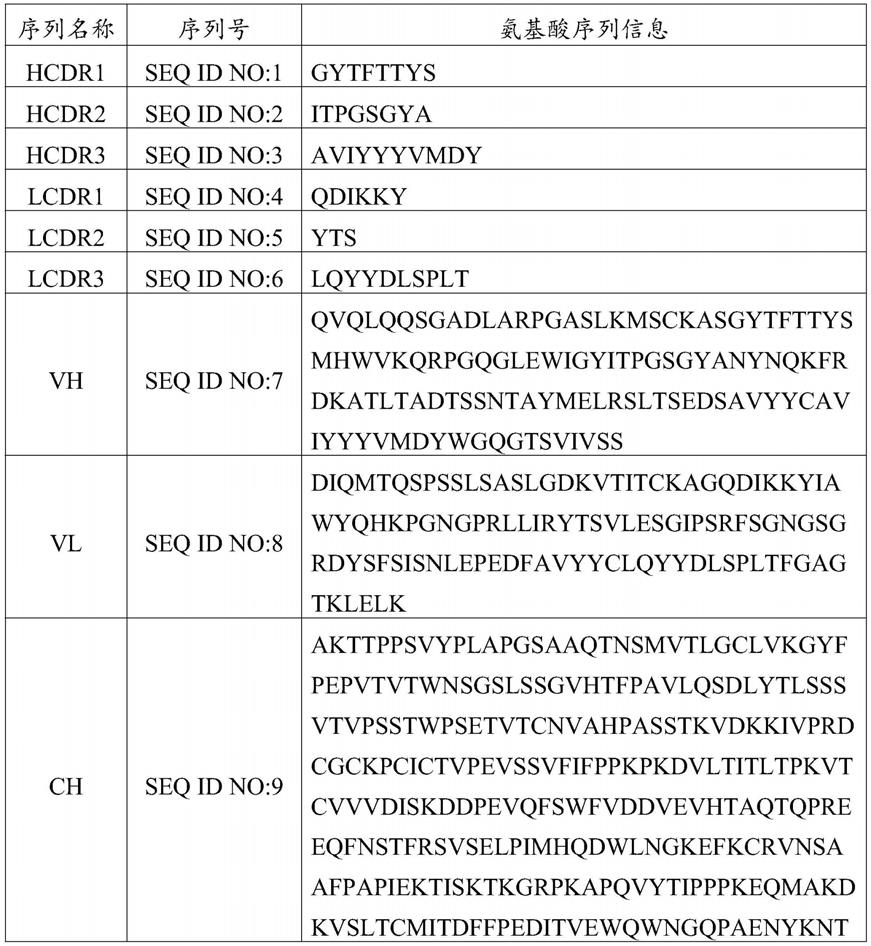
31.本发明的氨基酸序列信息如表1所示:
32.表1氨基酸序列
33.[0034][0035]
术语
[0036]
应该注意的是,除非上下文清楚地指明,否则本文和所附权利要求中所用的单数形式“一个/一种”和“所述/该”包括复数引用物。
[0037]
术语“表位”意指能够特异性地结合至抗体的蛋白质决定簇。表位通常由分子的化学活性表面基团(诸如氨基酸或糖侧链)组成,并且通常具有特定的三维结构特征以及特定的电荷特征。构象性表位和非构象性表位的区别在于,在变性溶剂的存在下,与前者而非后者的结合丧失。
[0038]
术语“抗体”、“抗体部分”、“抗原结合片段”或“抗体构建体”以最广义使用,并且涵盖各种抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如双特异性抗体)、全长抗体及其抗原结合片段,只要它们展现出期望的抗原结合活性即可。
[0039]
基本的4链抗体单元是由两条相同的轻(l)链和两条相同的重(h)链构成的异四聚体糖蛋白。igm抗体由5个基本异四聚体单元以及称为j链的另外多肽组成,并且含有10个抗原结合位点,而iga抗体包含2-5个基本4链单元,所述基本4链单元可以聚合形成与j链组合的多价聚集物。在igg的情况下,4链单元通常为约150,000道尔顿。每条l链通过一个共价二硫键与h链连接,而两条h链根据h链同种型通过一个或多个二硫键彼此连接。每条h和l链还具有规则间隔的链内二硫桥。每条h链在n末端具有一个可变结构域(vh),随后是每条α和γ链的三个恒定结构域(ch)以及μ和ε同种型的四个ch结构域。每条l链在n末端具有一个可变结构域(vl),随后是在其另一末端的一个恒定结构域。vl与vh对齐,并且cl与重链的第一恒定结构域(ch1)对齐。据信特定的氨基酸残基在轻链可变结构域与重链可变结构域之间形成界面。vh和vl一起配对形成单个抗原结合位点。对于不同类别抗体的结构和特性,参见例如,basic and clinical immunology,第8版,daniel p.sties,abba i.terr和tristramg.parsolw(编辑),appleton&lang e,norwalk,conn.,1994,第71页和第6章。根据
其恒定结构域的氨基酸序列,可以将来自任何脊椎动物物种的l链分配为两种明显不同的类型(称为κ和λ)中的一种。取决于其重链恒定结构域(ch)的氨基酸序列,可以将免疫球蛋白分配为不同类别或同种型。免疫球蛋白有五个类别:iga、igd、ige、igg和igm,它们分别具有命名为α、δ、ε、γ和μ的重链。根据ch序列和功能的相对小的差异,将γ和α类别进一步分成亚类。
[0040]“分离的”抗体是已经从其生产环境的组分(例如,天然或重组)中鉴定、分离和/或回收的一种抗体。优选地,分离的多肽不与来自其生产环境中的所有其他组分缔合。其生产环境的污染组分(诸如由重组转染细胞产生的污染组分)是通常干扰抗体的研究、诊断或治疗用途的物质,并且可包括酶、激素以及其他蛋白质或非蛋白质溶质。分离的抗体包括重组细胞内的原位抗体,将不存在抗体天然环境的至少一种组分。然而,通常,分离的多肽、抗体或构建体将通过至少一个纯化步骤来制备。
[0041]
抗体的“可变区”或“可变结构域”是指抗体重链或轻链的氨基末端结构域。重链和轻链的可变结构域可分别被称为“vh”和“vl”。这些结构域通常是抗体的变化最大的部分(相对于相同类别的其他抗体),并且含有抗原结合位点。
[0042]
术语“可变的”是指可变结构域的某些区段在抗体之间序列差异很大的事实。v结构域介导抗原结合并且限定特定抗体对其特定抗原的特异性。然而,可变性在可变结构域的整个范围内不是均匀分布。相反,它集中在轻链可变结构域和重链可变结构域中的三个称为互补决定区(cdr)或高变区(hvr)的区段中。可变结构域的更高度保守的部分被称为框架区(fr)。天然重链和轻链的可变结构域各自包含由三个cdr连接的、主要采用β-折叠构型的四个fr区,所述三个cdr形成环,所述环连接β-折叠结构并且在一些情况下形成β-折叠结构的一部分。每条链中的cdr通过fr区紧密结合在一起,并且与另一条链中的cdr一起有助于形成抗体的抗原结合位点(参见kabat等人,sequences of immunological interest,第五版,national institute of health,bethesda,md.(1991))。恒定结构域不直接参与抗体与抗原的结合,但是展现出多种效应子功能,诸如抗体参与抗体依赖性细胞毒性。
[0043]
如本文所用,术语“单克隆抗体”是指从基本上均质的抗体群体中获得的抗体,即,除可以少量存在的可能的天然发生的突变和/或翻译后修饰(例如,异构化、脱酰胺)以外构成群体的单独抗体是相同的。单克隆抗体具有高度特异性,针对单个抗原位点。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂相反,每种单克隆抗体针对抗原上的单一决定簇。除了其特异性之外,单克隆抗体的优势在于它们是由杂交瘤培养物合成的,不受其他免疫球蛋白的污染。修饰语“单克隆”表示从基本均质的抗体群体获得的抗体的特征,并且不应解释为要求通过任何特定方法来生产抗体。例如,可通过多种技术来制备根据本技术使用的单克隆抗体,所述技术包括例如杂交瘤方法(例如,kohler和milstein.,nature,256:495-97(1975);hongo等,hybridoma,14(3):253-260(1995);harlow等,antibodies:a laboratory manual,(cold spring harbor laboratory press,第2版1988);hammerling等,monoclonal antibodies and t-cell hybridomas 563-681(elsevier,n.y.,1981));重组dna方法(参见例如,美国专利号4,816,567);噬菌体展示技术(参见例如,clackson等,nature,352:624-628(1991);marks等,j.mol.biol.222:581-597(1992);sidhu等,j.mol.biol.338(2):299-310(2004);lee等,j.mol.biol.340(5):1073-1093(2004);fellouse,proc.nat’l.acad.sci.usa 101(34):12467-12472(2004);和
lee等,j.immunol.methods284(1-2):119-132(2004))。
[0044]
术语“恒定结构域”是指免疫球蛋白分子的一部分,所述部分相对于所述免疫球蛋白的另一部分(即可变结构域)具有更保守的氨基酸序列,其含有抗原结合位点。恒定结构域含有重链的ch1、ch2和ch3结构域(统称为ch)以及轻链的chl(或cl)结构域。
[0045]
术语“互补决定区”或“cdr”用于指由kabat系统所定义的高变区。参见kabat等人,sequences of proteins of immunological interest,第5版public health service,national institutes of health,bethesda,md.(1991)。
[0046]
如本文所用,术语“特异性地结合”、“特异性地识别”或“对
……
特异”是指可测量和可再现的相互作用诸如靶标与抗原结合蛋白(诸如mab)之间的结合,所述结合决定了在包括生物分子的异质分子群体的存在下所述靶标的存在。例如,特异性地结合靶标(其可以是表位)的抗原结合蛋白(诸如mab)是以更大的亲和力、亲合力、更容易地和/或以比其结合其他靶标更长的持续时间结合此靶标的抗原结合蛋白(诸如mab)。在一些实施方案中,如例如通过放射免疫测定(ria)所测量,抗原结合蛋白(诸如mab)与不相关靶标的结合程度为所述抗原结合蛋白(诸如mab)与所述靶标的结合的小于约10%。在一些实施方案中,特异性地结合靶标的抗原结合蛋白(诸如mab)具有以下解离常数(kd):≤10-5m、≤10-6m、≤10-7m、≤10-8m、≤10-9m、≤10-10m、≤10-11m、或≤10-12m。在一些实施方案中,抗原结合蛋白特异性地结合蛋白质上的表位,所述表位在来自不同物种的蛋白质中是保守的。在一些实施方案中,特异性结合可以包括但不要求排他结合。
[0047]
附图简述
[0048]
图1显示了全长抗全能核酸酶单克隆抗体sds-page电泳结果。
[0049]
图2显示了功能最佳的全能核酸酶单克隆抗体与全能核酸酶结合结果。
具体实施方式
[0050]
实施例1全能核酸酶抗体的制备
[0051]
用全能核酸酶免疫小鼠,首免100ug,二免50ug,三免50ug,四免50ug,再制备杂交瘤细胞,筛选得到编号为e6-7、e6-9、e6-14、e6-15的杂交瘤,之后进行杂交瘤细胞的克隆化,详细参见(proetzel,gabriele;ebersbach,hilmar(2012).[methods in molecular biology]antibody methods and protocols volume 901||hybridoma technology for the generation of monoclonal antibodies.,10.1007/978-1-61779-931-0(chapter 7),117
–
135.)。
[0052]
全能核酸酶氨基酸序列:
[0053]
mrfnnkmlalaallfaaqasadtlesidncavgcptggssnvsivrhaytlnnnsttkfanwvayhitkdtpasgktrnwktdpalnpadtlapadytganaalkvdrghqaplaslagvsdweslnylsnitpqksdlnqgawarledqerklidradissvytvtgplyerdmgklpgtqkahtipsaywkvifinnspavnhyaaflfdqntpkgadfcqfrvtvdeiekrtgliiwaglpddvqaslkskpgvlpelmgckn
[0054]
实施例2单克隆抗体的表达以及纯化
[0055]
将实施例1筛选到的杂交瘤细胞裂解后提取mrna,再将mrna逆转录之后形成cdna,cdna进行一轮扩增之后,调取igg重、轻链基因片段,之后将调取的igg重、轻链基因片段拼接入表达载体中来构建质粒。质粒采用expicho
tm reagent共转染hek293悬浮培养细胞进行
瞬时表达。转染时,细胞密度维持在6
×
106细胞/ml,expicho
tm reagent:dna(质粒)比例为4:1。细胞在37℃,8%co2培养箱中120转/分钟震荡培养。转染转染16-18h后,加入180μl expifectamine
tm
cho enhance和4.8ml expicho
tm
feed,随后转移至32℃,5%,120rpm摇床培养。转染11天后收集细胞上清。0.22μm滤膜过滤后进行纯化。纯化之前,将管道和蛋白a柱用0.2mnaoh去热原。将柱用含有0.05m tris和1.5m nacl(ph8.0)的缓冲液重新平衡。随后将收获的细胞培养物上清液使用2
×
上述缓冲液1:1稀释并过滤除菌。将过滤的上清液和蛋白a柱室温孵育2小时,用并1
×
上述缓冲液洗涤柱后,使用无菌0.1m柠檬酸钠(ph3.5)洗脱igg,收集了洗脱液并用九分之一体积的无菌1m tris-hcl(ph9)中和。在无菌条件下,将所述产品缓冲液交换为pbs(ph7.4)以除去任何的洗脱缓冲液并浓缩所述样品。浓缩之后,使用1.43的消光系数ec(0.1%)通过od280nm对抗体进行定量。
[0056]
沿用杂交瘤的编号对抗体进行编号,纯化的e6-7、e6-9、e6-14、e6-15抗体通过biorad电泳系统用10%预制胶(genscript)在50mm二硫苏糖醇还原条件下通过sds-page来分析。将所述凝胶用estain2.0(genscript)染色并通过比较染色带与protein ladder(genscript)来估计分子大小。图1结果显示e6-7、e6-9、e6-14、e6-15抗体均呈现分子量为50kda和25kda的两条带,分别为抗体的重链和轻链。泳道1:e6-7;泳道2:e6-9;泳道3:e6-14;泳道4:e6-15;泳道5:蛋白marker。
[0057]
实施例3全能核酸酶单克隆抗体的结合活性验证
[0058]
3.1包被抗原:使用包被液(1.59g无水碳酸钠,2.93g无水碳酸氢钠溶于1000ml蒸馏水中,购自国药)将2ug/ml的全能核酸酶加到反应板酶标孔中,每孔100μl,将反应板加盖放于4℃过夜包被,上层为液体,包被后的全能核酸酶吸附在反应板上。
[0059]
3.2封闭:用洗涤液(氯化钠8g、磷酸二氢钾0.5g、磷酸氢二钠2.9g、tween20 0.5ml溶于1000ml蒸馏水中,购自国药)每孔350μl冲洗反应板一次以洗去包被液,在吸水纸上将反应板中洗涤液拍干,每孔迅速加入100-200μl封闭液置于37℃培养箱,孵育2h;倒去封闭液(牛血清白蛋白5克溶于100ml洗涤缓冲液中,购自国药),甩板机甩干或在吸水纸上拍干封闭液,即可使用反应板,如不立即使用,反应板应放于密封袋中并加入干燥包置于2-8℃保存,干燥包需位于反应板板底,不能接触反应板孔。
[0060]
3.3加待测样品:反应板平衡至室温后从密封袋中拿出,每孔加入100ul e6-7、e6-9、e6-14、e6-15抗全能核酸酶的抗体,起始浓度为5000ng/ml,2倍倍比梯度稀释至0.3ng/ml,在微型振荡器上振荡60秒使孔内液体混合均匀,置于37℃培养箱,孵育1小时。
[0061]
3.4加酶标结合物:使用样本稀释液按1:20000稀释二抗-hrp(jackson immuno research,115-005-008),小心揭下板贴,每孔加入100μl稀释好的二抗-hrp,更换板贴并贴好,在微型振荡器上振荡60秒使孔内液体混合均匀,置于37℃培养箱,孵育1h小时。
[0062]
3.5洗板:小心揭下板贴,用1x洗涤液冲洗反应板六次(推荐使用洗板机,每孔加液量350μl),最后在吸水纸上拍干或甩板机甩干。
[0063]
3.6显色:将显色a液(醋酸钠13.6g,柠檬酸1.6g,30%双氧水0.3ml,蒸馏水加至500ml,购自国药。)和b液(乙二胺四乙酸二钠0.2g,柠檬酸0.95g,甘油50ml,tmb 0.15g,蒸馏水加至500ml,购自国药。)按体积比1:1混匀成显色工作液,每孔加入显色工作液100μl,更换板贴并贴好,置于37℃避光反应10分钟。
[0064]
3.7读数:小心揭下板贴,每孔加入终止液50μl终止反应,用酶标仪450nm单波长检
测,测定各孔的吸光值。各组反应数据如表2:
[0065]
表2不同抗体不同浓度与抗原的结合能力
[0066]
抗体浓度(ng/ml)e6-7e6-9e6-14e6-1550002.86942.6562.78632.791725002.84662.64582.67362.654412502.65172.65932.51512.68666252.43942.47062.4822.6664312.51.93972.15552.16752.1933156.251.39311.69391.66891.7478.1250.71781.11791.12321.122739.06250.36080.61930.6540.642819.531250.23880.30910.32280.28749.7656250.15240.21710.20380.21544.8828120.08570.14680.14160.1542.4414060.06330.09350.09390.09251.2207030.04790.06150.0580.06170.6103510.04720.04970.04690.05150.3051757810.04990.04670.04640.0494阴性0.04890.04750.04720.0474ec
50
182.9108.2110.9109.3r20.99930.99950.9990.9982
[0067]
表2显示了功能较佳的4个全能核酸酶单克隆抗体与全能核酸酶结合结果。以全能核酸酶抗原包被elisa板,以不同浓度的e6-14抗体与包被于板子上的抗原分子结合,并以hrp标记的羊抗鼠igg fc抗体测定结合的抗体。结果显示这4组抗体可结合于全能核酸酶,并呈现浓度依赖性和可饱和性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。