一种靶向tigit的放射性标记化合物及其制备方法和应用
技术领域
1.本发明属于医用放射性标记化合物和核医学应用技术领域,具体涉及一种靶向tigit的放射性标记化合物及其制备方法和应用。
背景技术:
2.含ig及itim结构域的t细胞免疫受体(tigit,也称为wucam,vstm3,vsig9)是脊髓灰质炎病毒受体(pvr)家族的一员,是一种在淋巴细胞中表达的共抑制受体,特别在活化的cd8 t和cd4 t细胞、自然杀伤(nk)细胞、调节性t细胞(tregs)中高表达,tigit与其同源配体pvr的结合直接抑制淋巴细胞激活,导致肿瘤逃逸。tigit和pvr广泛表达在不同类型的实体瘤中,说明tigit-pvr信号通路可能是一种主要的肿瘤免疫逃逸机制,是继pd-1/pd-l1之后的新型免疫检查点。
3.针对这一新兴免疫检查点,全球各大药企纷纷布局tigit抑制剂。目前,已有十多个tigit抑制剂进入临床试验研究。例如,一项名为cityscape的ii期研究表明,抗tigit抗体tiragolumab联合阿替利珠单抗显著改善pd-l1高表达非小细胞肺癌患者总体响应,与单独使用阿替利珠单抗相比,联用后患者的客观缓解率(orr)得到明显改善(31.3%vs 16.2%),中位无进展生存期(pfs)也显著提升(5.4个月vs 3.6个月),疾病进展风险降低43%,具有显著临床意义。尽管如此,应该清醒的认识到,实际上只有小于20%-30%的患者能够从这一治疗方法中获益。因此,提供一种检测tigit表达水平的方法,用于患者分层和指导抗tigit治疗,具有重要的临床价值。
4.核医学分子影像(pet和spect)在pd-l1表达检测中的成功应用(bensch f,van der veen el,lub-de hoogemn,etal.
89
zr-atezolizumab imaging as anon-invasiveapproach to assessclinical response to pd-l1blockade in cancer.nat med,2018,24,1852-1858)为人们带来启示:利用pet和spect,可以从整体上、实时、无创性地评估肿瘤tigit表达水平,为患者分层和指导抗tigit治疗提供准确依据。这一方法的关键在于发展一种靶向tigit的放射性标记化合物,这也是本领域研究人员亟需解决的问题之一。
技术实现要素:
5.本发明的目的在于克服现有技术缺陷,提供了一种靶向tigit的放射性标记化合物及其制备方法和应用。
6.本发明的技术方案如下:
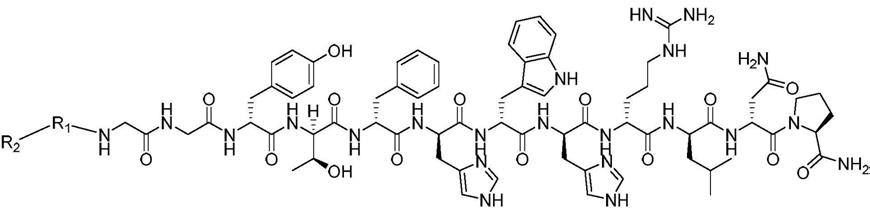
7.一种靶向tigit的放射性标记化合物,其结构式为:
[0008][0009]
其中,
[0010]
r1为n为0-10的整数;
[0011]
r2为放射性核素络合基团。
[0012]
在本发明的一个优选实施方案中,所述r2为nota配体、dota配体、dtpa配体、hynic配体或dfo配体络合放射性核素形成的基团。
[0013]
进一步优选的,所述r2为nota配体络合放射性核素形成的基团。
[0014]
在本发明的一个优选实施方案中,所述放射性核素为
99m
tc,
111
in,
177
lu,
18
f,
68
ga,
64
cu或
89
zr。
[0015]
进一步优选的,所述放射性核素为
68
ga。
[0016]
上述放射性标记化合物的制备方法,包括如下步骤:
[0017]
(1)利用多肽固相合成仪合成c-2化合物,该c-2化合物的结构式如下:
[0018][0019]
(2)将c-2化合物与所述放射性核素络合基团的配体在三乙胺、n,n-二异丙基乙胺或ph=8的缓冲液作用下反应8-16h,再依次经高效液相色谱纯化和冷冻干燥,得到标记前体化合物;
[0020]
(3)将放射性核素与上述标记前体化合物络合,纯化后即得所述放射性标记化合物。
[0021]
上述放射性标记化合物在制备spect显像剂中的应用。
[0022]
上述放射性标记化合物在制备pet显像剂中的应用。
[0023]
上述放射性标记化合物在制备肿瘤核素靶向治疗药物中的应用。
[0024]
在本发明的一个优选实施方案中,所述肿瘤为肺癌、肝癌、黑色素瘤、结直肠癌、胰腺癌、乳腺癌、肾癌、淋巴瘤、前列腺癌、白血病、胃癌、骨癌、头颈部癌中的至少一种。
[0025]
本发明的有益效果是:
[0026]
1、本发明具有高亲和力和特异性、良好的药代动力学特性,血液清除快、免疫原性
低和合成方便,能够对肿瘤微环境中的tigit表达进行活体显像和定量分析,助力于肿瘤精准免疫治疗。
[0027]
2、本发明的应用与现有病理检测相比,此技术具有非入侵性、定量、实时动态、高特异性、高灵敏度的特点。
附图说明
[0028]
图1为本发明实施例1中
68
ga-gp12的制备流程图。
[0029]
图2为本发明实施例1中
68
ga-gp12的放射化学纯度结果图。
[0030]
图3为本发明实施例1中
68
ga-gp12在生理盐水和血清中的稳定性结果图。
[0031]
图4为本发明实施例2中
68
ga-gp12的细胞实验结果图。其中,(a)人pbmcs经植物凝集素pha-m处理前后tigit表达变化,(b)不同类型细胞摄取
68
ga-gp12随时间变化曲线,(c)饱和结合实验。
[0032]
图5为本发明实施例3中
68
ga-gp12在b16f10荷瘤c57bl/6小鼠模型中的组织分布图。
[0033]
图6为本发明实施例4中
68
ga-gp12pet/ct显像实验结果图。其中,(a)
68
ga-gp12在b16f10荷瘤c57bl/6小鼠模型中的pet/ct显像图,(b)感兴趣区发测定肿瘤摄取值(%id/g)。
[0034]
图7为本发明实施例5中b16f10荷瘤c57bl/6小鼠注射
68
ga-gp12 60min后,离体肿瘤组织放射自显影图(a)、苏木精-伊红染色图(b)和tigit免疫组化图(c)。
具体实施方式
[0035]
以下通过具体实施方式结合附图对本发明的技术方案进行进一步的说明和描述。
[0036]
实施例1
68
ga-gp12的制备和表征
[0037]
(1)利用多肽固相合成仪合成图1中所示化合物1;
[0038]
(2)将50nmol的化合物1溶于1ml ph 8.0pbs溶液中,55nmol的nota-nhs溶于100uln,n-二甲基甲酰胺中,二者混合均匀,在室温下搅拌反应过夜;反应结束后,高效液相色谱纯化,冷冻干燥,得到如图1所示的标记前体化合物2;
[0039]
(3)将25μgnota-gp12标记前体化合物2溶于ph=5.5的0.25mnaoac水溶液中;用4ml 0.05m hcl将
68
gacl3淋洗至反应管中;将二者混匀,90℃下反应15min;反应结束后冷却至室温,加入10ml去离子水淬灭反应,sep-pak c18柱纯化,得到如图1所示的目标放射性标记化合物
68
ga-gp12;
[0040]
(4)对
68
ga-gp12的放射化学产率、放射化学纯度、比活度、脂水分配系数和稳定性进行分析测试。分析测试条件:agilent 1260infinity ii高效液相色谱仪,色谱柱为zorbax sb-c18,流动相a为含0.1%tfa的去离子水,流动相b为含0.1%tfa的乙腈,洗脱方式为梯度洗脱(0-5mim:5%乙腈;5-25min:5-90%乙腈;30min:90%乙腈)。
[0041]
与非放射性的ga-gp12相比,本实施例成功制备了
68
ga-gp12(如图2所示),其放射化学产率为77.0
±
3.9%(n=5),放射化学纯度为>99%(n=5),比活度为57.3
±
10.9gbq/umol(n=3),脂水分配系数logp为-2.43
±
0.20(n=6)。如图3所示,在生理盐水和血清中,本实施例制备的
68
ga-gp12具有良好的稳定性。
[0042]
实施例2细胞实验
[0043]
利用人淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司),以梯度离心法,从健康志愿者者新鲜外周血中分离人外周血单个核细胞(pbmcs)。分离的pbmcs接种于含有rpmi 1640培养基的培养瓶中,并加入5μg/ml的植物凝集素pha-m(sigma),在37℃和5%co2培养箱中培养48h,流式细胞术检测pbmcs上tigit表达变化。
[0044]
细胞摄取实验分为pbmcs组、激活的pbmcs组和阻断组。2
×
105细胞/孔pbmcs或激活的pbmcs接种于multiscreenhts滤膜板(美国millipore)中,每孔分别加入100ul实施例1制备的
68
ga-gp12的溶液(74kbq),阻断组每孔加入10ug gp12多肽。在5min、15min、30min、60min和120min,移去培养基,向孔板中加入冰冷的pbs洗两次,再加入1m naoh,室温下放置5-10min,吸取所有液体用于γ-count计数,计算细胞摄取率。
[0045]
饱和结合实验:在激活的pbmcs细胞中,2
×
105细胞/孔pbmcs或激活的pbmcs接种于multiscreenhts滤膜板中,每孔加入不同浓度(1、5、10、20、40、80、100和120nm)的实施例1制备的
68
ga-gp12,阻断组加入20uggp12多肽。在60min时,移去培养基,向孔板中加入冰冷的pbs洗两次,再加入1m naoh,室温下放置5-10min,吸取所有液体用于γ-count计数,计算kd值。
[0046]
如图4a所示,激活的pbmcs上tigit表达显著升高。在细胞摄取实验中,激活的pbmcs细胞摄取随着时间延长逐渐升高,在60min时达到最大,摄取率为45.88
±
4.98%(图4b)。加入gp12多肽阻断后,细胞摄取显著下降,证明
68
ga-gp12具有特异性。饱和结合实验表明
68
ga-gp12具有良好的亲和力,其kd值为37.28nm(图4c)。
[0047]
实施例3生物分布实验
[0048]
本实施例所使用的动物实验经厦门大学动物伦理委员会批准,5
×
106个b16f10黑色素瘤细胞接种于6-8周龄c57bl/6小鼠右上肢外侧,经过6天生长后用于生物分布实验研究。
[0049]
具体过程为:荷瘤c57bl/6小鼠模型每组5只,尾静脉注射1.85mbq 68
ga-gp12,在30min、60min和120min时,分别处死动物,收集组织和器官,称重,并γ-count计数,计算组织和器官的%id/g。gp12阻断和mab阻断组分别提前1h注射2mg/kggp12多肽和24h注射5mg/kg anti-tigit抗体(美国bioxcell)。
[0050]
如图5所示,
68
ga-gp12主要分布在肾脏,意味着其经泌尿系统排泄,其次为肿瘤和脾脏,其他器官分布较少。在60min时,肿瘤摄取达到最大(5.00
±
1.24%id/g),其瘤/肉比和瘤/血液比分别为11.14
±
2.18和5.59
±
0.83。gp12阻断时,肿瘤摄取显著降低,摄取值为0.66
±
0.17%id/g,瘤/肉比和瘤/血液比分别为1.09
±
0.30和0.53
±
0.12。这一结果证明,肿瘤特异性摄取
68
ga-gp12。抗tigit抗体阻断时,肿瘤摄取未显著变化,摄取值为4.56
±
1.15%id/g,瘤/肉比和瘤/血液比分别为8.06
±
1.90和4.89
±
0.89。这一结果表明,
68
ga-gp12和抗tigit抗体对tigit蛋白的结合表位不同,使其具有在抗tigit治疗过程中监测tigit表达和评估预后的能力。
[0051]
实施例4活体pet显像实验
[0052]
本实施例所使用的动物实验经厦门大学动物伦理委员会批准,5
×
106个b16f10黑色素瘤细胞接种于6-8周龄c57bl/6小鼠右上肢外侧,经过6天生长后用于pet显像研究。
[0053]
具体过程为:荷瘤c57bl/6小鼠模型每组5只,尾静脉注射5.0mbq
68
ga-gp12,60min
后,静态扫描10min。gp12阻断和mab阻断组分别提前1h注射2mg/kg gp12多肽和24h注射5mg/kg anti-tigit抗体(美国bioxcell)。扫描结束后重建图像,感兴趣区法定量肿瘤摄取。扫描结束后处死动物,取肿瘤组织进行he和免疫组化。
[0054]
如图6所示,在注射
68
ga-gp1260min后,肿瘤可显像,摄取值为4.22
±
0.68%id/g。gp12阻断后,肿瘤摄取显著下降,摄取值为0.78
±
0.16%id/g。抗tigit抗体阻断后,肿瘤仍能显像,其摄取值为4.18
±
0.23%id/g。
[0055]
实施例5离体组织学研究
[0056]
本实施例所使用的动物实验经厦门大学动物伦理委员会批准,5
×
106个b16f10黑色素瘤细胞接种于6-8周龄c57bl/6小鼠右上肢外侧,经过6天生长后用于组织学研究。
[0057]
具体过程为:荷瘤c57bl/6小鼠模型尾静脉注射7.4mbq mbq
68
ga-gp12,60min后,处死动物,取肿瘤组织,切片,进行放射自显影。gp12阻断和mab阻断组分别提前1h注射2mg/kggp12多肽和24h注射5mg/kg anti-tigit抗体(美国bioxcell)。取肿瘤组织,组织固定液固定,进行苏木精-伊红染色和tigit免疫组化。
[0058]
如图7a所示,
68
ga-gp12组肿瘤摄取较高,gp12阻断组肿瘤摄取显著下降,抗tigit抗体阻断肿瘤摄取未明显下降,进一步验证了活体显像的结果。he和免疫组化实验表明,肿瘤组织高表达tigit(图7b和c)。
[0059]
以上所述,仅为本发明的较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。