1.本发明涉及生物工程领域,涉及蛋白质谷氨酰胺酶生产菌株的筛选(富集培养)及其生长代谢的特性分析。
背景技术:
2.天然蛋白质含有较多的谷氨酰胺和天冬酰胺残基,它们以氢键的形式和其他氨基酸交联,导致蛋白质的溶解性降低,进而影响蛋白的工艺特性,如乳化性、起泡性、凝胶性等,从而限制蛋白质在食品、饮料、保健品、医药等领域的应用。
3.蛋白质脱酰胺作用是一种对大豆和其他富含谷氨酰胺的蛋白质潜在有用的修饰方法,在生物化学和工业应用方面受到关注。蛋白质改性技术即可以通过物理、化学、生物酶法作用于蛋白质,使其氨基酸和肽链发生改变2。酶法脱酰胺在蛋白质修饰中因为速度快、反应条件温和及其特异性高等特点,比化学处理法应用更加广泛。
4.谷氨酰胺转移酶、蛋白酶和肽谷氨酰胺酶均可以用于蛋白质的脱酰胺。但是都有一定的不足:谷氨酰胺转移酶过量使用会使蛋白质发生凝聚;蛋白酶能将蛋白质水解成短肽,底物专一性较差,容易产生苦味;肽谷氨酰胺酶对高分子量的多肽和蛋白质不发挥作用,且脱酰胺度不高。
5.蛋白质谷氨酰胺酶(protein-glutaminase,ec3.5.1.44)简称pg,是一种新型的脱酰胺酶3,能够脱去多种蛋白质、多肽或者短肽的氨基,且仅作用于蛋白质或肽的谷氨酰胺基团,而对天冬酰胺残基和游离谷氨酰胺没有影响,同时不会导致蛋白质的交联和水解,从而提高蛋白质的溶解度等特性,在食品当中有很好的市场潜力4。但由于野生菌株酶活较低,国内对能够产生蛋白质谷氨酰胺酶的菌株研究甚少,限制了蛋白质谷氨酰胺酶的工业化应用。
6.现有报道中,能产蛋白质谷氨酰胺酶的细菌有解朊金黄杆菌 (chryseobacterium proteolyticum)、黏金黄杆菌(chryseobacterium gleum)和产吲哚金黄杆菌(chryseobacterium indologenes)等。目前唯一被批准用于工业化生产的仅有解朊金黄杆菌,但其产酶能力较低,酶活约为0.34u/ml1。
技术实现要素:
7.为了克服现有技术的上述缺陷,本发明目的之一是建立一种新型的富集培养方法,旨在筛选酶活高的、新型的蛋白质谷氨酰胺酶菌株,扩大菌株来源,为在食品当中的应用提供优质菌株。
8.本发明提供了一种能够富集高产蛋白质谷氨酰胺酶菌株的培养基,用该富集培养基可以筛选到多株高产蛋白质谷氨酰胺酶的菌株,其中优选的是一株解朊金黄杆菌(chryseobacterium proteolyticum a4142),于2020年7月10日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为:北京市朝阳区北辰西路1号院3号,保藏编号为cgmcc no.20337。
9.所述培养基的组成及含量为:乳糖5g,酵母粉11.7g,cbz 1g,k2hpo
4 0.1g, kh2po
4 0.1g,氯化钠0.1g,ph7.2,加蒸馏水定容至1l,115℃灭菌20min。
10.所述解朊金黄杆菌chryseobacterium proteolyticum a4142的菌落为圆形,菌落状态饱满,边缘光滑,无缺刻,菌落有粘性;菌株呈杆状,不产芽孢,革兰氏阴性。
11.所述蛋白质谷氨酰胺酶产生菌解朊金黄杆菌a4142能分泌蛋白质谷氨酰胺酶,即pg酶,将所述解朊金黄杆菌a4142菌株在上述培养基中发酵培养16h,产酶量高达2.15u/ml,比文献报道1的产最高酶活的解朊金黄杆菌qrd1265提高了532%。
12.本发明还提供了一种蛋白质谷氨酰胺酶高产菌株的筛选方法,所述方法包括以下步骤:
13.(1)土壤悬液的富集培养
14.取土壤悬液至富集培养基中振荡培养。
15.其中,所述的富集培养基为:乳糖5g,酵母粉11.7g,cbz 1g,k2hpo
4 0.1g, kh2po
4 0.1g,氯化钠0.1g,ph7.2,加蒸馏水定容至1l,115℃灭菌20min。
16.所述振荡培养的温度为20℃-37℃;优选地,为30℃。
17.所述振荡培养的转速为150r/min-240r/min;优选地,为200r/min。
18.所述振荡培养的时间为3天-7天;优选地,为5天。
19.本发明方法的富集培养基可以对菌株进行有效富集,酶活高,筛选效率高。
20.(2)平板初筛
21.将步骤(1)富集后的菌液倍比稀释,涂布于lb平板中,然后置于培养箱中,20℃-37℃(优选地,为30℃)倒置培养3-5天。挑选黄色或橙色的菌株,转接于新的lb平板中,然后20℃-37℃(优选地,为30℃)培养1-2天,然后向菌株滴加3%(w/v)koh溶液,若菌株颜色变红,加hcl中和后恢复黄色,则该菌株为疑似菌株。
22.其中,所述的菌液倍比稀释,即取100μl菌液至900μl无菌水中,即为稀释10倍的菌液,再以此类推,制备稀释102、103、104不同稀释倍数的菌液,然后取100μl稀释后的菌液于lb平板中,然后用涂布棒涂匀。
23.其中,所述lb平板中培养基的成分包括:3-7g酵母粉,8-12g nacl,8-12 g胰蛋白胨,10-20g琼脂粉,加蒸馏水定容至1l;最适培养基成分为:5g酵母粉,10g nacl,10g胰蛋白胨,18g琼脂粉,加蒸馏水定容至1l。
24.(3)摇瓶复筛
25.将经过两次活化的菌液按照5%(v/v)的接种量接种至发酵培养基中, 20℃-37℃(优选地,为30℃)、150-240r/min(优选地,为200r/min),培养16h-20h (优选地,为16h),每隔一段时间测定酶活。
26.所述发酵培养基的组成及含量为:mgso4·
7h2o 0.25g,na2hpo4·
12h2o 3.8g, kh2po
4 0.25g,feso4·
7h2o 0.05g,乳糖5g,多聚蛋白胨10g,定容至1l,调节ph为7.2,高压蒸汽灭菌115℃,20min。
27.本发明在步骤(1)之前还包括预处理:土壤悬液的制备:
28.在摇瓶中加入蒸馏水以及20-30粒玻璃珠,高压蒸汽灭菌121℃,20min。然后土壤样品加入至装有蒸馏水的摇瓶中,20℃-37℃(优选地,为30℃)、150-240 rpm/min(优选地,为200r/min),振荡30-60min(优选地,为30min),制成10% (w/v)的土壤悬液。然后放置在
超净工作台当中,静置。
29.在一个具体实施方式中,所述筛选蛋白质谷氨酰胺酶产生菌的方法包括:土壤悬液的制备、土壤悬液的富集培养、平板初筛、摇瓶复筛。
30.(1)土壤悬液的制备
31.在250ml摇瓶中加入90ml蒸馏水,并加入20-30粒玻璃珠,高压蒸汽灭菌 121℃,20min。在超净工作台中,称取10g土壤样品,加入至装有蒸馏水的摇瓶当中,30℃、200rpm/min,振荡30min,制成10%的土壤悬液。然后放置在超净工作台当中,静置。
32.(2)土壤悬液的富集培养
33.取10%(w/v)土壤悬液至富集培养基(60ml)中,30℃、200rpm/min,振荡培养5天。
34.所述的富集培养基为乳糖5g,酵母粉11.7g,cbz 1g,k2hpo
4 0.1g,kh2po
4 0.1g,氯化钠0.1g,ph7.2,加蒸馏水定容至1l,115℃灭菌20min。
35.本发明方法的富集培养基可以对菌株进行有效富集,酶活高,筛选效率高。
36.(3)平板初筛
37.将富集后的菌液倍比稀释,选择适当的梯度的菌液,取100μl于lb平板中,涂布均匀,然后将平板放在30℃的培养箱中,倒置培养3-5天。挑选黄色或橙色的菌株,转接于新的lb平板中,然后30℃培养1-2天,向菌株滴加3%(w/v) koh溶液,若菌株颜色变红,加hcl中和后恢复黄色,则该菌株为疑似菌株。
38.(4)摇瓶复筛
39.将经过两次活化的菌液按照5%(v/v)的接种量接种至发酵培养基,30℃、 200rpm/min,培养16h,每隔一段时间测定酶活。
40.本发明还提供了由上述方法制备得到的蛋白质谷氨酰胺酶高产菌株。
41.本发明通过新型的筛选蛋白质谷氨酰胺酶产生菌的方法,筛选到菌株a4142,酶活为2.15u/ml,比文献报道1的最高酶活解朊金黄杆菌qrd1265提高了532%。
42.本发明还提供了一种蛋白质谷氨酰胺酶的发酵培养方法,所述方法包括:
43.(1)种子培养
44.将所述解朊金黄杆菌a4142在种子培养基中培养。
45.其中,所述培养的温度范围为20-40℃,ph范围为6.0-9.0,150-240rpm/min,培养时间12-16h。优选地,所述培养的温度范围为30℃,ph范围为7.0;转速 200rpm/min,培养时间12h。
46.其中,所述种子培养基,其配方为:多聚蛋白胨10g/l,酵母提取物2g/l,无水mgso
4 1g/l,ph为7.2。
47.(2)发酵培养
48.将所述解朊金黄杆菌a4142菌株以5%的接种量接种于发酵培养基,30℃、 200r/min,培养16h,产酶量高达2.15u/ml,比文献报道1的最高酶活解朊金黄杆菌qrd1265提高了532%。
49.其中,所述发酵培养基成分是:mgso4·
7h2o 0.25g,na2hpo4·
12h2o 3.8g,kh2po
4 0.25g,feso4·
7h2o 0.05g,乳糖5g,多聚蛋白胨10g,定容至1l,调节ph为7.2,高压蒸汽灭菌115℃,20min。
50.本发明还提供了一种蛋白质谷氨酰胺酶产生菌的特性分析方法,所述方法包括:
菌株形态观察、种子生长曲线、发酵代谢曲线、pg酶序列分析。
51.本发明还提供了用于扩增蛋白质谷氨酰胺酶高产菌株的16s rdna上下游引物对,其分别如seq id no.1、seq id no.2所示。
52.本发明还提供了用于扩增蛋白质谷氨酰胺酶高产菌株的pg酶基因上下游引物对,其分别如seq id no.3、seq id no.4所示。
53.本发明对蛋白质谷氨酰胺酶产生菌的pg酶基因进行pcr扩增并测序, a4142的基因序列如seq id no.5所示(dna序列共963bp);蛋白序列如seq idno.6所示,其中,蛋白序列共320个氨基酸,其中21个氨基酸信号肽(如seqid no.7所示),114个氨基酸前肽(如seq id no.8所示),185个氨基酸组成的成熟酶(如seq id no.9所示)。
54.本发明对不同菌株的pg酶序列进行比较和分析,其中,a4142和9670t的 pg酶氨基酸序列相似度达100%。
55.本发明有益效果在于,第一,本发明提供了一种能够富集高产蛋白质谷氨酰胺酶菌株的培养基,用该富集培养基可以筛选到多株高产蛋白质谷氨酰胺酶的菌株。第二,筛选到高产蛋白质谷氨酰胺酶的菌株,所涉及的解朊金黄杆菌a4142 菌株安全无毒,生长迅速、产酶量高达2.15u/ml,比文献报道的最高酶活解朊金黄杆菌qrd1265提高了532%。第三,了解菌株的生长产酶情况,确定其对数生长期、快速产酶期、酶活最高点,便于更好地指导菌株在实践中的应用。
附图说明
56.图1表示实施例1中本发明涉及的土壤悬液富集培养后稀释涂布情况。
57.图2表示实施例1中本发明涉及的滴加koh菌株颜色的变化。
58.图3表示实施例2中本发明涉及的解朊金黄杆菌(chryseobacteriumproteolyticum a4142)的形态。
59.图4表示实施例4中本发明涉及的解朊金黄杆菌(chryseobacteriumproteolyticum a4142)的生长曲线。
60.图5表示实施例5中本发明涉及的解朊金黄杆菌(chryseobacterium proteolyticum a4142)的产酶曲线。
61.图6表示实施例5中本发明涉及不同菌株的发酵液sds-page,m为蛋白 marker,1为解朊金黄杆菌(chryseobacterium proteolyticum a4142)(16h)发酵液sds-page,箭头表示pg酶条带。
具体实施方式
62.结合以下具体实施例和附图,对本发明作进一步的详细说明。实施本发明的过程、条件、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。
63.本发明中涉及的蛋白质谷氨酰胺酶产生菌为a4142,分类命名:解朊金黄杆菌,拉丁文学名:chryseobacterium proteolyticum,已于2020年7月10日保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为:北京市朝阳区北辰西路1号院3号,保藏编号为cgmcc no.20337。
64.针对本发明所涉及的菌株其发酵产物蛋白质谷氨酰胺酶的制备,采用下述方式具体实施。
65.实施例1产蛋白质谷氨酰胺酶菌株的筛选
66.(1)土壤悬液富集培养
67.其筛选步骤为:
68.在250ml摇瓶中加入90ml蒸馏水,并加入20-30粒玻璃珠,高压蒸汽灭菌 121℃,20min。在超净工作台中,称取10g土壤样品,加入至装有蒸馏水的摇瓶中,30℃、200rpm/min,振荡30min,制成10%(w/v)的土壤悬液。然后放置在超净工作台中,静置。取1%(v/v)土壤悬液至富集培养基(60ml)中, 30℃、200rpm/min,振荡培养5天。
69.所述富集培养基为:乳糖5g,酵母粉11.7g,cbz 1g,k2hpo
4 0.1g,kh2po
4 0.1g,氯化钠0.1g,ph7.2,加蒸馏水定容至1l,115℃灭菌20min。
70.(2)平板初筛
71.将富集后的菌液倍比稀释,选择适当的梯度的菌液,取100μl于lb平板当中,涂布均匀,然后将平板放在30℃的培养箱中,倒置培养3天。然后进行观察。如图1所示,lb平板上有很多形态和颜色不同的菌株,根据文献报道,发酵产pg酶的菌株chryseobacterium proteolyticum 9670t为黄杆菌属,该类菌株呈黄色或黄橙色,且产生flexirubin可逆色素。
72.其中,lb平板中培养基的成分包括:5g酵母粉,10g nacl,10g胰蛋白胨,18g琼脂粉,加蒸馏水定容至1l。
73.如图2所示,挑选黄色或橙色的菌株,转接于新的lb平板中,然后30℃培养2天,向菌株滴加3%(w/v)koh溶液,若菌株颜色变红,加hcl中和后恢复黄色,则该菌株为疑似菌株。
74.(3)菌株发酵产酶能力测定
75.a蛋白质谷氨酰胺酶的发酵培养
76.将经过两次活化的菌液按照5%(v/v)的接种量接种至发酵培养基,30℃、 200rpm/min,培养16h,每隔一段时间测定酶活。其中,发酵培养基成分为: mgso4·
7h2o 0.25g,na2hpo4·
12h2o 3.8g,kh2po40.25 g,feso4·
7h2o 0.05g,乳糖5g,多聚蛋白胨10g,定容至1l,调节ph为7.2,高压蒸汽灭菌115℃, 20min。
77.b蛋白质谷氨酰胺酶的酶活测定
78.发酵液经过10000r/min,4℃,离心20min去菌体得到上清,将上清液稀释 5倍,取0.1ml的上清稀释液加入到试管中,然后向其中加入已预热的0.01mol/l cbz-gln-gly溶液1ml,37℃温浴反应60min,然后加入1ml的三氯乙酸溶液,混合均匀,终止反应。苯酚法测定反应后溶液中氨的含量。a
630
测定吸光值a1。对照组为先加入三氯乙酸溶液后反应60min后再加入底物溶液,其余操作同实验组,测定a
630
为a2。定义每分钟产生1μmol氨所需的酶的量为一个酶活单位(u)。发酵液中酶活计算公式如下:
79.酶活力(u/ml)=(a1-a2)
×
2.1/0.1
×
1/17.03
×
1/60
×a×580.a1:实验组的吸光值;a2:对照组的吸光值;a:氨的标准曲线的斜率。
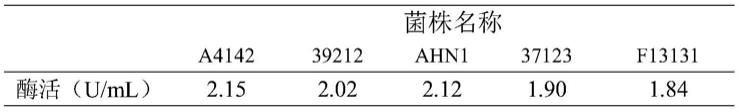
81.菌株发酵产蛋白质谷氨酰胺酶菌株的情况如表1所示:
82.表1菌株发酵产酶情况汇总
[0083][0084]
菌株a4142发酵产pg酶活为2.15u/ml,比文献报道1的最高酶活解朊金黄杆菌qrd1265提高了532%。
[0085]
实施例2产蛋白质谷氨酰胺酶菌株的鉴定
[0086]
将本发明实施例1筛选到的疑似菌株在lb平板上重新划线,得到单菌落,然后观察菌株的颜色、状态,菌落为圆形,菌落状态饱满,边缘光滑,无缺刻,菌落有粘性,如图3所示。
[0087]
随后进行革兰氏染色,菌株呈杆状,不产芽孢,革兰氏阴性。
[0088]
按照生理生化鉴定管的使用说明,首选将菌株进行活化,然后制备成菌悬液,接种于生理生化管中培养24h,观察实验现象并做好记录。其中,“ ”表示菌株呈阳性反应,
“-”
表示菌株呈阴性反应。鉴定结果与日本文献报道的 chryseobacteriumproteolyticum 9670t菌株有差异,表明是一株新的解朊金黄杆菌菌株。
[0089]
表2
[0090][0091]
提取菌株a4142的总基因组dna,并以此为模版,扩增该菌株的16s rdna 序列,其引物序列为:
[0092]
seq id no.1 f:5'-agagtttgatcctggctcag-3'
[0093]
seq id no.2 r:5'-ctacggctaccttgttacga-3'
[0094]
pcr产物经1%琼脂糖凝胶电泳检测后,割胶回收,并送至商业公司测序。测序工作由上海桑尼有限公司完成。将测得的16s rdna序列与在blast数据库中已有细菌的16s rdna序列进行相似性比对,结果表明菌株a4142与解朊金黄杆菌chryseobacterium proteolyticum 9670t同源性最高,达98%,因此该菌株为解朊金黄杆菌。
[0095]
实施例3菌株a4142的蛋白质谷氨酰胺酶的鉴定及分析
[0096]
提取菌株a4142的总基因组dna,并以此为模版,扩增该菌株所产蛋白质谷氨酰胺酶的全长dna序列,其引物序列为:
[0097]
seq id no.3:f-proteolyticum aacttgcttatgttattttttttat
[0098]
seq id no.4:r-proteolyticum ggatgttatcatacaaaaaaataat
[0099]
pcr产物经1%琼脂糖凝胶电泳检测后,割胶回收,并送至上海桑尼公司测序。得到菌株a4142的pg酶的基因序列,即seq id no.5(dna序列共963bp),对该序列进行翻译,得到pg酶蛋白序列,seq id no.6所示,其中,蛋白序列共320个氨基酸,其中21个氨基酸信号肽(如seq id no.7所示),114个氨基酸前肽(如seq id no.8所示),185个氨基酸组成的成熟酶(如seq id no.9 所示)。
[0100]
实施例4蛋白质谷氨酰胺酶生产菌株的生长曲线
[0101]
将菌株(chryseobacterium proteolyticum a4142)接种至种子培养基中,30℃、 200rpm/min,培养12h,再将种子液以5%(v/v)的接种量接种至新的种子培养基中进行再次活化,30℃、200rpm/min,培养12h。其中,种子培养基配方为多聚蛋白胨10g/l,酵母提取物2g/l,无水mgso
4 1g/l,ph为7.0。
[0102]
其生长曲线如图4所示,菌株a4142在2h起快速生长,进入对数生长期, 2-6h为对数生长期,12h后进入稳定期。a4142在12h-22h时,菌浓度od
600
维持在6.5-6.7。
[0103]
实施例5蛋白质谷氨酰胺酶生产菌株的产酶曲线
[0104]
将菌液a4142接种至发酵培养基中,30℃、200rpm/min,每2h取发酵液样品,测定其pg酶活性。
[0105]
用所述方法对菌株a4142酶活进行测定,其产酶曲线如图5所示,菌株a4142 在16h时酶活达到最高点,为2.30u/ml。
[0106]
如图6所示,菌株发酵液sds-page在18.4kd上边有一条条带,与文献报道的pg酶的理论分子量19860一样,证明菌株发酵产生pg酶。
[0107]
参考文献:
[0108]
1.曲瑞丹.蛋白质谷氨酰胺酶产生菌株的筛选、鉴定及培养基优化[d];华东师范大学,2016.
[0109]
2.董新红,赵谋明,蒋跃明.花生蛋白改性的研究进展[j].中国粮油学报, 2011,26(12):109-117.
[0110]
3.yamaguchi s,yokoe m.a novel protein-deamidating enzyme from chryseobacterium proteolyticum sp.nov.,a newly isolated bacterium from soil[j]. applied and environmental microbiology,2000,66(8):3337-3343.
[0111]
4.jiang z q,sontag-strohm t,salovaara h,et al.oat protein solubility andemulsion properties improved by enzymatic deamidation[j].j cereal sci,2015,64: 126-132。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。