1.本发明涉及基因领域,更具体涉及一种有竞争物参与的基因扩增方法,其中竞争物的扩增效率可控。
背景技术:
2.设计包含竞争物的扩增方法,可解决样本质量差异引起的检测信号差异易造成误判的问题,也可以根据竞争物的扩增推测目的基因的拷贝数或目的基因的含量。因此,常常需要应用包含竞争物的扩增方法来扩增目的基因。
3.然而,在实际操作中,由于使用的竞争物为人工合成序列,当竞争物和基因组dna在同一反应孔中扩增时,人工合成的序列纯度高,扩增位阻低,与gdna扩增效率不一致,扩增效率为gdna上千倍以上。因而,不容易调试得到最合适的竞争物浓度。在现有技术中,一般通过不断稀释竞争物来降低其扩增效率,这不仅步骤繁琐,耗时长,而且,低至十分之一pg级别浓度的竞争物还存在可重复性差、当下技术无法准确定量而导致批间差距大、较难稳定保存等问题。另外,由于竞争物扩增效率很高,操作时常出现一不小心混入阴性对照中导致实验失败等问题。
4.因此,本领域急需一种有可控的竞争物参与的基因扩增方法。
技术实现要素:
5.本发明的目的是提供一种竞争物的扩增效率可控的基因扩增方法,并有效地利用于扩增。
6.一方面,本发明提供了一种扩增方法,包括利用一对锁核酸修饰的扩增引物对目的基因及其竞争物同时进行扩增。
7.在一个优选例中,其用于控制所述竞争物的扩增效率,以使所述竞争物的扩增效率接近或优选等于所述目的基因的扩增效率。
8.在一个优选例中,其中所述扩增引物对中的一个或两个引物被锁核酸修饰;优选其中所述扩增引物对中的一个或两个引物的一个或多个位置的碱基被锁核酸修饰;更优选其中所述扩增引物对中的一个或两个引物的3’末端的碱基被锁核酸修饰。
9.在一个优选例中,其中所述目的基因选自下组的基因或其组合:smn1、smn2、alk、ret、ros1、ntrk1、ntrk2、ntrk3。
10.在一个优选例中,其中扩增引物对选自seq id no:1-72中所述序列或其不同组合。
11.在一个优选例中,其中所述竞争物包含一段与所述目的基因序列相比存在不同碱基的核苷酸序列,所述不同碱基的数量为1、2、3、4、5、6、7、8、9或10个。
12.在一个优选例中,所述不同碱基中的至少1个位于竞争物对应于扩增引物对的核苷酸序列之中;优选地,所述不同碱基中的至少1个位于竞争物对应于扩增引物对被锁核酸修饰的碱基的核苷酸位点。
13.在一个优选例中,其中所述扩增引物对中的一个或两个引物的3’末端的碱基被锁核酸修饰,且所述扩增引物对中被锁核酸修饰的碱基对应的所述目的基因的碱基和其竞争物的碱基不同。
14.在一个优选例中,所述竞争物为人工合成的单链或双链核酸分子;优选为人工合成的单链或双链dna分子;更优选为人工合成的质粒。
15.在一个优选例中,其中所述竞争物选自seq id no:113-145中所述序列或其不同组合。
16.在一个优选例中,所述竞争物的终浓度为0.05-250ng/μl、0.1-200ng/μl、0.1-150ng/μl、0.1-100ng/μl、0.1-90ng/μl、0.1-80ng/μl、0.1-70ng/μl、0.1-60ng/μl、0.1-50ng/μl、0.1-40ng/μl、0.1-30ng/μl、0.1-20ng/μl、0.1-10ng/μl、0.5-100ng/μl、0.5-90ng/μl、0.5-80ng/μl、0.5-70ng/μl、0.5-60ng/μl、0.5-50ng/μl、0.5-40ng/μl、0.5-30ng/μl、0.5-20ng/μl、0.5-10ng/μl、1-100ng/μl、1-90ng/μl、1-80ng/μl、1-70ng/μl、1-60ng/μl、1-50ng/μl、1-40ng/μl、1-30ng/μl、1-20ng/μl、1-10ng/μl、5-100ng/μl、5-90ng/μl、5-80ng/μl、5-70ng/μl、5-60ng/μl、5-50ng/μl、5-40ng/μl、5-30ng/μl、5-20ng/μl、5-10ng/μl、10-100ng/μl、10-90ng/μl、10-80ng/μl、10-70ng/μl、10-60ng/μl、10-50ng/μl、10-40ng/μl、10-30ng/μl或10-20ng/μl。
17.在一个优选例中,所述竞争物的加样量为5-80ng、10-70ng、15-60ng、20-50ng、20-40ng或20-30ng,优选为20-40ng。
18.在一个优选例中,所述扩增方法用于基质辅助激光解吸电离飞行时间质谱、taqman-pcr、二代测序、毛细管电泳分析或数字pcr等技术中。
19.另一方面,本发明提供了一种试剂盒,其包括一对锁核酸修饰的扩增引物对以及目的基因的竞争物。
20.在一个优选例中,所述试剂盒还包含选自下组的扩增试剂:dntp、dna聚合酶、mgcl2及其组合。
21.在一个优选例中,其中所述扩增引物对中的一个或两个引物被锁核酸修饰;优选其中所述扩增引物对中的一个或两个引物的一个或多个位置的碱基被锁核酸修饰;更优选其中所述扩增引物对中的一个或两个引物的3’末端的碱基被锁核酸修饰。
22.在一个优选例中,其中所述扩增引物对选自seq id no:1-72中所述序列或其不同组合。
23.在一个优选例中,其中所述竞争物包含一段与所述目的基因序列相比存在不同碱基的核苷酸序列,所述不同碱基的数量为1、2、3、4、5、6、7、8、9或10个。
24.在一个优选例中,所述不同碱基中的至少1个位于竞争物对应于扩增引物对的核苷酸序列之中;优选地,所述不同碱基中的至少1个位于竞争物对应于扩增引物对被锁核酸修饰的碱基的核苷酸位点。
25.在一个优选例中,其中所述扩增引物对中的一个或两个引物的3’末端的碱基被锁核酸修饰,且所述扩增引物对中被锁核酸修饰的碱基对应的所述目的基因的碱基和其竞争物的碱基不同。
26.在一个优选例中,所述竞争物为人工合成的单链或双链核酸分子;优选为人工合成的单链或双链dna分子;更优选为人工合成的质粒。
27.在一个优选例中,其中所述竞争物选自seq id no:113-145中所述序列或其不同组合。
28.在一个优选例中,所述竞争物的终浓度为0.05-250ng/μl、0.1-200ng/μl、0.1-150ng/μl、0.1-100ng/μl、0.1-90ng/μl、0.1-80ng/μl、0.1-70ng/μl、0.1-60ng/μl、0.1-50ng/μl、0.1-40ng/μl、0.1-30ng/μl、0.1-20ng/μl、0.1-10ng/μl、0.5-100ng/μl、0.5-90ng/μl、0.5-80ng/μl、0.5-70ng/μl、0.5-60ng/μl、0.5-50ng/μl、0.5-40ng/μl、0.5-30ng/μl、0.5-20ng/μl、0.5-10ng/μl、1-100ng/μl、1-90ng/μl、1-80ng/μl、1-70ng/μl、1-60ng/μl、1-50ng/μl、1-40ng/μl、1-30ng/μl、1-20ng/μl、1-10ng/μl、5-100ng/μl、5-90ng/μl、5-80ng/μl、5-70ng/μl、5-60ng/μl、5-50ng/μl、5-40ng/μl、5-30ng/μl、5-20ng/μl、5-10ng/μl、10-100ng/μl、10-90ng/μl、10-80ng/μl、10-70ng/μl、10-60ng/μl、10-50ng/μl、10-40ng/μl、10-30ng/μl或10-20ng/μl。
29.在一个优选例中,所述竞争物的加样量为5-80ng、10-70ng、15-60ng、20-50ng、20-40ng或20-30ng,优选为20-40ng。
30.在一个优选例中,所述试剂盒用于在受试者中检测脊髓性肌萎缩症。
31.在一个优选例中,所述试剂盒用于在受试者中检测癌症;优选检测肺癌、血液肿瘤、甲状腺癌、胆管癌、软组织肉瘤、乳腺癌、胃癌、食管癌或结直肠癌。
32.另一方面,本发明还提供了所述试剂盒用于在对目的基因及其竞争物同时进行扩增中控制所述竞争物的扩增效率的用途。
33.在一个优选例中,所述试剂盒用于扩增选自下组的基因或其组合:smn1、smn2、alk、ret、ros1、ntrk1、ntrk2、ntrk3。
34.另一方面,本发明还提供了锁核酸在对目的基因及其竞争物同时进行扩增中控制所述竞争物的扩增效率的用途。
35.在一个优选例中,其中所述锁核酸用于修饰扩增目的基因和其竞争物的引物对。
36.在一个优选例中,其中所述目的基因选自下组的基因或其组合:smn1、smn2、alk、ret、ro1、ntrk1、ntrk2、ntrk3。
37.在一个优选例中,其中所述引物对选自seq id no:1-72中所述的引物序列。
38.另一方面,本发明还提供了锁核酸修饰的引物对在对目的基因及其竞争物同时进行扩增中控制所述竞争物的扩增效率的用途。
39.在一个优选例中,其中所述扩增引物对选自seq id no:1-72中所述序列或其组合。
40.在一个优选例中,其中所述目的基因的竞争物序列(5
’→3’
)选自seq id no:113-145中所述序列或其组合。
41.在上下文中,在本发明的所有技术方案中,所述的扩增引物对、竞争物和/或延伸引物可进一步地优选地组合,例如:
42.在一个具体的优选例中,其中所述扩增引物对选自seq id no:1-10中所述序列或其组合,所述竞争物选自seq id no:113-117中所述序列或其组合;其中所述优选例用于检测smn1和/或smn2基因的基因突变和/或拷贝数。在进一步的优选例中,其中还包含延伸引物,所述延伸引物选自seq id no:73-79中所述序列或其组合。
43.在一个具体的优选例中,其中所述扩增引物对选自seq id no:17-44中所述序列
或其组合,所述竞争物选自seq id no:118-131中所述序列或其组合;其中所述优选例用于检测alk和/或ret和/或ros1基因的基因融合突变。在进一步的优选例中,其中还包含延伸引物,所述延伸引物选自seq id no:85-98中所述序列或其组合。
44.在一个具体的优选例中,其中所述扩增引物对选自seq id no:45-72中所述序列或其组合,所述竞争物选自seq id no:132-145中所述序列或其组合;其中所述优选例用于检测ntrk1和/或ntrk2和/或ntrk3基因的基因融合突变。在进一步的优选例中,其中还包含延伸引物,所述延伸引物选自seq id no:99-112中所述序列或其组合。
45.在一个具体的优选例中,其中所述扩增引物对序列为smn1-2_e5_f(seq id no:3)和smn1-2_e5_r(seq id no:4),以及所述目的基因的竞争物序列(5
’→3’
)为smn1-2_e5_qc(seq id no:114)。优选地,所述延伸引物序列为smn1-2_e5_w1_e(seq id no:74)。
46.在一个具体的优选例中,其中所述扩增引物对序列为smn1-2_e6_f(seq id no:5),和smn1-2_e6_r(seq id no:6),以及所述目的基因的竞争物序列(5
’→3’
)为smn1-2_e6_qc(seq id no:115)。优选地,所述延伸引物序列为smn1-2_e6_w1_e(seq id no:75)。
47.在一个具体的优选例中,其中所述扩增引物对序列为smn1-2_e7_ty_tyi_w1_f(seq id no:7),和smn1-2_e7_ty_tyi_w1_r(seq id no:8),以及所述目的基因的竞争物序列(5
’→3’
)为smn1-2_e7_qc(seq id no:116)。优选地,所述延伸引物序列为smn1-2_e7_ty_w1_e(seq id no:76)或smn1-2_e7_tyi_w1_e(seq id no:77)。
48.在一个具体的优选例中,其中所述扩增引物对序列为smn1-2_e8_ty_tyi_w1_f(seq id no:9),和smn1-2_e8_ty_tyi_w1_r(seq id no:10),以及所述目的基因的竞争物序列(5
’→3’
)为smn1-2_e8_qc(seq id no:117)。。优选地,所述延伸引物序列为smn1-2_e8_ty_w1_e(seq id no:78)或smn1-2_e8_tyi_w1_e(seq id no:79)。
49.在一个具体的优选例中,其中所述扩增引物对序列为rpp40_f(seq id no:1),和rpp40_r(seq id no:2),以及所述目的基因的竞争物序列(5
’→3’
)为rpp40_qc(seq id no:113)。优选地,所述延伸引物序列为rpp40#2_w1_e(seq id no:73)。
50.在另一个具体的优选例中,其中所述扩增引物对序列为alk_01-02_f(seq id no:21),和alk_01-02_r(seq id no:22),以及所述目的基因的竞争物序列(5
’→3’
)为alk_01-02_qc(seq id no:120)。优选地,所述延伸引物序列为alk_01-02_e(seq id no:87)。
51.在另一个具体的优选例中,其中所述扩增引物对序列为alk_21-22_f(seq id no:23),和alk_21-22_r(seq id no:24),以及所述目的基因的竞争物序列(5
’→3’
)为alk_21-22_qc(seq id no:121)。优选地,所述延伸引物序列为alk_21-22_e(seq id no:88)。
52.在另一个具体的优选例中,其中所述扩增引物对序列为alk_22-23_f(seq id no:25),和alk_22-23_r(seq id no:26),以及所述目的基因的竞争物序列(5
’→3’
)为alk_22-23_qc(seq id no:122)。优选地,所述延伸引物序列为alk_22-23_e(seq id no:89)。
53.在另一个具体的优选例中,其中所述扩增引物对序列为alk_23-24_f(seq id no:27),和alk_23-24_r(seq id no:28),以及所述目的基因的竞争物序列(5
’→3’
)为alk_23-24_qc(seq id no:123)。优选地,所述延伸引物序列为alk_23-24_e(seq id no:90)。
54.在另一个具体的优选例中,其中所述扩增引物对序列为ret_02-03_f(seq id no:29),和ret_02-03_r(seq id no:30),以及所述目的基因的竞争物序列(5
’→3’
)为ret_02-03_qc(seq id no:124)。优选地,所述延伸引物序列为ret_02-03_e(seq id no:91)。
55.在另一个具体的优选例中,其中所述扩增引物对序列为ret_04-05_f(seq id no:31),和ret_04-05_r(seq id no:32),以及所述目的基因的竞争物序列(5
’→3’
)为ret_04-05_qc(seq id no:125)。优选地,所述延伸引物序列为ret_04-05_e(seq id no:92)。
56.在另一个具体的优选例中,其中所述扩增引物对序列为ret_12-13_f(seq id no:33),和ret_12-13_r(seq id no:34),以及所述目的基因的竞争物序列(5
’→3’
)为ret_12-13_qc(seq id no:126)。优选地,所述延伸引物序列为ret_12-13_e(seq id no:93)。
57.在另一个具体的优选例中,其中所述扩增引物对序列为ret_13-14_f(seq id no:35),和ret_13-14_r(seq id no:36),以及所述目的基因的竞争物序列(5
’→3’
)为ret_13-14_qc(seq id no:127)。优选地,所述延伸引物序列为ret_13-14_e(seq id no:94)。
58.在另一个具体的优选例中,其中所述扩增引物对序列为ros1_01-02_f(seq id no:37),和ros1_01-02_r(seq id no:38),以及所述目的基因的竞争物序列(5
’→3’
)为ros1_01-02_qc(seq id no:128)。优选地,所述延伸引物序列为ros1_01-02_e(seq id no:95)。
59.在另一个具体的优选例中,其中所述扩增引物对序列为ros1_04-05_f(seq id no:39),和ros1_04-05_r(seq id no:40),以及所述目的基因的竞争物序列(5
’→3’
)为ros1_04-05_qc(seq id no:129)。优选地,所述延伸引物序列为ros1_04-05_e(seq id no:96)。
60.在另一个具体的优选例中,其中所述扩增引物对序列为ros1_35-36_f(seq id no:41),和ros1_35-36_r(seq id no:42),以及所述目的基因的竞争物序列(5
’→3’
)为ros1_35-36_qc(seq id no:130)。优选地,所述延伸引物序列为ros1_35-36_e(seq id no:97)。
61.在另一个具体的优选例中,其中所述扩增引物对序列为ros1_37-38_f(seq id no:43),和ros1_37-38_r(seq id no:44),以及所述目的基因的竞争物序列(5
’→3’
)为ros1_37-38_qc(seq id no:131)。优选地,所述延伸引物序列为ros1_37-38_e(seq id no:98)。
62.在另一个具体的优选例中,其中所述扩增引物对序列为eml4_11-12_f(seq id no:17),和eml4_11-12_r(seq id no:18),以及所述目的基因的竞争物序列(5
’→3’
)为eml4_11-12_qc(seq id no:118)。优选地,所述延伸引物序列为eml4_11-12_e(seq id no:85)。
63.在另一个具体的优选例中,其中所述扩增引物对序列为eml4_13-14_f(seq id no:19),和eml4_13-14_r(seq id no:20),以及所述目的基因的竞争物序列(5
’→3’
)为eml4_13-14_qc(seq id no:119)。优选地,所述延伸引物序列为eml4_13-14_e(seq id no:86)。
64.在又一个具体的优选例中,其中所述扩增引物对序列为ntrk1_07-08_f(seq id no:49),和ntrk1_07-08_r(seq id no:50),以及所述目的基因的竞争物序列(5
’→3’
)为ntrk1_07-08_qc(seq id no:134)。优选地,所述延伸引物序列为ntrk1_07-08_e(seq id no:101)。
65.在又一个具体的优选例中,其中所述扩增引物对序列为ntrk1_08-09_f(seq id no:51),和ntrk1_08-09_r(seq id no:52),以及所述目的基因的竞争物序列(5
’→3’
)为
no:71),和ntrk3_15-16_r(seq id no:72),以及所述目的基因的竞争物序列(5
’→3’
)为ntrk3_15-16_qc(seq id no:145)。优选地,所述延伸引物序列为ntrk3_15-16_e(seq id no:112)。
76.在又一个具体的优选例中,其中所述扩增引物对序列为tpm3_08-09_f(seq id no:45),和tpm3_08-09_r(seq id no:46),以及所述目的基因的竞争物序列(5
’→3’
)为tpm3_08-09_qc(seq id no:132)。优选地,所述延伸引物序列为tpm3_08-09_e(seq id no:99)。
77.在又一个具体的优选例中,其中所述扩增引物对序列为tpm3_10-11_f(seq id no:47),和tpm3_10-11_r(seq id no:48),以及所述目的基因的竞争物序列(5
’→3’
)为tpm3_10-11_qc(seq id no:133)。优选地,所述延伸引物序列为tpm3_10-11_e(seq id no:100)。
78.在上述的优选例中,所述的扩增引物对、竞争物和/或延伸引物的组合还可进一步组合为包括多个扩增引物对、多个竞争物和/或多个延伸引物的组合。
附图说明
79.图1显示了样本11、17、20、21的smn1和smn2基因的第5外显子扩增产物的质谱结果。
80.图2显示了样本11、17、20、21的smn1和smn2基因的第6外显子扩增产物的质谱结果。
81.图3显示了样本11、17、20、21的smn1和smn2基因的第7外显子扩增产物的质谱结果。
82.图4显示了样本11、17、20、21的smn1和smn2基因的第8外显子扩增产物的质谱结果。
83.图5显示了样本11、17、20、21的rpp40基因扩增产物的质谱结果。
84.图6显示了使用锁核酸修饰的引物和非锁核酸修饰的引物扩增产物的质谱结果。
85.图7显示了使用锁核酸修饰的引物和非锁核酸修饰的引物扩增smn1-2_e5的qpcr扩增曲线,其中共做了1、2、3、4四个样品,每个样品做了3个重复试验,1指smn1-2_e5投料5ng非锁核酸引物,2指smn1-2_e5投料1ng非锁核酸引物,3指smn1-2_e5投料5ng锁核酸引物,4指smn1-2_e5投料1ng锁核酸引物。
86.图8显示了使用锁核酸修饰的引物和非锁核酸修饰的引物扩增rpp40的qpcr扩增曲线,其中共做了1、2、3、4四个样品,每个样品做了3个重复试验,1指rpp40投料5ng非锁核酸引物,2指rpp40投料1ng非锁核酸引物,3指rpp40投料5ng锁核酸引物(靠近数字3的三条重复试验曲线),4指rpp40投料1ng锁核酸引物(靠近数字4的三条重复试验曲线)。
87.图9显示了alk基因的massarray质谱结果对比。
88.图10显示了ros1基因的massarray质谱结果对比。
89.图11显示了ret基因的massarray质谱结果对比。
90.图12显示了eml4基因的massarray质谱结果对比。
91.图13显示了ntrk1基因的massarray质谱结果对比。
92.图14显示了ntrk2基因的massarray质谱结果对比。
atrophy type ii,smn2)、儿童期或青少年起病的脊肌萎缩症ⅲ型(spinal muscular atrophy typeⅲ,sma3,也称作kugelherg-welander disease)和成年起病的脊肌萎缩症ⅳ型(spinal muscular atrophy typeⅳ,sma4)。4种亚型的sma致病基因相同,为运动神经元存活基因1(survival motor neuronl,smn1)[omim600354]。smn1基因位于5号染色体,全长约20kb,含9个外显子。与其紧邻的smn2和smn1高度同源,仅有5个核昔酸的差异。smn2为调节基因,其拷贝数与sma的病情严重程度成反比。
[0105]
alk中文名为间变性淋巴瘤激酶(anaplastic lymphoma kinase),此基因负责编码一种称为alk的受体酪氨酸激酶(receptor tyrosine kinase,rtk),其属于受体酪氨酸激酶家族的成员之一;alk基因常见的致病性突变为基因重排,包括易位和倒位。alk基因重排使alk在未形成二聚体前允许磷酸化过程的发生,也因此alk融合蛋白将持续处于激活状态,并激活其下游通路,进而造成细胞过度增殖,导致肿瘤的发生。
[0106]
ros1为原癌基因,在多种肿瘤细胞系中高度表达,ros1属于酪氨酸激酶胰岛素受体的的家族成员之一。其所编码的蛋白为具有酪氨酸激酶活性的i型膜内蛋白,可作为生长因子或分化因子的受体;ros1基因常见的致病性突变为基因重排,其所导致的ros1融合蛋白将成为处于持续激活状态的酪氨酸激酶,这会激活其下游通路的信号,进而造成细胞过度生长及增殖。
[0107]
ret属原癌基因,负责编码一种称为ret的跨膜蛋白,该蛋白属于一种受体酪氨酸激酶;ret基因发生致病性突变——突变或重排,进而激活ret基因,并可能编码出具有异常活动的ret蛋白,其将传递异常信号并造成多方面的影响:包括细胞生长、生存、侵袭、转移等。持续的信号传递会造成细胞的过度增殖,因此导致肿瘤的发生与进展。
[0108]
nrtk:神经营养型受体酪氨酸激酶(neurotrophic receptor kinase)。ntrk基因包括三种亚型:ntrk1、ntrk2、ntrk3,分别位于不同染色体上。ntrk编码的蛋白叫做trk蛋白,ntrk1、ntrk2、ntrk3分别编码trka、trkb、trkc三种蛋白。ntrk基因融合突变是由ntrk基因家族成员(ntrk1、ntrk2、ntrk3)与另一个不相关的基因(通常为管家基因)融合在一起,编码的trk融合蛋白处于结构性激活状态,引发持续性的信号级联反应,驱动细胞的恶性增殖,引发癌变。
[0109]
基因融合突变是指将两个或多个基因的编码区首尾相连。置于同一套调控序列(包括启动子、增强子、核糖体结合序列、终止子等)控制之下,构成的嵌合基因。上述的alk、ros1、ret、ntrk1、ntrk2、ntrk3基因融合突变检测对临床诊疗及判断预后都具有十分重要的意义,对临床选择靶向药物也有重要的指导作用。
[0110]
竞争物
[0111]
本发明的上下文中,“竞争物”是指,与待测样品存在至少1个核苷酸的差异,且已知分子量和/或序列和/或含量的物质。将其加入至待测样品中,以该物质的含量为标准,对比测定待测样品的含量。本领域中也将竞争物称为竞争底物、内标物、内对照dna、竞争性寡核苷酸等。
[0112]
所述竞争物具有独特的特征。不同区域的竞争物常具有不同的特征。竞争物可由天然的和/或非天然的核苷酸(例如带标记的核苷酸)或其混合物组成。适用于本发明的竞争物可采用已知技术合成并标记。竞争物可按照任何已知的合适方法化学合成或纯化。
[0113]
在一些实施方式中,针对特定区域所用的竞争物的长度相同。在另一些实施方式
中,针对不同区域所用的竞争物的长度不同。
[0114]
锁核酸
[0115]
本发明提供了一种锁核酸的用途,用于对目的基因及其竞争物同时进行扩增中控制所述竞争物的扩增效率,以使所述竞争物的扩增效率接近或优选等于所述目的基因的扩增效率。在一个优选例中,其中所述锁核酸用于修饰扩增目的基因和其竞争物的引物对。
[0116]
本发明提供了一种锁核酸修饰的引物的用途,用于对目的基因及其竞争物同时进行扩增中控制所述竞争物的扩增效率,以使所述竞争物的扩增效率接近或优选等于所述目的基因的扩增效率。
[0117]
锁核酸(locked nucleic acid,lna)是一种人工合成的反义寡核苷酸,是一种特殊的双环状核苷酸衍生物,其中核苷酸残基的核糖环(β-d-呋喃核糖)的2
’‑
氧和4
’‑
碳通过缩水作用形成亚甲基连接,结构中含有一个或多个2
’‑
o-4
’‑
c-亚甲基-β-d-呋喃核糖核酸单体,核糖的2
’‑
o位和4
’‑
c位通过不同的缩水作用形成氧亚甲基桥、硫亚甲基桥或胺亚甲基桥,并连接成环形,这个环形桥锁定了呋喃糖c3
’‑
内型的n构型,降低了核糖结构的柔韧性,增加了磷酸盐骨架局部结构的稳定性。由于lna与dna/rna在结构上具有相同的磷酸盐骨架,故其对dna、rna有很好的识别能力和强大的亲和力。一般将锁核酸掺入pcr探针中,这种pcr探针可溶于水和标准缓冲液,并遵循watson-crick碱基配对规则,相比与天然状态dna碱基,它具有多种优势,包括:热稳定性和杂交特异性更高,基因定量和等位基因鉴别更准确,针对有问题的靶序列,探针设计更容易、更灵活。
[0118]
本发明使用锁核酸修饰的引物对,同时优选地所述引物与扩增的目的基因对应的序列末端相同,而所述引物与扩增的目的基因对应的序列末端不同,即所述引物与扩增的目的基因的竞争物对应的序列末端存在错配。且本发明的具体实施方式中,用于同时扩增目的基因和目的基因的竞争物的引物对中的一个或两个存在锁核酸修饰,都可以显著地降低人工合成的低扩增位阻的竞争物的扩增效率。
[0119]
在一个具体的实施方式中,其中所述扩增引物对选自表1所示序列或其组合。
[0120]
核酸扩增方法
[0121]
本发明提供了一种扩增方法,包括利用一对锁核酸修饰的扩增引物对目的基因及其竞争物同时进行扩增。在一个优选例中,其用于控制所述竞争物的扩增效率,以使所述竞争物的扩增效率接近或优选等于所述目的基因的扩增效率。
[0122]
在一个具体的实施方式中,其中所述扩增引物对中的一个或两个引物被锁核酸修饰;优选其中所述扩增引物对中的一个或两个引物的一个或多个位置的碱基被锁核酸修饰;更优选其中所述扩增引物对中的一个或两个引物的3’末端的碱基被锁核酸修饰。
[0123]
在一个具体的实施方式中,其中所述目的基因选自下组的基因或其组合:smn1、smn2、alk、ret、ros1、ntrk1、ntrk2、ntrk3。
[0124]
在一个优选的实施方式中,其中扩增引物对选自seq id no:1-72中所述序列或其组合。
[0125]
在一个具体的实施方式中,其中所述竞争物包含一段与所述目的基因序列相比存在不同碱基的核苷酸序列,所述不同碱基的数量为1、2、3、4、5、6、7、8、9或10个。在一个优选例中,所述不同碱基中的至少1个位于竞争物对应于扩增引物对的核苷酸序列之中;优选地,所述不同碱基中的至少1个位于竞争物对应于扩增引物对被锁核酸修饰的碱基的核苷
酸位点。
[0126]
在一个具体的实施方式中,其中所述扩增引物对中的一个或两个引物的3’末端的碱基被锁核酸修饰,且所述扩增引物对中被锁核酸修饰的碱基对应的所述目的基因的碱基和其竞争物的碱基不同。
[0127]
在一个具体的实施方式中,所述竞争物为人工合成的单链或双链核酸分子;优选为人工合成的单链或双链dna分子;更优选为人工合成的质粒。
[0128]
在一个具体的实施方式中,其中所述竞争物选自seq id no:113-145中所述序列或其组合。
[0129]
在一个具体的实施方式中,所述竞争物的终浓度为0.05-250ng/μl、0.1-200ng/μl、0.1-150ng/μl、0.1-100ng/μl、0.1-90ng/μl、0.1-80ng/μl、0.1-70ng/μl、0.1-60ng/μl、0.1-50ng/μl、0.1-40ng/μl、0.1-30ng/μl、0.1-20ng/μl、0.1-10ng/μl、0.5-100ng/μl、0.5-90ng/μl、0.5-80ng/μl、0.5-70ng/μl、0.5-60ng/μl、0.5-50ng/μl、0.5-40ng/μl、0.5-30ng/μl、0.5-20ng/μl、0.5-10ng/μl、1-100ng/μl、1-90ng/μl、1-80ng/μl、1-70ng/μl、1-60ng/μl、1-50ng/μl、1-40ng/μl、1-30ng/μl、1-20ng/μl、1-10ng/μl、5-100ng/μl、5-90ng/μl、5-80ng/μl、5-70ng/μl、5-60ng/μl、5-50ng/μl、5-40ng/μl、5-30ng/μl、5-20ng/μl、5-10ng/μl、10-100ng/μl、10-90ng/μl、10-80ng/μl、10-70ng/μl、10-60ng/μl、10-50ng/μl、10-40ng/μl、10-30ng/μl或10-20ng/μl。
[0130]
在一个优选实施方式中,所述竞争物的加样量为5-80ng、10-70ng、15-60ng、20-50ng、20-40ng或20-30ng,优选为20-40ng。
[0131]
在一个优选实施方式中,本文上述的扩增方法可用于基质辅助激光解吸电离飞行时间质谱、taqman-pcr、二代测序、毛细管电泳分析或数字pcr等技术中。
[0132]
核酸扩增试剂盒
[0133]
本发明提供了一种试剂盒,其包括一对锁核酸修饰的扩增引物对以及目的基因的竞争物。在一个优选实施方式中,所述试剂盒还包含选自下组的扩增试剂:dntp、dna聚合酶、mgcl2及其组合。
[0134]
在一个具体的实施方式中,其中所述扩增引物对中的一个或两个引物被锁核酸修饰;优选其中所述扩增引物对中的一个或两个引物的一个或多个位置的碱基被锁核酸修饰;更优选其中所述扩增引物对中的一个或两个引物的3’末端的碱基被锁核酸修饰。
[0135]
在一个具体的实施方式中,其中所述扩增引物对选自seq id no:1-72中所述序列或其组合。
[0136]
在一个具体的实施方式中,其中所述竞争物包含一段与所述目的基因序列相比存在不同碱基的核苷酸序列,所述不同碱基的数量为1、2、3、4、5、6、7、8、9或10个。
[0137]
在一个优选例中,所述不同碱基中的至少1个位于竞争物对应于扩增引物对的核苷酸序列之中;优选地所述不同碱基中的至少1个位于竞争物对应于扩增引物对被锁核酸修饰的碱基的核苷酸位点。
[0138]
在一个具体的实施方式中,其中所述扩增引物对中的一个或两个引物的3’末端的碱基被锁核酸修饰,且所述扩增引物对中被锁核酸修饰的碱基对应的所述目的基因的碱基和其竞争物的碱基不同。
[0139]
在一个具体的实施方式中,所述竞争物为人工合成的单链或双链核酸分子;优选
为人工合成的单链或双链dna分子;更优选为人工合成的质粒。
[0140]
在一个具体的实施方式中,其中所述竞争物选自seq id no:113-145中所述序列或其组合。
[0141]
在一个具体的实施方式中,所述竞争物的终浓度为0.05-250ng/μl、0.1-200ng/μl、0.1-150ng/μl、0.1-100ng/μl、0.1-90ng/μl、0.1-80ng/μl、0.1-70ng/μl、0.1-60ng/μl、0.1-50ng/μl、0.1-40ng/μl、0.1-30ng/μl、0.1-20ng/μl、0.1-10ng/μl、0.5-100ng/μl、0.5-90ng/μl、0.5-80ng/μl、0.5-70ng/μl、0.5-60ng/μl、0.5-50ng/μl、0.5-40ng/μl、0.5-30ng/μl、0.5-20ng/μl、0.5-10ng/μl、1-100ng/μl、1-90ng/μl、1-80ng/μl、1-70ng/μl、1-60ng/μl、1-50ng/μl、1-40ng/μl、1-30ng/μl、1-20ng/μl、1-10ng/μl、5-100ng/μl、5-90ng/μl、5-80ng/μl、5-70ng/μl、5-60ng/μl、5-50ng/μl、5-40ng/μl、5-30ng/μl、5-20ng/μl、5-10ng/μl、10-100ng/μl、10-90ng/μl、10-80ng/μl、10-70ng/μl、10-60ng/μl、10-50ng/μl、10-40ng/μl、10-30ng/μl或10-20ng/μl。
[0142]
在一个优选实施方式中,所述竞争物的加样量为5-80ng、10-70ng、15-60ng、20-50ng、20-40ng或20-30ng,优选为20-40ng。
[0143]
在一个优选实施方式中,所述试剂盒用于在受试者中检测脊髓性肌萎缩症(sma)(例如由smn1或smn2基因突变或拷贝数异常引起)。
[0144]
在一个优选实施方式中,所述试剂盒用于在受试者中检测癌症;例如,以下基因的融合突变形成的癌症:alk(如肺癌、血液肿瘤),ros1(如肺癌),ret(如肺癌、甲状腺癌),ntrk(如多种成人和儿童肿瘤),fgfr(胆管癌、肺鳞癌)以及其他多个融合基因(血液肿瘤、软组织肉瘤),以及拷贝数异常(cnv),例如her2(乳腺癌、胃癌、食管癌、结直肠癌)等。
[0145]
本发明还提供了所述试剂盒用于在对目的基因及其竞争物同时进行扩增中控制所述竞争物的扩增效率的用途。
[0146]
在一个优选的实施方式中,其中所述扩增引物对序列选自seq id no:1-72所述序列。
[0147]
在一个优选的实施方式中,其中所述目的基因的竞争物序列选自seq id no:113-145所示序列。
[0148]
在本发明的上下文中,在一个具体的实施方式中,其中所述试剂盒中,所述扩增引物对选自seq id no:1-10所述序列或其组合,所述竞争物选自seq id no:113-117所述序列或其组合;其中所述试剂盒可用于检测smn1和/或smn2基因的基因突变和/或拷贝数。在进一步的实施方式中,其中还包含延伸引物,所述延伸引物选自seq id no:73-79所述序列或其组合。
[0149]
在一个具体的实施方式中,其中所述试剂盒中,其中所述扩增引物对选自seq id no:17-44所述序列或其组合,所述竞争物选自seq id no:118-131所述序列或其组合;其中所述试剂盒可用于检测alk和/或ret和/或ros1基因的基因融合突变。在进一步的实施方式中,其中还包含延伸引物,所述延伸引物选自seq id no:85-98所述序列或其组合。
[0150]
在一个具体的实施方式中,其中所述试剂盒中,其中所述扩增引物对选自seq id no:45-72所述序列或其组合,所述竞争物选自seq id no:132-145所述序列或其组合;其中所述试剂盒可用于检测ntrk1和/或ntrk2和/或ntrk3基因的基因融合突变。在进一步的实施方式中,其中还包含延伸引物,所述延伸引物选自seq id no:99-112所述序列或其组合。
[0151]
在一个优选的实施方式中,所述试剂盒为smn1和smn2的第5外显子的扩增试剂盒,其中所述扩增引物对序列为smn1-2_e5_f(seq id no:3),和smn1-2_e5_r(seq id no:4),以及所述目的基因的竞争物序列(5
’→3’
)为smn1-2_e5_qc(seq id no:114)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为smn1-2_e5_w1_e(seq id no:74)。
[0152]
在一个优选的实施方式中,所述试剂盒为smn1和smn2的第6外显子的扩增试剂盒,其中所述扩增引物对序列为smn1-2_e6_f(seq id no:5),和smn1-2_e6_r(seq id no:6),以及所述目的基因的竞争物序列(5
’→3’
)为smn1-2_e6_qc(seq id no:115)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为smn1-2_e6_w1_e(seq id no:75)。
[0153]
在一个优选的实施方式中,所述试剂盒为smn1和smn2的第7外显子的扩增试剂盒,其中所述扩增引物对序列为smn1-2_e7_ty_tyi_w1_f(seq id no:7),和smn1-2_e7_ty_tyi_w1_r(seq id no:8),以及所述目的基因的竞争物序列(5
’→3’
)为smn1-2_e7_qc(seq id no:116)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为smn1-2_e7_ty_w1_e(seq id no:76)或smn1-2_e7_tyi_w1_e(seq id no:77)。
[0154]
在一个优选的实施方式中,所述试剂盒为smn1和smn2的第8外显子的扩增试剂盒,其中所述扩增引物对序列为smn1-2_e8_ty_tyi_w1_f(seq id no:9),和smn1-2_e8_ty_tyi_w1_r(seq id no:10),以及所述目的基因的竞争物序列(5
’→3’
)为smn1-2_e8_qc(seq id no:117)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为smn1-2_e8_ty_w1_e(seq id no:78)或smn1-2_e8_tyi_w1_e(seq id no:79)。
[0155]
在一个优选的实施方式中,所述试剂盒为rpp40的第6内含子的扩增试剂盒,其中所述扩增引物对序列为:rpp40_f(seq id no:1),和rpp40_r(seq id no:2),以及所述目的基因的竞争物序列(5
’→3’
)为rpp40_qc(seq id no:113)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为rpp40#2_w1_e(seq id no:73)。
[0156]
在一个优选的实施方式中,所述试剂盒为alk的第1和第2外显子的扩增试剂盒,其中所述扩增引物对序列为alk_01-02_f(seq id no:21),和alk_01-02_r(seq id no:22),以及所述目的基因的竞争物序列(5
’→3’
)为alk_01-02_qc(seq id no:120)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为alk_01-02_e(seq id no:87)。
[0157]
在一个优选的实施方式中,所述试剂盒为alk的第21和第22外显子的扩增试剂盒,其中所述扩增引物对序列为alk_21-22_f(seq id no:23),和alk_21-22_r(seq id no:24),以及所述目的基因的竞争物序列(5
’→3’
)为alk_21-22_qc(seq id no:121)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为alk_21-22_e(seq id no:88)。
[0158]
在一个优选的实施方式中,所述试剂盒为alk的第22和第23外显子的扩增试剂盒,其中所述扩增引物对序列为alk_22-23_f(seq id no:25),和alk_22-23_r(seq id no:26),以及所述目的基因的竞争物序列(5
’→3’
)为alk_22-23_qc(seq id no:122)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为alk_22-23_e(seq id no:89)。
[0159]
在一个优选的实施方式中,所述试剂盒为alk的第23和第24外显子的扩增试剂盒,其中所述扩增引物对序列为alk_23-24_f(seq id no:27),和alk_23-24_r(seq id no:28),以及所述目的基因的竞争物序列(5
’→3’
)为alk_23-24_qc(seq id no:123)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为alk_23-24_e(seq id no:90)。
[0160]
在一个优选的实施方式中,所述试剂盒为ret的第2和第3外显子的扩增试剂盒,其
中所述扩增引物对序列为ret_02-03_f(seq id no:29),和ret_02-03_r(seq id no:30),以及所述目的基因的竞争物序列(5
’→3’
)为ret_02-03_qc(seq id no:124)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ret_02-03_e(seq id no:91)。
[0161]
在一个优选的实施方式中,所述试剂盒为ret的第4和第5外显子的扩增试剂盒,其中所述扩增引物对序列为ret_04-05_f(seq id no:31),和ret_04-05_r(seq id no:32),以及所述目的基因的竞争物序列(5
’→3’
)为ret_04-05_qc(seq id no:125)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ret_04-05_e(seq id no:92)。
[0162]
在一个优选的实施方式中,所述试剂盒为ret的第12和第13外显子的扩增试剂盒,其中所述扩增引物对序列为ret_12-13_f(seq id no:33),和ret_12-13_r(seq id no:34),以及所述目的基因的竞争物序列(5
’→3’
)为ret_12-13_qc(seq id no:126)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ret_12-13_e(seq id no:93)。
[0163]
在一个优选的实施方式中,所述试剂盒为ret的第13和第14外显子的扩增试剂盒,其中所述扩增引物对序列为ret_13-14_f(seq id no:35),和ret_13-14_r(seq id no:36),以及所述目的基因的竞争物序列(5
’→3’
)为ret_13-14_qc(seq id no:127)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ret_13-14_e(seq id no:94)。
[0164]
在一个优选的实施方式中,所述试剂盒为ros1的第1和第2外显子的扩增试剂盒,其中所述扩增引物对序列为ros1_01-02_f(seq id no:37),和ros1_01-02_r(seq id no:38),以及所述目的基因的竞争物序列(5
’→3’
)为ros1_01-02_qc(seq id no:128)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ros1_01-02_e(seq id no:95)。
[0165]
在一个优选的实施方式中,所述试剂盒为ros1的第4和第5外显子的扩增试剂盒,其中所述扩增引物对序列为ros1_04-05_f(seq id no:39),和ros1_04-05_r(seq id no:40),以及所述目的基因的竞争物序列(5
’→3’
)为ros1_04-05_qc(seq id no:129)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ros1_04-05_e(seq id no:96)。
[0166]
在一个优选的实施方式中,所述试剂盒为ros1的第35和第36外显子的扩增试剂盒,其中所述扩增引物对序列为ros1_35-36_f(seq id no:41),和ros1_35-36_r(seq id no:42),以及所述目的基因的竞争物序列(5
’→3’
)为ros1_35-36_qc(seq id no:130)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ros1_35-36_e(seq id no:97)。
[0167]
在一个优选的实施方式中,所述试剂盒为ros1的第37和第38外显子的扩增试剂盒,其中所述扩增引物对序列为ros1_37-38_f(seq id no:43),和ros1_37-38_r(seq id no:44),以及所述目的基因的竞争物序列(5
’→3’
)为ros1_37-38_qc(seq id no:131)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ros1_37-38_e(seq id no:98)。
[0168]
在一个优选的实施方式中,所述试剂盒为eml4的第11和第12外显子的扩增试剂盒,其中所述扩增引物对序列为eml4_11-12_f(seq id no:17),和eml4_11-12_r(seq id no:18),以及所述目的基因的竞争物序列(5
’→3’
)为eml4_11-12_qc(seq id no:118)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为eml4_11-12_e(seq id no:85)。
[0169]
在一个优选的实施方式中,所述试剂盒为eml4的第13和第14外显子的扩增试剂盒,其中所述扩增引物对序列为eml4_13-14_f(seq id no:19),和eml4_13-14_r(seq id no:20),以及所述目的基因的竞争物序列(5
’→3’
)为eml4_13-14_qc(seq id no:119)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为eml4_13-14_e(seq id no:86)。
[0170]
在一个优选的实施方式中,所述试剂盒为ntrk1的第7和第8外显子的扩增试剂盒,其中所述扩增引物对序列为ntrk1_07-08_f(seq id no:49),和ntrk1_07-08_r(seq id no:50),以及所述目的基因的竞争物序列(5
’→3’
)为ntrk1_07-08_qc(seq id no:134)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ntrk1_07-08_e(seq id no:101)。
[0171]
在一个优选的实施方式中,所述试剂盒为ntrk1的第8和第9外显子的扩增试剂盒,其中所述扩增引物对序列为ntrk1_08-09_f(seq id no:51),和ntrk1_08-09_r(seq id no:52),以及所述目的基因的竞争物序列(5
’→3’
)为ntrk1_08-09_qc(seq id no:135)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ntrk1_08-09_e(seq id no:102)。
[0172]
在一个优选的实施方式中,所述试剂盒为ntrk1的第14和第14外显子的扩增试剂盒,其中所述扩增引物对序列为ntrk1_13-14_f(seq id no:53),和ntrk1_13-14_r(seq id no:54),以及所述目的基因的竞争物序列(5
’→3’
)为ntrk1_13-14_qc(seq id no:136)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ntrk1_13-14_e(seq id no:103)。
[0173]
在一个优选的实施方式中,所述试剂盒为ntrk1的第14和第15外显子的扩增试剂盒,其中所述扩增引物对序列为ntrk1_14-15_f(seq id no:55),和ntrk1_14-15_r(seq id no:56),以及所述目的基因的竞争物序列(5
’→3’
)为ntrk1_14-15_qc(seq id no:137)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ntrk1_14-15_e(seq id no:104)。
[0174]
在一个优选的实施方式中,所述试剂盒为ntrk2的第9和第10外显子的扩增试剂盒,其中所述扩增引物对序列为ntrk2_09-10_f(seq id no:57),和ntrk2_09-10_r(seq id no:58),以及所述目的基因的竞争物序列(5
’→3’
)为ntrk2_09-10_qc(seq id no:138)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ntrk2_09-10_e(seq id no:105)。
[0175]
在一个优选的实施方式中,所述试剂盒为ntrk2的第10和第11外显子的扩增试剂盒,其中所述扩增引物对序列为ntrk2_10-11_f(seq id no:59),和ntrk2_10-11_r(seq id no:60),以及所述目的基因的竞争物序列(5
’→3’
)为ntrk2_10-11_qc(seq id no:139)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ntrk2_10-11_e(seq id no:106)。
[0176]
在一个优选的实施方式中,所述试剂盒为ntrk2的第13和第14外显子的扩增试剂盒,其中所述扩增引物对序列为ntrk2_13-14_f(seq id no:61),和ntrk2_13-14_r(seq id no:62),以及所述目的基因的竞争物序列(5
’→3’
)为ntrk2_13-14_qc(seq id no:140)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ntrk2_13-14_e(seq id no:107)。
[0177]
在一个优选的实施方式中,所述试剂盒为ntrk2的第14和第15外显子的扩增试剂盒,其中所述扩增引物对序列为ntrk2_14-15_f(seq id no:63),和ntrk2_14-15_r(seq id no:64),以及所述目的基因的竞争物序列(5
’→3’
)为ntrk2_14-15_qc(seq id no:141)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ntrk2_14-15_e(seq id no:108)。
[0178]
在一个优选的实施方式中,所述试剂盒为ntrk3的第9和第10外显子的扩增试剂盒,其中所述扩增引物对序列为ntrk3_09-10_f(seq id no:65),和ntrk3_09-10_r(seq id no:66),以及所述目的基因的竞争物序列(5
’→3’
)为ntrk3_09-10_qc(seq id no:142)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ntrk3_09-10_e(seq id no:109)。
[0179]
在一个优选的实施方式中,所述试剂盒为ntrk3的第10和第11外显子的扩增试剂盒,其中所述扩增引物对序列为ntrk3_10-11_f(seq id no:67),和ntrk3_10-11_r(seq id no:68),以及所述目的基因的竞争物序列(5
’→3’
)为ntrk3_10-11_qc(seq id no:143)。优
选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ntrk3_10-11_e(seq id no:110)。
[0180]
在一个优选的实施方式中,所述试剂盒为ntrk3的第14和第15外显子的扩增试剂盒,其中所述扩增引物对序列为ntrk3_14-15_f(seq id no:69),和ntrk3_14-15_r(seq id no:70),以及所述目的基因的竞争物序列(5
’→3’
)为ntrk3_14-15_qc(seq id no:144)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ntrk3_14-15_e(seq id no:111)。
[0181]
在一个优选的实施方式中,所述试剂盒为ntrk3的第15和第16外显子的扩增试剂盒,其中所述扩增引物对序列为ntrk3_15-16_f(seq id no:71),和ntrk3_15-16_r(seq id no:72),以及所述目的基因的竞争物序列(5
’→3’
)为ntrk3_15-16_qc(seq id no:145)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为ntrk3_15-16_e(seq id no:112)。
[0182]
在一个优选的实施方式中,所述试剂盒为tpm3的第8和第9外显子的扩增试剂盒,其中所述扩增引物对序列为tpm3_08-09_f(seq id no:45),和tpm3_08-09_r(seq id no:46),以及所述目的基因的竞争物序列(5
’→3’
)为tpm3_08-09_qc(seq id no:132)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为tpm3_08-09_e(seq id no:99)。
[0183]
在一个优选的实施方式中,所述试剂盒为tpm3的第10和第11外显子的扩增试剂盒,其中所述扩增引物对序列为tpm3_10-11_f(seq id no:47),和tpm3_10-11_r(seq id no:48),以及所述目的基因的竞争物序列(5
’→3’
)为tpm3_10-11_qc(seq id no:133)。优选地,所述试剂盒还包括延伸引物,所述延伸引物序列为tpm3_10-11_e(seq id no:100)。
[0184]
在一个优选的实施方式中,所述试剂盒可以是上述不同实施方式中各个试剂盒的任意组合。
[0185]
检测目的基因突变
[0186]
本发明可以用于检测目的基因突变。首先,针对目的基因突变位点设计目的基因的竞争物、含有锁核酸修饰的扩增引物对;然后使用本发明提供的方法扩增目的基因及其竞争物;最后检测得到的扩增产物中目的基因的突变情况。
[0187]
为了检测目的基因的突变情况,本发明提供的扩增方法可以结合常见的检测技术,包括但不限于基于基质辅助激光解吸电离飞行时间质谱方法、taqman-pcr法、二代测序技术、毛细管电泳分析、数字pcr等基因半定量/定量的检测方法。
[0188]
由于本发明提供的扩增方法中包含可控的竞争物的扩增,可以解决样本质量差异引起的检测信号差异易造成误判的问题,也可以根据竞争物的扩增推测目的基因的拷贝数,因此可以用来检测多种目的基因的突变情况,其中所述目的基因突变选自:单核苷酸多态性snp、dna拷贝数变化cnv、基因融合、病原体核酸定量、基因表达量变化及其组合等。
[0189]
与现有技术相比,本发明的优势包括:
[0190]
1.本发明通过优化竞争物和扩增引物的组合,在不改变待测基因位点的扩增效率的同时,显著降低竞争物的扩增效率,从而实现了接近的竞争物与待测基因位点的扩增效率水平。
[0191]
2.本方法使用锁核酸修饰的合成的双链dna作为竞争物,使得竞争物底物的添加量由原来的pg级提高到了ng级,更易于控制其使用量,而且避免了阴性对照实验中由于气溶胶等不可控的因素导致的非必要误差,提高了质谱分析数据的成功率和可操作性。
[0192]
3.本方法使用的优化的竞争物除了具有使用量更可操控的优点外,还具有冻融降解率低、易于保存的优点。
[0193]
4.本发明提供的扩增方法可以结合常见的检测技术,包括但不限于基于基质辅助激光解吸电离飞行时间质谱方法、taqman-pcr法、二代测序技术、毛细管电泳分析、数字pcr等基因半定量/定量的检测方法,应用范围广泛。
[0194]
5.采用本发明方法检测sma,对样本要求低,适合普筛。对smn1基因和smn2基因的拷贝数检测及点突变检测,均可在一个反应孔里完成,排除了反应孔间的干扰。通过单碱基延伸,利用差异碱基间分子量的差异来区分检测位点,能直接准确检测碱基类型,特异性强;不使用荧光探针,避免了相似位点的荧光干扰,检测结果精确,降低成本,满足sma的定性和商业化检测需求。
[0195]
6.利用本发明方法检测alk、ros1、ret、ntrk1、ntrk2、ntrk3六个基因是否发生基因融合突变,从新鲜肿瘤组织、ffpet、胸水、穿刺液样本中均能很好地检出,适用于辅助诊断。对于六个基因的检测,alk、ros1、ret可在一个反应孔里完成,ntrk1、ntrk2、ntrk3可在一个反应孔里完成,排除了反应孔之间的干扰,样品来源丰富,成本低,有利于商业化的推广应用。
[0196]
实施例
[0197]
下面结合说明书附图,进一步对本技术的优选实施例进行详细描述,以下的描述为示例性的,并非对本技术的限制,任何的其他类似情形也都落入本技术的保护范围之中。
[0198]
实施例1:引物和竞争物的设计
[0199]
本实施例中,根据sma疾病的病理特征和smn1和smn2基因的序列信息,设计了一系列针对smn1、smn2第5、6、7和8外显子对应片段的扩增引物、竞争物和延伸引物,以及作为参比的rpp40基因的扩增引物、竞争物和延伸引物;其中第5、6外显子的检测位点序列相同(smn1-2 e5:c.541和smn1-2 e6:c.692)。
[0200]
另外,根据基因alk、ret、ros1、ntrk1、ntrk2、ntrk3的序列信息,涉及了针对上述6个基因,以及作为参比的eml4和tpm3基因的扩增引物、竞争物和延伸引物。
[0201]
具体地,设计并使用的扩增引物信息如表1所示。其中,[x]表示碱基被锁核酸修饰,x可以为a、t、c或g。pcr的目的是为了获取目标dna。
[0202]
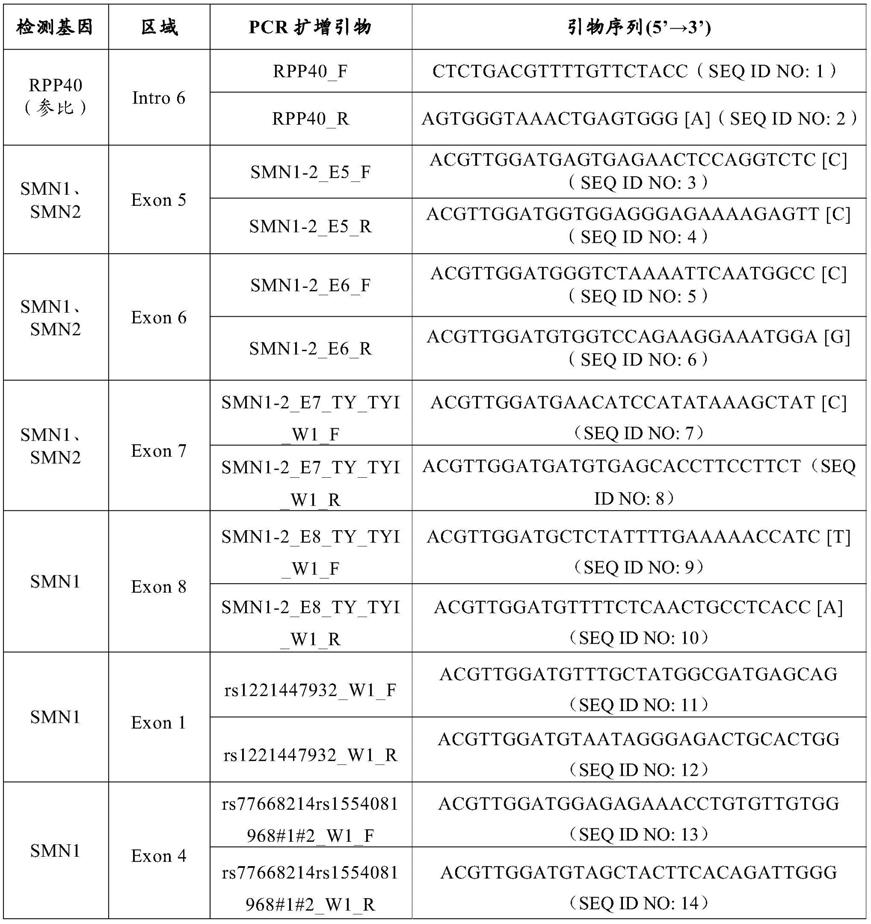
表1:扩增引物信息表
[0203]
[0204]
[0205]
[0206][0207][0208]
设计并使用的延伸引物的信息如下表2所示。其中,[x]表示碱基被锁核酸修饰,x可以为a、t、c或g。延伸引物取自pcr扩增序列的一部分,massarray的目的是检测dna的突变情况,可用于检测sma的拷贝数变异和疾病相关位点snp,或用于检测alk、ros1、ret、ntrk1、
ntrk2、ntrk3六个基因是否发生融合突变
[0209]
表2:延伸引物信息表
[0210]
[0211]
[0212][0213]
设计并使用的竞争物的信息如下表3所示。其中,[x]表示碱基被锁核酸修饰,x可以为a、t、c或g。
[0214]
表3:竞争物信息表
[0215]
[0216]
[0217]
[0218][0219]
其中,例如,t表示竞争物的序列在该碱基t位置与目的基因序列不同,且引入的不同碱基为人类基因上未出现的基因型。
[0220]
靶基因和竞争物的扩增产物序列信息如下表4所示:
[0221]
[0222]
[0223][0224]
其中,黑色加粗为pcr扩增引物序列,斜体为延伸引物序列,括号兼斜体为添加进去调节分子量的延伸引物序列,下划线加粗为检测位点或延伸碱基。
[0225]
实施例2
[0226]
利用实施例1中所述引物和竞争物,进行massarray检测临床样本中smn1和smn2基因突变情况。
[0227]
2.1样本处理
[0228]
本实施例使用的样本来自于临床采集的sma患者、突变基因携带者和正常人的抗凝血标本或血斑卡标本,以及对照人类基因组dna(promega,g1471)。
[0229]
新鲜或冷冻抗凝血标本用英芮城磁珠法血液基因组dna提取试剂盒提取基因组dna,
[0230]
血斑卡标本用英芮城磁珠法血斑基因组dna提取试剂盒提取基因组dna。
[0231]
gdna为2拷贝对照,smn1基因、smn2基因、rpp40基因也均为2个拷贝。
[0232]
2.2引物和竞争物的设计与合成
[0233]
设计并使用的扩增引物信息如表1所示;设计并使用的延伸引物的信息如下表2所示;设计并使用的竞争物如表3所示。
[0234]
然后将合成的序列连接到载体上,本实施例中将上述合成的序列连接到t载体中,环化形成包含一段与所述目的基因序列相比存在(3、4、6个)碱基不同的核苷酸序列的质
粒。
[0235]
2.3多重扩增目的基因片段
[0236]
将步骤2.2中得到的扩增引物如下混合,得到pcr primer mix,其中各pcr增引物在primer mix混合液中的浓度为0.5~1μm。
[0237]
将步骤2.2中得到的竞争物如下混合,得到qc mix:
[0238]
[0239][0240]
然后,配制pcr反应体系,如下所示:
[0241]
ddh2o0.8μl10x pcr buffer0.5μlmgcl20.4μldntp mix0.1μlpcr enzyme0.2μlqc mix1μlpcr primer mix1μl合计4μl
[0242]
然后,将配制的pcr反应体系分装到384孔板对应的反应孔中,每孔分装4μl,然后加入1μl步骤2.1中得到的待检样本。每次检测时需含2拷贝对照gdna和空白对照水。贴紧贴膜,稍稍离心后放置基因扩增仪上,按以下pcr程序进行扩增:
[0243][0244]
得到的pcr扩增反应产物包含smn1-2_e5、smn1-2_qc_e5、smn1-2_e6、smn1-2_qc_e6、rpp40、rpp40_qc。
[0245]
2.4通过基于基质辅助激光解吸电离飞行时间质谱方法验证扩增结果
[0246]
2.4.1sap纯化
[0247]
将步骤1.3得到的每孔pcr扩增产物中加入2μl sap反应混合液,贴紧贴膜,稍稍离心后放置基因扩增仪上,按以下sap程序进行纯化。
[0248]
37℃40min85℃5min8℃hold
[0249]
其中sap反应混合液的体系如下:
[0250]
ddh2o1.53μlsap buffer0.17μlsap enzyme0.3μl合计2μl
[0251]
2.4.2延伸反应
[0252]
将步骤2.4.1得到的每孔sap纯化反应产物中加入2μl延伸反应混合液,其中延伸反应混合液体系如下:
[0253]
ddh2o0.62μliplex buffer plus0.2μliplex termination mix0.2μliplex primer mix0.94μliplex pro enzyme0.04μl合计2μl
[0254]
各延伸引物在iplex primer mix中的浓度如下:
[0255]
[0256][0257]
给上述延伸反应体系贴紧贴膜,稍稍离心后放置基因扩增仪上,按以下延伸反应程序进行延伸。
[0258]
[0259][0260]
2.4.3脱盐处理、质谱仪打谱
[0261]
延伸反应程序结束后,瞬时离心。每孔加入16μl的灭菌双蒸水,6mg洁净树脂(resin)。颠倒混匀15min,离心力3200x g离心5min。样本点样,打谱。
[0262]
2.4.4数据分析和检测结果判读
[0263]
仪器配套软件typer4.0导出的原始文件。
[0264]
拷贝数检测结果分析:通过各检测位点的信噪比(snr)计算。计算公式为:
[0265][0266]
判读逻辑:先根据smn1的f值判断待测标本分组。再根据分组中smn2的f值判断smn2的拷贝数。
[0267]
该公式是利用信噪比计算拷贝数,用于排除外部环境(温度、压力)和人工操作等造成的误差,使检测结果更准确)。
[0268]
数值判读范围如下:
[0269][0270]
表5:36例样本smn1和smn2拷贝数结果(massarray方法检测和mlpa金标方法检测比较)
[0271][0272]
结果:
[0273]
样本编号样本说明11正常人
17携带者20患者21患者
[0274]
以样本11、17、20、21的质谱结果为例,其中样本对应的表型如上所示。图1-图5为4个样本分别使用竞争物和锁核酸修饰的引物依次扩增smn1-2_e5、smn1-2_e6、smn1-2_e7、smn1-2_e8、rpp40这5种目的基因产物的质谱检测图。
[0275]
结果发现,本方式使用上样量为ng数量级的竞争物进行扩增,说明本发明竞争物的扩增是在可控的范围的,其产物可以用于后续的检测反应如质谱检测中。因此,本方式提高了质谱法检测基因突变的临床实用性。
[0276]
基于massarray技术系统,本发明一个反应即检测出smn1和smn2拷贝数及其热点snp。相较于普通的massarray检测,在扩增环节添加了每个cnv检测位点的竞争底物,通过和竞争底物检测出峰信噪比的比对,能精确区分smn1/smn2=1/0、2/0、1/2、1/3、2/3、2/4的拷贝数情况,且能细化检测结果(例如区分1/2或2/4),检测结果更加精确,满足sma临床定量检测需求。
[0277]
实施例3
[0278]
3.1本实施例中,使用相同的样本、竞争物、扩增体系,但分别使用具有相同引物序列而未经锁核酸修饰的引物对和本方式提出的锁核酸修饰的扩增引物,加样量如下所示,进行各位点的扩增,然后进行质谱检测,比较本方式提出的锁核酸修饰的引物控制竞争物的扩增反应的效果。
[0279][0280][0281]
结果:如图6所示,使用了本方式提出的锁核酸修饰的扩增引物,能够成功检测出smn1-2_e5、smn1-2_e6、smn1-2_e7、smn1-2_e8、rpp40这5种目的基因产物。但是两种引物使用的竞争物的加样量则显著不同。以smn1-2_e5_qc为例,非锁核酸修饰引物对应的加样量为约0.05pg,使用锁核酸修饰引物后,对应的加样量提高到了约10ng,提升了2*105倍;而其他位点的竞争物的加样量也提升了10
5-106倍。
[0282]
3.2为了进一步直观验证使用本方案的锁核酸修饰引物降低竞争物的扩增效率,使用实时定量qpcr的方法,分别使用锁核酸和非锁核酸修饰的引物扩增竞争底物,比较各反应的cp值。在作为模板的竞争物加样量相同时,cp值越大,说明竞争物的扩增效率越低。
[0283]
反应使用的引物信息,如下所示:
[0284][0285]
混合液中包含的竞争物及其浓度如下所示:
[0286][0287][0288]
qpcr扩增体系如下所示:
[0289]
试剂体积sybrgreen5μlprimer mix(5p)0.4μl竞争物混合液1μlh2o3.6μltotal10μl
[0290]
qpcr扩增条件如下所示:
[0291][0292]
结果:qpcr实验的扩增反应如图7、图8所示,统计数据见下:
[0293][0294]
相同的竞争物混合液投料,分别用锁核酸引物和非锁核酸引物扩增,其中两类引物序列一致,锁核酸引物为部分引物碱基替换为有锁核酸修饰的碱基,非锁核酸引物所有碱基均为常规无修饰碱基;获得的锁核酸引物和非锁核酸引物cp平均值差距最低为7.86,差距最高为20.64,以差距值为指数,2为底数,所得到的幂数为扩增产物量的差异值。证明添加了锁核酸修饰的引物,极其显著地降低了竞争物的扩增效率,大大降低了扩增得到的产物量。
[0295]
实施例4
[0296]
4.1按照如下操作模拟实际操作中多次冻融高浓度(5ng)和低浓度(1pg)竞争物储存液的操作:
[0297]
4.1.1配置好的混合液至于-80℃冰冻。
[0298]
4.1.2待完全结冰后,取出置于室温条件下完全解冻。振荡离心,分别吸取10ul至新的管子中,标记为解冻1次,并将其置于-80℃保存。将原始管重新置于-80℃冰冻。
[0299]
4.1.3待完全结冰后,取出置于室温条件下完全解冻。再将原始管置于-80℃冰冻。
[0300]
4.1.4待完全结冰后,取出置于室温条件下完全解冻。振荡离心,分别吸取10ul至新的管子中,标记为解冻3次,并将其置于-80℃保存。将原始管重新置于-80℃冰冻。
[0301]
4.1.5重复3-4数次,获得解冻5、7、9、11、13、15、17、19次的竞争物混合物均置于-80℃保存。
[0302]
4.1.6将解冻1、3、5、7、9、11、13、15、17、19次的竞争物混合物全部取出,再次解冻获得解冻2、4、6、8、10、12、14、16、18、20次的竞争物混合物。
[0303]
然后,实时定量qpcr的方法检测竞争物的浓度,以判断竞争物的扩增效率是否受到储存浓度的影响高低而不稳定,具体序列如下:
[0304][0305]
所述qpcr扩增体系如下:
[0306]
试剂体积sybrgreen5μlprimer mix(5p)0.4μl竞争物混合液1μlh2o3.6μltotal10μl
[0307]
qpcr扩增条件如下:
[0308][0309]
结果:未冻融的不同浓度的竞争物的qpcr的结果如下所示:
[0310][0311]
而经过0、2、4、6、8、10、12、14、16、18、20次冻融的不同浓度的竞争物的qpcr的结果如下所示:
[0312]
[0313][0314]
从上结果,可知本实验进行反复冻融实验的竞争物混合物分别两个浓度1pg/μl和5ng/μl,历经20次反复冻融,取偶次数冻融进行检测。检测理论投料量分别为1pg和5ng,5ng的10份冻融检测数据保持稳定,且与5ng 0次冻融的数据也能保持稳定;1pg的10份冻融检测数据保持稳定,但与1pg的0次冻融的数据存在明显差距,差距值为2.2~3.19,1pg的10份冻融检测数据与0pg检测数据接近。证明历经20次反复冻融,5ng/μl混合液能保持稳定的cp值,1pg/μl混合液在冻融一次之后,就发生严重降解。
[0315]
4.2本次实验进行实验误差实验的竞争物混合液分别两个浓度约50pg/μl和5ng/μl,进行三个批次实验,第一个批次实验为0次冻融,第二和第三批次实验至少存在一次竞争物混合液的冻融,时间间隔至少24小时。然后计算每次获得的信噪比smn e6 snr比值(snr(smn1-2_e6_qc)和snr(smn e6)比值)、rpp40 snr比值(snr(rpp40_qc)和snr(rpp40)比值)。不同批次的snr比值结果越一致,说明体系越稳定。
[0316][0317]
其中,检测样本gdna 10ng浓度,而锁核酸引物组的竞争物在混合液中的浓度qc mix-锁核酸与非锁核酸引物组的竞争物在混合液中的浓度qc mix-非锁核酸,如下所示:
[0318]
成分qc mix-锁核酸qc mix-非锁核酸smn1-2_e6_qc约5ng/μl约50pg/μlrpp40_qc约5ng/μl约50pg/μl
[0319]
获得的snr(smn1-2_e6_qc)和snr(smn e6)比值、snr(rpp40_qc)和snr(rpp40)比值,如下所示:
[0320][0321]
结果证明在锁核酸引物实验中,smn e6 snr比值、rpp40 snr比值基本保持稳定;而在非锁核酸引物中第二批次明显降低,到第三批次已经检测不到竞争物。因此,证明使用非锁核酸的方法建立的反应体系不稳定,而使用本方法建立的竞争物反应体系相对稳定性大大提高。
[0322]
结论:在实际操作中,由于竞争物扩增效率过快会引起很多问题,比如造成扩增产物在后续质谱检测中的峰面积远远超过了待测物的峰面积,导致判断失败;导致试剂配制的误差大,偏差大;或者竞争物浓度过低,以至于在冻融后容易降解,因而不易储存。因此,本技术极大地降低了有竞争物的扩增反应的操作难度,使检测方法成功率大大提高。
[0323]
实施例5
[0324]
alk、ros1、ret、ntrk1、ntrk2、ntrk3的6个基因10%丰度发生融合突变参考品和sanger技术的正确度比对。
[0325]
5.1 massarray实验方案:
[0326]
5.1.1使用thermo fisher的high-capacity cdna reverse transcription kit(货号4368814)对200ng rna进行逆转录实验,获得cdna。
[0327]
5.1.2融合检测公式计算,阈值确定:以alk基因融合检测为例,计算公式如下:
[0328][0329]
阈值设定:配置alk 1%、5%、10%阳参、阴参,进行批内批间重复性验证,20例样本的正确度验证,最终划定阈值15。
[0330]
检测结果判断逻辑:作cdna/qc计算时,若qc snr值为0,调整为数值0.1,进行公式计算。
[0331]
第一步:内参质控,若eml4_11-12≤0.5和eml4_13-14≤0.01同时出现,质控不过;需增加投料。若eml4_11-12≥7.5和eml4_13-14≥3同时出现,质控不过;需减少投料。
[0332]
eml4_11-12和eml4_13-14任何一个在适用范围,均为质控通过,继续进行判断。
[0333]
第二步:3臂端若比值≤0.05,可直接判为阴性
[0334]
第三步:5臂端若比值为0,调整为数值0.01,进行公式计算,计算值大于等于对应阈值即为阳性。
[0335]
5.1.3其余步骤同实施例1方法。6个基因及参比基因eml4和tpm3的massarray图谱见图9-图16,汇总massarray结果如下:
[0336][0337]
5.2 sanger测序实验方案:
[0338]
5.2.1使用thermo fisher的high-capacity cdna reverse transcription kit(货号4368814)对200ng的rna进行逆转录实验,获得cdna。
[0339]
5.2.2 pcr反应,体系如下:
[0340]
试剂名称体积(μl)premix taq10primer1(10μm)1primer2(10μm)1模板1ddh2o7总体积20
[0341]
pcr循环条件如下:
[0342][0343][0344]
5.2.3 pcr产物割胶纯化
[0345]
pcr产物经2%琼脂糖凝胶电泳,割取大小对等的目的条带,按照医脉赛磁珠法pcr产物纯化试剂盒纯化回收。
[0346]
5.2.4 sanger测序
[0347]
测序反应体系如下:
[0348]
试剂名称体积(μl)bigdye mix kit1测序primer(3.2μm)2纯化后pcr产物1-3ddh2o0-1总体积5
[0349]
测序反应条件:
[0350][0351]
nh4ac.edta纯化:待测序反应结束后,将96孔板以3700rpm离心0.5min;每个中加1μl nh4ac.edta溶液,3700转离心30s;置于混匀器上震荡30s,3700转离心30s。
[0352]
100%酒精沉淀:加入18μl的100%乙醇溶液,-20℃沉淀30min,4500rpm离心30min,倒置离心400rpm,2min。
[0353]
75%酒精洗涤:加入50μl的75%酒精,4500rpm离心10min,倒置离心400rpm,2min。
[0354]
变性:加入6μl hi-di,3700rpm离心1min,-20℃存放待上测序仪。
[0355]
5.2.5测序:使用3730xl测序仪进行测序。所述测序引物如下:
[0356]
[0357][0358]
sanger测序结果如图17所示。本次实验进行正确度比对,使用金标方法sanger测序进行比对验证。使用的样本为标准品配置的分别六个基因10%的参考品进行检测。实验结论为massarray方法检测的结果和sanger测序结果完全一致,证明使用本方法建立的竞争物反应体系的正确性。检测的6个基因及其融合突变情况的结果对比如下:
[0359][0360]
本发明中利用massaarray技术检测alk、ros1、ret、ntrk1、ntrk2、ntrk3六个基因是否发生基因融合突变。从新鲜肿瘤组织、ffpet、胸水、穿刺液标本中,均能很好的检出,适用于辅助诊断。alk、ros1、ret、ntrk1、ntrk2、ntrk3六个基因的融合检测,alk、ros1、ret可在一个反应孔里完成,ntrk1、ntrk2、ntrk3可在一个反应孔里完成,排除了反应孔之间的干
扰,且降低成本。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。