1.与相关申请的交叉引用
2.本技术要求2019年6月19日在韩国知识产权局提交的韩国专利申请号10-2019-0073019的利益,其公开内容整体通过参考并入本文。技术领域
[0003][0004]
本发明涉及一种制备含有胺基的吲哚或吲唑化合物的方法,所述化合物是用于合成制药用吲哚或吲唑化合物所必需的中间体结构。
背景技术:
[0005]
已报道了关于具有吲哚结构作为母核的化合物的许多研究结果,代表性实例包括例如报道了所述化合物具有葡萄糖激酶活性的pct国际公开号wo2006/112549,报道了所述化合物可用作抗肿瘤剂和心血管系统产生的抑制剂的pct国际公开号wo1995/007276,以及报道了所述化合物可用作抗生素的pct国际公开号wo2004/018428。
[0006]
其中,本发明涉及一种制备含有胺基的吲哚或吲唑化合物的方法,所述化合物作为获得对细胞坏死和坏死相关疾病表现出预防或治疗和改善作用的吲哚或吲唑化合物所必需的中间体结构。
[0007]
常规情况下,使用利用铁(fe)催化剂从含有硝基的吲哚或吲唑化合物制备含有胺基的吲哚或吲唑化合物的方法。
[0008]
然而,在这种情况下,存在的限制在于当铁(fe)具有不同粒度、在反应期间搅拌不顺畅或反应时间延长时,由于反应中产生的杂质造成的得率降低。此外,存在着在反应后反应器被产生的氧化铁包被并需要成本和时间来清洁反应器的限制。
[0009]
因此,对开发可以解决使用铁(fe)催化剂的常规方法的限制,能够制备含有胺基的吲哚或吲唑化合物的新的成本效益高的方法,存在着需求。
技术实现要素:
[0010]
[技术问题]
[0011]
本发明的一个方面提供了一种从含有硝基的吲哚或吲唑化合物制备含有胺基的吲哚或吲唑化合物的方法,所述方法可以解决使用铁(fe)催化剂的常规方法的限制,并且可以高成本效益地制备含有胺基的吲哚或吲唑化合物。
[0012]
[技术解决方案]
[0013]
根据本发明的一个方面,提供了一种制备由下式1表示的化合物的方法,所述方法包括在水合氯化铁(iii)存在下将由下式2表示的化合物还原的步骤:
[0014]
[式1]
[0015][0016]
其中在上式1中,
[0017]
n是1至3的整数,
[0018]
m是0或1,
[0019]
a表示c
3-c
8-环烷基、苯基或各自含有1或2个选自n、o和s原子的杂原子的5-6元杂芳基或杂环,
[0020]
x表示c或n,前提是当x是n时m是0,而当x是c时m是1,
[0021]
r1表示氢、c
1-c
6-烷基或-(ch2)rnr9r
10
,其中r是2至5的整数,r9和r
10
各自独立地表示氢或c
1-c
3-烷基,前提是当x是n时r1是氢,
[0022]
r2表示氢、卤素或c
1-c
6-烷氧基,或表示-(ch2)
p
co2r9、-(ch2)
p
or9、-(ch2)
p
nr9r
10
、-nhr
11
、-n(h)s(o)2r9或-nhc(o)2r
11
,或表示-(ch2)
p-杂环-r
11
,其中所述杂环是含有1或2个选自n、o和s原子的杂原子的5-6元环,其中p是0至3的整数,r9和r
10
与上文所定义的相同,并且r
11
表示氢、酮基、c
1-c
6-烷基羰基、c
1-c
6-烷氧基或c
1-c
6-烷基,或含有1或2个氮原子作为杂原子的5-6元杂环,
[0023]
r3表示氢、卤素、c
1-c
6-烷基或苯基,或-(ch2)
q-杂环,其中所述杂环是含有1或2个选自n和o原子的杂原子的5-6元环,其中q是1至3的整数,前提是当x是n时r3是氢或苯基,
[0024]
r4表示-y1r
12
,其中y1是直接连键或表示-(cr9r
10
)
sy2-,其中s是0至3的整数,r9和r
10
与上文所定义的相同,并且y2选自-o-、-c(o)-和-c(o)o-,并且
[0025]r12
选自氢、卤素、c
1-c
6-烷基和-(ch2)
tb1-r
13
,其中t是0至3的整数,b1表示含有1或2个选自n、o和s原子的杂原子的5-6元杂环或表示c
6-c
10-芳基,r
13
表示氢、氰基、卤素、羟基、酮基、硫醇、羧基或羧基-c
1-c
6-烷基,前提是当x是n时r4是氢或c
1-c
6-烷基,
[0026]
其中烷基、烷氧基、芳基、环烷基、杂环和杂芳基可以任选地被取代,并且取代基是选自羟基、c
1-c
6-烷基氨基、二(c
1-c
6-烷基)氨基、羧基、c
1-c
6-烷基、c
1-c
6-烷氧基、羧基-c
1-c
6-烷基和酮基的一者或多者。
[0027]
[式2]
[0028][0029]
在上式2中,
[0030]
k是1至3的整数,
[0031]
j是0或1,
[0032]
a'表示c
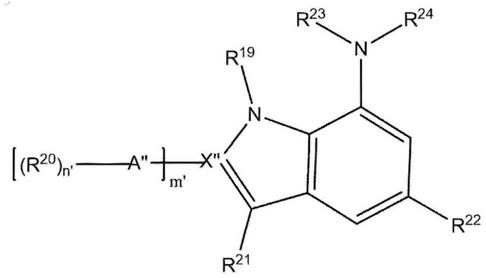
3-c
8-环烷基、苯基或各自含有1或2个选自n、o和s原子的杂原子的5-6元杂芳基或杂环,
[0033]
x'表示c或n,前提是当x'是n时j是0,而当x'是c时j是1,
[0034]
r5表示氢、c
1-c
6-烷基或-(ch2)enr
14r15
,其中e是2至5的整数,r
14
和r
15
各自独立地表示氢或c
1-c
3-烷基,前提是当x'是n时r5是氢,
[0035]
r6表示氢、卤素或c
1-c
6-烷氧基,或表示-(ch2)fc(o)2r
14
、-(ch2)for
14
、-(ch2)fnr
14r15
、-nhr
16
、-n(h)s(o)2r
14
或-nhc(o)2r
16
,或表示-(ch2)
f-杂环-r
16
,其中所述杂环是含有1或2个选自n、o和s原子的杂原子的5-6元环,其中f是0至3的整数,r
14
和r
15
与上文所定义的相同,并且r
16
表示氢、酮基、c
1-c
6-烷基羰基、c
1-c
6-烷氧基或c
1-c
6-烷基或含有1或2个氮原子作为杂原子的5-6元杂环,
[0036]
r7表示氢、卤素、c
1-c
6-烷基或苯基,或-(ch2)
g-杂环,其中所述杂环是含有1或2个选自n和o原子的杂原子的5-6元环,其中g是1至3的整数,前提是当x'是n时r7是氢或苯基,
[0037]
r8表示-y3r
17
,其中y3是直接连键或表示-(cr
14r15
)hy
4-,其中h是0至3的整数,r
14
和r
15
与上文所定义的相同,并且y4选自-o-、-c(o)-和-c(o)o-,并且
[0038]r17
选自氢、卤素、c
1-c
6-烷基和-(ch2)
ib2-r
18
,其中i是0至3的整数,b2表示含有1或2个选自n、o和s原子的杂原子的5-6元杂环,或表示c
6-c
10-芳基,r
18
表示氢、氰基、卤素、羟基、酮基、硫醇、羧基或羧基-c
1-c
6-烷基,前提是当x'是n时r8是氢或c
1-c
6-烷基,
[0039]
其中烷基、烷氧基、芳基、环烷基、杂环和杂芳基可以任选地被取代,并且取代基是选自羟基、c
1-c
6-烷基氨基、二(c
1-c
6-烷基)氨基、羧基、c
1-c
6-烷基、c
1-c
6-烷氧基、羧基-c
1-c
6-烷基和酮基的一者或多者。
[0040]
[有利效果]
[0041]
所述制备本发明的吲哚或吲唑化合物的方法可以解决传统铁(fe)催化剂的限制,可以始终如一地以出色的得率制备所需吲哚或吲唑化合物,并且由于使用比铁(fe)廉价得多的水合氯化铁(iii)而具有高成本效益。
具体实施方式
[0042]
在下文中将对本发明进行更详细描述,以帮助理解本发明。
[0043]
在本说明书和权利要求书中使用的术语或词语不应被解释为限于常规或词典的含义,而是应该在本发明人可以适合地定义所述术语的概念以便以最佳方式解释本发明的原则的基础上,被解释为与技术精神相符的含义和概念。
[0044]
在根据本发明所述的式(1)的化合物的取代基的定义中,术语“烷基”是指脂族烃基。烷基可以是不包括烯基或炔基组成部分的“饱和烷基”,或者是包括至少一个烯基或炔基组成部分的“不饱和烷基”。术语“烯基”是指含有至少一个碳-碳双键的基团,并且术语“炔基”是指含有至少一个碳-碳叁键的基团。当单独或以复合词形式例如烷氧基使用时,烷基可以是支链或直链的。
[0045]
除非另有定义,否则烷基可以具有1至20个碳原子。烷基可以是具有1至10个碳原子的中尺寸烷基。烷基可以是具有1至6个碳原子的短链烷基。典型的烷基包括但不限于甲
基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、戊基、己基、乙烯基、丙烯基、丁烯基等。例如,c
1-c
4-烷基在烷基链中具有1至4个碳原子,并选自甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基和叔丁基。
[0046]
除非另有定义,否则术语“烷氧基”是指具有1至10个碳原子的烷氧基。
[0047]
除非另有定义,否则术语“环烷基”是指饱和脂族3-10元环。典型的环烷基包括但不限于环丙基、环丁基、环戊基、环己基等。
[0048]
术语“芳基”包括至少一个具有共价π电子体系的环,例如单环或稠合的多环(即共有相邻的成对碳原子的环)基团。也就是说,除非另有定义,否则芳基是指芳香族4-10元、优选地6-10元单环或多环,包括苯基、萘基等。
[0049]
除非另有定义,否则术语“杂芳基”是指芳香族3-10元环,优选为4-8元环,更优选为5-6元环,其含有1至3个选自n、o和s的杂原子,并且可以与苯并或或c
3-c8环烷基稠合。单环杂芳基的实例包括但不限于噻唑、噁唑、噻吩、呋喃、吡咯、咪唑、异噁唑、异噻唑、吡唑、三唑、三嗪、噻二唑、四唑、噁二唑、吡啶、哒嗪、嘧啶、吡嗪等。双环杂芳基的实例包括但不限于吲哚、吲哚啉、苯并噻吩、苯并呋喃、苯并咪唑、苯并噁唑、苯并异噁唑、苯并噻唑、苯并噻二唑、苯并三唑、喹啉、异喹啉、嘌呤、呋喃并吡啶等。
[0050]
除非另有定义,否则术语“杂环”是指3-10元环,优选为4-8元环,更优选为5-6元环,其含有1至3个选自n、o和s的杂原子,并且可以与苯并或c
3-c8环烷基稠合,并且是饱和的或含有1或2个双键。杂环的实例包括但不限于吡咯啉、吡咯烷、咪唑啉、咪唑烷、吡唑啉、吡唑烷、吡喃、哌啶、吗啉、硫代吗啉、哌嗪、氢呋喃等。
[0051]
除非另有定义,否则本文中使用的术语和缩略语可以被解释为本发明所属领域的专业技术人员通常理解的含义。
[0052]
本发明涉及一种制备含有胺基的吲哚或吲唑化合物的方法,所述化合物是合成制药用吲哚或吲唑化合物所必需的中间体结构,所述方法的特征在于通过包括在水合氯化铁(iii)存在下将由式2表示的化合物还原的步骤来制备由式1表示的化合物。
[0053]
在这里,水合氯化铁(iii)可以被称为六水合氯化铁(iii)或六水合三氯化铁,并用fecl3·
6h2o表示。
[0054]
通过使用水合氯化铁(iii)代替传统的铁(fe)催化剂,本发明可以提高反应的得率和可重复性,并且可以解决由产物例如氧化铁包被反应器而引起的限制。
[0055]
本文中的还原步骤可以在0℃至65℃的温度下进行。具体来说,还原步骤可以在5℃至30℃或10℃至25℃,更具体来说20℃至25℃的温度下进行。
[0056]
所述还原步骤可以通过包含另外的还原剂来进行。具体来说,所述还原剂是选自nabh4、n2h4、9-硼二环[3.3.1]壬烷(9-bbn)、bh3sme2和libh4的至少一者。
[0057]
此外,本发明的制备方法可以进一步包括在还原步骤后纯化得到的化合物的步骤,其中所述纯化可以通过固体纯化方法来进行。
[0058]
具体来说,所述固体纯化可以包括过滤和以任何顺序洗涤所合成的化合物的步骤,其中水、极性有机溶剂或其混合物可用于过滤和洗涤。
[0059]
所述极性有机溶剂具体来说可以包括醇和二氯甲烷中的至少一者,并且所述醇具体来说可以包括甲醇、乙醇、丙醇和丁醇中的至少一者。
[0060]
此外,所述过滤步骤没有具体限制,并且可以通过常规方式进行。例如,所述过滤
步骤可以使用二氧化硅或硅藻土滤器来进行。
[0061]
在下文中,将详细描述式1、式2及其相关说明。
[0062]
[式1]
[0063][0064]
在上式1中,
[0065]
n是1至3的整数,
[0066]
m是0或1,
[0067]
a表示c
3-c
8-环烷基、苯基或各自含有1或2个选自n、o和s原子的杂原子的5-6元杂芳基或杂环,
[0068]
x表示c或n,前提是当x是n时m是0,而当x是c时m是1,
[0069]
r1表示氢、c
1-c
6-烷基或-(ch2)rnr9r
10
,其中r是2至5的整数,r9和r
10
各自独立地表示氢或c
1-c
3-烷基,前提是当x是n时r1是氢,
[0070]
r2表示氢、卤素或c
1-c
6-烷氧基,或表示-(ch2)
p
co2r9、-(ch2)
p
or9、-(ch2)
p
nr9r
10
、-nhr
11
、-n(h)s(o)2r9或-nhc(o)2r
11
,或表示-(ch2)
p-杂环-r
11
,其中所述杂环是含有1或2个选自n、o和s原子的杂原子的5-6元环,其中p是0至3的整数,r9和r
10
与上文所定义的相同,并且r
11
表示氢、酮基、c
1-c
6-烷基羰基、c
1-c
6-烷氧基或c
1-c
6-烷基,或含有1或2个氮原子作为杂原子的5-6元杂环,
[0071]
r3表示氢、卤素、c
1-c
6-烷基或苯基,或-(ch2)
q-杂环,其中所述杂环是含有1或2个选自n和o原子的杂原子的5-6元环,其中q是1至3的整数,前提是当x是n时r3是氢或苯基,
[0072]
r4表示-y1r
12
,其中y1是直接连键或表示-(cr9r
10
)
sy2-,其中s是0至3的整数,r9和r
10
与上文所定义的相同,并且y2选自-o-、-c(o)-和-c(o)o-,并且
[0073]r12
选自氢、卤素、c
1-c
6-烷基和-(ch2)
tb1-r
13
,其中t是0至3的整数,b1表示含有1或2个选自n、o和s原子的杂原子的5-6元杂环或表示c
6-c
10-芳基,r
13
表示氢、氰基、卤素、羟基、酮基、硫醇、羧基或羧基-c
1-c
6-烷基,前提是当x是n时r4是氢或c
1-c
6-烷基,
[0074]
其中烷基、烷氧基、芳基、环烷基、杂环和杂芳基可以任选地被取代,并且取代基是选自羟基、c
1-c
6-烷基氨基、二(c
1-c
6-烷基)氨基、羧基、c
1-c
6-烷基、c
1-c
6-烷氧基、羧基-c
1-c
6-烷基和酮基的一者或多者。
[0075]
[式2]
[0076][0077]
在上式2中,
[0078]
k是1至3的整数,
[0079]
j是0或1,
[0080]
a'表示c
3-c
8-环烷基、苯基或各自含有1或2个选自n、o和s原子的杂原子的5-6元杂芳基或杂环,
[0081]
x'表示c或n,前提是当x'是n时j是0,而当x'是c时j是1,
[0082]
r5表示氢、c
1-c
6-烷基或-(ch2)enr
14r15
,其中e是2至5的整数,r
14
和r
15
各自独立地表示氢或c
1-c
3-烷基,前提是当x'是n时r5是氢,
[0083]
r6表示氢、卤素或c
1-c
6-烷氧基,或表示-(ch2)fc(o)2r
14
、-(ch2)for
14
、-(ch2)fnr
14r15
、-nhr
16
、-n(h)s(o)2r
14
或-nhc(o)2r
16
,或表示-(ch2)
f-杂环-r
16
,其中所述杂环是含有1或2个选自n、o和s原子的杂原子的5-6元环,其中f是0至3的整数,r
14
和r
15
与上文所定义的相同,并且r
16
表示氢、酮基、c
1-c
6-烷基羰基、c
1-c
6-烷氧基或c
1-c
6-烷基或含有1或2个氮原子作为杂原子的5-6元杂环,
[0084]
r7表示氢、卤素、c
1-c
6-烷基或苯基,或-(ch2)
g-杂环,其中所述杂环是含有1或2个选自n和o原子的杂原子的5-6元环,其中g是1至3的整数,前提是当x'是n时r7是氢或苯基,
[0085]
r8表示-y3r
17
,其中y3是直接连键或表示-(cr
14r15
)hy
4-,其中h是0至3的整数,r
14
和r
15
与上文所定义的相同,并且y4选自-o-、-c(o)-和-c(o)o-,并且
[0086]r17
选自氢、卤素、c
1-c
6-烷基和-(ch2)
ib2-r
18
,其中i是0至3的整数,b2表示含有1或2个选自n、o和s原子的杂原子的5-6元杂环,或表示c
6-c
10-芳基,r
18
表示氢、氰基、卤素、羟基、酮基、硫醇、羧基或羧基-c
1-c
6-烷基,前提是当x'是n时r8是氢或c
1-c
6-烷基,
[0087]
其中烷基、烷氧基、芳基、环烷基、杂环和杂芳基可以任选地被取代,并且取代基是选自羟基、c
1-c
6-烷基氨基、二(c
1-c
6-烷基)氨基、羧基、c
1-c
6-烷基、c
1-c
6-烷氧基、羧基-c
1-c
6-烷基和酮基的一者或多者。
[0088]
具体来说,在上式1中,r1可以是氢、c
1-c
6-烷基或二(c
1-c
3-烷基)氨基-c
2-c
3-烷基。
[0089]
此外,r2可以表示氢、卤素、羧基、羧基-c
1-c
3-烷基、c
1-c
3-烷氧基羰基、c
1-c
3-烷氧基羰基-c
1-c
3-烷基、任选地被1个酮基取代的羟基-c
1-c
3-烷基、c
1-c
3-烷氧基、-(ch2)
p
nr9r
10
、-nhr
11
、-n(h)s(o)2r9或-nhc(o)2r
11
,或者可以是-(ch2)
p-杂环-r
11
,其中杂环、p、r9、r
10
和r
11
与上文所定义的相同。
[0090]
此外,r3可以表示氢、甲基或卤素、任选地被c
1-c
3-烷氧基取代的苯基,或者可以是杂环基-c
1-c
3-亚烷基,其中所述杂环是含有1或2个选自n和o原子的杂原子并任选地被1或2个酮基取代的5-6元环。
[0091]
此外,y1可以选自直接连键、-o-、-c(o)-和-ch2c(o)-。
[0092]
此外,r
12
可以选自氢、甲基、乙基、苯基、氟、氯、2-羧基-吡咯烷-1-基、吡咯烷-1-基、4-乙酸-1,3-噻唑啉-2-基、-ch
2-(1,1-二酮基-硫代吗啉-4-基)和-ch
2-(2-酮基哌嗪-4-基)。
[0093]
此外,在上式2中,r5可以是氢、c
1-c
6-烷基或二(c
1-c
3-烷基)氨基-c
2-c
3-烷基。
[0094]
此外,r6可以表示氢、卤素、羧基、羧基-c
1-c
3-烷基、c
1-c
3-烷氧基羰基、c
1-c
3-烷氧基羰基-c
1-c
3-烷基、任选地被1个酮基取代的羟基-c
1-c
3-烷基、c
1-c
3-烷氧基、-(ch2)fnr
14r15
、-nhr
16
、-n(h)s(o)2r
14
或-nhc(o)2r
16
,或者可以是-(ch2)
p-杂环-r
16
,其中杂环、f、r
14
、r
15
和r
16
与上文所定义的相同。
[0095]
此外,r7可以表示氢、甲基或卤素、任选地被c
1-c
3-烷氧基取代的苯基,或者可以是杂环基-c
1-c
3-亚烷基,其中所述杂环是含有1或2个选自n和o原子的杂原子并任选地被1或2个酮基取代的5-6元环。
[0096]
此外,y3可以选自直接连键、-o-、-c(o)-和-ch2c(o)-。
[0097]
此外,r
17
可以选自氢、甲基、乙基、苯基、氟、氯、2-羧基-吡咯烷-1-基、吡咯烷-1-基、4-乙酸-1,3-噻唑啉-2-基、-ch
2-(1,1-二酮基-硫代吗啉-4-基)和-ch
2-(2-酮基哌嗪-4-基)。
[0098]
此外,所述由上式1表示的化合物可以由下述式(1a)或(1b)表示:
[0099]
[式1a]
[0100][0101]
[式1b]
[0102][0103]
其中在上述式中,n、a、r1、r2、r3和r4与上文所定义的相同。
[0104]
此外,所述由上式2表示的化合物可以由下述式(2a)或(2b)表示:
[0105]
[式2a]
[0106][0107]
[式2b]
[0108][0109]
其中在上述式中,k、a'、r5、r6、r7和r8与上文所定义的相同。
[0110]
例如,所述由上述式1或式1a表示的化合物可以是(4-((7-氨基-2-苯基-1h-吲哚-5-基)甲基)硫代吗啉1,1-二氧化物,并且所述由上述式2或式2a表示的化合物可以是(4-((7-硝基-2-苯基-1h-吲哚-5-基)甲基)硫代吗啉1,1-二氧化物。
[0111]
此外,本文中上式2的化合物可以使用常规已知方法来制备。
[0112]
对于其中x是c的吲哚化合物来说,具有简单取代基的化合物(例如7-硝基-吲哚、2,3-二甲基-7-硝基-吲哚等)是可商购的,并且大多数化合物可以通过环化乙炔中间体例如下面反应路线1的化合物(8)来合成。此外,化合物(8)可以从卤代苯化合物(6)和乙炔化合物(7)通过连接反应来合成。
[0113]
[反应路线1]
[0114][0115]
在上述反应路线1中,
[0116]r6*
表示(r6)k-a'-,k、a'、r6和r8与上文所定义的相同,并且q表示碘或溴。
[0117]
为了获得具有优选的r8官能团的式2的化合物,可以进行用所述优选的r8官能团取代上述化合物(2-1)中的r8官能团的额外步骤,并且这可以使用常规已知方法或新方法,但实施方式不限于此。
[0118]
上述化合物(2-1)可以通过将乙炔化合物(8)在碱例如kobut、k2co3和dbu或金属催化剂例如cui和pd(ii)存在下进行环化来制备。
[0119]
乙炔化合物(8)可以通过在金属催化剂存在下添加碱来制备,pd(ii)、cu(i)等被用作金属催化剂,et3n、et2n(ipr)、dbu、n-甲基-吗啉、甲基-吡咯烷、k2co3等用作碱。
[0120]
乙炔化合物(7)通常是可商购的,或者可以按照下述文献中描述的已知方法,通过乙炔在pd(ii)或cu(i)和碱存在下的偶联反应来制备:synthesis,2004,59-61;bioorganic&medicinal chemistry,13,2005,197-209;journal of organic chemistry,71,2006,167-175。所使用的乙炔是三甲基甲硅烷基乙炔或2-甲基-3-丁炔-2-醇,所使用的碱是二乙胺、三乙胺、二异丙基乙胺等。
[0121]
卤代苯化合物(6)可以如下面的反应路线2中所示,从硝基苯胺化合物(13)使用碘或溴来合成:
[0122]
[反应路线2]
[0123][0124]
在上述反应路线2中,r8与上文所定义的相同。
[0125]
硝基苯胺化合物(13)是可商购的,或者可以通过乙酰化、硝化和脱乙酰化反应,从硝基化合物(11)或可商购的苯胺化合物(12)合成。不可商购的苯胺化合物(12)可以从硝基化合物(11)合成,并且同样地,硝基化合物(11)也是可商购的,或者可以从4-氟-硝基苯化合物(9)合成。在反应路线2中,式r
8-h的化合物(10)是指可商购的醇和胺。
[0126]
用于制备化合物(6)的卤化原料可以选自碘、溴、一溴化碘和一氯化碘,并且可以一起使用银离子例如硝酸银(agno3)、碳酸银(agco3)、硫酸银(ag2so4)。
[0127]
可以使用典型的乙酰化和硝化反应从化合物(12)获得化合物(13)。硝化反应可以在低温(-15℃至0℃)下使用硝酸作为储用溶液来进行,或者硝酸可以与各种不同溶剂例如二氯乙烷或二氯甲烷一起使用。此外,硝基的还原反应可以通过使用酸催化剂和金属,或在氢气存在下使用金属催化剂来进行。铁、锌、锂、钠和锡(通常为氯化锡)可用作所述金属,并且无机酸例如盐酸、硫酸、硝酸和磷酸,有机羧酸例如乙酸和三氟乙酸,或氯化铵等,可以用作所述酸催化剂。此外,可以在使用金属催化剂在氢气存在下的还原反应中使用的金属催化剂可以包括钯、镍、铂、钌、铑等,其中氢气的压力通常为1至3个大气压。
[0128]
此外,本发明涉及一种制备由下式3表示的化合物的方法,所述方法包括将由式1表示的化合物与酮或醛反应的步骤:
[0129]
[式3]
[0130][0131]
在上式3中,
[0132]
n'是1至3的整数,
[0133]
m'是0或1,
[0134]
a"表示c
3-c
8-环烷基、苯基或各自含有1或2个选自n、o和s原子的杂原子的5-6元杂芳基或杂环,
[0135]
x"表示c或n,前提是当x"是n时m'是0,而当x"是c时m'是1,
[0136]r19
表示氢、c
1-c
6-烷基或-(ch2)unr
25r26
,其中u是2至5的整数,r
25
和r
26
各自独立地表示氢或c
1-c
3-烷基,前提是当x"是n时r
19
是氢,
[0137]r20
表示氢、卤素或c
1-c
6-烷氧基,或表示-(ch2)vc(o)2r
25
、-(ch2)vor
25
、-(ch2)vnr
25r26
、-nhr
27
、-n(h)s(o)2r
25
或-nhc(o)2r
27
,或表示-(ch2)
v-杂环-r
27
,其中所述杂环是含有1或2个选自n、o和s原子的杂原子的5-6元环,其中v是0至3的整数,r
25
和r
26
与上文所定义的相同,并且r
27
表示氢、酮基、c
1-c
6-烷基羰基、c
1-c
6-烷氧基或c
1-c
6-烷基,或含有1或2个氮原子作为杂原子的5-6元杂环,
[0138]r21
表示氢、卤素、c
1-c
6-烷基或苯基,或表示-(ch2)
w-杂环,其中所述杂环是含有1或2个选自n和o原子的杂原子的5-6元环,其中w是1至3的整数,前提是当x"是n时r
21
是氢或苯基,
[0139]r22
表示-y5r
28
,其中y5是直接连键或表示-(cr
25r26
)
xy6-,其中x是0至3的整数,r
25
和r
26
与上文所定义的相同,并且y6选自-o-、-c(o)-和-c(o)o-,
[0140]r28
选自氢、卤素、c
1-c
6-烷基和-(ch2)
yb3-r
29
,其中y是0至3的整数,b3表示含有1或2个选自n、o和s原子的杂原子的5-6元杂环,或表示c
6-c
10-芳基,r
29
表示氢、氰基、卤素、羟基、酮基、硫醇、羧基或羧基-c
1-c
6-烷基,前提是当x"是n时r
22
是氢或c
1-c
6-烷基,
[0141]r23
表示氢、c
1-c
6-烷基、c
3-c
6-环烷基、杂环或杂环基-c
1-c
6-烷基,其中所述杂环是含有1至3个选自n和o原子的杂原子的3-8元环,前提是当x"是n时r
23
是氢,并且
[0142]r24
表示-(cr
25r26
)
o-z-d-w-r
30
,其中z表示直接连键或选自-c(o)-和-c(o)o-,d表示直接连键、c
4-c
6-环烷基、含有1或2个n原子的5-6元杂芳基或含有1或2个选自n、o和s原子的杂原子的5-6元杂环,w表示直接连键或-nr
25-、-c(o)-、-c(o)o-、-c(o)nr
31-或-s(o)
z-,r
31
表示氢、c
1-c
3-烷基或c
6-c
10-芳基,z是1或2的整数,o是0至3的整数,r
25
和r
26
与上文所定义的相同,r
30
表示氢、羟基、c
1-c
6-烷基、含有1至3个选自n、o和s原子的杂原子的5-6元杂环或c
6-c
10-ar-c
1-c
6-烷基,前提是当x"是n时,r
24
表示c
4-c
6-环烷基或含有1或2个选自n、o和s原子的杂原子的5-6元杂环,
[0143]
其中烷基、烷氧基、芳基、环烷基、杂环和杂芳基可以任选地被取代,并且取代基是
选自羟基、c
1-c
6-烷基氨基、二(c
1-c
6-烷基)氨基、羧基、c
1-c
6-烷基、c
1-c
6-烷氧基、羧基-c
1-c
6-烷基和酮基的一者或多者。
[0144]
应该解释的是,式3的化合物包括其可药用盐和异构体。为描述方便,它们在本文中被简单地表述为式3的化合物。
[0145]
当在本文中使用时,“可药用盐”包括由酸形成的酸加成盐,所述酸能够形成含有可药用阴离子的无毒性酸加成盐,例如无机酸如盐酸、硫酸、硝酸、磷酸、氢溴酸和氢碘酸,有机羧酸如酒石酸、甲酸、柠檬酸、乙酸、三氯乙酸、三氟乙酸、葡萄糖酸、苯甲酸、乳酸、延胡索酸、马来酸和水杨酸,或磺酸如甲磺酸、乙磺酸、苯磺酸、对甲苯磺酸和萘磺酸。此外还包括可药用碱加成盐,例如由锂、钠、钾、钙、镁等形成的碱金属盐或碱土金属盐,与赖氨酸、精氨酸、胍等形成的氨基酸盐,或与二环己胺、n-甲基-d-葡萄糖胺、三(羟甲基)甲胺、二乙醇胺、胆碱、三乙胺等形成的有机盐。根据本发明的式3的化合物可以通过任何常规方法转变成其盐,并且所述盐的形成可以由本领域技术人员在上述式3的结构的基础上容易地进行,对此无需额外解释。
[0146]
此外,本文中的术语“异构体”是指与式3的化合物或其盐具有相同的化学或分子式,但在光学或空间立体上不同的化合物。根据本发明所述的式3的化合物可能具有不对称碳中心,使得所述化合物可以以旋光异构体(r或s异构体)、外消旋体、非对映异构体的混合物或单独的非对映异构体等形式存在。当化合物具有双键时,所述化合物也可能以几何异构体(反式或顺式异构体)的形式存在。所有异构体及其混合物也包括在本发明的范围之内。
[0147]
[执行本发明的方式]
[0148]
下文中将根据实施例更详细地描述本发明。然而,下述实施例旨在说明本发明,并且本发明的范围不受其限制。
[0149]
实施例
[0150]
制备例1
[0151]
4-((7-硝基-2-苯基-1h-吲哚-5-基)甲基)硫代吗啉1,1-二氧化物的合成
[0152]
1)(4-氨基-3-碘-5-硝基苯甲酸)的合成
[0153]
在室温下向反应器添加可商购的(4-氨基-3-硝基苯甲酸)(由sinochem ningbo co.,ltd.制造)(5.0kg)、nis(n-碘代琥珀酰亚胺,9.3kg)、h2so4(0.50kg)和thf(25.0l)并搅拌,然后将反应器加热至80℃的温度并搅拌2小时。然后,在通过hplc分析反应溶剂显示出(4-氨基-3-硝基苯甲酸)的峰为5.0%或更小时终止反应。
[0154]
在确认反应完成后,将反应器的温度冷却至室温,然后向通过减压蒸馏获得的浓缩溶液添加二氯甲烷(dcm,50.0l),以形成固体。将形成的固体在室温搅拌1小时,过滤并洗涤[第1次:dcm(40.0l),第2次:h2o(30.0l),第3次:etoh/h2o=3/7,30.0l],然后在n2压力下干燥16小时,以合成(4-氨基-3-碘-5-硝基苯甲酸)(7.6kg,得率:89.8%,纯度:96.4%)。
[0155]1h nmr(500mhz,dmso-d6)δ13.1(br s,1h),8.52(d,j=1.8hz,1h)8.36(d,j=1.8hz,1h),7.50(s,2h)。
[0156]
2)(7-硝基-2-苯基-1h-吲哚-5-甲酸)的合成
[0157]
在室温下向反应器添加(4-氨基-3-碘-5-硝基苯甲酸)(7.6kg)、三乙胺(tea,7.5kg)、苯乙炔(3.0kg)和1,4-二噁烷(76.0l)并搅拌,然后向其添加作为反应催化剂的cui
[碘化亚铜(i),47.0g]和pd(pph3)2cl2(173.0g),并将反应器加热至60℃的温度。将反应混合物搅拌2小时。然后,在通过hplc分析反应溶液显示出(4-氨基-3-碘-5-硝基苯甲酸)的峰为1.0%或更小时终止反应。
[0158]
然后向反应混合物添加1,8-二氮杂二环[5.4.0]十一碳-7-烯(dbu,22.5kg),将反应器加热至110℃的温度,将反应混合物搅拌18小时,然后终止反应。在将反应混合物冷却至室温后,用3n-hcl水溶液(114.0l)将ph调整到3,向其添加h2o(38.0l),将混合物搅拌2小时,过滤并洗涤[第1次:h2o(38.0l),第2次:etoh/h2o=3/7,23.0l],然后在n2压力下干燥16小时,以合成(7-硝基-2-苯基-1h-吲哚-5-甲酸)(6.1kg,得率:87.4%,纯度:98.0%)。
[0159]1h nmr(500mhz,dmso-d6)δ11.6(s,1h),8.03(s,1h),7.96(m,3h),7.46(t,j=7.7hz,2h)7.36(d,j=7.3hz,1h),7.10(s,1h)
[0160]
3)(7-硝基-2-苯基-1h-吲哚-5-基)甲醇)的合成
[0161]
在室温下向反应器添加(7-硝基-2-苯基-1h-吲哚-5-甲酸)(5.8kg)和thf(61l)并搅拌,然后将反应混合物冷却至12
±
2℃,向其缓慢地逐滴添加5m bh
3-dms(12.3l),使得其内部温度不超过40℃。在滴加完成后,将反应器加热至40℃的温度,然后将反应混合物搅拌2小时。然后,在通过hplc分析反应溶液显示出(7-硝基-2-苯基-1h-吲哚-5-甲酸)的峰为1.0%或更小时终止反应。
[0162]
在确认反应完成后,向反应混合物缓慢地逐滴添加h2o(55l),然后对混合物进行层分离,以保存有机层,并将水层用etoac(29l)萃取,与保存的有机层混合,并在减压下蒸馏。向得到的浓缩物添加etoh/h2o(6.1l/12.2l),搅拌2小时,然后过滤。将得到的固体用清洗液(etoh/h2o=1/3,9.0l)洗涤,然后在n2压力下干燥16小时,以合成(7-硝基-2-苯基-1h-吲哚-5-基)甲醇(4.6kg,得率:83.5%,纯度:98.4%)。
[0163]1h nmr(500mhz,dmso-d6)δ11.6(s,1h),8.07(s,1h),8.00(m,3h),7.49(t,j=7.7hz,2h)7.40(d,j=7.3hz,1h),7.14(s,1h),5.42(t,j=6.7hz,1h),4.66(d,j=6.7hz,2h)。
[0164]
4)4-((7-硝基-2-苯基-1h-吲哚-5-基)甲基)硫代吗啉1,1-二氧化物的合成向反应器添加7-硝基-2-苯基-1h-吲哚-5-基)甲醇(4.6kg)和thf(46l)并在室温下搅拌,将反应器冷却至0℃的温度,然后添加pbr3(2.8kg),同时维持反应的内部温度低于20℃。在添加完成后,将反应器的温度升高至25℃,将混合物搅拌1小时,并在通过取样分析反应混合物显示出5-(羟基甲基)-7-硝基-2-苯基-1h-吲哚的峰为1.0%或更小时终止反应。
[0165]
确认反应的完成,将反应混合物冷却至0℃,并添加1,1-二酮基硫代吗啉hcl(4.4kg)和n,n-二异丙基乙胺(dipea)(8.0kg),同时维持反应的内部温度低于20℃。在添加完成后,将反应器的温度升高至50℃,将混合物搅拌4小时,并在通过取样分析反应混合物显示出5-(溴甲基)-7-硝基-2-苯基-1h-吲哚的峰为1.0%或更小时终止反应。
[0166]
在确认反应完成后,将反应器冷却至0℃的温度,向其添加水(46.0l),将反应混合物搅拌,在减压下蒸馏有机溶剂。在减压下蒸馏后,向其另外添加乙酸乙酯(etoac)(48.0l),并在减压下再次蒸馏有机溶剂,以获得作为固体的4-((7-硝基-2-苯基-1h-吲哚-5-基)甲基)硫代吗啉1,1-二氧化物,然后过滤。将得到的固体用水(26.0l)和乙醇(26.0l)洗涤,并在n2压力下干燥16小时,以合成粗品4-((7-硝基-2-苯基-1h-吲哚-5-基)甲基)硫代吗啉1,1-二氧化物(6.4kg,纯度:92.9%)。
[0167]
为了进行纯化,将上述粗品4-((7-硝基-2-苯基-1h-吲哚-5-基)甲基)硫代吗啉1,1-二氧化物添加到dmf(6.0l)和甲苯(60.0l)的混合物,搅拌,加热至120℃,搅拌2小时,然后在室温下再次搅拌另外2小时。向其另外添加甲苯(60.0l)并继续搅拌2小时,然后过滤出溶液中的固体并用甲苯(20.0l)洗涤,以合成4-((7-硝基-2-苯基-1h-吲哚-5-基)甲基)硫代吗啉1,1-二氧化物(5.1kg,得率:总共77.0%,纯度:98.4%)。
[0168]1h nmr(500mhz,dmso-d6)δ11.63(s,1h),8.07(s,1h),8.04(m,3h),7.49(t,j=7.7hz,2h)7.38(d,j=7.3hz,1h),7.14(s,1h),3.79(s,2h),3.12(m,4h),2.84(m,4h)。
[0169]
实施例1
[0170]
4-((7-氨基-2-苯基-1h-吲哚-5-基)甲基)硫代吗啉1,1-二氧化物的合成
[0171]
在室温下向反应器添加上述制备例1的(4-((7-氨基-2-苯基-1h-吲哚-5-基)甲基)硫代吗啉1,1-二氧化物)(0.345kg)、thf/meoh(2:1,5.18l)和fecl3·
6h2o(2.4g),搅拌30分钟,然后将反应器冷却到0℃至5℃的温度。向其缓慢添加nabh4(0.1kg)共30分钟,将反应器加热到20℃至25℃的温度,搅拌2小时,并在分析反应混合物显示出(4-((-7-硝基-2-苯基-1h-吲哚-5-基)甲基)硫代吗啉1,1-二氧化物)的峰为0.5%par或更小时终止反应。
[0172]
确认反应的完成,向反应混合物添加thf(3.0l)和h2o(1.73l)并搅拌30分钟,然后用硅藻土过滤,将得到的固体用thf/h2o(1:1,1.0l)洗涤。将滤液置于减压下并蒸馏thf以形成固体,将反应混合物在室温搅拌2小时。将得到的混合物过滤,并用清洗液洗涤[第1次h2o:1.73l,第2次乙醇/h2o=1/3,1.73l],然后在n2压力下干燥16小时,得到标题化合物[0.31kg(得率:97.53%,纯度:97.64%par)]。
[0173]1h nmr(500mhz,dmso-d6)δ10.89(s,1h),7.80(m,2h),7.48(t,j=7.7hz,2h)7.30(d,j=7.3hz,1h),6.74(m,2h),6.34(s,1h),5.15(s,2h),3.07(m,4h),2.87(m,4h)。
[0174]
比较例1
[0175]
4-((7-氨基-2-苯基-1h-吲哚-5-基)甲基)硫代吗啉1,1-二氧化物的合成
[0176]
在室温下向反应器添加上述制备例1的4-((7-氨基-2-苯基-1h-吲哚-5-基)甲基)硫代吗啉1,1-二氧化物(0.60kg)、thf/meoh/h2o(1:1:1,3.0l)和nh4cl(124g)并搅拌,然后向其添加fe(480g)。将反应器加热至60℃的温度,将反应混合物搅拌1小时,然后在通过取样分析反应混合物显示出4-((7-硝基-2-苯基-1h-吲哚-5-基)甲基)硫代吗啉1,1-二氧化物的峰为0.5%par或更小时终止反应。
[0177]
确认反应的完成,向反应混合物添加thf(3.0l)并搅拌10分钟,然后用硅藻土过滤,并将得到的固体用thf/h2o洗涤(1:1,3.0l)。将滤液置于减压下并蒸馏thf和meoh,以形成固体,然后将反应混合物在室温搅拌2小时。将得到的固体过滤并用清洗液洗涤[第1次h2o:500ml,第2次etoh/h2o=1/3,1.73l],然后在n2压力下干燥16小时,得到标题化合物[0.45kg(得率:81.3%,纯度:97.2%par)]。
[0178]
从上述结果证实,与比较例1相比,本发明的实施例1可以以出色的得率获得高纯度化合物。具体来说,实施例1的吲哚化合物具有97.53%的得率和97.64%的纯度,而比较例1的吲哚化合物具有81.3%的得率和97.2%的纯度。
[0179]
此外,如上所述,根据本发明的实施方式,由于在反应后没有产生氧化铁,因此反应器未被包被,并且由于在实施例中用作催化剂的水合氯化铁(iii)(fecl3)与比较例中的铁(fe)相比廉价得多,因此根据本发明的方法成本效益高。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。