一种脐血nk细胞的体外增殖培养基、体外培养试剂盒和体外培养方法
技术领域
1.本发明属于细胞体外培养技术领域,具体涉及一种脐血nk细胞的体外增殖培养基、体外培养试剂盒和体外培养方法。
背景技术:
2.自然杀伤细胞(natural killer cell,nk细胞)是人体天然免疫系统的效应细胞,是体内监视恶性病变细胞的主要功能细胞。nk细胞依赖细胞表面固有表达的多种活化性和抑制性受体识别病变细胞,起到一线抗感染以及清除恶性转化、衰老和损伤细胞的作用,是人体抗肿瘤的主力军。nk细胞有多种来源,包括外周血(pb)、脐带血(ucb)、诱导多能干细胞和胚胎干细胞。其中脐带血来源的nk细胞被视为一种潜在的“现成”产品,具有多种优势。
3.但是nk细胞体外增殖方法相对复杂,生产工艺的简化是大规模应用的首要条件。基于饲养细胞的扩增活化工艺,nk细胞扩增倍数较高(数千至数万倍),纯度也可达到约90%;但饲养细胞的存在使得临床应用风险增加,同时需更多的产品检定步骤。基于细胞因子、抗体等的无饲养细胞扩增体系, nk细胞扩增倍数可达数千倍,纯度可达约70%,避免了使用饲养细胞的风险;但该生产工艺仍然存在显著的个体差异,包括细胞活化、体内存留时间等。因此,探索nk细胞纯度、数量、产品稳定性、安全性、工艺可操作性俱佳的nk细胞生产工艺仍是人们面临的挑战。
技术实现要素:
4.有鉴于此,本发明的目的在于提供一种脐血nk细胞的体外增殖培养基、体外培养试剂盒和体外培养方法,简单、安全稳定且通用性强。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.本发明提供了一种脐血nk细胞的体外增殖培养基,所述体外增殖培养基以therapeak
tm
x
‑
vivo
tm
15培养基为基础培养基,还包括重组人白介素
‑
2。
7.优选的,所述重组人白介素
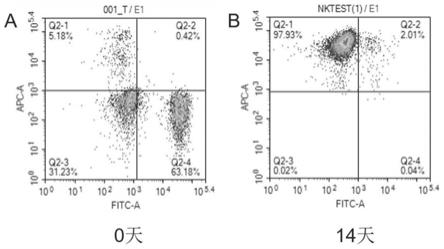
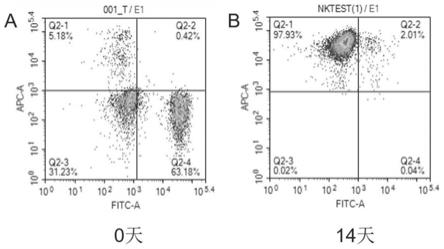
‑
2的工作浓度为200~2000iu/ml。
8.本发明还提供了一种脐血nk细胞的体外培养试剂盒,所述试剂盒包括上述体外增殖培养基。
9.优选的,所述试剂盒还包括脐血nk细胞的活化培养基,所述脐血nk 细胞的活化培养基以cts
tm
aim v
tm
sfm(ruo)培养基为基础培养基,还包括活化因子;
10.所述活化因子包括:重组人白介素
‑
2,重组人白介素
‑
15,stemregenin 1 和重组人过氧化物酶
‑
5(hprdx5)。
11.优选的,所述脐血nk细胞的活化培养基中,重组人白介素
‑
2的工作浓度为200~2000iu/ml,重组人白介素
‑
15的工作浓度为10~50ng/ml, stemregenin 1的工作浓度为1~10μm,重组人过氧化物酶
‑
5(hprdx5)的工作浓度为1~50μm。
12.本发明还提供了一种脐血nk细胞的体外增殖方法,包括以下步骤:将从脐血中分
离的单个核细胞经活化后,利用上述体外增殖培养基进行体外增殖培养;
13.所述体外增殖培养包括在37℃,5%co2饱和湿度环境中进行体外增殖培养。
14.优选的,所述活化后的单个核细胞在所述体外增殖培养基中的浓度为 (1~5)
×
106个/ml。
15.优选的,所述体外增殖培养过程中,每隔2~3天补充一次新鲜的体外增殖培养基,同时调整细胞密度为(1~5)
×
106个/ml,培养10~15天。
16.优选的,所述活化的方法包括:将所述单个核细胞接种到上述体外培养试剂盒的脐血nk细胞的活化培养基中进行活化。
17.优选的,所述活化时单个核细胞的接种密度为(1~5)
×
106个/ml,在 37℃,5%co2饱和湿度环境中培养1~5天。
18.有益效果:本发明提供了一种脐血nk细胞的体外增殖培养基,不包含动物血清,使用时减少免疫反应,应用更安全。本发明利用所述体外增殖培养基对脐血nk细胞进行体外增殖,操作简单易行,成本低廉,无需包被和分选,不需要滋养层细胞,不含动物源成分,安全性和稳定性好,可用于 ficoll分离的pbmc的直接培养,并得到更多量满足临床使用标准的nk细胞。利用本发明所述体外培养方法制备的nk细胞,cd3
‑
cd56
细胞表达率高达90%以上,并且高表达nkg2d、nkp30、nkp46等活化性受体,体外杀瘤活性强。
附图说明
19.图1为培养前和培养14天后流式细胞术检测nk细胞纯度;
20.图2为nk细胞表达cd16和nkg2d、nkp30和nkp44活化性受体情况。
具体实施方式
21.本发明提供了一种脐血nk细胞的体外增殖培养基,所述体外增殖培养基以therapeak
tm
x
‑
vivo
tm
15培养基为基础培养基,还包括重组人白介素
‑
2。
22.本发明所述therapeak
tm
x
‑
vivo
tm
15培养基优选购自美国lonza。本发明所述重组人白介素
‑
2(购自北京双鹭药业股份有限公司)的工作浓度优选为200~2000iu/ml,更优选为500~1500iu/ml,最优选为1000iu/ml。
23.本发明还提供了一种脐血nk细胞的体外培养试剂盒,所述试剂盒包括上述体外增殖培养基。
24.本发明所述试剂盒优选还包括脐血nk细胞的活化培养基,所述脐血 nk细胞的活化培养基优选以cts
tm
aim v
tm
sfm(ruo)培养基为基础培养基,还包括活化因子;所述活化因子优选包括:重组人白介素
‑
2,重组人白介素
‑
15(购自peprotech),stemregenin 1(购自selleck)和重组人过氧化物酶
‑
5(hprdx5,公开于cn110105442a)。
25.在本发明中,所述cts
tm
aim v
tm
sfm(ruo)培养基为无血清淋巴细胞培养基,优选购自thermo fisher scientific公司。
26.本发明所述活化培养基中,所述重组人白介素
‑
2的工作浓度优选为 200~2000iu/ml,更优选为500~1500iu/ml,最优选为1000iu/ml。本发明所述活化培养基中,所述重组人白介素
‑
15的工作浓度优选为10~50ng/ml,更优选为20~30ng/ml,最优选为25ng/ml。本发明所述活化培养基中,所述stemregenin 1的工作浓度优选为1~10μm,更优
选为2μm。本发明所述活化培养基中,所述重组人过氧化物酶
‑
5(hprdx5)的工作浓度优选为 1~50μm,更优选为5~20μm,最优选为10μm。
27.本发明还提供了一种脐血nk细胞的体外增殖方法,包括以下步骤:将从脐血中分离的单个核细胞经活化后,利用上述体外增殖培养基进行体外增殖培养;
28.所述体外增殖培养包括在37℃,5%co2饱和湿度环境中进行体外增殖培养。
29.本发明对所述单个核细胞的分离方法并没有特殊限定,优选利用ficoll 进行分离即可。本发明所述活化的方法优选包括:将所述单个核细胞接种到上述体外培养试剂盒的脐血nk细胞的活化培养基中进行活化,所述活化时单个核细胞的接种密度优选为(1~5)
×
106个/ml,更优选为2
×
106个/ml,在37℃,5%co2饱和湿度环境中培养1~5天。
30.本发明在进行上述活化时,优选将所述单个核细胞接种至cts
tm
aimv
tm
sfm(ruo)培养基中,而后添加活化因子至工作浓度,进行所述活化,经活化1~5天后,收集细胞液。
31.本发明将经所述活化后的单个核细胞接种至体外增殖培养基中进行体外增殖培养,所述接种优选包括将所述活化后的单个核细胞接种至 therapeak
tm
x
‑
vivo
tm
15培养基中,优选调整密度为(1~5)
×
106个/ml,更优选调整至2
×
106个/ml;然后添加重组人白介素
‑
2至工作浓度。本发明在进行所述体外增殖培养时,优选每隔2~3天补充一次新鲜的体外增殖培养基,同时调整细胞密度为(1~5)
×
106个/ml,培养10~15天,收获得到脐血nk细胞。
32.本发明对体外培养得到的nk细胞进行检测,其cd3
‑
cd56
细胞表达率高达90%以上,并且高表达nkg2d、nkp30、nkp46等活化性受体,体外杀瘤活性强。
33.下面结合实施例对本发明提供的一种脐血nk细胞的体外增殖培养基、体外培养试剂盒和体外培养方法进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
34.实施例1
35.体外扩增培养人脐血来源的nk细胞
36.1、分离脐血单个核细胞
37.①
对装有脐带血的血袋经过消毒处理后,吸出脐带血,加入到50ml离心管中进行离心(2000r/min,20min,升速为5,降速为5)。
38.②
离心完成后,将上层的血浆弃去,注意保留血浆与红细胞之间的细胞层。之后用等量的pbs溶液对离心管中的脐带血进行重悬。混合均匀后,取重悬后脐带血一半体积的淋巴细胞分离液(ficoll
‑
hypaque solution,ficoll,购自天津市灏洋生物制品科技有限责任公司)加入到新的50ml离心管内。将重悬后的脐带血缓缓加入到ficoll表面,保持接触面的稳定。之后对离心管进行离心(2000r/min,20min,升速为2,降速为2)。
39.③
离心完成后,能够清晰看到ficoll层与血浆层之间的白膜,这一部分即为单个核细胞。通过吸管将中间层的白膜全部吸出,置于新的离心管中,用pbs溶液对细胞稀释至体积为50ml,离心(1500r/min,5min),共用 pbs反复洗涤3次。
40.2、nk细胞活化培养
41.活化培养脐血nk细胞:用无血清淋巴细胞培养基cts
tm
aim v
tm
sfm (ruo)(购自thermo fisher scientific公司),调整脐血单个核细胞密度为2
ꢀ×
106个/ml,再添加1000iu/ml重组人白介素
‑
2,25ng/ml重组人白介素
‑
15, 2μm stemregenin 1和10μm重组人过氧化物酶
‑
5(hprdx5),在37℃,5%co2饱和湿度环境中培养5天,收集细胞液。
42.3、nk细胞增殖培养
43.增殖培养脐血nk细胞:从活化的细胞液中获取细胞,用therapeak
tm x
‑
vivo
tm
15细胞培养基(购自美国lonza),调整细胞密度为2
×
106个 /ml,再加入1000iu/ml重组人白介素
‑
2,在37℃,5%co2饱和湿度环境中培养,每隔2天补充含有重组人白介素
‑
2的新鲜培养基并调整细胞密度为 2*106/ml,培养10天,收获得到脐血nk细胞。
44.实施例2
45.脐血nk细胞的检测
46.1、采用实施例1的方法对脐血单个核细胞进行体外扩增培养,用 countstar的细胞自动计数仪进行细胞计数,结果如表1和表2所示,脐血细胞14天内平均扩增了305.13倍,但是利用本发明所述体外培养试剂盒和体外培养方法,相同时间内脐血nk细胞平均扩增了5767.37倍。
47.表1脐血细胞的总体数量和扩增倍数(20ml脐血量)
[0048][0049]
表2脐血nk细胞的绝对数量和扩增倍数(20ml脐血量)
[0050][0051]
2、流式细胞仪检测nk细胞纯度
[0052]
结果如表3所示,利用本发明所述体外培养试剂盒和体外培养方法,14 天体外培养后,脐血nk细胞纯度平均可达96.77%。
[0053]
表3脐血nk细胞纯度
[0054] 样本1样本2样本30天脐血nk细胞纯度5.18%5.45%4.47%14天脐血nk细胞纯度97.93%96.51%95.88%
[0055]
3、nk细胞表型鉴定
[0056]
计数nk细胞密度,取1
×
106个细胞1000rpm离心5min,弃上清,用2ml pbs重悬细
胞,离心弃上清。用pbs重悬细胞,设置对照管和试验管,分别加入cd56抗体、cd3抗体、cd16抗体、nkg2d、nkp44和nkp30 抗体(抗体均购自biolegend)。4℃避光孵育20min,分别加入2ml pbs 洗涤细胞,洗去多余的抗体。最后用200μl pbs重悬细胞,用流式细胞仪上机检测。
[0057]
nk细胞表型为cd3
‑
cd56
,单个核细胞经诱导培养后,cd3
‑
cd56
细胞由培养前的5.18%增加到培养后的97.93%,如图1所示,图1中a为培养前单个核细胞的流式细胞术检测结果,图1中b为单个核细胞培养14d后的流式细胞术检测结果。该结果表明,单个核细胞已基本诱导成nk细胞。并且几乎所有nk细胞都表达cd16及活化性受体nkp44、nkp30和nkg2d (图2中a、b、c和d)。
[0058]
4、ldh法测定脐带血nk细胞的杀伤活性
[0059]
采用ldh释放法检测nk细胞对k562和hgc
‑
27的杀伤活性。首先,通过预实验确定靶细胞的最佳细胞量为1
×
104/孔,调整细胞浓度后吸取100 μl用培养基稀释过的细胞悬液至96孔板中。过夜预培养后换成新的100μl 培养基,进行后续操作。按照不同效靶比调节nk细胞浓度,在对应的孔中加入100μl含有nk细胞的培养基,在37℃co2培养箱内培养3.5h,在高对照孔中加入20μl lysis buffer后,在低对照孔和背景blank孔中加入20 μl培养基,在37℃co2培养箱内培养30min。96孔板离心2min(250
×
g),使悬浮细胞沉淀。从每个孔中吸取100μl上清液至新的96孔板中。在每个孔中加入100μl working solution后,在避光、室温的条件下培养20min。在每孔中加入50μl stop solution后,立刻用酶标仪测定490nm的吸光度。细胞损伤率(%)=[(a
‑
c)/(b
‑
c)]
×
100,每孔各做三个复孔,取平均值,其中:
[0060]
a:样品的吸光度(样品孔
‑
样品blank孔);
[0061]
b:高对照的吸光度(高对照孔
‑
高对照blank孔);
[0062]
c:低对照的吸光度(低对照孔
‑
背景blank孔)。
[0063]
结果如表4所示。
[0064]
表4脐血nk细胞对k562和hgc
‑
27的杀伤能力
[0065][0066][0067]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。