一种检测中华绒螯蟹呼肠孤病毒荧光定量pcr检测试剂盒
技术领域
1.本发明涉及微生物检测技术领域,具体地,涉及一种检测中华绒螯蟹呼肠孤病毒荧光定量pcr检测试剂盒。
背景技术:
2.呼肠孤病毒是一种双链rna病毒,具有9至12个线性基因组片段,已在许多宿主中发现,包括脊椎动物、无脊椎动物和植物。近年来,我国淡水中华绒螯蟹的养殖产量有所增加,呼肠孤病毒引起的中华绒螯蟹震颤病(td)是中华绒螯蟹最严重的疾病之一。该病于1994年首次出现在中国江苏省。患有td的螃蟹表现为腿颤抖或弯曲、行动迟缓和食欲不振,目前已有研究者从病蟹中分离出呼肠孤病毒。
3.目前分子生物学检测中应用较多的方法是聚合酶链式反应(pcr),其检测过程pcr仪还需要搭配电泳仪和凝胶成像仪使用,操作步骤多,耗时长,且过程易造成气溶胶污染。实时荧光定量pcr(quantitative real-time pcr)是在常规pcr技术的基础上添加荧光染料或荧光探针,利用荧光信号积累实时监测整个pcr进程,通过标准曲线对未知浓度模板进行定量分析的方法。与普通pcr技术相比,实时荧光定量pcr技术的taqman探针特异性强,可进行单个核苷酸的区分,同时操作更简便,检测时间更短。
4.现有技术中公开了一种中华绒螯蟹呼肠孤病毒rt-lamp检测试剂盒及其检测方法,但灵敏度较低,操作繁琐,无法满足技术人员需求。
技术实现要素:
5.本发明在现有技术的基础上进行了改进措施,提供了一种检测中华绒螯蟹呼肠孤病毒探针法荧光定量pcr检测试剂盒。该试剂盒包含一组检测中华绒螯蟹呼肠孤病毒的引物组和一组检测中华绒螯蟹内参基因的引物组,所述两组引物组均包括一对特异性引物及对应的taqman探针,试剂盒还包括dna聚合酶,反转录酶,ung酶,2
×
反应缓冲液,密封液,阳性对照参考品和阴性对照参考品。本发明提供的试剂盒可直接从复杂样品中检测中华绒螯蟹呼肠孤病毒,具有特异性强、灵敏度高、实验重复性好和操作便捷快速的优点,同时设计内参基因引物作为内部参照,排除因样品核酸问题或者试剂失效导致的异常结果,适用于中华绒螯蟹呼肠孤病毒的现场快速、准确检测。
6.本发明的第一个目的是提供一组检测中华绒螯蟹呼肠孤病毒的引物组
7.本发明的第二个目的是提供一组检测中华绒螯蟹内参基因的引物组。
8.本发明的第三个目的是提供一种检测试剂盒。
9.为了实现上述目的,本发明是通过以下方案予以实现的:
10.一组检测中华绒螯蟹呼肠孤病毒的引物组,所述引物组由正向引物f、反向引物r和荧光探针q组成,所述正向引物f的核苷酸序列如seq id no:3所示,反向引物r的核苷酸序列如seq id no:4所示,荧光探针q的核苷酸序列如seq id no:5所示。
11.一组检测中华绒螯蟹内参基因的引物组,其特征在于,所述引物组由正向引物f、
反向引物r和荧光探针q组成,所述正向引物f的核苷酸序列如seq id no:9所示,反向引物r的核苷酸序列如seq id no:10所示,荧光探针q的核苷酸序列如seq id no:11所示。
12.优选地,所述荧光探针q的5’端标记荧光基团,3’端标记淬灭基团。
13.更优选地,所述荧光探针q的5’端标记6-fam荧光基团,3’端标记mgb淬灭基团。
14.一种检测试剂盒,所述试剂盒包含一组所述检测中华绒螯蟹呼肠孤病毒的引物组。
15.优选地,还包含一组所述检测中华绒螯蟹内参基因的引物组。
16.优选地,所述试剂盒中还包含dna聚合酶、反转录酶、ung酶、2
×
反应缓冲液、密封液、阳性对照参考品和/或阴性对照参考品。
17.优选地,所述dna聚合酶为tth dna polymerase和热启动抗体的混合液,反转录酶为m-mlv逆转录酶,ung酶为尿嘧啶-n-糖基化酶,2
×
反应缓冲液是含有datp、dctp、dgtp和dutp的2
×
浓度的反应溶液,密封液为矿物油。
18.优选地,所述阳性对照参考品为含有中华绒螯蟹呼肠孤病毒检测靶标基因的质粒dna,所述阴性对照参考品为无rna酶的去离子水。
19.优选地,所述试剂盒的反应体系为:一组所述检测中华绒螯蟹呼肠孤病毒的引物组中,正向引物f、反向引物r和荧光探针q引物在反应体系中的终浓度分别为0.4~0.6μm、0.4~0.6μm和0.2~0.3μm;一组所述检测中华绒螯蟹内参基因的引物组中,正向引物f、反向引物r和荧光探针q引物在反应体系中的终浓度分别为0.2~0.4μm、0.2~0.4μm和0.1~0.2μm;2
×
反应缓冲液12.4~12.6μl,dna聚合酶2~4u,反转录酶2~4u、ung酶0.3~0.5u,待检样品2~5μl,加无rna酶的去离子水至25μl。
20.更优选地,所述试剂盒的反应体系为:中华绒螯蟹呼肠孤病毒的引物组的正向引物f、反向引物r和荧光探针q引物在反应体系中的终浓度分别为0.4μm、0.4μm和0.2μm;中华绒螯蟹内参基因的引物组正向引物f、反向引物r和荧光探针q引物在反应体系中的终浓度分别为0.24μm、0.24μm和0.16μm;2
×
反应缓冲液12.5μl,dna聚合酶3u,反转录酶3u、ung酶0.4u,待检样品5μl,加无rna酶的去离子水至25μl。
21.优选地,所述反应体系的反应条件为50℃5min;95℃5min;95℃15s、60℃30s,45个循环。
22.所述试剂盒在检测中华绒螯蟹呼肠孤病毒中的应用。
23.本发明根据扩增曲线来判断检测结果。扩增曲线呈“s”形,检测结果为阳性,即检测样品中含有中华绒螯蟹呼肠孤病毒;无“s”形扩增曲线出现,检测结果为阴性,即检测样品不含有中华绒螯蟹呼肠孤病毒。
24.与现有技术相比,本发明具有以下有益效果:
25.(1)特异性强:本发明用于引物设计的中华绒螯蟹呼肠孤病毒vp9基因序列是一段特异性片段,其核苷酸序列如seq id no:1所示,针对该目的基因片段设计一对特异引物和一个荧光探针进行扩增,特异性强。
26.(2)灵敏度高:对于含有中华绒螯蟹呼肠孤病毒检测靶标基因的阳性质粒,最低检出限可达到101copies/μl;
27.(3)实验重复性高:对阳性对照参考品(质粒浓度106copies/μl和102copies/μl)分别进行20次重复实验,ct值变异系数≤5%;扩增曲线均呈典型“s”型曲线。
28.(4)操作简单且结果直接客观:操作步骤简单,可直接从复杂样品中检测中华绒螯蟹呼肠孤病毒,通过观察扩增曲线直接判断阴阳性,结果直接客观,不需要繁琐的电泳等其他任何分析步骤,对操作人员的经验要求不高,适合现场快速、准确检测。
29.(5)设置内参引物:可根据内参引物的扩增结果是否正常,排除因样品核酸问题或者试剂失效导致的异常结果。
附图说明
30.图1为实施例1中荧光定量pcr法筛选中华绒螯蟹呼肠孤病毒引物组的结果示意图,其中1为中华绒螯蟹呼肠孤病毒引物组1阳性对照,2为中华绒螯蟹呼肠孤病毒引物组2阳性对照,3为中华绒螯蟹呼肠孤病毒引物组1阴性对照,4为中华绒螯蟹呼肠孤病毒引物组2阴性对照。
31.图2为实施例1中荧光定量pcr法筛选中华绒螯蟹内参基因的引物组的结果示意图,其中1为中华绒螯蟹内参基因引物组1阳性对照,2为中华绒螯蟹内参基因引物组2阳性对照,3为中华绒螯蟹内参基因引物组1阴性对照,4为中华绒螯蟹内参基因引物组2阴性对照。
32.图3为实施例2中荧光定量pcr法检测中华绒螯蟹呼肠孤病毒的样品的结果示意图,其中1为阳性对照,2为样品2,3为样品1,4为阴性对照。
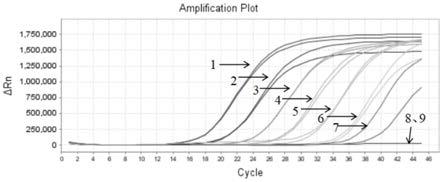
33.图4为实施例3中荧光定量pcr法检测中华绒螯蟹呼肠孤病毒的质粒dna的灵敏度的结果示意图,其中1为107copies/μl,2为106copies/μl,3为105copies/μl,4为104copies/μl,5为103copies/μl,6为102copies/μl,7为101copies/μl,8为100copies/μl,9为阴性对照。
34.图5为实施例4中荧光定量pcr法检测实际样品内参基因的结果示意图,其中1为中华绒螯蟹呼肠孤病毒样品,2为草鱼呼肠孤病毒样品,3为阳性对照样品,4为青蟹顺反子病毒样品,5为ⅰ型疱疹病毒样品,6为阴性对照。
35.图6为实施例4中荧光定量pcr法检测中华绒螯蟹呼肠孤病毒的实际样品的特异性的结果示意图,其中1为阳性对照样品,2为中华绒螯蟹呼肠孤病毒样品,3为草鱼呼肠孤病毒样品,4为青蟹顺反子病毒样品,5为ⅰ型疱疹病毒样品,6为阴性对照。
36.图7为实施例5中荧光定量pcr法检测中华绒螯蟹呼肠孤病毒的质粒dna的重复性的结果示意图,其中1为106copies/μl,2为102copies/μl,3为阴性对照。
具体实施方式
37.下面结合说明书附图及具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
38.实施例1引物组对检测中华绒螯蟹呼肠孤病毒的荧光定量pcr的影响
39.一、设计引物
40.以中华绒螯蟹呼肠孤病毒vp9基因作为特异靶标基因,核苷酸序列如seq id no:1所示;以中华绒螯蟹18s rrna部分基因序列为内参基因,核苷酸序列如seq id no:2所示。
采用引物设计软件primerexpress3.0.1设计的,由生工生物工程(上海)股份有限公司合成。
41.1、中华绒螯蟹呼肠孤病毒的引物组
42.中华绒螯蟹呼肠孤病毒的引物组1中:
43.正向引物f(seq id no:3):5
’‑
agtttgtttgccccggaatac-3’;
44.反向引物r(seq id no:4):5
’‑
aaggtgagatctttggctaattctg-3’;
45.荧光探针q(seq id no:5):5
’‑
atggtctagtgccacatc-3’;
46.荧光探针q的5’端标记6-fam荧光基团,3’端标记能够淬灭荧光基团所发射荧光信号的淬灭基团mgb。
47.中华绒螯蟹呼肠孤病毒的引物组2中:
48.正向引物f(seq id no:6):5
’‑
tccactgagtcatacttttggttacc-3’;
49.反向引物r(seq id no:7):5
’‑
cacagtggcgtcataatcgtaatc-3’;
50.荧光探针q(seq id no:8):5
’‑
acttctcgcacaaaag-3’;
51.荧光探针q的5’端标记6-fam荧光基团,3’端标记能够淬灭荧光基团所发射荧光信号的淬灭基团mgb。
52.2、中华绒螯蟹内参基因的引物组
53.中华绒螯蟹内参基因的引物组1中:
54.正向引物f(seq id no:9):5
’‑
acgtccctgccctttgtacac-3’;
55.反向引物r(seq id no:10):5
’‑
ggcctcactaaatcattcaatcg-3’;
56.荧光探针q(seq id no:11):5
’‑
cgcccgtcgctac-3’;
57.荧光探针q的5’端标记6-fam荧光基团,3’端标记能够淬灭荧光基团所发射荧光信号的淬灭基团mgb。
58.中华绒螯蟹内参基因的引物组2中:
59.正向引物f(seq id no:12):5
’‑
cccagtaagcgcaagtcatga-3’;
60.反向引物r(seq id no:13):5
’‑
gacgggcggtgtgtacaaag-3’;
61.荧光探针q(seq id no:14):5
’‑
tgcgttgattacgtccct-3’;
62.荧光探针q的5’端标记6-fam荧光基团,3’端标记能够淬灭荧光基团所发射荧光信号的淬灭基团mgb。
63.二、进行pcr反应
64.反应体系为:中华绒螯蟹呼肠孤病毒的引物组正向引物f、反向引物r和荧光探针q引物在反应体系中的终浓度分别为0.4μm、0.4μm和0.2μm。中华绒螯蟹内参基因的引物组正向引物f、反向引物r和荧光探针q引物在反应体系中的终浓度分别为0.24μm、0.24μm和0.16μm。2
×
反应缓冲液12.5μl,dna聚合酶3u,反转录酶3u、ung酶0.4u,待检样品5μl,加无rna酶的去离子水至25μl。
65.反应程序为:50℃5min;95℃1min;95℃15s、60℃45s,45个循环。
66.三、实验结果
67.如图1所示,结果表明,中华绒螯蟹呼肠孤病毒引物组1出峰时间早于引物组2,引物组1荧光值高于引物2,两组引物组均未出现非特异性扩增,应选择中华绒螯蟹呼肠孤病毒引物组1作为检测中华绒螯蟹呼肠孤病毒的引物组。
68.如图2所示,结果表明,中华绒螯蟹内参基因引物组1出峰时间早于引物组2,引物组1重复性较引物2好,两组引物组均未出现非特异性扩增,应选择中华绒螯蟹内参基因引物组1作为检测中华绒螯蟹内参基因的引物组。
69.实施例2一种检测中华绒螯蟹呼肠孤病毒荧光定量pcr检测试剂盒
70.一、组成:
71.1、一组实施例1中检测中华绒螯蟹呼肠孤病毒的荧光定量pcr引物组(seq id no:3~5);
72.正向引物f(seq id no:3):5
’‑
agtttgtttgccccggaatac-3’;
73.反向引物r(seq id no:4):5
’‑
aaggtgagatctttggctaattctg-3’;
74.荧光探针q(seq id no:5):5
’‑
atggtctagtgccacatc-3’;
75.荧光探针q的5’端标记6-fam荧光基团,3’端标记能够淬灭荧光基团所发射荧光信号的淬灭基团mgb。
76.2、一组实施例1中检测中华绒螯蟹内参基因的引物组(seq id no:9~11);
77.正向引物f(seq id no:9):5
’‑
acgtccctgccctttgtacac-3’;
78.反向引物r(seq id no:10):5
’‑
ggcctcactaaatcattcaatcg-3’;
79.荧光探针q(seq id no:11):5
’‑
cgcccgtcgctac-3’;
80.荧光探针q的5’端标记6-fam荧光基团,3’端标记能够淬灭荧光基团所发射荧光信号的淬灭基团mgb。
81.3、dna聚合酶、反转录酶、ung酶、2
×
反应缓冲液、密封液、阳性对照参考品和阴性对照参考品。
82.dna聚合酶为tth dna polymerase和热启动抗体的混合液,反转录酶为m-mlv逆转录酶,ung酶为尿嘧啶-n-糖基化酶,2
×
反应缓冲液是含有datp、dctp、dgtp和dutp的2
×
浓度的反应溶液,密封液为矿物油。
83.阳性对照参考品为含有中华绒鳌蟹呼肠孤病毒检测靶标基因seq id no:1和内参基因序列seq id no:2的质粒dna,所述阴性对照参考品为无rna酶的去离子水。
84.二、使用方法
85.1、将样品研磨至均匀状态,向离心管中加入400μl裂解液,振荡混匀30s。室温放置5~10min,10000rpm离心3min去除杂质。
86.2、取出试剂盒中的核酸吸附柱套管,尽可能多的转移上清液至柱子中,10000rpm离心1min。倒弃滤液后把核酸吸附柱套回收集管中,加入500μl洗涤液至吸附柱中,10000rpm离心1min。再加入400μl洗涤液,10000rpm离心1min,弃滤液,10000rpm空离3min,将核酸吸附柱转移至新的1.5ml离心管,加入100μl洗脱液至柱子的膜中央。室温静置1min,10000rpm离心1min。
87.3、弃去柱子,完成提取于-20℃保存备用,长期保存于-80℃。
88.4、进行pcr反应
89.反应体系为:中华绒螯蟹呼肠孤病毒的引物组正向引物f、反向引物r和荧光探针q引物在反应体系中的终浓度分别为0.4μm、0.4μm和0.2μm。中华绒螯蟹内参基因的引物组正向引物f、反向引物r和荧光探针q引物在反应体系中的终浓度分别为0.24μm、0.24μm和0.16μm。2
×
反应缓冲液12.5μl,dna聚合酶3u,反转录酶3u、ung酶0.4u,待检样品5μl,加无rna酶
的去离子水至25μl。
90.反应程序为:50℃5min;95℃1min;95℃15s、60℃45s,45个循环。
91.对提取的rna进行检测,同时设置阴性对照。
92.三、结果判定
93.用上述试剂盒对中华绒螯蟹呼肠孤病毒的实际样品进行检测,样品呈现典型的“s”型曲线扩增(如图3所示),为阳性结果,证明样品中检出中华绒螯蟹呼肠孤病毒。反之,结果为阴性。
94.实施例3灵敏度实验
95.将质粒dna(实施例2的试剂盒中的阳性对照参考品)进行10倍梯度稀释,分别以107copies/μl、106copies/μl、105copies/μl、104copies/μl、103copies/μl、102copies/μl、101copies/μl和100copies/μl八个梯度浓度dna作为模板和阴性对照(无rna酶的去离子水),使用实施例2的试剂盒进行检测。
96.如图4所示,结果表明:将质粒dna进行10倍梯度稀释后,实施例2的试剂盒可检测浓度为101copies/μl的质粒dna。
97.实施例4特异性实验
98.用实施例2的试剂盒分别检测中华绒螯蟹呼肠孤病毒、草鱼呼肠孤病毒、ⅰ型疱疹病毒和青蟹顺反子病毒的样品。
99.如图5所示,结果表明,检测样品内参基因均出现扩增曲线,显示检测样品的核酸正常,排除因样品核酸问题或者试剂失效导致的异常结果。
100.如图6所示,结果表明,仅检测中华绒螯蟹呼肠孤病毒的样品出现扩增曲线,其余样品没有扩增,显示实施例2的试剂盒检测特异性良好。
101.实施例5重复性实验
102.以浓度为106copies/μl和102copies/μl的中华绒螯蟹呼肠孤病毒质粒dna(实施例2的试剂盒中的阳性对照参考品)为模板dna,各自设置20次平行,同时设置阴性对照(无rna酶的去离子水)使用实施例2的试剂盒进行检测。
103.如图7所示,结果表明,质粒dna两个浓度重复20次进行检测实验,重复性良好,ct值变异系数≤5%,证明实施例2的试剂盒稳定性良好。
104.最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
