胰岛素-fc融合蛋白及其应用
技术领域
1.本发明涉及多肽类药物领域,尤其涉及一种在经过位点特异性蛋白酶切割后具有增强的胰岛素活性和延长的体内半衰期的胰岛素-fc融合蛋白、其制备方法和应用。
背景技术:
2.近年来,糖尿病的发病率呈逐年升高趋势,1型糖尿病主要依赖外源性的胰岛素控制血糖;2型糖尿病随着病情的恶化发展,胰岛素也成为其控制血糖的主要药物。因此,利用胰岛素治疗糖尿病已成为较有效的方式。
3.胰岛素疗法对于具有异常胰岛素分泌(i型)或胰岛素抗性(ii型)的患者是必需的,而且通过胰岛素施用能正常调节血液葡萄糖水平。然而,像其它蛋白质和肽激素一样,胰岛素具有很短的体内半衰期,因而具有反复施用的缺点。此类频繁施用对患者引起严重的疼痛和不适。出于这个原因,为了通过延长蛋白质的体内半衰期及降低施用频率来改善生活质量,已经对蛋白质配制剂和化学缀合(脂肪酸缀合物,聚乙烯聚合物缀合物)进行了许多研究。商品化的长效胰岛素包括由sanofi aventis制造的甘精胰岛素(lantus,持续约20小时至22小时),和由novo nordisk制造的地特胰岛素(levemir,持续约18小时至22小时)和tresiba(德谷胰岛素,持续约40小时)。这些长效胰岛素配制剂不产生血液胰岛素浓度峰,因而它们适合作为基础胰岛素。然而,因为这些配制剂不具有足够长的半衰期,所以仍然存在每天或者两到三天注射一次的缺点。因而,在实现每周一次给药频率,以改善需要长期施用胰岛素的糖尿病患者的便利性的预定目标方面存在限制。
4.专利公开cn103509118b中公开了一种与抗体fc区融合的单链胰岛素,虽然体外实验中证明该胰岛素-fc融合蛋白具有改善的半衰期,但是该融合胰岛素的体内降糖活性较低,不适于作为临床施用。
5.控制血糖病症的成功性与要治疗的患者的依从性高度相关,并且期望降低所需的注射频率。然而,现有的这些经修饰的胰岛素分子要么活性很低,不适于临床使用;要么活性很高,施用于患者后有快速降糖效应,导致低血糖的副作用。因此本领域迫切需要一种适合于临床施用的新型长效胰岛素。
技术实现要素:
6.经过大量研究,发明人提供了一种胰岛素-fc融合蛋白,该融合蛋白经过位点特异性蛋白酶切割后获得增强的胰岛素活性和延长的体内半衰期,并且令人惊奇地发现,所述融合蛋白的体内降血糖效应更为平坦和稳定,能够提高临床用药的安全性和患者依从性,从而更好地实现血糖管理并提供更好的生活质量。
7.在一个方面,本发明提供一种胰岛素-fc融合蛋白,其经过位点特异性蛋白酶切割后具有增强的胰岛素活性和延长的体内半衰期,其具有式(i)的结构:
8.x-e1-y-e2-z-l-fc
ꢀꢀ
(i),
9.其中,
10.x和z分别是胰岛素的b链和a链,并且如果x是b链,则z是a链;如果x是a链,则z是 b链。
11.y为任选的连接肽;y的长度可以为1-100个或更多个氨基酸,例如1、2、3、4、5、6、7、8、9、 10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、 33、34、35、36、37、38、39、40、50、60、70、80、90、100个或以上任意两个数值之间的值;例如y 为胰岛素c肽或者其变体或片段。
12.e1和e2中的一个存在或两个都存在,是包含位点特异性蛋白酶切割位点的一段氨基酸;e1和e2 的长度可以是1-10个或更多个氨基酸,例如1、2、3、4、5、6、7、8、9或10个氨基酸;如果同时存在, e1和e2可被相同或不同的位点特异性蛋白酶切割,例如可被相同的位点特异性蛋白酶切割;如果y存在,则优选地e1和e2两个都存在;如果y不存在,则优选地e1和e2中存在一个;所述位点特异性蛋白酶切割位点可以是kex2和/或弗林(furin)蛋白酶的切割位点,例如是kex2蛋白酶的切割位点。
13.l为连接z与fc的接头(linker);l可以是多肽片段,例如,l包含选自ala、thr、gly和ser 中一个、两个或更多个氨基酸的柔性单元(本文中也称柔性肽段),更例如一段由g和s构成的柔性单元; l也可以是包含刚性单元(本文中也称刚性肽段)的多肽片段。
14.在一些实施方案中,所述刚性单元包含或主要由刚性氨基酸构成,所述刚性氨基酸包括但不限于v、 p、i、k和l。
15.在一些实施例中,所述刚性单元包含一个或更多个pppx1lp(seq id no:125),其中x1为任意氨基酸;
16.在另一些实施例中,所述刚性单元包含一个或更多个x2apppx1lp(seq id no:126),其中x1为任意氨基酸,x2为k或v。
17.在另一些实施例中,所述刚性单元包含选自以下序列的多肽片段:
18.pppslpspsrlpgpsdtpilpq(seq id no:127);
19.pppalpapvrlpgp(seq id no:128);和
20.pppalpavapppalp(seq id no:129)。
21.在另一些实施例中,所述刚性单元包含选自以下序列的多肽片段:
22.kapppslpspsrlpgpsdtpilpq(seq id no:130);
23.vapppalpapvrlpgp(seq id no:131);和
24.vapppalpavapppalp(seq id no:132)。
25.在一些实施方案中,l既包含刚性单元,也包含柔性单元,可以是多于两个单元。
26.fc是免疫球蛋白的fc区;所述fc可以来自人免疫球蛋白;所述fc区可以是来自igg、iga、igd、 ige或igm的fc区;优选地,所述fc区是来自igg的fc区,例如来自igg1、igg2、igg3或igg4的 fc区;再优选地,所述fc区是来自igg2的fc区;其中与其来源序列相比,所述fc区可以带有一个或更多个替换、添加和/或缺失,同时仍保留延长半衰期的能力,例如来自人igg的fc区并带有降低或消除与fcγr结合的突变和/或增强与fcrn结合的一个或更多个突变,所述突变可以选自:n297a、 g236r/l328r、l234a/l235a、n434a、m252y/s254t/t256e、m428l/n434s、t250r/m428l;所述fc 区可以是糖基化的或未糖基化的。
27.在一些实施方案中,对于本发明的融合蛋白来说,所述胰岛素选自人胰岛素、牛胰岛素或猪胰岛素,优选地是人胰岛素;例如所述胰岛素的a链和b链源自人胰岛素。
28.在一些实施例中,y、e1和e2都存在,或者其中y不存在,e1和e2中存在一个。
29.在另一些实施例中,所述融合蛋白具有选自seq id no:47-72的氨基酸序列。
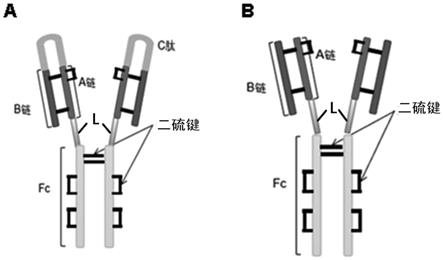
30.在第二个方面中,本发明提供一种胰岛素-fc融合蛋白,其具有ins-l-fc结构。在一些实施方案中,本发明第一个方面的融合蛋白在特异性蛋白酶的作用下,可以去除c链,产生本发明第二个方面所述的融合蛋白。在一些实施方案中,所述胰岛素-fc融合蛋白以同源二聚体的形式存在,其结构示意图如图3 所示。在一些实施方案中,所述胰岛素-fc融合蛋白具有与天然胰岛素类似的二级及三级结构。
31.其中,ins是提供胰岛素活性的胰岛素部分,其包括通过共价键连接的胰岛素a链和b链,但a 链和b链位于不同的肽链中;所述共价键优选地是二硫键。
32.l为连接z与fc的接头;l可以是多肽片段(在本文一些实施方案中也可称为连接肽),例如,l 包含选自ala、thr、gly和ser中一个、两个或更多个氨基酸的柔性单元;l还可以是包含刚性单元的多肽片段。
33.在一些实施例中,所述l包含一个或更多个刚性单元,所述刚性单元包含或主要由刚性氨基酸构成,所述刚性氨基酸包括但不限于v、p、i、k和l。
34.在另一些实施例中,所述刚性单元包含一个或更多个pppx1lp(seq id no:125),其中x1为任意氨基酸。
35.在另一些实施例中,所述刚性单元包含一个或更多个x2apppx1lp(seq id no:126),其中x1为任意氨基酸,x2为k或v。
36.在另一些实施例中,所述刚性单元包含选自以下序列的多肽片段:
37.pppslpspsrlpgpsdtpilpq(seq id no:127);
38.pppalpapvrlpgp(seq id no:128);和
39.pppalpavapppalp(seq id no:129)。
40.在另一些实施例中,所述刚性单元包含选自以下序列的多肽片段:
41.kapppslpspsrlpgpsdtpilpq(seq id no:130);
42.vapppalpapvrlpgp(seq id no:131);和
43.vapppalpavapppalp(seq id no:132)。
44.fc是免疫球蛋白的fc区;所述fc可以来自人免疫球蛋白;所述fc区可以是来自igg、iga、igd、 ige或igm的fc区;优选地,所述fc区是来自igg的fc区,例如来自igg1、igg2、igg3或igg4的 fc区;再优选地,所述fc区是来自igg2的fc区;其中与其来源序列相比,所述fc区可以带有一个或更多个替换、添加和/或缺失,同时仍保留延长半衰期的能力,例如来自人igg的fc区并带有降低或消除与fcγr结合的突变和/或增强与fcrn结合的一个或更多个突变,所述突变可以选自:n297a、 g236r/l328r、l234a/l235a、n434a、m252y/s254t/t256e、m428l/n434s、t250r/m428l;所述fc 区可以是糖基化的或未糖基化的。
45.在一些实施方案中,所述胰岛素选自人胰岛素、牛胰岛素或猪胰岛素,优选地是人胰岛素;例如所述胰岛素的a链和b链源自人胰岛素。
46.在另一些实施方案中,所述l包含ctp,例如包含1、2、3个或更多个ctp。
47.在第三个方面中,本发明提供一种生产具有增强胰岛素活性和延长半衰期的胰岛素-fc融合蛋白的方法,其包括将本发明第一方面中所述的融合蛋白与能切割所述位点的特异性蛋白酶接触,优选地所述位点特异性蛋白酶是kex2和/或弗林(furin)蛋白酶。
48.在一些实施方案中,本发明的具有增强胰岛素活性和延长体内半衰期的胰岛素-fc融合蛋白是由上述方法得到的。
49.在第四个方面中,本发明提供编码所述融合蛋白的多核苷酸,优选地所述多核苷酸是能表达所述融合蛋白的表达载体。
50.在第五个方面中,本发明提供能表达胰岛素-fc融合蛋白的细胞,其包含上述的多核苷酸。
51.在第六个方面中,本发明提供一种生产胰岛素-fc融合蛋白的方法,其包括在表达胰岛素-fc融合蛋白的条件下培养本发明第五个方面中所述的细胞;优选地还包括使所述胰岛素-fc融合蛋白与能切割所述位点的特异性蛋白酶相接触,其中所述培养步骤和接触酶切步骤可以同时进行或分开进行。所述方法还可包括蛋白纯化步骤,获得目的融合蛋白。
52.在第七个方面中,本发明提供能表征胰岛素-fc融合蛋白结构的方法,其包含融合蛋白脱糖分子量的检测和二硫键的表征。
53.在第八个方面中,本发明提供一种药物组合物,其包含以上第一和第三个方面中所述的融合蛋白、第四个方面中所述的多核苷酸或者第五个方面中所述的细胞。
54.在第九个方面中,本发明提供一种降低血糖和/或治疗糖尿病的方法,其包括将第一和第二个方面中所述的融合蛋白、第四个方面中所述的多核苷酸或者第五个方面中所述的细胞施予有此需要的对象,优选地所述糖尿病为i型或ii型糖尿病。此外,当施用本发明第一个方面中所述的融合蛋白时,还可以考虑额外施用适当的位点特异性蛋白酶,或者利用体内存在的适当的位点特异性蛋白酶。
55.对应于以上降低血糖和/或治疗糖尿病的方法,本发明还提供所述融合蛋白、多核苷酸或细胞在制备用于降低血糖和/或治疗糖尿病的药物中的用途。本发明还提供用于降低血糖和/或治疗糖尿病的融合蛋白、多核苷酸或细胞。
附图说明
56.图1示本发明用于胰岛素前体融合蛋白表达的载体示意图;其中,图1a为稳定转染表达载体,图 1b为瞬时转染表达载体。
57.图2示实施例3捕获的胰岛素-fc融合蛋白的sds-page电泳图;m表示marker,不同p为层析过程分段收集的目的蛋白,p dtt为蛋白还原后的目的条带。ss302-002分子sds图旁标注为marker 大小,其它图谱中使用的marker相同。
58.图3示本发明胰岛素-fc融合蛋白酶切前(3a)和酶切后(3b)结构示意图。
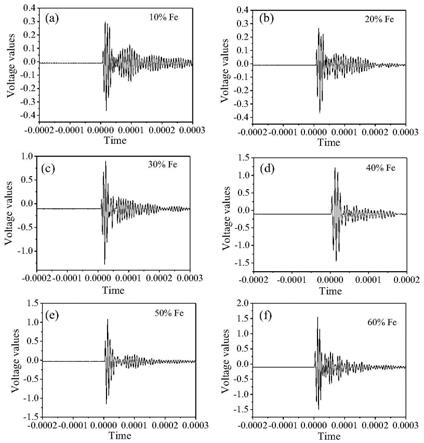
59.图4示酶切前后的ss 302-002分子在正常昆明小鼠中的药效结果图。
60.图5示不同融合蛋白对正常c57小鼠的降糖药效结果图;5a示ss302-012m、ss302-019m、 ss302-029m和ss302-035m的结果,5b示ss302-008m、ss302-014m、ss302-015m和ss302-030m的结果。
61.图6示ss302-035m在正常c57小鼠中的剂量效应图。
62.图7示ss302-002m(7a)和ss302-004m(7b)在i型糖尿病模型小鼠中的降糖效果。
63.图8a和8b示ss302-008m、ss302-012m和ss302-035m在i型糖尿病模型小鼠中的降糖效果。
64.图9示ss302-008m和ss302-012m在正常sd大鼠中的药效结果图。
65.图10示ss302-008m和ss302-012m在sd大鼠中的药代动力学结果。
66.图11示ss302-008m和ss302-012m在正常sd大鼠中的降糖效果(11a)和血药浓度曲线图(11b)。
具体实施方式
67.接下来将结合实施例中对本发明进行更详细的描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。术语胰岛素
68.胰岛素是由胰腺β细胞分泌以促进葡萄糖吸收和抑制脂肪降解的激素,从而起控制血糖水平的作用。在β细胞的细胞核中,第11对染色体短臂上胰岛素基因区dna向mrna转录,mrna从细胞核移向细胞浆的内质网,翻译成由106个氨基酸残基构成的前胰岛素原,在其n末端有20个残基左右的信号肽。前胰岛素原通过内质网膜时,被信号肽酶酶切去信号肽,生成86个氨基酸组成的长肽链——胰岛素原。胰岛素在高尔基体中经蛋白水解酶的作用,切去31位和32位两个精氨酸残基、64位赖氨酸残基和 65位精氨酸残基,断链生成作为连接部分的c肽,同时生成胰岛素,分泌到β细胞外,进入血液循环中。未经过蛋白酶水解的胰岛素原,一小部分随着胰岛素进入血液循环,胰岛素原几乎没有生物活性,其生物活性值仅有胰岛素的5%-10%。
69.本发明所述的“胰岛素”除了包含天然存在的胰岛素之外,还包括胰岛素的功能性变体,所述功能性变体是指对胰岛素的天然序列和/或结构进行修饰,比如添加、缺失和/或替换一个或更多个氨基酸,得到的仍具有胰岛素活性(调节机体中血糖水平)的多肽。氨基酸的替换、添加或缺失可以是天然存在的突变形式,也可以是为了特定目的而进行人工修饰而导致的突变形式。本领域普通技术人员熟知,实践中经常会将胰岛素功能性变体也称为胰岛素。又如cn105636979 b和cn 201480006998所公开的胰岛素类似物。参见本说明书,在本文中也符合这种实践。
70.从另一方面来说,胰岛素的功能性变体是指与天然胰岛素具有至少80%(优选85%、90%、91%、 92%、93%、94%、95%、96%、97%、98%、99%、100%)的氨基酸序列同源性、并仍然具有胰岛素活性的多肽。对于一些功能性变体,在特定氨基酸残基的一些基团上可以进行化学替换(例如,α-甲基化、α-羟基化)、缺失(例如,脱氨)或修饰(例如,n-甲基化)。
71.本领域技术人员熟知胰岛素功能性变体的制备方法和效果检验方法,已经上市的胰岛素类似物例如赖脯胰岛素(礼来)、门冬胰岛素(诺和诺德)、赖谷胰岛素(aventis)、甘精胰岛素(赛诺菲)、地特胰岛素(诺和诺德)和德谷胰岛素(诺和诺德)等。
72.赖脯胰岛素(insulin lispro)是将人胰岛素b链上的第28位的脯氨酸和第29位的赖氨酸位置互换,其他的氨基酸序列和结构没有变化。两个氨基酸顺序颠倒的结果,胰岛素的功能没有发生变化,但原来容易形成二聚体和六聚体的胰岛素,不再容易聚集成二聚体和六聚体,而是以单体的形式存在,这样其在皮下注射后容易吸收,从而实现快速起效。
73.门冬胰岛素(insulin aspart)同样是一种速效胰岛素,是将人胰岛素b28位的脯
氨酸被天冬氨酸所取代,从而使该胰岛素类似物不易形成六聚体,使其在皮下容易吸收,迅速发挥作用。
74.赖谷胰岛素使用了用赖氨酸替代b3位的天冬酰胺,谷氨酸替代b29位赖氨酸,从而实现快速起效的作用。
75.甘精胰岛素(insulin glargine,来得时,lantus),与人胰岛素的区别在于:1)在a链的第21位天冬氨酸被甘氨酸替代;2)b链c-末端加上2个精氨酸残基。这样改变的结果可以发生如下变化:a21位被甘氨酸替换的结果使得六聚体的结合更加稳定,在皮下组织中性环境下,溶解度降低产生沉淀,从而缓慢吸收,类似于基础胰岛素的无峰值分泌,适合长效治疗,如果添加少量锌,则其作用时间会进一步延长;b链c-末端加上2个精氨酸残基的结果改变了胰岛素的等电点,由原来的ph4.5上升至ph6.7,使得在皮下组织中性环境中形成微沉淀物,使胰岛素的分解、吸收及作用时间延长。
76.地特胰岛素(insulin detemir,levermir)由诺和诺德公司研制生产,结构上去除了b30位的氨基酸,在b29位赖氨酸位点上连接上1个n-16-烷酸基的14碳的游离脂肪酸链。在有锌离子存在的药液中,胰岛素分子仍以六聚体形式存在,脂肪酸链的修饰使其在皮下吸收缓慢,血浆中的地特胰岛素由于脂肪酸的存在而会与血浆中的白蛋白结合,而只有游离的地特胰岛素才能发挥降血糖作用,也延长了胰岛素的作用时间。
77.德谷胰岛素去掉b30位的苏氨酸,在b29位赖氨酸位点上,通过一个谷氨酸连接子,与16碳的脂肪二酸侧链相连。在苯酚和锌离子的作用下,德谷胰岛素在制剂中聚合成双六聚体。皮下注射后,随着苯酚的弥散和锌离子缓慢释放,可缓慢而持续地释放出德谷胰岛素单体,进而单体吸收入血。基于上述特征,德谷胰岛素在糖尿病患者体内具有超长作用时间,其半衰期为25小时左右。融合蛋白
78.本文所述的融合蛋白,既指由氨基酸通过肽键连接而成的蛋白,也可以指由2条或更多条肽链通过二硫键连接而形成的蛋白。
79.本发明所述的“胰岛素-fc融合蛋白”是指胰岛素(包括其功能性变体)与免疫球蛋白fc区形成的融合蛋白,在本文中有时被直接简称为“融合蛋白”。此外,为了区分酶切去除连接肽部分前后的胰岛素-fc 融合蛋白,有时会将经酶切前的所述融合蛋白称为“胰岛素前体-fc融合蛋白”,相应地同时出现的“胰岛素-fc融合蛋白”则指经酶切去除连接肽部分后的所述融合蛋白。然而,在本文中更常见的是不特别区分酶切前后的所述融合蛋白,此时所述融合蛋白或胰岛素-fc融合蛋白涵盖其酶切前后的形式。另外,当通过上下文就能理解所述融合蛋白是指哪种形式时,也经常直接使用“融合蛋白”或“胰岛素-fc融合蛋白”来指代这种形式。
80.天然人胰岛素的a链序列为:
81.gly-ile-val-glu-gln-cys-cys-thr-ser-ile-cys-ser-leu-tyr-gln-leu-glu-asn-tyr-cys-asn(seq id no: 1)
82.天然人胰岛素的b链序列为:
83.phe-val-asn-gln-his-leu-cys-gly-ser-his-leu-val-glu-ala-leu-tyr-leu-val-cys-gly-glu-arg-gly-p he-phe-tyr-thr-pro-lys-thr(seq id no:2)
84.本文所述的融合蛋白还可以包含延长体内半衰期的附加序列,所述附加序列例如
选自fc,ctp (c-terminal peptide)、xten、saba(serum albumin binding adnectin)和pas中的一个或更多个。所述附加序列可以位于融合蛋白中的末端、接头或其他位置。为了简化起见,本文中使用的结构式 x-e1-y-e2-z-l-fc和ins-l-fc也涵盖了所述附加序列位于其他位置的这些情形。连接肽(linking peptide)
85.在胰岛素体内加工过程中,连接胰岛素a链和b链的连接肽是c肽。所述c肽既包含其天然存在的序列,也包括在所述天然存在的序列基础上进行一个或多个氨基酸的替换、缺失或添加而形成的具有相同功能的变体形式。
86.作为参考,人胰岛素的天然形式c肽的序列为:
87.glu-ala-glu-asp-leu-gln-val-gly-gln-val-glu-leu-gly-gly-gly-pro-gly-ala-gly-ser-leu-gln-pro-l eu-ala-leu-glu-gly-ser-leu-gln(seq id no:3)
88.在本发明的胰岛素-fc融合蛋白中,所述连接肽不限于天然胰岛素的c肽或其变体/片段,还可以是起到连接胰岛素a链和b链作用的任何其他合适的多肽。在一些实施方案中,所述连接肽的长度可以为1-100个或更多个氨基酸,例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、 19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、50、 60、70、80、90、100个氨基酸或以上任意两个数值之间的值。
89.在一些实施例中,连接肽的序列为:
90.eaedlqvgqvelgggpgagslqplalegsl(seq id no:4)
91.glu-ala-glu-asp-leu-gln-val-gly-gln-val-glu-leu-gly-gly-gly-pro-gly-ala-gly-ser(seq id no: 5),
92.glu-ala-glu-asp-leu-gln-val-gly-gln-val-glu-leu-gly-gly-gly(seq id no:6),或
93.eaedlqvgqvelslqplal(seq id no:7)。
94.在另一些实施例中,连接肽可以是任意不同长度多肽的形式:
95.eaed(seq id no:8),
96.ypgdv(seq id no:9),
97.aa(seq id no:10),或
98.ew(seq id no:11)。fc区/fc片段
99.人免疫球蛋白igg由4个通过二硫键共价连接的多肽(轻链和重链的两个相同拷贝)组成。通过木瓜蛋白酶来蛋白水解igg分子产生两个fab片段和一个fc片段。所述fc片段由通过二硫键连接在一起的两个多肽组成。每个多肽,从n至c末端,由铰链区、ch2结构域和ch3结构域组成。所述fc片段结构在所有亚型的人免疫球蛋白中几乎相同。igg是人血液中最丰富的蛋白之一,其组成了人血清中总免疫球蛋白的70至75%。
100.免疫球蛋白的fc区用作药物载体是安全的,因为它是体内代谢的可生物降解多肽,此外,与整个免疫球蛋白分子相比,免疫球蛋白fc区具有相对低的分子量,因此在融合蛋白的制备、纯化和生产上是有利的。由于免疫球蛋白fc区不包含fab片段(其氨基酸序列根据抗体亚类而不同并且因此是高度不均一的),因此可以预期免疫球蛋白fc区可极大地增加物质的均一性并具有低抗原性。
101.本领域普通技术人员一般认为,术语“免疫球蛋白的fc区”是指含有免疫球蛋白的重链恒定区2 (ch2)和重链恒定区3(ch3),而不含免疫球蛋白的重链和轻链的可变区的蛋白质区段。它还可包含重链恒定区处的铰链区。此外,本发明的免疫球蛋白fc区可含有包含除了重链和轻链的可变区以外的重链恒定区1(ch1)和/或轻链恒定区(cl)的fc区的一部分或全部,只要它具有与天然蛋白质基本相似或更好的生理功能即可。此外,它可以是在ch2和/或ch3的氨基酸序列的相对长的部分中具有缺失的片段。例如,本发明的免疫球蛋白fc区可包含1)ch1结构域、ch2结构域和ch3结构域;2)ch1结构域和ch2结构域;3)ch1结构域和ch3结构域;4)ch2结构域和ch3结构域;5)ch1结构域、 ch2结构域、ch3或cl结构域;6)一种或更多种恒定区结构域与免疫球蛋白铰链区(或其部分)的组合;或7)重链恒定区和轻链恒定区的各个结构域的二聚体。总之,本发明的免疫球蛋白fc区是指具有一个或更多个重链/轻链恒定区结构域或其变体形式、能够赋予融合蛋白延长体内半衰期功能的任何形式的fc或其变体/衍生物,例如单链fc、单体fc。
102.此外,本发明的免疫球蛋白fc区可包括天然氨基酸序列及其序列变体(突变体)。由于一个或更多个氨基酸残基的缺失、插入、非保守或保守替换或其组合,氨基酸序列衍生物具有与天然氨基酸序列不同的序列。例如,在igg fc中,第214至238、297至299、318至322或327至331位处的已知对于结合重要的氨基酸残基可用作修饰的适合靶点。此外,其它多种衍生物也可以,包括其中缺失了能够形成二硫键的区域的、缺失了天然fc形式n-端处数个氨基酸残基的或者向天然fc形式的n-端添加了甲硫氨酸残基的衍生物。此外,为了去除效应子功能,缺失可发生于补体结合位点,如c1q结合位点和adcc 位点。制备这样的免疫球蛋白fc区的序列衍生物的技术公开于wo97/34631和wo96/32478中,其作为参考全文并入本文。此外,本领域普通技术人员熟知,对fc区中一个或更多个氨基酸进行突变可以增强 fc与fcrn的亲和力,延长血清半衰期,比如t250q/m428l突变(cn 1798767 b),这些突变体形式的 fc区也在本发明fc区含义范围内。
103.蛋白质和肽中一般不改变分子活性的氨基酸替换是本领域已知的(h.neurath,r.l.hill,the proteins, academic press,new york,1979)。最常发生的替换是ala/ser、val/ile、asp/glu、thr/ser、ala/gly、ala/thr、 ser/asn、ala/val、ser/gly、thy/phe、ala/pro、lys/arg、asp/asn、leu/ile、leu/val、ala/glu和asp/gly,双向皆可。
104.如果需要,fc区可以通过磷酸化、硫酸化、丙烯酸酯化、糖基化、甲基化、法尼基化(farnesylation)、乙酰化、酰胺化等进行修饰。
105.上述fc衍生物是与本发明的fc区具有相同生物活性或者改善的结构稳定性(例如对热、ph等的结构稳定性)的衍生物。
106.此外,这些fc区可以得自从人和包括牛、山羊、猪、小鼠、兔、仓鼠、大鼠和豚鼠的其他动物中分离的天然形式,或者可以是得自转化的动物细胞或微生物的其重组体或衍生物。在本文中,它们可通过从人或动物有机体分离完整的免疫球蛋白并用蛋白水解酶对它们进行处理而从天然免疫球蛋白获得。木瓜蛋白酶将天然免疫球蛋白消化成fab区和fc区,而胃蛋白酶处理则导致产生pfc’和f(ab’)2片段。例如,可对这些片段进行尺寸排阻层析以分离fc或pfc’。
107.此外,本发明的免疫球蛋白fc区可以是具有天然糖链、与天然形式相比糖链增加或与天然形式相比糖链减少的形式,或者可以是去糖基化的形式。免疫球蛋白fc糖链的增
加、减少或去除可以通过本领域中常用方法完成,如化学法、酶促法、利用遗传工程方法,或者通过将n297糖基化位点突变的方法。从fc片段去除糖链导致与补体(c1q)的结合亲和力明显降低和抗体依赖性细胞介导的细胞毒性或补体依赖性细胞毒性的降低或丧失,从而不会诱导不必要的体内免疫应答。鉴于此,去糖基化或未糖基化形式的免疫球蛋白fc区可更适于本发明的目的以作为药物使用。
108.本发明所使用的术语“去糖基化”意指从fc区酶促地去除糖部分,而术语“未糖基化”意指fc区是以无糖基化形式由原核动物(优选大肠杆菌)产生,或者通过将n297糖基化位点突变为g、a或任意其它氨基酸的方法产生的。
109.此外,免疫球蛋白fc区可以是衍生自igg、iga、igd、ige和igm的fc区,或者通过其组合或杂合制备而成。优选地,其衍生自igg或igm(它们是人类血液中最丰富的蛋白质之一),最优选衍生自igg (已知其延长配体结合蛋白质的半衰期)。
110.本发明所使用的术语“组合”意指编码相同来源的单链免疫球蛋白fc区的多肽与不同来源的单链多肽连接从而形成二聚体或多聚体。即,二聚体或多聚体可以由选自以下的两种或更多种区段形成:igg fc 区段、iga fc区段、igm fc区段、igd fc区段和ige fc区段。蛋白酶酶解
111.胰岛素原是没有活性的或活性很低,现有技术中制备重组胰岛素的常规工艺是用大肠杆菌或酵母菌进行表达,然后用胰酶或胰酶加羧肽酶b来加工成活性分子。然而当使用抗体的fc区与胰岛素形成缀合物时,常规制备工艺是不能使用的,这是因为fc上有很多胰酶的酶切位点,在胰岛素原的加工成活性分子的过程中会被切割失效。现有技术中为了规避上述问题,直接将单链胰岛素与fc区结合,不过发明人经过研究发现,上述胰岛素的体内活性非常低。
112.发明人意外的发现,如果能够模拟胰岛素体内的成熟机制,并制备出与天然胰岛素结构更加接近 (成熟分子中的a链和b链通过二硫键连接)、同时连接有fc区的胰岛素缀合物,则可以大大提高胰岛素的活性。申请人经过大量的筛选,发现如果制备本发明结构的融合多肽,其中引入kex2蛋白酶或弗林蛋白酶(furin)等酶切位点,利用所述蛋白酶进行加工即可获得有活性的长效的胰岛素缀合物分子。
113.本发明中所述的kex2蛋白酶是一种钙离子依赖性蛋白水解酶,能特异性识别和切割arg-arg、 lys-arg等双碱基氨基酸羧基端肽键。与胰蛋白酶不同,kex2不能识别和切割单一碱性氨基酸即精氨酸或赖氨酸的羧基端肽键。在酵母体内kex2蛋白酶负责加工killer toxin和α-factor的前体。kex2蛋白酶活性不受常规的丝氨酸蛋白酶抑制剂如抑肽酶、pmsf、tpck所抑制。
114.本发明中所述的弗林蛋白酶(furin)是真核生物细胞中一种重要的内切蛋白酶,定位于高尔基体外侧的网络中,是一种外泌途径中主要的蛋白质转化酶,其能够识别特定的氨基酸序列,在内质网-高尔基体中经两次自剪切活化后,对分泌途径中许多重要的多肽和蛋白的前体进行剪切加工,使之具有生物活性。因其编码基因(fur)位于原癌基因fes/feps的上游而得名。具体而言,弗林蛋白酶催化切割原蛋白中的arg-xaa-yaa-arg羧基端肽键(xaa为任意一种氨基酸,yaa为arg或lys)产生成熟的蛋白质。
115.本发明的融合多肽经过蛋白酶处理后,a链和b链之间的连接肽被切除,于是a链和
b链之间通过类似天然胰岛素的方式形成二硫键,例如在a7(cys)-b7(cys)、a20(cys)-b19(cys)四个半胱氨酸中的巯基形成两个二硫键,使a、b两链连接起来。另外a链内部的a6(cys)与a11(cys)之间也优选存在一个二硫键。发明人惊奇的发现,即使a链或b链与fc区存在连接,并不影响a链和b链之间形成正确的二硫键连接和空间折叠,形成与fc区融合的胰岛素,进而完成了本发明。接头(linker)
116.在本发明融合蛋白中,接头l的作用在于连接胰岛素a链或b链与fc区可以是多肽,也可以是非肽链的化学结构。
117.在一些实施方案中,接头是多肽,所述多肽包含或主要由a、t、g和/或s构成的柔性单元(柔性肽段),更例如一段由g和s构成的柔性单元;所述柔性单元的长度可以是2-50个或更多个氨基酸,例如2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、 26、27、28、29、30、35、40、45或50个氨基酸。
118.在另一些实施方案中,接头是多肽,所述多肽包含主要由刚性氨基酸构成的刚性单元(刚性肽段),所述刚性氨基酸包括但不限于v、p、i、k和l。结构表征
119.胰岛素-fc融合蛋白由cho细胞发酵分泌,融合蛋白在cho细胞中转录翻译后又经历了一系列的加工,包括脯氨酸羟基化、o糖、n糖、c端的赖氨酸缺失等翻译后修饰,这些修饰发生在胰岛素b链和a链之外的序列上。除此之外,胰岛素-fc融合蛋白在cho细胞的细胞器中还形成了二硫键以稳定其结构。
120.胰岛素-fc融合蛋白的二硫键在两个半胱氨酸(cys)残基间形成。其二硫键根据位置可分为两部分,一部分存在于胰岛素,一部分存在于fc。胰岛素的二硫键位于b链和a链,按照从n端到c端的顺序对b链和a链的氨基酸以位置(x)表示,分别为bx和ax,在一些实施例中,二硫键为cysa7-cysb7、 cysa20-cysb19、cysa6-cysa11。fc区由两条氨基酸序列一样的单链组成,在一些实施例中,每条单链内均有2对二硫键,两条单链之间有2对链间二硫键,fc上共有6对二硫键。
121.uplc-qtof是一种解析生物大分子结构的常规仪器。其主要功能模块为uplc和qtof,待测样品经uplc分离后以溶液的状态进入离子源发生电离,变成带电离子,在加速电场的作用下,进入质量分析器qtof,在电场和磁场的作用下,经三重串联四级杆(q)和飞行时间质谱(tof)两种质量分析器捕获得到各种离子的m/z,软件计算出精确分子量,最终实现复杂生物大分子蛋白的结构解析。本发明采用了uplc-qtof这种常用的具有高分辨率、高灵敏度的仪器方法作为解析融合蛋白的理想手段,主要对融合蛋白的去糖及去糖还原分子量、二硫键及二硫键错配率进行了分析表征。
122.结果表明,在一些实施例中,胰岛素-fc融合蛋白的分子量和二硫键均与理论一致,错配率低,且存在脯氨酸羟基化、o糖基化、n糖基化、c端的赖氨酸缺失等翻译后修饰。实施例1:胰岛素前体融合蛋白表达载体的构建
123.本实施例主要记载胰岛素前体融合蛋白分子构建方法,本文中,胰岛素前体融合蛋白有时也称为胰岛素融合蛋白。该胰岛素前体融合蛋白的分子形式为:proins-l-fc。可在酵母或真核细胞(如cho、hek293等)分泌表达,表达后的蛋白以同源二聚体的形式存在。为帮助蛋白分泌表达,可在蛋白的n 端加入信号肽和/或前肽。信号肽包括但不限于如下表
1所示序列。表1.信号肽序列信号肽名称序列nsmalwmrllpllallalwgpdpaaa(seq id no:12)lsmrslgalllllsaclavsa(seq id no:13)hmm 38mwwrlwwllllllllwpmvwa(seq id no:14)exendin-4mkiilwlcvfglflatlfpiswq(seq id no:15)
124.proins指来自人或其它的天然胰岛素前体或其类似物。所述类似物包括插入、缺失、截短或是突变的胰岛素前体,例如a14e\b16e\b25h\desb30变体,a14e\b16h\b25h\desb30变体或者a14e\desb30 变体等。所述类似物可以是降低胰岛素的免疫原性、或者是降低蛋白酶解以提高胰岛素的稳定性、或者是降低胰岛素与胰岛素受体(ir)的亲和力以延长体内半衰期等。也可以是其它任何用途。
125.本实施例的胰岛素前体可通过蛋白酶如kex2、furin、胰酶等加工成成熟胰岛素。本实施例的胰岛素前体也可通过优化的c肽,促进蛋白的正确折叠和加工。本实施例中选取的胰岛素前体类似物包括但不限于下表3所示。表3.胰岛素前体或类似物序列
126.l表示proins和fc之间的接头,可以是0到任意长度的氨基酸组成,既可以是柔性多肽,也可以是刚性多肽。l可以帮助与fc的同源二聚体相连的两个胰岛素分子各自形成正确的空间结构。优选的,所述l序列包括但不限于如表4、表5所示的序列。表4.柔性接头序列l名称l序列gs-(g4s)5gsggggsggggsggggsggggsggggs(seq id no:23)(g4s)5ggggsggggsggggsggggsggggs(seq id no:24)(g4s)3ggggsggggsggggs(seq id no:25)表5.刚性接头序列
127.fc优选人的igg;更优选的是不含adcc和cdc活性的人igg及其变体,如igg2和igg4;更优选的是突变后延长半衰期的人igg。fc也可以是fc的片段或是fc与其它蛋白/蛋白片段的融合。本发明所选择的fc包括但不限于以下序列。
128.fc1:人igg1 fc
129.epkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvd gvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqv ytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwq qgnvfscsvmhealhnhytqkslslspg(seq id no:36);
130.fc2:人igg2 fc,t250q/p331s/m428l
131.vecppcpappvagpsvflfppkpkdqlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnak tkpreeqfnstfrvvsvltvvhqdwlngkeykckvsnkglpasiektisktkgqprepqvytlppsree mtknqvsltclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscs vlhealhnhytqkslslspgk(seq id no:37);
132.fc3:人igg4 fc,s228p
133.eskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgve vhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlp psqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegn vfscsvmhealhnhytqkslslslg(seq id no:38);
134.fc4:人igg2 fc,t250q/n297a/p331s/m428l
135.vecppcpappvagpsvflfppkpkdqlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnak tkp
reeqfastfrvvsvltvvhqdwlngkeykckvsnkglpasiektisktkgqprepqvytlppsreem tknqvsltclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsv lhealhnhytqkslslspgk(seq id no:39);
136.fc5:人igg2 fc,m252y/s254t/t256e/n297a
137.vecppcpappvagpsvflfppkpkdtlyitrepevtcvvvdvshedpevqfnwyvdgvevhnakt kpreeqfastfrvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemt knqvsltclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvm healhnhytqkslslspgk(seq id no:40);
138.fc6:人igg2 fc,n297a/m428l/n434s
139.vecppcpappvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnakt kpreeqfastfrvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemt knqvsltclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvl healhshytqkslslspgk(seq id no:41);
140.fc7:人igg4 fc,s228p/f234a/l235a
141.eskygppcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgve vhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlp psqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegn vfscsvmhealhnhytqkslslslg(seq id no:42);
142.fc8:人igg4 fc,s228p/m252y/s254t/t256e/n297a
143.eskygppcppcpapeflggpsvflfppkpkdtlyitrepevtcvvvdvsqedpevqfnwyvdgve vhnaktkpreeqfastyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlp psqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegn vfscsvmhealhnhytqkslslslg(seq id no:43);
144.fc9:人igg4 fc,s228p/n297a/m428l/n434s
145.eskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgve vhnaktkpreeqfastyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlp psqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegn vfscsvlhealhshytqkslslslg(seq id no:44);
146.fc15:人igg4 fc,s228p/f234a/l235a
147.eskygppcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgve vhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlp psqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegn vfscsvmhealhnhytqkslslslg(seq id no:45);
148.fc16:人igg2 fc
149.vecppcpappvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnakt kpreeqfnstfrvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreem tknqvsltclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsv mhealhnhytqkslslspgk(seq id no:46)。
150.本发明所构建的部分胰岛素前体融合蛋白的氨基酸序列特征如表6所示。
表6.胰岛素前体融合蛋白(proins-l-fc)序列特征fc)序列特征
151.胰岛素前体融合蛋白可通过蛋白酶如kex2、furin、胰酶等加工,去除c肽等序列,转变为成熟的胰岛素融合蛋白。在本专利的所有实施例中,酶切加工后蛋白的命名均为在前体蛋白名称的末端添加字母m(mature)。例如胰岛素前体融合蛋白ss302-002通过蛋白酶
kex2加工后,成熟蛋白命名为ss302-002m。本发明所示的一些胰岛素前体融合蛋白经蛋白酶加工后得到的成熟胰岛素融合蛋白的氨基酸序列如下。
152.ss302-001m
153.b链:fvnqhlcgshlvealylvcgergffytpktrr(seq id no:73);
154.a链-l-fc1:giveqcctsicslyqlenycngsggggsggggsggggsggggsggggssssskapppslpspsrlpgpsd tpilpqepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyv dgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepq vytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrw qqgnvfscsvmhealhnhytqkslslspg(seq id no:74)。
155.ss302-002m
156.b链:fvnqhlcgshlvealylvcgergffytpktrr(seq id no:75);
157.a链-l-fc2:giveqcctsicslyqlenycngsggggsggggsggggsggggsggggssssskapppslpspsrlpgpsd tpilpqvecppcpappvagpsvflfppkpkdqlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnak tkpreeqfnstfrvvsvltvvhqdwlngkeykckvsnkglpasiektisktkgqprepqvytlppsree mtknqvsltclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscs vlhealhnhytqkslslspgk(seq id no:76)。
158.ss302-003m
159.b链:fvnqhlcgshlvealylvcgergffytpktrr(seq id no:77);
160.a链-l-fc3:giveqcctsicslyqlenycngsggggsggggsggggsggggsggggssssskapppslpspsrlpgpsd tpilpqeskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgve vhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlp psqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegn vfscsvmhealhnhytqkslslslg(seq id no:78)。
161.ss302-004m
162.b链:fvnqhlcgshlvealylvcgergffytpktrr(seq id no:79);
163.a链-l-fc2:giveqcctsicslyqlenycngsggggsggggsggggsggggsggggsvecppcpappvagpsvflfppk pkdqlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvltvvhqdw lngkeykckvsnkglpasiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsdiavewes ngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvlhealhnhytqkslslspgk(seqid no:80)。
164.ss302-005m
165.b链:fvnqhlcgshlvealylvcgergffytpktrr(seq id no:81);
166.a链-l-fc4:giveqcctsicslyqlenycnggggsggggsggggsggggsggggsvecppcpappvagpsvflfppkpk dqlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfastfrvvsvltvvhqdwln gkeykckvsnkglpasiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesng qpennykttp
pmldsdgsfflyskltvdksrwqqgnvfscsvlhealhnhytqkslslspgk(seq idno:82)。
167.ss302-006m
168.b链:fvnqhlcgshlvealylvcgergffytpktrr(seq id no:83);
169.a链-l-fc16:giveqcctsicslyqlenycnsasskapppslpspsrlpgpsdtpilpqvecppcpappvagpsvflfppkpk dtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvltvvhqdwln gkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesng qpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seq idno:84)。
170.ss302-007m
171.b链:fvnqhlcgshlvealylvcgergffytpktrr(seq id no:85);
172.a链-l-fc16:giveqcctsicslyqlenycnsssskapppslpspsrlpgpsdtpilpqvecppcpappvagpsvflfppkpkd tlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvltvvhqdwlng keykckvsnkglpapiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngq pennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seq idno:86)。
173.ss302-008m
174.b链:fvnqhlcgshlvealylvcgergffytpktrr(seq id no:87);
175.a链-l-fc16:giveqcctsicslyqlenycnsasskapppslpspsrlpgpsdtpilpqsssskapppslpspsrlpgpsdtpil pqvecppcpappvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkp reeqfnstfrvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtk nqvsltclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmh ealhnhytqkslslspgk(seq id no:88)。
176.ss302-009m
177.b链:fvnqhlcgshlvealylvcgergffytpktrr(seq id no:89);
178.a链-l-fc16:giveqcctsicslyqlenycngggsvapppalpapvrlpgpasssskapppslpspsrlpgpsdtpilpqvec ppcpappvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqf nstfrvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqvsl tclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealh nhytqkslslspgk(seq id no:90)。
179.ss302-011m
180.b链:fvnqhlcgshlvealylvcgergffytpktrr(seq id no:91);
181.a链-l-fc16:giveqcctsicslyqlenycngggsvapppalpavapppalpasssskapppslpspsrlpgpsdtpilpqvec ppcpappvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqf nstfrvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqvsl tclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealh nhytqkslslspgk(seq id no:92)。
fscsvmhealhnhytqkslslslg(seq id no:102)。
197.ss302-017m
198.b链:fvnqhlcgshlvealylvcgergffytpktrr(seq id no:103);
199.a链-l-fc8:giveqcctsicslyqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpavapppalpapvrlp gpaeskygppcppcpapeflggpsvflfppkpkdtlyitrepevtcvvvdvsqedpevqfnwyvdgvevh naktkpreeqfastyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlpps qeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvf scsvmhealhnhytqkslslslg(seq id no:104)。
200.ss302-018m
201.b链:fvnqhlcgshlvealylvcgergffytpktrr(seq id no:105);
202.a链-l-fc9:giveqcctsicslyqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpavapppalpapvrlp gpaeskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevh naktkpreeqfastyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlpps qeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvf scsvlhealhshytqkslslslg(seq id no:106)。
203.ss302-019m
204.b链:fvnqhlcgshlvealelvcgergfhytpktrr(seq id no:107);
205.a链-l-fc7:giveqcctsicsleqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpavapppalpapvrlp gpaeskygppcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvev hnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlpp sqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnv fscsvmhealhnhytqkslslslg(seq id no:108)。
206.ss302-022m
207.b链:fvnqhlcgshlvealylvcgergffytpktkrikr(seq id no:109);
208.a链-l-fc16:giveqcctsicslyqlenycngggsvapppalpapvrlpgpavapppalpapvrlpgpavecppcpappvagp svflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvlt vvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsd iavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslsls pgk(seq id no:110)。
209.ss302-023m
210.b链:fvnqhlcgshlvealylvcgergffytpktddddk(seq id no:111);
211.a链-l-fc16:giveqcctsicslyqlenycngggsvapppalpapvrlpgpavapppalpapvrlpgpavecppcpappvagp svflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvlt vvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsd iavewe
sngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslsls pgk(seq id no:112)。
212.ss302-029m
213.b链:fvnqhlcgshlvealelvcgergfhytpktrr(seq id no:113);
214.a链-l-fc8:giveqcctsicsleqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpavapppalpapvrlp gpaeskygppcppcpapeflggpsvflfppkpkdtlyitrepevtcvvvdvsqedpevqfnwyvdgvevh naktkpreeqfastyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlpps qeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvf scsvmhealhnhytqkslslslg(seq id no:114)。
215.ss302-030m
216.b链:fvnqhlcgshlvealelvcgergfhytpktrr(seq id no:115);
217.a链-l-fc9:giveqcctsicsleqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpavapppalpapvrlp gpaeskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevh naktkpreeqfastyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlpps qeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvf scsvlhealhshytqkslslslg(seq id no:116)。
218.ss302-035m
219.b链:fvnqhlcgshlvealhlvcgergfhytpkr(seq id no:117);
220.a链-l-fc15:giveqcctsicsleqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpaeskygppcppcpap eaaggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnsty rvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclv kgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhyt qkslslslg(seq id no:118)。
221.ss302-036m
222.b链:fvnqhlcgshlvealelvcgergfhytpkr(seq id no:119);
223.a链-l-fc15:giveqcctsicsleqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpaeskygppcppcpap eaaggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnsty rvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclv kgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhyt qkslslslg(seq id no:120)。
224.ss302-037m
225.b链:fvnqhlcgshlvealylvcgergffytpkr(seq id no:121);
226.a链-l-fc15:giveqcctsicsleqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpaeskygppcppcpap eaaggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnsty r
vvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclv kgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhyt qkslslslg(seq id no:122)。
227.ss302-038m
228.b链:fvnqhlcgshlvealylvcgergffytpktrr(seq id no:123);
229.a链-l-fc15:giveqcctsicslyqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpaeskygppcppcpap eaaggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnsty rvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclv kgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhyt qkslslslg(seq id no:124)。
230.根据《分子克隆实验指南(第三版)》记载的方法,进行胰岛素前体融合蛋白的表达载体构建。
231.根据cho细胞密码子偏好性对各胰岛素前体融合蛋白序列进行密码子优化。
232.优化后的dna序列经全基因合成后通过hindiii和ecori位点克隆到真核表达载体pfrl3.0或 pts1上。pfrl3.0载体包含dihydrofolatereductase(dhfr)基因,可通过dhfr和目的基因的共扩增来实现蛋白的高水平表达,该载体转染cho细胞后通过mtx加压筛选建立稳定表达细胞系。pts1为瞬时转染质粒,不含加压筛选标记,可以快速获得少量胰岛素前体融合蛋白用于早期分子鉴定。胰岛素前体融合蛋白的表达载体示意图如图1a和1b所示。实施例2:胰岛素融合蛋白的表达1.瞬时转染制备目的蛋白
233.将实施例1制备的部分表达胰岛素前体-fc融合蛋白的质粒转入人胚胎肾细胞hek-293中,瞬时表达目的蛋白。复苏hek-293细胞,置于细胞培养摇瓶中传代培养,传代接种密度为1.0
×
106个细胞/ml,培养基为opm-293cd05medium(上海奥浦迈生物科技有限公司),培养条件为37℃,120rpm,co2,每隔两天传代一次,培养一周后可用于瞬时转染。转染前调整细胞密度,使转染当天细胞密度在4.0
×
106个细胞/ml左右。采用fectopro试剂盒(polyplus transfection)将质粒瞬时转染hek-293细胞中,dna 与reagent比例为1:1(μg/μl),每毫升细胞转染1μgdna,对应1μlreagent。用瞬转总体积10%的室温opti-mem(gibco)稀释质粒,震荡混匀。将质粒稀释液一次性加入到reagent的离心管中,立即混匀,室温孵育10min。将制备好的质粒与转染试剂混合物一次性加入调整好的hek-293细胞悬液中,混匀,细胞培养摇瓶放入培养箱,培养条件为温度37℃,5%co2,摇床转速120rpm。细胞转染培养4h后,加入volume ofbooster,每毫升细胞加入0.5μl。培养24小时后,培养条件转换为温度31℃,5%co2,120rpm发酵培养,培养3-5天,细胞活力低于90%时,离心收获上清(3000rpm)并检测表达量,进行下一步纯化并获得目的蛋白。2.稳定表达细胞株的转染和高表达细胞株的筛选
234.将实施例1制备的部分表达胰岛素前体-fc融合蛋白的质粒(转入中国仓鼠卵巢细胞(cho dg44) (invitrogen)中,构建稳定表达细胞系,从中筛选高产的细胞株进行补料分
批培养以制备目的蛋白。
235.用完全培养基复苏宿主细胞dg44并进行培养,完全培养基的组成是cdm1n(上海奥浦迈生物科技有限公司)加上1%ht(invitrogen),培养条件为37℃,5%co2,摇床转速为120rpm。每天无菌吸取一定的细胞悬液计数,当细胞密度达到3
×
10
6-4
×
106个细胞/ml时进行传代培养,传代后细胞初始密度保持在1
×
106个细胞/ml左右。当细胞总量满足转染需求时,收集细胞进行电转染试验。采用电穿孔方法转染宿主细胞(cho dg44),使用bio-rad电转仪,电转时选用4mm的电转杯,具体电转参数:电压为 290v、脉冲长度为20毫秒,电转次数为1次。每次电击1
×
107个细胞,质粒40μg,总体积为0.8ml。电转后将细胞转入含有15ml的恢复培养基(cdm1n 1%ht)中,在细胞培养皿中静置培养48小时。 48小时后,离心细胞并重悬于筛选培养基(cdm1n 100nm mtx)中,将细胞稀释到1
×
104个细胞/ml 左右,接细胞稀释液种于96孔板中,100μl/孔,将细胞置于培养箱中静置培养,培养温度37℃,5%co2。细胞培养5天后补50μl的筛选培养基,待克隆汇合率达到80%或以上时,采用点印迹(dot blotting) 方法分析表达量,抗体为hrp标记羊抗人igg抗体,筛选出表达量相对高的克隆,将表达量高的克隆由 96孔板转入24孔中继续培养,并补加1ml筛选培养基。采用同样的方法进行12孔板和10cm细胞培养皿高产克隆筛选和扩增。
236.为了提高融合蛋白产量,采用递增mtx浓度的加压方法培养细胞。通过mtx对dhfr基因的抑制,实现dhfr基因和融合蛋白基因的共扩增。筛选过程采用了本领域普通技术人员公知的方法,例如具体细节可参见:1.杨薇,王迪,陈克清,等.质粒电穿孔转染条件的选择[j].华中科技大学学报,2009,38 (6):858-860.;2.谷欣,黎燕.电转染哺乳类动物细胞dg44-cho的方法探讨[j].生物技术通讯,2008, 19(1):87;3.jun,kim,baik,hwang,lee:selection strategies for the establishment of recombinant chinese hamster ovary cell line with dihydrofolate reductase-mediated gene amplification.appl microbiol biotechnol. 2005,69(2):162-169.10.1007/s00253-005-1972-8.
[0237]
10cm细胞培养皿中的克隆池经过筛选后,将高产克隆转入细胞培养摇瓶中培养,培养温度37℃, 5%co2,摇床转速120rpm。高产细胞克隆长到一定数目后,收集一部分细胞进行冻存保种,剩余细胞进行补料分批培养。分批补料时接种密度为1
×
106个细胞/ml,细胞置于细胞培养摇瓶中培养,培养温度37℃, 5%co2,摇床转速120rpm。接种后每天取样计数,记录细胞密度和活力。从培养第3天开始补料,每天补料1次。第3~8天,补料量分别为初始体积的2%、3%、4%、3%、3%、3%,第9天后补料量均为2%,总补料比例在20%~30%之间。每天补充一次葡萄糖,维持培养体系内葡萄糖浓度在3~4g/l。培养周期为12-14天,培养结束后离心(3000rpm)收获上清液并检测表达量,进行下一步纯化以获得目的蛋白。实施例3:胰岛素-fc融合蛋白的纯化1.胰岛素前体-fc融合蛋白的捕获
[0238]
实施例2中表达的各个胰岛素前体-fc融合蛋白(ss302-002、ss302-004、ss302-005、ss302-008、 ss302-012、ss302-014、ss302-015、ss302-019、ss302-029、ss302-030、ss302-035)的细胞发酵液经离心和0.22μm的滤膜过滤除去细胞碎片后用亲和层析进行捕获。博格隆proteina作为亲和介质,用3-5 倍柱体积缓冲液(20mm na2hpo4-柠檬酸,ph7.5)平衡protein a层析柱淋洗至基线平稳,再将处理过的发酵液上清进行上样(载量3-8g/l),上样完毕后,用清洗缓冲液(20mm tris,1.5m nacl,2murea,ph7.5)冲洗杂蛋白至基线,最
后用20mm na2hpo
4-柠檬酸,0.4m arg,ph3.5洗脱缓冲液进行洗脱,根据紫外检测器的示数收集,分段收集,当uv280nm吸收值高于0.15au开始收集,再次低于0.20au 停止收集。收集样品立即加入2.0mol/l tris-hcl缓冲液,并缓慢搅动,调整样品至ph6.5-7.0。样品储存于-80℃,并进行后续sds-page分析(图2)及结构鉴定(见实施例4)。
[0239]
sds-page结果如图2所示,其中,load表示层析上样样品,ft表示流穿样品(flow through), wash表示淋洗样品,p1、p2、p3等表示层析过程分段收集的目的蛋白样品,“p合”表示分段收集的样品按照收集体积的体积比合并后样品,naoh表示柱清洗收集的样品,dtt表示还原后的目的蛋白,m表示分子量标记(maker);a:ss302-002,b:ss302-004,c:ss302-005,d:ss302-008,e:ss302-014,f: ss302-019,g:ss302-030,h:ss302-012,i:ss302-015,j:ss302-029,k:ss302-035。从图2可以看出, ss302-002蛋白有明显的上条带(约130kd)和下条带(95-130kd之间),且存在高分子量形式(>170kd)。纯度大于90%的上条带(130kd)收率约60%。ss302-004蛋白具有明显的上条带(95-130kd)和下条带(约95kd),其中下条带p1-4合并样品和上条带p13-15合并样品分别送质谱进行结构鉴定(实施例4),且此分子在捕获蛋白中大部分为95kd的下条带,95-130kd之间纯度大于90%的上条带在捕获收集的蛋白中收率较低(15%左右);ss302-005蛋白在72-95kd之间,电泳条带较宽且称弥散状;这几个分子的共同特征是均含gs柔性接头;而其他分子如ss302-008、ss302-012、ss302-015等,基本都为单一条带,这些分子的共同特征是含ctp、c1等刚性接头。质谱鉴定结果进一步表明(见实施例4):含柔性接头(例如gs)的胰岛素前体-fc融合蛋白二硫键具有一定的错配率,正确条带回收率占比较低;而相对于含柔性接头(例如gs)的胰岛素前体-fc融合蛋白,含刚性接头的胰岛素前体-fc融合蛋白二硫键错配率较低,得到的蛋白中正确折叠的胰岛素前体蛋白含量较高。2.胰岛素前体-fc融合蛋白酶切
[0240]
步骤1中捕获的蛋白利用g25使用缓冲液50mmtris,150mm nacl,ph8.0进行换液,换液后各蛋白用kex2酶切切除c肽得到胰岛素-fc融合蛋白,ss302-002和ss302-004酶切条件为:蛋白终浓度1mg/ml,投料比(质量比)为200:1(前体:kex2),cacl2终浓度20mm/l,总反应体积为5ml和3ml, 37℃水浴6h进行酶切。ss302-008、ss302-012三个蛋白的酶切条件为:蛋白终浓度1mg/ml,投料比(质量比)为50:1(前体:kex2),cacl2终浓度20mm/l,总反应体积为190ml,37℃水浴反应6h。ss302-014、 ss302-015、ss302-019、ss302-029、ss302-030、ss302-035酶切条件为蛋白终浓度1mg/ml,投料比(质量比)为1:25(kex2:前体),cacl2终浓度20mm/l,总反应体积为60-180ml(不同蛋白反应体积略有差异),37℃水浴6h。各胰岛素前体-fc融合蛋白酶切后胰岛素-fc融合蛋白命名为s302-002m、ss302-004m、 ss302-005m、ss302-008m、ss302-012m、ss302-014m、ss302-015m、ss302-019m、ss302-029m、 ss302-030m和ss302-035m。3.酶切后的胰岛素-fc融合蛋白纯化
[0241]
为除去蛋白酶及反应后杂质,得到纯度较高且正确折叠的胰岛素-fc融合蛋白,ss302-004m和 ss302-005m酶切后用10kd超滤管去除蛋白酶及其它杂质,得到纯度较高的胰岛素-fc融合蛋白。 ss302-008m、ss302-012m、ss302-014m、ss302-015m、ss302-029m、ss302-030m酶切后利用疏水层析去除杂质。用3-5个柱体积的20mm tris,1m(nh4)2so4,ph7.5缓冲液平衡疏水层析介质butyl hp(博格隆),平衡完成后开始上样(载量3-8g/l),上
样完毕后,用20mm tris,ph7.5缓冲液线性洗脱(0-100%, 20个柱体积),根据紫外检测器的示数分段收集,并取样检测。ss302-019m、ss302-035m酶切后分两步进行杂质去除,第一步采用阴离子层析,首先用3-5个柱体积的20mm tris,ph8.5缓冲液平衡阴离子层析介质q hp(博格隆),平衡完成后开始上样(载量为5g/l),上样完毕后,用20mm tris,0.5m nacl, ph8.5缓冲液以3ml/min的流速0-60%b 15cv线性洗脱,根据紫外检测器的示数分段收集(方法同上),并取样检测,将纯度较高样品合并用于下一步疏水层析。用3-5个柱体积的20mm tris,1m nacl,ph8.0 缓冲液平衡疏水层析介质butyl hp(博格隆),平衡完成后开始上样,上样载量3-8g/l,上样完毕后,用 20mm tris,ph8.0缓冲液以1ml/min的流速0-100%b 15cv线性洗脱,根据紫外检测器的示数分段收集 (方法同上),并取样进行结构解析-采用uplc-qtof表征其分子量和二硫键,详见实施例4。实施例4:融合蛋白分子结构解析
[0242]
胰岛素融合蛋白前体的结构为proins-l-fc,proins为人胰岛素前体(包括b-c-a),l为接头(linker),其示意图见图3a。胰岛素融合蛋白前体经酶解后会形成成熟蛋白,其结构为胰岛素(b-a)-l-fc,其示意图见图3b。胰岛素融合蛋白采用的接头有柔性接头(例如gs)或刚性接头(例如ctp、c1)。在cho 细胞中发酵时,前肽、刚性接头(例如ctp、c1)上的s和t都可能发生o糖基化,c1这种接头上的p 可能产生脯氨酸羟基化,而gs这种柔性接头则几乎不会发生翻译后修饰。本结构解析采用uplc-qtof 表征其分子量和二硫键。胰岛素-fc融合蛋白分子(含糖修饰)经去糖及去糖还原后,得到容易分析的无糖修饰分子。对ss302-002(约130kd)、ss302-002(95-130kd之间)、ss302-008、ss302-008m、ss302-012、 ss302-012m、ss302-014、ss302-014m、ss302-015、ss302-015m、ss302-019、ss302-019m、ss302-029、 ss302-029m、ss302-030、ss302-030m、ss302-035、ss302-035m进行去糖完整、去糖还原分子检测,对ss302-004(95-130kd之间)、ss302-004(约95kd)、ss302-005进行完整、还原分子检测,结果表明,胰岛素-fc融合蛋白的分子量均与理论一致。
[0243]
胰岛素-fc融合蛋白的空间结构由两个半胱氨酸(cys)残基的巯基间形成二硫键支撑稳定。其二硫键分为两部分,即胰岛素部分的二硫键和fc部分的二硫键。胰岛素部分的二硫键位于b链和a链,按照从n端到c端的顺序对b链和a链的氨基酸命名,分别为bx和ax,其中x为氨基酸的序列号,二硫键为cysa7-cysb7、cysa20-cysb19、cysa6-cysa11。fc由两条序列相同的多肽链组成,每条多肽链上含有2对二硫键,两条多肽链共含有4对二硫键,且两条多肽链之间有2对链间二硫键,故fc共6 对二硫键。理论上,胰岛素-fc融合蛋白的二硫键不受kex2酶解过程影响。胰岛素-fc融合蛋白的二硫键结构解析经由非还原变性换液,以限制性内切酶酶切处理,结合unifi软件分析完成。前处理方法一共有两种。经unifi软件分析时,胰岛素-fc融合蛋白前体的两条链分别命名为1链和2链,经前处理方法 1的glu-c酶解后形成的肽段unifi软件命名为1:vn、2:vn(见表8~表11),经前处理方法2的glu-c 酶和胰酶酶解后形成的肽段unifi软件命名为1:vtn、2:vtn(见表15);胰岛素-fc融合蛋白成熟蛋白的两条b链分别命名为1链和3链,两条a fc链分别命名为2链和4链,经前处理方法2的glu-c 酶和胰酶酶解后形成的肽段unifi软件命名为1:vtn、2:vtn、3:vtn、4:vtn(见表12~表14、表16);其中n为蛋白酶解后肽段的软件编号,编号规则为从n端至c端依次为1、2、3、
……
等等;同时,unifi软件里的二硫键以=表示,链间二硫键位于两个肽段之间,链内二硫键位于肽段的右侧。
[0244]
ss302-002(约130kd)、ss302-002(95-130kd之间)、ss302-004(95-130kd之间)、ss302-004 (约95kd)、ss302-005,采用了前处理方法1进行了二硫键解析。前处理方法1步骤如下:取ss302 蛋白样品至0.5ml10kd超滤管中,在4℃、12000rpm的条件下,浓缩至5mg/ml,取30μl上述浓缩样品,加入8m盐酸胍18μl(ph7.5)和1m iaa(碘乙酰胺)0.48μl,涡旋混匀后于室温避光孵育40min,取1.8μl上述样品,加入50mm tris-hcl 23μl(ph8)缓冲液稀释样品,并按照蛋白:酶=25:1(μg:μg) 加入0.1mg/ml的glu-c酶2.25μl,37℃水浴过夜,次日加入3μl的10%fa(甲酸)终止反应,用 uplc-qtof检测。前处理方法1变性不完全,故linker区域难以酶解,使得胰岛素上的二硫键和铰链区的二硫键通过连接肽连接在一起,分子量大,难以匹配,此方法会缺失关键二硫键信息,主要用于对比 ss302-002(约130kd)与ss302-002(95-130kd之间)这两条带及ss302-004(95-130kd之间)与ss302-004 (约95kd)这两条带之间的二硫键错配情况的差异。
[0245]
ss302-008、ss302-012、ss302-012m、ss302-014、ss302-014m、ss302-015、ss302-015m、 ss302-019m、ss302-029m、ss302-030m、ss302-035、ss302-035m采用前处理方法2进行二硫键解析。前处理方法2步骤如下:取40μl ss302蛋白样品,加入8m盐酸胍120μl,于60℃水浴1h,冷却至室温后,加入1m iaa3.2μl,于室温避光孵育45min,用0.5ml 10kd超滤管在12000rpm、4℃条件下换液3次换至50mm tris-hcl(ph8)缓冲液中,使得换液后样品浓度约为0.62mg/ml。取40μl上述样品,按照蛋白:酶=25:1(μg:μg)加入2μl glu-c酶(0.5mg/ml)和2μltrypsin酶(0.5mg/ml),37℃水浴过夜,次日加入5μl的10%fa终止反应,用uplc-qtof检测。前处理方法2采用胰酶和glu-c酶一起酶解,上述ss302分子均实现linker区域的酶解,正确二硫键得以匹配,此方法错配二硫键的计算结果更真实。
[0246]
结合unifi软件分析uplc-qtof的二硫键检测结果,可解析正确二硫键和错配二硫键,其二硫键错配情况以总错配率和胰岛素错配率表示,其中总错配率为错配二硫键肽段总xic峰面积与所有二硫键肽段总xic峰面积之比,胰岛素错配率为胰岛素部分的错配二硫键总xic峰面积与所有二硫键肽段总 xic峰面积之比。ss302-002、ss302-004、ss302-005、ss302-008、ss302-012、ss302-012m、ss302-014、 ss302-014m、ss302-015、ss302-015m、ss302-019m、ss302-029m、ss302-030m、ss302-035、ss302-035m 的错配率见表7。
[0247]
就包含柔性接头的融合蛋白(ss302-004、ss302-005)而言,ss302-005的错配率是所有分子中最高的,ss302-004的目标带(95-130kd之间)的错配率比较低,但是不易与错配率高的组分分离,故其收率不高。对于接头中既包含柔性部分又包含刚性部分的融合蛋白(ss302-002),其目标带与包含柔性接头的融合蛋白(ss302-004)的总错配率及胰岛素错配率相当,二者均含有总错配率及胰岛素错配率高的组分,且不易于纯化分离。而包含刚性接头的前体蛋白和成熟蛋白(ss302-008、ss302-012、ss302-012m、 ss302-014、ss302-014m、ss302-015、ss302-015m、ss302-019m、ss302-029m、ss302-030m、ss302-035、 ss302-035m)的总错配率和胰岛素错配率均低于8%。对实施例4中ss302-002、ss302-004、ss302-012m、 ss302-019m、ss302-030m、ss302-035、ss302-035m的二硫键结果做详细说明,结果见表8-16。
[0248]
综上表明:刚性接头对胰岛素融合蛋白在cho细胞中结构表达的准确性有很大的积极作用,且刚性越强,其分子结构表达的准确性越高。表7.融合蛋白中二硫键的错配率
注:a表示该融合蛋白包含柔性接头,b表示该融合蛋白包含刚性接头;总错配率为错配二硫键肽段总xic峰面积与所有二硫键肽段总xic峰面积之比;胰岛素错配率为胰岛素部分的错配二硫键总xic峰面积与所有二硫键肽段总xic峰面积之比。1.ss302-002
[0249]
结合sds-page技术,此分子可纯化得到约130kd条带和95-130kd之间条带。对这两条带分别进行二硫键鉴定,估算二硫键总错配率和胰岛素错配率。结果显示约130kd条带的总错配率和胰岛素错配率均为9%,95-130kd之间条带的总错配率和胰岛素错配率均为29%。约130kd条带的二硫键结果见表8,95-130kd之间条带的二硫键结果见表9,错配二硫键主要体现为胰岛素b链自连和胰岛素两条b 链错配。表8.胰岛素前体-fc融合蛋白(ss302-002)约130kd位置条带的二硫键检测结果
注:下划线为错配二硫键所在区段表9.胰岛素前体-fc融合蛋白(ss302-002)95-130kd之间条带二硫键检测结果注:下划线为错配二硫键所在区段2.ss302-004
[0250]
此分子纯化得到95-130kd之间条带(p1-4合并样品)和约95kd条带(p13-15合并样品)。对这两条带分别进行二硫键鉴定,结果显示95-130kd之间条带的总错配率和胰岛素错配率均为4%,约95kd 条带的总错配率和胰岛素错配率均为37%。95-130kd之间条带的二
硫键结果见表10,约95kd条带的二硫键结果见表11,错配二硫键主要体现为胰岛素b链自连和胰岛素两条b链错配。表10.胰岛素前体-fc融合蛋白(ss302-004)95-130kd之间条带二硫键检测结果注:下划线为错配二硫键所在区段表11.胰岛素前体-fc融合蛋白(ss302-004)约95kd位置条带二硫键检测结果注:下划线为错配二硫键所在区段3.ss302-012m
[0251]
此分子的二硫键与理论一致,总错配率为2.9%,胰岛素错配率为2.2%,其二硫键结果见表12。表12.胰岛素前体-fc融合蛋白(ss302-012m)的二硫键检测结果
注:下划线为错配二硫键所在区段4.ss302-019m
[0252]
此分子的二硫键与理论一致,总错配率为2.8%,胰岛素错配率为1.2%,其二硫键结果见表13。表13.胰岛素前体-fc融合蛋白(ss302-019m)的二硫键检测结果
注:下划线为错配二硫键所在区段5.ss302-030m
[0253]
此分子的二硫键与理论一致,总错配率为1.7%,胰岛素错配率为0%,其二硫键结果见表14。表14.胰岛素前体-fc融合蛋白(ss302-030m)的二硫键检测结果
注:下划线为错配二硫键所在区段6.ss302-035
[0254]
此分子的二硫键与理论一致,总错配率为4.3%,胰岛素错配率为2.2%,其二硫键结果见表15。表15.胰岛素前体-fc融合蛋白(ss302-035)的二硫键检测结果
注:下划线为错配二硫键所在区段7.ss302-035m
[0255]
此分子的二硫键与理论一致,总错配率为2.5%,胰岛素错配率为2.0%,其二硫键结果见表16。表16.胰岛素前体-fc融合蛋白(ss302-035m)的二硫键检测结果
注:下划线为错配二硫键所在区段实施例5:ss302-002和ss302-002m对昆明小鼠的降糖效果
[0256]
24只健康雄性昆明小鼠(22-28g)随机分成4组,6只/组:(1)ss302-002m-24nmol/kg;(2) ss302-002-24nmol/kg;(3)甘精胰岛素-48nmol/kg;(4)阴性对照组。颈部皮下注射给药。分别在0、1、 2、4、6、8、10、12、24、36、48、60、72、96h进行血糖值检测。实验过程中小鼠不禁食,给予充足的水和食物。
[0257]
如图4所示,甘精胰岛素药效持续到4h。ss302-002组在给药后4h开始出现明显降糖效果,但 ss302-002组就降糖效果及药效持续时间方面均明显弱于ss302-002m组,ss302-002组vs.ss302-002m 组最大降糖效果依次为(5.33vs.2.97mmol/l)和药效持续时间依次为(36h vs.72h)。上述数据分析表明切除c肽后的胰岛素融合蛋白效价更高,降糖效果更优。实施例6:ss302-008m、ss302-012m、ss302-014m、ss302-015m、ss302-019m、ss302-029m、ss302-030m 和ss302-035m对正常c57小鼠的降糖效果
[0258]
将50只8-10周龄,体重22-28g健康雄性c57小鼠,随机分为10组,5只/组,包括ss302-008m、 ss302-012m、ss302-014m、ss302-015m、ss302-019m、ss302-029m、ss302-030m、ss302-035m、德谷胰岛素和对照组。待测样品按15nmol/kg颈部皮下给药,德谷胰岛素剂量为30nmol/kg,分别于给药前和给药后不同时间点检测血糖值。实验过程中小鼠不禁食。实验数据采用graphpad prism7.0作图, mann-whiteney统计分析差异性。
[0259]
如图5a和5b所示,与对照组相比,给药组小鼠均有明显的降血糖效果。德谷胰岛素(30nmol/kg) 药效持续到12h;在15nmol/kg剂量下,不同胰岛素融合蛋白在正常c57小鼠上的药效持续时间如下: ss302-035m/ss302-030m/ss302-019m/ss302-008m(96h)》ss302-012m(72h)》 ss302-015m(48h)》ss302-029m/ss302-014m(24h)。实施例7:不同剂量ss302-035m在正常c57小鼠中的降糖效果
[0260]
将25只8-10周龄,体重22-28g健康雄性c57小鼠,随机分为5组,5只/组。ss302-035m分别按5、7.5、10、12.5nmol/kg颈部皮下给药,并在0、4、24、48、72、96、120h进行血糖值检测。实验过程中小鼠不禁食。实验结果数据用graphpad prism7.0进行作图,并用mann-whiteney统计分析差异性。
[0261]
如图6所示,在正常c57小鼠中,ss302-035m的降糖效果具有明显的剂量依赖关系。 ss302-035m-5nmol/kg组,血糖最低值4.3mmol/l,药效持续至72h;sss302-035m-7.5nmol/kg组,血糖最低值至3.2mmol/l,药效持续至72h;sss302-035m-10nmol/kg组,血糖最低值至2.8mmol/l,药效持续至96h;sss302-035m-12.5nmol/kg组,血糖最低值至2.5mmol/l,药效持续至96h。实施例8:ss302-004m和ss302-002m在糖尿病模型小鼠中的降糖效果1.stz诱导i型糖尿病小鼠模型
[0262]
c57bl/6j小鼠(8周龄,体重22-28g)腹腔注射柠檬酸-柠檬酸钠缓冲液配制的0.4%链脲佐菌素(stz) 溶液,40mg/kg连续给药五天,每天一次,末次给药后第7-10天检测空腹血糖值。空腹血糖值》13.8mmol/l (空腹时间为8:00a.m-14:00p.m)即为造模成功。2.体内活性和长效性检测
[0263]
取35只stz诱导的i型糖尿病小鼠,按血糖值随机分成7组:1~2:ss302-002m高、低剂量组; 3~4:ss302-004m高、低剂量组;5~6:甘精胰岛素(glargine insulin)高、低剂量组;(7)对照组(20mmtris 300mm nacl)。其中,ss302-002m和ss302-004m的高、低剂量组分别按12.5nmol/kg和6.25nmol/kg 颈部皮下注射给药,甘精胰岛素高、低剂量组分别按25nmol/kg和12.5nmol/kg颈部皮下注射给药。分别于给药前和给药后不同时间点监测血糖值变化。实验过程中小鼠不禁食,给予充足的水和食物。
[0264]
结果如图7a(ss302-002m)和7b(ss302-004m)所示。在stz诱导的i型糖尿病小鼠中给予 ss302-002m、ss302-004m后均有明显的降血糖药效,s302-002m低剂量组药效维持至120h,高剂量组药效维持至192h;s302-004m低剂量组药效维持至84h,高剂量组药效维持至144h。
[0265]
值得注意的是,在相同摩尔的胰岛素,即25nmol/kg给药剂量下,相比ss302-002m和ss302-004m 组,甘精胰岛素组的血糖值下降和恢复程度更为迅速,在给药后1h左右即降到血糖最低点(约5mmol/l),低于正常c57血糖值(约8mmol/l),随后又快速回升,6h回升至初始血糖值。这提示ss302-002m、 ss302-004m具有更为平坦和稳定pd谱,临床安全性更高。实施例9:ss302-008m、ss302-012m和ss302-035m在糖尿病模型小鼠中的降糖效果1.stz诱导小鼠i型糖尿病模型
[0266]
c57bl/6j小鼠(12周龄,体重22-28g)腹腔注射柠檬酸-柠檬酸钠缓冲液配制的0.4%链脲佐菌素 (stz)溶液,40mg/kg连续给药五天,每天一次,在最后一次给药后第7-10天检测空腹血糖值》13.8mmol/l (空腹时间为8:00a.m-14:00p.m),即为造模成功。
[0267]
2.体内活性和长效性检测
[0268]
取40只stz造模成功的i型糖尿病小鼠,按血糖值随机分成8组:(1)ss302-008m-7.5nmol/kg 组;(2)ss302-012m-7.5nmol/kg组;(3)ss302-035m-7.5nmol/kg组;(4)ss302-008m-15nmol/kg组; (5)ss302-012m-15nmol/kg组;(6)ss302-035m-15nmol/kg组;(7)德谷胰岛素-30nmol/kg;(8)缓冲液对照组(20mm tris 150mm nacl)。分别在给药前和给药后不
同时间点进行血糖值检测。实验过程中小鼠不禁食。实验结果采用graphpad prism7.0进行作图,mann-whiteney统计分析差异性。
[0269]
如图8a和8b所示,相同剂量下ss302-035m的药效维持时间明显优于ss302-008m和s302-012m,尤其在低剂量7.5nmol/kg组(144h vs.72h)。图8b中德谷胰岛素在30nmol/kg给药后,糖尿病小鼠的血糖值迅速下降和恢复,1h左右即降到最低点,24h回升至初始血糖值。这提示ss302-008m、ss302-012m、 ss302-035m具有更长的pd谱,药效维持时间远优于德谷胰岛素。实施例10:ss302-008m和ss302-012m在sd大鼠的药效动力学(pd)和药代动力学(pk)实验
[0270]
10只sd大鼠(8-10周龄,体重250-350g)随机分为2组,每组3
♂
/2
♀
,分别按20nmol/kg颈部皮下给与ss302-008m、ss302-012m。在给药前和给药后的不同时间点检测血糖值,并采集全血,分离血清用于pk检测。实验过程中不禁食,给予充足的水和食物。全部数据用graphpad prism7.0进行作图,并用mann-whiteney统计分析差异性。2、elisa检测
[0271]
鼠抗胰岛素单克隆抗体(abcam,ab8302)用pbs稀释至1ug/ml,100μl/孔加入酶标板,放置于4℃过夜包被;去除包被液,pbst洗板4次后加入4%bsa,250μl/孔,37℃封闭2h;去除封闭液后用pbst洗板4次。ss302-008m/ss302-012m标准品用2%bsa稀释,从200ng/ml起始,倍比稀释共8 个梯度建立标曲。大鼠血清用2%bsa稀释为不同的倍数。阴性对照为正常大鼠血清。将上述样品100μl/ 孔加入酶标板,于37℃孵育1h;pbst洗板4次,加入2%bsa稀释的二抗(mouse monoclonalanti-human igg2fc(hrp),1:3000)(abcam,ab99779),100μl/孔,37℃孵育1h;pbst洗板4次后加入tmb显色液,100μl/孔,37℃避光显色10min;加入2m h2so4,50μl/孔,终止反应,酶标仪检测 od450/630值。3、药效动力学实验结果
[0272]
如图9所示:给与ss302-008m和ss302-012m后sd大鼠均有明显的降血糖效果。ss302-008m 药效维持至96h,而ss302-012 m药效维持至72h。4、药代动力学结果和分析
[0273]
ss302-008m和ss302-012m在sd大鼠中的药代动力学结果如图10所示。ss302-008m和 ss302-012m在sd大鼠中的半衰期(t1/2)分别为16.32
±
0.77h和13.39
±
0.43h,具体pk参数见表17。表17.ss302-008m和ss302-012m的pk参数
实施例11:ss302-035m在比格犬中药效动力学(pd)和药代动力学(pk)实验
[0274]
8-12kg雄性健康普通级比格犬(4只)单次皮下给与2.5nmol/kg ss302-035m后评估药效动力学和药代动力学参数。分别于给药前和给药后不同时间点采集血样,采样部位为四肢外周静脉。每个时间点采集约1ml全血,放入含edta-k2的抗凝管中,随后于4℃条件下3000g/min离心10min收集血浆。在给药前0h和给药后1、2、3、4、6、24、48、72、96、120、144及168h时间点取一滴全血用快速血糖仪(罗氏accu-chek performa)和血糖试纸(罗氏accu-chek performa)测定动物的血糖值。药效动力学(pd)结果如图11a所示;药代动力学(pk)结果如图11b所示。实验过程中0-6h内禁食,之后动物自由进食进水。使用winnonlin 8.2软件计算药代动力学参数(非房室模型),相关的pk参数显示在表18中。pd结果显示:ss302-035m在2.5nmol/kg剂量下能显著性地降低比格犬随机血糖,降糖的效果持续到120h,并且未出现明显的低血糖的症状。pk结果显示:在2.5nmol/kg剂量下,ss302-035m在正常比格犬的体内半衰期为37.65
±
7.36h。表18.ss302-035m的pk参数pk参数结果auc
0-∞
(ng*hr/ml)14631.28
±
628.94t1/2(hr)37.65
±
7.36t
max
(hr)2
±
0c
max
(ng/ml)485.75
±
26.18vss(ml/kg)498.53
±
55.90cl(ml/hr/kg)11.83
±
1.29mrt(hr)39.05
±
4.11本发明实施例中构建的融合蛋白前体全长序列如下:1)胰岛素前体融合蛋白ss302-001 seq id no:47fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkrgive qcctsicslyqlenycngsggggsggggsggggsggggsggggssssskapppslpspsrlpgpsdtpilp qepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgve vhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytl ppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgn vfscsvmhealhnhytqkslslspg2)胰岛素前体融合蛋白ss302-002 seq id no:48
fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkrgive qcctsicslyqlenycngsggggsggggsggggsggggsggggssssskapppslpspsrlpgpsdtpilp qvecppcpappvagpsvflfppkpkdqlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpr eeqfnstfrvvsvltvvhqdwlngkeykckvsnkglpasiektisktkgqprepqvytlppsreemtkn qvsltclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvlhe alhnhytqkslslspgk3)胰岛素前体融合蛋白ss302-003 seq id no:49fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkrgive qcctsicslyqlenycngsggggsggggsggggsggggsggggssssskapppslpspsrlpgpsdtpilp qeskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhn aktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsq eemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfs csvmhealhnhytqkslslslg4)胰岛素前体融合蛋白ss302-004 seq id no:50fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkrgive qcctsicslyqlenycngsggggsggggsggggsggggsggggsvecppcpappvagpsvflfppkpkd qlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvltvvhqdwlng keykckvsnkglpasiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngq pennykttppmldsdgsfflyskltvdksrwqqgnvfscsvlhealhnhytqkslslspgk5)胰岛素前体融合蛋白ss302-005 seq id no:51fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkrgive qcctsicslyqlenycnggggsggggsggggsggggsggggsvecppcpappvagpsvflfppkpkdql misrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfastfrvvsvltvvhqdwlngke ykckvsnkglpasiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpe nnykttppmldsdgsfflyskltvdksrwqqgnvfscsvlhealhnhytqkslslspgk6)胰岛素前体融合蛋白ss302-006 seq id no:52fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkrgive qcctsicslyqlenycnsasskapppslpspsrlpgpsdtpilpqvecppcpappvagpsvflfppkpkdtlm isrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvltvvhqdwlngkey kckvsnkglpapiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpen nykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk7)胰岛素前体融合蛋白ss302-007 seq id no:53fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkrgive qcctsicslyqlenycnsssskapppslpspsrlpgpsdtpilpqvecppcpappvagpsvflfppkpkdtlmi srtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvltvvhqdwlngkeyk ckvsnkglpapiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpenn ykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk8)胰岛素前体融合蛋白ss302-008 seq id no:54fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkrgive qcctsicslyqlenycnsasskapppslpspsrlpgpsdtpilpqsssskapppslpspsrlpgpsdtpilpqve cppcpappvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeq fnstfr
vvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqvs ltclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealh nhytqkslslspgk9)胰岛素前体融合蛋白ss302-009 seq id no:55fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkrgive qcctsicslyqlenycngggsvapppalpapvrlpgpasssskapppslpspsrlpgpsdtpilpqvecppcp appvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstf rvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqvsltclv kgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhyt qkslslspgk10)胰岛素前体融合蛋白ss302-011 seq id no:56fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkrgive qcctsicslyqlenycngggsvapppalpavapppalpasssskapppslpspsrlpgpsdtpilpqvecppcp appvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstf rvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqvsltclv kgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhyt qkslslspgk11)胰岛素前体融合蛋白ss302-012 seq id no:57fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkrgive qcctsicslyqlenycngggsvapppalpapvrlpgpavapppalpapvrlpgpavecppcpappvagpsvfl fppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvltvvh qdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsdiave wesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk12)胰岛素前体融合蛋白ss302-013 seq id no:58fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkrgive qcctsicslyqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpavapppalpapvrlpgpav ecppcpappvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpree qfnstfrvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqv sltclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmheal hnhytqkslslspgk13)胰岛素前体融合蛋白ss302-014 seq id no:59fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkrgive qcctsicslyqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpavapppalpapvrlpgpav ecppcpappvagpsvflfppkpkdtlyitrepevtcvvvdvshedpevqfnwyvdgvevhnaktkpree qfastfrvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqv sltclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmheal hnhytqkslslspgk14)胰岛素前体融合蛋白ss302-015 seq id no:60fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkrgive qcctsicslyqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpavapppalpapvrlpgpav ecppcpappvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpree qfastfrvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqv sltclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvlheal hshytqkslslspgk15)胰岛素前体融合蛋白ss302-016 seq id no:61
fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkr giveqcctsicslyqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpavapppalpapvrlp gpaeskygppcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvev hnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlpp sqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnv fscsvmhealhnhytqkslslslg16)胰岛素前体融合蛋白ss302-017 seq id no:62fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkrgive qcctsicslyqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpavapppalpapvrlpgpae skygppcppcpapeflggpsvflfppkpkdtlyitrepevtcvvvdvsqedpevqfnwyvdgvevhnak tkpreeqfastyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqee mtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscs vmhealhnhytqkslslslg17)胰岛素前体融合蛋白ss302-018 seq id no:63fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkrgive qcctsicslyqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpavapppalpapvrlpgpae skygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnak tkpreeqfastyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqee mtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscs vlhealhshytqkslslslg18)胰岛素前体融合蛋白ss302-019 seq id no:64fvnqhlcgshlvealelvcgergfhytpktrreaedlqvgqvelgggpgagslqplalegslqkrgiv eqcctsicsleqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpavapppalpapvrlpgpa eskygppcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhna ktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqe emtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfsc svmhealhnhytqkslslslg19)胰岛素前体融合蛋白ss302-022 seq id no:65fvnqhlcgshlvealylvcgergffytpktkrikreaedlqvgqvelgggpgagslqplalegslqkri krgiveqcctsicslyqlenycngggsvapppalpapvrlpgpavapppalpapvrlpgpavecppcpappva gpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsv ltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqvsltclvkgfyp sdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqksls lspgk20)胰岛素前体融合蛋白ss302-023 seq id no:66fvnqhlcgshlvealylvcgergffytpktddddkeaedlqvgqvelgggpgagslqplalegslqkr ddddkgiveqcctsicslyqlenycngggsvapppalpapvrlpgpavapppalpapvrlpgpavecppcpa ppvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfr vvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqvsltclvk gfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytq kslslspgk21)胰岛素前体融合蛋白ss302-029 seq id no:67fvnqhlcgshlvealelvcgergfhytpktrreaedlqvgqvelgggpgagslqplalegslqkrgiv eqcctsicsleqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpavapppalpapvrlpgpa es
kygppcppcpapeflggpsvflfppkpkdtlyitrepevtcvvvdvsqedpevqfnwyvdgvevhna ktkpreeqfastyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqee mtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscs vmhealhnhytqkslslslg22)胰岛素前体融合蛋白ss302-030 seq id no:68fvnqhlcgshlvealelvcgergfhytpktrreaedlqvgqvelgggpgagslqplalegslqkrgiv eqcctsicsleqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpavapppalpapvrlpgpa eskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhna ktkpreeqfastyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqee mtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscs vlhealhshytqkslslslg23)胰岛素前体融合蛋白ss302-035 seq id no:69fvnqhlcgshlvealhlvcgergfhytpkreaedlqvgqvelgggpgagslqplalegslqkrgiveq cctsicsleqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpaeskygppcppcpapeaag gpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvs vltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfy psdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqksls lslg24)胰岛素前体融合蛋白ss302-036 seq id no:70fvnqhlcgshlvealelvcgergfhytpkreaedlqvgqvelgggpgagslqplalegslkrgiveqc ctsicsleqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpaeskygppcppcpapeaagg psvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvl tvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfyps diavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslsls lg25)胰岛素前体融合蛋白ss302-037 seq id no:71fvnqhlcgshlvealylvcgergffytpkreaedlqvgqvelgggpgagslqplalegslqkrgiveqc ctsicsleqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpaeskygppcppcpapeaagg psvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvl tvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfyps diavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslsls lg26)胰岛素前体融合蛋白ss302-038 seq id no:72fvnqhlcgshlvealylvcgergffytpktrreaedlqvgqvelgggpgagslqplalegslqkrgive qcctsicslyqlenycnggaavapppalpapvrlpgpavapppalpapvrlpgpaeskygppcppcpapeaa ggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvv svltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgf ypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqksl slslg。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。