1.本发明涉及可与底物结合的蛋白序列、包含有此蛋白序列的纤维蛋白原相关蛋白1及其活性结构域在制备抑制纤维蛋白组装的产品中的应用。
背景技术:
2.血栓是血流在心血管系统血管内面剥落处或修补处的表面所形成的小块。在可变的流体依赖型(variable flow dependent patterns)中,血栓由不溶性纤维蛋白,沉积的血小板,积聚的白细胞和陷入的红细胞组成。血栓形成是由一组遗传和环境因素相互作用、相互影响的多因素变化过程。临床常见的血栓患者,最主要的特点有家族遗传性,反复发作性,症状严重性,血栓形成部位异常性,以及发病时间年轻化。抗血栓疗法是运用溶栓药物,抗血小板药物和抗凝剂来抑制血栓的形成或分解已形成的血栓。
3.抗血栓药可分为抗凝血药、抗血小板聚集药和溶血栓药三大类:
4.a、抗凝血药(anticoagulants)是一类干扰凝血因子,阻止血液凝固的药物,主要用于血栓栓塞性疾病的预防与治疗。
5.b、抗血小板聚集药分为三代:阿司匹林为第一代,噻氯匹啶为第二代,血小板糖蛋白ⅱb/ⅲa受体拮抗剂为第三代。其中,血小板糖蛋白ⅱb/ⅲa受体拮抗剂的问世是抗血小板治疗中的一个重要里程碑。
6.c、凝血中形成的纤维蛋白,可经纤溶酶作用从精氨酸-赖氨酸键上分解成可溶性产物,使血栓溶解。纤维蛋白溶解药(fibrinolytic drugs)激活纤溶酶而促进纤溶,也称溶栓药(thrombolytic drugs),用于治疗急性血栓栓塞性疾病。第一代的溶栓药链激酶(sk)和尿激酶(uk)至今仍然是国内外使用最广泛的品种,随着尿激酶原(pro-uk)等新一代溶栓药的问世,这类药物正在临床逐渐推广应用。
7.纤维蛋白原(fibrinogen,又称为血纤维蛋白原)是由肝细胞合成和分泌的一种糖蛋白(α2β2γ2),是参与凝血和止血过程中的重要蛋白纤维蛋白。是在凝血过程中,凝血酶切除血纤蛋白原中的血纤肽a和b而生成的单体蛋白质。高纤维蛋白原是各种血栓性疾病重要危险因素,在临床中被认为是疾病状态的标志物。
技术实现要素:
8.本发明的目的是提供了一种含有可与底物gprp肽段结合的氨基酸序列的蛋白、含有此氨基酸序列的纤维蛋白原相关蛋白1(fibrinogen like protein 1,简称fgl1)以及其纤维原蛋白结构域(fibrinogen domain of fgl1,简称fd),其与现有的药物具有不同的作用机制,可以通过竞争纤维蛋白γ亚基与血纤肽a结合,从而抑制血栓形成过程中纤维蛋白组装。
9.本发明的上述目的可采用下列技术方案来实现:
10.本发明的第一个发明点是提供了一种蛋白,所述蛋白含有可与底物gprp肽段结合
的氨基酸序列,氨基酸序列的结构为:色氨酸—aa
n1
—酪氨酸—aa
n2
—半胱氨酸—aa
n3
—谷氨酸—天冬氨酸—aa
n4
—半胱氨酸—组氨酸—aa
n5
—天冬氨酸—aa
n6
—酪氨酸—aa
n7
—色氨酸,其中,aa为氨基酸,n1-n7为氨基酸数量,n1=16-18个,n2=2-4个,n3=1-3个,n4=7-9个,n5=16-18个,n6=4-6个,n7=3-5个。
11.上述的蛋白,所述氨基酸数量n1=17个,n2=3个,n3=2个,n4=8个,n5=17个,n6=5个,n7=4个。
12.也即是,氨基酸序列的结构为:色氨酸—17个氨基酸—酪氨酸—3个氨基酸—半胱氨酸—2个氨基酸—谷氨酸—天冬氨酸—8个氨基酸—半胱氨酸—组氨酸—17个氨基酸—天冬氨酸—5个氨基酸—酪氨酸—4个氨基酸—色氨酸。
13.表明了色氨酸与酪氨酸之间连接有任意的17个氨基酸,酪氨酸与半胱氨酸之间连接有任意的3个氨基酸,半胱氨酸与谷氨酸之间连接有任意的2个氨基酸,谷氨酸与天冬氨酸之间直接连接,天冬氨酸与另一半胱氨酸之间连接有任意的8个氨基酸,另一半胱氨酸与组氨酸之间直接相连,组氨酸与另一天冬氨酸之间连接有任意的17个氨基酸,另一天冬氨酸与另一酪氨酸之间连接有任意的5个氨基酸,另一酪氨酸与另一色氨酸之间连接有任意的4个氨基酸。
14.此蛋白所包含的可与底物gprp肽段结合的氨基酸序列,在保证此氨基酸序列关键位点存在以及结构相同或80%相同的情况下,氨基酸序列中的aa可以为任意的功能性氨基酸,采用不同功能的aa,也将会给所述蛋白带来不同的复合功效;同时,对此蛋白氨基酸序列中的某些关键位点进行突变,也有可能实现增强其抑制血栓形成功能的效果,如204位和/或269位色氨酸突变为丙氨酸的情形下,突变体对聚集的纤维蛋白的裂解相比于不突变形态下,明显有所增强(如图27所示)。
15.具体到本发明所提供的纤维蛋白原相关蛋白1中,氨基酸序列即为204位色氨酸,222位酪氨酸,226位半胱氨酸,229位谷氨酸,230位天冬氨酸,239位半胱氨酸,240位组氨酸,258位天冬氨酸,264位酪氨酸,269位色氨酸。
16.上述的氨基酸序列中所列出的氨基酸位点,为可与底物gprp(gly-pro-arg-pro)肽段相结合的关键性氨基酸位点,氨基酸序列能够通过这些关键氨基酸位点以疏水键、氢键或盐键特异性、竞争性的与底物gprp相结合,如图26所示,其竞争性的占据了可与血纤肽a结合的结合位点,从而通过抑制纤维蛋白的组装、抑制了纤维蛋白的活性,实现了抑制血栓形成或减缓血栓形成进度的效果。
17.本发明的第二个发明点是提供了纤维蛋白原相关蛋白1,为如下任意一项所示的蛋白质并包含有前述的氨基酸序列:
18.(a1)氨基酸序列如seq id no.1(即seq id no.1)或seq id no.1的第48-290位(即seq id no.3)所示的蛋白质;
19.(a2)将seq id no.1或seq id no.1的第48-290位所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;
20.(a3)与(a1)-(a2)中任一所限定的氨基酸序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且具有相同功能的蛋白质;
21.(a4)在(a1)-(a3)中任一所限定的蛋白质的n端和/或c端连接标签后得到的融合蛋白。
22.纤维蛋白原相关蛋白1(fgl1)包含纤维原蛋白结构域蛋白(fd),并且单独fd结构域蛋白也具有与fgl1相同的或类似的功能;其中,fgl1的氨基酸序列如序列表中seq id no.1所示,单独fd结构域蛋白的氨基酸序列如序列表中seq id no.1的第48-290位所示。
23.纤维蛋白原相关蛋白1(fgl1)的氨基酸序列如下所示,seq id no.1:
24.ledcaqeqmrlraqvrlletrvkqqqvkikqllqenevqfldkgdentvidlgskrqyadcseifndgyklsgfykikplqspaefsvycdmsdgggwtviqrrsdgsenfnrgwkdyengfgnfvqkhgeywlgnknlhflttqedytlkidladfeknsryaqyknfkvgdeknfyelnigeysgtagdslagnfhpevqwwashqrmkfstwdrdhdnyegncaeedqsgwwfnrchsanlngvyysgpytaktdngivwytwhgwwyslksvvmkirpndfipnvi。
25.纤维原蛋白结构域蛋白(fd)的氨基酸序列如下所示,seq id no.3:
26.tvidlgskrqyadcseifndgyklsgfykikplqspaefsvycdmsdgggwtviqrrsdgsenfnrgwkdyengfgnfvqkhgeywlgnknlhflttqedytlkidladfeknsryaqyknfkvgdeknfyelnigeysgtagdslagnfhpevqwwashqrmkfstwdrdhdnyegncaeedqsgwwfnrchsanlngvyysgpytaktdngivwytwhgwwyslksvvmkirpndfipnvi。
27.本发明的第三个发明点是提供了编码上述纤维蛋白原相关蛋白1的核酸分子。
28.进一步的,所述核酸分子为基因;所述基因是如下任意一项所述的dna分子:
29.(b1)seq id no.2(即seq id no.2)或seq id no.2的第142-870位(即seq id no.4)所示的dna分子;
30.(b2)在严格条件下与(b1)限定的dna分子杂交且编码所述蛋白质的dna分子;
31.(b3)与(b1)-(b2)限定的dna序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且编码所述蛋白质的dna分子。
32.(b4)编码(a3)中所述蛋白质的dna分子。
33.纤维蛋白原相关蛋白1(fgl1)的核酸序列如下所示,seq id no.2:
34.ctcgaggactgtgcccaggagcagatgcggctcagagcccaggtgcgcctgcttgagacccgggtcaaacagcaacaggtcaagatcaagcagcttttgcaggagaatgaagtccagttccttgataaaggagatgagaatactgtcattgatcttggaagcaagaggcagtatgcagattgttcagagattttcaatgatgggtataagctcagtggattttacaaaatcaaacctctccagagcccagcagaattttctgtttattgtgacatgtccgatggaggaggatggactgtaattcagagacgatctgatggcagtgaaaactttaacagaggatggaaagactatgaaaatggctttggaaattttgtccaaaaacatggtgaatattggctgggcaataaaaatcttcacttcttgaccactcaagaagactacactttaaaaatcgaccttgcagattttgaaaaaaatagccgttatgcacaatataagaatttcaaagttggagatgaaaagaatttctacgagttgaatattggggaatattctggaacagctggagattcccttgcggggaattttcatcctgaggtgcagtggtgggctagtcaccaaagaatgaaattcagcacgtgggacagagatcatgacaactatgaagggaactgcgcagaagaagatcagtctggctggtggtttaacaggtgtcactctgcaaacctgaatggtgtatactacagcggcccctacacggctaaaacagacaatgggattgtctggtacacctggcatgggtggtggtattctctgaaatctgtggttatgaaaattaggccaaatgattttattccaaatgtaatt。
35.纤维原蛋白结构域蛋白(fd)的核酸序列如下所示,seq id no.4:
36.actgtcattgatcttggaagcaagaggcagtatgcagattgttcagagattttcaatgatgggtataagctcagtggattttacaaaatcaaacctctccagagcccagcagaattttctgtttattgtgacatgtccgatggaggaggatggactgtaattcagagacgatctgatggcagtgaaaactttaacagaggatggaaagactatgaaaatggctttggaaattttgtccaaaaacatggtgaatattggctgggcaataaaaatcttcacttcttgaccactcaaga
agactacactttaaaaatcgaccttgcagattttgaaaaaaatagccgttatgcacaatataagaatttcaaagttggagatgaaaagaatttctacgagttgaatattggggaatattctggaacagctggagattcccttgcggggaattttcatcctgaggtgcagtggtgggctagtcaccaaagaatgaaattcagcacgtgggacagagatcatgacaactatgaagggaactgcgcagaagaagatcagtctggctggtggtttaacaggtgtcactctgcaaacctgaatggtgtatactacagcggcccctacacggctaaaacagacaatgggattgtctggtacacctggcatgggtggtggtattctctgaaatctgtggttatgaaaattaggccaaatgattttattccaaatgtaatt。
37.本发明的第四个发明点是提供了上述核酸分子的表达盒、重组载体、重组菌或转基因细胞系。
38.本发明的第五个发明点是提供了上述纤维蛋白原相关蛋白1(fgl1)或上述核酸分子或上述重组载体、重组菌或转基因细胞系的应用,所述应用至少为如下所述的任意一种:
39.(c1)制备用于抑制血栓发生的产品;
40.(c2)制备用于抑制血栓程度的产品;
41.(c3)制备用于抑制血浆中纤维蛋白活性的产品;
42.(c4)制备用于抑制血浆中纤维蛋白原组装的产品;
43.(c5)制备用于增强溶纤能力的产品;
44.(c6)制备用于延长血浆的活化部分凝血酶时间和/或凝血酶原时间和/或凝血酶时间的产品。
45.本发明的研究表明纤维蛋白原相关蛋白1(fgl1)或纤维原蛋白结构域蛋白(fd)抑制血栓形成过程中纤维蛋白组装,可用于制备治疗血栓相关疾病的药物。
46.其中,所述治疗血栓相关疾病的药物,是以纤维蛋白原相关蛋白1(fgl1)或纤维原蛋白结构域蛋白(fd)为活性成分的药物。所述治疗血栓相关疾病的药物可用于治疗多种原因引起的血栓疾病,也可以用于预防血栓疾病的发生,同时,还可以用于预防和治疗多种与纤维蛋白活性增高、溶纤能力降低以及血浆的活化部分凝血酶时间和/或凝血酶原时间和/或凝血酶时间缩短相关的疾病。
47.纤维蛋白原相关蛋白1(fgl1)包含纤维原蛋白结构域蛋白(fd),其作用机理为:可通过竞争纤维蛋白γ亚基与血纤肽a结合,从而抑制血栓形成过程中纤维蛋白组装。
48.也可对纤维蛋白原相关蛋白1(fgl1)进行突变,以期增加其与血纤肽a的亲和力,从而达到提高药效的目的。
49.进一步的,上述的应用,所述蛋白质的制备方法为:将所述蛋白质的编码基因克隆入真核表达载体,以无血清培养基培养真核细胞表达所述蛋白质,采用ni-nta亲和力柱进行纯化,再使用superdex 200 10/300gl色谱柱通过凝胶过滤进一步纯化蛋白质,得到高纯度纯化蛋白质。
50.进一步的,上述的应用,所述产品为药物产品,所述药物产品包括疫苗产品。
51.进一步的,上述的应用,所述药物产品类型包括dna药物、mrna药物、蛋白药物或腺病毒药物。所述的用于预防或治疗血栓类疾病的药物产品,包括但不只限于上述的类型产品,其可采用多种载体形式进行给药,如质粒包裹、微球包裹、外泌体携带等,亦可采用多种形式的载蛋白给药方式,如蛋白与化合物结合给药、蛋白质与肽结合给药、蛋白质与小分子结合给药等,其最终目的是为了保证本发明所述纤维蛋白原相关蛋白1(fgl1)或纤维原蛋白结构域蛋白(fd)的生物活性,通过不同的给药方式将活性成分摄入,以抑制纤维蛋白的
组装。
52.进一步的,上述的应用,所述产品中还修饰有用于穿过血脑屏障的结构。
53.进一步的,上述的应用,所述修饰的穿过血脑屏障的结构为大脑靶向配体。
54.进一步的,上述的应用,所述大脑靶向配体,包括但不限于rvg肽、硬脂酸-转铁蛋白、载体蛋白e。
55.基于上述记载,本发明所述的用于预防或治疗血栓类疾病的药物产品,在保证纤维蛋白原相关蛋白1(fgl1)或纤维原蛋白结构域蛋白(fd)生物活性的前提下,还可以将其与多种靶向配体结合,比较突出的靶向配体修饰是将蛋白或结构域蛋白与大脑靶向配体结合,以利于其突破血脑屏障(bbb),从而实现脑部血栓的机体供药治疗,但本发明的作用并不仅限于此,其同样可与其它结构或形式的靶向配体结合,从而实现针对不同病灶的靶向治疗。
56.进一步的,上述的应用,所述药物中还包括有可联合使用的治疗用药。
57.进一步的,上述的应用,所述可联合使用的治疗用药分别为尿激酶、链激酶、阿替普酶、瑞替普酶或组织性纤维酶原激活剂。
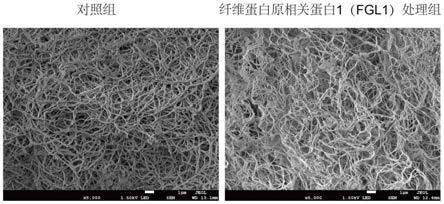
58.纤维蛋白原相关蛋白1(fgl1)及其突变体可以有效协同现有抗血栓药物(尿激酶和组织型纤维酶原激活剂等),并降低现有抗血栓药物的使用剂量,缓解其毒副作用。
59.本发明的第六个发明点是提供了一种生物材料,所述生物材料为能够表达上述纤维蛋白原相关蛋白1(fgl1)的核酸分子或含有所述核酸分子的表达盒、重组载体、重组菌或转基因细胞系。
60.目前已有的抗血栓药,根据作用机制不同可分为三类,分别为:
61.1)抗凝药物:机制为抑制凝血过程,副作用为容易造成组织出血;
62.2)抗血小板药物:机制为抑制血小板聚集,副作用为造成组织出血;
63.3)纤溶药物:机制为通过诱导纤维蛋白降解,使已经形成的血栓溶解,副作用同样为出血并发症。
64.本发明的的特点及优点是:本发明提供了含有可与底物gprp肽段结合的氨基酸序列的蛋白、含有此氨基酸序列的纤维蛋白原相关蛋白1(fgl1)及其活性结构域(fd),以及上述蛋白在制备抑制纤维蛋白组装的产品中的应用,所述的含有可与底物gprp肽段结合的氨基酸序列的蛋白、纤维蛋白原相关蛋白1(fgl1)、其纤维原蛋白结构域(fd)及其突变体,与现有的药物具有不同的作用机制,可以通过竞争纤维蛋白底物结合口袋,从而抑制血栓形成过程中纤维蛋白的组装,通过突变,可以使其具有更强的底物亲和力,能够有效增强血栓治疗药物的使用效果。fgl1和fd的作用机理是破坏了纤维蛋白的组装过程,故而其与现有溶栓药物相比,溶栓效果优异,但溶栓过程更为缓和,基本不会产生出血等副作用。也即是说,本发明是作用于纤维蛋白,而非纤维蛋白原,也就避免了现有血栓治疗药物在使用过程中由于作用于纤维蛋白原,而导致极易引发药物副作用大出血的技术难题;也正是由于此种作用机理,将本发明提供的fgl1和fd与多种现有血栓治疗药物(如阿替普酶等)联合使用时,能够协同治疗血栓类疾病,同时也能够大幅降低现有抗血栓药物普遍性出血副作用的发生几率,为血栓类疾病的治疗拓展了新的途径。
附图说明
65.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
66.图1显示为纤维蛋白原相关蛋白1(fgl1)ni-nta亲和力柱纯化后的sds-page图。
67.图2显示为纤维蛋白原相关蛋白1(fgl1)经过superdex 200 10/300gl色谱柱纯化图;其中,图中纵坐标为a280蛋白吸收值,横坐标为体积数。
68.图3显示为纤维蛋白原相关蛋白1(fgl1)经过superdex 200 10/300gl色谱柱纯化后的sds-page图;其中,泳道1-12分别显示为:1-蛋白标准品,2-收集管1,3-收集管2,4-收集管3,5-收集管4,6-收集管5,7-收集管6,8-收集管7,9-收集管8,10-收集管9,11-收集管10,12-蛋白标准品。
69.图4显示为纤维蛋白原结构域(fd)ni-nta亲和力柱纯化后的sds-page图。
70.图5显示为纤维蛋白原结构域(fd)经过superdex 200 10/300gl色谱柱纯化图,其中,图中纵坐标为a280蛋白吸收值,横坐标为体积数。
71.图6显示为纤维蛋白原结构域(fd)经过superdex 200 10/300gl色谱柱纯化后sds-page图;其中,泳道19-29分别显示为:19-收集管19,20-收集管20,21-收集管21,22-收集管22,23-收集管23,24-收集管24,25-收集管25,26-收集管26,27-收集管27,28-收集管28,29-蛋白标准品。
72.图7显示为纤维蛋白原相关蛋白1(fgl1)在无氯化钙的作用下对纤维蛋白聚集的影响。
73.图8显示为纤维蛋白原相关蛋白1(fgl1)在有氯化钙的作用下对纤维蛋白聚集的影响。
74.图9显示为纤维蛋白原结构域(fd)在无氯化钙的作用下对纤维蛋白聚集的影响。
75.图10显示为纤维蛋白原结构域(fd)在有氯化钙的作用下对纤维蛋白聚集的影响。
76.图11显示为扫描电镜观察纤维蛋白原相关蛋白1(fgl1)对纤维蛋白聚集的影响对比图。
77.图12显示为扫描电镜观察纤维蛋白原结构域(fd)对纤维蛋白聚集的影响对比图;其中可以明显看出,在纤维蛋白原结构域(fd)的处理下纤维蛋白聚集形成的栓变细,结构变松散。
78.图13显示为扫描电镜观察纤维蛋白原相关蛋白1(fgl1)对小鼠血栓形态的影响对比图。
79.图14显示为扫描电镜观察纤维蛋白原结构域(fd)对小鼠血栓形态的影响对比图,其中可以明显看出,在纤维蛋白原结构域(fd)的处理下血栓变细,结构变松散。
80.图15显示为纤维蛋白原结构域(fd)对聚集的纤维蛋白裂解作用的对照图。
81.图16显示为纤维蛋白原相关蛋白1(fgl1)对聚集的纤维蛋白裂解作用的对照图。
82.图17显示为纤维蛋白原相关蛋白1(fgl1)与组织型纤溶酶原激活剂tpa协同溶解纤维蛋白聚集的对比图。
83.图18显示为纤维蛋白原结构域(fd)与组织型纤溶酶原激活剂tpa协同溶解纤维蛋
白聚集的对比图。
84.图19显示为纤维蛋白原相关蛋白1(fgl1)与尿激酶upa协同溶解纤维蛋白聚集的对比图。
85.图20显示为纤维蛋白原结构域(fd)与尿激酶upa协同溶解纤维蛋白聚集的对比图。
86.图21显示为纤维蛋白原相关蛋白1(fgl1)质粒注射小鼠过表达改善凝血酶诱导的血栓模型数据统计图;其中,(a)为elisa验证纤维蛋白原相关蛋白1(fgl1)质粒注射过表达的对比图;(b)为纤维蛋白原相关蛋白1(fgl1)过表达显著提高小鼠存活率的对比图。
87.图22显示为纤维蛋白原结构域(fd)质粒注射小鼠过表达改善凝血酶诱导的血栓模型数据统计图;其中,(a)为elisa验证纤维蛋白原结构域(fd)质粒注射过表达的对比图;(b)为纤维蛋白原结构域(fd)过表达显著提高小鼠存活率的对比图。
88.图23显示为使用rvg肽和cy5.5荧光修饰纤维蛋白原相关蛋白1(fgl1)的操作流程。
89.图24显示为rvg肽修饰促进纤维蛋白原相关蛋白1(fgl1)在小鼠脑组织中的分布检测结果图。
90.图25显示为纤维蛋白原相关蛋白1(fgl1)及维蛋白原结构域(fd)对纤维蛋白原的损失(a)和流血时间(b)无明显影响(无毒副作用)。
91.图26显示为纤维蛋白原相关蛋白1(fgl1)(绿色)和底物gprp肽段结合(橙色)结构图;其中,标记显示的氨基酸为底物结合的关键位点,分别为204位色氨酸,222位酪氨酸,226位半胱氨酸,229位谷氨酸,230位天冬氨酸,239位半胱氨酸,240位组氨酸,258位天冬氨酸,264位酪氨酸,269位色氨酸;图26b为图26a沿y轴旋转70
°
得到的。
92.图27显示为纤维蛋白原结构域(fd)突变体对聚集的纤维蛋白的裂解作用对比图;其中,突变位点为204位和269位的色氨酸,突变为丙氨酸,突变后的纤维蛋白原结构域(fd)突变体裂解效果明显增强。
具体实施方式
93.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
94.实施例1:
95.一种蛋白,含有可与底物gprp肽段结合的氨基酸序列,氨基酸序列的结构为:色氨酸—aa
n1
—酪氨酸—aa
n2
—半胱氨酸—aa
n3
—谷氨酸—天冬氨酸—aa
n4
—半胱氨酸—组氨酸—aa
n5
—天冬氨酸—aa
n6
—酪氨酸—aa
n7
—色氨酸,其中,aa为氨基酸,n1-n7为氨基酸数量,n1=16-18个,n2=2-4个,n3=1-3个,n4=7-9个,n5=16-18个,n6=4-6个,n7=3-5个。
96.优选为,氨基酸数量n1=17个,n2=3个,n3=2个,n4=8个,n5=17个,n6=5个,n7=4个。
97.也即是,氨基酸序列的结构为:色氨酸—17个氨基酸—酪氨酸—3个氨基酸—半胱氨酸—2个氨基酸—谷氨酸—天冬氨酸—8个氨基酸—半胱氨酸—组氨酸—17个氨基酸—
天冬氨酸—5个氨基酸—酪氨酸—4个氨基酸—色氨酸。
98.表明了色氨酸与酪氨酸之间连接有任意的17个氨基酸,酪氨酸与半胱氨酸之间连接有任意的3个氨基酸,半胱氨酸与谷氨酸之间连接有任意的2个氨基酸,谷氨酸与天冬氨酸之间直接连接,天冬氨酸与另一半胱氨酸之间连接有任意的8个氨基酸,另一半胱氨酸与组氨酸之间直接相连,组氨酸与另一天冬氨酸之间连接有任意的17个氨基酸,另一天冬氨酸与另一酪氨酸之间连接有任意的5个氨基酸,另一酪氨酸与另一色氨酸之间连接有任意的4个氨基酸。
99.实施例2:
100.纤维蛋白原相关蛋白1,为如下任意一项所示的含有实施例1所述的氨基酸序列的蛋白质:
101.(a1)氨基酸序列如seq id no.1或seq id no.1的第48-290位所示的蛋白质;
102.(a2)将seq id no.1或seq id no.1的第48-290位所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的蛋白质;
103.(a3)与(a1)-(a2)中任一所限定的氨基酸序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且具有相同功能的蛋白质;
104.(a4)在(a1)-(a3)中任一所限定的蛋白质的n端和/或c端连接标签后得到的融合蛋白。
105.纤维蛋白原相关蛋白1(fgl1)包含纤维原蛋白结构域蛋白(fd),并且单独fd结构域蛋白也具有与纤维蛋白原fgl1相同的或类似的功能;其中,纤维蛋白原fgl1的氨基酸序列如序列表中seq id no.1所示,单独fd结构域蛋白的氨基酸序列如序列表中seq id no.1的第40-272位所示。
106.纤维蛋白原相关蛋白1(fgl1)的氨基酸序列如下所示:
107.ledcaqeqmrlraqvrlletrvkqqqvkikqllqenevqfldkgdentvidlgskrqyadcseifndgyklsgfykikplqspaefsvycdmsdgggwtviqrrsdgsenfnrgwkdyengfgnfvqkhgeywlgnknlhflttqedytlkidladfeknsryaqyknfkvgdeknfyelnigeysgtagdslagnfhpevqwwashqrmkfstwdrdhdnyegncaeedqsgwwfnrchsanlngvyysgpytaktdngivwytwhgwwyslksvvmkirpndfipnvi。
108.纤维原蛋白结构域蛋白(fd)的氨基酸序列如下所示:
109.tvidlgskrqyadcseifndgyklsgfykikplqspaefsvycdmsdgggwtviqrrsdgsenfnrgwkdyengfgnfvqkhgeywlgnknlhflttqedytlkidladfeknsryaqyknfkvgdeknfyelnigeysgtagdslagnfhpevqwwashqrmkfstwdrdhdnyegncaeedqsgwwfnrchsanlngvyysgpytaktdngivwytwhgwwyslksvvmkirpndfipnvi。
110.具体到本发明所提供的纤维蛋白原相关蛋白1中,氨基酸序列即为204位色氨酸,222位酪氨酸,226位半胱氨酸,229位谷氨酸,230位天冬氨酸,239位半胱氨酸,240位组氨酸,258位天冬氨酸,264位酪氨酸,269位色氨酸。
111.上述的氨基酸序列中所列出的氨基酸位点,为可与底物gprp(gly-pro-arg-pro)肽段相结合的关键性氨基酸位点,氨基酸序列能够通过这些关键氨基酸位点特异性、竞争性的与底物gprp相结合,如图26所示,其竞争性的占据了可与血纤肽a结合的结合位点,从而通过抑制纤维蛋白的组装、抑制了纤维蛋白的活性,实现了抑制血栓形成或减缓血栓形成进度的效果。
112.实施例3:
113.本发明还提供了编码上述纤维蛋白原相关蛋白1的核酸分子,核酸分子为基因;所述基因是如下任意一项所述的dna分子:
114.(b1)seq id no.2或seq id no.2的第142-870位所示的dna分子;
115.(b2)在严格条件下与(b1)限定的dna分子杂交且编码所述蛋白质的dna分子;
116.(b3)与(b1)-(b2)限定的dna序列具有99%以上、95%以上、90%以上、85%以上或者80%以上同源性且编码所述蛋白质的dna分子。
117.纤维蛋白原相关蛋白1(fgl1)的核酸序列如下所示:
118.ctcgaggactgtgcccaggagcagatgcggctcagagcccaggtgcgcctgcttgagacccgggtcaaacagcaacaggtcaagatcaagcagcttttgcaggagaatgaagtccagttccttgataaaggagatgagaatactgtcattgatcttggaagcaagaggcagtatgcagattgttcagagattttcaatgatgggtataagctcagtggattttacaaaatcaaacctctccagagcccagcagaattttctgtttattgtgacatgtccgatggaggaggatggactgtaattcagagacgatctgatggcagtgaaaactttaacagaggatggaaagactatgaaaatggctttggaaattttgtccaaaaacatggtgaatattggctgggcaataaaaatcttcacttcttgaccactcaagaagactacactttaaaaatcgaccttgcagattttgaaaaaaatagccgttatgcacaatataagaatttcaaagttggagatgaaaagaatttctacgagttgaatattggggaatattctggaacagctggagattcccttgcggggaattttcatcctgaggtgcagtggtgggctagtcaccaaagaatgaaattcagcacgtgggacagagatcatgacaactatgaagggaactgcgcagaagaagatcagtctggctggtggtttaacaggtgtcactctgcaaacctgaatggtgtatactacagcggcccctacacggctaaaacagacaatgggattgtctggtacacctggcatgggtggtggtattctctgaaatctgtggttatgaaaattaggccaaatgattttattccaaatgtaatt。
119.纤维原蛋白结构域蛋白(fd)的核酸序列如下所示:
120.actgtcattgatcttggaagcaagaggcagtatgcagattgttcagagattttcaatgatgggtataagctcagtggattttacaaaatcaaacctctccagagcccagcagaattttctgtttattgtgacatgtccgatggaggaggatggactgtaattcagagacgatctgatggcagtgaaaactttaacagaggatggaaagactatgaaaatggctttggaaattttgtccaaaaacatggtgaatattggctgggcaataaaaatcttcacttcttgaccactcaagaagactacactttaaaaatcgaccttgcagattttgaaaaaaatagccgttatgcacaatataagaatttcaaagttggagatgaaaagaatttctacgagttgaatattggggaatattctggaacagctggagattcccttgcggggaattttcatcctgaggtgcagtggtgggctagtcaccaaagaatgaaattcagcacgtgggacagagatcatgacaactatgaagggaactgcgcagaagaagatcagtctggctggtggtttaacaggtgtcactctgcaaacctgaatggtgtatactacagcggcccctacacggctaaaacagacaatgggattgtctggtacacctggcatgggtggtggtattctctgaaatctgtggttatgaaaattaggccaaatgattttattccaaatgtaatt。
121.本发明同时还提供了上述核酸分子的表达盒、重组载体、重组菌或转基因细胞系。
122.实施例4:
123.上述纤维蛋白原相关蛋白1或上述核酸分子或上述重组载体、重组菌或转基因细胞系的应用,所述应用至少为如下所述的任意一种:
124.(c1)制备用于抑制血栓发生的产品;
125.(c2)制备用于抑制血栓程度的产品;
126.(c3)制备用于抑制血浆中纤维蛋白活性的产品;
127.(c4)制备用于抑制血浆中纤维蛋白原组装的产品;
128.(c5)制备用于增强溶纤能力的产品;
129.(c6)制备用于延长血浆的活化部分凝血酶时间和/或凝血酶原时间和/或凝血酶时间的产品。
130.研究表明纤维蛋白原相关蛋白1(fgl1)或纤维原蛋白结构域蛋白(fd)抑制血栓形成过程中纤维蛋白组装,可用于制备治疗血栓相关疾病的药物。
131.其中,所述治疗血栓相关疾病的药物,是以纤维蛋白原相关蛋白1(fgl1)或纤维原蛋白结构域蛋白(fd)为活性成分的药物。所述治疗血栓相关疾病的药物可用于治疗多种原因引起的血栓疾病,也可以用于预防血栓疾病的发生,同时,还可以用于预防和治疗多种与纤维蛋白活性增高、溶纤能力降低以及血浆的活化部分凝血酶时间和/或凝血酶原时间和/或凝血酶时间缩短相关的疾病。
132.纤维蛋白原相关蛋白1(fgl1)包含纤维原蛋白结构域蛋白(fd),其作用机理为:可通过竞争纤维蛋白γ亚基与血纤肽a结合,从而抑制血栓形成过程中纤维蛋白组装。
133.也可对纤维蛋白原相关蛋白1(fgl1)进行突变,以期增加其与血纤肽a的亲和力,从而达到提高药效的目的。
134.所述蛋白质的制备方法为:将所述蛋白质的编码基因克隆入真核表达载体,以无血清培养基培养真核细胞表达所述蛋白质,采用ni-nta亲和力柱进行纯化,再使用superdex 200 10/300gl色谱柱通过凝胶过滤进一步纯化蛋白质,得到高纯度纯化蛋白质。
135.所述产品为药物产品,所述药物产品包括疫苗产品。
136.所述药物产品类型包括dna药物、mrna药物、蛋白药物或腺病毒药物。所述的用于预防或治疗血栓类疾病的药物产品,包括但不只限于上述的类型产品,其可采用多种载体形式进行给药,如质粒包裹、微球包裹、外泌体携带等,亦可采用多种形式的载蛋白给药方式,如蛋白与化合物结合给药、蛋白质与肽结合给药、蛋白质与小分子结合给药等,其最终目的是为了保证本发明所述纤维蛋白原相关蛋白1(fgl1)或纤维原蛋白结构域蛋白(fd)的生物活性,通过不同的给药方式将活性成分摄入,以抑制纤维蛋白的组装。
137.所述产品中还修饰有用于穿过血脑屏障的结构。
138.所述修饰的穿过血脑屏障的结构为大脑靶向配体。
139.所述大脑靶向配体,包括但不限于rvg肽、硬脂酸-转铁蛋白、载体蛋白e。
140.基于上述记载,本发明所述的用于预防或治疗血栓类疾病的药物产品,在保证纤维蛋白原相关蛋白1(fgl1)或纤维原蛋白结构域蛋白(fd)生物活性的前提下,还可以将其与多种靶向配体结合,比较突出的靶向配体修饰是将蛋白或结构域蛋白与大脑靶向配体结合,以利于其突破血脑屏障(bbb),从而实现脑部血栓的机体供药治疗,但本发明的作用并不仅限于此,其同样可与其它结构或形式的靶向配体结合,从而实现针对不同病灶的靶向治疗。
141.所述药物中还包括有可联合使用的治疗用药。
142.所述可联合使用的治疗用药分别为尿激酶、链激酶、阿替普酶、瑞替普酶或组织性纤维酶原激活剂。
143.纤维原样蛋白1及其突变体可以有效协同现有抗血栓药物(尿激酶和组织型纤维酶原激活剂等),并降低现有抗血栓药物的使用剂量,缓解其毒副作用。
144.本发明同时还提供了一种生物材料,所述生物材料为能够表达上述蛋白的核酸分
子或含有所述核酸分子的表达盒、重组载体、重组菌或转基因细胞系。
145.实施例5:
146.纤维蛋白原相关蛋白1(fgl1)和纤维蛋白原结构域(fd)抑制纤维蛋白聚集:
147.a、纤维蛋白原相关蛋白1(fgl1)的制备:
148.将纤维蛋白原相关蛋白1(fgl1)蛋白质的编码基因克隆入真核表达载体,以无血清培养基培养真核细胞表达所述蛋白质,采用ni-nta亲和力柱进行纯化,再使用superdex 200 10/300gl色谱柱通过凝胶过滤进一步纯化蛋白质,得到高纯度纯化的蛋白质,sds-page验证其纯度。
149.纤维蛋白原相关蛋白1(fgl1)ni-nta亲和力柱纯化后的sds-page如图1所示;
150.纤维蛋白原相关蛋白1(fgl1)分子筛如图2所示;
151.纤维蛋白原相关蛋白1(fgl1)分子筛后的sds-page如图3所示。
152.b、纤维蛋白原结构域蛋白(fd)按照如下方法获得:
153.纤维蛋白原结构域蛋白(fd)表达与纯化:以纤维蛋白原相关蛋白1(fgl1)蛋白质的编码基因为模版,使用pcr及同源重组法获得表达载体。以无血清培养基培养真核细胞表达所述蛋白质,采用ni-nta亲和力柱进行纯化,再使用superdex 20010/300gl色谱柱通过凝胶过滤进一步纯化蛋白质,得到高纯度纯化蛋白质,sds-page验证其纯度。
154.纤维蛋白原结构域(fd)ni-nta亲和力柱纯化后的sds-page如图4所示;
155.图5显示为纤维蛋白原结构域(fd)分子筛如图5所示;
156.图6显示为纤维蛋白原结构域(fd)分子筛后sds-page如图6所示。
157.c、纤维蛋白原相关蛋白1(fgl1)抑制纤维蛋白聚集:
158.纤维原蛋白也叫做凝血因子i,由α2β2γ2三个亚基组成的六聚体复合物,是血栓的重要组成部分。纤维蛋白聚集主要由凝血酶thrombin和凝血因子13介导。凝血因子13催化α或者γ亚基c端结构域的氨基酸共价连接。凝血酶thrombin将纤维原蛋白的α和β亚基切割,暴露出血纤肽a(knob a)和血纤肽b(knob b)。暴露出的血纤肽a(knob a)和血纤肽b(knob b)分别插入另一个纤维蛋白分子的γ和β亚基的c端结构域,从而促进纤维蛋白聚集。组织型纤溶酶原激活剂tpa虽然可以直接靶向降解纤维蛋白,但由于一些抑制因子的作用,使其在临床上用量极大,造成的副作用主要为神经毒性及出血。研究表明,松散结构的纤维蛋白有助于增强组织型纤溶酶原激活剂tpa降解效果。纤维蛋白原相关蛋白1(fgl1)可以通过靶向纤维蛋白抑制纤维蛋白聚集。
159.实验方法如下:
160.多功能酶标仪m200pro检测光散射过程,调节仪器激发光为350nm,发射光为350nm。对照组为3.3μm的纤维原蛋白,模型组为3.3μm的纤维原蛋白 2.5u/ml凝血酶thrombin,给药组为3.3μm的纤维原蛋白 2.5u/ml凝血酶thrombin 各剂量的纤维蛋白原相关蛋白1(fgl1)。以上体系均在20mm tris-hcl,ph7.4,150mm nacl
±
5mm cacl2溶液中,体积为100微升/孔(96孔板)。25℃,每分钟检测一次,测量动力学曲线。
161.纤维蛋白原相关蛋白1(fgl1)在无氯化钙的作用下对纤维蛋白聚集的影响如图7所示。
162.纤维蛋白原相关蛋白1(fgl1)在有氯化钙的作用下对纤维蛋白聚集的影响如图8所示。
163.扫描电镜观察纤维蛋白原相关蛋白1(fgl1)对纤维蛋白聚集的影响对比如图11所示。
164.d、纤维蛋白原结构域(fd)抑制纤维蛋白聚集:
165.同理纤维蛋白原结构域(fd)可以通过靶向纤维蛋白抑制纤维蛋白聚集。
166.实验方法如下:
167.多功能酶标仪m200pro检测光散射过程,调节仪器激发光为350nm,发射光为350nm。对照组为3.3μm的纤维原蛋白,模型组为3.3μm的纤维原蛋白 2.5u/ml凝血酶thrombin,给药组为3.3μm的纤维原蛋白 2.5u/ml凝血酶thrombin 各剂量的纤维蛋白原结构域(fd)。以上体系均在20mm tris-hcl,ph7.4,150mm nacl
±
5mm cacl2溶液中。25℃,每分钟检测一次a350吸光值,测量动力学曲线。
168.纤维蛋白原结构域(fd)在无氯化钙的作用下对纤维蛋白聚集的影响如图9所示。
169.纤维蛋白原结构域(fd)在有氯化钙的作用下对纤维蛋白聚集的影响如图10所示。
170.扫描电镜观察纤维蛋白原结构域(fd)对纤维蛋白聚集的影响对比如图12所示;其中可以明显看出,在纤维蛋白原结构域(fd)的处理下纤维蛋白聚集形成的栓变细,结构变松散。
171.实施例6:
172.纤维蛋白原相关蛋白1(fgl1)和纤维蛋白原结构域(fd)质粒注射小鼠过表达对凝血酶诱导的血栓模型的保护作用:
173.1、纤维蛋白原相关蛋白1(fgl1)质粒注射小鼠过表达对凝血酶诱导的血栓模型的保护作用:
174.a.小鼠的分组:
175.雌性八周龄balb/c小鼠(18-22g)只,随机分为3组,即正常对照组、模型组、纤维蛋白原相关蛋白1(fgl1)质粒注射组;
176.b.纤维蛋白原相关蛋白1(fgl1)质粒注射及过表达体系的验证:
177.构建pcdna3.1载体的fgl1表达质粒,小鼠尾静脉注射质粒,100μg/2ml pbs/只小鼠,18小时后取小鼠血浆,elisa检测血浆中过表达的fgl1含量;
178.c.纤维蛋白原相关蛋白1(fgl1)对凝血酶诱导的血栓模型的保护作用:
179.凝血酶thrombin 15u/200μl pbs/只小鼠尾静脉注射造模,记录注射后1小时内每组小鼠死亡只数,计算纤维蛋白原相关蛋白1(fgl1)过表达的保护率。
180.扫描电镜观察纤维蛋白原相关蛋白1(fgl1)对小鼠血栓形态的影响对比如图13所示。
181.纤维蛋白原相关蛋白1(fgl1)对聚集的纤维蛋白裂解作用的对照如图16所示。
182.纤维蛋白原相关蛋白1(fgl1)质粒注射小鼠过表达改善凝血酶诱导的血栓模型数据统计如图21所示。
183.2、纤维蛋白原结构域(fd)质粒注射小鼠过表达对凝血酶诱导的血栓模型的保护作用:
184.具体操作方法与前述fgl1相同。
185.扫描电镜观察纤维蛋白原结构域(fd)对小鼠血栓形态的影响对比如图14所示,其中可以明显看出,在纤维蛋白原结构域(fd)的处理下血栓变细,结构变松散。
186.纤维蛋白原结构域(fd)对聚集的纤维蛋白裂解作用的对照如图15所示。
187.纤维蛋白原结构域(fd)质粒注射小鼠过表达改善凝血酶诱导的血栓模型数据统计如图22所示。
188.实施例7:
189.rvg肽修饰促进纤维蛋白原相关蛋白1(fgl1)进入小鼠血脑屏障:
190.a.试验材料:
191.rvg29-cys(ytwmpenprpgtpcdiftnsrgkrasnggggggc)多肽由南京金斯瑞合成,a-maleimide-u-n-hydroxy-succinimide ester polyethylene glycol(mal-peg-nhs,分子量2.1kda)由美国creative pegworks公司购买,nhs-cy5.5染料由赛默飞公司购买;
192.b.mal-peg修饰的纤维蛋白原相关蛋白1(fgl1)(mal-peg-fgl1)制备:
193.mal-peg-nhs和纤维蛋白原相关蛋白1(fgl1)以摩尔比1:2的比例,在pbs(ph 8.0,0.3ml)中室温反应3小时;10kda的浓缩管浓缩并置换出未反应的mal-peg-nhs;
194.c.rvg29-cys-peg修饰的纤维蛋白原相关蛋白1(fgl1)(rvg29-cys-peg-fgl1)
195.制备:
196.rvg29-cys肽和mal-peg-fgl1以摩尔比5:1的比例,在pbs(ph 7.0,0.3ml)中室温反应24小时;10kda的浓缩管浓缩并置换出未反应的rvg29-cys肽;
197.d.nhs-cy5.5标记的rvg29-cys-peg-fgl1蛋白制备:
198.10μg的nhs-cy5.5和10mg rvg29-cys-peg-fgl1,在pbs(ph 8.0,0.3ml)中室温反应1小时,10kda的浓缩管浓缩并置换出未反应的nhs-cy5.5;
199.e.观察nhs-cy5.5标记的rvg29-cys-peg-fgl1蛋白脑组织中荧光含量:
200.雌性八周龄balb/c小鼠(18-22g)只,随机分为3组,即正常对照组、nhs-cy5.5标记的fgl1组和nhs-cy5.5标记的rvg29-cys-peg-fgl1组;小鼠尾静脉注射10mg/kg蛋白,1小时、2小时、6小时后使用小动物成像仪(ivis lumina xr)观察蛋白在小鼠器官中的分布。
201.使用rvg肽和cy5.5荧光修饰纤维蛋白原相关蛋白1(fgl1)的操作流程如图23所示。
202.rvg肽修饰促进纤维蛋白原相关蛋白1(fgl1)在小鼠脑组织中的分布检测结果如图24所示。
203.实施例8:
204.纤维蛋白原相关蛋白1(fgl1)与组织型纤溶酶原激活剂tpa的协同使用:
205.a.纤维蛋白原相关蛋白1(fgl1)与组织型纤溶酶原激活剂tpa的协同使用促进纤维蛋白的聚集:
206.实验方法如下:
207.多功能酶标仪m200pro检测光散射过程,调节仪器激发光为350nm,发射光为350nm。对照组为3.3μm的纤维原蛋白,模型组为3.3μm的纤维原蛋白 2.5u/ml凝血酶thrombin。上体系均在20mm tris-hcl,ph7.4,150mm nacl
±
10mm cacl2溶液中,体积为100微升/孔(96孔板)。在凝胶状的纤维蛋白形成1小时后,加入100微升,2nm组织型纤溶酶原激活剂tpa 各剂量的纤维蛋白原相关蛋白1(fgl1)。25℃,每分钟检测一次a350吸光值,测量动力学曲线。
208.b.纤维蛋白原相关蛋白1(fgl1)与组织型纤溶酶原激活剂tpa的协同使用促进血
栓的溶解:
209.方法如下:
210.1)血栓的制备:
211.首先在96孔板中沿着孔壁底部加入5微升促血栓滴液(innovin cacl2),其次在孔壁底部加入25微升新鲜小鼠血液。37℃孵育30分钟,即可得新鲜制备的血栓样本。
212.2)血栓的溶解:
213.对照组为试剂对照,给药组为2nm组织型纤溶酶原激活剂tpa,各剂量的纤维蛋白原相关蛋白1(fgl1)的单用以及联用组。在37℃,使用多功能酶标仪m200pro检测510nm激发光的吸收值,每分钟检测一次,测量动力学曲线。
214.纤维蛋白原相关蛋白1(fgl1)与组织型纤溶酶原激活剂tpa协同溶解纤维蛋白聚集的对比如图17所示。
215.实施例9:
216.纤维蛋白原结构域(fd)与组织型纤溶酶原激活剂tpa的协同使用:
217.a.纤维蛋白原结构域(fd)与组织型纤溶酶原激活剂tpa的协同使用促进纤维蛋白的聚集:
218.实验方法如下:
219.多功能酶标仪m200pro检测光散射过程,调节仪器激发光为350nm,发射光为350nm。对照组为3.3μm的纤维原蛋白,模型组为3.3μm的纤维原蛋白 2.5u/ml凝血酶thrombin。上体系均在20mm tris-hcl,ph7.4,150mm nacl
±
10mm cacl2溶液中,体积为100微升/孔(96孔板)。在凝胶状的纤维蛋白形成1小时后,加入100微升,2nm组织型纤溶酶原激活剂tpa 各剂量的纤维蛋白原结构域(fd)。25℃,每分钟检测一次a350吸光值,测量动力学曲线。
220.b.纤维蛋白原结构域(fd)与组织型纤溶酶原激活剂tpa的协同使用促进血栓的溶解:
221.方法如下:
222.1)血栓的制备:
223.首先在96孔板中沿着孔壁底部加入5微升促血栓滴液(innovin cacl2),其次在孔壁底部加入25微升新鲜小鼠血液。37℃孵育30分钟,即可得新鲜制备的血栓样本。
224.2)血栓的溶解:
225.对照组为试剂对照,给药组为2nm组织型纤溶酶原激活剂tpa,各剂量的纤维蛋白原结构域(fd)的单用以及联用组。在37℃,使用多功能酶标仪m200pro检测510nm激发光的吸收值,每分钟检测一次,测量动力学曲线。
226.纤维蛋白原结构域(fd)与组织型纤溶酶原激活剂tpa协同溶解纤维蛋白聚集的对比如图18所示。
227.实施例10:
228.纤维蛋白原相关蛋白1(fgl1)与尿激酶upa的协同使用:
229.a.纤维蛋白原相关蛋白1(fgl1)与尿激酶upa的协同使用促进纤维蛋白的聚集:
230.实验方法如下:
231.多功能酶标仪m200pro检测光散射过程,调节仪器激发光为350nm,发射光为
350nm。对照组为3.3μm的纤维原蛋白,模型组为3.3μm的纤维原蛋白 2.5u/ml凝血酶thrombin。上体系均在20mm tris-hcl,ph7.4,150mm nacl
±
10mm cacl2溶液中,体积为100微升/孔(96孔板)。在凝胶状的纤维蛋白形成1小时后,加入100微升,800u/ml尿激酶upa 各剂量的纤维蛋白原相关蛋白1(fgl1)。25℃,每分钟检测一次a350吸光值,测量动力学曲线。
232.b.纤维蛋白原相关蛋白1(fgl1)与尿激酶upa的协同使用促进血栓的溶解:
233.方法如下:
234.1)血栓的制备:
235.首先在96孔板中沿着孔壁底部加入5微升促血栓滴液(innovin cacl2),其次在孔壁底部加入25微升新鲜小鼠血液。37℃孵育30分钟,即可得新鲜制备的血栓样本。
236.2)血栓的溶解:
237.对照组为试剂对照,给药组为800u/ml尿激酶upa,各剂量的纤维蛋白原相关蛋白1(fgl1)的单用以及联用组。在37℃,使用多功能酶标仪m200pro检测510nm激发光的吸收值,每分钟检测一次,测量动力学曲线。
238.纤维蛋白原相关蛋白1(fgl1)与尿激酶upa协同溶解纤维蛋白聚集的对比如图19所示。
239.实施例11:
240.纤维蛋白原结构域(fd)与尿激酶upa的协同使用:
241.a.纤维蛋白原结构域(fd)与尿激酶upa的协同使用促进纤维蛋白的聚集:
242.实验方法如下:
243.多功能酶标仪m200pro检测光散射过程,调节仪器激发光为350nm,发射光为350nm。对照组为3.3μm的纤维原蛋白,模型组为3.3μm的纤维原蛋白 2.5u/ml凝血酶thrombin。上体系均在20mm tris-hcl,ph7.4,150mm nacl
±
10mm cacl2溶液中,体积为100微升/孔(96孔板)。在凝胶状的纤维蛋白形成1小时后,加入100微升,2800u/ml尿激酶upa 各剂量的纤维蛋白原结构域(fd)。25℃,每分钟检测一次a350吸光值,测量动力学曲线。
244.b.纤维蛋白原结构域(fd)与尿激酶upa的协同使用促进血栓的溶解方法如下:
245.1)血栓的制备:
246.首先在96孔板中沿着孔壁底部加入5微升促血栓滴液(innovin cacl2),其次在孔壁底部加入25微升新鲜小鼠血液。37℃孵育30分钟,即可得新鲜制备的血栓样本。
247.2)血栓的溶解:
248.对照组为试剂对照,给药组为800u/ml尿激酶upa,各剂量的纤维蛋白原结构域(fd)的单用以及联用组。在37℃,使用多功能酶标仪m200pro检测510nm激发光的吸收值,每分钟检测一次,测量动力学曲线。
249.纤维蛋白原结构域(fd)与尿激酶upa协同溶解纤维蛋白聚集的对比如图20所示。
250.实施例12:
251.纤维蛋白原相关蛋白1(fgl1)和纤维蛋白原结构域(fd)具有较低的毒副作用:
252.雌性八周龄balb/c小鼠(18-22g)60只,随机分为5组,即正常对照组、纤维蛋白原相关蛋白1(fgl1)100mg/kg,纤维蛋白原相关蛋白1(fgl1)30mg/kg,纤维蛋白原结构域(fd)100mg/kg,纤维蛋白原结构域(fd)30mg/kg,阿替普酶10mg/kg,尾静脉给药给药1小时候,戊巴比妥钠麻醉小鼠并进行流血时间测定。在距小鼠尾尖5mm处断尾,同时用秒表开始计时。
每隔10s用干净的滤纸片拭其断尾处,直至无血迹印到滤纸片上,停止计时,记录下所用时间。该时间即为小鼠尾出血时间。2小时后,取小鼠血浆,测定血浆中纤维蛋白原的含量。
253.纤维蛋白原相关蛋白1(fgl1)及维蛋白原结构域(fd)对纤维蛋白原的损失(a)和流血时间(b)无明显影响(无毒副作用),结果如图25所示。
254.实施例13:
255.此蛋白氨基酸序列中的某些关键位点进行突变,也能够实现增强其抑制血栓形成功能的效果,本实施例中对204位和269位关键位点的色氨酸突进行了突变处理,突变为丙氨酸,再采用实施例6的方法对突变后的纤维蛋白原结构域(fd)进行处理,得到的纤维蛋白原结构域(fd)突变体对聚集的纤维蛋白裂解作用的对照如图27所示;从图27对比结果可以看出,突变体对聚集的纤维蛋白的裂解相比于不突变形态下,明显有所增强。
256.最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
