1.本发明属于有机合成和新药物研发相关的药物化学技术领域,具体涉及一种异白叶藤碱 类似物,同时还涉及一种以依诺沙星为原料制备异白叶藤碱类似物的方法,以及其在制备抗 结核药物中的应用。
背景技术:
2.结核病是由结核杆菌引起的高发病率的慢性传染疾病,由于缺乏有效的治疗药物,目前 已成为全球所面临的一个紧迫的公共卫生和社会问题。同时,加之结核杆菌对现有药物易产 生耐药性,尤其是多药耐药性的产生,对开发抗结核药物提出新挑战,导致自利福平抗结核 药被发现以来的半个多世纪尚没有一个新型化合物用于结核病的治疗。因此,抗结核药物的 研发是一项高耗时、高投入的复杂智力创新工程而被受关注。其中,以天然药物有效成分为 先导物,对其结构进行优化修饰,是发现新药最经济有效的策略。在多种天然有效成分的研 发中发现,以吲哚并喹啉为结构特征骨架的白叶藤碱类生物碱,如白叶藤碱(cryptolepine,a)、 异白叶藤碱(isocryptolepine,b)、新白叶藤碱(neocryptolepine,c)等,因结构独特,且具有较好 的抗结疟原虫、抗肿瘤等多种生物活性而引起研究的兴趣,但是对其抗结核活性的报道尚少。
[0003][0004]
然而,由于白叶藤类生物碱的来源困难,加之水溶性差而导致其生物利用度低等缺陷而 限制临床应用。为此,如何以白叶藤类生物碱为先导物,以原子经济策略设计新型结构的吲 哚并喹啉类抗结核药物显得极为重要。一方面,基于氟喹诺酮药物不仅是临床重要的抗菌药 物,同时也是临床二线抗结核药物,如把白叶藤类生物碱及氟喹诺酮类的优势结构相拼合, 发挥各自的药效团优势,有可能设计发现新型的吲哚并喹啉类抗结核药物;另一方面,通过 引入氟喹诺酮药物分子中的有效取代基,进一步改善其药效学和药动学性质以克服现有生物 碱的自身缺陷,促进新型吲哚并喹啉类抗结核药物的成药性发展。鉴于此,我们选择白叶藤 碱类生物碱中的异白叶藤碱b为先导物,以其吲哚并[3,2-c]喹啉为优势骨架,引入氟喹诺酮 药物结构中的亲水性碱性哌嗪基以增加水溶性、改善其生物利用度,同时氟原子的引入可增 加药物分子的渗透性以提高其生物活性。
技术实现要素:
[0005]
本发明目的在于克服现有技术缺陷,提供一种具有抗结核菌作用和功效的异白叶藤碱类 似物,其以从商业购得的氟喹诺酮药物依诺沙星为原料,通过还原脱酸到萘啶酮
(6-氟-1-乙基
ꢀ‑
7-哌嗪-1-基-2,3-二氢-[1,8]萘啶-4(1h)-酮),然后与苯肼类通过费歇尔吲哚合成方法成功构建 获得。
[0006]
本发明还提供了一种以依诺沙星为原料制备异白叶藤碱类似物的方法,同时提供了异白 叶藤碱类似物的应用。本发明异白叶藤碱类似物以依诺沙星为原料,实现了由氟喹诺酮结构 到吲哚并萘啶骨架的有效化学构建,扩展了异白叶藤碱的结构修饰新途径,达到了氟喹诺酮 药物与天然吲哚并喹啉类生物碱的优势结构的互补,进而增加了该类化合物的抗结核菌活性 及其抗耐药性,并降低对正常细胞的毒性,可作为全新结构的抗结核药物进一步开发。
[0007]
为实现上述目的,本发明采用如下技术方案:
[0008]
一种异白叶藤碱类似物,其化学结构通式如式ⅰ所示:
[0009][0010]
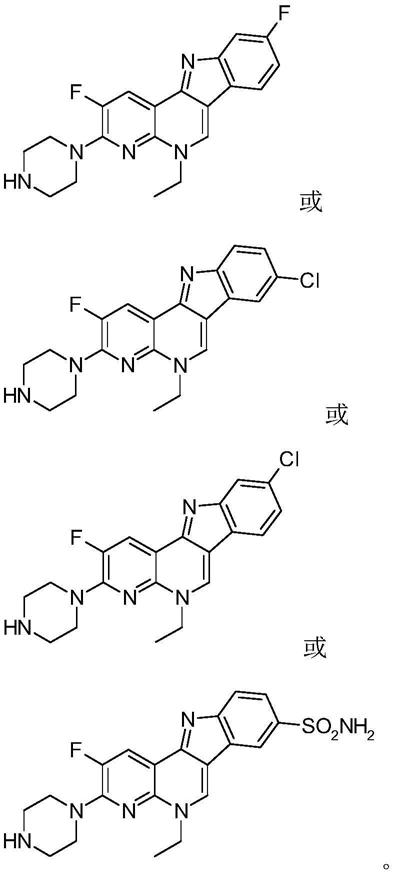
式ⅰ中的取代基r可独立为氢原子-h、甲氧基-och3、甲基-ch3、氟原子-f、氯原子-cl 或黄酰胺基-so2nh2,该类化合物为以下具体结构的化合物:
[0011]
[0012]
[0013][0014]
本发明提供了一种以依诺沙星为原料制备上述异白叶藤碱类似物的方法,其具体步骤包 括:以式ii所示的依诺沙星为原料,在溶剂存在条件下经与硼氢化钾还原脱酸反应制得式iii 所示化合物6-氟-1-乙基-7-哌嗪-1-基-2,3-二氢-[1,8]萘啶-4(1h)-酮,然后与苯肼类化合物通过 费歇尔吲哚合成方法构建吲哚并萘啶母核结构特征的白叶藤碱类生物碱,经后处理制得异白 叶藤碱类似物;
[0015][0016]
上述制备异白叶藤碱类似物的方法中,具体的,依诺沙星与还原剂硼氢化钾的摩尔比为 1.0:1.0~3.0,6-氟-1-乙基-7-哌嗪-1-基-2,3-二氢-[1,8]萘啶-4(1h)-酮与苯肼类化合物的摩尔比为 1.0:1.0~2.0。作为进一步的改进,所述的溶剂可为无水甲醇、无水乙醇或95%乙醇中的至少一 种,优选无水甲醇。苯肼类化合物可以是苯肼、对甲氧基苯肼、间甲氧基苯肼、邻甲氧基苯 肼、对甲基苯肼、对氟苯肼、间氟苯肼、对氯苯肼、间氯苯肼、对磺酰胺基苯肼等。
[0017]
本发明还提供了上述异白叶藤碱类似物在制备抗结核药物中的应用。进一步的,可以是 在制备抑制结核分支杆菌药物中的应用。结核分支杆菌可以为h
37
ra或h
37
rv等。
[0018]
本发明异白叶藤碱类似物的制备,以商业得到的式ⅱ所示的依诺沙星为原料,经与商业 购得的分析纯化学试剂硼氢化钠发生还原脱羧反应制得式ⅲ所示6-氟-1-乙基-7-哌嗪-1-基
ꢀ‑
2,3-二氢-[1,8]萘啶-4(1h)-酮,其制备方法参考文献(kondo h,sakamoto f,et al.studis onprodrugs.7.synthesis and antimicrobial activity of 3-formylquinolone derivatives,j med chem, 1988,31(1):221-225.)的类似方法。
[0019][0020]
作为进一步的改进,用不易吸潮、价格便宜的硼氢化钾替代文献中的硼氢化钠,其制备 操作过程:
[0021][0022]
取依诺沙星ⅱ18.0g(55.0mmol)悬浮于500ml溶剂无水甲醇中,常温搅拌下分次慢慢 加入硼氢化钾7.4g(138.0mmol),混合反应物水浴加热,搅拌回流反应至原料ⅱ消失(tlc 检测)。放置室温,用旋转蒸发器减压蒸除溶剂。剩余物加入去离子水500ml,用浓盐酸调 ph为2.0左右,加入适量的活性炭脱色,滤液用质量浓度为30%的氢氧化钠溶液调ph≈10.0, 放置析出固体。粗品依次用沸水重结晶、乙酸乙酯重结晶得式ⅲ所示的6-氟-1-乙基-7-哌嗪-1
‑ꢀ
基-2,3-二氢-[1,8]萘啶-4(1h)-酮,产率53.7%,m.p.114~116℃。
[0023]
将式ⅲ所示6-氟-1-乙基-7-哌嗪-1-基-2,3-二氢-[1,8]萘啶-4(1h)-酮与分析纯化学试剂苯肼 类化合物在酸的催化下在无水乙醇中进行费歇尔吲哚合成反应,待反应完全后,经处理得到 目标化合物如式ⅰ所示。
[0024][0025]
其中,式ⅰ中的取代基r可独立为氢原子-h、甲氧基-och3、甲基-ch3、氟原子-f、氯 原子-cl或黄酰胺基-so2nh2等。
[0026]
目标化合物式ⅰ通用的合成制备操作步骤为:取式ⅲ所示的6-氟-1-乙基-7-哌嗪-1-基
ꢀ‑‑
2,3-二氢-[1,8]萘啶-4(1h)-酮1.0g(3.6mmol)溶解于15ml无水乙醇中,加入苯肼类化合物 (3.6mmol),混合反应物常温搅拌至原料ⅲ消失(tlc检测)。滴加0.5ml环合催化剂,混合 反应物回流反应10~24h,放置室温,过滤收集产生的式ⅰ盐酸盐固体粗品。将式ⅰ盐酸盐固 体粗品溶于50ml去离子水中,加入适量的活性炭回流脱色1.0h,滤液用浓氨水调ph≈10.0。 过滤收集产生的固体,用无水乙醇-乙酸乙酯混合溶剂重结晶,得淡黄色结晶目标物式ⅰ。
[0027]
作为进一步的改进,式ⅲ所示的6-氟-1-乙基-7-哌嗪-1-基-2,3-二氢-[1,8]萘啶-4(1h)-酮与 苯肼类化合物物质的量(摩尔)比为1:1.0~2.0。所述的环合催化剂为浓盐酸、浓硫酸、磷酸、 多聚磷酸、冰乙酸或三氟乙酸中的至少一种,优选浓盐酸作为催化剂。
[0028]
和现有技术相比,本发明有益效果如下:
[0029]
本发明异白叶藤碱类似物保留了异白叶藤碱的优势骨架—吲哚并[1,8]萘啶母核,同时也 兼有氟喹诺酮药物的特征结构—[1,8]萘啶环,尤其是作为氟喹诺酮药物的有效修饰基,其亲 水性的碱性哌嗪基作为吲哚并[1,8]萘啶母核的修饰基,不仅可有效改善白叶藤生物碱类的水 溶性,提高生物利用度,有利于成药性的发展,同时f原子的引入可增加药物渗透作用,实 现增效降毒及抗耐药的效果。本发明异白叶藤碱类似物实现了不同结
构药效团的互补和活性 的叠加,具有优秀的体外抑制结核杆菌生长活性,可作为新型的吲哚并[1,8]萘啶结构特征的 抗结核药物进一步开发。
具体实施方式
[0030]
以下结合实施例对本发明的技术方案作进一步地详细介绍,但本发明的保护范围并不局 限于此。
[0031]
下述实施例中,所用式ⅲ所示化合物6-氟-1-乙基-7-哌嗪-1-基-2,3-二氢-[1,8]萘啶-4(1h)
‑ꢀ
酮经下述步骤制备获得:
[0032][0033]
取依诺沙星ⅱ18.0g(55.0mmol)悬浮于500ml溶剂无水甲醇中,常温搅拌下分次慢慢 加入硼氢化钾7.4g(138.0mmol),混合反应物水浴加热,搅拌回流反应至原料ⅱ消失(tlc 检测)。放置室温,用旋转蒸发器减压蒸除溶剂。剩余物加入去离子水500ml,用浓盐酸调 ph为2.0左右,加入适量的活性炭脱色,滤液用质量浓度为30%的氢氧化钠溶液调ph≈10.0, 放置析出固体。粗品依次用沸水重结晶、乙酸乙酯重结晶得式ⅲ所示的6-氟-1-乙基-7-哌嗪-1
‑ꢀ
基-2,3-二氢-[1,8]萘啶-4(1h)-酮,产率53.7%,m.p.114~116℃。1h nmr(400mhz,cd3cl)δ: 8.12(1h,d,5-h),3.07~3.38(8h,哌嗪-h),3.62(2h,q,ch2),3.24~2.56(4h,m,2-h和3-h), 2.13(1h,brs,nh),1.38(3h,t,ch3);ms(m/z):279[m h]
,计算(c
14h19
fn4o):278.33。
[0034]
实施例1
[0035]
2-氟-3-哌嗪-1-基-5-乙基-5h-吲哚并[3,2-c][1,8]萘啶(i-1),其化学结构式为:
[0036][0037]
即式ⅰ中的r为h原子。
[0038]
该化合物(i-1)的制备方法为:取6-氟-1-乙基-7-哌嗪-1-基-2,3-二氢-[1,8]萘啶-4(1h)-酮
ⅲꢀ
1.0g(3.6mmol)溶解于15ml无水乙醇中,加入苯肼0.50g(4.6mmol),常温搅拌反应20h(tlc 观察原料ⅲ消失),有大量的沉淀物生成。加入浓盐酸(0.50ml)作为环合催化剂,混合反应 物回流反应20h,放置过夜(12h,下同)。过滤收集产生的固体,用50ml去离子水溶解固 体,加入适量的活性炭,回流脱色1h。热过滤,滤液用氨水调ph≈10.0。过滤收集产生的固 体,干燥,用无水乙醇-乙酸乙酯混合溶剂(v:v=5:1)重结晶,得淡黄色结晶目标物式i-1,产率 52.7%,m.p.235~237℃。1h nmr(400mhz,cd3cl)δ:9.15(1h,d,6-h),7.36
~8.62(5h,m, 1-h和ph-h),4.86(2h,q,ch2),3.35~3.82(9h,m,哌嗪-h和nh),1.86(3h,t,ch3); ms(m/z):350[m h]
,计算(c
20h20
fn5):349.41。
[0039]
实施例2
[0040]
2-氟-8-甲氧基-3-哌嗪-1-基-5-乙基-5h-吲哚并[3,2-c][1,8]萘啶(i-2),其化学结构式为:
[0041][0042]
即式ⅰ中的r为甲氧基。
[0043]
该化合物(i-2)的制备方法为:取6-氟-1-乙基-7-哌嗪-1-基-2,3-二氢-[1,8]萘啶-4(1h)-酮
ⅲꢀ
1.0g(3.6mmol)溶解于15ml无水乙醇中,加入对甲氧基苯肼0.62g(4.5mmol),常温搅拌反 应过夜(tlc观察原料ⅲ消失),有明显的沉淀物生成。加入浓盐酸(0.50ml),混合反应物回 流反应16h,放置过夜。过滤收集产生的固体,用50ml去离子水溶解固体,加入适量的活 性炭,回流脱色1h。热过滤,滤液用氨水调ph≈10.0。过滤收集产生的固体,干燥,用无水 乙醇-乙酸乙酯混合溶剂(v:v=5:1)重结晶,得淡黄色结晶目标物式i-2,产率56.2%,m.p. 236~238℃。1h nmr(400mhz,cd3cl)δ:9.17(1h,d,6-h),7.52~8.66(4h,m,1-h和ph-h), 4.84(2h,q,ch2),3.94(3h,s,och3),3.37~3.81(9h,m,哌嗪-h和nh),1.92(3h,t,ch3);ms(m/z):380[m h]
,计算(c
21h22
fn5o):379.44。
[0044]
实施例3
[0045]
2-氟-9-甲氧基-3-哌嗪-1-基-5-乙基-5h-吲哚并[3,2-c][1,8]萘啶啉(i-3),其化学结构式为:
[0046][0047]
即式ⅰ中的r为甲氧基。
[0048]
该化合物(i-3)的制备方法为:取6-氟-1-乙基-7-哌嗪-1-基-2,3-二氢-[1,8]萘啶-4(1h)-酮
ⅲꢀ
1.0g(3.6mmol)溶解于15ml无水乙醇中,加入间甲氧基苯肼0.83g(6.0mmol),常温搅拌反 应24h(tlc观察原料ⅲ消失),出现明显的沉淀物生成。加入浓盐酸(0.50ml),混合反应物 回流反应16h,放置过夜。过滤收集产生的固体,用50ml去离子水溶解固体,加入适量的 活性炭,回流脱色1h。热过滤,滤液用氨水调ph≈10.0。过滤收集产生的固体,干燥,用无 水乙醇-乙酸乙酯混合溶剂(v:v=5:1)重结晶,得淡黄色结晶目标物式i-3,产率50.2%,m.p. 233~235℃。1h nmr(400mhz,cd3cl)δ:9.16(1h,d,6-h),7.53~8.67(4h,m,1-h和ph-h), 4.86(2h,q,ch2),3.91(3h,s,och3),3.35~3.84(9h,m,哌嗪-h和nh),
1.90(3h,t,ch3); ms(m/z):380[m h]
,计算(c
21h22
fn5o):379.44。
[0049]
实施例4
[0050]
2-氟-10-甲氧基-3-哌嗪-1-基-5-乙基-5h-吲哚并[3,2-c][1,8]萘啶啉(i-4),其化学结构式为:
[0051][0052]
即式ⅰ中的r为甲氧基。
[0053]
该化合物(i-4)的制备方法为:取6-氟-1-乙基-7-哌嗪-1-基-2,3-二氢-[1,8]萘啶-4(1h)-酮
ⅲꢀ
1.0g(3.6mmol)溶解于15ml无水乙醇中,加入邻甲氧基苯肼0.72g(5.0mmol),常温搅拌反 应24h(tlc观察原料ⅲ消失),有沉淀物生成。加入浓盐酸(0.50ml),混合反应物回流反应 18h,放置过夜。过滤收集产生的固体,用50ml去离子水溶解固体,加入适量的活性炭, 回流脱色1h。热过滤,滤液用氨水调ph≈10.0。过滤收集产生的固体,干燥,用无水乙醇
‑ꢀ
乙酸乙酯混合溶剂(v:v=5:1)重结晶,得淡黄色结晶目标物式i-4,产率46.5%,m.p.227~229℃。 1
h nmr(400mhz,cd3cl)δ:9.15(1h,d,6-h),7.56~8.72(4h,m,1-h和ph-h),4.88(2h,q, ch2),3.93(3h,s,och3),3.37~3.86(9h,m,哌嗪-h和nh),1.92(3h,t,ch3);ms(m/z): 380[m h]
,计算(c
21h22
fn5o):379.44。
[0054]
实施例5
[0055]
2-氟-8-甲基-3-哌嗪-1-基-5-乙基-5h-吲哚并[3,2-c][1,8]萘啶啉(i-5),其化学结构式为:
[0056][0057]
即式ⅰ中的r为甲基。
[0058]
该化合物(i-5)的制备方法为:取式ⅲ所示的6-氟-1-乙基-7-哌嗪-1-基-2,3-二氢-[1,8]萘啶
ꢀ‑
4(1h)-酮ⅲ1.0g(3.6mmol)溶解于15ml无水乙醇中,加入对甲基苯肼0.70g(5.7mmol), 常温搅拌反应过夜(tlc观察原料ⅲ消失),有沉淀物生成。加入浓盐酸(0.50ml),混合反应 物回流反应17h,放置过夜。过滤收集产生的固体,用50ml去离子水溶解固体,加入适量 的活性炭,回流脱色1h。热过滤,滤液用氨水调ph≈10.0。过滤收集产生的固体,干燥,用 无水乙醇-乙酸乙酯混合溶剂(v:v=6:1)重结晶,得淡黄色结晶目标物式i-5,产率51.6%,m.p. 234~236℃。1h nmr(400mhz,cd3cl)δ:9.12(1h,d,6-h),7.47~8.66(4h,m,1-h和ph-h), 4.85(2h,q,ch2),3.92(3h,s,och3),3.28~3.85(9h,m,哌嗪-h和nh),2.28(3h,s,ph-ch3), 1.96(3h,t,ch3);ms(m/z):364[m h]
,计算(c
21h22
fn5):363.44。
[0059]
实施例6
[0060]
2,8-二氟-3-哌嗪-1-基-5-乙基-5h-吲哚并[3,2-c][1,8]萘啶啉(i-6),其化学结构式为:
[0061][0062]
即式ⅰ中的r为f原子。
[0063]
该化合物(i-6)的制备方法为:取6-氟-1-乙基-7-哌嗪-1-基-2,3-二氢-[1,8]萘啶-4(1h)-酮ⅲ1.0g(3.6mmol)溶解于15ml无水乙醇中,加入对氟苯肼0.60g(4.8mmol),常温搅拌反应24 h(tlc观察原料ⅲ消失),有大量的沉淀物生成。加入浓盐酸(0.50ml),混合反应物回流反应 16h,放置过夜。过滤收集产生的固体,用50ml去离子水溶解固体,加入适量的活性炭, 回流脱色1h。热过滤,滤液用氨水调ph≈10.0。过滤收集产生的固体,干燥,用无水乙醇
‑ꢀ
乙酸乙酯混合溶剂(v:v=5:1)重结晶,得淡黄色结晶目标物式i-6,产率56.4%,m.p.233~235℃。 1
h nmr(400mhz,cd3cl)δ:9.18(1h,d,6-h),7.67~8.83(4h,m,1-h和ph-h),4.87(2h,q, ch2),3.37~3.88(9h,m,哌嗪-h和nh),2.16(3h,t,ch3);ms(m/z):368[m h]
,计算 (c
20h19
f2n5):367.40。
[0064]
实施例7
[0065]
2,9-二氟-3-哌嗪-1-基-5-乙基-5h-吲哚并[3,2-c][1,8]萘啶(i-7),其化学结构式为:
[0066][0067]
该化合物(i-7)的制备方法为:取6-氟-1-乙基-7-哌嗪-1-基-2,3-二氢-[1,8]萘啶-4(1h)-酮
ⅲꢀ
1.0g(3.6mmol)溶解于15ml无水乙醇中,加入间氟苯肼0.66g(5.2mmol),常温搅拌反应过 夜(tlc观察原料ⅲ消失),有明显的沉淀物生成。加入浓盐酸(0.50ml),混合反应物回流反 应16h,放置过夜。过滤收集产生的固体,用50ml去离子水溶解固体,加入适量的活性炭, 回流脱色1h。热过滤,滤液用氨水调ph≈10.0。过滤收集产生的固体,干燥,用无水乙醇
‑ꢀ
乙酸乙酯混合溶剂(v:v=5:1)重结晶,得淡黄色结晶目标物式i-7,产率50.2%,m.p.231~233℃。 1
h nmr(400mhz,cd3cl)δ:9.17(1h,d,6-h),7.62~8.84(4h,m,1-h和ph-h),4.86(2h,q, ch2),3.35~3.86(9h,m,哌嗪-h和nh),2.12(3h,t,ch3);ms(m/z):368[m h]
,计算 (c
20h19
f2n5):367.40。
[0068]
实施例8
[0069]
2-氟-8-氯-3-哌嗪-1-基-5-乙基-5h-吲哚并[3,2-c][1,8]萘啶(i-8),其化学结
构式为:
[0070][0071]
即式ⅰ中的r为氯原子。
[0072]
该化合物(i-8)的制备方法为:取6-氟-1-乙基-7-哌嗪-1-基-2,3-二氢-[1,8]萘啶-4(1h)-酮
ⅲꢀ
1.0g(3.6mmol)溶解于15ml无水乙醇中,加入对氯苯肼0.74g(5.2mmol),常温搅拌反应24 h(tlc观察原料ⅲ消失),有大量的沉淀物生成。加入浓盐酸(0.50ml),混合反应物回流反应 24h,放置过夜。过滤收集产生的固体,用50ml去离子水溶解固体,加入适量的活性炭, 回流脱色1h。热过滤,滤液用氨水调ph≈10.0。过滤收集产生的固体,干燥,用无水乙醇
‑ꢀ
乙酸乙酯混合溶剂(v:v=5:1)重结晶,得淡黄色结晶目标物式i-8,产率46.4%,m.p.230~232℃。 1
h nmr(400mhz,cd3cl)δ:9.16(1h,d,6-h),7.56~8.67(4h,m,1-h和ph-h),4.82(2h,q, ch2),3.33~3.81(9h,m,哌嗪-h和nh),1.96(3h,t,ch3);ms(m/z):384(cl
35
)[m h]
, 386(cl
37
)[m h]
,计算(c
20h19
clfn5):383.86。
[0073]
实施例9
[0074]
2-氟-9-氯-3-哌嗪-1-基-5-乙基-5h-吲哚并[3,2-c][1,8]萘啶(i-9),其化学结构式为:
[0075][0076]
即式ⅰ中的r为氯原子。
[0077]
该化合物(i-9)的制备方法为:取6-氟-1-乙基-7-哌嗪-1-基-2,3-二氢-[1,8]萘啶-4(1h)-酮
ⅲꢀ
1.0g(3.6mmol)溶解于15ml无水乙醇中,加入间氯苯肼0.70g(5.0mmol),常温搅拌反应 24h(tlc观察原料ⅲ消失),有明显的沉淀物生成。加入浓盐酸(0.50ml),混合反应物回流反 应18h,放置过夜。过滤收集产生的固体,用50ml去离子水溶解固体,加入适量的活性炭, 回流脱色1h。热过滤,滤液用氨水调ph≈10.0。过滤收集产生的固体,干燥,用无水乙醇
‑ꢀ
乙酸乙酯混合溶剂(v:v=5:1)重结晶,得淡黄色结晶目标物式i-9,产率47.4%,m.p.232~234℃。 1
h nmr(400mhz,cd3cl)δ:9.15(1h,d,6-h),7.60~8.78(4h,m,1-h和ph-h),4.85(2h,q, ch2),3.36~3.86(9h,m,哌嗪-h和nh),1.97(3h,t,ch3);ms(m/z):384(cl
35
)[m h]
, 386(cl
37
)[m h]
,计算(c
20h19
clfn5):383.86。
[0078]
实施例10
[0079]
2-氟-8-磺酰胺基-3-哌嗪-1-基-5-乙基-5h-吲哚并[3,2-c][1,8]萘啶(i-10),其化学结构式为:
[0080][0081]
即式ⅰ中的r为磺酰胺基。
[0082]
该化合物(i-10)的制备方法为:取6-氟-1-乙基-7-哌嗪-1-基-2,3-二氢-[1,8]萘啶-4(1h)-酮
ⅲꢀ
1.0g(3.6mmol)溶解于15ml无水乙醇中,加入对磺酰胺基苯肼0.67g(3.6mmol),常温搅拌 反应过夜(tlc观察原料ⅲ消失),有大量的沉淀物生成。加入浓盐酸(0.50ml),混合反应物 回流反应24h,放置过夜。过滤收集产生的固体,用50ml去离子水溶解固体,加入适量的 活性炭,回流脱色1h。热过滤,滤液用氨水调ph≈10.0。过滤收集产生的固体,干燥,用无 水乙醇-乙酸乙酯混合溶剂(v:v=8:1)重结晶,得淡黄色结晶目标物式i-10,产率55.7%,m.p. 246~248℃。1h nmr(400mhz,cd3cl)δ:9.25(1h,d,6-h),7.53~8.92(6h,m,1-h、ph-h 和nh2),4.92(2h,q,ch2),3.36~3.93(9h,m,哌嗪-h和nh),2.18(3h,t,ch3);ms(m/z): 429[m h]
,计算(c
20h21
fn6o2s):428.49。
[0083]
实验例
[0084]
一、实施例1~10提供的异白叶藤碱类似物的体外抗结核菌活性测定
[0085]
1、实验试剂
[0086]
阳性对照品异烟肼(isoniazide,inh)和依诺沙星(enoxacin)购自河南省食品药品检验所; 7h9液体培养液购自美国difco公司。在无菌条件下,用二甲基亚砜(dmso)将阳性对照品及 实施例i-1~i-10供试品配成4mg/ml的溶液,超声充分溶解后以0.22μm滤膜过滤,滤液作为 储备液置-20℃下保存待用(使用时,为避免dmso对实验结果的影响,dmso在培养液中 的浓度《0.5%)。
[0087]
2、结核菌株
[0088]
实验用结核菌株分别为结核分枝杆菌标准株h
37
ra(atcc25177)、h
37
rv(atcc27294)及3 株临床分离的耐药结核分枝杆菌(本技术中编号分别为h6、h7和h10),均由河南省疾病预 防控制中心提供并提供实验数据的测定。其中,h6、h7为对异烟肼、利福平、乙胺丁醇、 链霉素、氧氟沙星的多重耐药菌株,h10为对异烟肼、利福平的耐药菌株。
[0089]
3、实验方法
[0090]
1)菌株悬液的制备:将培养2~3周菌龄的待测结核杆菌用接种环取出接入灭菌小瓶中, 混均至成乳状,生理盐水稀释,通过与no.1麦氏标准比浊管比浊,将菌液配成1mg/ml的菌 液,再用生理盐水稀释至1
×
105cfu备用。
[0091]
2)在96孔培养板上,加入200μml合适浓度的待测化合物溶液(以无菌的7h9液体培 养液稀释待测化合物至200μg/ml),然后根据需要再对待测化合物进行稀释(倍比稀释至50、 25、12.5、6.25、3.125、1.56、0.78、0.39、0.195、0.097、0.048、0.024、0.012μg/ml),并 设无药对照孔。
[0092]
3)将上述稀释好的菌液加入到所有检测孔中以及无药对照孔中,将这些板置于恒温孵箱 中,每板在37℃,5%co2条件下培养21天。40
×
的显微镜观察,肉眼未见菌株生长的
最低浓 度即为该药的最低抑菌浓度(mic)。同时,以异烟肼、依诺沙星为阳性对照,以dmso和不 添加任何化合物的培养液作为阴性对照。每个数据平行测定三次,求其平均值,实验结果见 表1所示。
[0093]
表1供试样品的体外抗结核活性(mic)
[0094][0095]
表1结果表明,实施例1~10提供的化合物中,除实施例5外,对h
37
ra和h
37
rv两种结 核分枝杆菌标准株的mic值均相当于或低于对照依诺沙星,尤其是实施例1、实施例4、实 施例7和实施例10的活性与异烟肼相当,表现出较好的体外抗结核菌活性。同时,实施例 1~10提供的化合物多数对3种临床分离的耐药菌株h6、h7和h10的mic值低于对照依诺 沙星或异烟肼,体现出较好的抗耐药活性。
[0096]
二、实施例1~10的体外细胞毒性测定
[0097]
1、实验试剂
[0098]
阳性对照品异烟肼(isoniazide,inh)和依诺沙星(enoxacin)购自河南省食品药品检验所; 正常细胞为非洲绿猴肾细胞株vero,购买于上海通派生物科技有限公司。rpmi,胰蛋白酶 (trgpsin)和胎牛血清购于杭州四季青生物工程材料有限公司;溴化-(4,5)-二甲基-2-噻唑
ꢀ‑
2,5-二苯基四氮唑(mtt,amresco分装);十二烷基磺酸钠(sds),磷酸二氢钠购于天津科 密欧化学试剂开发中心;乙二胺四乙酸二钠盐(edta)和二甲基亚砜(dmso)购于天津德恩 化学式有限公司。
[0099]
2、实验供试液的配制
[0100]
在无菌条件下,用二甲基亚砜(dmso)将阳性对照品及实施例1~10供试品配制成 1.0
×
10-4
mol
·
l-1
浓度的12种储备液,之后用质量百分比浓度为10%的胎牛血清的rpmi-1640 培养液将储备液稀释成具有5个浓度梯度(0.1、1.0、5.0、10.0、50.0μmol
·
l-1
)的工作
液, 超声充分溶解后以0.22μm滤膜过滤,滤液作为供试液置-20℃下保存待用。
[0101]
3、实验方法(mtt法)
[0102]
取对数生长期的vero非洲绿猴肾细胞株,以每孔6000个细胞接种于96孔板,随后分 别加入上述12种样品的具有5个浓度梯度的工作液,48小时后每孔加入5g
·
l
–1mtt(噻唑 蓝)溶液10μl,继续再培养4小时之后加入100μl质量百分比浓度为10%的十二烷基硫酸钠 (sds)溶液。培养24小时,然后用酶标仪在570nm波长处测定吸光度(od)值。细胞增殖 抑制率按公式计算:
[0103]
抑制率=[(1-实验组od值)/对照组od值]
×
100%
[0104]
然后以各供试样品的各浓度的对数值对各浓度对应的vero细胞抑制率作线性回归,得到剂 量-效应方程,从所得剂量-效应方程计算出供试样品对实验vero细胞的半数抑制浓度(ic
50
); 每个数据平行测定三次,求其平均值,结果见表2所示。
[0105]
表2供试样品的体外vero细胞毒性测定(ic
50
)
[0106][0107][0108]
表2结果表明,实施例1~10提供的化合物对vero细胞的半数生长抑制浓度(ic
50
)与阳 性对照依诺沙星相当,体现出较低的细胞毒作用,同时,实施例1~10提供的化合物的ic
50
高于阳性异烟肼的ic
50
值,表明实施例1~10提供的化合物其细胞毒性低于阳性对照异烟肼。
[0109]
综上所述,实施例1~10提供的化合物体外不仅具有较好的抗结核菌活性,同时也具有潜 在的抗耐药活性,且表现出较低的细胞毒作用。基于新药研究的规律,本发明异白叶藤碱类 似物有望开发出高效低毒的抗结核药物。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。