用于基因水平abo嵌合体的taqman水解探针及检测方法
技术领域
1.本发明属于基因检测技术领域,具体涉及一种用于基因水平abo嵌合体的taqman水解探针及检测方法。
背景技术:
2.异基因造血干细胞移植(allogenic hematopoietic stem cell transplantation,allo
‑
hsct)是用健康的供者造血细胞替代受者自身来重建造血及免疫功能以达到治疗疾病的目的。allo
‑
hsct 术后受者必然出现自身及供者来源造血共存即嵌合体现象(chimerism),嵌合体状态可伴随移植进展呈动态性变化或稳定存在。当前allo
‑
hsct嵌合体分析具有重要的临床诊疗价值,如:移植物植入监控、移植排斥早期诊断、微小残留病或早期复发诊断等,也是实施调整 gvhd 免疫抑制强度、供者淋巴细胞输注等干预措施的重要依据。
3.当前国内外主流的基因水平嵌合体分析方法为短片段重复序列 pcr(short tandem repeats,str
‑
pcr)和基于单核苷酸多态性(single nucleotide polymorphisms,snp)的实时荧光定量pcr,但str
‑
pcr存在1%~5%的低灵敏度、有时存在切迹峰干扰其准确定量的缺陷;而依赖snp实时荧光定量 pcr 灵敏度尽管可达 10
‑1~10
‑4,但因 snp更低的信息效力将导致其筛选规模较str明显扩大。最关键的是,这两种方法实施前提均需要首先确定具有区分供受者的遗传标志物作为靶点,其具体的策略是依据群体分布频率高低来组成相应规模的候选标志物谱,并从中随机筛选加以确定,因而具有区分供受者效力的靶点在实际筛选中存在较大的盲目性、不确定性和种群间的不通用性。
4.目前abo血型不合的造血干细胞移植在临床上比较常见,约占移植总体的40~50%。而abo血型不合的造血干细胞移植术后天然存在供受者两种不同abo血型血细胞的共存时期,即天然存在abo嵌合体。考虑到abo基因特征性的核酸多态性位点(nucleotide polymorphism sites, nps)主要为 snp 或插入缺失多态性,因而完全符合基因水平嵌合体分析的靶点要求。更重要的是,除了极罕见基因表达障碍外,abo 不合 hsct 供受者 abo 表型及其基因型均存在固有的差异,也即提示天然存在可区分供受者的abo基因型特征性nps,这决定了其作为嵌合体分析的靶点将更直接和具有可利用性,且拥有极低筛选规模及成本优势。动态监测abo嵌合体比例及其转变不但反映abo血型不合移植的供受者血细胞转变的实时状态及进程,而且是确保移植后全过程输血支持治疗的重要实验室依据。
5.目前已建立了abo双倍体基因型相关的5个核酸多态性位点(nps),即216突变位点、261正常位点、467突变位点、803正常位点和803突变位点,所采用的检测方法为采用sybr
‑
green1染料的实时荧光 pcr 检测体系。随着taqman 水解探针实时荧光定量pcr的出现,研究发现该方法比采用sybr
‑
green1染料的实时荧光 pcr更有应用优势,从方法原理上比较,taqman水解探针的特异性比sybr
‑
green1染料更好,因为sybr
‑
green1染料不只针对特异扩增的模板,对于引物非特异性的扩增产物也会导致荧光信号产生,而taqman水解探针是与待检测的扩增模板特异性结合并在pcr延伸过程中才会产生荧光信号。但是目前仍
缺少适合abo嵌合体基因水平检测的taqman水解探针,而且缺少一套完整的用于abo嵌合体的taqman 水解探针实时荧光定量pcr检测方法。
技术实现要素:
6.针对上述不足,本发明的目的在于提供了一种用于基因水平abo嵌合体的taqman水解探针及检测方法,提高基因水平abo嵌合体检测的灵敏性、准确性。
7.本发明是采用如下技术方案实现的:一种用于基因水平abo嵌合体的taqman 水解探针,包括三种taqman水解探针,它们分别为:探针261:fam
‑
tcaacatcgacatcctcaacgagca
‑
bhq(序列表的序列1);探针467:fam
‑
cgcggtgccccgcgtga
‑
bhq(序列表的序列2);探针803:fam
‑
gggatgtaggcctgggactggggccggc
‑
bhq(序列表的序列3)。
8.一种用于基因水平abo嵌合体的检测方法,其具体包括以下步骤:(1)内参白蛋白基因标准曲线的建立:取一份高质量的基因组dna作为标准品,用分光光度计重复测定基因组dna的浓度8次,然后计算得到基因组dna的浓度平均值, 再使用te缓冲液进行稀释并调整得到浓度为100ng/
µ
l的dna溶液,接着使用te缓冲液对所述dna溶液进行倍比梯度稀释,得到浓度依次为50ng/
µ
l、25ng/
µ
l、12.5ng/
µ
l、6.25ng/
µ
l、3.125ng/
µ
l、1.5625ng/
µ
l的稀释液;将各个稀释浓度的基因组dna溶液分别作为dna模板进行白蛋白内参基因pcr扩增反应,所述白蛋白内参基因pcr扩增反应的体系总体积为20
µ
l,其具体包括2
×
hieff
tm qpcr green master mix试剂盒的反应mix液10
µ
l、dna模板2.0
µ
l、白蛋白上游引物0.8
µ
l、白蛋白下游引物0.8
µ
l,余量为无菌双蒸水;所述白蛋白上游引物和白蛋白下游引物的浓度均为10
µ
m;所述白蛋白上游引物为tgttgcatgagaaaacgcca(序列表的序列4);所述白蛋白下游引物为gtcgcctgttcaccaaggat(序列表的序列5);所述内参基因pcr扩增反应的程序参数为:s1.95℃预变性 5min;s2.扩增循环参数:95℃ 10s,60℃ 30s,75℃ 1s,共40个循环;s3.熔解曲线分析参数:95℃ 15s,60℃ 60s,95℃ 15s,检测范围60℃~95℃,温度变化率为0.1℃/s;根据测定结果绘制白蛋白基因的扩增曲线、熔解曲线和标准回归曲线;(2)取待测血样进行dna的提取,具体是先取血样2ml于edta抗凝管中得到edta抗凝血,然后取edta抗凝血100μl于ep管中,接着加入100 μlnai,涡旋振荡2~3 min,接着加入200 μl抽提剂抽提3 min,再在13000 r/min的条件下离心5 min,取上清液至新的ep管中,再加入200 μl异丙醇摇匀,然后在13000 r/min的条件下离心5 min,接着弃上清液,加入1ml体积浓度为70%的乙醇,在13000 r/min的条件下离心5 min,再弃上清液得到沉淀,然后将沉淀干燥后再加入20μl的灭菌双蒸水溶解得到待测dna;所述抽提剂是氯仿和异戊醇按照体积比24:1的比例均匀混合得到的;(3)取5μl待测dna用灭菌双蒸水稀释至1.0 ml得到待测样品,测定待测样品在
260nm、280nm和310nm处的吸光度od值,计算每个待测样品的浓度,将待测样品作为dna模板,按照步骤(1)中所述的白蛋白内参基因pcr扩增反应进行扩增,根据所得到的扩增曲线和步骤(1)中得到的标准回归曲线分析计算得到待测样品的浓度,以此对待测样品的浓度进行校正,然后调节待测样品中dna的浓度至20ng/μl;(4)pcr扩增反应:将步骤(2)中得到的待测样品分别作为检测模板进行pcr扩增反应,先将引物组261、引物组467、引物组803和三个水解taqman探针分别用双蒸水稀释成10pmol/μl的溶液,然后与检测模板、2
×
probe pcr master mix试剂和灭菌双蒸水混合得到用于检测261突变位点、261正常位点、467突变位点、803突变位点、803正常位点的扩增反应体系溶液;每个待测样品重复检测2次;所述引物组261由以下引物组成:上游引物261
‑
mut:ggaaggatgtcctcgtggca(序列表的序列6);上游引物261
‑
nor:ggaaggatgtcctcgtggcg(序列表的序列7);下游引物261:cttgatggcaaacacagttaac(序列表的序列8);所述引物组467由以下引物组成:上游引物467
‑
mut:tatgtcttcaccgaccagtt(序列表的序列9);下游引物467:cgctcgcagaagtcactgat(序列表的序列10);所述引物组803由以下引物组成:上游引物803:ctccgctgttcggcaccctg(序列表的序列11);下游引物803
‑
mut:ccgaccccccgaagaaag(序列表的序列12);下游引物803
‑
nor:ccgaccccccgaagaaac(序列表的序列13);所述2
×
probe pcr master mix试剂是由qiagen 公司生产的 quantinova
tm probe pcr kit 的 2
×
probe pcr master mix;每个扩增反应体系溶液中待测样品中dna的起始定量浓度为20ng/
µ
l;用于检测261突变位点的扩增反应体系溶液的体积为20μl,其具体由以下体积的组分组成:2
×
probe pcr master mix试剂10μl、检测模板2.5μl、上游引物261
‑
mut和下游引物261的体积各为1.0μl、探针261的体积为0.5μl,余量为灭菌双蒸水;接着将所得到的扩增反应体系溶液在荧光定量pcr仪中依次进行如下扩增反应程序:95℃预变性2min,扩增循环参数为95℃变性5s,60℃ 30s,共40个循环;用于检测261正常位点的扩增反应体系溶液的体积为20μl,其具体由以下体积的组分组成:2
×
probe pcr master mix试剂10μl、检测模板2.5μl、上游引物261
‑
nor和下游引物261的体积各为1.0μl、探针261的体积为0.5μl,余量为灭菌双蒸水;接着将所得到的扩增反应体系溶液在荧光定量pcr仪中依次进行如下扩增反应程序:95℃预变性2min,扩增循环参数为95℃变性5s,60℃ 30s,共40个循环;用于检测467突变位点的扩增反应体系溶液的体积为20μl,其具体由以下体积的组分组成:2
×
probe pcr master mix试剂10μl、检测模板2.5μl、上游引物467
‑
mut和下游引物467的体积各为1.0μl、探针467的体积为0.5μl,余量为灭菌双蒸水;接着将所得到的扩增反应体系溶液在荧光定量pcr仪中依次进行如下扩增反应程序:95℃预变性2min,扩增循环参数为95℃变性5s,60℃ 30s,共40个循环;用于检测803突变位点的扩增反应体系溶液的体积为20μl,其具体由以下体积的
组分组成:2
×
probe pcr master mix试剂10μl、检测模板2.5μl、上游引物803和下游引物803
‑
mut的体积各为1.0μl、探针803的体积为0.5μl,余量为灭菌双蒸水;接着将所得到的扩增反应体系溶液在荧光定量pcr仪中依次进行如下扩增反应程序:95℃预变性2min,扩增循环参数为95℃变性5s,60℃ 30s,共40个循环;用于检测803正常位点的扩增反应体系溶液的体积为20μl,其具体由以下体积的组分组成:2
×
probe pcr master mix试剂10μl、检测模板2.5μl、上游引物803和下游引物803
‑
nor的体积各为1.0μl、探针803的体积为0.5μl,余量为灭菌双蒸水;接着将所得到的扩增反应体系溶液在荧光定量pcr仪中依次进行如下扩增反应程序:95℃预变性2min,扩增循环参数为95℃变性5s,60℃ 30s,共40个循环;(5)结果检测:通过荧光定量pcr仪自带软件绘制扩增曲线并读取相应的ct值并进行结果判定。
9.检测待测样本时,以位点阴性模板作为阴性对照,待测样品的ct值不大于阴性对照ct值即为阳性,将所得到的ct值带入对应位点的回归曲线得到阳性扩增的dna量,再将其除以起始dna的量(50ng),得到阳性dna占总dna的比例,即含有位点阳性dna的嵌合体比例。
10.进一步的,步骤(1)中,所述白蛋白基因组dna的od260/od280比值为1.8~1.9。
11.进一步的,步骤(1)中,每个浓度梯度的dna模板均重复测定2次。
12.本发明方法与现有技术相比较具有以下有益效果:本发明针对abo双倍体基因型相关的3个核酸多态性位点,设计适合用于上述位点检测的三种特异性taqman水解探针,同时结合专门设计的引物组,通过优化扩增反应条件,获得一套完整的用于abo嵌合体的taqman水解探针实时荧光定量pcr检测方法,其具有特异性强、敏感性高、重复性好等优点,能够用于基因组dna或外周血网织红细胞mrna 的abo 嵌合体检测。
13.通过试验分析,采用本发明所述方法,检测261 突变位点时,基因组水平的abo嵌合体比例的线性检测范围下限可以低至10
‑4;检测261 正常位点时,基因组水平的abo嵌合体比例的线性检测范围下限可以低至10
‑2;检测467 突变位点时,基因组水平的abo嵌合体比例的线性检测范围下限可以低至5
‰
;检测803 突变位点时,基因组水平的abo嵌合体比例的线性检测范围下限可以低至10
‑5;检测803 正常位点时,基因组水平的abo嵌合体比例的线性检测范围下限可以低至10
‑2。abo 嵌合体检测方法的特异性、灵敏性和线性检测范围的提高,将有助于 abo 嵌合体分析在应用方面的拓展,比如在 abo 不合造血干细胞的嵌合体分析领域可以更加适于进行异基因干细胞移植后的abo微嵌合体分析甚至是微小残留病(mrd)的早期判定,也有助于更早期且精准的研究移植后供受者造血的转变评估。另外,可以应用在母婴 abo 血型不合新生儿及胎儿溶血病(abo
‑
hdfn)中产前无创诊断领域,当母婴abo血型不合的妊娠会天然存在另一种生理形式的abo嵌合体,通过实现早期且精准的检测母体血浆dna背景中的胎儿不同血型基因的dna片段即基因水平的abo嵌合体分析,可以直接确定妊娠期的母婴abo血型是否存在不合,从而有助于早期且直接评估abo
‑
hdfn发病风险及制定更加科学合理的妊娠监管策略。
附图说明
14.图1是实施例1中所述白蛋白基因组dna的扩增曲线图,其中图a~g依次表示dna模
板中dna的起始量为:200ng、100ng、50ng、25ng、12.5ng、6.25ng、3.125ng。
15.图2是实施例1中所述白蛋白基因组dna的熔解曲线图,其中图a~g依次表示dna模板中dna的起始量为:200ng、100ng、50ng、25ng、12.5ng、6.25ng、3.125ng。
16.图3是实施例1中所述白蛋白基因组dna的标准回归曲线图。
17.图4是实施例2中所得到的扩增曲线图,其中a~g依次表示阳性模板、10倍稀释液、100倍稀释液、1000倍稀释液、10000倍稀释液、100000倍稀释液和阴性模板的扩增曲线。
18.图5是实施例2中所得到的回归曲线图。
19.图6是实施例3中所得到的扩增曲线图,其中a~g依次表示阳性模板、10倍稀释液、100倍稀释液、1000倍稀释液、10000倍稀释液、100000倍稀释液和阴性模板的扩增曲线。
20.图7是实施例3中所得到的回归曲线图。
21.图8是实施例4中所得到的扩增曲线图,其中a~g依次表示阳性模板、10倍稀释液、100倍稀释液、1000倍稀释液、10000倍稀释液、100000倍稀释液和阴性模板的扩增曲线。
22.图9是实施例4中所得到的回归曲线图。
23.图10是实施例5中所得到的扩增曲线图,其中a~f依次表示阳性模板、10倍稀释液、100倍稀释液、1000倍稀释液、10000倍稀释液和100000倍稀释液的扩增曲线。
24.图11是实施例5中所得到的回归曲线图。
25.图12是实施例6中所得到的扩增曲线图,其中a~g依次表示阳性模板、10倍稀释液、100倍稀释液、1000倍稀释液、10000倍稀释液、100000倍稀释液和阴性模板的扩增曲线。
26.图13是实施例6中所得到的回归曲线图。
具体实施方式
27.以下通过实施例进一步说明本发明,但不作为对本发明的限制。下列实施例中未注明的具体实验条件和方法,所采用的技术手段通常为本领域技术人员所熟知的常规手段。
28.实施例1:一种用于基因水平abo嵌合体的taqman 水解探针,包括三种taqman水解探针,它们分别为:探针261:fam
‑
tcaacatcgacatcctcaacgagca
‑
bhq(序列表的序列1);探针467:fam
‑
cgcggtgccccgcgtga
‑
bhq(序列表的序列2);探针803:fam
‑
gggatgtaggcctgggactggggccggc
‑
bhq(序列表的序列3)。
29.一种用于基因水平abo嵌合体的检测方法,具体包括以下步骤:(1)内参白蛋白基因标准曲线的建立:取一份高质量的基因组dna作为标准品,所述基因组dna的od260/od280比值为1.8~1.9,用分光光度计重复测定基因组dna的浓度8次,然后计算得到基因组dna的浓度平均值, 再使用te缓冲液进行稀释并调整得到浓度为100ng/
µ
l的dna溶液,接着使用te缓冲液对所述dna溶液进行倍比梯度稀释,得到浓度依次为50ng/
µ
l、25ng/
µ
l、12.5ng/
µ
l、6.25ng/
µ
l、3.125ng/
µ
l、1.5625ng/
µ
l的稀释液;将各个稀释浓度的基因组dna溶液分别作为dna模板进行白蛋白内参基因pcr扩增反应,所述白蛋白内参基因pcr扩增反应的体系总体积为20
µ
l,其具体包括2
×
hieff
tm qpcr green master mix试剂盒的反应mix液10
µ
l、dna模板2.0
µ
l、白蛋白上游引物0.8
µ
l、白蛋白
下游引物0.8
µ
l,余量为无菌双蒸水;所述白蛋白上游引物和白蛋白下游引物的浓度均为10
µ
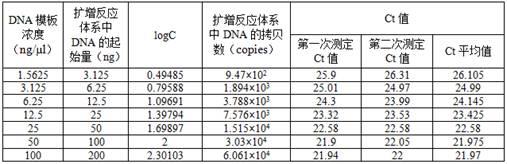
m;所述白蛋白上游引物为tgttgcatgagaaaacgcca(序列表的序列4);所述白蛋白下游引物为gtcgcctgttcaccaaggat(序列表的序列5);所述内参基因pcr扩增反应的程序参数为:s1.95℃预变性 5min;s2.扩增循环参数:95℃ 10s,60℃ 30s,75℃ 1s,共40个循环;s3.熔解曲线分析参数:95℃ 15s,60℃ 60s,95℃ 15s,检测范围60℃~95℃,温度变化率为0.1℃/s;每个浓度梯度的dna模板均重复测定2次,具体测定结果见表1,根据测定结果绘制白蛋白基因组dna的扩增曲线(参见图1)、熔解曲线(参见图2)和标准回归曲线(参见图3),绘制回归曲线时纳入dna模板量为3.125~200ng的检测点,回归曲线的方程为:y =
‑
0.3655x 9.9714,r
2 =0.9921;表1内参白蛋白dna模板测定结果根据上述测定结果,线性范围为:3.125~100ng。将每次检测的dna模板起始量定量为20ng/μl,该值处于线性范围的中部;(2)取待测血样进行dna的提取,具体是先取血样2ml于edta抗凝管中得到edta抗凝血,然后取edta抗凝血100μl于ep管中,接着加人100 μlnai,涡旋振荡2~3 min,接着加入200 μl抽提剂抽提3 min,再在13000 r/min的条件下离心5 min,取上清液至新的ep管中,再加入200 μl异丙醇摇匀,然后在13000 r/min的条件下离心5 min,接着弃上清液,加入1ml体积浓度为70%的乙醇,在13000 r/min的条件下离心5 min,再弃上清液得到沉淀,然后将沉淀干燥后再加入20μl的灭菌双蒸水溶解得到待测dna;所述抽提剂是氯仿和异戊醇按照体积比24:1的比例均匀混合得到的;(3)取5μl待测dna用灭菌双蒸水稀释至1.0 ml得到待测样品,测定待测样品在260nm、280nm和310nm处的吸光度od值,计算每个待测样品的浓度,将待测样品作为dna模板,按照步骤(1)中所述的白蛋白内参基因pcr扩增反应进行扩增,根据所得到的扩增曲线和步骤(1)中得到的标准回归曲线分析计算得到待测样品的浓度,以此对待测样品的浓度进行校正,然后调节待测样品中dna的浓度至20ng/μl;(4)pcr扩增反应:将步骤(2)中得到的待测样品分别作为检测模板进行pcr扩增反应,先将引物组261、引物组467、引物组803和三个水解taqman探针分别用双蒸水稀释成10pmol/μl的溶液,然后与检测模板、2
×
probe pcr master mix试剂和灭菌双蒸水混合得到用于检测261突变位点、261正常位点、467突变位点、803突变位点、803正常位点的扩增反
应体系溶液;每个待测样品重复检测2次;所述引物组261由以下引物组成:上游引物261
‑
mut:ggaaggatgtcctcgtggca(序列表的序列6);上游引物261
‑
nor:ggaaggatgtcctcgtggcg(序列表的序列7);下游引物261:cttgatggcaaacacagttaac(序列表的序列8);所述引物组467由以下引物组成:上游引物467
‑
mut:tatgtcttcaccgaccagtt(序列表的序列9);下游引物467:cgctcgcagaagtcactgat(序列表的序列10);所述引物组803由以下引物组成:上游引物803:ctccgctgttcggcaccctg(序列表的序列11);下游引物803
‑
mut:ccgaccccccgaagaaag(序列表的序列12);下游引物803
‑
nor:ccgaccccccgaagaaac(序列表的序列13);所述2
×
probe pcr master mix试剂是由qiagen 公司生产的 quantinova
tm probe pcr kit 的 2
×
probe pcr master mix;每个扩增反应体系溶液中待测样品中dna的起始定量浓度为20ng/
µ
l;用于检测261突变位点的扩增反应体系溶液的体积为20μl,其具体由以下体积的组分组成:2
×
probe pcr master mix试剂10μl、检测模板2.5μl、上游引物261
‑
mut和下游引物261的体积各为1.0μl、探针261的体积为0.5μl,余量为灭菌双蒸水;接着将所得到的扩增反应体系溶液在荧光定量pcr仪中依次进行如下扩增反应程序:95℃预变性2min,扩增循环参数为95℃变性5s,60℃ 30s,共40个循环;用于检测261正常位点的扩增反应体系溶液的体积为20μl,其具体由以下体积的组分组成:2
×
probe pcr master mix试剂10μl、检测模板2.5μl、上游引物261
‑
nor和下游引物261的体积各为1.0μl、探针261的体积为0.5μl,余量为灭菌双蒸水;接着将所得到的扩增反应体系溶液在荧光定量pcr仪中依次进行如下扩增反应程序:95℃预变性2min,扩增循环参数为95℃变性5s,60℃ 30s,共40个循环;用于检测467突变位点的扩增反应体系溶液的体积为20μl,其具体由以下体积的组分组成:2
×
probe pcr master mix试剂10μl、检测模板2.5μl、上游引物467
‑
mut和下游引物467的体积各为1.0μl、探针467的体积为0.5μl,余量为灭菌双蒸水;接着将所得到的扩增反应体系溶液在荧光定量pcr仪中依次进行如下扩增反应程序:95℃预变性2min,扩增循环参数为95℃变性5s,60℃ 30s,共40个循环;用于检测803突变位点的扩增反应体系溶液的体积为20μl,其具体由以下体积的组分组成:2
×
probe pcr master mix试剂10μl、检测模板2.5μl、上游引物803和下游引物803
‑
mut的体积各为1.0μl、探针803的体积为0.5μl,余量为灭菌双蒸水;接着将所得到的扩增反应体系溶液在荧光定量pcr仪中依次进行如下扩增反应程序:95℃预变性2min,扩增循环参数为95℃变性5s,60℃ 30s,共40个循环;用于检测803正常位点的扩增反应体系溶液的体积为20μl,其具体由以下体积的组分组成:2
×
probe pcr master mix试剂10μl、检测模板2.5μl、上游引物803和下游引物803
‑
nor的体积各为1.0μl、探针803的体积为0.5μl,余量为灭菌双蒸水;接着将所得到的扩增反应体系溶液在荧光定量pcr仪中依次进行如下扩增反应程序:95℃预变性2min,扩增循
环参数为95℃变性5s,60℃ 30s,共40个循环;(5)结果检测:通过荧光定量pcr仪自带软件绘制扩增曲线并读取相应的ct值并进行结果判定。
30.检测待测样本时,以位点阴性模板作为阴性对照,待测样品的ct值不大于阴性对照ct值即为阳性,将所得到的ct值带入对应位点的回归曲线得到阳性扩增的dna量,再将其除以起始dna的量(50ng),得到阳性dna占总dna的比例,即含有位点阳性dna的嵌合体比例。
31.实施例2:探针261用于检测261突变位点的标准回归曲线绘制:选取261 突变纯合子配制浓度为20ng/
µ
l作为阳性模板(即表示嵌合体),选取261正常纯合子配制浓度为20ng/
µ
l作为阴性模板,然后将阳性模板和阴性模板按不同比例混合配制不同浓度的阳性模板稀释溶液,具体稀释方式见表2。
32.表2 阳性模板和阴性模板的配比将阳性模板、阴性模板和上述稀释液作为检测模板分别按照按照实施例1中所述用于检测261突变位点的扩增反应体系溶液和扩增反应程序进行扩增,每个浓度梯度的dna模板重复测定2次,所得到的扩增曲线参见图4,ct值见表3。
33.表3 不同浓度梯度所检测得到的ct值将10
‑4稀释比例纳入线性回归可得的回归方程为:y =0.365x 11.19,r2=0.976,回归曲线图见图5,通过回归分析可知:添加了探针261的扩增体系其线性范围可到达10
‑4,本发明提高了检测方法的线性检测范围。
34.实施例3:探针261用于检测261正常位点的标准回归曲线绘制:
选取261 正常纯合子配制浓度为20ng/
µ
l作为阳性模板(即表示嵌合体),选取261突变纯合子配制浓度为20ng/
µ
l作为阴性模板,然后将阳性模板和阴性模板按不同比例混合配制不同浓度的阳性模板稀释溶液,具体稀释方式见表4。
35.表4 阳性模板和阴性模板的配比将阳性模板、阴性模板和上述稀释液作为检测模板分别按照按照实施例1中所述用于检测261正常位点的扩增反应体系溶液和扩增反应程序进行扩增,每个浓度梯度的dna模板重复测定2次,所得到的扩增曲线参见图6,ct值见表5。
36.表5 不同浓度梯度所检测得到的ct值将10
‑2稀释比例纳入线性回归可得的回归方程为:y =0.4046x 12.825,r2=0.9912,回归曲线图见图7,通过回归分析可知:添加了探针261的扩增体系其线性范围可到达10
‑2,本发明提高了检测方法的线性检测范围。
37.实施例4:探针467用于检测467突变位点的标准回归曲线绘制:选取467 突变杂合子配制浓度为20ng/
µ
l作为阳性模板(即表示嵌合体),选取467正常纯合子配制浓度为20ng/
µ
l作为阴性模板,然后将阳性模板和阴性模板按不同比例混合配制不同浓度的阳性模板稀释溶液,具体稀释方式见表6。
38.表6 阳性模板和阴性模板的配比
将阳性模板、阴性模板和上述稀释液作为检测模板分别按照按照实施例1中所述用于检测467突变位点的扩增反应体系溶液和扩增反应程序进行扩增,每个浓度梯度的dna模板重复测定2次,所得到的扩增曲线参见图8,ct值见表7。
39.表7 不同浓度梯度所检测得到的ct值将10
‑2稀释比例纳入线性回归可得的回归方程为:y =0.5489x 15.445,r2=0.9701,回归曲线图见图9,通过回归分析可知:添加了探针467的扩增体系其线性范围可到达10
‑2,而且以467突变杂合子进行试验,换算成实际的467突变阳性模板占比为5
‰
,本发明提高了检测方法的线性检测范围。
40.实施例5:探针803用于检测803突变位点的标准回归曲线绘制:选取803突变纯合子配制浓度为20ng/
µ
l作为阳性模板(即表示嵌合体),选取803正常纯合子配制浓度为20ng/
µ
l作为阴性模板,然后将阳性模板和阴性模板按不同比例混合配制不同浓度的阳性模板稀释溶液,具体稀释方式见表8。
41.表8 阳性模板和阴性模板的配比
将阳性模板、阴性模板和上述稀释液作为检测模板分别按照按照实施例1中所述用于检测803突变位点的扩增反应体系溶液和扩增反应程序进行扩增,每个浓度梯度的dna模板重复测定2次,所得到的扩增曲线参见图10,其中阴性模板扩增40个循环后未见扩增曲线出图,ct值见表9。
42.表9 不同浓度梯度所检测得到的ct值将10
‑5稀释比例纳入线性回归可得的回归方程为:y =
‑
0.443x 9.8965,r2=0.9968,回归曲线图见图11,通过回归分析可知:添加了探针803的扩增体系其线性范围可到达10
‑5,本发明提高了检测方法的线性检测范围。
43.实施例6:探针803用于检测803正常位点的标准回归曲线绘制:选取803正常纯合子配制浓度为20ng/
µ
l作为阳性模板(即表示嵌合体),选取803突变纯合子配制浓度为20ng/
µ
l作为阴性模板,然后将阳性模板和阴性模板按不同比例混合配制不同浓度的阳性模板稀释溶液,具体稀释方式见表10。
44.表10 阳性模板和阴性模板的配比
将阳性模板、阴性模板和上述稀释液作为检测模板分别按照按照实施例1中所述用于检测803正常位点的扩增反应体系溶液和扩增反应程序进行扩增,每个浓度梯度的dna模板重复测定2次,所得到的扩增曲线参见图12,ct值见表11。
45.表11 不同浓度梯度所检测得到的ct值将10
‑2稀释比例纳入线性回归可得的回归方程为:y =0.3642x 10.74,r2=0.9869,回归曲线图见图13,通过回归分析可知:添加了探针803的扩增体系其线性范围可到达10
‑2,本发明提高了检测方法的线性检测范围。
46.此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。