多肽表达系统
1.本技术为2015年7月2日提交的,发明名称为“多肽表达系统”的pct申请pct/us2015/039086的分案申请,所述pct申请进入中国国家阶段的日期为2016年12月28日,申请号为201580035228.7。
2.序列表
3.本技术包含已经以ascii形式以电子方式提交的序列表,在此通过全文引用插入。所说的ascii副本是在2015年6月25日生成的,被命名为p05833
‑
wo_sl.txt并且大小为24,421个字节。
发明领域
4.本发明涉及用于模块化表达和生产多肽的多肽表达系统。
背景技术:
5.重组多肽有时是以用于功能性或纯化目的的单个结构域或标志物的融合体形式被表达的。传统上使用重组dna方法来连接编码每个模块的序列,对于每一种组合,需要不同的构建体。这给涉及由以不同组合加入的复现模块组成的大的蛋白质集合表达的技术提出了挑战,因为构建体的数目作为所用的模块数目的函数以几何方式增加。
6.尽管用于亚克隆的高通量系统能够平行地处理许许多多的插入片段,但是它们通常是资源密集的并且产生大量的构建体,在初始表征步骤以后,这些构建体最终不是必需的。因此,在关于发展允许模块化表达和生产重组多肽的多肽表达系统的领域,存在着未满足的需要。
7.发明概述
8.本发明涉及用于模块化表达和生产多肽的多肽表达系统。
9.在一个方面中,本发明的特征是包含第一核酸分子和第二核酸分子的多肽表达系统,其中(a)所述的第一核酸分子包括包含下列组件的第一表达盒:(i)第一真核启动子(p1
euk1
)、(ii)编码第一多肽的序列(pes11)、(iii)第一5’剪接位点(5’ss11)和(iv)杂交序列(hs1),其中所述的组件沿着5
’‑
至
‑3’
方向彼此有效连接成p1
euk1
‑
pes11‑5’
ss11‑
hs1;并且(b)所述的第二核酸分子包含下列组件:(i)真核启动子(p2
euk
)、(ii)能够与hs1杂交的杂交序列(hs2)、(iii)3’剪接位点(3’ss2)、(iv)编码多肽的序列(pes2)和(v)多聚腺苷酸化位点(pa2),其中所述的组件沿着5
’‑
至
‑3’
方向彼此有效连接成p2
euk
‑
hs2
‑3’
ss2
‑
pes2
‑
pa2。在一些实施方式中,所述的p1
euk1
是巨细胞病毒(cmv)启动子或猿猴病毒40(sv40)启动子。在一些实施方式中,所述的p1
euk1
是巨细胞病毒(cmv)启动子或猿猴病毒40(sv40)启动子。在一些实施方式中,所述的p2
euk
是cmv启动子或sv40启动子。在一些实施方式中,所述的第一表达盒进一步包含编码真核信号序列的第一核酸序列(ess11),其中所述的ess11位于所述的p1
euk1
和pes11之间。在一些实施方式中,所述的ess11源自于可变重链(vh)基因。
10.在一些实施方式中,所述的第一表达盒进一步包含包括下列组件的可切除的原核启动子模块(eppm1):(i)5’剪接位点(5’ss12)、(ii)原核启动子(p1
prok1
)和(iii)3’剪接位
点(3’ss11),其中所述的组件沿着5
’‑
至
‑3’
方向彼此有效连接成5’ss12‑
p1
prok1
‑3’
ss11,并且其中所述的eppm1位于所述的p1
euk1
和pes11之间。在一些实施方式中,所述的p1
prok1
选自由phoa启动子、tac启动子、lac和tphac启动子组成的组。在一些实施方式中,所述的eppm1进一步包含编码原核信号序列的第一核酸序列(pss11)。在一些实施方式中,所述的pss11源自于热稳定的肠毒素ii(stii)基因。在一些实施方式中,所述的多肽表达系统进一步包含位于所述的pss11和所述的3’ss11之间的多聚嘧啶束(ppt11)。在一些实施方式中,所述的ppt11包含ttccttttttctctttcc的核酸序列(seq id no:1)。在一些实施方式中,所述的pes11不包含隐蔽的5’剪接位点。在一些实施方式中,所述的hs1是编码外壳蛋白或接头蛋白的全部或一部分的基因。在一些实施方式中,所述的外壳蛋白选自由噬菌体m13、f1或fd的pi、pii、piii、piv、pv、pvi、pvii、pviii、pix和px组成的组。在一些实施方式中,所述的外壳蛋白是噬菌体m13的piii蛋白。在一些实施方式中,所述的piii片段包括所述的piii蛋白的氨基酸残基267
‑
421或所述的piii蛋白的氨基酸残基262
‑
418。在一些实施方式中,所述的接头蛋白是亮氨酸拉链。在一些实施方式中,所述的亮氨酸拉链包含seq id no:4或5的氨基酸序列。
11.在一些实施方式中,所述的第一核酸分子进一步包含第二表达盒,其包含第二真核启动子(p1
euk2
)、(ii)编码第二多肽的序列(pes12)和(iii)多聚腺苷酸化位点(pa1),其中所述的组件沿着5
’‑
至
‑3’
方向彼此有效连接成p1
euk2
‑
pes12‑
pa1。在一些实施方式中,所述的p1
euk2
是cmv启动子或sv40启动子。在一些实施方式中,所述的第二表达盒进一步包含编码真核信号序列的第二核酸序列(ess12)。在一些实施方式中,所述的ess12源自于鼠的结合免疫球蛋白的蛋白(mbip)基因。在一些实施方式中,所述的ess12包含atg aan ttn acn gtn gtn gcn gcn gcn ctn ctn ctn ctn ggn的核酸序列,其中n是a、t、c或g(seq id no:6)。
12.在一些实施方式中,所述的第二表达盒进一步包含可切除的原核启动子模块(eppm2),其包括下列组件:(i)5’剪接位点(5’ss13)、(ii)原核启动子(p1
prok2
)和(iii)3’剪接位点(3’ss12),其中所述的组件沿着5
’‑
至
‑3’
方向彼此有效连接成5’ss13‑
p1
prok2
‑3’
ss12,并且其中所述的eppm2位于所述的p1
euk2
和pes12之间。在一些实施方式中,所述的p1
prok2
选自由phoa启动子、tac启动子和lac启动子组成的组。在一些实施方式中,所述的eppm2进一步包含编码原核信号序列的核酸序列(pss12)。在一些实施方式中,所述的pss12源自于热稳定的肠毒素ii(stii)基因。在一些实施方式中,所述的多肽表达系统进一步包含位于所述的pss12和3’ss12之间的多聚嘧啶束(ppt12)。在一些实施方式中,所述的ppt12包含ttccttttttctctttcc的核酸序列(seq id no:1)。在一些实施方式中,所述的第二表达盒位于所述的第一表达盒的5’端。在一些实施方式中,所述的多肽表达系统进一步包含位于所述的5’ss11和hs1之间的内含子剪接增强子(ise)(ise1)。在一些实施方式中,所述的ise1包括包含三个或更多个连续的鸟嘌呤残基的g
‑
片段。在一些实施方式中,所述的ise1包括包含九个连续的鸟嘌呤残基的g
‑
片段。在一些实施方式中,所述的多肽表达系统进一步包含位于所述的hs2和3’ss2之间的多聚嘧啶束(ppt2)。在一些实施方式中,所述的ppt2包含ttcctctttccctttctctcc的核酸序列(seq id no:7)。在一些实施方式中,所述的多肽表达系统进一步包含位于所述的hs2和3’ss2之间的ise(ise2)。在一些实施方式中,所述的ise2包括包含三个或更多个连续的鸟嘌呤残基的g
‑
片段。在一些实施方式中,所述的ise2
包括包含九个连续的鸟嘌呤残基的g
‑
片段。在一些实施方式中,所述的5’ss11包含gtaaga的核酸序列(seq id no:8)。
13.在一些实施方式中,经由真核启动子的表达发生在哺乳动物细胞中。在一些实施方式中,所述的哺乳动物细胞是expi293f细胞、cho细胞、293t细胞或nso细胞。在一些实施方式中,所述的哺乳动物细胞是expi293f细胞。在一些实施方式中,经由原核启动子的表达发生在细菌细胞中。在一些实施方式中,所述的细菌细胞是大肠杆菌细胞。在一些实施方式中,所述的pes11编码全部或一部分抗体。在一些实施方式中,所述的pes11编码包含vh结构域的多肽。在一些实施方式中,所述的多肽进一步包含ch1结构域。在一些实施方式中,所述的pes2编码全部或一部分抗体。在一些实施方式中,所述的pes2编码包含ch2结构域和ch3结构域的多肽。在一些实施方式中,所述的pes12编码全部或一部分抗体。在一些实施方式中,所述的pes12编码包含vl结构域和cl结构域的多肽。
14.在另一个方面中,本发明的特征是包含第一表达盒的核酸分子,其包括下列组件:(a)第一真核启动子(p1
euk1
);(b)第一可切除的原核启动子模块(eppm1),其包括下列组件:(i)5’剪接位点(5’ss12);(ii)原核启动子(p1
prok1
);和(iii)3’剪接位点(3’ss11),其中所述的eppm1的组件沿着5
’‑
至
‑3’
方向彼此有效连接成5’ss12‑
p1
prok1
‑3’
ss11;(c)编码第一多肽的序列(pes11);(d)第一5’剪接位点(5’ss11);和(e)编码实用肽的序列(upes),其中所述的第一表达盒的组件沿着5
’‑
至
‑3’
方向彼此有效连接成p1
euk1
‑
eppm1‑
pes11‑5’
ss11‑
upes。在一些实施方式中,所述的第一表达盒进一步包含编码真核信号序列的第一核酸序列(ess11),其中所述的ess11位于所述的p1
euk1
和eppm1之间。在一些实施方式中,所述的eppm1进一步包含编码原核信号序列的第一核酸序列(pss11),其中所述的pss11位于所述的p1
prok1
和3’ss11之间。在一些实施方式中,所述的核酸分子进一步包含第二表达盒,其包括第二真核启动子(p1
euk2
)、(ii)编码第二多肽的序列(pes12)和(iii)多聚腺苷酸化位点(pa1),其中所述的组件沿着5
’‑
至
‑3’
方向彼此有效连接成p1
euk2
‑
pes12‑
pa1。在一些实施方式中,所述的第二表达盒进一步包括编码真核信号序列的第二核酸序列(ess12),其中所述的ess12位于所述的p1
prok2
和3’ss12之间。在一些实施方式中,所述的第二表达盒进一步包括可切除的原核启动子模块(eppm2),其包括下列组件:(i)5’剪接位点(5’ss13)、(ii)原核启动子(p1
prok2
)、(iii)编码原核信号序列的核酸序列(pss12)和(iv)3’剪接位点(3’ss12),其中所述的组件沿着5
’‑
至
‑3’
方向彼此有效连接成5’ss13‑
p1
prok2
‑
pss12‑3’
ss12,并且其中所述的eppm2位于所述的p1
euk2
和pes12之间。在一些实施方式中,所述的upes编码选自由标签、标记物、外壳蛋白和接头蛋白组成的组的全部或一部分实用肽。在一些实施方式中,所述的外壳蛋白选自由噬菌体m13、f1或fd的pi、pii、piii、piv、pv、pvi、pvii、pviii、pix和px组成的组。在一些实施方式中,所述的外壳蛋白是噬菌体m13的piii。
15.在一个方面中,本发明的特征是包含任意一种前面所述的核酸分子的载体。在一个方面中,本发明的特征是包含第一载体和第二载体的载体组,其中所述的第一和第二载体分别包含本文中公开的任意一种多肽表达系统的第一和第二核酸分子。
16.在另一个方面中,本发明的特征是包含前面所述的核酸、载体和/或载体组的宿主细胞。在一些实施方式中,所述的宿主细胞是原核细胞。在一些实施方式中,所述的原核细胞是细菌细胞。在一些实施方式中,所述的细菌细胞是大肠杆菌细胞。在其它实施方式中,所述的宿主细胞是真核细胞。在一些实施方式中,所述的真核细胞是哺乳动物细胞。在一些
实施方式中,所述的哺乳动物细胞是expi293f细胞、cho细胞、293t细胞或nso细胞。在一种实施方式中,所述的哺乳动物细胞是expi293f细胞。
17.在进一步方面中,本发明的特征是用于生产多肽的方法,其包括在培养基中培养包含一种或更多种前面所述的核酸、载体和/或载体组的宿主细胞。在一些实施方式中,所述的方法进一步包括从所述的宿主细胞或所述的培养基中回收所述的多肽。
18.附图简述
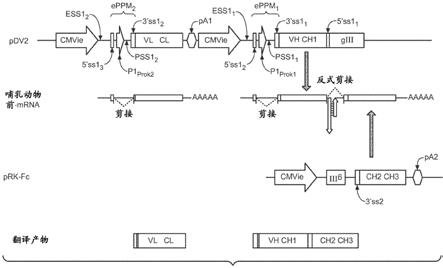
19.图1是显示用于模块化蛋白质表达的多肽表达系统的pdv2和prk
‑
fc核酸分子的相对组织的示意图。该图也显示在真核细胞中在所述的核酸分子转录以后总的前mrna产物、预期的在两种产生的前mrna产物之间的反式剪接事件和在翻译剪接的mrna分子以后的最终产品。
20.图2包括图2a和2b,是所述的pdv2载体的部分序列图。5’ss、3’ss和多聚嘧啶束(ppt)是粗体的并且带下划线的。编码杂交到来源于prk
‑
fc和prk
‑
fc2的转录物的所述150
‑
nt基因iii序列的区是图2b中斜体的并且带下划线的。来自野生型ppt的突变是粗体的、斜体的并且带下划线的。在所述的pdv2载体中在基因iii中aataaa潜在的多聚腺苷酸化位点显示在被引入变体pdv2载体pdv2c和pdc2d中的沉默突变的序列上方(粗体的、斜体的并且带下划线的)。图2a和2b按照出现的顺序,分别公开了seq id no:2、3、9、10和19
‑
22。
21.图3是所述的prk
‑
fc载体的部分序列图。分支点共有序列(bp)、多聚嘧啶束和3’ss是粗体的或粗体的并且带下划线的并且被表示在图3中。所述的150
‑
bp反义基因iii序列是斜体的并且带下划线的。在所述的cmv启动子之后的第一框内atg密码子是粗体的、斜体的并且带下划线的。图3按照出现的顺序,分别公开了seq id no:23和24。
22.图4a是显示在pdv2中的基因iii中添加ise序列或除去潜在的多聚腺苷酸化基序以及补充prk
‑
fc和prk
‑
fc2载体对expi293f细胞中igg表达水平(以μg/ml表示)的效果的图。
23.图4b是显示pdv2c和prk
‑
fc2的质粒比率对于expi293f细胞中igg表达水平(以μg/ml表示)的影响的图。所示的值是以一式三份所做的两个独立实验的代表性实验的平均值和平均值的标准差。
24.图5包括图5a和5b,是所述的pdv2b载体的部分序列图。指示了所述的5’ss和3’ss并且所述的序列是粗体的。指示了所述的多聚嘧啶束(ppt)和9
‑
nt g
‑
片段ise,并且其分别是粗体的和高亮显示的。在图5b中,杂交到来源于prk
‑
fc和prk
‑
fc2的转录物上的编码所述的150
‑
nt基因iii序列的区是斜体的。来自野生型stii信号序列和m13基因iii的突变是粗体的并且是斜体的,同时野生型核苷酸残基显示在所述序列的上面。在所述序列的上面显示潜在的aataaa多聚腺苷酸化位点基序。在括号中的氨基酸是既由大肠杆菌也由通过在哺乳动物细胞中剪接而生成的密码子编码的。在所述序列的上面显示用于可变区序列克隆的信号序列的3’端中的bsiwi和rsrii限制性位点。图5a和5b按照出现的顺序,分别公开了seq id no:2、25、9、10、19、20、26和27。
25.图6是所述的prk
‑
fc2载体的部分序列图。分支点共有序列(bp)、多聚嘧啶束和3’ss是粗体的。所述的9
‑
nt g
‑
片段ise是高亮显示的。所述的150
‑
bp反义基因iii序列是斜体的。所述的第一atg三联体和框内终止密码子是带下划线的。在所述的cmv启动子之后的第一框内atg密码子是粗体并且斜体的。指示所述的cmv启动子tata盒和转录起始位点在所述
序列的上面。在括号中的谷氨酸残基是被通过在哺乳动物细胞中反式剪接而生成的密码子编码的。图6按照出现的顺序,分别公开了seq id no:28和29。
26.图7a是显示来自纯化的在expi293f细胞中表达的igg的重链(左组)和轻链(右组)的质谱分析的去卷积质量的一组图。
27.图7b是显示图7a中重链和轻链两者的预期质量和观测质量的表。
28.图8a是显示从被所述的pdv2d(在基因iii中包含ise并且不包含aataaa基序)和所述的prk
‑
fc2载体共转染的expi293f细胞培养物的上清液(30ml)中纯化的具有5种不同特异性的igg分子的产率(以mg表示)的图。误差线显示平均值的标准差。
29.图8b是显示从被所述的pdv2d(在基因iii中包含ise并且不包含aataaa基序)和所述的prk
‑
fc2载体共转染的293t和cho细胞培养物的上清液(30ml)中纯化的具有5种不同特异性的igg分子的产率(以mg表示)的图。n=4。误差线显示平均值的标准差。
30.图9是prk
‑
fab
‑
flag载体的部分序列图,显示在所述的cmv启动子tata盒和与所述的flag标记序列融合的人igg1上绞链区之间的区域。在所述的铰链和flag标记序列的后面是sv40多聚腺苷酸化信号(没有显示)。指示了包括所述的多聚嘧啶束和共有分支点(bp)的所述的3’ss,并且其是粗体的或粗体并且带下划线的。指示了所述的ise序列,并且其是粗体的、带下划线的和斜体的。介导与供体转录物的杂交的反义基因iii序列是斜体的并且带下划线的。图9按照出现的顺序,分别公开了seq id no:30和31。
31.图10是示意图,显示了关于多肽产物的总的模块化表达的可能的第一和第二核酸分子的相对组织。该图也显示在真核细胞中在所述的核酸分子转录以后总的前mrna产物、预期的在两种产生的前mrna产物之间的反式剪接事件和在翻译所述剪接的mrna分子以后的最终产品。
32.图11是示意图,显示了关于多于一种多肽产物的总的模块化表达的可能的第一和第二核酸分子的相对组织。该图也显示在真核细胞中在所述的核酸分子转录以后总的前mrna产物、预期的在两种产生的前mrna产物之间的反式剪接事件和在翻译所述剪接的mrna以后的最终产品。.
33.图12是显示在用pdv2变体和prk
‑
fc2共转染的expi293f细胞中mab1重链和fd
‑
cp3融合蛋白表达的一组蛋白质印迹。采用二硫苏糖醇(dtt)还原转染的expi293f裂解液并且采用抗igg1 fc(顶部图)或抗m13p3(底部图)抗体通过蛋白质印迹进行分析。gfp和hc对照载体分别表达绿色荧光蛋白和人igg1重链。hc指示全长人igg1重链。基因iii aataaa指示潜在的多聚腺苷酸化位点存在于基因iii中。fc*指示推测的细胞质的n
‑
末端截短的fc片段表达产物。na是不适用的。
34.图13是十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds
‑
page)凝胶,其显示对纯化的在expi293f细胞中表达的igg和fab片段的分析。把从被pdv2d和prk
‑
fc2(igg)或prk
‑
fab
‑
f(fab片段)共转染的expi293f细胞上清液的表达的纯化的igg和fab纯化,在还原或非还原条件下通过4
‑
20%梯度sds
‑
page分离并且采用考马斯亮蓝染色。在右边显示了带的身份。hc是重链。lc是轻链。fd是重链fd片段(vh ch1 上铰链)。hc和lc(非还原的)带是在igg样品中未能形成链间二硫键但是可能具有链内二硫键的重链和轻链。在非还原的fab样品中大约25
‑
kda的带具有不形成链间二硫键但是可能具有链内二硫键的共迁移的重和轻链。
35.图14是显示通过噬菌体酶连接的免疫吸附测定(elisa)检测的fab片段展示在具
有噬粒pdv2的噬菌体上的图。fab拉链噬菌体是通过采用m13ko7辅助噬菌体感染含有pfab拉链噬菌粒的大肠杆菌细胞而产生的。所述的pdv2噬菌体是通过采用amber
‑
2614 ko7噬菌体感染含有pdv2d载体的大肠杆菌细胞而产生的。
36.本发明的实施方式的详细描述
37.i.定义
38.在本文中术语“抗体”以最广泛的意义被使用并且包括不同的抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如双特异性抗体)以及抗体片段,只要它们展示所要的抗原结合活性。
39.当提及可变结构域中的残基(大约轻链的残基1
‑
107以及重链的残基1
‑
113)时,一般使用kabat编号系统(例如kabat等人,sequences of immunological interest.第五版,public health service,national institutes of health,bethesda,md.(1991))。当提及免疫球蛋白重链恒定区中的残基时,一般使用“eu编号系统”或“eu索引”(例如在kabat等人的上文中报告的eu索引)。“如在kabat中的eu索引”是指人igg1 eu抗体的残基编号。在本文中除非另有说明,提及在抗体的可变结构域中的残基序号意指根据kabat编号系统的残基编号。在本文中除非另有说明,在抗体的重链恒定结构域中,提及残基序号意指根据eu编号系统的残基编号。
40.天然存在的基本的4
‑
链抗体单元是由两个相同的轻链(lc)和两个相同的重链(hc)组成的杂四聚体糖蛋白(igm抗体由5个基本的杂四聚体单元以及另外的被称为j链的多肽组成,因此包含10个抗原结合位点,而分泌的iga抗体能够聚合而形成包含2
‑
5个基本的4
‑
链单元以及j链的多价集聚体)。在igg的情形中,所述的4
‑
链单元一般是大约150,000道尔顿。每个lc通过一个共价的二硫键与一个hc连接,而所述的两个hc通过一个或更多个二硫键彼此连接,取决于所述的hc同种型。每个hc和lc也具有有规则地间隔的链内二硫桥。对于μ和ε同种型的每一种α和γ链以及四种cj结构域,每个hc在n
‑
端处具有可变结构域(vh),随后是三个恒定结构域(ch1、ch2、ch3)。每个lc在n
‑
端处具有可变结构域(vl),随后是处于它的另外一端的恒定结构域(cl)。把所述的vl与所述的vh比对,并且把所述的cl与所述重链的第一恒定结构域(ch1)比对。能够通过绞链区使ch1与所述重链的第二恒定结构域(ch2)连接。相信特定的氨基酸残基在所述的轻链和重链可变结构域之间形成界面。vh和vl的配对一起形成单个抗原结合位点。关于不同类别的抗体的结构和性质,参见例如basic and clinical immunology,第8版,daniel p.stites,abba i.terr和tristram g.parslow(编辑),appleton&lange,norwalk,ct,1994,第71页和第6章。
41.人igg fc区的“ch2域”通常伸出所述的igg大约231至大约340个残基。所述的ch2域是独特的,因为它不与另一个结构域紧密地配对。相反地,两个n
‑
连接的带支链的碳水化合物链被插入完整的天然igg分子的两个ch2域之间。已经推测所述的碳水化合物可能提供所述的结构域
‑
结构域配对的替代物并且帮助稳定所述的ch2域。burton,molec.immunol.22:161
‑
206(1985)。
42.所述的“ch3域”包括在fc区中ch2结构域c端的一段残基(即igg的大约341个氨基酸残基至大约447个氨基酸残基)。
43.基于它们的恒定结构域的氨基酸序列,可以把来自任何脊椎动物物种的所述轻链(lc)归属到被称为κ和λ的两种明显不同类型中的一种。取决于它们的重链的恒定结构域
(ch)的氨基酸序列,可以把免疫球蛋白归属到不同的类别或同种型。存在着五个类别的免疫球蛋白:iga、igd、ige、igg和igm,其分别具有名称为α、δ、γ、ε和μ的重链。基于在ch序列与功能方面的相对微小的差别,所述的γ和α类别被进一步分成亚类,例如人表达下列亚类:igg1、igg2、igg3、igg4、iga1和iga2。
44.术语“可变的”是指这样的事实:在抗体中所述可变结构域的某些节段在序列方面广泛地不同。所述的可变结构域介导抗原结合并且确定特定抗体对于它的特定抗原的特异性。然而,在所述的可变结构域的110个氨基酸跨度,所述的可变性不是均匀地分布的。而是,所述的可变区由被每个长度为9
‑
12个氨基酸的被称为"超变区"的具有极端可变性的较短的区分开的被称为构架区(fr)的15
‑
30个氨基酸的相对不变的片段组成。天然的重链和轻链的所述的可变结构域每个包含四种fr,其大体上采取β
‑
折叠构型,通过三个高变区连接,该高变区形成环连接,并且在某些情况下形成为所述的β
‑
折叠结构的一部分。在每条链中的高变区被所述的fr维持在一起处于紧密邻近中,并且与来自另一条链的高变区一起对抗体的抗原结合位点的形成有贡献(参见kabat等人,sequences ofproteins ofimmunological interest,第五版,public health service,national institutes of health,bethesda,md,1991)。恒定结构域不直接参与抗体对抗原的结合,但是展示各种效应子功能,例如使抗体参与依赖于抗体的细胞的细胞毒性(adcc)。
[0045]“抗体片段”是指除完整抗体以外的分子,其包括结合完整抗体所结合的抗原的完整抗体的一部分。抗体片段的实例包括但是不局限于fv、fab、fab’、fab
’‑
sh、f(ab’)2;双抗体;线性抗体;单链抗体分子(例如scfv);和由抗体片段形成的多特异性抗体。
[0046]“fab”片段是通过木瓜蛋白酶消化抗体而产生的抗原结合片段并且由全部轻链以及重链的可变区结构域(vh)和一条重链的第一恒定结构域(ch1)组成。木瓜蛋白酶消化抗体产生两个相同的fab片段。胃蛋白酶处理抗体产生单个大的f(ab’)2片段,其大致对应于具有二价的抗原结合活性并且仍然能够交联抗原的两个二硫键连接的fab片段。fab’片段不同于fab片段,在于在所述的ch1结构域的羧基端处具有另外的少数几个残基,包括来自所述抗体绞链区的一个或更多个半胱氨酸。在本文中fab
’‑
sh是指fab’,其中恒定结构域的半胱氨酸残基带有游离的硫羟基。f(ab’)2抗体片段最初是以fab’片段对的形式被产生的,在它们之间具有铰链半胱氨酸。抗体片段的其它化学偶联也是已知的。
[0047]
正如本文中所用的那样,“接头蛋白”是指在溶液中与另一个接头蛋白序列特异性地相互作用的蛋白质序列。在一种实施方式中,所述的“接头蛋白”包括异源多聚化结构域。这样的接头蛋白包括亮氨酸拉链蛋白或多肽,其包含seq id no:4的氨基酸序列(cjun(r):asiarleekv ktlkaqnyel astanmlreq vaqlggc)或seq id no:5(fosw(e):asidelqaev eqleernyal rkevedlqkq aeklggc)或其变体(在seq id no:4和seq id no:5中可以被修饰的氨基酸包括但是不限于带下划线的并且以粗体表示的那些氨基酸),其中所述的变体具有氨基酸修饰,其中所述的修饰保持或增大所述的接头蛋白与另一种接头蛋白,或包含选自由seq id no:11(asiarlrervktlrarnyelrsranmlrervaqlggc)或seq id no:12(asldeleaeieqleeenyalekeiedlekeleklggc)组成的组的氨基酸序列的多肽,或包含seq id no:13(gaba
‑
r1:eeksrlleke nrelekiiae keervselrh qlqsvggc)或seq id no:14(gaba
‑
r2:tsrleglqse nhrlrmkite ldkdleevtm qlqdvggc)或seq id no:15(cys:agsc)或seq id no:16(铰链:cppcpg)的氨基酸序列的多肽的亲和力。编码所述的外壳蛋白或接头蛋白的核
酸分子被包含在合成内含子之内。
[0048]
正如本文中所用的那样,“异源多聚化结构域”是指对生物分子的改变或添加,以便促进异源多聚体形成并且阻碍同源多聚体形成。任何对于形成异源二聚体具有强烈的胜过同源二聚体的偏爱的异源二聚化结构域都在本发明所述的保护范围范围之内。说明性例子包括但是不局限于例如美国专利申请20030078385(arathoon等人
–
genentech;描述了旋钮入孔);wo2007147901(等人
–
novo nordisk;描述了离子相互作用);wo 2009089004(kannan等人
–
amgen;描述了静电操纵的效果);wo2011/034605(christensen等人
‑
genentech;描述了卷曲螺旋)。也参见例如pack,p.&plueckthun,a.,biochemistry 31,1579
‑
1584(1992),描述了亮氨酸拉链,或pack等人bio/technology 11,1271
‑
1277(1993),描述了螺旋
‑
转角
‑
螺旋基序。在本文中,短语“异源多聚化结构域”和“异源二聚化结构域”可互换地使用。
[0049]
正如本文中所用的那样,术语“克隆位点”是指包含限制性位点的核酸序列,用于通过连接包含相容的粘性末端或平末端的核酸序列而介导的限制性核酸内切酶的克隆、核酸序列区,充当通过同源性和延伸“重叠pcr滚压”的插入dna的pcr介导的克隆的引发位点或重组位点,用于重组酶的通过重组
‑
交换反应介导的靶核酸序列的插入或靶核酸序列的转座子介导的插入的嵌合端,以及本领域中常见的其它技术。
[0050]
正如本文中所用的那样,“外壳蛋白”是指作为噬菌体微粒的组件的五种衣壳蛋白中的任意一种,包括piii、pvi、pvii、pviii和pix。在一种实施方式中,可以使用所述的“外壳蛋白”来展示蛋白质或肽(参见phage display,a practical approach,牛津大学出版社,由clackson和洛曼所编,2004,第1
‑
26页)。在一种实施方式中,外壳蛋白可以是所述的piii蛋白或其某种变体、部分和/或衍生物。例如,m13噬菌体piii外壳蛋白(cp3)的c端部分,例如可以使用编码m13噬菌体的蛋白iii的c末端残基267
‑
421的序列。在一种实施方式中,所述的piii序列包括seq id no:17的氨基酸序列(aediefasgggsgaetvesclakphtensftnvwk
d
dktldryanyegclwnatgvvvctgdetqcygtwvpiglaipenegggsegggsegggsegggtkppeygdtpipgytyinpldgtyppgteqnpanpnpsleesqplntfmfqnnrfrnrqgaltvytgtvtqgtdpvktyyqytpvsskamydaywngkfrdcafhsgfnedpfvceyqgqssdlpqppvnagggsgggsgggsegggsegggsegggsegggsgggsgsgdfdyekmanankgamtenadenalqsdakgkldsvatdygaaidgfigdvsglangngatgdfagsnsqmavgdgdnsplmnnfrqylpslpqsvecrpfvfsagkpyefsidcdkinlfrgvfafllyvatfmyvfstfanilrnkes)。在一种实施方式中,所述的piii片段包括seq id no:18的氨基酸序列(sgggsgsgdfdyekmanankgamtenadenalqsdakgkldsvatdygaaidgfigdvsglangngatgdfagsnsqmaqvgdgdnsplmnnfrqylpslpqsvecrpfvfgagkpyefsidcdkinlfrgvfafllyvatfmyvfstfanilrnkes)。
[0051]
正如本文中所用的那样,“表达盒”意指包含特定的核酸序列的具有特定的生物和/或生物化学活性的核酸片段(例如dna片段)。表述“盒”、“基因盒”或“dna盒”可以被互换地使用并且具有相同意义。
[0052]
术语“宿主细胞”、“宿主细胞系”、和“宿主细胞培养物”可以被互换地使用并且是指已经被引入了外源核酸的细胞,包括这样的细胞的后代。宿主细胞包括“转化体”和“转化细胞”,其包括原代转化细胞和来源于其的后代,不考虑传代的数目。后代在核酸含量方面可以不必与亲本细胞完全相同,而是可能包含突变。正如在最初转化的细胞中筛选或选择
的那样,具有相同功能或生物学活性的突变体后代被包括在本文中。
[0053]
正如在本文中使用的那样,术语“连接的”或“连接”或“连接”意指两个氨基酸序列或两个核酸序列分别通过肽键或磷酸二酯键共价连接在一起,这样的连接可以在所述相连的两个氨基酸序列或核酸序列之间包括任一数目的另外的氨基酸或核酸序列。
[0054]
正如可在本文中互换地使用那样,“核酸”或“多核苷酸”是指具有任何长度的核苷酸的聚合物,并且包括dna和rna。所述的核苷酸可以是脱氧核糖核苷酸、核糖核苷酸、修饰的核苷酸或碱基和/或它们的类似物,或可以通过dna或rna聚合酶或通过合成反应被掺入聚合物的任何底物。多核苷酸可以包含修饰的核苷酸,例如甲基化的核苷酸和它们的类似物。如果存在的话,可以在装配所述的聚合物之前或之后赋予对所述的核苷酸结构的修饰。所述的核苷酸序列可以被非核苷酸组分中断。在合成之后,可以进一步修饰多核苷酸,例如通过与标记物缀合。其它类型的修饰包括例如“加帽”、一个或更多个天然存在的核苷酸被类似物替代、核苷酸间修饰例如举例来说,具有不带电的键(例如膦酸甲酯、磷酸三酯、氨基磷酸酯、氨基甲酸酯等等)和具有带电荷的键(例如硫代磷酸酯、二硫代磷酸酯等等)的那些修饰、包含侧链部分的那些修饰,例如举例来说蛋白质(例如核酸酶、毒素、抗体、信号肽、聚l
‑
赖氨酸等等)、具有嵌入剂(例如吖啶、补骨脂素等等)的那些修饰、包含螯合剂(例如金属、放射性金属、硼、氧化的金属等等)的那些修饰、包含烷基化剂的那些修饰、具有修饰的键的那些修饰(例如α异头核酸等等)以及未修饰的形式的多核苷酸。例如可以通过膦酸酯基、磷酸基把通常存在于糖中的任意一个羟基替换、通过标准保护基将其保护或将其活化而产生与另外的核苷酸的另外的连接,或可以将其缀合到固体或半固体的载体上。可以把5’和3’端oh磷酸化或者用具有1至20个碳原子的胺类或有机封端基部分取代。也可以把其它羟基衍生成标准的保护基。多核苷酸还可以包含本领域中一般已知的类似形式的核糖或脱氧核糖糖类,其包括例如2
’‑
o
‑
甲基
‑
、2
’‑
o
‑
烯丙基、2
’‑
氟
‑
或2
’‑
叠氮基核糖、碳环糖类似物、α
‑
异头糖、差向异构的糖例如阿拉伯糖、木糖或来苏糖、吡喃糖糖类、呋喃糖糖类、景天庚酮糖、非环状的类似物和碱性的核苷类似物例如甲基核糖核苷。一个或更多个磷酸二酯键可以被交替的连接基团替换。这些交替的连接基团包括但是不限于其中磷酸酯被p(o)s(“硫代酸酯”)、p(s)s(“二硫代酸酯”)、“(o)nr2(“酰胺化物”)、p(o)r、p(o)or’、co或ch 2(“甲缩醛”)替换的实施方式,其中每个r或r’独立地是h或取代的或未被取代的任选地包含醚(
‑
o
‑
)键的烷基(1
‑
20c)、芳基、链烯基、环烷基、环烯基或芳烷基。在多核苷酸中不需要所有的键是相同的。前面的描述适用于本文中提到的所有的多核苷酸,包括rna和dna。
[0055]
当核酸被置于与另一个核酸序列的结构或功能关系中时,它是有效连接的。例如,一段dna与另一段dna可以是有效连接的,如果它们相对于彼此位于同一个连续的dna分子上并且具有结构或功能关系,例如启动子或增强子,其相对于编码序列定位,以便促进所述编码序列的转录;核糖体结合位点,其相对于编码序列定位,以便促进翻译;或前序列或分泌的前导序列,其相对于编码序列定位,以便促进前蛋白(例如参与所述的编码多肽分泌的前蛋白)的表达。在其它实例中,所述的有效连接的核酸序列不是连续的,而是以这样一种方式定位,以致它们彼此之间具有像由它们表达的核酸或蛋白质那样的功能关系。例如,增强子不必是连接的。可以通过在方便的限制性位点处的连接或通过使用合成寡核苷酸衔接头或接头来实现连接。
[0056]
在本文中使用术语“多聚腺苷酸化信号”或“多聚腺苷酸化位点”来意指足以使聚
腺苷核糖核酸定向添加到细胞中表达的rna分子的序列。
[0057]“启动子”是能够使信使rna中的基因序列转录启动的核酸序列,这样的转录用在所述的启动子上或附近的rna聚合酶的结合而启动。
[0058]
术语“3’剪接位点”用来意指可以被剪接机构识别和结合的核酸序列,例如在3’内含子/外显子边界处的前mrna序列。
[0059]
术语“5’剪接位点”用来意指可以被剪接机构识别和结合的核酸序列,例如在5’外显子/内含子边界处的前mrna序列。
[0060]
术语“隐蔽剪接位点”用来意指通常休眠的5’或3’剪接位点,它通过突变或其它方式被活化并且可以充当剪接元件。例如,突变可以活化处于天然的或占支配地位的5’剪接位点下游的5’剪接位点。使用这种“隐蔽”剪接位点导致产生不同的mrna剪接产物,其不通过利用天然的或占支配地位的剪接位点产生。
[0061]
正如本文中所用的那样,术语“反式剪接”意指包含在分开的、非连续的rna分子上的外显子的连接。
[0062]
术语“可变区”或“可变结构域”是指参与抗体与抗原结合的抗体重或轻链的结构域。天然抗体的重链和轻链的可变结构域(分别为vh和vl)一般地具有相似的结构,同时每个结构域包含四个保守性构架区(fr)和三个高变区(hvr)。(参见,例如kindt等人,kuby immunology,第6版,w.h.freeman and co.,第91页(2007))。单个vh或vl结构域可以足以赋予抗原结合特异性。而且,可以使用来自结合所述抗原的抗体的vh或vl结构域来分离结合特定抗原的抗体,从而分别地筛选互补的vl或vh结构域的库。参见例如portolano等人,j.immunol.150:880
‑
887(1993);clarkson等人,nature 352:624
‑
628(1991)。
[0063]
正如本文中所用的那样,术语“载体”是指能够使与它连接的另一个核酸增殖的核酸分子。该术语包括作为自我复制核酸结构的载体以及掺入所被引入的宿主细胞的基因组中的载体。某些载体能够指导与它们有效连接的核酸的表达。这样的载体在本文中被称为“表达载体”。
[0064]
ii.模块化多肽表达系统
[0065]
本发明至少部分地基于这样的发现:可以在哺乳动物细胞中利用前mrna反式剪接来确保模块化重组蛋白质表达。模块化的灵活的蛋白表达的概念允许在没有其它的蛋白
‑
蛋白质剪接方法的任何要求和限制的情况下,被两种不同的构建体编码的两种任意的蛋白编码序列精确地连接成编码多肽链的单个mrna。可以使这种概念适应于简化和延伸其它技术,所述技术需要哺乳动物细胞表达具有不同的复现模块组合的大的蛋白质集合。
[0066]
在这里,我们描述确保在噬菌体展示表达系统的背景中不同的抗体形式的模块化表达的多个多肽表达系统的产生。本文中描述了使用所述的多肽表达系统,所需要的核酸组件、载体、宿主细胞和方法。
[0067]
a.实现本发明的方式
[0068]
除非另有指示,实施本发明将会利用分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学和免疫学的常规技术,其在本领域的技术范围之内。在文献中充分地阐明了这样的技术,例如“molecular cloning:a laboratory manual”,第二版(sambrook等人,1989);;“oligonucleotide synthesis”(m.j.gait编辑,1984);“animal cell culture”(r.i.freshney,编辑,1987);;“methods in enzymology”(academic press,inc.);
“
handbook of experimental immunology”,第4版(d.m.weir&c.c.blackwell编辑,blackwell science inc.,1987);gene transfer vectors for mammalian cells”(j.m.miller&m.p.calos编辑,1987);“current protocols in molecular biology”(f.m.ausubel等人编辑,1987);“pcr:the polymerase chain reaction”,(mullis等人编辑,1994);和“current protocols in immunology”(j.e.coligan等人编辑,1991)。
[0069]
b.模块化蛋白表达系统
[0070]
本发明所述的多肽表达系统可以以相同或不同的(例如重新格式化的)方式支持多肽(例如融合蛋白)的表达。本发明提供通过使用所述的反式剪接方法用于以宿主细胞依赖性方式产生这样的用于模块化表达和产生不同形式(例如不同形式或不同融合体形式)的目的蛋白的多肽表达系统的工具。
[0071]
1.模块化蛋白表达系统的核酸组件
[0072]
a.模块化蛋白表达系统的核酸组件的结构
[0073]
所述的蛋白表达系统使用至少两种核酸分子,这两种核酸分子一起通过定向的前mrna反式剪接方法确保任意一种所要的多肽的灵活的、模块化表达。所述的第一核酸分子包括包含真核启动子(p1
euk1
)(例如巨细胞病毒(cmv)启动子、猿猴病毒40(sv40)启动子、moloney鼠白血病病毒u3区、羊关节炎
‑
脑炎病毒u3区、绵羊髓鞘脱落病毒u3区或逆转录病毒u3区序列)的第一表达盒,其与多肽编码序列(pes11)有效连接。在有些情况下,所述的多肽编码序列仅仅编码所要多肽的一部分,同时其余部分由包含在第二核酸分子上的多肽编码序列(pes2)提供。除了杂交序列(hs1)(的5’端)的上游之外,所述的第一核酸分子可以包含位于所述的pes11(的3’端)下游的5’ss(5’ss11)(例如gtaaga(seq id no:8))。
[0074]
所述的hs1序列可以包含编码多肽标签、标记物、外壳蛋白和/或衔接头蛋白的全部或一部分的基因,该基因可以与pes11位于框内,使得所述的表达产生与所述hs1编码的蛋白融合的pes11编码的蛋白。在一种情形中,所述的hs1是编码选自由噬菌体m13、f1或fd的pi、pii、piii、piv、pv、pvi、pvii、pviii、pix和px组成的组的外壳蛋白的全部或一部分的基因。例如,所述的pes11可以编码抗体或其fab片段的全部或一部分并且所述的hs1序列可以编码外壳蛋白(例如噬菌体m13的piii蛋白的全部或一部分,例如piii片段包含所述的piii蛋白的氨基酸残基267
‑
421或所述的piii蛋白的氨基酸残基262
‑
418),产生抗体
‑
或fab片段
‑
piii蛋白融合产物。在另一种情形中,所述的hs1是编码衔接头蛋白例如亮氨酸拉链的全部或一部分的基因,其中所述的亮氨酸拉链包含seq id no:4或5的氨基酸序列。
[0075]
另外,所述的第一核酸分子可以编码位于p1
euk1
的3’端和pes11的5’端的真核信号序列(ess11)。相应地,所述的第一核酸分子可以沿着5
’‑
至
‑3’
方向包含上述彼此连接(例如有效连接)成p1
euk1
‑
ess11‑
pes11‑5’
ss11‑
hs1的组件。
[0076]
所述的蛋白表达系统的第二核酸分子可以包含真核启动子(p2
euk
)(例如巨细胞病毒(cmv)启动子或猿猴病毒40(sv40)启动子),其与多肽编码序列(pes2)有效连接。在有些情况下,所述的多肽编码序列仅仅编码所要多肽的一部分,同时其余部分由包含在所述的第一核酸分子上的多肽编码序列(pes11)提供。所述的第二核酸分子可以包含位于pes2的5’端的3’剪接位点(3’ss2)。所述的第二核酸分子可以包含能够杂交到位于p2
euk
和3’ss2之间的hs1的杂交序列(hs2)。进一步,所述的第二核酸分子可以包含多聚腺苷酸化位点(pa2),其中所述的第二核酸分子的组件沿着5
’‑
至
‑3’
方向彼此有效连接成p2
euk
‑
hs2
‑3’
ss2
‑
pes2
‑
pa2。
[0077]
因此在真核细胞(例如哺乳动物细胞)中,在所述的第一和第二核酸前mrna产物之间的反式剪接将会由位于分开的mrna分子上互补序列(即hs1和hs2)的杂交引起,使得所述的第一分子的单独的5’剪接位点(5’ss11)和所述的第二分子的单独的3’剪接位点(3’ss2)由于将要发生的反式剪接而变成邻近的并且支持所要的反式剪接的mrna转录物的形成。另外,为了促进反式剪接,所述的第一核酸分子可以包含位于所述的5’ss11和hs1之间的内含子剪接增强子(ise)(ise1)。所述的ise1例如可以包含具有三个或更多个连续的鸟嘌呤残基的g
‑
片段,例如具有九个连续的鸟嘌呤残基的g
‑
片段。进一步,在它们在真核细胞(例如哺乳动物细胞,例如expi293f、293t或cho细胞)中转录时,可以通过将所述的第一核酸分子工程化使得在它的pes11和/或hs1组件的下游缺乏标准的多聚腺苷酸化位点,来诱导所述的第一和第二核酸前mrna之间的反式剪接。这将会使在可能发生所述的第二核酸分子的mrna转录物的反式剪接之前,将会被输出到细胞质的成熟mrna转录物的形成减到最少。
[0078]
在某些情况下,同时地表达分开的多肽产物可能是理想的。例如,表达第二多肽产物可能是理想的,该第二多肽产物可以与由所述的第一和第二核酸分子两者编码的第一多肽产物自我装配而形成所要的杂多聚体蛋白产物(例如由重和轻链两者组成的抗体)。为此目的,所述的第一和/或第二核酸分子可以另外包含第二表达盒。例如,在其中所述的第一核酸分子包含第二表达盒的情形中,所述的第二表达盒可以包含第二真核启动子(p1
euk2
)、(ii)编码真核信号序列的第二核酸序列(ess12)、(iii)第二多肽编码序列(pes12)和(iv)多聚腺苷酸化位点(pa1),其中所述的组件沿着5
’‑
至
‑3’
方向彼此有效连接成p1
euk2
‑
ess12‑
pes12‑
pa1。在某些情况下,所述的第二表达盒可以不包含ess12组件(例如当不需要或希望分泌所表达的多肽时)。因此,所述的第一核酸分子将会把下面的两种多肽产物编码成分开的启动子,从而经由定向反式剪接形成了编码所述的第一核酸分子的多肽产品中的一种的mrna转录物中的一种,与第二核酸分子编码的mrna转录物。在某些情况下,所述的第二表达盒位于所述的第一表达盒的5’端。在其它情况下,所述的第二表达盒位于所述的第一表达盒的3’端。
[0079]
b.在原核和真核细胞两者中的多肽表达
[0080]
在某些情况下,为了在原核和真核细胞这两者背景中的多肽表达,可以把所述的多肽表达系统工程化。因此,如果想要表达由pes11或在一些情况下由pes11和hs1编码的多肽产物的话,所述的第一核酸分子可以包含位于所述的p1
euk1
和pes11之间的可切除的原核启动子模块(eppm1)。所述的eppm1可以包含5’剪接位点(5’ss12)、原核启动子(p1
prok1
)、编码原核信号序列的核酸序列(pss11)和3’剪接位点(3’ss11),其相互之间沿着5
’‑
至
‑3’
方向定位成5’ss12‑
p1
prok1
‑
pss11‑3’
ss11,并且有效连接来驱动由pes11或pes11和hs1编码的多肽的转录。在某些情况下,所述的eppm1可以不包含pss11组件(例如当不需要或希望分泌所表达的多肽时)。因此,所述的eppm1将会在原核细胞中驱动所述的第一核酸分子的pes11编码的多肽的转录。另一方面,在真核细胞(例如哺乳动物细胞)中,所述的p1
euk1
将会驱动所述的第一核酸分子的pes11编码的多肽的转录的表达,并且通过借助于5’ss12和3’ss11组件侧翼的命中的顺式剪接,所述的eppm1将会被从所述的前mrna转录物中除去。
[0081]
在某些情况下,所述的eppm1也包含位于所述的pss11和3’ss11之间的多聚嘧啶束(ppt11)。所述的ppt11可以包含例如ttccttttttctctttcc的序列(seq id no:1)的序列。所
述的第二核酸分子也可以包含多聚嘧啶束(ppt2),该多聚嘧啶束例如可以位于所述的hs2和3’ss2之间。所述的ppt2可以包含例如ttcctctttccctttctctcc的序列(seq id no:7)。另外,所述的第二核酸分子可以进一步包含位于所述的hs2和3’ss2之间的ise(ise2)。所述的ise2例如可以包含具有三个或更多个连续的鸟嘌呤残基的g
‑
片段,例如具有九个连续的鸟嘌呤残基的g
‑
片段。
[0082]
在其中所述的多肽表达系统的第一核酸分子包含第二表达盒的一些实施方式中,所述的第二表达盒可以进一步包含位于p1
euk2
和pes12之间并且包括下列组件的可切除的原核启动子模块(eppm2):(i)5’剪接位点(5’ss13)、(ii)原核启动子(p1
prok2
)、(iii)编码原核信号序列的核酸序列(pss12)和(iv)3’剪接位点(3’ss12),凭此所述的组件相互之间沿着5
’‑
至
‑3’
方向定位成5’ss13‑
p1
prok2
‑
pss12‑3’
ss12,并且有效连接来驱动由pes12编码的多肽的转录。在某些情形中,所述的eppm2可以不包含pss12组件(例如当不需要或希望分泌所表达的多肽时)。所述的第二可切除的原核启动子模块将会以类似于上面描述的第一可切除的原核启动子模块的方式起作用。
[0083]
所述可切除的原核启动子模块的原核启动子可以是phoa、tac、lac或tphac启动子(参见例如kim等人,plos one.7(4):e35844)或本领域中已知的另一种原核启动子。
[0084]
在构建能够在原核细胞(例如大肠杆菌细胞)和真核细胞(哺乳动物细胞,例如expi293f细胞)这两者中表达目的蛋白质的载体中的另外的挑战来自于在这些细胞类型中发现的信号序列的差别。虽然在原核和真核细胞这两者中信号序列的某些特征一般地被保留(例如位于所述序列中间的一片疏水性残基以及靠近处于成熟多肽的n
‑
端切割位点的极性的/带电荷的残基),但是其它特征是一种细胞类型而不是另一种细胞类型的特征性的。而且,本领域中已知在哺乳动物细胞中,不同的信号序列可能对表达水平具有显著的影响,即使所述的序列全部是哺乳动物来源的(hall等人,j of biological chemistry,265:19996
‑
19999(1990);humphreys等人,protein expression and purification,20:252
‑
264(2000))。例如,细菌的信号序列典型地紧接在起始甲硫氨酸之后具有带正电荷的残基(最通常是赖氨酸),然而这些并不总是存在于哺乳动物的信号序列中。
[0085]
如果需要或希望分泌所表达的蛋白的话,可以使用在原核生物中将目的多肽靶向外周质和在真核生物中将目的多肽靶向内质网的任何信号序列(包括共有信号序列)。例如,所述的真核信号序列(例如ess11或ess12)可以来源于或包括鼠的结合免疫球蛋白的蛋白(mbip)信号序列的全部或一部分(uniprotkb:登录号p20029)或抗体重链或轻链的信号序列(例如鼠的vh基因信号序列)。在一些实施方式中,所述的原核信号序列(例如pss11或pss12)可以来源于或包括热稳定的肠毒素ii(stii)基因的全部或一部分。其它可以被利用的信号序列包括来自人生长激素(hgh)(uniprotkb:登录号bia4g6)、gaussia princeps荧光素酶(uniprotkb:登录号q9blz2)和酵母内切
‑
1,3
‑
葡聚糖酶(ybgl2)(uniprotkb:登录号p15703)的信号序列。所述的信号序列可以是天然的或合成的信号序列。在一些实施方式中,所述的合成的信号序列是最优化的信号分泌序列,它与它的非优化的天然信号序列相比,以优化水平驱动展示的水平。
[0086]
2.载体、宿主细胞和生产方法
[0087]
本发明的特征是包含一种或更多种上面描述的核酸分子的载体或载体组。因此,本发明的特征还是包含第一载体和第二载体的载体组,其中所述的第一和第二载体分别包
含上面描述的多肽表达系统的第一和第二核酸分子。
[0088]
除了上面详细描述的核酸分子的组件之外,所述的载体或载体组还可以包含细菌的复制起点、哺乳动物的复制起点和/或编码可用作对照(例如gd蛋白)或活性(例如蛋白纯化、蛋白标志或蛋白标记)的多肽的核酸。
[0089]
还提供了用于生产多肽的方法,包括在培养基中培养包含一种或更多种上面所述的载体或载体组的宿主细胞以及任选地从所述的宿主细胞(或宿主细胞培养基)中回收所述的抗体。
[0090]
c.用于模块化抗体表达和重新格式化(reformatting)的噬菌体展示载体系统
[0091]
在一些实施方式中,可以使用本发明的多肽表达系统来生产抗体(例如全长抗体,例如全长igg抗体,或其片段,例如fab片段)。我们通过设计允许在人细胞中从相同克隆表达不同的抗体形式的噬菌体展示载体系统,阐述了模块化蛋白表达系统的应用。通过在细胞中表达期间通过前mrna反式剪接把编码所述多肽的不同部分的序列连接,使由所述的噬菌体展示载体编码的重链的抗原结合区和部分恒定区直接地并且精确地融合到在第二互补构建体中编码的序列。
[0092]
在下面的实施例1和2中描述了所述的多肽表达系统用于允许在哺乳动物细胞中直接表达igg的目的而无需亚克隆所述的噬菌体fab序列。在某些情况下,可以把所述的多肽表达系统的第一核酸分子设计成编码所述的fab片段组件全部。因此,所述的第一核酸分子可以包含编码具有所述fab的vh结构域和ch1结构域的多肽的pes11组件。所述的第一核酸分子还可以包含编码vl结构域和cl结构域的pes12组件。所述的第一核酸分子的转录将会产生两种非连续的前mrna产物,它们一起形成可以被适当地标记(例如融合到m13的piii)用于噬菌体展示目的的fab片段。
[0093]
随后通过在真核细胞(例如哺乳动物细胞,例如expi293f细胞)中表达所述的第一核酸分子以及提供所述抗体的其余部分(即所述的ch2和ch3结构域)的第二核酸分子,可以实现将所述的fab片段重新格式化成全长igg抗体的方法。例如,所述的第二核酸分子可以包含编码具有ch2结构域和ch3结构域的多肽的pes2组件。在真核细胞中转录所述的第一和第二分子将会导致三种前mrna转录物的产生,同时编码前mrna转录物的重链被诱导而彼此之间发生反式剪接而产生所要的igg抗体的重新格式化后的全长重链。所述的加工后的mrna然后将会被翻译并且导致所述的igg分子的轻链和重链这两者的产生,并且这样的产生将不要求对劳动密集性亚克隆的需要。
[0094]
当针对不同的筛选试验需要不同的抗体形式例如野生型igg、fab片段或具有用于双特异性形式的fc修饰的igg时,从相同的克隆表达不同抗体形式的能力可用于抗体的发现中。通过在互补质粒中在ch1区之后简单地克隆待添加的合适的序列,本发明所述的多肽表达系统原则上允许任何这些或额外的形式。而且,所述系统的模块化组织允许表达新的抗体形式而无需重新生成噬菌体展示库的原种,因为这仅仅需要构造新的互补质粒。还可以通过把所述的5’ss从所述ch1编码区的下游转移到所述的vh中或j
‑
ch1接合点中的j区(fr4),因而把在两个不同的核酸中的所述重链的vh和整个恒定区分开,来调适所述的核酸以允许使用任何ch1区。通过在编码上铰链的序列之后简单地添加终止密码子,所述的核酸分子与在大肠杆菌中表达fab片段的传统方法相容。然而,在fab噬菌体展示库中在所述的重链和基因iii序列的接合点处的琥珀终止密码子通常导致显著降低的展示水平,因而在
幼稚全部组成成分库的情形中,在选择之后需要重新格式化克隆(lee等人,journal of immunological methods.284:119
‑
132,2004)。使用用于igg表达的相同方法,在哺乳动物细胞中表达fab片段避开了这种对重新格式化的需要,同时产率可与通常在大肠杆菌中得到的那些产率相当。
[0095]
通过这种多肽表达系统生产的抗体可以包括以重组产生的嵌合的、人源化的和/或人抗体。在某些情况下,所述的抗体是抗体片段,例如fab、fv、fab’、scfv、双抗体或f(ab’)2片段。在其它情形中,所述的抗体是全长抗体,例如完整的igg1、igg2、igg3或igg4抗体或在本文中定义的另一类别或同种型的其它抗体。
[0096]
所述表达的抗体可以单独地或以组合方式掺入下面部分1
‑
7中描述的任意一种特征:
[0097]
1.抗体亲和力
[0098]
通过本文中描述的多肽表达系统生产的抗体(例如fab或全长igg抗体)可以具有≤1μm、≤100nm、≤10nm、≤1nm、≤0.1nm、≤0.01nm或≤0.001nm(例如10
‑8m或更小,例如10
‑8m至10
‑
13
m,例如10
‑9m至10
‑
13
m)的解离常数(k
d
)。
[0099]
在一种实施方式中,正如由下列试验描述的那样,通过采用所述的fab形式的目的抗体和它的抗原进行的放射性标记的抗原结合试验(ria)来测定k
d
。通过使fab与最小浓度的(
125
i)标记的抗原在滴定系列的非标记抗原存在下平衡,然后采用抗fab抗体包被的平板俘获结合的抗原,来测定fab对于抗原的溶液结合亲和力(参见例如chen等人,j.mol.biol.293:865
‑
881(1999))。为了为所述的试验建立条件,采用在50mm碳酸钠(ph 9.6)中的5μg/ml的捕捉抗fab抗体(cappel labs)包被多孔板(thermo scientific)过夜,随后在室温下(大约23℃)采用在pbs中的2%(w/v)牛血清白蛋白阻断2至5小时。在非吸附性板(nunc#269620)中,把100pm或26pm[
125
i]
‑
抗原与目的fab的系列稀释液(例如与在presta等人,cancer res.57:4593
‑
4599(1997)中所述的抗vegf抗体fab
‑
12的估计一致)混合。然后培育所述的目的fab过夜;然而,所述的培育可以持续一段更长的期间(例如大约65小时)以确保达到平衡。此后,把所述的混合物转移到所述的捕获板,用于在室温下温育(例如持续一个小时)。然后除去所述的溶液并且采用在pbs中的0.1%聚山梨酯20(tween
‑
)洗涤所述的板8次。当所述的板已经干燥时,添加150μl/孔的闪烁剂(microscint
‑
20
tm
;packard),并且在topcount
tm
gamma计数器(packard)上对所述的板进行计数10分钟。挑选提供小于或等于最大结合的20%的每种fab的浓度,用于竞争性结合试验中。
[0100]
根据另一种实施方式,使用表面等离振子共振试验,利用
‑
2000或
‑
3000(biacore,inc.,piscataway,nj)在25℃,采用固定化抗原cm5芯片以~10应答单位(ru)来测定k
d
。简单来说,根据供应商的说明书,采用n
‑
乙基
‑
n
’‑
(3
‑
二甲基氨基丙基)
‑
碳二亚胺盐酸盐(edc)和n
‑
羟基琥珀酰亚胺(nhs)活化羧甲基化的葡聚糖生物传感器芯片(cm5,biacore,inc.)。在以5μl/分钟的流速注射之前,用ph4.8的10mm乙酸钠把抗原稀释到5μg/毫升(~0.2μm)以达到大约10应答单位(ru)的偶联蛋白。在注射抗原以后,注射1m乙醇胺来阻断未反应的基团。为了动力学测定,在25℃以大约25μl/分钟的流速,注射含有0.05%聚山梨酯20(tween
‑
20
tm
)表面活性剂(pbst)的pbs中的fab的两倍系列稀释液
(0.78nm至500nm)。使用简单的一对一的朗缪尔结合模型(evaluation software版本3.2),通过同时地拟合缔合和解离传感图来计算缔合速率(k
on
)和解离速率(k
off
)。把平衡解离常数(k
d
)计算成比率k
off
/k
on
。参见例如chen等人,j.mol.biol.293:865
‑
881(1999)。如果通过上面所述的表面等离振子共振试验测得所述的缔合速率超过106m
‑1s
‑1,则可以通过使用荧光淬灭技术来测定所述的缔合速率,该荧光淬灭技术在25℃下,在逐步增大浓度的抗原存在下,测定在ph 7.2的pbs中20nm抗抗原抗体(fab形式)的荧光发射强度的增大或减小(激发=295nm;发射=340nm,16nm的带通),如在分光计例如装备了停流的分光光度计(aviv instruments)或具有搅拌的样品池的8000系列slm
‑
aminco tm
分光光度计(thermospectronic)中测定。
[0101]
2.抗体片段
[0102]
在某些实施方式中,通过本文中描述的多肽表达系统生产的抗体是抗体片段。抗体片段包括但是不限于fab、fab’、fab
’‑
sh、f(ab’)2、fv和scfv片段以及如下所述的其它片段。关于某些抗体片段的综述,参见hudson等人nat.med.9:129
‑
134(2003)。关于scfv片段的综述,参见例如pluckth
ü
n,在the pharmacology of monoclonal antibodies,第113卷,rosenburg和moore编辑,(springer
‑
verlag,new york),第269
‑
315页(1994)中;也参见wo 93/16185;和美国专利号5,571,894和5,587,458。关于包含补救受体结合表位残基并且具有增大的体内半衰期的fab和f(ab’)2片段的讨论,参见例如美国专利号5,869,046。
[0103]
双抗体是具有两个抗原结合位点的抗体片段,其可以是二价的或双特异性的。参见例如ep 404,097;wo 1993/01161;hudson等人,nat.med.9:129
‑
134(2003);和hollinger等人,proc.natl.acad.sci.usa 90:6444
‑
6448(1993)。在hudson等人,nat.med.9:129
‑
134(2003)中还描述了三抗体和四抗体。
[0104]
单结构域抗体是包含抗体的重链可变结构域的全部或一部分或轻链可变结构域的全部或一部分的抗体片段。在某些实施方式中,单结构域抗体是人单结构域抗体(domantis,inc.,waltham,ma;参见例如美国专利号6,248,516b1)。
[0105]
3.嵌合的并且人源化的抗体
[0106]
在某些实施方式中,通过本文中描述的多肽表达系统生产的抗体(例如fab或全长igg抗体)是嵌合抗体。某些嵌合抗体例如被描述在美国专利号4,816,567;和morrison等人,proc.natl.acad.sci.usa,81:6851
‑
6855(1984)中)。在一个实施例中,嵌合抗体包含非人可变区(例如来源于小鼠、大鼠、仓鼠、兔子或非人灵长类,例如猴子的可变区)和人恒定区。在进一步的实例中,嵌合抗体是“转换类别的”抗体,其中所述的类别或亚类已经被从亲本抗体的类别或亚类中改变了。嵌合抗体包括其抗原结合片段。
[0107]
在某些实施方式中,嵌合抗体是人源化的抗体。典型地,非人抗体被人源化以减小对人的免疫原性,同时保留了亲本非人抗体的特异性和亲和力。一般地,人源化的抗体包含一个或更多个可变结构域,其中hvr,例如cdr(或其部分)源自于非人抗体,并且fr(或其部分)源自于人抗体序列。人源化的抗体任选地还将会包含人恒定区的至少一部分。在一些实施方式中,在人源化的抗体中,某些fr残基被来自非人抗体(例如所述的hvr残基所源自的抗体)的相应残基取代,例如为了恢复或改善抗体特异性或亲和力。
[0108]
例如在almagro和fransson,front.biosci.13:1619
‑
1633(2008)中综述了人源化的抗体和制造它们的方法,并且例如在riechmann等人,nature332:323
‑
329(1988);queen
等人,proc.nat’l acad.sci.usa86:10029
‑
10033(1989);美国专利号5,821,337、7,527,791、6,982,321和7,087,409;kashmiri等人,methods 36:25
‑
34(2005)(描述了sdr(a
‑
cdr)接枝);padlan,mol.immunol.28:489
‑
498(1991)(描述了“表面重建”);dall’acqua等人,methods 36:43
‑
60(2005)(描述了“fr改组”);和osbourn等人,methods 36:61
‑
68(2005)以及klimka等人,br.j.cancer,83:252
‑
260(2000)(描述了实现fr改组的“指导选择”方法)中进一步描述人源化的抗体和制造它们的方法。
[0109]
可以被用于人源化的人构架区包括但是不局限于:使用所述的“最佳拟合”方法选择的构架区(参见例如sims等人,j.immunol.151:2296(1993));来源于轻或重链可变区的特定子群的人抗体的共有序列的构架区(参见例如carter等人,proc.natl.acad.sci.usa,89:4285(1992);和presta等人,j.immunol.,151:2623(1993));人成熟(以体细胞方式突变的)构架区或人生殖细胞构架区(参见例如almagro和fransson,front.biosci.13:1619
‑
1633(2008));和来自于筛选fr库的构架区(参见例如baca等人,j.biol.chem.272:10678
‑
10684(1997)和rosok等人,j.biol.chem.271:22611
‑
22618(1996))。
[0110]
4.人抗体
[0111]
在某些实施方式中,通过本文中描述的多肽表达系统生产的抗体(例如fab或全长igg抗体)是人抗体。所述的人抗体可以是重组人抗体,其是使用本领域中已知的各种技术最初制备并且然后鉴定其序列的。人抗体一般地被描述在van dijk和van de winkel,curr.opin.pharmacol.5:368
‑
74(2001)和lonberg,curr.opin.immunol.20:450
‑
459(2008)中。
[0112]
5.来源于库的抗体
[0113]
依靠利用可用于噬菌体展示系统中的本文中所描述的多肽表达系统,通过筛选具有所要活性或多种活性的抗体组合文库,已经可以把通过本发明的多肽表达系统生产的抗体(例如fab或全长igg抗体)分离出来。参见例如hoogenboom等人,在methods in molecular biology 178:1
‑
37(o’brien等人编辑,human press,totowa,nj,2001)中以及还参见例如在mccafferty等人,nature 348:552
‑
554;clackson等人,nature 352:624
‑
628(1991);marks等人,j.mol.biol.222:581
‑
597(1992)中;marks和bradbury在methods in molecular biology 248:161
‑
175(lo编辑,human press,totowa,nj,2003)中;sidhu等人,j.mol.biol.338(2):299
‑
310(2004);lee等人,j.mol.biol.340(5):1073
‑
1093(2004);fellouse,proc.natl.acad.sci.usa 101(34):12467
‑
12472(2004);和lee等人,j.immunol.methods 284(1
‑
2):119
‑
132(2004)。
[0114]
6.多特异性抗体
[0115]
在某些实施方式中,通过本文中描述的多肽表达系统生产的抗体(例如fab或全长igg抗体)是多特异性抗体,例如双特异性抗体。多特异性抗体是对于至少两个不同的位点具有结合特异性的单克隆抗体。在某些实施方式中,一种结合特异性针对第一抗原而另一种结合特异性针对任何其它抗原。在某些实施方式中,双特异性抗体可以与所述的第一抗原的两个不同的表位结合。还可以使用双特异性抗体来把细胞毒剂定位到表达所述的第一抗原的细胞。可以把双特异性抗体制备成全长抗体或抗体片段。
[0116]
包括“章鱼抗体”在内的具有三个或更多个功能性抗原结合位点的工程化抗体也被包括在本文中(参见例如us2006/0025576a1)。
[0117]
在本文中所述的抗体或片段也包括“双作用fab”或“daf”,其包含与第一抗原以及另一种不同的抗原结合的抗原结合位点(例如参见us2008/0069820)。
[0118]
7.抗体变体
[0119]
在某些实施方式中,考虑本文中提供的抗体的氨基酸序列变体。例如,改善所述抗体的结合亲和力和/或其它生物学性质可能是所希望的。可以通过把合适的修饰引入到一种或更多种编码所述抗体的全部或一部分的核酸分子中来制备抗体的氨基酸序列变体。这样的修饰包括例如在所述抗体的氨基酸序列之内残基的缺失、和/或插入和/或取代。可以使缺失、插入和取代的任何组合达到最后的构建体,条件是最后的构建体拥有所要的特征,例如抗原结合。
[0120]
在某些实施方式中,可以通过本发明所述的表达系统和方法生产相对于彼此具有一个或更多个氨基酸取代的抗体变体的集合。用于取代式诱变的目的位点包括所述的hvr和fr。在表1中在标题“保守性取代”下显示了保守性取代。更多个实质性的改变被提供在表1中的“示范性取代”标题下并且在下面针对氨基酸侧链类别进一步描述。可以把氨基酸取代引入目的抗体中并且针对想要的活性,例如保留的/改善的抗原结合、减小的免疫原性或改善的adcc或cdc,筛选所述的产物。
[0121]
表1.示范性的和优选的氨基酸取代
[0122]
原来的残基示范性的取代优选的取代ala(a)val;leu;ilevalarg(r)lys;gln;asnlysasn(n)gln;his;asp,lys;argglnasp(d)glu;asnglucys(c)ser;alasergln(q)asn;gluasnglu(e)asp;glnaspgly(g)alaalahis(h)asn;gln;lys;argargile(i)leu;val;met;ala;phe;正亮氨酸leuleu(l)正亮氨酸;ile;val;met;ala;pheilelys(k)arg;gln;asnargmet(m)leu;phe;ileleuphe(f)trp;leu;val;ile;ala;tyrtyrpro(p)alaalaser(s)thrthrthr(t)val;sersertrp(w)tyr;phetyrtyr(y)trp;phe;thr;serpheval(v)ile;leu;met;phe;ala;正亮氨酸leu
[0123]
可以根据常见的侧链性质把氨基酸分组:
[0124]
(1)疏水性的:正亮氨酸、met、ala、val、leu、ile;
[0125]
(2)中性亲水的:cys、ser、thr、asn、gln;
[0126]
(3)酸性的:asp、glu;
[0127]
(4)碱性的:his、lys、arg;
[0128]
(5)影响链取向的残基:gly、pro;
[0129]
(6)芳香族的:trp、tyr、phe。
[0130]
非保守性取代将会势必造成把这些类别中的一员交换为另一类别。
[0131]
一种类型的取代式变体涉及取代亲本抗体(例如人源化的或人抗体)的一个或更多个高变区残基。一般地,被选择用于进一步研究的所产生的变体相对于所述的亲本抗体将在某些生物学性质(例如增大的亲和力、减小的免疫原性)方面具有改变(例如改善)和/或将实质上保留了所述的亲本抗体的某些生物学性质。一种示范性的取代式变体是亲和力成熟的抗体,其可以被方便地产生,例如使用基于噬菌体展示的亲和力成熟技术,例如本文中描述的那些技术。简单来说,一个或更多个hvr残基被突变并且将所述的变体抗体展示在噬菌体上并针对特定的生物学活性(例如结合亲和力)进行筛选。
[0132]
可以在hvr中产生改变(例如取代),例如以改善抗体亲和力。可以使这样的改变在hvr“热点”,即由在体细胞成熟过程期间以高频发生突变的密码子编码的残基(参见例如chowdhury,methods mol.biol.207:179
‑
196(2008))和/或sdr中产生,同时测试所得的变体vh或vl的结合亲和力。经由构建并且从二级库中再次筛选的亲和力成熟例如已经被描述在hoogenboom等人的methods in molecular biology 178:1
‑
37(o’brien等人编辑,human press,totowa,nj,(2001)中。在亲和力成熟的一些实施方式中,通过多种方法(例如易错聚合酶链式反应、链改组或寡核苷酸指导的诱变)中的任意一种,把多样性引入被挑选用于成熟的可变基因中。然后生成一个二级库。然后筛选所述的库以鉴定具有所要的亲和力的任何抗体变体。用来引入多样性的另一种方法涉及hvr定向方法,其中把几个hvr残基(例如每次4
‑
6个残基)随机化。可以以特异性方式鉴定参与抗原结合的hvr残基,例如使用丙氨酸扫描诱变或建模。特别地,常常靶向cdr
‑
h3和cdr
‑
l3。
[0133]
在某些实施方式中,取代、插入或缺失可以发生在一个或更多个hvr之内,只要这样的改变实质上不减小所述抗体结合抗原的能力。例如,可以在hvr中产生实质上不减小结合亲和力的保守性改变(例如本文中提供的保守性取代)。这样的改变可以在hvr“热点”或sdr的外面。在上面提供的变体vh和vl序列的某些实施方式中,每个hvr要么是未改变的,要么包含不多于一个、两个或三个氨基酸取代。
[0134]
由cunningham和wells(1989)science,244:1081
‑
1085描述的一种可用于鉴定可以被靶向用于诱变的抗体的残基或区域的方法被称为“丙氨酸扫描诱变”。在这种方法中,鉴定了靶残基(例如带电荷的残基例如arg、asp、his、lys和glu)的残基或残基组并且用中性或带负电荷的氨基酸(例如丙氨酸或聚丙氨酸)将其替换,以确定所述抗体与抗原的相互作用是否受到影响。可以把更多的取代引入证明在功能上对所述的初始取代敏感的氨基酸位置。备选地或另外,抗原抗体复合物的晶体结构用来鉴定所述的抗体和抗原之间的接触点。可以靶向这样的接触残基和相邻残基或将其作为取代的候选者消除。可以筛选变体以确定它们是否包含所要的性质。
[0135]
氨基酸序列插入物包括长度范围从一个残基到包含一百或更多个残基的多肽的氨基和/或羧基端融合体以及具有单个或多个氨基酸残基的序列内插入物。末端插入物的
实例包括具有n端甲硫氨酰基残基的抗体。所述的抗体分子的其它插入式变体包括所述抗体的n
‑
或c
‑
端与增大所述抗体的血清半衰期的酶(例如用于adept)或多肽的融合体。
[0136]
尽管我们通过在本文中详述的噬菌体抗体展示载体系统的背景中通过前mrna反式剪接描述了模块化蛋白表达的概念,但是正如通过利用本文中描述的核酸分子、载体、载体组、宿主细胞和方法举例说明的那样,例如可以把所述概念的应用进行调适和延伸到需要哺乳动物细胞表达具有不同的复现模块组合的大的蛋白质集合的其它技术。
具体实施方案
[0137]
1.包含第一核酸分子和第二核酸分子的多肽表达系统,其中:
[0138]
(a)所述的第一核酸分子包含包括下列组件的第一表达盒:(i)第一真核启动子(p1
euk1
)、(ii)编码第一多肽的序列(pes11)、(iii)第一5’剪接位点(5’ss11)和(iv)杂交序列(hs1),其中所述的组件沿着5
’‑
至
‑3’
方向彼此有效连接成p1
euk1
‑
pes11‑5’
ss11‑
hs1;并且
[0139]
(b)所述的第二核酸分子包含下列组件:(i)真核启动子(p2
euk
)、(ii)能够与hs1杂交的杂交序列(hs2)、(iii)3’剪接位点(3’ss2)、(iv)多肽编码序列(pes2)和(v)多聚腺苷酸化位点(pa2),其中所述的组件沿着5
’‑
至
‑3’
方向彼此有效连接成p2
euk
‑
hs2
‑3’
ss2
‑
pes2
‑
pa2。
[0140]
2.实施方案1所述的多肽表达系统,其中所述的p1
euk1
是巨细胞病毒(cmv)启动子或猿猴病毒40(sv40)启动子。
[0141]
3.实施方案1或2所述的多肽表达系统,其中p2
euk
是cmv启动子或sv40启动子。
[0142]
4.实施方案1
‑
3中任意一项所述的多肽表达系统,其中所述的第一表达盒进一步包含编码真核信号序列的第一核酸序列(ess11),其中所述的ess11位于p1
euk1
和pes11之间。
[0143]
5.实施方案4所述的多肽表达系统,其中所述的ess11源自于可变重链(vh)基因。
[0144]
6.实施方案1
‑
5中任意一项所述的多肽表达系统,其中所述的第一表达盒进一步包含含有下列组件的可切除的原核启动子模块(eppm1):(i)5’剪接位点(5’ss12)、(ii)原核启动子(p1
prok1
)和(iii)3’剪接位点(3’ss11),其中所述的组件沿着5
’‑
至
‑3’
方向彼此有效连接成5’ss12‑
p1
prok1
‑3’
ss11,并且其中所述的eppm1位于所述的p1
euk1
和pes11之间。
[0145]
7.实施方案6所述的多肽表达系统,其中所述的p1
prok1
选自由phoa启动子、tac启动子、lac和tphac启动子组成的组。
[0146]
8.实施方案6或7所述的多肽表达系统,其中所述的eppm1进一步包含编码原核信号序列的第一核酸序列(pss11)。
[0147]
9.实施方案6
‑
8中任意一项所述的多肽表达系统,其中所述的pss11源自于热稳定的肠毒素ii(stii)基因。
[0148]
10.实施方案6
‑
9中任意一项所述的多肽表达系统,其进一步包含位于pss11和3’ss11之间的多聚嘧啶束(ppt11)。
[0149]
11.实施方案10所述的多肽表达系统,其中所述的ppt11包含ttccttttttctctttcc的核酸序列(seq id no:1)。
[0150]
12.实施方案1
‑
11中任意一项所述的多肽表达系统,其中所述的pes11不包含隐蔽的5’剪接位点。
[0151]
13.实施方案1
‑
12中任意一项所述的多肽表达系统,其中所述的hs1是编码外壳蛋白或衔接头蛋白的全部或一部分的基因。
[0152]
14.实施方案13所述的多肽表达系统,其中所述的外壳蛋白选自由噬菌体m13、f1或fd的pi、pii、piii、piv、pv、pvi、pvii、pviii、pix和px组成的组。
[0153]
15.实施方案14所述的多肽表达系统,其中所述的外壳蛋白是噬菌体m13的piii蛋白。
[0154]
16.实施方案15所述的多肽表达系统,其中所述的piii片段包含所述的piii蛋白的氨基酸残基267
‑
421或所述的piii蛋白的氨基酸残基262
‑
418。
[0155]
17.实施方案13所述的多肽表达系统,其中所述的衔接头蛋白是亮氨酸拉链。
[0156]
18.实施方案17所述的多肽表达系统,其中所述的亮氨酸拉链包含seq id no:4或5的氨基酸序列。
[0157]
19.实施方案1
‑
18中任意一项所述的多肽表达系统,其中所述的第一核酸分子进一步包含第二表达盒,所述第二表达盒包含第二真核启动子(p1
euk2
)、(ii)第二多肽编码序列(pes12)和(iii)多聚腺苷酸化位点(pa1),其中所述的组件沿着5
’‑
至
‑3’
方向彼此有效连接成p1
euk2
‑
pes12‑
pa1。
[0158]
20.实施方案19所述的多肽表达系统,其中所述的p1
euk2
是cmv启动子或sv40启动子。
[0159]
21.实施方案19或20所述的多肽表达系统,其中所述的第二表达盒进一步包括编码真核信号序列的核酸序列(ess12)。
[0160]
22.实施方案21所述的多肽表达系统,其中所述的ess12来源于鼠的结合免疫球蛋白的蛋白(mbip)基因。
[0161]
23.实施方案19
‑
22中任意一项所述的多肽表达系统,其中所述的ess12包含atg aan ttn acn gtn gtn gcn gcn gcn ctn ctn ctn ctn ggn的核酸序列,其中n是a、t、c或g(seq id no:6)。
[0162]
24.实施方案19
‑
23中任意一项所述的多肽表达系统,其中所述的第二表达盒进一步包含包括下列组件的可切除的原核启动子模块(eppm2):(i)5’剪接位点(5’ss13)、(ii)原核启动子(p1
prok2
)和(iii)3’剪接位点(3’ss12),其中所述的组件沿着5
’‑
至
‑3’
方向彼此有效连接成5’ss13‑
p1
prok2
‑3’
ss12,并且其中所述的eppm2位于所述的p1
euk2
和pes12之间。
[0163]
25.实施方案24所述的多肽表达系统,其中所述的p1
prok2
选自由phoa启动子、tac启动子和lac启动子组成的组。
[0164]
26.实施方案24或25所述的多肽表达系统,其中所述的eppm2进一步包含编码原核信号序列的核酸序列(pss12)。
[0165]
27.实施方案24
‑
26中任意一项所述的多肽表达系统,其中所述的pss12源自于热稳定的肠毒素ii(stii)基因。
[0166]
28.实施方案24
‑
27中任意一项所述的多肽表达系统,其进一步包含位于所述的pss12和3’ss12之间的多聚嘧啶束(ppt12)。
[0167]
29.实施方案28所述的多肽表达系统,其中所述的ppt12包含ttccttttttctctttcc的核酸序列(seq id no:1)。
[0168]
30.实施方案19
‑
29中任意一项所述的多肽表达系统,其中所述的第二表达盒位于
所述的第一表达盒的5’端。
[0169]
31.实施方案1
‑
30中任意一项所述的多肽表达系统,其进一步包含位于所述的5’ss11和hs1之间的内含子剪接增强子(ise)(ise1)。
[0170]
32.实施方案31所述的多肽表达系统,其中所述的ise1包括包含三个或更多个连续的鸟嘌呤残基的g
‑
片段。
[0171]
33.实施方案32所述的多肽表达系统,其中所述的ise1包括包含九个连续的鸟嘌呤残基的g
‑
片段。
[0172]
34.实施方案1
‑
33中任意一项所述的多肽表达系统,其进一步包含位于所述的hs2和3’ss2之间的多聚嘧啶束(ppt2)。
[0173]
35.实施方案34所述的多肽表达系统,其中所述的ppt2包含ttcctctttccctttctctcc的核酸序列(seq id no:7)。
[0174]
36.实施方案35所述的多肽表达系统,其进一步包含位于所述的hs2和3’ss2之间的ise(ise2)。
[0175]
37.实施方案36所述的多肽表达系统,其中所述的ise2包括包含三个或更多个连续的鸟嘌呤残基的g
‑
片段。
[0176]
38.实施方案37所述的多肽表达系统,其中所述的ise2包括包含九个连续的鸟嘌呤残基的g
‑
片段。
[0177]
39.实施方案1
‑
38中任意一项所述的多肽表达系统,其中所述的5’ss11包含gtaaga的核酸序列(seq id no:8)。
[0178]
40.实施方案1
‑
39中任意一项所述的多肽表达系统,其中经由真核启动子的表达发生在哺乳动物细胞中。
[0179]
41.实施方案40所述的多肽表达系统,其中所述的哺乳动物细胞是expi293f细胞、cho细胞、293t细胞或nso细胞。
[0180]
42.实施方案41所述的多肽表达系统,其中所述的哺乳动物细胞是expi293f细胞。
[0181]
43.实施方案6
‑
42中任意一项所述的多肽表达系统,其中经由原核启动子的表达发生在细菌细胞中。
[0182]
44.实施方案43所述的多肽表达系统,其中所述的细菌细胞是大肠杆菌细胞。
[0183]
45.实施方案1
‑
44中任意一项所述的多肽表达系统,其中所述的pes11编码抗体的全部或一部分。
[0184]
46.实施方案45所述的多肽表达系统,其中所述的pes11编码包含vh结构域的多肽。
[0185]
47.实施方案46所述的多肽表达系统,其中所述的多肽进一步包含ch1结构域。
[0186]
48.实施方案45
‑
47中任意一项所述的多肽表达系统,其中所述的pes2编码抗体的全部或一部分。
[0187]
49.实施方案48所述的多肽表达系统,其中所述的pes2编码包含ch2结构域和ch3结构域的多肽。
[0188]
50.实施方案19
‑
49中任意一项所述的多肽表达系统,其中所述的pes12编码抗体的全部或一部分。
[0189]
51.实施方案50所述的多肽表达系统,其中所述的pes12编码包含vl结构域和cl结
构域的多肽。
[0190]
52.核酸分子,其包含包括下列组件的第一表达盒:
[0191]
(a)第一真核启动子(p1
euk1
);
[0192]
(b)包含下列组件的第一可切除的原核启动子模块(eppm1):
[0193]
(i)5’剪接位点(5’ss12);
[0194]
(ii)原核启动子(p1
prok1
);和
[0195]
(iii)3’剪接位点(3’ss11),
[0196]
其中所述的eppm1的组件沿着5
’‑
至
‑3’
方向彼此有效连接成5’ss12‑
p1
prok1
‑3’
ss11;
[0197]
(c)编码第一多肽的序列(pes11);
[0198]
(d)第一5’剪接位点(5’ss11);和
[0199]
(e)编码实用肽的序列(upes),
[0200]
其中所述的第一表达盒的组件沿着5
’‑
至
‑3’
方向彼此有效连接成p1
euk1
‑
eppm1‑
pes11‑5’
ss11‑
upes。
[0201]
53.实施方案错误!未找到引用源。所述的核酸分子,其中所述的第一表达盒进一步包含编码真核信号序列的第一核酸序列(ess11),其中所述的ess11位于所述的p1
euk1
和所述的eppm1之间。
[0202]
54.实施方案52或53所述的核酸分子,其中所述的eppm1进一步包含编码原核信号序列的第一核酸序列(pss11),其中所述的pss11位于所述的p1
prok1
和3’ss11之间。
[0203]
55.实施方案52
‑
54中任意一项所述的核酸分子,其进一步包含第二表达盒,所述第二表达盒包含第二真核启动子(p1
euk2
)、(ii)第二多肽编码序列(pes12)和(iii)多聚腺苷酸化位点(pa1),其中所述的组件沿着5
’‑
至
‑3’
方向彼此有效连接成p1
euk2
‑
pes12‑
pa1。
[0204]
56.实施方案55所述的核酸分子,其中所述的第二表达盒进一步包含编码真核信号序列的第二核酸序列(ess12),其中所述的ess12位于所述的p1
euk2
和pes12之间。
[0205]
57.实施方案55或56所述的核酸分子,其中所述的第二表达盒进一步包含包括下列组件的可切除的原核启动子模块(eppm2):(i)5’剪接位点(5’ss13)、(ii)原核启动子(p1
prok2
)和(iii)3’剪接位点(3’ss12),其中所述的组件沿着5
’‑
至
‑3’
方向彼此有效连接成5’ss13‑
p1
prok2
‑3’
ss12,并且其中所述的eppm2位于所述的p1
euk2
和pes12之间。
[0206]
58.实施方案57所述的核酸分子,其中所述的eppm2进一步包含编码原核信号序列的核酸序列(pss12),其中所述的pss12位于所述的p1
prok2
和3’ss12之间。
[0207]
59.实施方案52
‑
58中任意一项所述的核酸分子,其中所述的upes编码选自由标签、标记物、外壳蛋白和衔接头蛋白组成的组的实用肽的全部或一部分。
[0208]
60.实施方案59所述的核酸分子,其中所述的外壳蛋白选自由噬菌体m13、f1或fd的pi、pii、piii、piv、pv、pvi、pvii、pviii、pix和px组成的组。
[0209]
61.实施方案60所述的核酸分子,其中所述的外壳蛋白是噬菌体m13的piii。
[0210]
62.载体,其包含实施方案错误!未找到引用源。
‑
61中任意一项所述的核酸分子。
[0211]
63.载体组,其包含第一载体和第二载体,其中所述的第一和第二载体分别地包含实施方案1
‑
51中任意一项所述的多肽表达系统的第一和第二核酸分子。
[0212]
64.宿主细胞,其包含实施方案62所述的载体或实施方案63所述的载体组。
[0213]
65.实施方案64所述的宿主细胞,其中所述的宿主细胞是原核细胞。
[0214]
66.实施方案65所述的宿主细胞,其中所述的原核细胞是细菌细胞。
[0215]
67.实施方案66所述的宿主细胞,其中所述的细菌细胞是大肠杆菌细胞。
[0216]
68.实施方案64所述的宿主细胞,其中所述的宿主细胞是真核细胞。
[0217]
69.实施方案68所述的宿主细胞,其中所述的真核细胞是哺乳动物细胞。
[0218]
70.实施方案69所述的宿主细胞,其中所述的哺乳动物细胞是expi293f细胞、cho细胞、293t细胞或nso细胞。
[0219]
71.实施方案70所述的宿主细胞,其中所述的哺乳动物细胞是expi293f细胞。
[0220]
72.用于生产多肽的方法,其包括在培养基中培养包含实施方案62所述的载体或实施方案63所述的载体组的宿主细胞。
[0221]
73.实施方案72所述的方法,其中所述的方法进一步包括从所述的宿主细胞或培养基中回收所述的多肽。
[0222]
iii.实施例
[0223]
下列是本发明的实施例。应该明白:提供了上面提供的一般说明后,各种其它的实施方式可以被实施。
[0224]
实施例1.用于在噬菌体展示载体的背景中的抗体重新格式化的模块化蛋白表达系统的产生
[0225]
我们描述了用于模块化表达和生产多肽的多肽表达系统的产生。本发明至少部分地基于证明可以在哺乳动物细胞中利用前mrna反式剪接来确保模块化重组蛋白表达的实验发现。模块化蛋白表达的概念允许在没有其它蛋白
‑
蛋白剪接方法的要求和限制下,由两个不同的构建体编码的两个任意的蛋白编码序列精确连接成编码多肽链的单个mrna。可以把经由前mrna反式剪接的模块化蛋白表达的概念调适以简化和延伸需要哺乳动物细胞表达具有复现模块不同的组合的蛋白质大的集合的其它技术。例如,这种概念将会在需要表达融合蛋白配偶体的多种组合或在单个多肽突变的设置中找到应用。这种技术既简单又强大,允许以任何规模应用并且对于在哺乳动物细胞中的重组蛋白质表达领域具有广泛的重要性,该领域是许多现代生物技术的基础。
[0226]
在这里,我们描述能够在噬菌体展示表达系统的背景中模块化表达不同抗体形式的这样一种多肽表达系统的产生。噬菌体展示被广泛地用在用于开发治疗性抗体和试剂抗体的抗体片段的发现和工程化中(mccafferty等人,nature.348:552
‑
554,1990;sidhu.current opinion in biotechnology.11:610
‑
616,2000;smith.science.228:1315
‑
1317,1985)。噬菌体展示传统上允许迅速选择抗原特异性的结合剂但是有限的筛选所选择的抗体片段。对所述抗体片段的详细表征常常需要表达通常在哺乳动物细胞中表达的全长免疫球蛋白g(igg)。然而,在这个过程中一个限制性的步骤是把噬菌体克隆变换到用于igg表达的哺乳动物表达载体。尽管可以使用高通量亚克隆方法来变换大量的克隆,但是这些方法通常是相对劳动密集型的并且产生许多在所述的筛选阶段后将不会被使用的克隆。
[0227]
为了回避对亚克隆的需要并且确保模块化蛋白表达,我们生产了第一核酸分子:双宿主载体pdv2(图1)。不同于先前描述的双载体pdv(其包含具有用于在细菌或哺乳动物细胞中表达重链的工程化的信号序列的igg表达盒并且需要采用用于完全igg表达的表达
轻链的哺乳动物表达载体共转染哺乳动物细胞)(tesar等人protein engineering,design&selection:peds.26:655
‑
662,2013),pdv2包含细菌启动子和通过在哺乳动物细胞中剪接而被除去的嵌入内含子中的大部分stii信号序列。
[0228]
修饰了pdv2中的stii信号序列以在所述3’ss的前面包含3’剪接位点(3’ss)和优化的多聚嘧啶束(ppt)这两者。这需要在所述的stii信号序列中引入三个相对保守性氨基酸取代,其不影响fab片段在噬菌体上的展示(图2)。为了允许模块化灵活的表达来自相同克隆的抗体形式,我们没有添加编码恒定区的完全的内含子和外显子,其处于编码所述的ch1结构域的区的下游。而是,我们寻求添加来自第二核酸分子的反式的这些重链序列。为了实现这一点,我们利用所述的前mrna反式剪接、连接两种不同的前mrna以形成单个成熟的mrna的方法。通过把单独的5’ss和3’ss带给前mrna,通过所述的5’ss下游和所述的3’ss上游的互补序列杂交而形成单个的以非共价键相连的前mrna,可以引发反式剪接,该以非共价键相连的前mrna然后被剪接成正常的前mrna(konarska等人,cell.42:165
‑
171,1985;puttaraju等人,nature biotechnology.17:246
‑
252,1999;solnick.cell.42:157
‑
164,1985)。在这种特定的多肽表达系统中,我们使用了所述的m13基因iii(giii)的150
‑
bp片段作为所述的杂交序列(图1)。这种基因iii序列在编码ch1的序列的3’边界处跟随在先前描述的优化的gtaaga 5’ss(tesar等人,protein engineering,design&selection:peds.26:655
‑
662,2013)。
[0229]
为了完成所述的多肽表达系统,我们产生了第二核酸分子prk
‑
fc,它是表达前mrna的互补质粒,其包含150
‑
nt反义基因iii序列,随后是接头序列、共有分支点和ppt,以及3’ss,随后是在一个外显子中的铰链、ch2和ch3区,以及sv40多聚腺苷酸化信号(图1和3)。这个转录物不编码信号序列,并且开头两个潜在的起始密码子位于框外的反义基因iii序列中和绞链区中。因此,除了所述的5’ss之外,所有其它的需要剪接的序列都是由prk
‑
fc而不是pdv2编码的。采用pdv2和prk
‑
fc共转染expi293f细胞(invitrogen)产生基线但是可检测的表达水平的igg(图4a)。
[0230]
实施例2.用于在噬菌体展示载体的背景中的抗体重新格式化的优化模块化蛋白表达系统的产生
[0231]
通过pdv2和prk
‑
fc实现的基线igg产生可能起因于缺乏有效的反式剪接所需要的序列或在载体中抑制反式剪接的序列。在外显子和内含子这两者中的核苷酸基序可以充当剪接增强子或抑制基因或这两者,取决于它们的位置。为了载体设计的目的,可以更加容易地添加内含子剪接增强子(ise),因为在哺乳动物细胞表达中,这些增强子将不可能影响编码序列。一种被很好地描述的ise由位于靠近所述的内含子边界处的3个或更多个连续的鸟嘌呤残基残基的序列或g
‑
片段组成,该内含子边界被核内异质的核糖核蛋白h或f结合而增强剪接(wang等人,nature structural&molecular biology.19:1044
‑
1052,2012;xiao等人,nature structural&molecular biology.16:1094
‑
1100,2009)。也已经显示:靠近所述的5’ss不局限于g
‑
片段的富含嘌呤的内含子序列增强剪接(hastings等人,rna.7:859
‑
874,2001)。
[0232]
因此,我们生成了pdv2的变体pdv2b,其在距离所述的5’ss 26
‑
bp的下游包含23个碱基对(bp)的富含嘌呤的区,所述的5’ss在编码所述的m13噬菌体piii外壳蛋白(cp3)的上铰链和c端部分之间的接头的区域中具有9
‑
nt g
‑
片段以及在下游10nt处具有第二4
‑
nt g
‑
片段(图5)。这种变体把所述的上铰链和cp3之间的gly
‑
arg
‑
pro接头改变为三个gly残基。所述的载体不包含所述的重链盒的标准多聚腺苷酸化位点。其原因是试图使来自所述载体的成熟重链mrna的形成减到最少,于是在可能发生反式剪接并且潜在地导致fab
‑
cp3融合蛋白表达之前,该成熟重链mrna将会被输出到细胞质。还把所述的prk
‑
fc分子优化。也已经显示在所述的3’ss附近的内含子g
‑
片段刺激体外剪接(martinez
‑
contreras.plos biology.4:e21,2006)。因此,还把9
‑
nt的ise添加到所述的分支点的上游以产生优化的互补质粒prk
‑
fc2(图6)。采用pdv2和prk
‑
fc(ise
‑
)或prk
‑
fc2(ise )共转染人expi293f细胞产生了基线水平的igg表达(图4a)。采用所述的ise pdv2b质粒和要么prk
‑
fc要么prk
‑
fc2共转染expi293f细胞产生更高水平的igg表达,最高的表达水平至多为25μg/ml,是通过共转染所述的ise 质粒pdv2b和prk
‑
fc2产生的,这指示在这两种转录物中的ise序列增强反式剪接的效率。
[0233]
在转染的expi293f细胞中基线igg表达水平与转染后7天的表观细胞溶解作用有关,当单独地转染pdv2或pdv2b但不是prk
‑
fc或prk
‑
fc2时,也观察到所述的基线igg表达水平。通过蛋白质印迹,采用抗m13 p3抗体分析转染的细胞裂解液揭示了具有大约41kda的表观分子量的多肽(图12,底部组,第3至6泳道),与融合到所述的m13 cp3肽上的igg1 fd片段(vh
‑
ch1
‑
上铰链)的表达一致。在没有互补质粒的情况下,在被pdv2或pdv2b转染的细胞中,这种多肽的表达是较高的。所述的结果指示所述的pdv2和pdv2b质粒能够表达编码潜在地有毒的产物的成熟mrna,尽管事实是这两者在所述的重链盒下游的所述载体中都缺乏哺乳动物的多聚腺苷酸化位点。
[0234]
对编码cp3的基因iii序列的外观检查揭示了可能能够充当多聚腺苷酸化位点的aataaa基序(图2)。我们在这个位点引入了两个沉默突变而产生质粒pdv2c(ise
–
)和pdv2d(ise ),用来测试这是否将会减小在哺乳动物的细胞中的毒性并且改善蛋白表达。相对于在基因iii中具有潜在的多聚腺苷酸化位点的所述的pdv2和pdv2b载体来说,采用prk
‑
fc和要么pdv2c要么pdv2d共转染expi293f细胞产生大约6倍的更高水平的igg表达(图4a)。这种在igg表达水平方面的增加与转染的细胞的高生命力和在转染的细胞中显著地减小的或fd
‑
cp3融合蛋白的检测不到的表达有关(图12,下组,第7至10泳道)。这表明在基因iii之内的供体载体中潜在的多聚腺苷酸化位点的存在导致单独地来自所述的供体质粒的不希望有的蛋白表达,其对蛋白表达具有显著消极的影响。与采用所述的ise
‑
prk
‑
fc载体共转染相比,采用pdv2c或pdv2d以及所述的ise prk
‑
fc2互补载体共转染expi293f细胞导致igg表达的额外的2倍增加(图4a)。这些结果指示:决定所述的pdv2载体中基线蛋白表达的主要因素是在基因iii中潜在的多聚腺苷酸化位点的存在,然而当不存在潜在的基因iii多聚腺苷酸化基序时,添加ise对蛋白表达具有微小的影响。相比之下,当在基因iii中没有潜在的多聚腺苷酸化位点的情况下,采用pdv2变体共转染时,在所述的互补prk
‑
fc2质粒中添加ise导致大约2倍的较高的igg产率(图4a)。
[0235]
通过确定用于转染的最佳dna比率,实现了对蛋白表达的进一步优化。使用相对于pdv2d 2:1过量的所述的互补质粒prk
‑
fc2,在这种系统中产生了最高的igg表达产率(图4b)。使用具有优化的dna比率的pdv2d和prk
‑
fc2,来自30ml转染的expi293f细胞上清液的纯化igg的产率是3.2
±
1.2mg(n=3)。通过质谱和sds
‑
page不能区别从采用这些质粒共转染的expi293f细胞中纯化的igg和通过常规表达载体表达的相同igg(图7a
‑
7b和图13)。采
用编码具有不同特异性的可变区的pdv2d和具有优化的dna比率的prk
‑
fc2共转染expi293f细胞,导致从30ml转染的expi293f细胞上清液中纯化的2.5至5.5mg igg的高igg表达(图8a)。所述的多肽表达系统不局限于利用expi293f细胞来实现高表达水平。被广泛地用于igg表达的其它哺乳动物细胞系,例如293t和cho细胞也是有效的。采用表达具有不同特异性的可变区的pdv2d和prk
‑
fc2共转染293t或cho细胞导致高igg表达(图8b)。
[0236]
当采用所述的pdv2质粒共转染时,为了表达fab片段,修饰了所述的prk
‑
fc2载体。把编码所述prk
‑
fc2中的下铰链和fc区的序列除去并且采用flag标记替换而产生所述的prk
‑
fab
‑
flag载体(图9)。从30ml被pdv2d和prk
‑
fab
‑
flag共转染的expi293f细胞的上清液中纯化的纯化fab片段的产率是0.8
±
0.06mg(平均值
±
标准差,n=3)。所述的纯化的flag标记的fab片段的结构正确性被质谱和sds
‑
page所证实(图13)。所测量的重链质量是25,169da,接近于当排除剪掉的c端赖氨酸时25,172da的预期质量。
[0237]
已经在用于基因疗法的反式剪接系统中观测了来自所述的互补转录物的n
‑
末端截短的蛋白质的表达(monjaret等人molecular therapy 22:1176
‑
1187,2014)。这起因于编码具有形成成熟mrna所需的所有元件的3’外显子的互补转录物,该成熟mrna的形成能够导致来自内部起始密码子的翻译。我们通过被prk
‑
fc2转染的细胞裂解液的蛋白质印迹观察到与翻译自所述的第一框内atg密码子的fc片段一致的多肽的表达(图12,顶部组,第11泳道)。推测这种多肽缺乏分泌信号序列并且仅仅在细胞质中被表达。尽管通过细胞溶解作用,这种产物能够被释放到培养基中,但是我们通过sds
‑
page(图13,第2泳道)和质谱没有在纯化的igg样品中观测到它。当pdv2c或pdv2d被共转染到细胞中时,这种截短的产物的表达被减少了但是没有被消除(图12,顶部组,第8和10泳道)。插入在潜在的fc起始密码子上游的内含子区中的具有最佳翻译起始位点的框外可读框没有显著地减少所述的截短fc产物的表达。
[0238]
决定筛选效率的噬菌体展示载体的一个重要的性质是所实现的展示在噬菌体微粒上的抗体片段水平。使用先前描述的在大肠杆菌supe抑制基因菌株中具有减少的p3表达的amber
‑
2614 ko7辅助噬菌体,采用所述的pdv2d载体所实现的fab片段展示水平可与采用专门的fab展示载体fab
‑
zip
‑
噬菌体、使用标准m13ko7辅助噬菌体所实现的fab展示水平相当(图14)。
[0239]
当需要不同的抗体形式,例如野生型igg、fab片段或具有用于双特异性形式的fc修饰的igg用于不同的筛选试验时,从相同克隆表达不同的抗体形式的能力可用于抗体的发现中。所述的载体组通过在互补质粒中的ch1区后面简单地克隆将要被添加的合适序列,原则上允许这些或另外的形式中的任何一种。而且,所述系统的模块化组织允许表达新的抗体形式而无需重新生成噬菌体展示库的原种,因为这仅仅需要构造新的互补质粒。还可以通过把所述的ch1编码区下游的5’ss转移到vh中或j
‑
ch1接合点中的j
‑
区(fr4),因而把在两个不同质粒中的重链的vh和全部恒定区分开,来调适所述的双载体以允许使用任意一个ch1区。通过简单地在编码所述上铰链的序列后面添加终止密码子,所述的pdv2载体与用于在大肠杆菌中表达fab片段的传统方法相容,已知在fab噬菌体展示库中在所述的重链和基因iii序列的接合点处的琥珀终止密码子通常导致显著降低的展示水平,因而至少在幼稚全部组成成分库的情形中,在筛选之后需要重新格式化克隆(lee等人journal of immunological methods.284:119
‑
132,2004)。使用用于igg表达的相同方法在哺乳动物细
胞中表达fab片段规避了这种对重新格式化的需要,同时产率可与通常在大肠杆菌中得到的那些产率相当。
[0240]
实施例3.模块化蛋白表达系统
[0241]
在实施例1和2中产生和表征的多肽表达系统证明:通过利用多肽表达系统,例如上面描述的用于在噬菌体展示背景中的蛋白重新格式化的优化的表达系统,能够直接地实现任意一种想要的蛋白的模块化灵活的多肽表达。因此,所述的表达系统将会包含两个核酸分子组件(多肽编码序列pes11和pes2),其每个编码单个所要的多肽产物的一部分,其中在体内在无需亚克隆编码蛋白的核酸的情况下,通过前mrna反式剪接把所述蛋白的这些分开的编码区精确地连接在一起。如图10中所示,所述的第一核酸分子包含具有所述的pes11的表达盒并且在所述的pes11组件的上游也包含真核启动子(p1
euk1
)和真核信号序列(ess11)以及位于pes11下游的5’剪接位点(5’ss11)和杂交序列(hs1)。所述的互补的第二核酸分子也将会包含真核启动子(p2
euk
)以及能够与所述的pes2组件上游的hs1(hs2)和3’剪接位点(3’ss2)杂交的杂交序列。另外,所述的第二核酸分子将会在所述的pes2组件的下游包含多聚腺苷酸化位点(pa2)。因而,当在哺乳动物细胞中被转录时,所产生的两种前mrna分子,一种具有单独的5’ss而另一种具有单独的3’ss,将会通过它们的互补杂交序列(hs1和hs2)被定向在一起并且发生反式剪接而形成单个连续的mrna,后者能够随后翻译和编码所要的蛋白产物。
[0242]
如果还希望在原核细胞中表达由pes11以及任选的所述hs1区编码的多肽产物,则所述的第一核酸分子可以进一步包含位于所述的p1
euk1
和pes11之间的可切除的原核启动子模块(eppm1)。所述的eppm1可以包含5’剪接位点(5’ss12)、原核启动子(p1
prok1
)、编码原核信号序列的第一核酸序列(pss11)和3’剪接位点(3’ss11),它们沿着5
’‑
至
‑3’
方向彼此有效连接成5’ss12‑
p1
prok1
‑
pss11‑3’
ss11。所述的eppm1将会在原核细胞中驱动所述的第一核酸分子编码的多肽的转录。另一方面,在真核细胞(例如哺乳动物细胞)中,所述的p1
euk1
将会驱动所述的第一核酸分子编码的多肽的转录的表达,并且通过顺式剪接,依靠侧翼的5’ss12和3’ss11组件的命中,将会从所述的前mrna转录物中除去所述的eppm1。
[0243]
在某些情况下,也表达第二多肽可能是所希望的。因此可以把所述的模块化蛋白表达系统的第一核酸分子设计成包含第二表达盒。如图11中所示,将会以类似于所述的第一表达盒的方式设计编码所述的第二蛋白产物的第二表达盒(pes12),但是其将会包含在所述的pes12序列下游的多聚腺苷酸化位点(pa1),以确保在转录以后产生不同的前mrna分子。在其它情形中,可以把所述的第二表达盒设计到所述的多肽表达系统的第二核酸分子中。
[0244]
其它实施方式
[0245]
尽管为了清楚地理解的目的,通过举例说明和实施例,已经在一些细节方面描述了上述发明,但是所述的描述和实施例不应该被理解为限定本发明所述的保护范围。在本文中提到的所有专利和科学文献的公开内容通过引用明确地整体并入。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。