一种人白细胞介素2
‑
聚乙二醇偶联物及其应用
技术领域
1.本发明涉及生物制药领域,具体涉及一种人白细胞介素2
‑
聚乙二醇偶联物及其应用。
背景技术:
2.白细胞介素
‑
2(interleukin2,il
‑
2,常被简称白介素2)是由活化的i型辅助性t淋巴细胞(th1)产生的一种重要免疫调节因子,曾被称为t细胞生长因子,其主要生物学功能以刺激和抗凋亡双重方式促进t细胞(包括cd4
和cd8
t细胞)的生长、增殖、分化,并促进细胞因子进一步分泌。除此之外,白介素2还刺激nk细胞增殖,增强nk杀伤活性及产生细胞因子,诱导lak细胞产生;促进b细胞增殖和分泌抗体;因此,白介素2对机体的免疫应答和抗病毒感染等具有重要作用(gaffena s.l.,cytokine 28:109e123,2004)。
3.自1976年morgan等首次发现il
‑
2以来,其在临床上得到了广泛的应用。1991年,美国cetus生产的rhil
‑
2(产品名:aldesleukin)被fda批准上市,广泛应用于肾细胞癌、恶性黑色素瘤、恶性淋巴瘤等恶性肿瘤(proleukin说明书),且在乙肝、丙肝感染的辅助治疗方面也有潜在效果(tomova r.等,anticancer research,29:5241
‑
5244,2009)。我国至今有10余家重组人白介素2生物制品投产上市,广泛应用于肾细胞癌、黑色素瘤、乳腺癌、膀胱癌、肝癌、直肠癌、淋巴癌、肺癌等恶性肿瘤的治疗,用于癌性胸腹水的控制,用于手术、放疗及化疗后的肿瘤患者增强机体免疫功能,用于先天或后天免疫缺陷症患者提高细胞免疫功能和抗感染能力,用于各种自身免疫病的治疗,如类风湿性关节炎、系统性红班狼疮、干燥综合症等,且对某些病毒性、杆菌性疾病、胞内寄生菌感染性疾病,如乙型肝炎、麻风病、肺结核、白色念珠菌感染等具有一定的治疗作用。
4.人il
‑
2前体由153个氨基酸残基组成,在分泌出细胞时,其信号肽(含20个氨基酸残基)被切除,产生了133个氨基酸的成熟il
‑
2,其相对分子量为15.4kd。il
‑
2对效应细胞的激活作用是通过与细胞表面的il
‑
2受体(il
‑
2r)结合来实现。现已发现,il
‑
2受体包括 il
‑
2rα、il
‑
2rβ和il
‑
2rγ三种,三者可形成具高亲和力的异多聚体糖蛋白功能复合物il
‑ꢀ
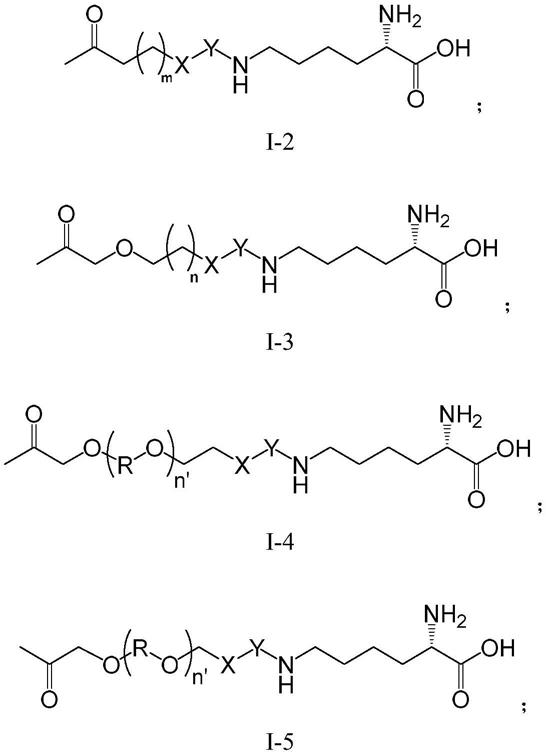
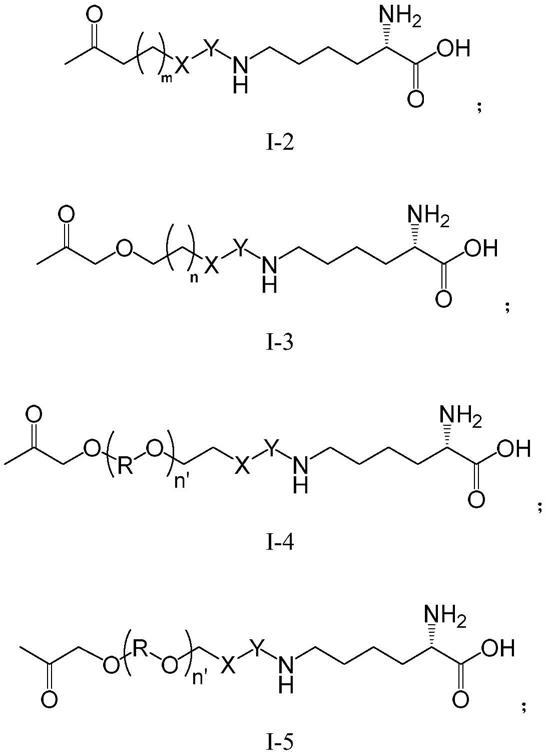
2rαβγ(kd=10
‑
11
mol/l)。il
‑
2rβ和il
‑
2rγ可形成中等亲和力的受体复合物il
‑
2rβγ(kd=10
‑9mol/l),受il
‑
2激活后有生物学活性;il
‑
2rα亚基是低亲和力受体形式(kd=10
‑8mol/l),它与il
‑
2的结合无法传导细胞内增殖信号;虽然il
‑
2rα和il
‑
2rβ也可形成高亲和力受体复合物,但无生物学功能也不能被il
‑
2活化。在不同细胞、同种细胞不同发育阶段以及疾病的不同状态下,il
‑
2受体种类表达的程度不同,从而形成不同的受体复合物。例如,lak 细胞前体表达高水平的il
‑
2rβγ复合物,受il
‑
2活化后可攻击和裂解癌细胞;巨噬细胞也表达il
‑
2rβγ复合物,也可被il
‑
2激活;单核细胞表达大量il
‑
2rγ和小量il
‑
2rβ,而nk 细胞表达大量il
‑
2rβ和小量il
‑
2rγ,它们分别形成中等亲和力的il
‑
2rβγ受体,与高浓度il
‑
2结合形成三聚体后激活单核细胞或nk细胞;活化的t细胞表面表达il
‑
2rα、il
‑ꢀ
2rβ和il
‑
2rγ,过量的il
‑
2rα有利于和il
‑
2rβ先聚合,il
‑
2rαβ与il
‑
2结合后再结合il
‑ꢀ
2rγ形成高亲和力受体
‑
il
‑
2复合物,进而传递信号,引起细胞增殖反应。细胞反应后,il
‑ꢀ
2rα、
il
‑
2rβ和il
‑
2rγ解离,细胞对il
‑
2不再敏感;人肿瘤细胞也有il
‑
2受体表达,il
‑ꢀ
2与肿瘤细胞上的受体复合物结合后可抑制肿瘤细胞的增殖,由于不同的癌细胞表达各自特殊的il
‑
2受体复合物,故改进il
‑
2结构,使其只对特异肿瘤表面的对应受体起作用,可实现只攻击癌细胞,减少对正常细胞的损害。
5.以该研究理论为基础,众多研究者针对il
‑
2进行了不同方向的改造,增强其结合抗肿瘤相关效应细胞表面的特异受体复合物(如il
‑
2rβγ复合物),活化与肿瘤杀伤相关的细胞类型,同时尽量减少与负向免疫调节t细胞(如treg细胞)表面高表达的il
‑
2rαβγ复合物的结合,这样既可达到增强药效,同时降低药物的副作用。现有的对il
‑
2的改造包括:设计特异的il
‑
2变异蛋白(例如,aron m.l.等,nature,484(7395):529
‑
33,2012),改变与il
‑
2rα、il
‑
2rβ或者il
‑
2rγ结合位点的氨基酸序列使其空间结构不利于与il
‑
2rα相互作用,或者加强与il
‑
2rβ或者il
‑
2rγ的相互作用;设计il
‑
2/抗il
‑
2抗体(或il
‑
2受体)复合物(例如,jared e.l.等,j immunother cancer,8(1):e000673,2020),利用抗 il
‑
2抗体特异性掩盖与il
‑
2r的结合位点,实现il
‑
2功能的改变以及体内半衰期的延长;将il
‑
2与fc或人血清白蛋白(hsa)进行融合表达以实现il
‑
2在体内的半衰期延长(例如,jianyonglei等,protein expression and purification,84(1):154
‑
160,2012);结合定点突变与hsa/fc融合来同时实现功能改变和半衰期延长(例如,cn 112724259a);对 il
‑
2进行非定点偶联peg化延长il
‑
2半衰期(例如,deborah h.c.等,clin cancer res, 22(3):680
‑
90,2016)。
6.上述对il
‑
2的改造研究存在如下缺陷:
7.1、单纯的氨基酸定点突变可以实现减弱与il
‑
2rα的结合能力,或者增强与il
‑
2rβ或 il
‑
2rγ的结合能力,但不能有效延长分子半衰期,且突变产物容易在体内产生免疫源性反应,容易降低产物生物学活性,并产生较大的毒性风险。
8.2、单纯的融合表达(如与fc或hsa融合)或il
‑
2修饰尽管能延长分子的半衰期,但在实际使用效果上与未经修饰的il
‑
2相比没有产生明显的优势。融合表达只能实现在目标蛋白的n末端或c末端修饰融合分子,无法实现修饰位点的最优化。
9.3、部分定点突变结合融合表达的il
‑
2在实际应用上没有表现出特殊的优势。(例如, rodrigo vazquez
‑
lombardi等,nat commun,8:15373,2017)。
10.4、常规的非定点偶联peg化il
‑
2实际应用上并没有表现出特殊的优势,综合减弱 il
‑
2rα结合能力的peg化il
‑
2取得了阶段性的成功,但非定点偶联工艺特点使其存在生产工艺和质量上难以控制、分子结构复杂、作用机制复杂等缺陷。
11.针对上述il
‑
2改造的局限性,有研究者使用密码子扩展技术开发peg定点偶联il
‑
2 (例如,wo 2019028419a1),其所使用的非天然氨基酸为lys
‑
azido,结构式如下所示:
[0012][0013]
lys
‑
azido末端的叠氮结构(
‑
n3)能与含炔烃结构(如bcn,即)修饰的载体药物(如peg等)进行化学连接得到偶联物(例如,中国专利cn 103153927b),具有很高的特异选择性。但是,该种偶联方法和化学修饰方法需引入成本较高的炔烃类结构,且使用当
量较大时才可获得可接受的药物抗体偶联比率,由此增加了相应的生产成本,工艺过程也较为复杂,工艺条件苛刻。
[0014]
综上所述,目前针对的il
‑
2改造还具有很多不足,需要对其进行进一步的研究。
技术实现要素:
[0015]
针对现有的对il
‑
2的改造方面存在的缺陷,本发明的一个目的是提供一种人白细胞介素2
‑
聚乙二醇偶联物,使用一系列全新的非天然氨基酸定点突变重组人白细胞介素2氨基酸序列中的一个或多个天然氨基酸,再将聚乙二醇(peg)通过肟化反应定点偶联在上述非天然氨基酸上,从而形成本发明的偶联物。
[0016]
本发明的另一个目的是提供所述人白细胞介素2
‑
聚乙二醇偶联物的应用,本发明提供的人白细胞介素2
‑
聚乙二醇偶联物可以用于治疗恶性实体瘤、血液肿瘤等疾病。
[0017]
在第一个方面,本发明提供了一种人白细胞介素2
‑
聚乙二醇偶联物,其包含含有至少一个非天然氨基酸的重组人白细胞介素2和偶联在所述至少一个非天然氨基酸上的peg;
[0018]
其中,所述非天然氨基酸为具有如式(i)所示结构的含有羰基端基的化合物或其对映异构体,通过所述羰基端基与含有羟胺基端基(即氨氧基)的peg形成肟键而使peg偶联在所述至少一个非天然氨基酸上,
[0019][0020]
其中,x表示
‑
o
‑
、
‑
s
‑
、
‑
nh
‑
或
‑
ch2‑
,y表示
‑
o
‑
、
‑
s
‑
、
‑
c(o)
‑
、
‑
s(o)
‑
或
‑
ch2‑
,以及 l表示取代或未取代的c0~c20直链或支链亚烷基,其中的一个或多个
‑
ch2‑
可任选地替换为
‑
o
‑
、
‑
s
‑
、
‑
nh
‑
、
‑
c(o)
‑
、
‑
s(o)
‑
中的一个或多个;
[0021]
当x表示
‑
o
‑
且y表示
‑
c(o)
‑
时,所述l不表示
‑
ch2ch2‑
;
[0022]
当所述l表示取代的基团时,取代基可以选自羟基、巯基、卤素、硝基、氰基、烷基、烯基、炔基、烷氧基、酰基、酰胺基、羧基、酯基、氨基、磺酰基、亚磺酰基、环烷基、杂环基、芳基、杂芳基中的一种或多种。
[0023]
如实施例9所示,本发明的发明人发现,除了成本昂贵、工艺复杂之外,lys
‑
azido末端的叠氮结构(
‑
n3)在插入到重组人白细胞介素2中时容易被还原为氨基结构(
‑
nh2) (如式1所示),从而失去偶联的活性,因此该还原反应降低了偶联物制备过程中的收率。
[0024][0025]
本发明所述的非天然氨基酸在其末端引入了羰基作为活性反应基团,不仅结构新颖、制备简便,而且偶联条件温和,生产成本较低,插入蛋白时不易发生结构变化而导致反应活性丧失,所得偶联物具有较好的稳定性。此外,本发明所述的非天然氨基酸中还包含有
一定链长的亚烷基,化合物的柔性较好,更容易形成偶联物。
[0026]
本发明提供的偶联物中,重组人白细胞介素2中含有的非天然氨基酸含有羰基端基,而所使用的peg中含有羟胺基端基,具有如式(ⅱ)所示结构:
[0027][0028]
非天然氨基酸中的羰基能够和peg中的羟胺基发生肟化反应形成肟键,结构如式(ⅲ) 所示,由此将peg偶联至非天然氨基酸之上。
[0029][0030]
式(ⅲ)中,d’表示本发明所述的重组人白细胞介素2中除去非天然氨基酸的羰基部分的残基,d”表示除去“nh2‑
o
‑”
端基的peg。
[0031]
与野生型il
‑
2或市售的重组人il
‑
2相比,本发明提供的偶联物具有降低的与il
‑
2rα之间的结合力,并保留与il
‑
2rβγ的结合活性,通过il
‑
2rβγ复合物对cd8
t细胞的激活保留激活和扩充cd8
t细胞的能力,同时能抑制treg细胞的扩充,在体内具有显著延长的半衰期,能够有效促进免疫、抑制肿瘤。而且,本发明提供的偶联物偶联率更高,稳定性也更好。
[0032]
在根据本发明的一些优选的实施方式中,所述重组人白细胞介素2为seq id no:3所示的蛋白或其功能活性片段。
[0033]
在根据本发明的一些优选的实施方式中,所述含有至少一个非天然氨基酸的重组人白细胞介素2中,至少一个非天然氨基酸的位置选自对应于seq id no:2的p34位、k35 位、t37位、r38位、l40位、t41位、f42位、k43位、f44位、y45位、e61位、e62 位、k64位、p65位、e67位、e68位、n71位、l72位和y107位中的一个或多个位点。在根据本发明的一些更优选的实施方式中,所述含有至少一个非天然氨基酸的重组人白细胞介素2中,至少一个非天然氨基酸的位置选自对应于seq id no:2的k35位、t41位、 k43位、y45位、e61位、k64位和p65位中的一个或多个位点。
[0034]
本发明所述的非天然氨基酸中,“c0~cn”包括c0~c1、c0~c2、
……
c0~cn,当表示c0时,意为该基团不存在,其两端的c原子直接连接成键。举例而言,所述“c0~ c6”基团是指该部分中具有0~6个碳原子,即基团不存在、包含1个碳原子、2个碳原子、3个碳原子、4个碳原子、5个碳原子或6个碳原子;所述“c6~c10”基团是指该部分中具有6~10个碳原子,即包含6个碳原子、7个碳原子、8个碳原子、9个碳原子或10 个碳原子。
[0035]
在根据本发明的一些优选的实施方式中,所述取代基可以选自羟基、巯基、卤素、硝基、氰基、c1~c6烷基、c1~c6烷氧基、酰基、酰胺基、羧基、酯基、氨基、磺酰基、亚磺酰基、c3~c8环烷基、c3~c8杂环基、c6~c20芳基、c4~c10杂芳基中的一种或多种。
[0036]
在根据本发明的一些优选的实施方式中,所述l可以表示c0~c10直链或支链亚烷基,其中的一个或多个
‑
ch2‑
可任选地替换为
‑
o
‑
;在根据本发明的一些更优选的实施方式中,所述l可以表示c0~c6直链亚烷基,其中的一个或多个
‑
ch2‑
可任选地替换为
‑
o
‑
。
[0037]
在根据本发明的一些优选的实施方式中,所述x可以表示
‑
o
‑
、
‑
s
‑
、
‑
nh
‑
或
‑
ch2‑
。
[0038]
在根据本发明的一些优选的实施方式中,所述y可以表示
‑
c(o)
‑
。
[0039]
在根据本发明的一些优选的实施方式中,所述非天然氨基酸为具有如式(i
‑
1)所示结构的化合物,
[0040][0041]
其中,所述x、y和l各自独立地如上述技术方案任一项所定义。
[0042]
在根据本发明的一些较优选的实施方式中,所述非天然氨基酸为具有如式(i
‑
2)、式(i
‑ꢀ
3)、式(i
‑
4)、式(i
‑
5)之一所示结构的化合物,
[0043][0044][0045]
其中,所述x、y各自独立地如上述技术方案任一项所定义,m、n各自独立地表示 0~8的整数(例如,0、1、2、3、4、5、6、7或8),优选表示0~5的整数,更优选表示 0、1、2或3;
[0046]
当x表示
‑
o
‑
且y表示
‑
c(o)
‑
时,m不表示1;
[0047]
r表示c1~c4直链或支链亚烷基,优选表示
‑
ch2‑
、
‑
ch2ch2‑
或
‑
ch2ch2ch2‑
;n’表示0~5的整数(例如,0、1、2、3、4或5),优选表示0~3的整数,更优选表示0、1 或2。
[0048]
本发明所述的非天然氨基酸包括光学纯的对映异构体和外消旋体。
[0049]
在根据本发明的一些更优选的实施方式中,本发明所述的非天然氨基酸为具有以下结构之一的化合物:
[0050][0051][0052]
在根据本发明的一些优选的实施方式中,本发明所述的含有羟胺基(“nh2‑
o
‑”
)端基的peg的分子量可以为10~100kd,包括但不限于约10kd、20kd、30kd、40kd、 50kd、60kd、70kd、80kd、90kd、100kd等分子量值或任意组合的分子量区间。在根据本发明的一些更优选的实施方式中,含有“nh2‑
o
‑”
端基的peg的分子量可以为 20~50kd。
[0053]
在根据本发明的一些优选的实施方式中,本发明所述的含有至少一个非天然氨基酸的重组人白细胞介素2可以通过密码子扩展技术或者通过化学合成的方式制备。在根据本发明的一些更优选的实施方式中,本发明所述的含有至少一个非天然氨基酸的重组人白细胞介素2通过密码子扩展技术制备,其中,密码子扩展技术在大肠杆菌中实现。
[0054]
本发明所述的密码子扩展技术具体可包括如下步骤:突变重组人白细胞介素2的核酸分子与编码重组人白细胞介素2的核酸分子相比,突变后的核酸分子的区别在于:对应于 seq id no:2的p34位、k35位、t37位、r38位、l40位、t41位、f42位、k43位、 f44位、y45位、e61位、e62位、k64位、p65位、e67位、e68位、n71位、l72位和 y107位中的至少一个位点的氨基酸的密码子被突变为琥珀密码子uag;使突变后的核酸分子在大肠杆菌中表达,同时通过正交trna合成酶/trna对将本发明所述的含有羰基的赖氨酸类似物(如nopk)掺入表达的重组人白细胞介素2中。所述的密码子扩展系统的工作原理为:trna
pyl
不能利用宿主细胞的赖氨酰trna酶,只能被trna
pyl rs酰化, trna
pyl rs只能酰化trna
pyl
,不能酰化其它trna,即trna
pyl
和trna
pyl rs之间具有正交性,只有trna
pyl rs可以把相应的非天然氨基酸酰化到这种正交的trna上,且只能酰化这种trna,而不能酰化其它的trna。该密码子扩展系统可使含有羰基的赖氨酸类似物与琥珀密码子uag相对应(即trna
pyl
对应的密码子为uag),从而将含有羰基的赖氨酸类似物定点引入到il
‑
2中。
[0055]
在根据本发明的一些优选的实施方式中,在大肠杆菌中表达所述突变的重组人白细胞介素2之后还包括蛋白变性、复性、超滤的步骤。
[0056]
在根据本发明的一些优选的实施方式中,重组人白细胞介素2中的非天然氨基酸与含有羟胺基的peg的肟化反应可以包括以下过程:肟化反应之前,调节突变的重组人白细胞介素2溶液的ph到约3.5~4.5(例如,使用2m的醋酸溶液调节ph到约4.0),并调节蛋白浓度至0.5~1.5mg/ml(例如,使用20mm、ph4.0的醋酸钠缓冲液),按照一定的摩尔比(例如,蛋
白:peg=1:15)投料,充分溶解,密封,在恒温摇床中摇晃反应(例如,反应30~60h)。反应之后可以通过常规检测方法(例如,rp
‑
hplc)分析偶联情况。
[0057]
在根据本发明的一些优选的实施方式中,肟化反应(即偶联反应)之后反应溶液中包含部分未反应的il
‑
2、杂蛋白、未反应完全的peg,因此还可以采用阳离子交换层析进一步进行纯化。例如可以为以下纯化过程:层析介质:capto mmc;平衡缓冲液:20mm枸橼酸钠缓冲液(ph=3.0),洗脱缓冲液:20mm枸橼酸钠缓冲液
‑
1m nacl(ph=7.8),将偶联反应液用平衡缓冲液调节ph3.0
±
0.2,电导率≤5ms/cm,上样至capto mmc,使用洗脱缓冲液进行线性洗脱(0
‑
100%的洗脱缓冲液,20cv),收集目的蛋白组分。该纯化过程可得到纯度约为95%的目标蛋白样品。
[0058]
在第二个方面,本发明还提供了上述技术方案任一项所述的人白细胞介素2
‑
聚乙二醇偶联物在制备促进免疫、预防和/或治疗实体瘤(尤其是恶性实体瘤)和血液肿瘤、和/或扩充cd8
t细胞的药物中的用途。
[0059]
在根据本发明的一些优选的实施方式中,所述实体瘤为膀胱癌、骨癌、脑癌、乳腺癌、结直肠癌、食道癌、眼癌、头颈癌、肾癌、肺癌、黑素瘤、卵巢癌、胰腺癌或前列腺癌。
[0060]
在根据本发明的一些优选的实施方式中,所述血液肿瘤为慢性淋巴细胞白血病(cll)、小淋巴细胞性淋巴瘤(sll)、滤泡性淋巴瘤(fl)、弥漫性大b细胞淋巴瘤(dlbcl)、套细胞淋巴瘤(mcl)、瓦尔登斯特伦巨球蛋白血症、多发性骨髓瘤、结外边缘区b细胞淋巴瘤、结边缘区b细胞淋巴瘤、伯基特淋巴瘤、非伯基特高恶性b细胞淋巴瘤、原发性纵隔b细胞淋巴瘤(pmbl)、免疫母细胞性大细胞淋巴瘤、前体b淋巴母细胞淋巴瘤、b细胞幼淋巴细胞白血病、淋巴浆细胞性淋巴瘤、脾边缘区淋巴瘤、浆细胞骨髓瘤、浆细胞瘤、纵膈(胸腺)大b细胞淋巴瘤、血管内大b细胞淋巳瘤、原发性渗出性淋巴瘤或淋巴瘤样肉芽肿病。
[0061]
在第三个方面,本发明还提供了一种试剂盒,其包含上述任一所述的人白细胞介素2
‑ꢀ
聚乙二醇偶联物。
[0062]
在第四个方面,本发明还提供了一种预防和/或治疗实体瘤(尤其是恶性实体瘤)或血液肿瘤的方法,包括向有需要的患者施用治疗有效量的上述任一所述的人白细胞介素2
‑
聚乙二醇偶联物的步骤。
[0063]
在根据本发明的一些优选的实施方式中,所述实体瘤为膀胱癌、骨癌、脑癌、乳腺癌、结直肠癌、食道癌、眼癌、头颈癌、肾癌、肺癌、黑素瘤、卵巢癌、胰腺癌或前列腺癌。
[0064]
在根据本发明的一些优选的实施方式中,所述血液肿瘤为慢性淋巴细胞白血病(cll)、小淋巴细胞性淋巴瘤(sll)、滤泡性淋巴瘤(fl)、弥漫性大b细胞淋巴瘤(dlbcl)、套细胞淋巴瘤(mcl)、瓦尔登斯特伦巨球蛋白血症、多发性骨髓瘤、结外边缘区b细胞淋巴瘤、结边缘区b细胞淋巴瘤、伯基特淋巴瘤、非伯基特高恶性b细胞淋巴瘤、原发性纵隔b细胞淋巴瘤(pmbl)、免疫母细胞性大细胞淋巴瘤、前体b淋巴母细胞淋巴瘤、b细胞幼淋巴细胞白血病、淋巴浆细胞性淋巴瘤、脾边缘区淋巴瘤、浆细胞骨髓瘤、浆细胞瘤、纵膈(胸腺)大b细胞淋巴瘤、血管内大b细胞淋巳瘤、原发性渗出性淋巴瘤或淋巴瘤样肉芽肿病。
[0065]
在根据本发明的一些优选的实施方式中,所述人白细胞介素2
‑
聚乙二醇偶联物可以单独施用或者与其他一种或多种抗肿瘤药物联用。
[0066]
本发明提供的技术方案具有以下优点:
[0067]
(1)通过密码子扩展技术,能够将本发明所述的新型的非天然氨基酸引入至指定
位点,从而实现peg与白介素
‑
2的精确定点偶联,克服了传统随机偶联方式无法精确偶联的缺点,且产物均一性高。
[0068]
(2)本发明所述的非天然氨基酸为结构中含有端基羰基的赖氨酸类似物,相对于常见的含有叠氮基团的赖氨酸类似物(例如,lys
‑
azido),制备更简便,安全性更好,插入蛋白时不易失活,与peg的结合率更高,所得偶联物的稳定性也更好,在重组蛋白包涵体变复性后仍能有超过95%的偶联效率。
[0069]
(3)通过突变位点的设计与筛选,本发明获得了可降低il
‑
2rα结合活性,并保持il
‑ꢀ
2rβ和il
‑
2rγ结合活性相对不变的白介素
‑
2突变位点,使得该定点修饰的人白细胞介素 2
‑
聚乙二醇偶联物在肿瘤微环境中特异性促进cd8
t细胞的增殖,而对cd4
t细胞的增殖无明显作用,从而有利于肿瘤的免疫治疗。
[0070]
(4)本发明的偶联物通过peg的偶联实现了il
‑
2在体内半衰期的延长,由此可降低患者的给药频率。
附图说明
[0071]
图1为表达质粒nb1s3
‑
wt示意图。
[0072]
图2为辅助质粒nb1w示意图。
[0073]
图3为实施例2所得的不同突变位点的rhil
‑
2表达菌株在添加非天然氨基酸nopk后获得的发酵产物的sds
‑
page电泳图(箭头所指为目的产物条带位置);其中,泳道1:投料nopk的rhil2
‑
k35
‑
bl21菌体破碎、离心后沉淀;泳道2:投料nopk的rhil2
‑
t41
‑ꢀ
bl21菌体破碎、离心后沉淀;泳道3:投料nopk的rhil2
‑
k43
‑
bl21菌体破碎、离心后沉淀;泳道4:投料nopk的rhil2
‑
y45
‑
bl21菌体破碎、离心后沉淀;泳道5:投料nopk 的rhil2
‑
e61
‑
bl21菌体破碎、离心后沉淀;泳道6:投料nopk的rhil2
‑
k64
‑
bl21菌体破碎、离心后沉淀;泳道7:投料nopk的rhil2
‑
p65
‑
bl21菌体破碎、离心后沉淀;泳道 8:投料nopk的rhil2
‑
y45
‑
bl21菌体沉淀经洗涤后得到的包涵体。
[0074]
图4a和图4b分别为实施例3中突变型rhil
‑
2与peg偶联前、后的rp
‑
hplc图谱;其中,图4a显示偶联前的各个突变型rhil
‑
2,其中约22.5min处为目标蛋白主峰;图4b 显示偶联后的各个突变型rhil
‑
2(peg均为30kd peg),其中约21min处为目标蛋白主峰。
[0075]
图5为实施例4中偶联物30kd peg
‑
rhil2
‑
y45柱层析前、后的rp
‑
hplc图谱。
[0076]
图6为实施例9中的rhgh
‑
v91的质谱图。
具体实施方式
[0077]
以下结合具体实施例对本发明的技术方案做进一步详细说明。
[0078]
本发明的制备例、实施例中所使用的试剂或原料如无特别说明均为商购产品;所使用的实验方法如无特别说明均为本领域常规方法。
[0079]
人yt细胞在文献“yodoi,j.等.(1985).tcgf(il 2)
‑
receptor inducing factor(s).i. regulation of il 2 receptor on a natural killer
‑
like cell line(yt cells).journal of immunology, 134(3),1623
‑
1630”中公开过,公众可从浙江新码生物医药有限公司获得。
[0080]
制备例1非天然氨基酸nobk的制备
[0081]
nobk的结构式如下所示:
[0082][0083]
反应过程如下所示:
[0084][0085]
制备过程包括以下步骤:
[0086]
a)在反应烧瓶中,加入3
‑
丁烯
‑1‑
醇(2.00g,27.74mmol),加入溶剂dcm(15.0ml),在0c
°
下加入cdi(4.50g,27.74mmol),混合物在室温下反应18小时后,加入水10ml,用dcm萃取3次,合并有机相,加入无水硫酸钠干燥,过滤,减压浓缩后得到产物1
‑
1 (4.50g,收率98%)。
[0087]
b)在反应烧瓶中,加入产物1
‑
1(0.55g,3.31mmol)和fmoc
‑
赖氨酸盐酸盐(1.12g,2.76 mmol),加入溶剂二氧六环9ml和水3ml(v/v=3:1),再加入三乙胺(0.70g,6.9mmol),混合物在室温下反应24小时后,加入1m hcl溶液20ml,调ph至2左右,用乙酸乙酯萃取3次,合并有机相,加入无水硫酸钠干燥,过滤,减压浓缩,经柱层析(洗脱剂: dcm:meoh=30:1)纯化后得到产物1
‑
2(0.17g,收率14%)。
[0088]
c)在两口反应烧瓶中,加入产物1
‑
2(0.13g,0.28mmol)、硫酸铁(0.17g,0.42mmol)和氯化钯(15mg,0.03mmol),加入溶剂乙腈3ml和水0.5ml,混合物在60℃下回流24小时后,降至室温,用dcm萃取3次,合并有机相,减压浓缩,经柱层析(洗脱剂: dcm:meoh=20:1)纯化后得到产物1
‑
3(91.0mg,收率68%)。
[0089]
d)在反应烧瓶中,将产物1
‑
3(91.0mg,0.19mmol)溶于dcm(2ml)中,加入哌啶(36.4 mg,0.43mmol),在室温下反应3小时,减压浓缩,经柱层析(洗脱剂: dcm:meoh:h2o=40:10:1)纯化后即得目标产物nobk 1
‑
4(20.1mg,收率41%)。
[0090]1h nmr(400mhz,重水)δ4.20(t,j=6.8hz,2h),3.64(t,j=6.0hz,1h),3.02(t,j=6.0hz,2h),2.16(s,3h),2.07
–
1.80(m,4h),1.69
–
1.52(m,2h),1.52
–
1.36(m,2h).
[0091]
制备例2非天然氨基酸nohk的制备
[0092]
nohk的结构式如下所示:
[0093][0094]
反应过程如下所示:
[0095][0096]
制备过程包括以下步骤:
[0097]
a)在反应烧瓶中,加入5
‑
氧代己酸(2.60g,20.0mmol)、n
‑
羟基丁二酰亚胺(2.30g,20.0 mmol)、edci(3.83g,20.0mmol),加入溶剂dcm(100ml),混合物在室温下反应18小时,用水洗涤3次,无水硫酸钠干燥,减压浓缩后得到产物2
‑
1(4.62g,收率102%),无需纯化直接用于下一步。
[0098]
b)在反应烧瓶中,加入产物2
‑
1(4.62g,20.35mmol)和boc
‑
赖氨酸(4.42g,16.96mmol),再加入dipea(4.07ml,42.4mmol),加入溶剂dmf(50ml),混合物在40℃下反应24小时,用水洗涤5次,加入无水硫酸钠干燥,过滤,减压浓缩,经柱层析(洗脱剂: dcm:meoh=30:1)纯化后得到产物2
‑
2(4.36g,收率60%)。
[0099]
c)在反应烧瓶中,加入产物2
‑
2(4.36g),加入溶剂dcm(10ml)和等量的三氟乙酸 (tfa)10ml,混合物在室温下搅拌20分钟,减压浓缩,再多次加入乙腈溶剂,在减压浓缩下除去多余三氟乙酸,得到目标产物nohk 2
‑
3(4.10g,产率91%)。
[0100]1h nmr(400mhz,重水)δ3.75(t,j=6.0hz,1h),3.21(t,j=6.8hz,2h),2.61(t,j= 7.2hz,2h),2.26(d,j=7.4hz,2h),2.23(s,3h),1.96
–
1.79(m,4h),1.63
–
1.52(m,2h),1.49
ꢀ–
1.34(m,2h).
[0101]
制备例3非天然氨基酸nopk的制备
[0102]
nopk的结构式如下所示:
[0103][0104]
反应过程如下所示:
[0105][0106]
制备过程包括以下步骤:
[0107]
a)在反应瓶中,加入溴丙烯(18.15g,0.15mol),加入dmso(60ml),降温至0℃,加入乙二醇(37.26g,0.6mol)、dmso(120ml)、koh(10.11g,0.18mol)和水(30ml),在该温度下反
no:5所示。
[0116]
seq id no:1
[0117][0118]
seq id no:2
[0119][0120]
seq id no:3
[0121][0122]
seq id no:4
[0123][0123][0124]
seq id no:5
[0125]
[0126]
[0127][0128]
2、定点突变位点的选择
[0129]
选取seq id no:2的p34位、k35位、t37位、r38位、l40位、t41位、f42位、k43位、f44位、y45位、e61位、e62位、k64位、p65位、e67位、e68位、n71位、l72位和y107位为特定位点进行点突变,以此突变型il
‑
2为原料并对其进行定点修饰。
[0130]
3、定点突变的引物设计以及突变载体的构建
[0131]
针对seq id no:2的p34位、k35位、t37位、r38位、l40位、t41位、f42位、k43位、 f44位、y45位、e61位、e62位、k64位、p65位、e67位、e68位、n71位、l72位和y107位这几个位点,分别设计能够使编码所述氨基酸的密码子突变为琥珀密码子的引物,具体引物如表1所示。
[0132]
表1 突变引物列表
[0133]
[0134]
[0135][0136]
以限制性dna内切酶xbai和xhoi双酶切质粒nb1s3
‑
wt,得到线性化dna质粒,以其为模板,利用高保真dna聚合酶(购自takara,货号为r045a),以表1的引物xbai
‑
f配对各位点的引物r,表1的引物xhoi
‑
r配对各位点的引物f,通过pcr扩增和重叠pcr方法获得 il
‑
2的k35、t41、k43、y45、e61、k64和p65这几个位点的氨基酸密码子突变为琥珀终止密码子的突变基因(例如,以线性化质粒nb1s3
‑
wt为模板,以xbai
‑
f和t41
‑
r为引物对进行pcr扩增,得到t41位点突变的上游片段;以线性化质粒nb1s3
‑
wt为模板,以xhoi
‑
r和 t41
‑
f为引物对进行pcr扩增,得到t41位点突变的下游片段;然后以上述获得的t41位点突变的上游片段和
t41位点突变的下游片段为模板,以xbai
‑
f和xhoi
‑
r为引物对进行重叠pcr 扩增,得到t41位点突变的全长基因),再利用高保真dna组装克隆试剂盒(购自neb,货号为e5520s),按说明书操作将获得的突变基因分别替换nb1s3
‑
wt质粒的xbai和xhoi两个酶切位点之间的片段,构建得到7种表达质粒nb1s3
‑
k35、nb1s3
‑
t41、nb1s3
‑
k43、 nb1s3
‑
y45、nb1s3
‑
e61、nb1s3
‑
k64和nb1s3
‑
p65,经测序验证突变成功。
[0137]
4、定点突变的rhil
‑
2表达株的构建
[0138]
参考文献(chatterjee,a.等,biochemistry,52(10),1828
‑
1837,2013)记载的质粒pultra 结构,通过基因全合成方式获得含有特异识别如本发明式(ⅰ)所示结构的含有羰基端基的赖氨酸类似物的trna和trna合成酶编码基因(野生型古甲烷球菌吡咯赖氨酸合成酶和对应trna的编码基因)和氯霉素抗性基因(seq id no:46),再通过pcr扩增方式从商业化载体pcdf
‑
duet1中扩增出包含clodf13复制起始位点的dna片段(seq id no:47),利用高保真dna组装克隆试剂盒一步亚克隆连接两个dna片段,得到辅助质粒nb1w (见图2,以下简称该质粒为辅助质粒),该质粒的筛选标记为氯霉素抗性。分别将辅助质粒和步骤3得到的表达质粒(壮观霉素抗性),共同转化大肠杆菌bl21(de3),经壮观霉素抗性和氯霉素抗性平板筛选出双阳性菌株(双阳性菌株表示同时获得壮观霉素抗性和氯霉素抗性的菌株):rhil2
‑
k35
‑
bl21、rhil2
‑
t41
‑
bl21、rhil2
‑
k43
‑
bl21、rhil2
‑
y45
‑
bl21、 rhil2
‑
e61
‑
bl21、rhil2
‑
k64
‑
bl21、rhil2
‑
p65
‑
bl21。
[0139]
包含野生型古甲烷球菌吡咯赖氨酸合成酶编码基因、对应trna编码基因以及氯霉素抗性基因的dna片段(seq id no:46)如下:
[0140]
[0141][0142]
clodf13复制起始位点的dna片段(seq id no:47)如下:
[0143][0144]
实施例2定点突变插入非天然氨基酸的rhil
‑
2的表达和纯化
[0145]
1、突变型rhil
‑
2的非天然氨基酸掺入表达
[0146]
将实施例1获得的7种表达菌株rhil2
‑
k35
‑
bl21、rhil2
‑
t41
‑
bl21、rhil2
‑
k43
‑
bl21、 rhil2
‑
y45
‑
bl21、rhil2
‑
e61
‑
bl21、rhil2
‑
k64
‑
bl21、rhil2
‑
p65
‑
bl21分别接种至lb培养基(酵母提取物5g/l,胰蛋白胨10g/l,nacl 10g/l,含100mg/l壮观霉素和37.5mg/l 氯霉素)中,37℃培养5
‑
8小时后进行二级扩种(培养基组成与之前相同)至菌液od
600
为 2.0
±
0.2,得到二级种子液。
[0147]
将上述二级种子液接种于发酵培养基中进行发酵培养,在5l发酵罐中实施,培养体积为2l,培养基为2
×
yt培养基(酵母提取物16g/l,胰蛋白胨10g/l,nacl 5g/l),接种量:5%(v/v);培养温度:37℃;ph控制:6.90
±
0.05,必要时自动流加氨水或h3po4; do控制:30%,do关联转速;菌液od
600
至20.0
±
2.0时,添加iptg和制备例3所得的非天然氨基酸nopk,终浓度均为1mm,同时开始补料50%甘油,补料速度0.6
±
0.1ml/min;诱导表达5
‑
6小时后收集菌体。各个菌株的sds
‑
page电泳图见图3。
[0148]
2、突变型rhil
‑
2的分离提取
[0149]
将上述收集的菌体分别用缓冲液(25mm tris,6mm edta,1mm dtt,ph8.0)重悬,加入1%dna酶(1mg/ml)、0.5%pmsf,混合均匀,用超高压均质机在50
‑
80mpa 压力下均质3次;将均质液10000rpm离心20min,收集下层包涵体粗体。
[0150]
将得到的包涵体粗体用洗涤缓冲液(20mm tris
‑
hcl,100mm nacl,2%tritonx
‑
100, ph8.0)清洗两次后,再用超纯水清洗一次,获得纯化包涵体。
[0151]
将纯化包涵体用变性缓冲液(20mm tris
‑
hcl,100mm nacl,6m盐酸胍,1mm dtt, ph8.0)溶解,30min后10000rpm离心,收集上清即为变性蛋白溶液。将4倍体积的复性缓冲液(20mm tris
‑
hcl,100mm nacl,ph8.0)加入收集的变性蛋白溶液中,充分搅拌后静置12h,10000rpm离心收集上清即为复性蛋白溶液。
[0152]
将复性蛋白溶液用截留分子量为5kda的超滤膜包(millipore,biomax
‑
5)浓缩至原体积1/4,使用置换缓冲液(20mm tris
‑
hcl,ph8.0)换液至电导约为2ms/cm,并进一步浓缩至蛋白浓度约为0.5
‑
1mg/ml,10000rpm离心后收集上清即为突变型rhil
‑
2粗蛋白 rhil2
‑
k35、rhil2
‑
t41、rhil2
‑
k43、rhil2
‑
y45、rhil2
‑
e61、rhil2
‑
k64、rhil2
‑
p65,可直接用于后续peg偶联。
[0153]
实施例3peg与定点突变插入非天然氨基酸nopk的rhil
‑
2的定点偶联
[0154][0155]
peg与定点突变插入非天然氨基酸的rhil
‑
2的定点偶联如式2的合成路线所示(其中 p1到p2的方向为氨基酸序列的n末端到c末端方向)。
[0156]
以30kd氨氧基peg(即羟胺基peg)肟化反应偶联rhil
‑
2为例,偶联反应操作如下:在偶联反应前,用2m醋酸溶液调节上述获得的目的蛋白至ph为4.0,20mm醋酸钠缓冲液(ph4.0)调节蛋白浓度至约1mg/ml,按照1:15(摩尔比,蛋白:氨氧基peg) 加入30kd氨氧基
peg固体(购自北京键凯科技有限公司),充分摇晃溶解,得到澄清透明溶液,之后将反应液密封,在恒温摇床(25℃,100rpm)中摇晃反应。48h后使用rp
‑ꢀ
hplc分析偶联情况,见图4a和4b。结果显示,图4b中仅有微弱的rhil
‑
2峰,表明7 种目标蛋白均实现了peg偶联,偶联率(100%
‑
偶联结束后残留的rhil
‑
2浓度/偶联反应零时的rhil
‑
2浓度
×
100%)均大于95%,进一步表明了上述非天然氨基酸nbok插入了目标蛋白中。
[0157]
偶联了peg之后的突变型rhil
‑
2蛋白分别称为:30kd peg
‑
rhil2
‑
k35、30kd peg
‑ꢀ
rhil2
‑
t41、30kd peg
‑
rhil2
‑
k43、30kd peg
‑
rhil2
‑
y45、30kd peg
‑
rhil2
‑
e61、30kd peg
‑ꢀ
rhil2
‑
k64和30kd peg
‑
rhil2
‑
p65。
[0158]
rp
‑
hplc分析条件如下:
[0159]
流动相a(0.1%tfa
‑
h2o);
[0160]
流动相b(0.1%tfa
‑
acn)。
[0161][0162][0163]
实施例4定点修饰的30kd peg
‑
rhil2的纯化
[0164]
层析介质:capto mmc;平衡缓冲液:20mm枸橼酸钠缓冲液(ph=3.0),洗脱缓冲液:20mm枸橼酸钠缓冲液
‑
1m nacl(ph=7.8)。
[0165]
纯化过程具体包括:将实施例3所得的30kd peg
‑
rhil2
‑
k35、30kd peg
‑
rhil2
‑
t41、 30kd peg
‑
rhil2
‑
k43、30kd peg
‑
rhil2
‑
y45、30kd peg
‑
rhil2
‑
e61、30kd peg
‑
rhil2
‑
k64 和30kd peg
‑
rhil2
‑
p65偶联反应液分别用平衡缓冲液调节ph3.0
±
0.2,电导率≤5ms/cm,上样至capto mmc,使用洗脱缓冲液进行线性洗脱(0
‑
100%的洗脱液,20cv),收集目的蛋白组分,即可得到纯度约为95%的目的蛋白样品。以30kd peg
‑
rhil2
‑
y45为例,纯化后的偶联物30kd peg
‑
rhil2
‑
y45和偶联前的rhil2
‑
y45的典型rp
‑
hplc图谱见图5。其他蛋白样品的纯化结果与之类似。
[0166]
实施例5定点修饰的30kd peg
‑
rhil2的体外活性评价(stat5磷酸化实验)
[0167]
本方法采用两种细胞株,小鼠ctll
‑
2细胞为含有il
‑
2rαβγ的细胞株,人yt细胞为含有il
‑
2rβγ的细胞株,rhil
‑
2通过与细胞表面il
‑
2r结合,激活jak
‑
stat信号通路。各样品的修饰位点不同,对两种细胞的相对活性不同,yt细胞/ctll
‑
2细胞ec50比值变化百分比越低,样品可促进免疫功能的效果越好;相反,则抑制免疫功能的效果越好。
[0168]
具体过程如下:小鼠ctll
‑
2细胞(购自american type culture collection)和人yt 细胞用各自培养基(ctll
‑
2细胞培养基:rpmi 1640 10%fbs 400iu/ml rhil
‑
2、2mml
‑
谷氨酰胺、1mm丙酮酸钠;yt细胞培养基:rpmi 1640 10%fbs 1mm non
‑
essentialamino acids solution(购自gibco,产品目录号为11140050))于37℃、5%二氧化碳条件下培养至足够量,在检测前饥饿4h,然后调整细胞密度为1
×
106细胞/ml备用。将30kdpeg
‑
rhil2
‑
k35、30kd peg
‑
rhil2
‑
t41、30kd peg
‑
rhil2
‑
y45、30kd peg
‑
rhil2
‑
e61和 30kd peg
‑
rhil2
‑
p65和偶联前的rhil2
‑
k35、rhil2
‑
t41、rhil2
‑
y45、rhil2
‑
e61、rhil2
‑
p65 样品以及rhil
‑
2参比品(购自北京索莱宝科技有限公司,货号:p00020)分别梯度稀释,每种样品共6个浓度(ctll
‑
2细胞实验中,参比品的浓度范围为0.004~4ng/ml,4倍梯度稀释;yt细胞实验中,参比品的浓度范围为2.1~510ng/ml,3倍梯度稀释;其他样品的浓度范围通过预实验筛选获得,并与表2中相应的ec50值相对应),37℃刺激细胞10 分钟,然后裂解细胞,进行western blot实验,采用pstat5抗体(购自cst,产品目录号为9359l)和β
‑
actin(购自cst,产品目录号为8457s)杂交,检测细胞裂解液中pstat5 和β
‑
actin蛋白量,根据pstat5/β
‑
actin灰度结果和样品浓度计算ec50。结果见表2。结果表明,k35、t41、y45、e61、p65位点插入非天然氨基酸nopk并偶联30kd peg的 rhil2均达到了最初的设计要求(以参比品作为对照,ec50比值变化百分比低于参比品)。
[0169]
表2 stat5磷酸化实验结果
[0170][0171]
*计算公式为:[30kd peg
‑
rhil2样品的yt细胞ec50/30kd peg
‑
rhil2样品的ctll
‑
2 细胞ec50]/[参比品的yt细胞ec50/参比品的ctll
‑
2细胞ec50]
×
100%
[0172]
实施例6小鼠体内的药代动力学研究
[0173]
实验采用雌性c57小鼠(spf级,购自浙江维通利华实验动物技术有限公司),以泉奇rhil
‑
2(购自山东泉港药业有限公司)作为阳性对照药物,考察受试物30kd peg
‑
rhil2
‑ꢀ
y45在小鼠体内的代谢情况。30kd peg
‑
rhil2
‑
y45和泉奇rhil
‑
2分别以1mg/kg单次静脉注射给药,分别按以下采血点采血,每个点0.5ml(n=5):给药前、给药后0.0833h、 0.5h、1h、4h、8h、16h、24h,此外30kd peg
‑
rhil2
‑
y45多设5个采血点:48h、72 h、96h、120h、144h。血样
室温放置15min,6800g/min离心6min得到血清。血清按以下方法进行血药浓度分析:
[0174]
(1)包被:向高吸附96孔板中,每孔加入50μl 1μg/ml的anti
‑
il
‑
2抗体(购自 abcam,产品目录号为ab9618)工作液,2~8℃孵育过夜。(2)清洗:弃孔内液体,用1
×
pbst (0.05%tween
‑
20)洗涤3次,300μl/孔。(3)封闭:按200μl/孔加入酪蛋白封闭液(购自thermo,产品目录号为37528),室温条件下静置90min。(4)清洗:弃孔内液体,用 1
×
pbst洗涤3次,300μl/孔。(5)加样:用小鼠血清梯度稀释泉奇rhil
‑
2、30kd peg
‑ꢀ
rhil2
‑
y45和待测血清样品,按50μl/孔转入微孔板,室温静置120min。(6)清洗:弃孔内液体,用1
×
pbst洗涤3次,300μl/孔。(7)一抗:每孔加入50μl 0.25μg/ml的il
‑ꢀ
2monoclonal antibody(bg5),biotin(购自invitrogen,产品目录号为m600b)工作液,室温静置60min。(8)清洗:弃孔内液体,用1
×
pbst洗涤3次,300μl/孔。(9)二抗:将pierce
tm high sensitivity streptavidin
‑
hrp(购自thermo,产品目录号为21130)用酪蛋白封闭液稀释4000倍,每孔加入50μl,室温静置60min。(10)清洗:弃孔内液体,用 1
×
pbst洗涤4次,300μl/孔。(11)底物:每孔加入50μl 1
‑
step
tm turbo tmb
‑
elisasubstrate solution(购自thermo,产品目录号为34022)。(12)终止并读数:25min后加入2m硫酸终止液,在酶标仪(购自perkin elmer,型号为ensight)上读取450nm和650 nm处的吸光值。(13)分析:通过dazdaq ltd.workout 1.5分析软件进行四参数拟合,输入对应泉奇rhil
‑
2和30kd peg
‑
rhil2
‑
y45的浓度和单位,二者各拟合一条曲线,分别计算待测血清的血药浓度。根据das软件的非房室模型(统计矩参数)算出泉奇rhil
‑
2和 30kd peg
‑
rhil2
‑
y45的平均半衰期t
1/2
分别为0.77h和14.69h。泉奇rhil
‑
2和30kd peg
‑ꢀ
rhil2
‑
y45的药动学参数见表3。
[0175]
表3 泉奇rhil
‑
2和30kd peg
‑
rhil2
‑
y45的药动学参数(n=5)
[0176][0177]
实施例7小鼠体内的药效学研究——抗肿瘤活性
[0178]
实验采用雌性balb/c小鼠(spf级,浙江维通利华实验动物技术有限公司),分别将 2
×
105/0.1ml/小鼠ct26.wt(购自atcc,产品目录号为crl
‑
2638)细胞悬液和 4
×
105/0.1ml/小鼠h22(购自cctcc,产品目录号为gdc0091)细胞悬液接种至小鼠右侧背部皮下,在肿瘤体积达到50mm3左右时,随机分组,每组7只小鼠,分别给予溶媒(1
ꢀ×
pbs)、0.7mg/kg 30kd peg
‑
rhil2
‑
t41、5.0mg/kg 30kd peg
‑
rhil2
‑
t41、0.7mg/kg 30kdpeg
‑
rhil2
‑
y45、5.0mg/kg 30kd peg
‑
rhil2
‑
y45(给药体积均为10ml/kg)。实验期间每周3次测定动物体重和肿瘤体积,给药方式和实验结果见表4。相对抑制率tgi
tw
(%)计算公式为:(t
wc
‑
t
wt
)/t
wc
×
100%,其中t
wc
为溶媒对照组平均肿瘤重量,t
wt
为治疗组平均肿瘤重量。
[0179]
结果表明,相比溶媒组,2个受试物的高低剂量组对小鼠结肠癌ct26.wt和小鼠肝癌 h22同种移植瘤均有显著的抑制作用。
[0180]
表4 受试物在ct26.wt和h22同种移植瘤模型中的给药方式及对动物肿瘤重量的影响
[0181][0182]
注:*:p<0.05;**:p<0.01;***:p<0.001,与溶媒组相比。
[0183]
实施例8小鼠体内的药效学研究——免疫细胞群的表达
[0184]
实验采用雌性balb/c小鼠(spf级,浙江维通利华实验动物技术有限公司),将 2
×
105/0.1ml/小鼠ct26.wt细胞悬液接种至小鼠右侧背部皮下,在肿瘤体积达到100mm3左右时,随机分组,每组3只小鼠,按表5分别给予各受试物和泉奇rhil
‑
2(购自山东泉港药业有限公司),给药体积为10ml/kg。在第5天时,收取各组肿瘤组织样本进行流式检测cd8
t cells和cd4
treg细胞群比例的变化,结果如表5所示。
[0185]
表5 受试物在ct26.wt同种移植瘤模型中的给药方式及对免疫细胞群的影响
[0186]
[0187][0188]
与泉奇rhil2相比,30kd peg
‑
rhil2
‑
t41和30kd peg
‑
rhil2
‑
y45的cd8
t细胞比例显著增加,cd4
treg细胞比例显著减少,cd8
t/cd4
treg的比例显著增加,表现出了优异的增强免疫的药效。
[0189]
实施例9lys
‑
azido的活性基团还原现象
[0190]
参考实施例1中的方法,构建第91位氨基酸(缬氨酸)密码子突变为琥珀密码子的 rhil
‑
2(简称rhgh
‑
v91)表达菌株,构建过程中用到的引物如下:
[0191]
v91
‑
f:5
’‑
gatttccaatatcaactagattgttctggaactga
‑3’
(seq id no:48)
[0192]
v91
‑
r:5
’‑
tcagttccagaacaatctagttgatattggaaatc
‑3’
(seq id no:49)。
[0193]
参考实施例2,利用上述rhgh
‑
v91表达菌株,通过在发酵过程中添加lys
‑
azido,表达第91位突变为lys
‑
azido的rhil
‑
2,并通过实施例2中相应纯化手段提纯。将该第91位突变为lys
‑
azido的rhil
‑
2通过液质联用(高分辨质谱仪:xevog2
‑
xs q
‑
tof,waters公司;超高效液相色谱:uplc(acquity uplc i
‑
class),waters公司)分析完整分子量,如图6所示。结果显示样品中出现比理论分子量(15672.75da)小约26da的组分,推断为由lys
‑ꢀ
azido末端的叠氮结构(
‑
n3)被还原为(
‑
nh2)的产物。
[0194]
lys
‑
azido的还原会导致突变为lys
‑
azido的rhil
‑
2无法与bcn
‑
peg进行偶联,由此会降低偶联率。包含本发明的非天然氨基酸的rhil
‑
2与peg进行偶联时,偶联率明显得到了提高,因此显著提高了反应效率。
[0195]
除非特别限定,本发明所用术语均为本领域技术人员通常理解的含义。
[0196]
本发明所描述的实施方式仅出于示例性目的,并非用以限制本发明的保护范围,本领域技术人员可在本发明的范围内作出各种其他替换、改变和改进,因而,本发明不限于上述实施方式,而仅由权利要求限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。