1.本发明涉及兽用生物制品技术领域,具体涉及一种i群e种8a型禽腺病毒毒株、灭活疫苗及其制备方法和应用。
背景技术:
2.禽腺病毒(fowladenoviruses)属于腺病毒科的禽腺病毒属成员,为无囊膜的双股dna病毒。禽腺病毒可分为三个群:禽i群腺病毒具有共同的群抗原,基于交叉中和试验的测定分为5个类型(fav a~e),包含12个血清型,代表毒株有血清4型禽i群腺病毒;ii群fav包括火鸡出血性肠炎病毒、雉鸡大理石脾病毒和禽类脾肿大病毒;iii群fav仅包含减蛋综合征病毒(edsv
‑
76)。禽i群腺病毒具体分为a、b、c、d、e等5个基因型,按照血清型分为1、2、3、4、5、6、7、8a、8b、9、10、11型;基因型和血清型的对应关系为a(1)、b(5)、c(4、10)、d(2、3、9、11)、e(6、7、8a、8b)。禽腺病毒在感染初期呈隐性感染,死亡率较低,到了感染后期的时候,不同疾病表现出不同的致病性,临床上由禽腺病毒引起的疾病主要有肌胃糜烂、包涵体肝炎和心包积液-肝炎综合征等。自2012年以来,我国疫情呈上升趋势。
3.血清8型禽腺病毒又分为8a血清型和8b血清型,主要感染3
‑
8周龄的各种鸡只,总体死亡率通常在10%以下,但有时可达到30%。该病的特征性病理变化为包涵体肝炎,表现为肝脏褪色呈淡褐色至黄色,质脆易碎,肿胀、呈脂肪变性,表面有不同程度的出血点或出血斑,伴发局灶性坏死,在肝细胞核内可见嗜碱性或嗜酸性的包涵体,边缘较大而清晰,呈圆形或形状不规则。有些病例脾脏肿大、出血。组织病理学特征性变化主要为:肝细胞发生脂肪样变并伴有空泡变性以及部分细胞发生破裂,肝细胞萎缩等。在大多数病例中,肝索分解,肝细胞呈现明显的空泡化,染色切片显示肝细胞明显的空泡化是由脂肪变性引起的。变性和坏死的灶性区域在整个肝组织中随机分布。大多数肝细胞可见不同程度的萎缩、核裂解和核溶解并留下一个或多个大空泡组成的悬浮细胞。部分肝细胞可见细胞核肿胀和染色质边缘化。在许多变性的肝细胞中发现了cowdry a型核内包涵体。禽i群腺病毒的12个血清型均能使包涵体肝炎发生,但主要是fadv
‑
2、fadv
‑
8a、fadv
‑
8b和fadv
‑
11,因血清型和毒株的不同其致病性也存在差异。我国自2012年在10~20周龄的蛋鸡群中开始出现包涵体肝炎,近些年该病在我国的发病率呈上升趋势,给我国的养鸡业造成很大的经济损失。
4.禽i群腺病毒既可垂直传播,也可水平传播,但主要以垂直传播为主。病毒可以通过种蛋孵化的形式进行垂直传播,此外也有在鸡胚肾细胞、鸡胚肝细胞。以及鸡场发病的雏鸡体内检测到病毒的相关报道。虽然在1日龄的雏鸡体内就可以分离到病毒,但通常情况下病鸡在感染3周后才开始出现排毒,肉鸡的排毒高峰在4~6周龄,蛋鸡在5~9周龄。病毒主要通过直接接触发病鸡只的粪便进行水平传播,但在小范围内,病毒也可通过空气长时间缓慢传播。
5.由禽i群腺病毒引起的鸡包涵体肝炎,给各国的家禽养殖业造成很大的经济损失,目前市场上使用的大多数疫苗鸡胚或组织灭活苗,免疫效果不太理想。禽i群腺病毒的血清型较多,其病毒特性和致病性差异较大,增大了疫苗研制和应用的难度。e8a作为新近流行
的血清型,缺乏具有针对性的疫苗。
技术实现要素:
6.本发明的目的在于提供一种适应于lmh悬浮细胞培养的血清8a型的禽ⅰ群腺病毒毒株及其应用。分离、鉴定、筛选中国鸡群感染流行的fadv
‑
8a型致病毒株,经lmh悬浮细胞培养,得到一株优良的、抗原性优异的疫苗毒株,制备相应的疫苗,将对预防禽ⅰ群8a型腺病毒感染及其他亚型禽腺病毒的感染具有重要意义。
7.本发明目的实现的技术方案如下:
8.首先提供一种禽腺病毒血清8a型dk02株,保藏于中国典型培养物保藏中心,地址:中国,武汉,武汉大学,保藏日期为2021年09月17日,保藏号为:cctcc no:v202170。所述病毒毒株经鉴定为禽腺病毒ⅰ群腺病毒中的e种,血清型为8a型,所述病毒可经9~10日龄鸡胚尿囊腔、绒毛尿囊膜、6日龄鸡胚卵黄囊途径培养,也可在鸡肝癌细胞lmh细胞上增殖;禽腺病毒dk02株分离自禽包涵体肝炎
‑
心包积水综合征病死鸡肝脏组织,采用鸡胚分离增殖获得,通过克隆及传代适应能在鸡肝癌细胞上适应增殖,毒株增殖能力强,免疫原性好,适合做疫苗毒株生产灭活疫苗。
9.所述毒株制备的生物制品疫苗,含悬浮鸡肝癌细胞培养的禽i群腺病毒dk02株灭活抗原,含量为灭活前≥10
8.5
tcid
50
/0.1ml。
10.所述毒株是通过蚀斑克隆纯化得到,具体制备方法包括以下步骤:
11.(1)选取铺满单层的lmh贴壁细胞,弃掉原培养液,加入含有1%禽腺病毒dk02株病毒液的细胞维持液,置于37℃,5%co2培养,当细胞病变达80%以上时,冻融2次,收获病毒液,即为f1代病毒,将f1代病毒在lmh贴壁细胞上传代至f5,进行驯化培养;
12.(2)将f5代禽腺病毒dk02株病毒液用dmem进行10倍梯度稀释至10
‑5~10
‑9后接种至生长成致密单层的lmh细胞,吸附1h后,弃掉液体,加铺约3mm厚的第一层营养琼脂,所述第一层营养琼脂含有终浓度为1%低熔点琼脂糖和含2%胎牛血清的dmem,置co2培养箱,37℃,5%co2条件下倒置培养48h后,待细胞出现病变时加铺第二层营养琼脂,所述第二层营养琼脂含有终浓度为1%低熔点琼脂糖和含2%胎牛血清的1
×
dmem,37℃,5%co2条件下避光倒置培养;
13.(3)待蚀斑形成后用滴头吸出,连同琼脂糖一起放入1.0ml的不含血清dmem中,反复冻融3次,使病毒充分释放,接种新的空白lmh细胞,进行病毒增殖,如此重复克隆三次,随机挑选第四代克隆的五个蚀斑,即f9代病毒进行培养,测定病毒含量,分别挑选病毒含量最高的一株毒,通过lmh细胞继续传代,即可获得纯化后的禽i群腺病毒dk02株病毒液。
14.该毒株适应于贴壁及悬浮lmh细胞培养,所述方法包括以下步骤:
15.(1)贴壁lmh细胞制备及病毒接种、收获:选取长势良好的lmh贴壁细胞,弃掉原培养液,加入含有1%禽腺病毒dk02株病毒液的细胞维持液,置于37℃,5%co2培养,当细胞病变达80%以上时,冻融2次,收获病毒液,即为适应于贴壁lmh细胞培养的dk02株病毒液;
16.(2)悬浮lmh细胞制备及病毒接种、收获:选取初始密度约为200万的悬浮lmh细胞,将由贴壁lmh细胞扩繁得到的禽腺病毒dk02株基础种毒用dmem进行适当稀释后接种至悬浮lmh细胞中,于37℃,120rpm振摇培养72~96h后,冻融2次,收获病毒液,分装注明毒种代次及收获时间;
17.一种i群e种8a型禽腺病毒的灭活疫苗,所述疫苗的抗原来自禽腺病毒dk02株。其制备方法包括如下步骤:
18.油相制备:
19.取矿物油95份,硬脂酸铝1份,在油相制备管中混合均匀并加热至75~85℃后,再加5份司本80,至温度达到110~120℃时维持20~40分钟,冷却后完成油相制备;
20.水相制备:
21.将所述dk02株接种悬浮lmh细胞,培养72~96h,收获培养物为病毒液;取灭活的禽腺病毒血清8a型病毒抗原液95份,灭菌的5份吐温80,充分混匀;
22.乳化:
23.取2份油相,1份水相,放入乳化罐中搅拌,即得所述灭活疫苗。
24.本发明的有益效果是:本发明提供的ⅰ群8a型禽腺病毒毒株dk02株为自然分离株,并经过蚀斑纯化筛选所获得,通过最佳接种剂量、最适收获时间等培养条件的优化,培育出效价稳定的血清8a型禽腺病毒,具有良好的免疫原性和特异性,且产毒量高。同时对由禽i群腺病毒血清8a型引起的鸡包涵体肝炎具有预防作用,该腺病毒制备成灭活疫苗后,通过对疫苗的生产工艺、安全性、攻毒保护效果、免疫剂量等研究表明该疫苗安全性好,攻毒保护率高,免疫效果稳定。
附图说明
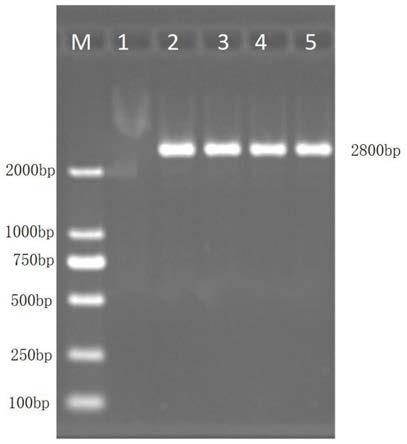
25.图1是本发明对临床分离的禽腺病毒dk02株样本进行禽i群腺病毒pcr鉴定图,其中m:dnamarker dl2501,1:禽i群腺病毒阴性对照,2:禽i群腺病毒阳性对照,3~5:临床分离样本。
26.图2是禽腺病毒hexon基因遗传进化树。
27.图3蚀斑克隆纯化试验结果图,白色斑点为本发明实施例使用的禽i群腺病毒dk02株形成的蚀斑。
具体实施方式
28.下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
29.实施例1毒株分离、纯化与鉴定
30.禽腺病毒dk02株分离
31.采集出现典型症状和病理变化的病鸡肝脏、脾脏组织,剪碎研磨,称重量后分别按照1:3的重量比加入灭菌的pbs,4℃、6000r/min离心10min,4℃、8000r/min离心10min,取上清液转入另一无菌1.5ml离心管中,加入双抗(终浓度为青霉素2000iu/ml,链霉素2mg/ml),37℃作用1h,经卵黄囊接种5日龄spf鸡胚各5枚,0.2ml/枚。弃去24h内死亡的鸡胚,以后每隔6h观察1次,收取死亡鸡胚的尿囊液及胚体,至216h取出所有鸡胚尿囊液及胚体,组织捣碎,用含青链霉素的无菌pbs做2倍稀释,留样检测,病毒分离物置于
‑
70℃保存。
32.hexon基因序列测定及遗传进化分析
33.提取样品核酸,根据已公布的fav
‑
i hexon基因序列设计引物对基因进行pcr鉴定,条带大小约2800bp(图1),对阳性样本进行克隆测序。对测序结果进行构建遗传进化树分析,显示分离毒株与禽腺病毒i亚群8a型的亲缘关系最近,与血清4型等i亚群其他血清型以及edsv、hev亲缘关系较远(图2)。提示采用分离株制备疫苗,可对禽i群腺病毒e8a型流行毒株具有较好的防疫效果。
34.病毒的细胞驯化及蚀斑克隆纯化
35.选取长势良好的lmh贴壁细胞,弃掉原培养液,加入含有1%病毒液的细胞维持液,置于37℃,5%co2培养,当细胞病变达80%以上时,冻融2次,收获病毒液,即为f1代病毒。将f1代病毒在lmh贴壁细胞上传代至f5,进行驯化培养。
36.将f5代病毒液用dmem进行10倍梯度稀释至10
‑5~10
‑9后接种至生长成致密单层的lmh细胞,吸附1h后,弃掉液体,加铺约3mm厚的第一层营养琼脂(终浓度为1%低熔点琼脂糖、2%胎牛血清的dmem),置co2培养箱,37℃,5%co2条件下倒置培养48h后(待细胞出现病变时)加铺第二层营养琼脂(终浓度为1%低熔点琼脂糖、2%胎牛血清的1
×
dmem),37℃,5%co2条件下避光倒置培养。待蚀斑形成后(图3)用滴头吸出,连同琼脂糖一起放入1.0ml的不含血清dmem中,反复冻融3次,使病毒充分释放,接种新的空白lmh细胞,进行病毒增殖,如此重复克隆三次。随机挑选第四代克隆的五个蚀斑,即f9代病毒进行培养,测定病毒含量,分别挑选病毒含量最高的一株毒,通过lmh细胞连续传代,f11代毒作为后续攻毒实验用毒,f15代毒作为上悬浮细胞培养用的基础种毒。
37.禽i群腺病毒dk02株毒种的鉴定
38.(1)无菌检验和支原体检验
39.按现行《中国兽药典》附录进行检验,dk02株f15代基础种毒样品接种后,无菌和支原体生长。
40.(2)病毒含量测定
41.将dk02株f15代病毒液10倍系列稀释后,取10
‑6、10
‑7、10
‑8、10
‑9、10
‑
10
五个稀释度,分别接种96孔细胞板上的单层lmh细胞,置37℃孵育72小时。72小时后,逐孔观察细胞病变,以接种细胞出现典型病变判为感染,按reed
‑
muench方法计算病毒含量。结果表明:dk02株f15代种毒的病毒含量为10
7.85
tcid
50
/0.1ml。
42.(3)外源病毒检验
43.采用鸡检验法进行,将病毒液经甲醛灭活后乳化,肌肉注射途径接种14日龄spf鸡,21日后再次以相同方法重复接种1次。第一次接种后42天采血,进行相关病原的血清抗体监测。结果表明,dk02株病毒液无外源病毒污染。
44.表1 dk02株外源病毒血清学检验结果
45.检查病原检验方法dk02株阳性对照阴性对照禽iii群腺病毒(有血凝性)hi
‑
‑
禽a型流感病毒agp/hi
‑
‑
禽白血病病毒elisa
‑
‑
禽脑脊髓炎病毒elisa
‑
‑
禽网状内皮组织增殖症病毒ifa/elisa
‑
‑
鸡痘病毒agp/临床观察
‑
‑
禽呼肠孤病毒agp/elisa
‑
‑
鸡马立克氏病病毒agp
‑
‑
鸡新城疫病毒hi
‑
‑
鸡传染性支气管炎病毒hi/elisa
‑
‑
鸡传染性喉气管炎病毒中和抗体/elisa
‑
‑
鸡传染性法氏囊病病毒agp/elisa
‑
‑
46.注:
“‑”
代表阴性,“ ”代表阳性。
47.(4)最小致病量测定
48.取禽腺病毒dk02株f11代毒进行攻毒试验。用不同剂量dk02株病毒分别肌肉注射10日龄spf鸡,观察l4日。结果显示,试验鸡的发病和死亡都集中在攻毒后7日内,之后观察到14日未见到新增发病情况。10
6.0
tcid
50
、10
5.0
tcid
50
攻毒发病率均为10/10,死亡率为8/10~10/10;10
4.0
tcid
50
攻毒发病率为8/10,死亡率为8/10;10
3.0
tcid
50
攻毒发病率为7/10,死亡率为6/10;pbs对照鸡10/10正常。试验表明最小致病量为10
4.0
tcid
50
。病死鸡剖检可见肝脏呈土黄色,肿胀、质脆易碎,肾脏肿大、有少量心包积液。对照组鸡只无任何临床症状。结果详见表2。
49.表2不同攻毒剂量对spf鸡的致病力试验结果
[0050][0051]
发病标准:
①
临床症状:精神沉郁、羽毛粗乱、闭眼、蹲伏等,严重者死亡;
②
剖检病变:死亡或出现临床症状后2~3日内未死亡的发病鸡,剖检发现肝脏呈土黄色,肿胀、质脆易碎,肾脏肿大、有少量心包积液等病理变化。
③
核酸检测:肝脏中禽i群腺病毒8a型核酸呈阳性。符合任一一项判为发病。
[0052]
(5)免疫原性测定
[0053]
将dk02株f15代种毒,接种生长良好的lmh悬浮细胞,收获病毒液,制成灭活疫苗,具体方法如下:将白油和司本
‑
80按照94︰6的体积比混匀后作为疫苗油相。采用甲醛灭活禽腺病毒dk02株病毒液,得到灭活病毒液。将灭活病毒液和吐温
‑
80按照体积比96︰4混匀,作为疫苗水相。将油相和水相按照2︰1的体积比混匀,即获得灭活疫苗。
[0054]
将f15代毒种制备的灭活疫苗按0.3ml/羽份颈部皮下分别免疫7日龄spf鸡各10只,另取10只不免疫作为空白对照。免疫后21日,所有试验鸡采血,分离血清,参照现行《兽用生物制品检验操作规程》中方法进行琼脂扩散试验。同时对免疫组和对照组的鸡进行禽腺病毒dk02株(f11代)攻毒保护试验。
[0055]
攻毒保护试验:用禽腺病毒dk02株(f11代)进行攻毒,每只鸡肌肉注射0.2ml(≥
10
5.0
tcid
50
/0.1ml),攻毒后10日内每日观察鸡群状态,如发病则判为不保护;若试验鸡只攻毒后在观测期内不发病判为保护。结果表明,f15代毒种制备的灭活疫苗按照0.3ml/羽份剂量免疫后21天,免疫组血清琼扩抗体阳性率均高达10/10;禽腺病毒dk02株(f11代)攻毒保护试验结果表明,f15代毒种制备的灭活疫苗免疫组所有攻毒鸡只均为保护,对照组攻毒鸡只全部发病。
[0056]
表3dk02株毒免疫原性测定结果
[0057]
组别日龄免疫途径免疫数免疫剂量抗体阳性率攻毒剂量保护率发病率dk02株7d皮下100.3ml10/100.2ml10/100/10对照7d皮下10/0/100.2ml/10/10
[0058]
发病标准:
①
临床症状:精神沉郁、羽毛粗乱、闭眼、蹲伏等,严重者死亡;
②
剖检病变:死亡或出现临床症状后2~3日内未死亡的发病鸡,剖检发现肝脏呈土黄色,肿胀、质脆易碎,肾脏肿大、有少量心包积液等病理变化。
③
核酸检测:肝脏中禽i群腺病毒8a型核酸呈阳性。符合任一一项判为发病。
[0059]
禽腺病毒dk02株生物学特性研究结果表明,该毒是i群8a型的流行毒株,可在lmh贴壁细胞及lmh悬浮细胞上高滴度增殖,具有良好的免疫原性,能够有效抵抗同源病毒攻击。因此可作为禽腺病毒病的候选毒株,用于灭活疫苗研制。
[0060]
实施例2
ꢀⅰ
群血清8a型禽腺病毒dk02株灭活疫苗的制备
[0061]
1.dk02株抗原制备
[0062]
将禽腺病毒dk02株f15代基础种毒病毒液用dmem进行适当稀释后接种至初始密度约为200万的悬浮lmh细胞中,于37℃,120rpm振摇培养72~96h后,收获病毒液分装注明毒种代次及收获时间等,并留样进行检测。待检样品根据现行《中国兽药典》附录进行无菌检验,支原体检验,外源病毒检验,应无细菌、真菌、支原体、外源病毒污染,并且灭活前病毒含量每0.1ml病毒液含量应≥10
8.5
tcid
50
。收获的病毒液灭活前置2~8℃保存,应不超过3日。
[0063]
dk02株病毒培养液用0.2%的甲醛,37℃灭活24小时。灭活完成后取样做无菌检验及灭活检验,置2~8℃保存,应不超过7日。
[0064]
2.半成品检验
[0065]
(1)无菌检验,按现行《中国兽药典》附录,对灭活后的dk02株进行无菌检验,应无菌生长。
[0066]
(2)灭活检验
[0067]
将灭活后的病毒液作10倍稀释,接种长势良好的lmh细胞(24孔细胞板)4孔,每孔0.2ml,补充维持液至1ml,同时设鸡肝癌细胞作空白对照,置37℃、co2培养箱中培养120小时。细胞对照孔及样品孔均不出现细胞病变。将收获的培养物反复冻融后盲传1代,按上述方法继续培养120小时,样品孔仍不出现细胞病变时,判定为灭活完全。
[0068]
3.疫苗制备
[0069]
按照以下步骤制备3批灭活疫苗:
[0070]
(1)油相制备:取矿物油95份,硬脂酸铝1份,在油相制备管中混合均匀并加热至80℃后,再加5份司本80,至温度达到115℃时维持30分钟,冷却后完成油相制备;
[0071]
(2)水相制备:将dk02株分别接种lmh细胞,待细胞发生80%病变后,收获培养物为病毒液;将灭活的禽腺病毒dk02株病毒液灭活得抗原液;取抗原液95份,灭菌的5份吐温80,
充分混匀;
[0072]
(3)乳化:取2份油相,1份水相,放入乳化罐中,3500r/min搅拌5分钟,8000r/min搅拌15分钟,完成乳化制备。
[0073]
(4)定量分装,加盖密封,并贴标签,置2~8℃保存。
[0074]
4.疫苗成品检验
[0075]
(1)性状
[0076]
对3批疫苗分别进行了外观、剂型、黏度和稳定性测定,结果详见表4。
[0077]
表4 3批灭活苗性状检验结果
[0078]
疫苗批号外观剂型黏度(cp)稳定性结果判定20210401乳白色均匀乳剂油包水型25.47无水相析出合格20210402乳白色均匀乳剂油包水型22.95无水相析出合格20210403乳白色均匀乳剂油包水型23.10无水相析出合格
[0079]
(2)无菌检验
[0080]
按现行《中国兽药典第三部》附录的方法对3批二联苗进行了装量检查,结果均不低于瓶签标示量,结果详见表5。
[0081]
表5 3批灭活苗的装量检查结果
[0082]
疫苗批号标示装量(ml/瓶)检验结果(ml)结果判定20210401250251.2,251.7,251.4合格20210402250252.0,251.3,252.1合格20210403250252.0,251.1,251.5合格
[0083]
(3)无菌检验
[0084]
按现行《中国兽药典第三部》附录的方法对3批疫苗进行了无菌检验,结果均无菌生长,结果详见表6。
[0085]
表6 3批灭活苗的无菌检验结果
[0086][0087]
(4)安全性试验
[0088]
1)一次单剂量接种安全试:取3批dk02株灭活疫苗,分别经颈背部皮下和腿部肌肉各注射7日龄spf鸡10只,每只注射0.3ml。注射后观察28日,详细记录试验鸡的精神、饮食状况,并分别于注射后14、21和28日,从各组分别取3只、4只和3只进行剖检,观察注射部位。试验结果见表7。
[0089]
表7一次单剂量接种安全试验结果
[0090][0091]
2)单剂量重复接种的安全试验:取3批ⅰ群血清8a型禽腺病毒dk02株灭活疫苗,每批疫苗分别经颈背部皮下和腿部肌肉各注射7日龄spf鸡10只,每只注射0.3ml,14日后以同样途径再次注射0.3ml,之后观察28日,详细记录试验鸡的精神、饮食状况。并于二次注射后14、21和28日,从各组分别取3只、4只和3只进行剖检,观察注射部位。试验结果见表8。
[0092]
表8单剂量重复接种的安全试验结果
[0093][0094]
3)超剂量接种的安全试验:取3批ⅰ群血清8a型禽腺病毒dk02株灭活疫苗,每批疫苗分别经颈背部皮下和腿部肌肉各注射7日龄spf鸡10只,每只注射1.0ml;同时设20只同条件对照鸡,分别经颈背部皮下和腿部肌肉注射1.0ml无菌生理盐水,每种途径注射10只。注射前随机抽10只鸡称重。于注射后14日,用各接种组的10只鸡,连同10只对照鸡进行称重,比较接种组增重是否低于对照组增重。同时,注射后观察28日,详细记录试验鸡的精神、饮食状况,并于注射后14、21和28日,从各接种组分别取3只、4只和3只进行剖检,观察注射部位。试验结果见表9。
[0095]
表9超剂量接种的安全试验结果
[0096][0097]
(5)效力检验
[0098]
血清学方法:取7日龄spf鸡20只,其中10只各颈部皮下或腿部肌肉接种疫苗0.3m1,另10只作对照。接种后21日,每只鸡分别采血,分离血清,用琼扩试验检测禽i群8a型腺病毒抗体,免疫组至少8只阳性,对照组应全部阴性。试验结果见表9。
[0099]
免疫攻毒法:取7日龄spf鸡20只,其中10只各颈部皮下或腿部肌肉接种疫苗0.3m1,另10只作对照。接种后21日,所有免疫鸡和对照鸡,肌肉注射禽i群8a型腺病毒dk02株病毒液(病毒含量≥10
5.0
tcid
50
/0.1ml),每只0.2ml,观察14日,对照鸡应至少发病8只,免疫鸡应至少保护8只。试验结果见表10。
[0100]
表10效力检验试验结果
[0101][0102]
发病标准:
①
临床症状:精神沉郁、羽毛粗乱、闭眼、蹲伏等,严重者死亡;
②
剖检病变:死亡或出现临床症状后2~3日内未死亡的发病鸡,剖检发现肝脏呈土黄色,肿胀、质脆易碎,肾脏肿大、有少量心包积液等病理变化。
③
核酸检测:肝脏中禽i群腺病毒8a型核酸呈阳性。符合任一一项判为发病。
[0103]
以上试验结果表明,制备的禽i群8a型腺病毒dk02株灭活疫苗安全、有效。虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。