一种快速鉴定和定量肠炎沙门菌的探针法双重荧光定量pcr引物组及试剂盒
技术领域
1.本发明涉及生物技术检测领域,特别是涉及一种快速鉴定和定量肠炎沙门菌的探针法双重荧光定量pcr引物组及试剂盒。
背景技术:
2.沙门菌病是公共卫生学上有重要意义的传染病之一,是食源性细菌性肠炎的主要原因之一,大多数沙门菌感染病例是由于食用受污染的食物或水所致,例如猪肉、牛肉、家禽和鸡蛋。在众多血清型沙门菌中,肠炎沙门菌是导致人类严重感染的最重要病原体之一。肠炎沙门菌感染人体后会引起胃肠炎、腹泻、呕吐甚至严重全身性感染。肠炎沙门菌能够在蛋清中存活进而污染蛋制品,导致重大经济和健康负担。
3.传统的沙门菌血清分型是基于kauffman
‑
white通过细菌表面o和h抗原的特异性抗血清进行鉴定。尽管这种方法应用广泛,但由于需要传统的基于培养的方法,因此这种方法相对昂贵、工作量大且耗时较长。因此准确的鉴定方法对于沙门菌病的防控至关重要,因此建立一种流行沙门菌血清型快速准确的鉴定方法可以促进常规监测和公共卫生安全。聚合酶链式反应(pcr)因其快速、高通量、高灵敏度和特异性而被广泛研究。与传统pcr不同,探针法荧光定量pcr方法不需要通过凝胶电泳分析来确认细菌病原体的存在,并且可以对数据进行实时定量分析,及时鉴定肠炎沙门菌对于沙门菌病的有效防控意义重大。
技术实现要素:
4.鉴于以上所述现有技术的缺点,本发明的目的在于提供一种快速鉴定和定量肠炎沙门菌的探针法双重荧光定量pcr引物组及试剂盒,用于解决现有技术中的问题。
5.为实现上述目的及其他相关目的,本发明提供一种检测肠炎沙门菌的pcr引物组,所述pcr引物组中包括用于分别检测lygd基因和inva基因的引物对。
6.优选的,所述pcr引物组中包括以下中的任一项或多项:
7.1)第一引物对:包括核苷酸序列如seq id no:1所示的上游引物与核苷酸序列如seq id no:2所示的下游引物;
8.2)第一探针引物:核苷酸序列如seq id no:3所示;
9.3)第二引物对:包括核苷酸序列如seq id no:4所示的上游引物与核苷酸序列如seq id no:5所示的下游引物;
10.4)第二探针引物:核苷酸序列如seq id no:6所示。
11.本发明还提供所述pcr引物组在制备lygd基因和inva基因检测产品中的用途。
12.本发明还提供一种检测肠炎沙门菌的探针法双重荧光定量pcr检测试剂盒,所述试剂盒包括所述pcr引物组。
13.本发明还提供所述引物组或所述试剂盒在鉴定和定量检测肠炎沙门菌中的用途。
14.本发明还提供一种肠炎沙门菌的鉴定方法,所述鉴定方法包括如下步骤:
15.1)配制pcr反应体系:利用所述探针法双重荧光定量pcr检测试剂盒和待测样品的基因组dna配制pcr反应体系;
16.2)pcr反应:将配制完成的pcr反应体系进行pcr扩增;
17.3)结果分析:能同时扩增出lygd基因和inva基因的待测样品即为肠炎沙门菌,不能同时扩增出lygd基因和inva基因的待测样品即不是肠炎沙门菌。
18.本发明还提供一种定量检测肠炎沙门菌的方法,所述方法包括如下步骤:
19.1)配制标准曲线的pcr反应体系:将所述探针法双重荧光定量pcr检测试剂盒中的阳性对照dna梯度稀释,以梯度稀释后的阳性对照dna分别作为模板配制标准曲线的反应体系;
20.2)配制待测样品的pcr反应体系:以待测样品的基因组dna为模板,利用所述探针法双重荧光定量pcr检测试剂盒配制待测样品的pcr反应体系;
21.3)配制阴性对照的pcr反应体系:以所述探针法双重荧光定量pcr检测试剂盒中的阴性对照dna为模板配制阴性对照的pcr反应体系;
22.4)pcr反应:将配制完成的各pcr反应体系进行pcr扩增;
23.5)结果分析:通过各pcr反应体系的扩增信号,代入标准曲线计算待测样品中肠炎沙门菌的含量。
24.如上所述,本发明的快速鉴定和定量肠炎沙门菌的探针法双重荧光定量pcr引物组及试剂盒,具有以下有益效果:本发明首次以两对特异性引物通过探针法双重荧光定量pcr技术检测了lygd基因和inva基因在不同血清型沙门菌及其它细菌中的分布。本发明的试剂盒能快速高通量鉴定和定量肠炎沙门菌,可替代传统沙门菌血清学分型和生化鉴定等复杂程序,并为肠炎沙门菌的监测与实验室诊断提供了一种简单快速、重复性好的新方法。
附图说明
25.图1显示为本发明基于lygd基因和inva基因建立探针法双重荧光定量pcr标准曲线及其灵敏度分析;其中,lygd基因为肠炎沙门菌特有基因,inva基因为鉴定沙门菌内参基因。通过检测不同浓度的肠炎沙门菌c50041基因组dna确定该方法的检测灵敏度。(a)探针法双重荧光定量pcr检测肠炎沙门菌的扩增曲线;(b)探针法双重荧光定量pcr lygd和inva基因标准曲线的建立。
26.图2显示为本发明探针法双重荧光定量pcr对小鼠脏器中肠炎沙门菌的检测和定量分析;其中,通过平板计数法分别检测肝脏和脾脏的细菌量,通过建立的探针法双重荧光定量pcr标准曲线分别计算脏器的细菌数量。
具体实施方式
27.本发明首先提供一种检测肠炎沙门菌的pcr引物组,所述pcr引物组中包括用于分别检测lygd基因和inva基因的引物对。
28.在一种实施方式中,所述pcr引物组中包括以下中的任一项或多项:
29.1)第一引物对:包括核苷酸序列如seq id no:1所示的上游引物与核苷酸序列如seq id no:2所示的下游引物;
30.2)第一探针引物:核苷酸序列如seq id no:3所示;
31.3)第二引物对:包括核苷酸序列如seq id no:4所示的上游引物与核苷酸序列如seq id no:5所示的下游引物;
32.4)第二探针引物:核苷酸序列如seq id no:6所示。
33.其中第一引物对用于检测lygd基因,第二引物对用于检测inva基因,所述lygd基因仅存在肠炎沙门菌中,inva基因仅存在沙门菌中,lygd和inva双基因可准确鉴定待测样本是否为肠炎沙门菌。
34.所述第一探针引物和第二探针引物一端分别标记有荧光报告基团,另一端分别标记有荧光淬灭基团。
35.较佳的,所述第一探针引物和第二探针引物5’端标记有不同的荧光报告基团,3’端标记有不同的荧光淬灭基团。
36.具体的,所述荧光报告基团选自以下中的一种:fam、hex、vic、cy3、rox、610、texas red、cy5。
37.具体的,所述荧光淬灭基团与荧光报告基团相对应,能够淬灭相应的荧光报告基团即可。例如,当荧光报告基团为fam时,所述荧光淬灭基团选自以下中的一种:bhq1、dabcyl、tamra、mgb。
38.较佳的,所述第一探针引物和第二探针引物5’端标记的荧光报告基团分别为cy5和fam荧光基团,3’端标记的荧光淬灭基团分别为bhq2和tamra。
39.在一种实施方式中,所述pcr引物组包括第一引物对、第一探针引物、第二引物对和第二探针引物。
40.对于上述例示的引物对具有的具体碱基序列而言,只要能够在pcr实施条件下特异性地识别各自的特异性识别区域(优选在单一的反应容器内使用的引物之间不发生退火及自退火),则可以使1个或多个碱基替换为其他碱基,也可在3’端或5’端添加1个或多个碱基。此处,所谓多个,例如为2~3个。向引物添加1个或多个碱基的情况下,优选向引物的5’端添加。
41.将上述例示的引物对具体的碱基序列中的1个或多个碱基取代为其他碱基而得到的碱基序列、与被取代前的碱基序列(即,序列号所示碱基序列)的同一性优选为70%以上,更优选为75%以上,更优选为80%以上,更优选为85%以上,更优选为90%以上,更优选为95%以上。
42.对于各引物的长度而言,只要能够特异性地识别对应的特异性识别区域、且引物之间不发生杂交即可,没有特别限制,优选为15个碱基以上且40个碱基以下。更优选的是,引物的长度的下限为16个碱基以上,进一步优选为17个碱基以上,进一步优选为18个碱基以上。更优选的是,引物的长度的上限为39个碱基以下,进一步优选为38个碱基以下,进一步优选为37个碱基以下。
43.本发明还提供所述pcr引物组在制备lygd基因和inva基因检测产品中的用途。
44.在一种实施方式中,所述lygd基因和inva基因检测产品为肠炎沙门菌鉴定或定量产品。
45.在一种实施方式中,所述肠炎沙门菌鉴定或定量产品为试剂盒。
46.本发明还提供一种检测肠炎沙门菌的探针法双重荧光定量pcr检测试剂盒,所述试剂盒包括所述pcr引物组。
47.所述试剂盒中还可以包括其他一些荧光定量pcr所需要的常规试剂。所述试剂盒中例如还包括水、premix ex taq master、rox reference dye ii、样品基因组dna提取试剂中的一种或多种。由于此类pcr常用试剂均可经市场途径单独购得或者自行配置,因此具体需要将哪些试剂装配入试剂盒,可以根据客户实际需要配置,为方便起见,也可全部装配入试剂盒。
48.本发明的试剂盒可以是包括各种独立包装的上述试剂,也可以是配置好的含有所述引物组的荧光定量pcr检测液。所述pcr检测液可自行配置,也可直接以市售的不含引物的通用pcr检测液加入所述引物组获得。在一种实施方式中,所述pcr检测液中,lygd
‑
f和lygd
‑
r的浓度分别为240nm,lygd
‑
p的浓度为100nm,inva
‑
f和inva
‑
r的浓度分别为200nm,inva
‑
p的浓度为80nm。
49.在一种实施方式中,所述试剂盒中还可含有阳性对照dna。所述阳性对照dna为含有肠炎沙门菌基因组的dna。
50.在一种实施方式中,所述试剂盒中还可含有阴性对照dna。阴性对照dna为非肠炎沙门菌的dna。
51.本发明的试剂盒采用探针法双重荧光定量pcr检测技术进行lygd基因和inva基因检测,根据扩增及检测情况可分析判断检测对象是否属于肠炎沙门菌。因此,引物的设计是本发明试剂盒的关键之一。
52.本发明还提供所述引物组或所述试剂盒在鉴定和定量检测肠炎沙门菌中的用途。本发明的所述引物组或所述试剂盒能够快速鉴定待测样本是否为肠炎沙门菌,以及肠炎沙门菌的含量。
53.本发明还提供一种肠炎沙门菌的鉴定方法,所述鉴定方法包括如下步骤:
54.1)配制pcr反应体系:利用所述探针法双重荧光定量pcr检测试剂盒和待测样品的基因组dna配制pcr反应体系;
55.2)pcr反应:将配制完成的pcr反应体系进行pcr扩增;
56.3)结果分析:能同时扩增出lygd基因和inva基因的待测样品即为肠炎沙门菌,不能同时扩增出lygd基因和inva基因的待测样品即不是肠炎沙门菌。
57.所述待测样品选自易被肠炎沙门菌污染的物质。在一种实施方式中,所述待测样品选自食物、水、家禽等。所述鉴定方法为非疾病诊断目的的方法。
58.具体的,步骤1)中配制的pcr反应体系包括待测样品的反应体系、阳性对照的反应体系、阴性对照的反应体系。
59.在一种实施方式中,所述pcr反应体系为25μl体系,其中包括:2
×
premix ex taq master 12.5μl,lygd
‑
f 240nm,lygd
‑
r 240nm,lygd
‑
p 100nm,inva
‑
f 200nm,inva
‑
r 200nm,inva
‑
p 80nm,dna模板2.5μl,rox reference dye ii 0.25μl,ddh2o补至25μl。
60.其他体积的pcr反应体系可根据25μl体系进行同比变化。
61.在一种实施方式中,pcr反应的条件为:(a)95℃30s;(b)95℃5s;(c)60℃34s,步骤(b)~(c)循环40次。
62.本发明还提供一种定量检测肠炎沙门菌的方法,所述方法包括如下步骤:
63.1)配制标准曲线的pcr反应体系:将所述探针法双重荧光定量pcr检测试剂盒中的阳性对照dna梯度稀释,以梯度稀释后的阳性对照dna分别作为模板配制标准曲线的反应体
系;
64.2)配制待测样品的pcr反应体系:以待测样品的基因组dna为模板,利用所述探针法双重荧光定量pcr检测试剂盒配制待测样品的pcr反应体系;
65.3)配制阴性对照的pcr反应体系:以所述探针法双重荧光定量pcr检测试剂盒中的阴性对照dna为模板配制阴性对照的pcr反应体系;
66.4)pcr反应:将配制完成的各pcr反应体系进行pcr扩增;
67.5)结果分析:通过各pcr反应体系的扩增信号,代入标准曲线计算待测样品中肠炎沙门菌的含量。
68.在一种实施方式中,所述pcr反应体系为25μl体系,其中包括:2
×
premix ex taq master 12.5μl,lygd
‑
f 240nm,lygd
‑
r 240nm,lygd
‑
p 100nm,inva
‑
f 200nm,inva
‑
r 200nm,inva
‑
p 80nm,dna模板2.5μl,rox reference dye ii 0.25μl,ddh2o补至25μl。
69.其他体积的pcr反应体系可根据25μl体系进行同比变化。
70.在一种实施方式中,pcr反应的条件为:(a)95℃30s;(b)95℃5s;(c)60℃34s,步骤(b)~(c)循环40次。
71.所述定量检测肠炎沙门菌的方法为非疾病诊断目的的方法。
72.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
73.在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
74.当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
75.实施例1试剂盒的制备
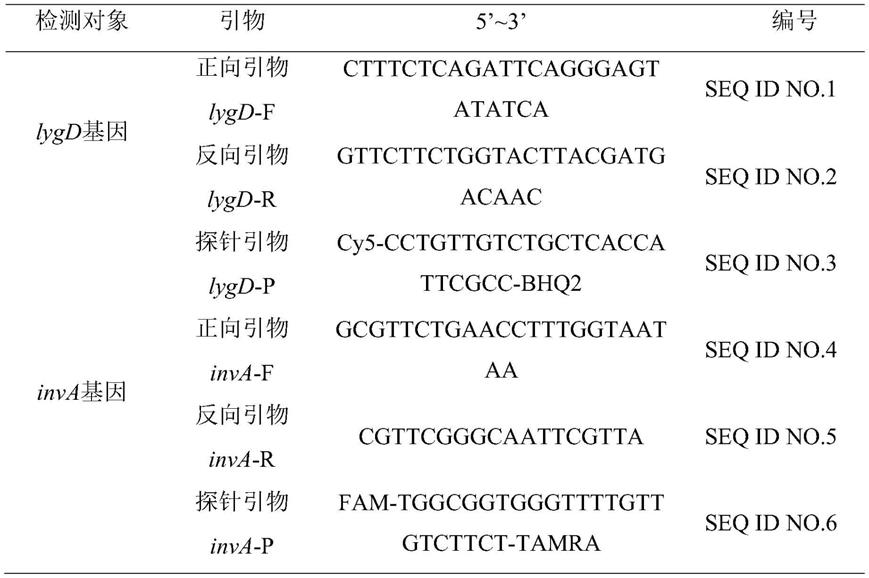
76.引物设计与合成:分别以lygd基因(核苷酸序列如seq id no.7)和inva基因(核苷酸序列如seq id no.8)为模板,设计并分析引物,并根据基因组dna序列情况,从中选择最佳检测用引物对和探针引物,其中,lygd引物扩增部分序列(111bp),其探针引物为cy5标记,用于检测肠炎沙门菌;inva引物扩增部分序列(105bp),其探针引物为fam标记,用于检测沙门菌,两对检测引物和探针引物的核苷酸序列如表1所示。
77.表1探针法双重荧光定量pcr检测引物和探针引物的核苷酸序列
[0078][0079]
上述引物对可单独包装,也可以配成pcr检测液。所述pcr检测液中,上述引物对的量采用240nm lygd
‑
f/r(lygd
‑
f和lygd
‑
r的浓度分别为240nm)和100nm lygd
‑
p以及200nminva
‑
f/r(inva
‑
f和inva
‑
r的浓度分别为200nm)和80nm inva
‑
p。
[0080]
也就是说,本发明的试剂盒,可以是含有上述独立包装的引物对,也可以是含有配置好的含有引物对的pcr检测液。
[0081]
进一步地,所述试剂盒还含有无菌水(ddh2o)、premix ex taq master、rox reference dye ii。
[0082]
实施例2试剂盒检测肠炎沙门菌的特异性鉴定
[0083]
采用实施例1所述试剂盒中的两对检测引物和探针引物,以不同血清型沙门菌和其它非沙门菌细菌的基因组分别为模板,探针法双重荧光定量pcr方法鉴定lygd基因和inva基因在不同细菌中的分布特点。
[0084]
pcr反应体系为(25μl):2
×
premix ex taq master 12.5μl,lygd
‑
f 240nm,lygd
‑
r 240nm,lygd
‑
p 100nm,inva
‑
f 200nm,inva
‑
r 200nm,inva
‑
p 80nm,dna模板2.5μl,rox reference dye ii 0.25μl,ddh2o补至25μl。
[0085]
pcr程序为95℃30s;95℃5s,60℃34s,40个循环。
[0086]
通过荧光定量pcr仪采集扩增信号,pcr结果表明以肠炎沙门菌基因组为模板可采集lygd和inva两种扩增信号;以非肠炎的其它血清型沙门菌基因组为模板仅扩增一种信号,为inva基因(表2)。表明以实施例1所述试剂盒中特定的lygd和inva扩增引物和探针引物,可以通过探针法双重荧光定量pcr方法快速鉴定未知细菌是否为肠炎沙门菌。即,lygd基因仅存在肠炎沙门菌中,inva基因仅存在沙门菌中,lygd和inva双基因检测可准确鉴定肠炎沙门菌。
[0087]
表2探针法双重荧光定量pcr检测肠炎沙门菌的特异性鉴定
[0088][0089][0090]
实施例3试剂盒检测肠炎沙门菌的灵敏度鉴定
[0091]
采用实施例1所述试剂盒中的两对检测引物和探针引物,将肠炎沙门菌c50041基因组依次10倍稀释,以稀释的基因组为模板,鉴定试剂盒检测肠炎沙门菌基因组dna的灵敏度。
[0092]
pcr反应体系为(25μl):2
×
premix ex taq master 12.5μl,lygd
‑
f 240nm,lygd
‑
r 240nm,lygd
‑
p 100nm,inva
‑
f 200nm,inva
‑
r 200nm,inva
‑
p 80nm,dna模板2.5μl,rox reference dye ii 0.25μl,ddh2o补至25μl。
[0093]
pcr程序为95℃30s;95℃5s,60℃34s,40个循环。
[0094]
通过荧光定量pcr仪采集不同浓度dna模板的扩增信号,建立了基于lygd基因和inva基因的探针法双重荧光定量pcr标准曲线。pcr结果表明基于lygd和inva的双重pcr检测试剂盒可检测4copies/体系的肠炎沙门菌(图1)。
[0095]
实施例4试剂盒在小鼠脏器中肠炎沙门菌的定量检测
[0096]
采用实施例1所述试剂盒中的两对检测引物和探针引物,检测小鼠脏器中肠炎沙门菌,可快速准确地检测和定量肠炎沙门菌。具体步骤如下:
[0097]
将5
×
104cfu肠炎沙门菌灌胃感染小鼠,感染3天后采集小鼠肝脏和脾脏,将脏器均质处理后,通过平板计数法检测脏器载菌量。同时将均质液稀释后提取细菌基因组dna,通过建立的试剂盒检测肠炎沙门菌基因组含量。
[0098]
pcr反应体系为(25μl):2
×
premix ex taq master 12.5μl,lygd
‑
f 240nm,lygd
‑
r 240nm,lygd
‑
p 100nm,inva
‑
f 200nm,inva
‑
r 200nm,inva
‑
p 80nm,dna模板2.5μl,rox reference dye ii 0.25μl,ddh2o补至25μl。
[0099]
pcr程序为95℃30s;95℃5s,60℃34s,40个循环。
[0100]
通过荧光定量pcr仪采集不同脏器沙门菌dna模板的扩增信号,通过标准曲线计算脏器中沙门菌含量,并与平板计数法进行比较,结果显示两种检测计数方法无显著性差异(图2)。pcr结果表明基于lygd和inva的双重pcr检测试剂盒可准确快速检测脏器中肠炎沙门菌含量。
[0101]
实施例5试剂盒在检测鸡胚中肠炎沙门菌的应用
[0102]
采用实施例1中试剂盒,检测70份死鸡胚中的肠炎沙门菌,可快速准确地检测出肠炎沙门菌。具体步骤如下:
[0103]
1)沙门菌的分离和传统血清型鉴定
[0104]
本试验中样品采自江苏某鸡场,样品的处理、增菌及沙门菌的分离和生理生化鉴定参考现有技术中已建立方法(li y,et al.food control,2016;cai y,et al.int j food microbiol,2016),通过该传统方法共分离鉴定了27株沙门菌,其中含有23株肠炎沙门菌。
[0105]
2)探针法双重荧光定量pcr方法检测样本中肠炎沙门菌
[0106]
采集70份死鸡胚的肝脏和卵黄,并分别于bpw增菌液中进行前增菌,37℃100rpm增菌6h后,使用细菌基因组提取试剂盒提取各样品的基因组,以基因组为模板扩增lygd基因和inva基因,pcr反应体系为(25μl):2
×
premix ex taq master 12.5μl,lygd
‑
f 240nm,lygd
‑
r 240nm,lygd
‑
p 100nm,inva
‑
f 200nm,inva
‑
r 200nm,inva
‑
p 80nm,dna模板2.5μl,rox reference dye ii 0.25μl,ddh2o补至25μl。pcr程序为95℃30s;95℃5s,60℃34s,40个循环,可同时扩增出lygd和inva基因的为肠炎沙门菌。结果显示70份鸡胚样品中共有26份可同时检测到lygd和inva基因,这些沙门菌即为肠炎沙门菌(表3)。
[0107]
表3探针法双重荧光定量pcr鉴定鸡胚中肠炎沙门菌的污染情况
[0108][0109][0110]
se:肠炎沙门菌;sw:韦太夫雷登沙门菌;sl:伦敦沙门菌。
[0111]
在本实施例中,采用血清型鉴定和生化实验鉴定的方法,将70份鸡胚样品中的肠炎沙门菌筛选出来,需要至少2天的时间。而采用本发明实施例1的检测试剂盒,仅需7个小时,即可将26株肠炎沙门菌准确筛选出来,而传统沙门菌分离和血清型鉴定方法鉴定了23株肠炎沙门菌,表明建立的探针法双重荧光定量pcr相较于传统方法具有更高的灵敏性。
[0112]
综上所述,本发明试剂盒相较于传统血清型鉴定方法的优势:
[0113]
传统血清型鉴定需购买特定的沙门菌血清型鉴定试剂盒,价格昂贵,步骤繁琐,尤
其在大样本中分离特定的血清型沙门菌(如肠炎沙门菌)时,需耗费大量时间(至少两天),且工作量庞大,其结果是由肉眼进行判断,因而可能存在人为误差;而本发明试剂盒的检测方法操作简单,从样品采集到细菌鉴定整个过程在七小时内即可完成,且灵敏性高于传统沙门菌分离鉴定方法,并可对特定样品中的沙门菌进行定量分析。
[0114]
因此,本发明的一种快速鉴定和定量肠炎沙门菌的探针法双重荧光定量pcr检测试剂盒,有利于简化沙门菌血清型鉴定的传统步骤,为在大量样本中筛选肠炎沙门菌提供了一种快速鉴定的新方法。
[0115]
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。