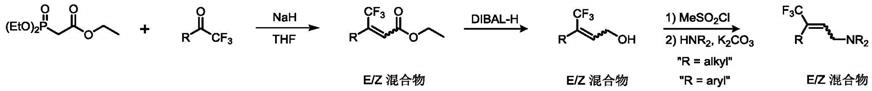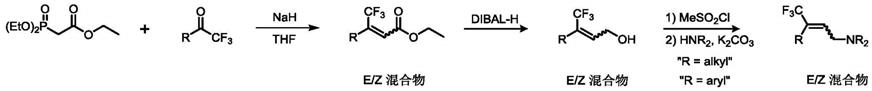
一种多取代(e)
‑
三氟甲基烯烃的制备方法
技术领域
1.本发明属于有机合成技术领域,特别涉及一种多取代(e)
‑
三氟甲基烯烃的制备方法,适用于各类多取代(e)
‑
三氟甲基烯烃的合成。
背景技术:
2.多取代(e)
‑
三氟甲基烯烃及其衍生物是一类非常重要的有机合成中间体,广泛存在于天然产物、生物活性分子中。除此之外,部分多取代(e)
‑
三氟甲基烯烃也可应用于光致发光材料。目前,传统制备多取代(e)
‑
三氟甲基烯烃的策略主要是利用三氟甲基取代的酮类化合物作为前体和磷酸酯通过horner
‑
wittig反应来实现三氟甲基烯烃的合成。但是这种方法具有很大的不足:1)生成大量的含磷副产物,分离困难;2)此类方法合成的三氟甲基烯烃属于e/z混合物,不能实现高立体选择性合成;3)此类方法只能适用于三取代的烯烃化合物合成,不适用与四取代类三氟甲基烯烃合成;4)此类方法需要多步反应进行后续转化,最终产率较低,成本较高且流程复杂。
[0003][0004]
因此,如何寻找到一种具有普适性的简单有效合成立体选择性的多取代(e)
‑
三氟甲基烯烃合成方法,一直是尚未解决的科学难题。
技术实现要素:
[0005]
为了克服上述现有技术的缺点,本发明的目的在于提供一种多取代(e)
‑
三氟甲基烯烃的制备方法,该方法产率高,立体选择性好,易于工业化生产。
[0006]
为了达到上述目的,本发明采用以下技术方案予以实现:
[0007]
一种多取代(e)
‑
三氟甲基烯烃的制备方法,以烯丙基碳酸酯类化合物、亲核试剂为反应原料,以钯盐、有机磷配体为催化体系,于有机溶剂中反应,得到目标物多取代(e)
‑
三氟甲基烯烃化合物,其反应通式如下:
[0008][0009]
式中,r1为芳基;r2为h、芳基或烷基;亲核试剂为芳胺,芳基亚磺酸钠盐,苯酚类或水。
[0010]
一种多取代(e)
‑
三氟甲基烯烃制备方法,包括以下步骤:
[0011]
1)将钯盐、有机膦配体l1在有机溶剂中充分混合均匀。
[0012]
2)将烯丙基碳酸酯化合物、亲核试剂加入步骤1)的反应体系中,反应处理2~24小时,反应产物去除溶剂后经硅胶柱色谱分离,得到多取代(e)
‑
三氟甲基烯烃。
[0013]
所述的钯盐为pd(dba)2、pd2(dba)3·
chcl3、pd(oac)2或pdcl2。
[0014]
所述的有机磷配体l1的结构式如下:
[0015][0016]
所述的有机溶剂为1,1,1,3,3,3
‑
六氟异丙醇或乙腈。
[0017]
所述的钯盐与有机膦配体的摩尔比为1:1~5。
[0018]
所述的钯盐与所用烯丙基碳酸酯化合物的摩尔比为0.025~0.050:1。
[0019]
所述的亲核试剂的摩尔量为所用烯丙基碳酸酯化合物的摩尔量的1.0~5.0倍。
[0020]
所述的操作步骤中的反应温度为:室温~60℃。
[0021]
所述的亲核试剂为芳胺,芳基亚磺酸钠盐,苯酚类或水。
[0022]
当亲核试剂采用苯酚或水,需要额外添加无机碱,无机碱包括碳酸铯,碳酸钾,叔丁醇钾,碳酸铯,所用碱的摩尔量为烯丙基碳酸酯化合物的1.0~2.0倍。
[0023]
与现有技术相比,本发明具有以下有益效果:
[0024]
本发明公开的一种多取代(e)
‑
三氟甲基烯烃的制备方法,以烯丙基碳酸酯为化合物、亲核试剂为反应原料,以钯盐、有机膦配体催化体系,于有机溶剂中反应,得到目标物多取代(e)
‑
三氟甲基烯烃。以经济易得的芳胺,芳基亚磺酸钠,苯酚类或水作为亲核试剂,通过烯丙基取代反应合成多取代(e)
‑
三氟甲基烯烃,本发明的合成工艺路线具有底物普适性好、产率高(最高能达到89%)、立体选择性好(e:z>99:1)、易于实现工业化生产等优点。
附图说明
[0025]
图1是实施例1的氢谱图。
[0026]
图2是实施例1的碳谱图。
[0027]
图3是实施例1的氟谱图。
[0028]
图4是实施例2的氢谱图。
[0029]
图5是实施例2的碳谱图。
[0030]
图6是实施例2的氟谱图。
[0031]
图7是实施例3的氢谱图。
[0032]
图8是实施例3的碳谱图。
[0033]
图9是实施例3的氟谱图。
[0034]
图10是实施例4的氢谱图。
[0035]
图11是实施例4的碳谱图。
[0036]
图12是实施例4的氟谱图。
[0037]
图13是实施例5的氢谱图。
[0038]
图14是实施例5的碳谱图。
[0039]
图15是实施例5的氟谱图。
[0040]
图16是实施例6的氢谱图。
[0041]
图17是实施例6的碳谱图。
[0042]
图18是实施例6的氟谱图。
[0043]
图19是实施例7的氢谱图。
[0044]
图20是实施例7的碳谱图。
[0045]
图21是实施例7的氟谱图。
[0046]
图22是实施例8的氢谱图。
[0047]
图23是实施例8的碳谱图。
[0048]
图24是实施例8的氟谱图。
[0049]
图25是实施例9的氢谱图。
[0050]
图26是实施例9的碳谱图。
[0051]
图27是实施例9的氟谱图。
[0052]
图28是实施例10的氢谱图。
[0053]
图29是实施例10的碳谱图。
[0054]
图30是实施例10的氟谱图。
[0055]
图31是实施例11的氢谱图。
[0056]
图32是实施例11的碳谱图。
[0057]
图33是实施例11的氟谱图。
[0058]
图34是实施例12的氢谱图。
[0059]
图35是实施例12的碳谱图。
[0060]
图36是实施例12的氟谱图。
具体实施方式
[0061]
下面结合具体的实施例对本发明做进一步详细描述。
[0062]
实施例1
[0063][0064]
无需氮气保护,在10ml反应瓶中依次加入1.4mg pd(dba)2,2.7mg l1配体和0.5ml的1,1,1,3,3,3
‑
六氟异丙醇,室温下搅拌完全后加入39.6mg烯丙基碳酸酯i
‑
1,11.2mg苯胺ii
‑
1。反应体系在60℃下搅拌反应24小时。将反应液浓缩旋干,通过硅胶柱(洗脱液:乙酸乙酯/石油醚=1/50)分离得到纯化产物(e)
‑
iii
‑
1。产率为85%,e:z>99:1,纯品结构表征数据如下,参照图1
‑
图3:
[0065]1h nmr(400mhz,cdcl3)δ7.44(d,j=4.9hz,3h),7.35
‑
7.28(m,2h),7.18(t,j=7.6hz,2h),6.75(t,j=7.3hz,1h),6.53(d,j=7.5hz,3h),3.76(d,j=6.0hz,3h).
[0066]
13
c nmr(100mhz,cdcl3)δ147.29,134.09(q,3j
c
‑
f
=5.3hz),133.19(q,2j
c
‑
f
=29.9hz),131.67,129.49,129.47,129.10,128.79,123.23(q,1j
c
‑
f
=271.6hz),118.27,113.10,41.95.
[0067]
19
f nmr(376mhz,cdcl3)δ
‑
66.04.ir(neat,cm
‑1)3419,3056,3025,2925,2853,
1602,1505,1444,1324,1259,1203,1168,1115,751,700.hrms(esi):m/z:calcd for c
16
h
15
f3n[m h]
:278.1157,found:278.1160.
[0068]
实施例2
[0069][0070]
无需氮气保护,在10ml反应瓶中依次加入1.4mg pd(dba)2,2.7mg l1配体和0.5ml的1,1,1,3,3,3
‑
六氟异丙醇,室温下搅拌完全后加入41.0mg烯丙基碳酸酯i
‑
2,11.2mg苯胺ii
‑
1。反应体系在60℃下搅拌反应24小时。将反应液浓缩旋干,通过硅胶柱(洗脱液:乙酸乙酯/石油醚=1/100)分离得到纯化产物(e)
‑
iii
‑
2。产率为54%,e:z>99:1,纯品结构表征数据如下:
[0071]1h nmr(400mhz,cdcl3)δ7.39(q,j=7.9,7.2hz,3h),7.21(d,j=6.7hz,2h),7.13(t,j=7.8hz,2h),6.70(t,j=7.3hz,1h),6.45(d,j=8.3hz,1h),3.72(s,1h),3.58(s,2h),2.11(q,j=2.3hz,3h).
[0072]
13
c nmr(100mhz,cdcl3)δ147.74,144.73(q,3j
c
‑
f
=3.0hz),134.48(q,3j
c
‑
f
=1.7hz),129.74,129.37,128.67,128.44,128.33(q,2j
c
‑
f
=33.1hz),123.83(q,1j
c
‑
f
=273.7hz),117.99,112.88,48.31,16.84.
[0073]
19
f nmr(376mhz,cdcl3)δ
‑
56.76.ir(neat,cm
‑1)3410,3042,2921,2857,1605,1510,1492,1445,1292,1234,1169,1116,993,769,702.hrms(esi)m/z:[m h]
calcd for c
17
h
17
f3n292.3252;found 292.3253.
[0074]
实施例3
[0075][0076]
无需氮气保护,在10ml反应瓶中依次加入1.4mg pd(dba)2,2.7mg l1配体和0.5ml的1,1,1,3,3,3
‑
六氟异丙醇,室温下搅拌完全后加入47.2mg烯丙基碳酸酯i
‑
3,11.2mg苯胺ii
‑
1。反应体系在60℃下搅拌反应24小时。将反应液浓缩旋干,通过硅胶柱(洗脱液:乙酸乙酯/石油醚=1/100)分离得到纯化产物(e)
‑
iii
‑
3。产率为67%,e:z>99:1,纯品结构表征数据如下:
[0077]1h nmr(400mhz,cdcl3)δ7.48(t,j=7.3hz,3h),7.44
‑
7.32(m,5h),7.19(dd,j=7.1,2.2hz,2h),7.07(t,j=7.9hz,2h),6.68(t,j=7.3hz,1h),6.25(d,j=7.9hz,2h),3.92
‑
3.81(m,2h).
[0078]
13
c nmr(100mhz,cdcl3)δ147.09,137.53,133.85(q,4j
c
‑
f
=1.1hz),130.69(q,2j
c
‑
f
=29.4hz),129.93,129.17,128.91,128.74,128.24,128.09,127.82,127.80,123.12(q,1j
c
‑
f
=273.9hz),118.15,113.59,48.25.
[0079]
19
f nmr(376mhz,cdcl3)δ
‑
56.20.ir(neat,cm
‑1)3419,3056,3025,2925,2853,1602,1505,1325,1203,1168,1115,751,700.hrms(esi)m/z:[m h]
calcd for c
22
h
19
f3n 354.3882;found 354.3883.
[0080]
实施例4
[0081][0082]
无需氮气保护,在10ml反应瓶中依次加入1.4mg pd(dba)2,2.7mg l1配体和0.5ml的1,1,1,3,3,3
‑
六氟异丙醇,室温下搅拌完全后加入39.6mg烯丙基碳酸酯i
‑
1,12.9mg对甲基苯胺ii
‑
2。反应体系在60℃下搅拌反应24小时。将反应液浓缩旋干,通过硅胶柱(洗脱液:乙酸乙酯/石油醚=1/100)分离得到纯化产物(e)
‑
iii
‑
4。产率为84%,e:z>99:1,纯品结构表征数据如下:
[0083]1h nmr(400mhz,cdcl3)δ7.43(d,j=4.8hz,3h),7.29(d,j=6.3hz,2h),6.98(d,j=7.8hz,2h),6.53(t,j=6.0hz,1h),6.46(d,j=7.7hz,2h),3.73(d,j=5.8hz,2h),2.24(s,3h).
[0084]
13
c nmr(100mhz,cdcl3)δ145.00,134.3(q,3j
c
‑
f
=5.3hz),133.03(q,2j
c
‑
f
=29.9hz),131.72,129.95,129.50,129.06,128.76,127.57,123.25(q,1j
c
‑
f
=271.7hz),113.31,42.28,20.51.
[0085]
19
f nmr(376mhz,cdcl3)δ
‑
65.97.ir(neat,cm
‑1)3408,3023,2922,2859,1617,1521,1292,1170,1118,909,808.hrms(esi)m/z:[m h]
calcd for c
17
h
17
f3n 292.1313;found292.1317.
[0086]
实施例5
[0087][0088]
无需氮气保护,在10ml反应瓶中依次加入1.4mg pd(dba)2,2.7mg l1配体和0.5ml的1,1,1,3,3,3
‑
六氟异丙醇,室温下搅拌完全后加入39.6mg烯丙基碳酸酯i
‑
1,14.1mg邻氰基苯胺ii
‑
3。反应体系在60℃下搅拌反应24小时。将反应液浓缩旋干,通过硅胶柱(洗脱液:乙酸乙酯/石油醚=1/50)分离得到纯化产物(e)
‑
iii
‑
5。产率为66%,e:z>99:1,纯品结构表征数据如下:
[0089]1h nmr(400mhz,cdcl3)δ7.48
‑
7.42(m,3h),7.41
‑
7.38(m,1h),7.37
‑
7.27(m,3h),6.71(t,j=7.5hz,1h),6.58
‑
6.31(m,2h),4.75(t,j=5.0hz,1h),3.85(tt,j=4.2,2.1hz,2h).
[0090]
13
c nmr(100mhz,cdcl3)δ149.40,143.45,134.38,133.04,132.53(q,3j
c
‑
f
=
5.4hz),129.38,129.35,128.92,128.80(q,2j
c
‑
f
=57.5hz),116.84(q,1j
c
‑
f
=246.7hz),117.72,117.44,110.66,96.48,41.19.
[0091]
19
f nmr(376mhz,cdcl3)δ
‑
66.17.ir(neat,cm
‑1)3419,3056,3025,2925,2853,1602,1505,1325,1203,1168,1115,751,700.hrms(esi)m/z:[m h]
calcd for c
17
h
14
f3n
2 303.3010;found 303.3012.
[0092]
实施例6
[0093][0094]
无需氮气保护,在10ml反应瓶中依次加入1.4mg pd(dba)2,2.7mg l1配体和0.5ml的1,1,1,3,3,3
‑
六氟异丙醇,室温下搅拌完全后加入39.6mg烯丙基碳酸酯i
‑
1,11.2mg苯基亚磺酸钠ii
‑
4。反应体系在60℃下搅拌反应24小时。将反应液浓缩旋干,通过硅胶柱(洗脱液:乙酸乙酯/石油醚=1/10)分离得到纯化产物(e)
‑
iii
‑
6。产率为89%,e:z>99:1,纯品结构表征数据如下:
[0095]1h(400mhz,cdcl3)δ7.78(d,j=7.5hz,2h),7.73(t,j=7.5hz,1h),7.58(t,j=7.8hz,2h),7.35(t,j=7.4hz,1h),7.26(t,j=7.6hz,2h),6.72(d,j=7.5hz,2h),6.59
‑
6.36(m,1h),3.85
‑
3.63(m,2h).
[0096]
13
c nmr(100mhz,cdcl3)δ138.77(q,2j
c
‑
f
=30.5hz),138.10,134.34,129.93,129.48,129.40,129.14,128.74,128.63,122.90(q,3j
c
‑
f
=5.8hz),122.51(q,1j
c
‑
f
=272.2hz),55.94.
[0097]
19
f nmr(376mhz,cdcl3)δ
‑
66.99.ir(neat,cm
‑1)3065,2925,1669,1594,1490,1400,1299,1172,1131,822,750.hrms(esi)m/z:[m h]
calcd for c
16
h
14
f3o2s 327.0667;found 327.0668.
[0098]
实施例7
[0099][0100]
无需氮气保护,在10ml反应瓶中依次加入1.4mg pd(dba)2,2.7mg l1配体和0.5ml的1,1,1,3,3,3
‑
六氟异丙醇,室温下搅拌完全后加入41.0mg烯丙基碳酸酯i
‑
2,19.7mg苯基亚磺酸钠ii
‑
4。反应体系在60℃下搅拌反应24小时。将反应液浓缩旋干,通过硅胶柱(洗脱液:乙酸乙酯/石油醚=1/10)分离得到纯化产物(e)
‑
iii
‑
7。产率为82%,e:z>95:5,纯品结构表征数据如下:
[0101]1h nmr(400mhz,cdcl3)δ7.68(dd,j=15.1,7.5hz,3h),7.53(t,j=7.8hz,2h),7.32
‑
7.25(m,1h),7.21(t,j=7.4hz),6.65(d,j=7.3hz),3.77,2.35(q,j=2.6hz).
[0102]
13
c nmr(100mhz,cdcl3)δ138.89,135.40(q,2j
c
‑
f
=30.2hz),134.73(q,3j
c
‑
f
=
2.9hz),134.15,133.22(q,4j
c
‑
f
=1.7hz),129.41,128.63,128.56,128.48,123.25(q,1j
c
‑
f
=274.1hz),62.78,19.3.
[0103]
19
f nmr(376mhz,cdcl3)δ
‑
57.36.ir(neat,cm
‑1)3063,2925,1447,1323,1225,1165,1121,1085,766,743.hrms(esi)m/z:[m h]
calcd for c
17
h
16
f3o2s 341.3602;found 341.3603.
[0104]
实施例8
[0105][0106]
无需氮气保护,在10ml反应瓶中依次加入1.4mg pd(dba)2,2.7mg l1配体和0.5ml的1,1,1,3,3,3
‑
六氟异丙醇,室温下搅拌完全后加入39.6mg烯丙基碳酸酯i
‑
1,21.4mg对甲苯亚磺酸钠ii
‑
5。反应体系在60℃下搅拌反应24小时。将反应液浓缩旋干,通过硅胶柱(洗脱液:乙酸乙酯/石油醚=1/10)分离得到纯化产物(e)
‑
iii
‑
8。产率为81%,e:z>99:1,纯品结构表征数据如下:
[0107]1h nmr(400mhz,cdcl3)δ7.66(d,j=8.3hz,2h),7.35(t,j=8.1hz,3h),7.27(t,j=7.5hz,2h),6.77(d,j=7.4hz,2h),6.52
‑
6.44(m,1h),3.78
‑
3.71(m,2h),2.49(s,3h).
[0108]
13
c nmr(100mhz,cdcl3)δ145.48,138.60(q,2j
c
‑
f
=30.5hz),135.33,130.05,129.38,129.21,128.71,128.63,123.07(q,3j
c
‑
f
=5.7hz),122.58(q,1j
c
‑
f
=272.1hz),56.04,21.83.
[0109]
19
f nmr(376mhz,cdcl3)δ
‑
66.86.ir(neat,cm
‑1)3065,2925,1669,1594,1490,1400,1299,1172,1132,866,822.hrms(esi)m/z:[m h]
calcd for c
17
h
16
f3o2s 341.3120;found341.3121.
[0110]
实施例9
[0111][0112]
无需氮气保护,在10ml反应瓶中依次加入1.4mg pd(dba)2,2.7mg l1配体和0.5ml的乙腈,室温下搅拌完全后加入39.6mg烯丙基碳酸酯i
‑
1,11.3mg苯酚ii
‑
6,65.2mg碳酸铯。反应体系在60℃下搅拌反应24小时。将反应液浓缩旋干,通过硅胶柱(洗脱液:乙酸乙酯/石油醚=1/100)分离得到纯化产物(e)
‑
iii
‑
9。产率为68%,e:z>99:1,纯品结构表征数据如下:
[0113]1h nmr(400mhz,cdcl3)δ7.35
‑
7.29(m,3h),7.20
‑
7.12(m,4h),6.84(t,j=7.3hz,1h),6.68(d,j=8.2hz,2h),6.60
‑
6.54(m,1h),4.39(dq,j=6.4,2.2hz,2h).
[0114]
13
c nmr(100mhz,cdcl3)δ158.07,133.81(q,2j
c
‑
f
=30.1hz),131.91(q,3j
c
‑
f
=5.5hz),131.34,129.67,129.32,128.84,124.40,123.04(q,1j
c
‑
f
=271.8hz),121.43,
114.69,64.30.
[0115]
19
f nmr(376mhz,cdcl3)δ
‑
66.26.ir(neat,cm
‑1)3062,2927,1743,1493,1219,1175,1124,754.hrms(esi)m/z:[m h]
calcd for c
16
h
14
f3o 279.0977;found 279.0988.
[0116]
实施例10
[0117][0118]
无需氮气保护,在10ml反应瓶中依次加入1.4mg pd(dba)2,2.7mg l1配体和0.5ml的乙腈,室温下搅拌完全后加入41.0mg烯丙基碳酸酯i
‑
4,20.8mg间溴苯酚ii
‑
7,65.2mg碳酸铯。反应体系在60℃下搅拌反应24小时。将反应液浓缩旋干,通过硅胶柱(洗脱液:乙酸乙酯/石油醚=1/100)分离得到纯化产物(e)
‑
iii
‑
10。产率为76%,e:z>99:1,纯品结构表征数据如下:
[0119]1h nmr(400mhz,cdcl3)δ7.38(d,j=8.5hz,2h),7.30(d,j=8.0hz,2h),7.26
‑
7.19(m,2h),7.05(d,j=2.0hz,1h),6.86(dt,j=7.6,2.2hz,1h),6.77
‑
6.70(m,1h),4.64
‑
4.58(m,2h),2.53(s,3h).
[0120]
13
c nmr(100mhz,cdcl3)δ158.84,139.46,134.39(q,2j
c
‑
f
=30.0hz),130.83(q,3j
c
‑
f
=5.4hz),130.74,129.63,129.17,124.52,123.02(q,1j
c
‑
f
=271.7hz),122.95,117.86,113.86,64.59,21.46.
[0121]
19
f nmr(376mhz,cdcl3)δ
‑
66.37.ir(neat,cm
‑1)2974,1576,1474,1221,1171,1124,821.hrms(esi)m/z:[m]calcd for c
17
h
15
of3br 371.0258;found 371.0261.
[0122]
实施例11
[0123][0124]
无需氮气保护,在10ml反应瓶中依次加入1.4mg pd(dba)2,2.7mg l1配体和0.5ml的乙腈,室温下搅拌完全后加入39.6mg烯丙基碳酸酯i
‑
1,18.0mg水ii
‑
8,65.2mg碳酸铯。反应体系在60℃下搅拌反应24小时。将反应液浓缩旋干,通过硅胶柱(洗脱液:乙酸乙酯/石油醚=1/10)分离得到纯化产物(e)
‑
iii
‑
11。产率为64%,e:z>99:1,纯品结构表征数据如下:
[0125]1h nmr(400mhz,cdcl3)δ7.47
‑
7.41(m,3h),7.32
‑
7.24(m,2h),6.61
‑
6.54(m,1h),4.88
‑
4.81(m,2h).
[0126]
13
c nmr(100mhz,cdcl3)δ134.80(q,3j
c
‑
f
=5.4hz),132.57(q,2j
c
‑
f
=30.0hz),131.46,129.42,129.10,128.68,123.17(q,1j
c
‑
f
=271.6hz),59.35.
[0127]
19
f nmr(376mhz,cdcl3)δ
‑
66.18.ir(neat,cm
‑1)3317,2918,1295,1171,1118,712.hrms(esi)m/z:[m h]
calcd for c
10
h
10
f3o 203.0684;found 203.0674.
[0128]
实施例12
[0129][0130]
无需氮气保护,在10ml反应瓶中依次加入1.4mg pd(dba)2,2.7mg l1配体和0.5ml的乙腈,室温下搅拌完全后加入41.0mg烯丙基碳酸酯i
‑
4,18.0mg水ii
‑
8,65.2mg碳酸铯。反应体系在60℃下搅拌反应24小时。将反应液浓缩旋干,通过硅胶柱(洗脱液:乙酸乙酯/石油醚=1/10)分离得到纯化产物(e)
‑
iii
‑
12。产率为71%,e:z>99:1,纯品结构表征数据如下:
[0131]1h nmr(400mhz,cdcl3)δ7.31(d,j=7.6hz,2h),7.22(d,j=7.6hz,2h),6.62(t,j=6.0hz,1h),4.23(d,j=5.6hz,2h),2.48(s,3h),2.26(s,1h).
[0132]
13
c nmr(100mhz,cdcl3)δ139.06,134.53(q,3j
c
‑
f
=5.3hz),132.46(q,2j
c
‑
f
=29.9hz),129.35,129.26,128.43,123.24(q,1j
c
‑
f
=271.6hz),59.25,21.30.
[0133]
19
f nmr(376mhz,cdcl3)δ
‑
66.18.ir(neat,cm
‑1)3310,2997,1774,1176,1123,1015,742.hrms(esi)m/z:[m]calcd for c
11
h
12
of
3 217.0840;found 217.0844.
[0134]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。