1.本发明属于生物技术领域的蛋白质复性方法,具体涉及到一种以锌离子辅助的梯度透析复性方法。
背景技术:
2.核受体(nuclear receptors,nrs)是一类感受体内代谢信号与生长信号的细胞核受体的总称,属于配体活化的转录因子家族。按照结合配体的不同,核受体大致可分为:维甲酸受体 (rar)和类维甲酸类受体(rxr),过氧化物酶体增殖因子活化受体(ppar),维生素d受体(vdr) 和雌激素核受体(er)等。它们都可以通过与相应的配体结合,激活自身的转录活性,通过结合相应的dna序列,招募必要的转录辅助因子形成转录机器,促进各自的下游基因表达,从而调节整个身体的代谢稳态。从蛋白质结构角度上讲,所有的核受体都包含四个主要的功能结构域:n端激活区,dna结合区(dna binding domain,dbd),铰链区(hinge domain) 以及配体结合区(ligand binding domain,lbd)。其中lbd区域包含12个α螺旋,配体与 lbd结合后改变lbd构象,通过hinge的柔性连接,靠近dbd,激活dbd结合dna的能力。dbd区域包含两个锌指结构(zinc finger),通过这种结构结合dna上的核受体反应元件序列。
3.由于核受体蛋白大多是代谢类疾病相关药物研发的重点蛋白靶点,因此核受体蛋白及其转录复合物结构的解析是理解药物作用机理的一项关键环节,药物分子与核受体蛋白结合模式亦为药物设计的核心环节。因此获得高纯度高均一度的核受体蛋白成为蛋白质晶体解析的先决条件,但是由于核受体蛋白本身的特性,导致全长蛋白可溶性表达纯化困难,而通过变复性手段又难以获得具备生物学活性的核受体。因此,对于在保证产率的同时,如何获得高纯度高均一性的核受体蛋白成为相关药物研发的难点。
4.包涵体是外源基因在原核细胞中表达时,由于新生成的多肽浓度较高,无充足的时间进行折叠,所形成的由膜包裹的高密度、不溶性蛋白质颗粒。经包涵体纯化所得到的目的蛋白纯度可达到95%以上,具有较高的纯度和均一度。但是对于包涵体蛋白的复性一直是世界公认的难题,目前尚无统一的具备普适性的复性方法适用于所有包涵体蛋白的复性,需要针对不同的蛋白性质,开发不同的蛋白复性体系。对于核受体蛋白来说,其dbd区域结构特征所导致的疏水性以及单一肽链折叠的复杂性导致其复性困难,传统的透析复性方法由于buffer 组分配比和梯度粗糙,不能够满足核受体蛋白复性的要求。在此,我们对传统的液相透析复性方法做出改进,使目标蛋白在梯度透析环境中逐渐恢复其生物结构与活性。更重要的是,为了能够稳定dbd区域的结构,我们通过添加锌离子的方式,帮助dbd区域双锌指结构的形成,从而进一步稳定三级结构,使得整个蛋白的折叠效率大大改善。该方法操作简单,能够在短期内获得高纯度且具有生物学活性的核受体蛋白,可应用到规模化生产。
5.以核受体家族成员pparγ为例,pparγ是一种被用于ii型糖尿病临床治疗的药物靶点,通过使用pparγ的完全激动剂噻唑烷二酮类(tzds)药物可完全激活pparγ的转录活
性,激活胰岛素敏感性基因的表达,改善肝脏、肌肉及脂肪组织对胰岛素的敏感性。但是,由于tzds类药物强烈的副作用,亟需开发新型的小分子激动剂,规避pparγ完全激动毒性。但是由于全长pparγ体外表达困难,目前的基于结构的配体设计都不能够分析其dbd区域的结构变化特征,因此需要对pparγ的表达方案作出优化,获得高纯度和高均一度的目的蛋白。在本专利中,以pparγ为例,通过改进型的核受体复性方法获得具有天然活性的pparγ全长蛋白。
技术实现要素:
6.本发明的目的在于优化一种适用于核受体蛋白包涵体复性的方法,提供一种简便的,获得高纯度及高均一度,具有生物学活性核受体蛋白的手段。后续获得蛋白可用于生物学功能分析,配体药物分子筛选及结构生物学分析等。
7.为了达到上述目的,本发明以核受体蛋白pparγ为例,采取的技术方案是在增加透析的梯度,并在透析同时添加锌离子帮助dbd区形成完整的锌指结构,增强全长蛋白的折叠成功率。具体包括以下步骤:(1)通过原核表达的方式,表达携带his标签的核受体蛋白(pparγ)。(2)菌体破碎裂解后,收集包涵体,通过2m-4m梯度尿素洗脱,除去大部分的杂蛋白和黏连蛋白。(3)使用8m尿素溶解最终包涵体组分,置于透析袋中,进行锌离子辅助的梯度透析。(4)使用超滤技术对透析复性完成后蛋白液进行浓缩。(5)镍柱纯化目的蛋白,透析除去咪唑,保存于storage buffer中。(6)对复性纯化后核受体蛋白进行生物学活性的评估与测定。
8.使用的用于评价蛋白质量的手段包括:纯度分析:sds-page(聚丙烯酰胺凝胶电泳)蛋白质均一度分析:蛋白质品控仪蛋白质活性分析:mst(微量热泳动)
附图说明
9.图1:纯化后的纯度检测,(左)sds-page考马斯亮蓝,(右)western blotting检测。
10.图2:蛋白质品控仪器质控图(均一度及活性),其中sample 1为不加配体分子纯 pparγ空对照,sample 2为dmso阴性对照组,sample 3为100nm罗格列酮(rosiglitazone, rsg)组,sample 4为1μm rsg组。所有组别中pparγ的浓度为1μm。
11.图3:mst活性分析图(生物学活性分析),0-1mm共16个梯度的rsg与100nmpparγ进行体外binding,mst检测相互作用。
具体实施方式
以下结合实例对本发明的原理和特征进行描述,所举实例只用于解释本发明,并未用于限定本发明的范围。
12.pparγ的原核表达1.将测序正确的pet30a-his-pparγ质粒转化大肠杆菌bl21感受态细胞,挑单克隆菌
落,200 转每分钟震荡培养12~16小时,按照5%转接3l新鲜lb培养基,37摄氏度200转每分钟震荡培养3~4小时(至600nm处od值达到0.55),加入终浓度为1mm的异丙基硫代半乳糖苷 (iptg)16摄氏度200转每分钟震荡培养16小时;2.诱导表达完成后,高速离心收集菌体。弃去上清,在菌体沉淀中加入10倍体积的bacterialysis buffer 1(50mm tris,150mm nacl,ph=8)重悬,加入终浓度为1mm的蛋白酶抑制剂pmsf,超高压破碎菌体。随后,使用冷冻高速离心机10000rcf每分钟离心30分钟,弃上清,包涵体沉淀依次用inclusion body wash buffer 1~3清洗包涵体沉淀,每次清洗均采用 12000rcf离心法收集沉淀。最终沉淀产物,使用inclusion body wash buffer 4重悬,溶解。再次离心,收集上清,备用。表1:inclusion body wash buffer
ꢀꢀ
tris basenaclureabuffer 150mm150mm-buffer 250mm150mm2mbuffer 350mm150mm4mbuffer 450mm150mm8m注:上述溶液ph值均为8.0
13.pparγ包涵体蛋白的透析复性1.取上述最后一步上清液,测定蛋白浓度。按照蛋白浓度,取总蛋白量10mg上清液,采用逐滴滴加的方式,溶解于inclusion body wash buffer 4中,使得终浓度为0.1mg/ml。2.将上述蛋白液装入孔径为30kd的透析袋中,于renaturation buffer 1中4℃透析过夜。3.依次换用renaturation buffer 2~8,每次透析6~8小时。表2:renaturation buffer ꢀ
tris basenaclureaarginineglycerolznso4
·
7(h2o)dttbuffer150mm150mm4m
--
10μm1mmbuffer250mm150mm2m0.5m-10μm1mmbuffer350mm150mm1m0.5m-10μm1mmbuffer450mm150mm-0.5m10%10μm1mmbuffer550mm150mm-0.25m10%10μm1mmbuffer650mm150mm-0.1m10%10μm1mmbuffer750mm150mm
--
10%10μm1mmbuffer850mm150mm
---
10μm1mm
注:上述溶液ph值均为8.04.将所得蛋白液于超滤管中进行浓缩,使得浓缩后的蛋白浓度为0.5mg/ml。
14.复性后蛋白的纯化1.使用镍离子亲和柱(ni
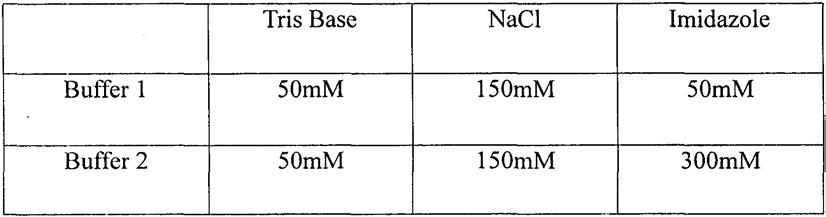
)将上一步浓缩获得的蛋白进行纯化。依次用下表中(表3)的 elution buffer 1~3进行洗脱。其中,于elution buffer 2处可获得高纯度的复性蛋白。表3:elution buffer
注:上述溶液ph值均为8.0
15.复性后pparγ的均一度及生物活性检测1.均一度质控:使用nanotemper tycho nt.6蛋白品控仪对蛋白样品进行均一度检测。检测标准为单一的热量吸收峰。2.生物活性质控:使用monolith nt.115
pico
微量热泳动,评价pparγ不同的小分子配体与其结合的kd,以此判断复性蛋白的生物学活性。
16.以上实施例进一步说明本发明的内容,但不应理解为对本发明的限制。对于本领域的技术人员来说,在不背离本发明精神和实质的情况下对本发明方法、步骤或条件所做的修改和替换,均属于本发明的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。