1.本发明属于分子生物学技术领域,具体涉及一种用于鉴别非洲猪瘟野毒与疫苗毒株的四重定量荧光探针引物组合、试剂盒及鉴别方法。
背景技术:
2.非洲猪瘟(african swine fever,asf)是由非洲猪瘟病毒(african swine fever virus,asfv)引起猪的一种急性、发热、高度接触传染性疾病。家猪与野猪普遍易感,软蜱为asfv的贮藏宿主和媒介。asfv的潜伏期为5
‑
15天,一旦爆发病程短,病死率高,可达100%。临场症状复杂且难以与其他疾病进行区分,多表现为高热、皮肤充血、流产、水肿及脏器出血。然而,非洲猪瘟发病后并没有有效的治疗措施,且该病毒具有复杂的免疫逃避机制,缺乏典型的中和抗体,也没有有效的疫苗防疫。
3.asfv是一种直径约为170
‑
200nm的正20面体病毒,由内部的双链dna和外周的衣壳及囊膜组成,大小约170~190kb。asfv基因组的两端通过部分碱基配对形成发夹环,中间区域较为保守,两端靠近发夹环部位有末端重复序列和可变区,asfv基因组大小变化由可变区决定。
4.目前国内的主流疫苗由中国农业科学院哈尔滨兽医研究所步志高等利用分离到的黑龙江非洲猪瘟流行毒株(pig/cn/hlj/2018)为亲本,构建了mgf360
‑
505r基因缺失和cd2v(ep402r)与mgf360
‑
505r双基因联合缺失的减毒活疫苗,分别命名为rasfvδ360
‑
egfp、rasfvδcd2v/360
‑
egfp
‑
mcherry。另外张艳艳等以我国首例非洲猪瘟疫情中分离的流行毒株(sy18)为亲本株,构建了mgf基因和cd2v(ep402r)基因缺失的非洲猪瘟病毒基因缺失疫苗候选株,主要缺失的毒力基因有多基因家族mgf360
‑
505(mgf360
‑
9l、mgf360
‑
10l、mgf360
‑
11l、mgf360
‑
12l、mgf360
‑
13l、mgf360
‑
14l、505
‑
1r、505
‑
2r、505
‑
3r)和ep402r,随着今后疫苗的上市,可能出现阴性场感染疫苗毒的情况,由于非洲猪瘟野毒感染与疫苗毒感染,对于猪场的疫病防控措施及拔牙的方法都有极大的区别,因此建立一种快速、灵敏、准确的鉴别非洲猪瘟野毒株与基因缺失疫苗毒株的方法显得尤为重要。
技术实现要素:
5.本发明的目的在于提供一种用于鉴别非洲猪瘟野毒与疫苗毒株的四重定量荧光探针引物组合、试剂盒及鉴别方法。
6.为了实现上述发明目的,本发明采用以下技术方案:
7.一组用于鉴别非洲猪瘟野毒与疫苗毒株的四重定量荧光探针引物组合,包括:用于检测非洲猪瘟病毒b646l基因、非洲猪瘟病毒ep402r基因、非洲猪瘟病毒mgf360
‑
14l基因、非洲猪瘟病毒疫苗毒株特有egfp荧光报告基因的引物探针组合;
8.所述用于检测非洲猪瘟病毒b646l基因的引物探针组合,其核苷酸序列如下:
9.上游引物b646l
‑
f:如seq id no:1所示
10.下游引物b646l
‑
r:如seq id no:2所示
11.荧光探针b646l
‑
p:如seq id no:3所示;
12.所述用于检测非洲猪瘟病毒ep402r基因的引物探针组合,其核苷酸序列如下:
13.上游引物ep402r
‑
f:如seq id no:4所示
14.下游引物ep402r
‑
r:如seq id no:5所示
15.荧光探针ep402r
‑
p:如seq id no:6所示;
16.所述用于检测非洲猪瘟病毒mgf360
‑
14l基因的引物探针组合,其核苷酸序列如下:
17.上游引物mgf360
‑
f:如seq id no:7所示
18.下游引物mgf360
‑
r:如seq id no:8所示
19.荧光探针mgf360
‑
p:如seq id no:9所示;
20.所述用于检测非洲猪瘟病毒疫苗egfp基因的引物探针组合,其核苷酸序列如下:
21.上游引物egfp
‑
f:如seq id no:10所示
22.下游引物egfp
‑
r:如seq id no:11所示
23.荧光探针egfp
‑
p:如seq id no:12所示。
24.进一步地,所述探针为水解探针,所述探针的5’端标记有荧光报告基团和3’端标记有淬灭基团。
25.进一步地,所述荧光报告基团选自fam、hex、cy5、rox中的任一种;所述淬灭基团选自bhq1、tamra、bhq2中的任一种。
26.进一步地,不同特异性探针的5’端标记荧光报告基团不同。
27.一种用于鉴别非洲猪瘟野毒与疫苗毒株的四重荧光定量pcr的试剂盒,包括上述引物探针组合。
28.进一步地,所述试剂盒还包括阳性对照。所述阳性对照包括含有非洲猪瘟病毒b646l基因的重组质粒、含有非洲猪瘟病毒ep402r基因的重组质粒、含有非洲猪瘟病毒mgf360
‑
14l基因的重组质粒和含有荧光蛋白egfp基因的质粒。
29.进一步地,所述试剂盒还包括阴性对照,所述阴性对照为水。
30.一种鉴别非洲猪瘟野毒株与疫苗毒株的方法,该方法是使用上述引物探针组合或上述试剂盒进行实时荧光定量pcr,收集荧光信号,确定受试样品中是否含有非洲猪瘟病毒野毒株和/或疫苗株。
31.所述实时荧光定量pcr的反应条件为:94
‑
96℃,2
‑
3min;94
‑
96℃,25
‑
30s;58℃
‑
60℃,30
‑
35s;40
‑
42个循环。
32.与现有技术相比,本发明具有以下特点:
33.1、由于非洲猪瘟基因缺失疫苗毒株缺失的毒力基因ep402r和mgf位于asfv的可变区,因此在遗传进化过程中容易发生突变,且采用四个荧光通道,如果ct值差距过大,会导致荧光抑制,从而在检测过程中,影响检出率。即在毒力基因较短的高度保守的序列中,找到合适的引物探针序列且扩增效率接近,同时通过调整引物与荧光探针的比例,进一步使四对荧光探针保持较一致的扩增效率。
34.2、本发明针对目前国内研发的主流非洲猪瘟基因缺失疫苗毒株,包括mgf360基因缺失苗、mgf360
‑
505基因缺失苗,ep402r单基因缺失苗和mgf360
‑
505、ep402r联合缺失苗;
缺失的毒力基因为国内流行的基因ii型的非洲猪瘟病毒的多基因家族mgf360
‑
505(包括mgf360
‑
9l、mgf360
‑
10l、mgf360
‑
11l、mgf360
‑
12l、mgf360
‑
13l、mgf360
‑
14l、mgf505
‑
1r、mgf505
‑
2r、mgf505
‑
3r)和ep402r,其中通过对多基因家族缺失的基因进行比对后,发现大多数缺失的毒力基因同源性很低,突变位点较多,只有mgf360
‑
14l中有一段高度保守的基因序列,因此选取该段基因进行引物设计。
35.3、当出现非洲猪瘟野毒与疫苗毒共同感染时,单靠鉴别缺失的基因无法确定是否存在基因缺失疫苗毒感染,本发明提供一种进一步确诊是否感染基因缺失疫苗毒的方法,通过基因缺失重组毒株特有的荧光蛋白egfp,鉴定是否为野毒与基因缺失疫苗毒共同感染。
36.4、本发明的特异性较强,对于猪瘟病毒、猪伪狂犬病毒、猪蓝耳病毒、猪圆环病毒、猪细小病毒和猪乙型脑炎病毒,均无非特异性扩增曲线,保证检测的准确性。
37.5、本发明建立了一个快速鉴别非洲猪瘟野毒株与疫苗毒株的检测试剂盒,具有灵敏性高、特异性强、重复性和稳定性好的特点。
附图说明
38.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
39.图1为非洲猪瘟病毒b646l基因的荧光扩增曲线图。
40.图2为非洲猪瘟病毒b646l基因的标准曲线图。
41.图3为非洲猪瘟病毒ep402r基因的荧光扩增曲线图。
42.图4为非洲猪瘟病毒ep402r基因的标准曲线图。
43.图5为非洲猪瘟病毒mgf360基因的荧光扩增曲线图。
44.图6为非洲猪瘟病毒mgf360基因的标准曲线图。
45.图7为非洲猪瘟疫苗株egfp基因的荧光扩增曲线图。
46.图8为非洲猪瘟疫苗株egfp基因的标准曲线图。
47.图9为特异性实验得到的荧光扩增曲线图。
具体实施方式
48.下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
49.本发明针对目前国内研发的非洲猪瘟基因缺失毒株,选取非洲猪瘟的b646l、ep402r、mgf360
‑
14l的基因序列以及非洲猪瘟基因缺失减毒疫苗株特有的egfp荧光报告基因,设计合成针对该四个基因的特异性引物和探针,建立了鉴别非洲猪瘟野毒株与疫苗毒株的方法并研制方便诊断的试剂盒。所述试剂盒和鉴定方法能够同时鉴别非洲猪瘟野毒株与疫苗毒株的四个基因,不同基因的引物之间互相无干扰,并且具有灵敏性高、特异性强、
重复性和稳定性好的特点。
50.所述荧光探针b646l
‑
p、mgf360
‑
p、ep402r
‑
p、egfp
‑
p的5'
‑
端可以标记荧光报告基团fam、hex、cy5、rox中的任一种,所述荧光探针3'
‑
端可以标记荧光淬灭基团bhq1、tamra、bhq2中的任一种。
51.所述荧光探针b646l
‑
p、mgf360
‑
p、ep402r
‑
p、egfp
‑
p分别标记三种不同的荧光基团。
52.具体地:
53.所述非洲猪瘟病毒b646l基因序列如下:
54.gcagatgccgataccacaagatcagccgtagtgatagaccccacgtaatccgtgtcccaactaatataaaattctcttgctctggatacgttaatatgaccactgggttggtattcctcccgtgg(seq id no:13)
55.用于检测非洲猪瘟病毒b646l基因的引物探针组合包括:
56.上游引物b646l
‑
f:5
’‑
ccacgggaggaataccaa
ꢀ‑3’
(seq id no:1)
57.下游引物b646l
‑
r:5
’‑
gcagatgccgataccaca
‑3’
(seq id no:2)
58.荧光探针b646l
‑
p:fam
‑
tcatattaacgtatccagagcaaga
–
bhq1(seq id no:3);
59.所述非洲猪瘟病毒ep402r基因序列如下:
60.tgaagaaatagaaagtccaccacctgaatctaatgaagaagaacaatgtcagcatgatgacaccacttccatacatgaaccatctcccagagaaccattacttcctaagccttacagtcgttatcagtataatacacctatttactacatgcgtc(seq id no:14)
61.用于检测非洲猪瘟病毒ep402r基因的引物探针组和包括:
62.上游引物ep402r
‑
f:5
’‑
tgaagaaatagaaagtccacc
‑3’
(seq id no:4)
63.下游引物ep402r
‑
r:5
’‑
gacgcatgtagtaaataggtgta
‑3’
(seq id no:5)
64.荧光探针ep402r
‑
p:hex
‑
aggcttaggaagtaatggttctctggg
–
tramra(seq id no:6);
65.所述非洲猪瘟病毒mgf360
‑
14l基因序列如下:
66.tatttgtggattggggcgcaaatcctgaatatgggcttatacgtgttcctgccgtgtatctaaagcggctgtgtgcggaactgggaggcttaacgcctgtatccgaaccc(seq id no:15)
67.用于检测非洲猪瘟病毒mgf360
‑
14l基因的引物探针组合包括:
68.上游引物mgf360
‑
f:5
’‑
tatttgtggattggggcg
‑3’
(seq id no:7)
69.下游引物mgf360
‑
r:5
’‑
gggttcggatacaggcgt
‑3’
(seq id no:8)
70.荧光探针mgf360
‑
p:cy5
‑
agcctcccagttccgcacacagccgctt
–
bhq2(seq id no:9);
71.所述mgf360
‑
p荧光报告基因序列如下:
72.tatttgtggattggggcgcaaatcctgaatatgggcttatacgtgttcctgccgtgtatctaaagcggctgtgtgcggaactgggaggcttaacgcctgtatccgaaccc(seq id no:16)
73.用于检测egfp荧光报告的引物探针组合包括:
74.上游引物egfp
‑
f:5
’‑
accctcgtgaccaccctga
‑3’
(seq id no:10)
75.下游引物egfp
‑
r:5
’‑
tagttgccgtcgtccttga
‑3’
(seq id no:11)
76.荧光探针egfp
‑
p:rox
‑
agtgcttcagccgctaccccga
–
bhq2(seq id no:12)。
77.本发明还提供使用所述专用引物和探针组鉴别检测非洲猪瘟病毒野毒株和疫苗株的四重荧光pcr方法,具体如下:
78.1、提取待测样品的总dna备用。
79.2、配制反应体系:样品dna 5μl,引物预混液4μl(400nm),探针预混液2μl(200nm),pcr扩增液12.5μl,ddh2o 1.5μl。
80.3、扩增程序
81.37℃2min,95℃30s,循环为95℃10s,58℃30s(采集荧光信号),共计40个循环。共4个荧光通道,分别是:报告基团“fam”、淬灭基团“bhq1”;报告基团“hex”、淬灭基团“tamra”;报告基团“cy5”、淬灭基团“bhq2”;报告基团“rox”、淬灭基团“bhq2”。
82.4、结果判定
83.阳性对照四个通道ct值<30并出现特异的s型扩增曲线,阴性对照无ct值且无特异的扩增曲线,二者均成立可判定实验结果成立。
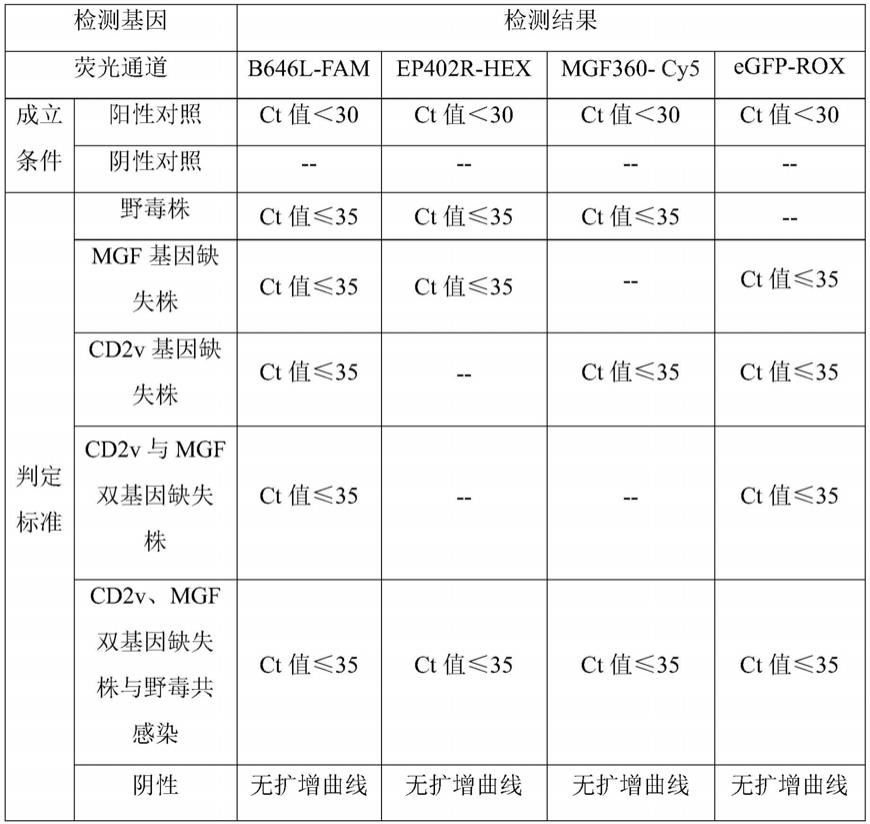
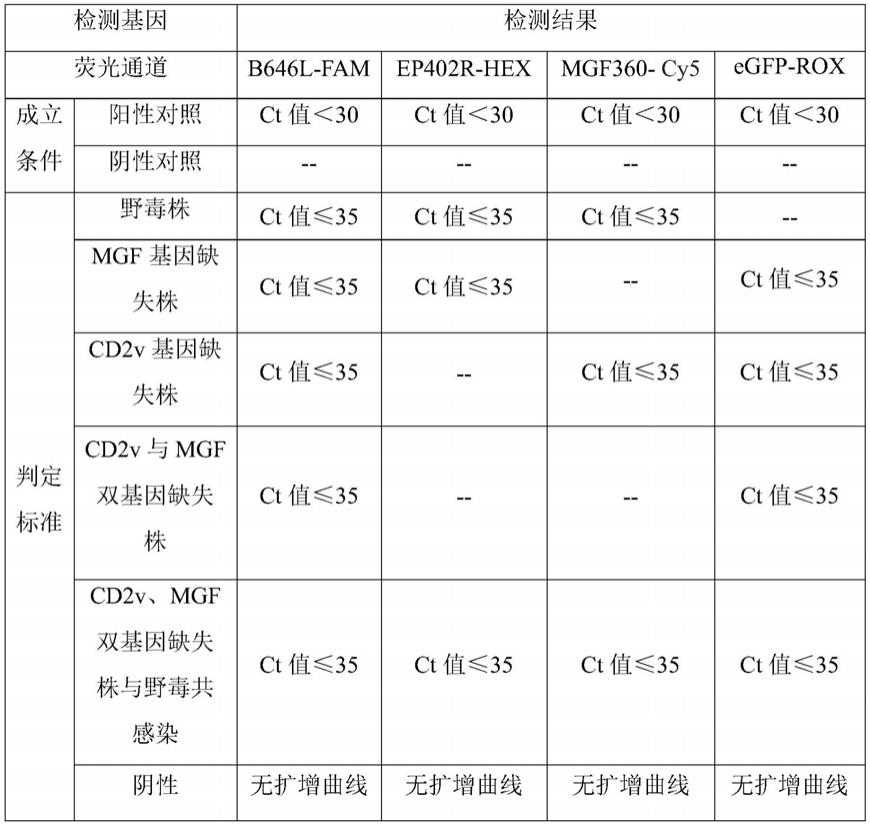
84.检测结果判定标准:
[0085][0086]
被检样品ct值≤35并出现特异的s型扩增曲线,判为非洲猪瘟病毒核酸阳性;无ct值且无特异的扩增曲线,判为非洲猪瘟病毒核酸阴性;35<ct值<40并出现特异的扩增曲线,判为非洲猪瘟病毒核酸可疑,可疑样品需重新取样提取dna,进行复检,ct值<40判为阳性,否则判为阴性。
[0087]
本发明还提供使用所述四组引物和探针制备的试剂盒,所述试剂盒可用于辅助鉴别非洲猪瘟病毒野毒株和疫苗株,和/或检测样品中是否含有非洲猪瘟病毒野毒株和/或疫
苗株。
[0088]
该试剂盒还包括以下试剂:阳性对照、阴性对照、引物预混液、探针预混液、pcr扩增液;
[0089]
阳性对照:含有b646l、ep402r和mgf360
‑
14l基因片段的重组质粒以及质粒pcmv
‑
c
‑
egfp;
[0090]
阴性对照:双蒸水;
[0091]
引物预混液:包括初始浓度为10μm的mgf360
‑
f、mgf360
‑
r、ep402r
‑
f、ep402r
‑
r、b646l
‑
f、b646l
‑
r、egfp
‑
f、egfp
‑
r摩尔比为1:1:1:1:1:1:1:1的预混液;
[0092]
探针预混液:初始浓度为10μm的mgf360
‑
p、ep402r
‑
p、ep402r
‑
p、egfp
‑
p摩尔比为1:1:1:1的预混液;
[0093]
pcr扩增液包括:2
×
animal detection probe master mix。
[0094]
本发明还提供了用于检测受试样品中是否含有非洲猪瘟病毒野毒株与疫苗株的方法。使用所述引物探针组合或所述试剂盒对受试样品提取的核酸进行pcr扩增反应,收集荧光信号,确定受试样品中是否含有非洲猪瘟病毒野毒株和/或疫苗株。
[0095]
下面就本发明的技术方案做详细说明。以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
[0096]
实施例1
[0097]
1、阳性标准品的制备
[0098]
b646l、ep402r和mgf360
‑
14l的阳性标准品用已知asfv的阳性样品提取dna,按照天根的dna病毒提取试剂盒,进行总dna的提取,采用25μl的体系,反应体系包括:2
×
pcr mix 10μl、上游引物1μl、下游引物1μl、dna 2μl、truescript enzyme mix 0.8μl以及rnase free h2o(无核酸酶水)10.2μl。pcr扩增程序:94℃5min;循环94℃30s,55℃30s,72℃30s,共30个循环;再72℃延伸10min。扩增完成后,所有产物用1%琼脂糖凝胶电泳鉴定。鉴定为阳性的pcr产物用天根的胶回收试剂盒进行纯化回收,连接到peasy
‑
t1载体并转化到dh5
ɑ
感受态细胞,挑取阳性克隆,用lb培养液摇菌扩增后,将菌液送到上海生工生物工程有限公司进行测序。
[0099]
egfp的阳性标准品使用实验室保存的质粒pcmv
‑
egfp。
[0100]
2、四重荧光定量pcr条件优化
[0101]
用天根的质粒提取试剂盒提取标准质粒,用nanodrop 2000核酸浓度测定仪检测质粒模板浓度,将四种标准质粒分别进行10倍梯度稀释后取浓度104copise/μl,1:1:1:1进行混合作为模板,总体系25μl,将上下游引物与相应探针分别以不同的探针终浓度和引物终浓度进行混合,引物(上、下游)与相应探针分别加0.5μl、0.25μl(200nm:100nm),0.5μl、0.5μl(200nm:200nm),1μl、0.5μl(400nm:200nm),1μl、1μl(400nm:400nm),所有引物探针应用浓度均为10μm,按本发明提供的扩增程序37℃2min,95℃30s,循环为95℃10s,58℃30s(采集荧光信号),共计40个循环,进行pcr扩增,以获得最低的ct值和较高的荧光强度增加值时的引物探针浓度比例为最佳。
[0102]
引物浓度和探针浓度分组试验:
[0103][0104]
实验结果说明,用不同组合探针和引物浓度进行最佳反应体系摸索实验,发现当探针终浓度为200nm,引物终浓度为400nm时该多重qpcr反应中cy5和rox荧光强度最高,且ct值也最低(因为该多重检测方法中cy5和rox荧光本身就相对较弱,因此选择cy5和rox荧光强度最大的引物探针组合作为最佳组合)。
[0105]
将四种标准质粒分别进行10倍梯度稀释后作为模板,取其中浓度为108、107、106、105、104、103、102、101copise/μl进行敏感度测定,采用单重qpcr反应体系:dna模板5μl,上、下游引物1μl(400nm),探针0.5μl(200nm),pcr扩增液12.5μl,ddh2o 6μl,所有引物探针应用浓度均为10μm。扩增程序37℃2min,95℃30s,循环为95℃10s,58℃30s(采集荧光信号),共计40个循环,进行pcr扩增,并分析其标准曲线。
[0106]
如图1
‑
8所示,在稀释的现行浓度范围内,模板量与对应的ct值呈较好的线性关系,相关系数r2分别为0.999、0.998、0.998、0.998,本发明的荧光定量方法对于不同毒力基因有较高的扩增效率(99.13%
‑
101.25%),荧光定量pcr的最低检测量为102copise/μl,因此本发明建立的荧光定量pcr具有较高的敏感性。
[0107]
3、重复性试验
[0108]
分别以8个浓度的10倍梯度稀释的阳性标准品为模板,终浓度分别为108、107、106、105、104、103、102、101copise/μl,按提供荧光定量的反应体系及程序进行荧光定量pcr,每个梯度设定3个重复,验证该方法的重复性。结果表明,本发明的重复实验变异系数(cv值)均在0.5%以下,表明本发明具有很好的重复性。
[0109]
4、特异性试验
[0110]
以发明人保存的猪瘟病毒、猪伪狂犬病毒、猪蓝耳病毒、猪圆环病毒、猪细小病毒和猪乙型脑炎病毒阳性样品作为模板,用本发明中的引物及探针进行荧光定量pcr扩增。结果如图9所示,该体系中不同信号通道检测结果均为阴性,表明该方法特异性强,与其他主要传染病原无交叉反应。
[0111]
上述对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
[0112]
序列表
[0113]
<110>福建傲农生物科技集团股份有限公司
[0114]
<120>一种用于鉴别非洲猪瘟野毒与疫苗毒株的四重定量荧光探针引物组合、试
剂盒及鉴别方法
[0115]
<130>20210806
[0116]
<160>16
[0117]
<170>siposequencelisting 1.0
[0118]
<210>1
[0119]
<211>18
[0120]
<212>dna
[0121]
<213>人工序列(artificial sequence)
[0122]
<400>1
[0123]
ccacgggagg aataccaa 18
[0124]
<210>2
[0125]
<211>18
[0126]
<212>dna
[0127]
<213>人工序列(artificial sequence)
[0128]
<400>2
[0129]
gcagatgccg ataccaca 18
[0130]
<210>3
[0131]
<211>25
[0132]
<212>dna
[0133]
<213>人工序列(artificial sequence)
[0134]
<400>3
[0135]
tcatattaac gtatccagag caaga 25
[0136]
<210>4
[0137]
<211>21
[0138]
<212>dna
[0139]
<213>人工序列(artificial sequence)
[0140]
<400>4
[0141]
tgaagaaata gaaagtccac c 21
[0142]
<210>5
[0143]
<211>23
[0144]
<212>dna
[0145]
<213>人工序列(artificial sequence)
[0146]
<400>5
[0147]
gacgcatgta gtaaataggt gta 23
[0148]
<210>6
[0149]
<211>27
[0150]
<212>dna
[0151]
<213>人工序列(artificial sequence)
[0152]
<400>6
[0153]
aggcttagga agtaatggtt ctctggg 27
[0154]
<210>7
[0155]
<211>18
[0156]
<212>dna
[0157]
<213>人工序列(artificial sequence)
[0158]
<400>7
[0159]
tatttgtgga ttggggcg 18
[0160]
<210>8
[0161]
<211>18
[0162]
<212>dna
[0163]
<213>人工序列(artificial sequence)
[0164]
<400>8
[0165]
gggttcggat acaggcgt 18
[0166]
<210>9
[0167]
<211>28
[0168]
<212>dna
[0169]
<213>人工序列(artificial sequence)
[0170]
<400>9
[0171]
agcctcccag ttccgcacac agccgctt 28
[0172]
<210>10
[0173]
<211>19
[0174]
<212>dna
[0175]
<213>人工序列(artificial sequence)
[0176]
<400>10
[0177]
accctcgtga ccaccctga 19
[0178]
<210>11
[0179]
<211>19
[0180]
<212>dna
[0181]
<213>人工序列(artificial sequence)
[0182]
<400>11
[0183]
tagttgccgt cgtccttga 19
[0184]
<210>12
[0185]
<211>22
[0186]
<212>dna
[0187]
<213>人工序列(artificial sequence)
[0188]
<400>12
[0189]
agtgcttcag ccgctacccc ga 22
[0190]
<210>13
[0191]
<211>125
[0192]
<212>dna
[0193]
<213>人工序列(artificial sequence)
[0194]
<400>13
[0195]
gcagatgccg ataccacaag atcagccgta gtgatagacc ccacgtaatc cgtgtcccaa 60
[0196]
ctaatataaa attctcttgc tctggatacg ttaatatgac cactgggttg gtattcctcc 120
[0197]
cgtgg 125
[0198]
<210>14
[0199]
<211>155
[0200]
<212>dna
[0201]
<213>人工序列(artificial sequence)
[0202]
<400>14
[0203]
tgaagaaata gaaagtccac cacctgaatc taatgaagaa gaacaatgtc agcatgatga 60
[0204]
caccacttcc atacatgaac catctcccag agaaccatta cttcctaagc cttacagtcg 120
[0205]
ttatcagtat aatacaccta tttactacat gcgtc 155
[0206]
<210>15
[0207]
<211>110
[0208]
<212>dna
[0209]
<213>人工序列(artificial sequence)
[0210]
<400>15
[0211]
tatttgtgga ttggggcgca aatcctgaat atgggcttat acgtgttcct gccgtgtatc 60
[0212]
taaagcggct gtgtgcggaa ctgggaggct taacgcctgt atccgaaccc 110
[0213]
<210>16
[0214]
<211>110
[0215]
<212>dna
[0216]
<213>人工序列(artificial sequence)
[0217]
<400>16
[0218]
tatttgtgga ttggggcgca aatcctgaat atgggcttat acgtgttcct gccgtgtatc 60
[0219]
taaagcggct gtgtgcggaa ctgggaggct taacgcctgt atccgaaccc 110
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。