一株嗜热链球菌s131及其在免疫调节领域中的应用
技术领域
1.本发明涉及益生菌技术领域,尤其涉及一株嗜热链球菌s131及其在免疫调节领域中的应用。
背景技术:
2.随着新冠疫情的爆发,关于机体免疫调节方向成为研究热点,而益生菌可以作为微生物制剂调节机体免疫。菌株对调节免疫具有菌株特异性,不同的菌株在免疫调节能力上存在差异。市场中大多都是活菌益生菌,其研究也只是特定菌株的在一定活菌数下对调节免疫起功效。但是有一定的局限性,在货架期随着时间的延长及生产、储存条件等外界环境的影响,导致活菌数下降,无法长时间定值,进而影响一定的功效。
3.乳酸菌的功能为促进营养物质的吸收进而促进机体生长发育,调节肠胃道菌群进而提高机体免疫力。灭活型益生菌良好的安全性和效用被认为可代替活性益生菌。并且灭活型乳酸菌具有高安全性、对菌量没有限制、耐热和ph稳定、生产保存便捷容易、不需要冷藏得外界条件的影响,同时可以起到调节肠道调节免疫的功效。但大多数灭活型益生菌的功效均不如其活菌,这也是目前灭活性乳酸菌的应用受到限制的原因。而且目前用于调理肠胃、提高免疫力的益生菌的功效有限,尤其是用于提高免疫力,需要长期服用,而且效果并不明显,加之目前益生菌的价格昂贵,并没有得到大部分人的认可,接受范围仍然非常有限。
4.目前市场上公认可以调节免疫的菌株有动物双歧杆菌和鼠李糖乳杆菌等,而嗜热链球菌主要用于酸奶发酵领域。
技术实现要素:
5.针对现有用于提高机体免疫力的益生菌存在的上述问题,本发明提供一株嗜热链球菌s131及其在免疫调节领域中的应用,嗜热链球菌s131的活菌体与灭活菌体均具有较高的粘附能力,均能显著提高巨噬细胞活性的功能,并能促进巨噬细胞分泌大量tnf
‑
α、il
‑
6和il
‑
10等多种免疫因子,可短时间内显著提升免疫细胞的活性。
6.为达到上述发明目的,本发明实施例采用了如下的技术方案:
7.一种嗜热链球菌s131,其菌株保藏号为:cgmcc no.23336,拉丁文名称为streptococcus thermophilus,于2021年09月01日保藏于中国普通微生物菌种保藏管理中心,保藏地址为:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所。
8.相对于现有技术,本发明提供的菌株保藏号为cgmcc no.23336的嗜热链球菌s131活菌具有较高的粘附能力,使其较易定植于肠道中,同时,该嗜热链球菌s131具有高产胞外多糖的能力,且其产生的胞外多糖又能与肠道免疫细胞上的信号传导受体直接作用,传递信号,起到免疫调节和抑制病菌的作用。嗜热链球菌s131的灭活菌株同样具有较高的粘附能力,且活菌与灭活菌均能够显著促进raw264.7巨噬细胞的增殖和吞噬能力,并且可调节raw264.7巨噬细胞分泌细胞因子tnf
‑
α、il
‑
6、il
‑
10的量,进而提高机体免疫,能有效调节
免疫细胞应对炎症的反应。同时,嗜热链球菌s131的灭活菌株具有安全性高、对菌量没有限制、耐热、ph稳定、生产保存便捷容易以及无需冷藏等优势,具有极高的应用价值。
9.本发明还提供所述嗜热链球菌s131在制备提高免疫力的产品中的应用。
10.本发明还提供所述的嗜热链球菌s131活菌株在制备提高免疫力的产品中的应用。
11.本发明还提供所述嗜热链球菌s131灭活菌株在制备提高免疫力的产品中的应用。
12.优选的,所述产品为促进巨噬细胞增殖的产品。
13.优选的,所述产品为提高巨噬细胞吞噬能力的产品。
14.优选的,所述产品为调节巨噬细胞分泌免疫因子的产品。
15.优选的,所述免疫因子包括tnf
‑
α、il
‑
6和il
‑
10中的至少一种。
16.优选的,所述产品为药品、食品或保健品。
17.优选的,所述产品的剂型包括粉剂、颗粒剂、片剂、胶囊剂和溶液剂。
18.优选的,所述药品包括所述嗜热链球菌s131及药学上可接受的载体。
附图说明
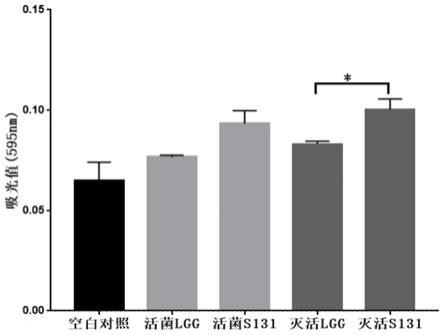
19.图1是本发明实施例1中的粘附实验中测得的吸光值统计图;
20.图2是本发明实施例1中不同浓度葡萄糖溶液与吸光度值的标准曲线图;
21.图3是本发明实施例2中嗜热链球菌s131活菌和灭活菌对巨噬细胞的增殖作用影响统计图;
22.图4是本发明实施例2中嗜热链球菌s131活菌和灭活菌对巨噬细胞的吞噬作用影响统计图;
23.图5是本发明实施例3中实验期间小鼠体质量变化情况统计图。
具体实施方式
24.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
25.实施例1
26.1、粘附实验
27.1.1、实验菌株
28.嗜热链球菌s131活菌菌悬液和灭活菌菌悬液、鼠李糖乳杆菌lgg活菌菌悬液和灭活菌菌悬液、空白对照;
29.其中,嗜热链球菌s131活菌菌悬液的制备方法为:嗜热链球菌s131活化3代后,接种于mrs液体培养基中,37℃培养18h后,4℃离心(5000r/min,5min),分别收集菌体;收集的菌体用pbs洗涤2次,4℃离心(5000r/min,5min),去除上清,菌体用含10%胎牛血清的dmem培养基重悬混匀,用0.9%生理盐水对重悬后的1ml菌液进行梯度稀释,用流式细胞仪检测菌浓,调整菌液浓度至1.5
×
108cfu/ml,得到嗜热链球菌s131活菌菌悬液;
30.嗜热链球菌s131灭活菌菌悬液的制备方法为:嗜热链球菌s131活化3代后,接种于mrs液体培养基中,37℃培养18h后,4℃离心(5000r/min,5min),分别收集菌体;收集的菌体用pbs洗涤2次,4℃离心(5000r/min,5min),去除上清,菌体用pbs重悬,于水浴锅中80℃灭
活30min,离心后去除上清,菌体用含10%胎牛血清的dmem培养基重悬混匀,用0.9%生理盐水对重悬后的1ml菌液进行梯度稀释,用流式细胞仪检测菌浓,调整菌液浓度至1.5
×
108cfu/ml,得到嗜热链球菌s131灭活菌菌悬液;
31.鼠李糖乳杆菌lgg活菌菌悬液和灭活菌菌悬液的制备方法为同嗜热链球菌s131活菌菌悬液和灭活菌菌悬液的制备方法;鼠李糖乳杆菌lgg活菌菌悬液和灭活菌菌悬液中的菌体浓度为:1.5
×
108cfu/ml;
32.空白对照为:pbs。
33.1.2、实验材料与仪器
34.实验材料:2型猪胃黏蛋白(sigma m2378
‑
100g)、吐温20、曲拉通x
‑
100、结晶紫、96孔板;
35.ph7.0的pbs:nacl 8g、kcl 0.2g、na2hpo
4 1.44g、kh2po
4 0.24g定容1l。
36.仪器:酶标仪、流式细胞仪。
37.1.3、实验方法:
38.1)黏蛋白母液的制备:称取黏蛋白0.1g溶于10ml pbs(ph 7.0)中,制成10mg/ml的黏蛋白母液,4℃保存备用;
39.2)将黏蛋白母液10倍稀释,得到终浓度为1.0mg/ml的黏蛋白溶液,分装后4℃保存备用;
40.3)在96孔板中加入100μl黏蛋白溶液,4℃过夜孵育,用无菌ph7.0pbs洗涤菌体2次;
41.4)再向4℃过夜孵育后的96孔板中每孔加入100μl含1%吐温20的pbs封闭1小时(含1%吐温20的pbs:100ml pbs中加入1g吐温20,过滤除菌);
42.5)将含1%吐温20的pbs去除,向封闭后的96孔板中每孔加入100μl菌悬液,每种菌悬液3个平行,同时加入pbs作为空白对照;
43.6)加入菌悬液的96孔板在37℃孵育3h,待孵育完毕后每孔加入100μl含0.05%吐温20的pbs,清洗2次,去除未粘附的细菌,在60℃烘箱中干燥1h(含0.05%吐温20的pbs:100ml pbs中加入0.05g吐温20,过滤除菌);
44.7)干燥后96孔板每孔加入100μl万分之一的结晶紫溶液,室温放置染色45min;然后每孔加入200μl pbs清洗4次;清洗后每孔加入100μl无水乙醇,静置10min释放染液;
45.8)用酶标仪在595nm波长下测定96孔板中各孔的吸光值,根据吸光值的高低判断菌株粘附能力。
46.1.4、实验结果
47.经测定,嗜热链球菌s131和鼠李糖杆乳菌lgg菌株的活菌与灭活菌的都具有一定的粘附能力,单菌株(s131和lgg)的活菌与灭活菌之间无显著性差异;与鼠李糖杆乳菌lgg的活性菌相比,嗜热链球菌s131的活性菌具有很强的粘附能力;且灭活型s131比灭活型lgg的粘附能力强,且有显著性差异(p<0.01),如图1中的吸光值统计图中所示。
48.2、胞外多糖实验
49.2.1、实验菌株
50.嗜热链球菌s131、对照(mrs培养基);
51.2.2、实验材料与仪器
52.试验试剂:
53.氯化钠、三氯乙酸、95%乙醇、苯酚、浓硫酸、透析袋(10kd);
54.培养基:mrs液体培养基、mrs固体培养基;
55.葡萄糖标准液的配制:准确称取干燥恒重的无水葡萄糖100mg,蒸馏水准确定容至100ml,摇匀后准确吸取10ml,用蒸馏水稀释定容至100ml,即得100ug/ml的葡萄糖标准液;
56.90%苯酚液的配制:准确移取苯酚90ml,蒸馏水定容至100ml,即得90%的苯酚液,棕色瓶中避光保存;
57.6%苯酚液的配制:将90%苯酚液稀释至6%,临用现配。
58.仪器:酶标仪
59.2.3、实验方法:
60.2.3.1、菌落拉丝法测定产胞外多糖水平
61.将嗜热链球菌s131的分离纯化菌株在mrs固体培养基上进行划线分离(2个重复),37℃厌氧培养48h,观察并记录菌落特征。用无菌牙签接触菌落,轻轻地向外拉,然后在2s内垂直离开,以在培养基表面形成连续的拉丝,重复操作5个菌落,每个菌落平行做2次,测量菌落拉丝的最大长度(mm),结果以“平均值
±
标准方差”表示(通常情况下,当菌落拉丝长度在40mm以上时,分离菌株的产胞外多糖的水平都较高)。
62.2.3.2、胞外多糖的提取和测定
63.将嗜热链球菌s131菌株活化后,转接至mrs液体培养基中,37℃培养48h,取10ml培养液在沸水浴95℃加热5min去酶活,于冷冻离心机中8000rpm、4℃离心15min,取上清,冷却至室温,在试管中取上清液5ml再加入2.5ml 12%的三氯乙酸(tca),充分搅拌后静置30min,8000rpm、4℃离心15min,取上清液。将上清液移至50ml离心管中,加3倍体积的95%的乙醇,4℃醇沉过夜,离心取沉淀(此沉淀为胞外多糖),将沉淀溶于10ml纯水中,装入透析袋,透析2d,每8h换一次水,得胞外粗多糖水溶液。
64.取25ml带塞试管,分别吸取100μg/ml葡萄糖标准液0、0.1ml、0.2ml、0.3ml、0.4ml、0.5ml、0.6ml 0.7ml、0.8ml、0.9ml、1ml于每支试管中,纯水补足至1ml,然后分别加入1ml 6%苯酚溶液,摇匀,然后迅速加入浓硫酸5ml,立即摇匀,室温静置30min,在酶标仪波长490nm处测定各反应液的吸光度值,以葡萄糖系列质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制葡萄糖标准曲线,如图2所示。
65.在带塞试管中加入胞外粗多糖水溶液1ml,另取1ml蒸馏水作为对照,然后分别加入6%苯酚溶液1ml,摇匀后迅速加入浓硫酸5ml,立即摇匀,室温静置30min,在波长490nm处测定各溶液的吸光度值,按照葡萄糖标准曲线回归方程计算胞外多糖的含量(硫酸
‑
苯酚法)。
66.2.4、实验结果
67.2.4.1、菌落拉丝法测定产胞外多糖水平过程中,嗜热链球菌s131菌落拉丝长度均在40mm以上。
68.2.4.2、根据葡萄糖标准曲线(y=0.005x
‑
0.01,r2=0.998)测的以mrs为对照的胞外多糖的产量为(304.2
±
0.4163)μg/ml;嗜热链球菌s131的胞外多糖产量为(444.2
±
2.013)μg/ml,且有极显著差异(p<0.0001)。
69.实施例2
70.细胞实验
71.1、实验试剂与仪器
72.1.1、实验试剂:dmem高糖培养液,美国invitrogen公司;胎牛血清、pbs缓冲液、青链霉素混合液、cck
‑
8试剂盒、刀豆球蛋白a(con a)、0.4%台盼蓝染色液,上海生工生物工程有限公司;快速细胞冻存液(无血清),上海雅酶生物医药科技有限公司;脂多糖(lps),美国sigma公司;中性红细胞增殖及细胞毒性检测试剂盒,碧云天;elisa试剂盒,北京四正柏生物科技有限公司;dmem完全培养液由90%的dmem、10%的胎牛血清和1%的青链霉素混合液组成。
73.1.2、实验仪器:低速离心机、自动细胞计数仪、倒置显微镜。
74.2、实验细胞与菌株
75.raw264.7(小鼠单核巨噬细胞白血病细胞);嗜热链球菌s131活菌菌悬液和灭活菌菌悬液、鼠李糖乳杆菌lgg活菌菌悬液和灭活菌菌悬液、空白对照。
76.3、实验方法
77.3.1、细胞培养:
78.将raw264.7(小鼠单核巨噬细胞白血病细胞)细胞复苏后,置于含有dmem完全培养液的培养瓶中,于37℃、5%co2培养箱中孵育,待细胞生长良好且密度达80%左右进行传代,传代3次进行实验。
79.3.2、菌悬液的制备:
80.乳酸菌活化3代后,接种于mrs液体培养基中,37℃培养18h后,4℃5000r/min离心5min,分别收集菌体;
81.收集的菌体用pbs洗涤1次,4℃、5000r/min离心5min后,去除上清,菌体用含10%胎牛血清的dmem培养液重悬混匀,用0.9%生理盐水对重悬后的1ml菌液进行梯度稀释,用流式细胞仪检测菌浓,调整菌液浓度1.5
×
108cfu/ml左右,得到活菌菌悬液。
82.收集的菌体用pbs洗涤1次,4℃、5000r/min离心5min后,去除上清,菌体用pbs重悬,于水浴锅中80℃灭活30min,离心后去除上清,用含10%胎牛血清的dmem培养液重悬混匀,用0.9%生理盐水对重悬后的1ml菌液进行梯度稀释,用流式细胞仪检测菌液浓度,调整菌液浓度1.5
×
108cfu/ml左右,得到灭活菌菌悬液。
83.嗜热链球菌s131活菌菌悬液和灭活菌菌悬液、鼠李糖乳杆菌lgg活菌菌悬液和灭活菌菌悬液均通过上述方法得到。
84.3.3、细胞增殖实验
85.收集raw264.7传代3次后的细胞(3.1中传代3次后的细胞),用0.4%台盼蓝染色液进行细胞染色,取40μl细胞悬液与40μl的0.4%台盼蓝溶液以1:1混匀,3分钟后,取20μl用自动细胞计数仪计数和稀释,按密度1.5
×
105个/ml接种于96孔板,每孔100μl细胞悬液在37℃、5%co2培养箱中过夜孵育。
86.待细胞贴壁后,弃去上清液,每孔加入100μl细胞培养液(含10%胎牛血清的dmem培养基)再各自加入100μl的活菌菌悬液或灭活菌菌悬液(分别加入3.2中得到的嗜热链球菌s131活菌菌悬液和灭活菌菌悬液和鼠李糖乳杆菌lgg活菌菌悬液和灭活菌菌悬液),空白对照组为100μl细胞培养液,每组5个重复,在37℃、5%co2条件下活菌组与细胞共孵育4h,灭活菌组与细胞共孵育24h。
87.用cck
‑
8法检测细胞活性及增殖情况:具体为,每孔内加入10μl的cck
‑
8溶液,37℃、5%co2培养箱内孵育1h,在450nm波长下测定吸光度od值,计算细胞增殖指数和增殖率。
88.细胞增殖指数=(as
‑
ac)/ac;增殖率=细胞增殖指数
×
100%。
89.式中:as表示实验组od值,ac表示空白对照组od值。
90.计算和统计结果如图3所示,嗜热链球菌s131的活菌与灭活菌均对巨噬细胞有一定的增殖效果;在活菌中,嗜热链球菌s131对巨噬细胞的增殖能力高于鼠李糖杆乳菌lgg;在灭活菌中,嗜热链球菌s131的灭活菌对巨噬细胞的增殖能力高于鼠李糖杆乳菌lgg的灭活菌。
91.3.4、细胞吞噬实验
92.收集对数生长期的raw264.7细胞,用0.4%台盼蓝染色液进行细胞染色,取40μl raw264.7细胞悬液与40μl的0.4%台盼蓝溶液以1:1混匀,3分钟后,取20μl用自动细胞计数仪计数和稀释,调整细胞浓度为1.5
×
105cells/ml,在96孔板中每孔加入100μl细胞悬液,37℃、5%co2培养箱培养过夜。
93.弃去培养液,随后加入100μl细胞培养液(含10%胎牛血清的dmem培养基)和100μl乳酸菌活菌菌悬液或灭活菌悬液(3.2中得到的嗜热链球菌s131活菌菌悬液和灭活菌菌悬液和鼠李糖乳杆菌lgg活菌菌悬液和灭活菌菌悬液),每组5个复孔,同时设定空白组(含10%胎牛血清的dmem培养基),其中活菌组与细胞共孵育4h,灭活菌组与巨噬细胞共孵育24h。
94.中性红试剂盒检测细胞吞噬效果:孵育结束后,吸出96孔板中的上清液,用pbs洗涤2次,随后加入200μl细胞培养液,同时加入20μl中性红染液,在细胞培养箱内孵育2h。除去含有中性红染液的细胞培养液,pbs洗涤1次,于每孔加入200μl中性红检测裂解液,至室温摇床裂解10min。于540nm波长处测定od值,计算细胞吞噬指数。
95.细胞吞噬指数=as/ac;吞噬率=细胞吞噬指数
×
100%。
96.式中:as表示实验组od值,ac表示空白对照组od值。
97.计算结果如图4所示,嗜热链球菌s131的活菌与灭活菌均可促进巨噬细胞的吞噬作用;在活菌中,嗜热链球菌s131对促进巨噬细胞的吞噬能力高于鼠李糖杆乳菌lgg;在灭活菌中,嗜热链球菌s131可显著促进巨噬细胞的吞噬作用,且吞噬效果明显高于鼠李糖乳杆菌lgg,且有显著性差异(p<0.01)。
98.3.5、嗜热链球菌s131的活菌与灭活菌对lps介导的炎性raw264.7(小鼠单核巨噬细胞白血病细胞)分泌细胞因子的影响实验
99.raw264.7细胞培养方法和嗜热链球菌s131活菌菌悬液和灭活菌菌悬液的制备方法同上,以2
×
105个/ml浓度的raw264.7细胞接种于24孔板中,在37℃、5%co2培养箱中过夜培养,去掉上清液,加入2ml含10%胎牛血清的dmem培养基。以lps介导细胞产生炎症细胞,lps的浓度为1μg/ml。设置下列不同组与细胞共孵育(每组5个重复):
100.1)阴性对照组(dmem)
101.24孔板中加100μl/孔dmem,置于细胞培养箱中,阴性对照组一孵育4h,阴性对照组二孵育24h;
102.2)阳性对照组(lps)
103.24孔板中加lps使其终浓度为1μg/ml,置于细胞培养箱中,阳性对照组一孵育4h,
阳性对照组二孵育24h;
104.3)lgg组
105.24孔板中加100μl/孔鼠李糖乳杆菌lgg活菌菌悬液或灭活菌菌悬液,置于细胞培养箱中,活菌组孵育4h,灭活菌组孵育24h。
106.4)s131组
107.24孔板中加100μl/孔嗜热链球菌s131活菌菌悬液或灭活菌菌悬液,置于细胞培养箱中,活菌组孵育4h,灭活菌组孵育24h;
108.5)竞争组(s131 lps)
109.在24孔板中同时加入lps(终浓度为1μg/ml)和嗜热链球菌s131活菌菌悬液或灭活菌菌悬液(100μl/孔),置于细胞培养箱中,活菌组孵育4h,灭活菌组孵育24h;
110.6)预防组(s131/lps)
111.在24孔板中先加入嗜热链球菌s131活菌菌悬液或灭活菌菌悬液100μl/孔,置于细胞培养箱中,活菌组先孵育4h,灭活菌组先孵育12h,然后再加入lps(终浓度为1μg/ml),活菌组孵育4h,灭活菌组孵育12h;
112.7)治疗组(lps/s131)
113.在24孔板中先加入lps(终浓度为1μg/ml),置于细胞培养箱中,活菌组先孵育4h,灭活菌组先孵育12h,然后再加入嗜热链球菌s131活菌菌悬液或灭活菌菌悬液100μl/孔,活菌组孵育4h,灭活菌组孵育12h;
114.收集细胞培养上清液,1000r/min离心10min去除颗粒和聚合物,分装到无菌离心管中,
‑
80℃保藏备用。
115.按elisa试剂盒说明书测定上述7组测定组中的tnf
‑
α、il
‑
6和il
‑
10的细胞因子的分泌量。
116.测定结果如表1和表2所示。
117.表1活菌对细胞因子分泌量的影响
118.119.注:
“‑”
代表细胞因子分泌量小于检出限;“ ”代表分泌量15.625
‑
125pg/ml;“ ”代表分泌量125
‑
500pg/ml;“ ”代表分泌量500
‑
1000pg/ml;“ ”代表分泌量大于1000pg/ml。
120.由表1可知,与阴性对照相比,s131活菌组和lgg活菌组与细胞共孵育可促进细胞因子tnf
‑
α、il
‑
6和il
‑
10的分泌,s131活菌组促细胞分泌il
‑
10的能力高于lgg活菌组;说明s131活菌在正常情况下可激活巨噬细胞,并上调tnf
‑
α、il
‑
6和il
‑
10的分泌,产生生理性炎症反应,提高机体免疫;当lps诱导细胞形成炎症细胞时,s131活菌的竞争组、预防组、治疗组的tnf
‑
α和il
‑
6值没有出现差异,但分泌抑炎因子il
‑
10增多,说明发生炎症后s131活菌可以增加抑炎因子il
‑
10的分泌,从而调节细胞炎症反应,进而提高机体免疫力。
121.表2灭活菌对细胞因子分泌量的影响
[0122][0123]
注:
“‑”
代表细胞因子分泌量小于检出限;“ ”代表分泌量15.625
‑
125pg/ml;“ ”代表分泌量125
‑
500pg/ml;“ ”代表分泌量500
‑
1000pg/ml;“ ”代表分泌量大于1000pg/ml。
[0124]
由表2可知,与阴性对照相比,s131灭活菌组和lgg灭活菌组与细胞共孵育可促进细胞因子tnf
‑
α、il
‑
6和il
‑
10的分泌,s131灭活菌促细胞分泌il
‑
10的能力高于灭活型lgg;说明s131灭活菌在正常情况下可激活巨噬细胞,并上调tnf
‑
α、il
‑
6和il
‑
10的分泌,产生生理性炎症反应,提高机体免疫;当lps诱导细胞形成炎症细胞时,s131灭活菌的竞争组、预防组、治疗组的tnf
‑
α和il
‑
6值没有出现差异,但分泌抑炎因子il
‑
10增多,说明发生炎症后s131灭活菌可以增加抑炎因子il
‑
10的分泌,从而调节细胞炎症反应,进而提高机体免疫力。
[0125]
综上,根据嗜热链球菌s131活菌菌悬液和灭活菌菌悬液与巨噬细胞共孵育可激活巨噬细胞,并上调tnf
‑
α、il
‑
6和il
‑
10的分泌,产生生理性炎症反应,提高机体免疫;当lps诱导细胞形成炎症细胞时,促炎因子tnf
‑
α和il
‑
6值没有出现差异,但分泌抑炎因子il
‑
10增多,说明发生炎症后s131灭活菌可以增加抑炎因子il
‑
10的分泌,从而调节细胞炎症反
应,进而提高机体免疫力。
[0126]
实施例3
[0127]
1、材料
[0128]
嗜热链球菌s131灭活菌菌粉、40只6周龄雄性spf级babl/c健康小鼠(购自北京维通利华公司)。
[0129]
2、方法
[0130]
40只小鼠的饲养环境保持在(23
±
2)℃,相对湿度(50
±
10)%,12h光照12h黑夜交替。将小鼠适应性饲养1周后,将40只小鼠随机分为4组,每组10只,分别为空白组、模型组、嗜热链球菌s131活菌组、嗜热链球菌s131灭活菌组。除空白组外,其余3组采取连续3天皮下注射环磷酰胺(80mg/kg)的方法建立免疫抑制小鼠模型。造模后各组按0.lml/(10g
·
d)剂量连续灌胃4周,空白组和模型组给予灭菌生理盐水,嗜热链球菌s131活菌组和嗜热链球菌s131灭活菌组为1
×
108cfu/天(生理盐水稀释嗜热链球菌s131活菌菌粉和灭活菌菌粉得到)。实验结束时,检测相应指标。
[0131]
2.1、小鼠体质量变化
[0132]
每周定期对小鼠称重,记录小鼠体质量变化,并根据体质量调整灌胃量。实验期间小鼠体质量变化情况如图5。
[0133]
由图5中可知,与空白组相比,免疫抑制小鼠(模型组、嗜热链球菌s131活菌组、嗜热链球菌s131灭活菌组)的生长受到明显抑制,体重增长缓慢,说明免疫抑制小鼠造模成功,环磷酰胺可抑制小鼠食欲,影响吸收,进而抑制小鼠体质量增长。通过干预灌胃4周的乳酸菌,嗜热链球菌s131活菌组和灭活菌组的体质量增长速度明显快于模型组,嗜热链球菌s131活菌组和灭活菌组都可促进体质量的增长,其中嗜热链球菌s131活菌组体质量增长速度较快,嗜热链球菌s131灭活菌组体质量增长速度相对较慢。
[0134]
2.2、脏器指数测定
[0135]
灌胃4周后,小鼠称体质量,摘眼球取血,颈椎脱白处死之后摘取胸腺、胖脏、肝脏和肾脏,将周围组织剥离干净后称重。检测结果如表3所示。
[0136]
脏器指数计算公式:脏器指数=(小鼠脏器湿重/体质量)x100%
[0137]
表3脾脏指数和胸腺指数结果
[0138][0139]
注:含*表示模型组与其他组有显著性差异(p<0.05)
[0140]
由表3数据可知,模型组小鼠的脾脏指数和胸腺指数显著低于其他组(空白组、s131活菌组和s131灭活菌组);与模型组相比,通过干预灌胃4周的乳酸菌,嗜热链球菌s131活菌组和灭活菌组的脾脏指数和胸腺指数明显升高,其中嗜热链球菌s131活菌组小鼠的脾
脏指数和胸腺指数高于嗜热链球菌s131灭活菌组。
[0141]
2.3、血液中白细胞数的测定
[0142]
灌胃4周后,将小鼠眼眶取血,吸取20μl并将其放入盛有380μl白细胞稀释液中,摇匀。按红细胞计数的方法,将白细胞混悬液滴入计数池内,静置3min,待白细胞下沉后可计数。白细胞特点为呈圆形,浆透亮,核呈紫黑色,稍有折光。白细胞数=5个大格的总数
×
500。检测结果如表4所示。
[0143]
表4血液中白细胞数结果
[0144][0145][0146]
注:含**表示模型组与其他组有显著性差异(p<0.01)
[0147]
由表4数据可知,模型组小鼠血液中白细胞数显著低于其他组(空白组、s131活菌组和s131灭活菌组),说明服用环磷酰胺,可造成白细胞数量明显减少。与模型组相比,服用嗜热链球菌s131活菌和灭活菌后,可显著提高血液中白细胞的数量,可减轻机体免疫系统的损伤,可增强机体免疫。
[0148]
2.4、血清中细胞因子含量测定
[0149]
灌胃4周后,每只小鼠取眼球血0.5~1.0ml置于1.5ml离心管中,静置1h后,4℃离心(3000r/min,15min)使得血清充分析出,转移血清至另一离心管,
‑
80℃保藏,待测。采用elisa法按照试剂盒说明测定小鼠血清tnf
‑
a、il
‑
6、il
‑
10的含量。测定结果如表5所示。
[0150]
表5血清中细胞因子含量测定
[0151][0152]
注:含*表示模型组与其他组有显著性差异(p<0.05)
[0153]
由表5数据可知,模型组小鼠血清中的tnf
‑
a和il
‑
6含量高于空白组,il
‑
10含量低于空白组;说明环磷酰胺,影响了小鼠血清中的相关细胞因子含量。用嗜热链球菌s131活菌和灭活菌干预4周后,与模型组相比,血清中的tnf
‑
a含量无显著性差异;但炎症因子il
‑
6的含量显著降低,抗炎因子il
‑
10的含量显著增加。说明嗜热链球菌s131活菌和灭活菌可通过调节血清中的细胞因子含量,提高机体免疫。
[0154]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换或改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。