结合cd3和肿瘤抗原的异二聚体抗体
1.相关申请的交叉引用
2.本技术根据35u.s.c.
§
19(e)要求2014年11月26日提交的美国临时专利申请号62/085,117、2014年11月26日提交的美国临时专利申请号62/084,908、 2014年11月26日提交的美国临时专利申请号62/085,027、2014年11月26 日提交的美国临时专利申请号62/085,106、2015年5月8日提交的美国临时专利申请号62/159,111、2015年11月4日提交的美国临时专利申请号62/251,005 和2015年11月4日提交的美国临时专利申请号62/250,971的优先权,其全部内容通过引用全文纳入本文,尤其是参考其中的附图、说明和权利要求。
3.发明背景
4.基于抗体的治疗已经成功用于治疗多种疾病,包括癌症和自身免疫/炎性病症。但仍然需要对这类药物的改进,尤其是增强其临床功效。正在探索的一条路是将其他和新抗原结合位点改造成基于抗体的药物,使得单个免疫球蛋白分子共结合两个不同的抗原。这种结合两个不同抗原的非天然或变换抗体形式通常被称为双特异性抗体。由于抗体可变区(fv)的显著多样性理论上能产生上识别任何分子的fv,双特异性抗体生成的一般方法是向抗体中引入新的可变区。
5.已经探索的多种变换抗体形式用于双特异性靶向(chames和baty,2009, mabs 1[6]:1
‑
9;holliger和hudson,2005,nature biotechnology 23[9]:1126
‑
1136; kontermann,mabs 4(2):182(2012),其全部通过引用纳入本文)。最初,通过将各自产生单个单克隆抗体的两个细胞系融合来制备双特异性抗体(milstein等, 1983,nature 305:537
‑
540)。尽管得到的杂种杂交瘤或四倍体确实产生双特异性抗体,但它们仅是少数群体,并且需要大量纯化以分离所需抗体。其改造解决方案是使用抗体片段制备双特异性抗体。因为这样的片段缺乏全长抗体的复杂四级结构,所以可以在单个遗传构建体中连接可变轻链和重链。已经产生了许多不同形式的抗体片段,包括双抗体、单链双抗体、串联scfv和fab2双特异性抗体(chames和baty,2009,mabs 1[6]:1
‑
9;holliger和hudson,2005, nature biotechnology 23[9]:1126
‑
1136;通过引用明确地并入本文)。虽然这些形式可以在细菌中以高水平表达,并且由于其小尺寸可能具有有利的渗透益处,但它们在体内迅速清除,并且可能存在与其生产和稳定性有关的制造困难。这些缺点的主要原因是抗体片段通常缺乏具有相关功能的抗体恒定区,包括较大尺寸、高稳定性以及与血清中保持长半衰期的各种fc受体和配体结合(即,新生儿fc受体fcrn)或用作纯化的结合位点(即蛋白a和蛋白g)。
[0006]
已开始尝试通过将双重结合改造为全长抗体
‑
样形式来解决基于片段的双特异性抗体的缺点(wu等,2007,nature biotechnology 25[11]:1290
‑
1297; ussn12/477,711;michaelson等,2009,mabs 1[2]:128
‑
141; pct/us2008/074693;zuo等,2000,protein engineering 13[5]:361
‑
367; ussn09/865,198;shen等,2006,j biol chem 281[16]:10706
‑
10714;lu等, 2005,j biol chem 280[20]:19665
‑
19672;pct/us2005/025472;明确地通过引用并入本文)。这些形式克服了抗体片段双特异性抗体的一些障碍,主要是因为它们含有fc区。这些形式的一个明显缺点在于,因为它们在同二聚体恒定链顶部构建新的抗
15:915
‑
919;kipriyanov等,2002 jimmunol 169:137
‑
144)、bu12
‑
皂草毒蛋白(flavell等,1995 br j cancer 72: 1373
‑
1379)、和抗
‑
cd19
‑
伊达比星(rowland等,1993 cancer immunolimmunother 55:503
‑
514);全部明确地通过引用纳入本文。
[0011]
cd123也称为白细胞介素
‑
3受体α(il
‑
3rα),在树突状细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞上表达。大多数髓系细胞(cd13 ,cd14 , cd33 ,cd15低)和一些cd19 细胞、定向造血干细胞/祖细胞也组成型地表达cd123。它不存在于cd3 细胞。
[0012]
因此,尽管由抗体片段产生的双特异性抗体遭遇有生物物理和药代动力学上的障碍,用全长抗体样形式构建的缺点则在于它们在主要靶抗原不存在的情况下会多价结合副靶标抗原,导致非特异性活化并可能导致毒性作用。本发明通过引入针对cd3和cd38的新型双特异性抗体来解决这个问题。
技术实现要素:
[0013]
因此,本发明提供异二聚体抗体,其包含:a)第一单体,其包含:i)第一重链,其包含:1)第一可变重链结构域;2)包含第一fc结构域的第一恒定重链; 3)包含scfv可变轻链结构域、scfv接头和scfv可变重链结构域的scfv;其中所述scfv用结构域接头共价连接到所述fc结构域的c末端;b)包含第二重链的第二单体,所述第二重链包含第二可变重链结构域和第二恒定重链,所述第二恒定重链包含第二fc结构域;和c)包含可变轻链结构域和恒定轻链结构域的共同轻链。
[0014]
另一方面,本发明提供如下异二聚体抗体,其包含:a)第一单体,其包含: i)第一重链,其包含:1)第一可变重链结构域;2)包含第一fc结构域的第一恒定重链结构域;和3)第一可变轻链结构域,其中所述第一可变轻链结构域用结构域接头共价连接到所述第一fc结构域的c
‑
末端;b)第二单体,其包含:i) 第二可变重链结构域;ii)包含第二fc结构域的第二恒定重链结构域;和iii)第三可变重链结构域,其中所述第二可变重链结构域用结构域接头共价连接到所述第二fc结构域的c
‑
末端;c)包含可变轻链结构域和恒定轻链结构域的共同轻链。
[0015]
在另一方面,本发明提供如下异二聚体抗体,其包含:a)第一单体,其包含:i)第一重链,其包含:1)第一可变重链结构域;2)包含第一ch1结构域和第一fc结构域的第一恒定重链;3)包含scfv可变轻链结构域、scfv接头和scfv 可变重链结构域的scfv;其中所述scfv用结构域接头共价连接在所述ch1结构域的c
‑
末端和所述第一fc结构域的n
‑
末端之间;b)包含第二重链的第二单体,所述第二重链包含第二可变重链结构域和第二恒定重链,所述第二恒定重链包含第二fc结构域;和c)包含可变轻链结构域和恒定轻链结构域的共同轻链。
[0016]
另一方面,本发明提供如下异二聚体抗体,其包含:a)第一单体,其包含: i)第一重链,其包含:1)第一可变重链结构域;2)包含第一fc结构域的第一恒定重链结构域;和3)第一可变轻链结构域,其中所述第二可变轻链结构域用结构域接头共价连接到所述第一恒定重链结构域的ch1结构域的c
‑
末端和所述第一fc结构域的n
‑
末端之间;b)第二单体,其包含:i)第二可变重链结构域; ii)包含第二fc结构域的第二恒定重链结构域;和iii)第三可变重链结构域,其中所述第二可变重链结构域用结构域接头共价连接到所述第二fc结构域的c
‑ꢀ
末端;c)包含可变轻链结构域和恒定轻链结构域的共同轻链。
[0017]
在另一方面,本发明提供如下异二聚体抗体,其包含:a)第一单体,其包含:i)第一重链,其包含:1)第一可变重链结构域;2)包含第一ch1结构域和第一fc结构域的第一恒定重链;3)包含scfv可变轻链结构域、scfv接头和scfv 可变重链结构域的scfv;其中所述scfv用结构域接头共价连接在所述ch1结构域的c
‑
末端和所述第一fc结构域的n
‑
末端之间;b)包含第二fc结构域的第二单体;和c)包含可变轻链结构域和恒定轻链结构域的轻链。
[0018]
在一些方面,第一和第二fc结构域具有组合氨基酸取代,选自:s364k/ e357q:l368d/k370s;l368d/k370s:s364k;l368e/k370s:s364k;t411t /e360e/q362e:d401k;l368d/k370s:s364k/e357l和k370s:s364k/ e357q。此外,可变重链结构域和可变轻链结构域结合第一靶肿瘤抗原(tta), scfv结合第二tta或人cd3。某些实施方式中,tta选自cd19、cd20和 cd123。
[0019]
在另一方面,本发明提供抗
‑
cd3抗原结合结构域,其cdr和/或可变结构域和/或scfv的序列如h1.32_l1.47,h1.89_l1.47,h1.90_l1.47,h1.33_l.1.47 和h1.31_l1.47的图中所示。本发明还提供核酸组合物、表达载体组合物和宿主细胞。
[0020]
在另一方面,本发明还提供如下异二聚体抗体,其包含a)第一单体,其包含:i)第一fc结构域;ii)包含scfv可变轻链结构域、scfv接头和scfv可变重链结构域的抗
‑
cd3 scfv;其中所述scfv用结构域接头共价连接到所述fc结构域的n
‑
末端;b)包含重链的第二单体,其包含:i)重链可变结构域;和ii)包含第二fc结构域的重链恒定结构域;和c)包含可变轻链结构域和可变轻链恒定结构域的轻链;其中抗
‑
cd3 scfv选自抗cd3 h1.32_l1.47,抗cd3h1.89_l1.47,抗cd3 h1.90_l1.47和抗cd3 h1.33_l1.47(seq id no:xx)。重链可变结构域和轻链可变结构域结合tta(包括但不限于cd19,cd20,cd38 和cd123)。
[0021]
另一方面,本发明提供抗
‑
cd20抗体结合结构域,其包含:a)包含具有序列raswsvsyih(seq id no:xx)的v1cdr1,具有序列atsnlas(seq idno:xx)的v1cdr2,和具有序列qqwthnppt(seq id no:xx)的vlcdr3 的可变轻链结构域;和b)包含具有序列synmh(seq id no:xx)的vhcdr1,具有序列aiypgngatsysqkfqg(seq id no:xx)的vhcdr2和具有序列 syymggdwyfdv(seq id no:xx)的vhcdr3的可变重链结构域。某些实施方式中,抗
‑
cd20抗体结合结构域具有c2b8 h1.202_l1.113序列。
[0022]
另一方面,本发明提供抗
‑
cd20抗体结合结构域,其包含:a)包含具有序列rasssvsyih(seq id no:xx)的v1cdr1,具有序列atsnlas(seq id no:xx)的v1cdr2,和具有序列qqwtsnppt(seq id no:xx)的vlcdr3 的可变轻链结构域;和b)包含具有序列synmh(seq id no:xx)的vhcdr1,具有序列aiypgngdtsynqkfqg(seq id no:xx)的vhcdr2和具有序列 styyggdwyfnv(seq id no:xx)的vhcdr3的可变重链结构域。
[0023]
某些实施方式中,抗
‑
cd20抗体结合结构域具有c2b8_h1l1序列。
[0024]
在另一方面,本发明提供如下异二聚体抗体,其包含a)第一单体,其包含: i)第一fc结构域;ii)包含scfv可变轻链结构域、scfv接头和scfv可变重链结构域的抗
‑
cd3 scfv;其中所述scfv用结构域接头共价连接到所述fc结构域的 n
‑
末端;b)包含重链的第二单体,其包含:i)重链可变结构域;和ii)包含第二 fc结构域的重链恒定结构域;和c)包含可变轻链结构域和可变轻链恒定结构域的轻链;其中所述可变重链和轻链形成c2b8 h1.202_l1.113或c2b8_h1l1结合结构域。
[0025]
在另一方面,本发明提供如下异二聚体抗体,其包含a)第一单体,其包含: i)第一
fc结构域;ii)包含scfv可变轻链结构域、scfv接头和scfv可变重链结构域的抗
‑
cd3 scfv;其中所述scfv用结构域接头共价连接到所述fc结构域的 n
‑
末端;b)包含重链的第二单体,其包含:i)重链可变结构域;和ii)包含第二 fc结构域的重链恒定结构域;和c)包含可变轻链结构域和可变轻链恒定结构域的轻链。在该实施方式中,可变结构域结合cd123并且可以具有 7g3_h1.109_l1.47的序列。
[0026]
另外,本发明提供选自以下的异二聚体抗体:xenp15049,xenp15051, xenp15050,xenp13676,xenp14696,xenp15629,xenp15053,xenp15630, xenp15631,xenp15632,xenp15633,xenp15634,xenp15635,xenp15636, xenp15638,xenp15639,xenp13677,xenp14388,xenp14389,xenp14390, xenp14391,xenp14392,xenp14393,xenp16366,xenp16367,xenp16368, xenp16369,xenp16370,xenp16371,xenp16372,xenp16373,xenp16375, xenp16376和xenp16377。本发明提供制备这些蛋白质并用它们治疗患者的方法,此外还提供了核酸、表达载体和宿主细胞。
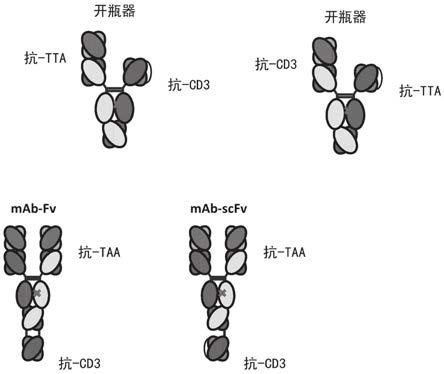
附图说明
[0027]
图1a和1b、1c显示本发明的多种形式。显示了两种样式的“开瓶器”形式,一种的抗cd3抗原结合结构域含scfv而抗tta抗原结合结构域含fab,另一种则与此相反。mab
‑
fv,mab
‑
scfv,中心
‑
scfv和中心
‑
fv形式全部展示于图中。另外,还显示了单体之一仅含fc结构域的“单臂”形式,既有单臂中心scfv也有单臂中心fv。还显示了双scfv形式。
[0028]
图2显示“高cd3”抗
‑
cd3
‑
h1.30_l1.47构建体的各序列,包括可变重链结构域和可变轻链结构域(cdr标有下划线),各单列v1cdr和vhcdr,以及具有带电荷接头(双下划线)的scfv构建体。该带电荷接头可根据需要用不带电荷接头或不同的其他带电荷接头替代,附图中所有序列皆是如此。
[0029]
图3显示“高
‑
中#1”抗
‑
cd3_h1.32_l1.47构建体的各序列,包括可变重链结构域和可变轻链结构域(cdr标有下划线),各单列v1cdr和vhcdr,以及具有带电荷接头(双下划线)的scfv构建体。该带电荷接头可根据需要用不带电荷接头或不同的其他带电荷接头替代,附图中所有序列皆是如此。
[0030]
图4显示“高
‑
中#2”抗
‑
cd3_h1.89_l1.47构建体的各序列,包括可变重链结构域和可变轻链结构域(cdr标有下划线),各单列v1cdr和vhcdr,以及具有带电荷接头(双下划线)的scfv构建体。该带电荷接头可根据需要用不带电荷接头或不同的其他带电荷接头替代,附图中所有序列皆是如此。
[0031]
图5显示“高
‑
中#3”抗
‑
cd3_h1.90_l1.47构建体的各序列,包括可变重链结构域和可变轻链结构域(cdr标有下划线),各单列v1cdr和vhcdr,以及具有带电荷接头(双下划线)的scfv构建体。该带电荷接头可根据需要用不带电荷接头或不同的其他带电荷接头替代,附图中所有序列皆是如此。
[0032]
图6显示“中”抗
‑
cd3_h1.90_l1.47构建体的各序列,包括可变重链结构域和可变轻链结构域(cdr标有下划线),各单列v1cdr和vhcdr,以及具有带电荷接头(双下划线)的scfv构建体。该带电荷接头可根据需要用不带电荷接头或不同的其他带电荷接头替代,附图中所有序列皆是如此。
[0033]
图7显示“低”抗
‑
cd3_h1.31_l1.47构建体的各序列,包括可变重链结构域和可变
轻链结构域(cdr标有下划线),各单列v1cdr和vhcdr,以及具有带电荷接头(双下划线)的scfv构建体。该带电荷接头可根据需要用不带电荷接头或不同的其他带电荷接头替代,附图中所有序列皆是如此。
[0034]
图8显示高cd38:okt10_h1.77_l1.24构建体的各序列,包括可变重链结构域和可变轻链结构域(cdr标有下划线),各单列v1cdr和vhcdr,以及具有带电荷接头(双下划线)的scfv构建体。
[0035]
图9显示中cd38:okt10_h1l1.24构建体的各序列,包括可变重链结构域和可变轻链结构域(cdr标有下划线),各单列v1cdr和vhcdr,以及具有带电荷接头(双下划线)的scfv构建体。
[0036]
图10显示低cd38:okt10_h1l1构建体的各序列,包括可变重链结构域和可变轻链结构域(cdr标有下划线),各单列v1cdr和vhcdr,以及具有带电荷接头(双下划线)的scfv构建体。
[0037]
图11显示xenp15331的序列。
[0038]
图12显示xenp13243的序列。
[0039]
图13显示xenp14702的序列。
[0040]
图14显示xenp15426的序列。
[0041]
图15显示xenp14701的序列。
[0042]
图16显示xenp14703的序列。
[0043]
图17显示xenp13243的序列。
[0044]
图18显示xenp18967的序列。
[0045]
图19显示xenp18971的序列。
[0046]
图20显示xenp18969的序列。
[0047]
图21显示xenp18970的序列。
[0048]
图22显示xenp18972的序列。
[0049]
图23显示xenp18973的序列。
[0050]
图24显示xenp15055的序列。
[0051]
图25显示xenp13544的序列。
[0052]
图26显示xenp13694的序列。
[0053]
图27显示人cd3ε的序列。
[0054]
图28显示全长人cd38蛋白(seq id no:130)及其胞外结构域(ecd;seqid no:131)。
[0055]
图29a
‑
29e显示有用的配对异源二聚化变体组合(包括偏向变体和pi变体)。
[0056]
图30显示一系列等排变体抗体恒定区及相应取代。pi_(
‑
)表示低pi变体,而pi_( )表示高pi变体。这些可以任选地、独立地与本发明的其它异二聚化变体(以及如本文所述的其它变体类型)组合。
[0057]
图31显示有用的消除fcγr结合的消除变体(有时亦称“敲除”或“ko”变体)。
[0058]
图32显示本发明两个特别有用的实施方式。
[0059]
图33显示多种带电荷的scfv接头,用于提高或降低采用单scfv或多scfv 作为组分的异二聚体抗体的pi。有一种单电荷现有技术scfv接头,称为“whitlow”,见whitlow等,
protein engineering 6(8):989
‑
995(1993)。需要指出的是,该接头被用于减少scfv聚集和增强蛋白水解稳定性。
[0060]
图34显示一系列改造的异二聚体
‑
偏向fc变体,及其异二聚体得率(据 hplc
‑
ciex测定)和热稳定性(据dsc测定)。热稳定性未测定则用“n.d.”表示。
[0061]
图35:蛋白a亲和纯化后双特异性抗体的表达产率。
[0062]
图36:阳离子交换纯化色谱图。
[0063]
图37:重定向t细胞细胞毒性测定,24小时孵育,10k rpmi8226细胞, 400k t细胞。试验品为抗
‑
cd38
×
抗
‑
cd3双特异性抗体。采用ldh检测。
[0064]
图38:重定向t细胞细胞毒性测定,24小时孵育,10k rpmi8226细胞, 500k人pbmc。试验品为抗
‑
cd38
×
抗
‑
cd3双特异性抗体。采用ldh检测。
[0065]
图39显示xenp14419的序列。
[0066]
图40显示xenp14420的序列。
[0067]
图41显示xenp14421的序列。
[0068]
图42显示xenp14422的序列。
[0069]
图43显示xenp14423的序列。
[0070]
图44:重定向t细胞细胞毒性测定,96小时孵育,40k rpmi8226细胞, 400k人pbmc。试验品为抗
‑
cd38
×
抗
‑
cd3 fab
‑
scfv
‑
fc。用流式细胞术进行检测,具体为检测cd38 细胞的消失。
[0071]
图45:对图1所示重定向t细胞细胞毒性试验的进一步分析。第一行显示流式细胞术测得的cd4 和cd8 t细胞上激活标志物cd69的平均荧光强度(mfi)。第二行显示ki
‑
67 的cd4 和cd8 t细胞的百分比,作为细胞增殖的指标。第三行显示流式细胞术测得的cd4 和cd8 t细胞上粒酶b抑制剂 pi
‑
9的胞内平均荧光强度(mfi)。
[0072]
图46:小鼠试验的设计,用以检测抗
‑
cd38
×
抗
‑
cd3 fab
‑
scfv
‑
fc双特异性抗体的抗肿瘤活性。
[0073]
图47:测量的肿瘤大小与时间和治疗的关系。
[0074]
图48:生物发光图像(第10天)。
[0075]
图49:单剂次指定试验品后猕猴中cd38
细胞的清除。
[0076]
图50:据cd69平均荧光强度(mfi)测定的猕猴中t细胞活化,颜色标注如图49所示。
[0077]
图51单剂次指定试验品后的il
‑
6血清水平。
[0078]
图52显示xenp15427的序列。
[0079]
图53显示xenp15428的序列。
[0080]
图54显示xenp15429的序列。
[0081]
图55显示xenp15430的序列。
[0082]
图56显示xenp15431的序列。
[0083]
图57显示xenp15432的序列。
[0084]
图58显示xenp15433的序列。
[0085]
图59显示xenp15434的序列。
[0086]
图60显示xenp15435的序列。
[0087]
图61显示xenp15436的序列。
[0088]
图62显示xenp15437的序列。
[0089]
图63显示xenp15438的序列。
[0090]
图64显示biacore试验中的结合亲和性。
[0091]
图65显示采用不同的轻链、fab
‑
fc和scfv
‑
fc比例,稳定集合形成期间的异二聚体纯度。
[0092]
图66:hupbmc小鼠模型中抗
‑
cd38
×
抗
‑
cd3双特异性抗体的人igm和 igg2清除。
[0093]
图67显示稳定性优化的人源化抗
‑
cd3变体scfv。显示相比h1_l1.4 scfv 序列的取代。氨基酸编号是kabat编号。
[0094]
图68:稳定性优化的人源化抗
‑
cd3变体scfv的氨基酸序列。cdr标有下划线。对于每个重链/轻链组合,列出四个序列:(i)具有c
‑
末端6
×
his标签的scfv,(ii)仅scfv,(iii)仅vh,(iv)仅vl。
[0095]
图69:重定向t细胞细胞毒性测定,24小时孵育,10k rpmi8226细胞, 500k pbmc。试验品为抗
‑
cd38(okt10_h1l1,okt10_h1.77_l1.24)
×
抗
‑
cd3fab
‑
scfv
‑
fc。采用ldh检测。
[0096]
图70:hupbl
‑
scid ig
‑
清除实验。pbmc移植后8天给予试验品,剂量为0.03、0.3或3mg/kg。给药途径是腹膜内。在pbmc移植后14天采取血样,加工得血清,测定人igm和igg2。
[0097]
图71显示xenp15049的序列。
[0098]
图72显示xenp15051的序列。
[0099]
图73显示xenp15050的序列。
[0100]
图74显示xenp13676的序列。
[0101]
图75显示xenp14696的序列。
[0102]
图76显示xenp15629的序列。
[0103]
图77显示xenp15053的序列。
[0104]
图78显示xenp15630的序列。
[0105]
图79显示xenp15631的序列。
[0106]
图80显示xenp15632的序列。
[0107]
图81显示xenp15633的序列。
[0108]
图82显示xenp15634的序列。
[0109]
图83显示xenp15635的序列。
[0110]
图84显示xenp15636的序列。
[0111]
图85显示xenp15638的序列。
[0112]
图86显示xenp15639的序列。
[0113]
图87显示xenp13677的序列。
[0114]
图88显示xenp14388的序列。
[0115]
图89显示xenp14389的序列。
[0116]
图90显示xenp14390的序列。
[0117]
图91显示xenp14391的序列。
[0118]
图92显示xenp14392的序列。
[0119]
图93显示xenp14393的序列。
[0120]
图94显示xenp16366的序列。
[0121]
图95显示xenp16367的序列。
[0122]
图96显示xenp16368的序列。
[0123]
图97显示xenp16369的序列。
[0124]
图98显示xenp16370的序列。
[0125]
图99显示xenp16371的序列。
[0126]
图100显示xenp16372的序列。
[0127]
图101显示xenp16373的序列。
[0128]
图102显示xenp16374的序列。
[0129]
图103显示xenp16375的序列。
[0130]
图104显示xenp16376的序列。
[0131]
图105显示xenp16377的序列。
[0132]
图106显示cd20和cd123抗原的序列。
[0133]
图107:cd3亲和性的表面等离振子共振测定。试验品为抗
ꢀ‑
cd20(c2b8_h1.202_l1.113)
×
抗
‑
cd3 fab
‑
scfv
‑
fc。人cd3δε
‑
fc(义翘神州生物技术公司(sino biological))共价结合于芯片表面。试验品以3.125、12.5、50 和200nm通过。
[0134]
图108:cd3亲和性的表面等离振子共振测定。试验品为抗
ꢀ‑
cd20(c2b8_h1.202_l1.113)
×
抗
‑
cd3 fab
‑
scfv
‑
fc。猕猴cd3δε
‑
fc(义翘神州生物技术公司)共价结合于芯片表面。试验品以3.125、12.5、50和200nm通过。
[0135]
图109:cd3亲和性的表面等离振子共振测定。试验品为抗
ꢀ‑
cd20(c2b8_h1.202_l1.113)
×
抗
‑
cd3 fab
‑
scfv
‑
fc。人cd3δε
‑
fc(义翘神州生物技术公司(sino biological))共价结合于芯片表面。试验品以31.25、125、500 和2000nm通过。
[0136]
图110:cd3亲和性的表面等离振子共振测定。试验品为抗
ꢀ‑
cd20(c2b8_h1.202_l1.113)
×
抗
‑
cd3 fab
‑
scfv
‑
fc。猕猴cd3δε
‑
fc(义翘神州生物技术公司)共价结合于芯片表面。试验品以31.25、125、500和2000nm通过。
[0137]
图111:cd3亲和性的表面等离振子共振测定。试验品为抗
ꢀ‑
cd20(c2b8_h1.202_l1.113)
×
抗
‑
cd3 fab
‑
scfv
‑
fc。猕猴cd3δε
‑
fc(义翘神州生物技术公司)共价结合于芯片表面。试验品以31.25、125、500和2000nm通过。
[0138]
图112:重定向t细胞细胞毒性测定,24小时孵育,10k拉莫斯细胞,250k pbmc。试验品为抗
‑
cd20(c2b8_h1.202_l1.113)
×
抗
‑
cd3 fab
‑
scfv
‑
fc。采用 ldh检测。
[0139]
图113:重定向t细胞细胞毒性测定,24小时孵育,20k jeko细胞,200kpbmc(cd19
‑
清除)。试验品为抗
‑
cd20(c2b8_h1.202_l1.113)
×
抗
‑
cd3fab
‑
scfv
‑
fc。采用流式细胞术检测,具体检测cd19
细胞的消失。
[0140]
图114:图113中所述实验的24小时后il
‑
6产出。
[0141]
图115:重定向t细胞细胞毒性测定,5小时孵育,20k jeko细胞,500kpbmc(cd19
‑
清除)。试验品为抗
‑
cd20(c2b8_h1l1)
×
抗
‑
cd3 fab
‑
scfv
‑
fc。采用流式细胞术检测,具体检测cd19
细胞的消失。
[0142]
图116:重定向t细胞细胞毒性测定,24小时孵育,20k jeko细胞,500kpbmc(cd19
‑
清除)。试验品为抗
‑
cd20(c2b8_h1.202_l1.113)
×
抗
‑
cd3fab
‑
scfv
‑
fc。采用流式细胞术
检测,具体检测cd19
细胞的消失。
[0143]
图117:图113中所述的实验24小时后的il
‑
6产生。
[0144]
图118:重定向t细胞细胞毒性测定,24小时孵育,10k rpmi8226细胞, 500k pbmc。试验品为抗
‑
cd38(okt10_h1l1,okt10_h1.77_l1.24)
×
抗
‑
cd3 fab
‑
scfv
‑
fc。采用ldh检测。
[0145]
图119:hupbl
‑
scid ig
‑
清除实验。pbmc移植后1和8天给予5mg/kg 的试验品。给药途径是腹膜内。在pbmc移植后14天采取血样,加工得血清,检测人igm和igg2。
[0146]
图120:hupbl
‑
scid ig
‑
清除实验。pbmc植入后8天给予0.03、0.3或3 mg/kg的试验品。给药途径是腹膜内。在pbmc移植后14天采取血样,加工得血清,检测人igm和igg2。
[0147]
图121显示高cd20 c2b8_h1.202_l1.113的序列。
[0148]
图122显示低cd20 c2b8_h1l1的序列。
[0149]
图123显示cd123 7g3_h1.109_l1.57的序列。
[0150]
图124中的矩阵为本发明可能的组合形式。“a”表示参比cd3序列cdr 可与右手侧的tta上的cdr组合。即,来自可变重链cd3 h1.30序列的vhcdr 和来自cd3 l1.57序列的可变轻链的vlcdr可与来自cd38 okt10 h1.77序列的vhcdr和来自okt10l1.24序列的vlcdr组合。“b”表示来自cd3构建体的cdr可与tta的可变重链结构域和可变轻链结构域组合。即,来自可变重链cd3 h1.30序列的vhcdr和来自cd3 l1.57序列的可变轻链的vlcdr可与可变重链结构域cd38 okt10 h1.77序列和okt10l1.24序列组合。“c”相反,即cd3序列的可变重链结构域和可变轻链结构域与tta的cdr联用。“d”:每一个的可变重链和可变轻链的组合。“e”:cd3的scfv与tta 的cdr联用,“f”:cd3的scfv与tta抗原结合结构域的可变重链结构域和可变轻链结构域联用。
[0151]
发明详述
[0152]
i.定义
[0153]
为了使本技术得到更完整的理解,下面给出若干定义。这些定义包括其语语法同义和等同形式。
[0154]
本文中的“消除”表示降低或去除活性。因此,例如,“消除fcγr结合”表示,与不含特定变体的fc区相比,fc区氨基酸变体的结合低于初始结合的 50%,优选活性丧失70
‑
80
‑
90
‑
95
‑
98%或以上,总体上,活性低于biacore实验中可检测结合水平。消除fcγr结合特别有用的那些见图16。
[0155]
本文所用的“adcc”或“抗体依赖性细胞介导的细胞毒性”表示如下所述细胞介导的反应:表达fcγr的非特异性细胞毒性细胞识别靶细胞上结合的抗体,随后引起靶细胞裂解。adcc和与fcγriiia结合相关;增加fcγriiia结合导致adcc活性增强。
[0156]
本文所用的“adcp”或抗体依赖性细胞介导的吞噬作用表示如下所述细胞介导的反应:表达fcγr的非特异性细胞毒性细胞识别靶细胞上结合的抗体,随后引起对靶细胞的吞噬作用。
[0157]
本文所用的“修饰”表示多肽序列中的氨基酸取代、插入和/或缺失,或蛋白质上化学连接的结构单元的改变。例如,修饰可以是蛋白质上相连的糖或 peg结构改变。本文的“氨基酸修饰”表示多肽序列中的氨基酸取代、插入和 /或缺失。为了清楚起见,除非另外说明,氨基酸修饰总是对dna编码的氨基酸进行,例如,具有dna和rna密码子的那20个氨基酸。
[0158]
本文中的“氨基酸取代”或“取代”表示用不同的氨基酸置换在亲本多肽序列中的特定位置的氨基酸。具体地,某些实施方式中,取代指非天然存在于某位置的氨基酸,非天然存在于该生物或非天然存在于任何生物中。例如,取代e272y是指这样的变体多肽,在此为fc变体,其中在272位处的谷氨酸被酪氨酸替代。为了清楚起见,经改造改变了核酸编码序列而没有改变初始氨基酸(例如,将cgg(编码精氨酸)改成cga(仍然编码精氨酸)以提高宿主表达水平)的蛋白质不属于“氨基酸取代”;即,尽管生成了编码相同蛋白质的新基因,如果蛋白质特定位置仍为原初同样的氨基酸,则不是氨基酸取代。
[0159]
本文所用的“氨基酸插入”或“插入”表示在亲本多肽序列中的特定位置处加入氨基酸序列。例如,
‑
233e或233e是指在233位之后234位之前插入谷氨酸。另外,
‑
233ade或a233ade是指在233位之后234位之前插入 alaaspglu。
[0160]
本文所用的“氨基酸缺失”或“缺失”表示在亲本多肽序列中的特定位置去除氨基酸序列。例如,e233
‑
或e233#或e233()是指233位谷氨酸缺失。另外,eda233
‑
或eda233#是指在233位处序列gluaspala缺失。
[0161]
本文所用的“变体蛋白质”或“蛋白质变体”或“变体”表示与亲本蛋白质相差至少一个氨基酸修饰的蛋白质。蛋白质变体可以指蛋白质本身、包含蛋白质的组合物、或编码蛋白质的氨基酸序列。优选地,与亲本蛋白质相比,蛋白质变体具有至少一个氨基酸修饰,例如,与亲本相比约1个至约70个氨基酸修饰,优选约1个至约5个氨基酸修饰。如下所述,某些实施方式中,亲本多肽,例如fc亲本多肽,是人野生型序列,如来自igg1、igg2、igg3或igg4 的fc区,但是,具有变体的人序列也可作为“亲本多肽”,例如,图19中的 igg1/2杂合体。本文中的蛋白质变体序列优选与亲本蛋白质序列至少约80%相同,优选至少约90%相同,更优选至少约95
‑
98
‑
99%相同。变体蛋白质可指代变体蛋白质本身、包含蛋白质变体的组合物、或编码变体蛋白质的dna序列。因此,本文所用的“抗体变体”或“变体抗体”表示与亲本抗体相差至少1个氨基酸修饰的抗体,本文所用的“igg变体”或“变体igg”表示与亲本igg(同样,许多情况中是人igg序列)相差至少1个氨基酸修饰的抗体,并且,本文所用的“免疫球蛋白变体”或“变体免疫球蛋白”表示与亲本免疫球蛋白序列相差至少1个氨基酸修饰的免疫球蛋白序列。本文所用的“fc变体”或“变体 fc”表示包含fc结构域内氨基酸修饰的蛋白质。本发明的fc变体按照所含氨基酸修饰来描述。因此,例如,n434s或434s是相比亲本fc多肽在434位处有取代丝氨酸的fc变体,其中编码是按照eu索引。类似地,m428l/n434s 描述的是相比亲本fc多肽具有m428l和n434s取代的fc变体。可能不标明野生(wt)氨基酸,例如以428l/434s描述的变体。需要说明的是,取代描述的顺序是任意的,也就是说,例如,428l/434s和m428l/n434s是相同fc变体,以此类推。本发明中与抗体相关的所有位置,除非另有说明,均按照eu 索引对氨基酸位置进行编号。eu索引或kabat或eu编码方案中的eu索引是指eu抗体编码体系(edelman等,1969,proc natl acad sci usa 63:78
‑
85,通过引用全文纳入本文)。修饰可以是添加、缺失或取代。取代可包括天然氨基酸,有时还包括合成氨基酸。示例包括美国专利号6,586,207;wo 98/48032;wo 03/073238;us2004
‑
0214988a1;wo 05/35727a2;wo 05/74524a2;j.w.chin 等,(2002),journal of the american chemical society 124:9026
‑
9027;j.w.chin 和p.g.schultz,(2002),chembiochem 11:1135
‑
1137;j.w.chin等,(2002), picas united states of america 99:11020
‑
11024;和l.wang和p.g.schultz, (2002),chem.1
‑
10,全部通过引用纳入本文。
[0162]
本文所用的“蛋白质”表示共价接合的至少两个氨基酸,其包括蛋白质、多肽、寡肽和肽。肽基可包含天然氨基酸和肽键或合成的拟肽结构,即“类似物”,如类肽(参见simon等,pnas usa 89(20):9367(1992),通过引用全文纳入)。氨基酸可以是天然的或是合成的(例如不是由dna编码的氨基酸);正如本领域技术人员所能理解的。例如,高苯丙氨酸、瓜氨酸、鸟氨酸和正亮氨酸在本发明中视为合成氨基酸,并且,d
‑
和l
‑
(r或s)构象的氨基酸均可采用。本发明的变体可包括采用合成氨基酸的修饰,合成氨基酸掺入可采用例如 schultz及其同事开发的技术,包括但与限于以下所述的方法:cropp和shultz, 2004,trends genet.20(12):625
‑
30,anderson等,2004,proc natl acad sci usa101(2):7566
‑
71,zhang等,2003,303(5656):371
‑
3,和chin等,2003,science301(5635):964
‑
7,全部通过引用全文纳入本文。另外,多肽可包括一条或多条侧链、一个或多个末端的合成衍生化、糖基化、peg化、环状排列、环化、连接其他分子的接头、与蛋白质或蛋白质结构域的融合、以及添加肽标签或标记物。
[0163]
本文所用的“残基”表示蛋白质中的位置及该位置上的氨基酸。例如,天冬酰胺297(也称为asn297或n297)指人抗体igg1中297位处的残基。
[0164]
本文所用的“fab”或“fab区”表示包含vh、ch1、vl和cl免疫球蛋白结构域的多肽。fab可以指分离出来的该区域或包含于全长抗体、抗体片段或fab融合蛋白中的该区域。本文所用的“fv”或“fv片段”或“fv区”表示包含单个抗体的vl和vh结构域的多肽。本领域技术人员可以看出,这些一般由两条链组成。
[0165]
本文所用的“igg亚类修饰”或“同种型修饰”表示将某igg同种型内某氨基酸转变成另一并列igg同种型中相应氨基酸的氨基酸修饰。例如,因为 igg1在eu第296位是酪氨酸而igg2是苯丙氨酸,则igg2中的f296y取代被认为是igg亚类修饰。
[0166]
本文所用的“非天然修饰”表示非同种型氨基酸修饰。例如,由于所有igg 第434位处都不是丝氨酸,则igg1、igg2、igg3、或igg4(或其杂合体)中的取代434s被认为是非天然修饰。
[0167]
本文所用的“氨基酸”和“具体的氨基酸”表示由dna和rna编码的 20种天然氨基酸之一。
[0168]
本文所用的“效应物功能”表示由抗体fc区与fc受体或配体的相互作用产生的生物化学事件。效应物功能包括但不限于adcc、adcp和cdc。
[0169]
本文所用的“igg fc配体”表示来自各种生物体的这样的分子,优选多肽,其结合igg抗体的fc区以形成fc/fc配体复合物。fc配体包括但不限于fcγri、 fcγrii、fcγriii、fcrn、c1q、c3、甘露聚糖结合凝集素、甘露糖受体、葡萄球菌蛋白a、链球菌蛋白g、和病毒fcγr。fc配体还包括fc受体同源物(fcrh),这是一个与fcγr同源的fc受体家族(davis等,2002,immunological reviews190:123
‑
136,通过引用全文纳入)。fc配体包括尚未发现的结合fc的分子。特定的igg fc配体是fcrn和fcγ受体。本文所用的“fc配体”表示来自各种生物体的这样的分子,优选多肽,其结合抗体的fc区以形成fc/fc配体复合物。
[0170]
本文所用的“fcγ受体”、“fcγr”或“fcqammar”表示这样一个蛋白质家族的成员,该家族蛋白结合igg抗体fc区并由fcγr基因编码。在人类中,该家族包括但不限于fcγri(cd64),包括亚型fcγria、fcγrib、和fcγric; fcγrii(cd32),包括亚型fcγriia(包括同种异型h131和r131)、fcγriib(包括 fcγriib
‑
1和fcγriib
‑
2)、和fcγriic;和fcγ
riii(cd16),包括亚型fcγriiia(包括同种异型v158和f158)和fcγriiib(包括同种异型fcγriib
‑
na1和 fcγriib
‑
na2)(jefferis等,2002,immunol lett 82:57
‑
65,全文通过引用纳入)、还包括尚未发现的人fcγr或fcγr亚型或同种异型。fcγr可来自任何生物体,包括但不限于人、小鼠、大鼠、兔和猴。小鼠fcγr包括但不限于fcγri(cd64)、 fcγrii(cd32)、fcγriii(cd16)、和fcγriii
‑
2(cd16
‑
2),还包括尚未发现的小鼠 fcγr或fcγr亚型或同种异型。
[0171]
本文所用术语“fcrn”或“新生儿fc受体”表示结合igg抗体fc区并至少部分由fcrn基因编码的蛋白质。fcrn可来自任何生物体,包括但不限于人、小鼠、大鼠、兔和猴。如本领域所知,功能性fcrn蛋白质包括通常称为重链和轻链的两条多肽。轻链是β
‑2‑
微球蛋白,重链由fcrn基因编码。除非本文另外说明,fcrn或fcrn蛋白质是指fcrn重链和β
‑2‑
微球蛋白的复合物。各种fcrn变体用于增强与fcrn受体的结合,有时用于延长血清半衰期,见图83及其说明。
[0172]
本文所用的“亲本多肽”指初始多肽,后经修饰而成变体。亲本多肽可以是天然多肽,或天然多肽的变体或改造版本。亲本多肽可以指多肽本身\包含亲本多肽的组合物\或编码亲本多肽的氨基酸序列。因此,本文所用的“亲本免疫球蛋白”是指未修饰的免疫球蛋白多肽,其经修饰而成变体,本文所用的“亲本抗体”是指未修饰的抗体,经修饰而成变体抗体。需要说明的是,“亲本抗体”包括已知的市售、重组产生的抗体,如后文所述。
[0173]
本文所用的“fc”或“fc区”或“fc结构域”表示包含抗体恒定区除第一恒定区免疫球蛋白结构域之外部分的多肽,有时还排除部分铰链区。因此, fc指iga、igd和igg的后两个恒定区免疫球蛋白结构域,ige和igm的后三个恒定区免疫球蛋白结构域,以及这些结构域n末端的柔性绞链区。对于iga 和igm而言,fc可包含j链。对于igg而言,fc区包括免疫球蛋白结构域cγ2 和cγ3(cγ2和cγ3)以及cγ1(cγ1)和cγ2(cγ2)之间的铰链区下部。虽然fc区的边界可变,但人igg重链fc区通常被定义为包含残基c226或p230至羧基端的区域,其中编号是根据kabat的eu索引。某些实施方式中,如后文所述,对fc区进行氨基酸修饰,例如,由此改变与一个或多个fcγr受体或fcrn受体的结合。
[0174]
本文的“重链恒定区”表示抗体的ch1
‑
铰链
‑
ch2
‑
ch3部分。
[0175]
本文的“fc融合蛋白”或“免疫粘附素”是指这样一种蛋白质,其包含 fc区,一般连接(任选地通过接头连接,如本文所述)至另外的蛋白质,如针对靶蛋白的结合部分,如本文所述。在一些情况中,异二聚体抗体的单体之一包含抗体重链(或者包括scfv或者还包括轻链)并且另一个单体是fc融合体,包含可变fc结构域和配体。某些实施方式中,这些“半抗体
‑
半融合蛋白”被称为“融合体(fuisionbody)”。
[0176]
本文所用的“位置”是指蛋白质序列中的位置。位置可依次顺序编号,或者按照既有格式,例如用于抗体编号的eu索引。
[0177]
本文所用的“靶抗原”是指被给定抗体的可变区特异性结合的分子。靶抗原可以是蛋白质、糖、脂质或其他化合物。下文描述了多种合适的靶抗原。
[0178]
就本发明异二聚体抗体的单体而言,“链型”是指,与“相互匹配”的 dna双链相似,在各单体中引入异二聚体变体从而保留“相互匹配”以形成异二聚体的能力。例如,如果某些pi变体被改造成单体a(例如,使pi更高),则同样可采用“电荷对”的立构变体不干扰pi变体,例如,使pi更高的电荷变体被放在同一“链”或“单体”上以保留两种官能团。类似的,对
于下文配对组合方式出现的“偏向(skew)”变体,本领域技术人员在决定将配对中某组纳入哪一链或哪一单体时会考虑pi,从而同时利用偏向变体的pi使pi分离最大化。
[0179]
本文所用的“靶细胞”是指表达靶抗原的细胞。
[0180]
本文所用的“可变区”是免疫球蛋白的如下所述的区域:其包含一个或多个基本由v.κ、v.λ和/或分别构成κ、λ和重链免疫球蛋白遗传基因座的vh基因编码的ig结构域。
[0181]
本文的“野生型或wt”表示在自然中发现的氨基酸序列或核苷酸序列,包括等位基因变异。wt蛋白质具有还未经特意修饰的氨基酸序列或核苷酸序列。
[0182]
本发明的抗体一般是分离的或重组的。当用于描述本文公开的各种多肽时,“分离的”表示多肽已经从其表达的细胞或细胞培养物中分离和/或回收并鉴定。通常,分离的多肽其制备经历至少一个纯化步骤。“分离抗体”指基本不含抗原特异性不同的其他抗体。“重组”表示抗体是用重组核酸技术在外源宿主细胞中生成的。
[0183]“特异性结合”或“特异性结合至”或“特异性针对”特定抗原或表位表示结合可测知地区别于非特异性相互作用。例如,特异性结合可通过测定某分子的结合并与对照分子的结合进行比较来测定,对照分子一般是结构上相似但没有结合活性的分子。例如,可通过与靶标相似的对照分子的竞争来确定特异性结合。
[0184]
针对特定抗原或表位的特异性结合可表现为抗体对抗原或表位的k
d
至少约10
‑4m、至少约10
‑5m、至少约10
‑6m、至少约10
‑7m、至少约10
‑8m、至少约10
‑9m、或者至少约10
‑
10
m、至少约10
‑
11
m、至少约10
‑
12
m或更高,其中k
d
是指特定抗体
‑
抗原相互作用的解离率。一般而言,特异性结合某抗原的抗体的k
d
比该抗原或表位相关对照分子高20、50、100、500、1000、5,000、 10000或更多倍。
[0185]
同时,针对特定抗原或表位的特异性结合还可表现为,例如,抗体对某抗原或表位的k
a
或k
a
比对照高至少20、50、100、500、1000、5000、10000或更多倍,其中k
a
或k
a
是指特定抗体
‑
抗原相互作用的结合率。
[0186]
ii.概述
[0187]
已设计了cd3和肿瘤抗原靶标共结合的双特异性抗体用于重定向t细胞以攻击并裂解靶向的肿瘤细胞。例如bite和dart型,它们单价结合cd3 和肿瘤抗原。虽然cd3
‑
靶向策略已显示出相当的前景,这类疗法的常见副作用是与之关联的细胞因子产生,通常导致有害的细胞因子释放综合征。因为双特异性抗体的抗
‑
cd3结合结构域结合所有的t细胞,募集了细胞因子高产的 cd4 t细胞亚组。并且,cd4 t细胞亚组包括调节性t细胞,其募集和扩增会导致免疫抑制并对长期肿瘤抑制有负面影响。另外,这些形式的双特异性抗体不含fc结构域,在患者中血清半衰期非常短。
[0188]
虽然cd3
‑
靶向策略显示出相当的前景,这类疗法的常见副作用是与之关联的细胞因子产生,通常导致有害的细胞因子释放综合征。因为双特异性抗体的抗
‑
cd3结合结构域结合所有的t细胞,募集了细胞因子高产的cd4 t细胞亚组。并且,cd4 t细胞亚组包括调节性t细胞,其募集和扩增会导致免疫抑制并对长期肿瘤抑制有负面影响。一种降低细胞因子产生并可能降低cd4 t 细胞活化的可行方式是通过降低抗
‑
cd3结构域对cd3的亲和性。
[0189]
因此,某些实施方式中,本发明提供的抗体构建体具有抗
‑
cd3抗原结合结构域,其为对cd3的“强”或“高亲和性”结合者(例如,h1.30_l1.47的重链和轻链可变结构域(任选地包括适当的带电荷的接头)),还结合cd38。另一些实施方式中,本发明提供的抗体构建体具
有抗
‑
cd3抗原结合结构域,其为对cd3的“轻度”或“低亲和性”结合者。另一些实施方式中,抗体构建体具有抗
‑
cd3抗原结合结构域,其对cd3的亲和性为中等或“中度”,还结合cd38。
[0190]
应理解本发明的“高、中、低”抗
‑
cd3序列可用于各种形式的异二聚化。虽然本文中大多采用“开瓶器”型异二聚体,这些可变重链序列和可变轻链序列,以及scfv序列(和包含可变重链序列和可变轻链序列的fab序列)可以用于其他形式,如wo公开号2014/145806的图2中那些,该申请的附图、所示形式和附图说明通过引用纳入本文。
[0191]
因此,本发明提供可结合两种不同抗原的异二聚体抗体,例如,该抗体是“双特异性的”,即它们结合两种不同的靶抗原,一般是下文所述的肿瘤抗原 (tta)。这些异二聚体抗体可以单价(例如,只有一个抗原结合结构域,如可变重链结构域和可变轻链结构域对)或二价(有两个抗原结合结构域,各自独立结合抗原)结合这些靶抗原。本发明的异二聚体抗体基于采用不同的单体,这些单体含有相比同二聚体“偏向”形成异二聚体的氨基酸取代(如后文所述)联合“pi变体”,“pi变体”使得异二聚体易于与同二聚体纯化分离(亦如下文所述)。对于本发明的异二聚体双特异性抗体,本发明主要依赖于采用改造的fc 结构域或变体fc结构域,它们能在生产细胞中自组装成异二聚体蛋白质,本发明同时还基于生成并纯化这种异二聚体蛋白质的方法。
[0192]
iii.抗体
[0193]
本发明涉及生成结合两种不同抗原,例如cd3和靶肿瘤抗原如cd20、 cd38和cd123,并且总体而言为治疗性抗体的双特异性抗体。文中“抗体”是广义的。可用于本发明的抗体可采用本文所述的多种形式,包括传统抗体以及抗体衍生物、片段和模拟物,如本文所述。
[0194]
常规抗体结构单元一般包括四聚体。各四聚体一般由相同的两对多肽链构成,各对有一条“轻链”(分子量一般为约25kda)和一条“重链”(分子量一般为约50
‑
70kda)。人轻链分类为κ和λ轻链。本发明涉及igg类,其具有几个亚类,包括但不限于igg1、igg2、igg3、和igg4。因此,本文所用的“同种型”表示由恒定区的化学和抗原特征决定的免疫球蛋白各亚类。应理解,治疗性抗体还可包含同种型和/或亚类的杂合体。如美国公开号2009/0163699中所述,其通过引用纳入,本发明包括对igg1/g2杂合体的pi改造。
[0195]
各链的氨基末端部分包括约100
‑
110或更多个氨基酸的可变区,其主要负责抗原识别,一般在本领域和本文中被称为“fv结构域”或“fv区”。在可变区中,重链和轻链各自v结构域中的3个环共同形成抗原结合位点。各环称为互补决定区(下文中称为“cdr”),其中氨基酸序列的变化最显著。“可变”是指可变区某些区段的序列在抗体间存在广泛差异。可变区内的变化并不是均匀分布的。事实上,v区由称为框架区(fr)的相对稳定的15
‑
30个氨基酸的延伸部分和分布在框架区之间称为“高变区”的各自长9
‑
15个氨基酸或更长的高度可变短区域组成。
[0196]
每一vh和vl由三个高变区(“互补决定区”,“cdr”)和四个fr组成,从氨基端到羧基端按照以下顺序排列: fr1
‑
cdr1
‑
fr2
‑
cdr2
‑
fr3
‑
cdr3
‑
fr4。
[0197]
高变区一般包含轻链可变区的约氨基酸残基24
‑
34(lcdr1;“l”表示轻链)、50
‑
56(lcdr2)和89
‑
97(lcdr3)以及重链可变区的约氨基酸残基 31
‑
35b(hcdr1;“h”表示重链)、50
‑
65(hcdr2)和95
‑
102(hcdr3);kabat等,《免疫学感兴趣蛋白质的序列》(sequences of proteins ofimmunological interest),第5版,马里兰州贝塞斯达的国立卫生研究院公
共健康服务部(public health service,national institutes of health,bethesda, md.)(1991)和/或形成高变环(例如,轻链可变区中的残基26
‑
32(lcdr1)、 50
‑
52(lcdr2)和91
‑
96(lcdr3)以及重链可变区中的残基26
‑
32(hcdr1)、 53
‑
55(hcdr2)和96
‑
101(hcdr3)的那些残基;chothia和lesk(1987)j.mol. biol.196:901
‑
917。下面描述本发明的具体cdr。
[0198]
本说明书中,提及可变结构域中的残基时,一般采用kabat编号系统(大致上,轻链可变区残基1
‑
107,重链可变区残基1
‑
113),并且,fc区采用eu 编号系统(例如,kabat等,同上(1991))。
[0199]
本发明提供了大量不同的cdr组合。在这种情况中,“全cdr组”包括 3个可变轻链cdr和3个可变重链cdr,例如,vlcdr1、vlcdr2、vlcdr3、 vhcdr1、vhcdr2和vhcdr3。这可以分别是更大的可变轻链结构域和可变重链结构域的局部。另外,如本文更详细的论述,可变重链结构域和可变轻链结构域可分处于分开的多肽链中,当采用重链和轻链时(例如,当采用fab时),或在同一多肽链上,例如scfv序列。
[0200]
cdr参与形成抗原结合位点,或更具体地说是表位结合位点。“表位”是指与抗体分子可变区中特定抗原结合位点(“抗体决定簇”)相互作用的决定簇。表位由氨基酸或糖侧链等分子集合而成,且通常具有特定的结构特征以及特定电荷特征。一个抗原可具有一个以上表位。
[0201]
表位可包含直接参与结合的氨基酸残基(也称为表位的免疫决定组分)和不参与结合的其他氨基酸残基,如被特异性抗原结合肽有效封闭的氨基酸残基;换而言之,这些氨基酸残基包括在特异性抗原结合肽的足迹(footprint)内。
[0202]
表位可以是构象表位或线性表位。构象表位由线性多肽链不同区段的氨基酸空间并列形成。线性表位由多肽链中的相邻氨基酸残基形成。构象表位和非构象表位的区别在于:变性溶剂存在下,与构象表位的结合会丢失,而非构象表位的则不会。
[0203]
表位通常包含呈独特空间构象的至少3个、或更常见的是至少5个或8
‑
10 个氨基酸。可以通过简单的免疫实验显示一种抗体阻断另一种抗体与靶抗原结合的能力来认证识别相同表位的抗体,例如,“聚类试验(binning)”。
[0204]
各链的羧基末端部分定义为主要负责效应物功能的恒定区。kabat等汇总了众多重链和轻链可变区的一级序列。根据序列的保守程度,各一级序列被分类为cdr和框架区,并且制成列表(参见《免疫学感兴趣蛋白质的序列》 (sequences of proteins of immunological interest),第5版, nih出版号91
‑
3242,e.a.kabat等,通过引用全文纳入)。
[0205]
在免疫球蛋白的igg亚类中,重链中存在多个免疫球蛋白结构域。本文中“免疫球蛋白(ig)结构域”表示免疫球蛋白中具有独特三级结构的区域。本发明感兴趣的是重链结构域,包括恒定重链(ch)结构域和铰链结构域。就igg抗体而言,igg同种型各有3个ch区。因此,igg的“ch”结构域如下:按照 kabat的eu索引,“ch1”指118
‑
220位。按照kabat的eu索引,“ch2”指237
‑
340 位,并且按照kabat的eu索引,“ch3”指341
‑
447位。如本文所述,pi变体可存在于一个或多个ch区以及铰链区中,如后文所述。
[0206]
需要说明的是,此处的序列自ch1,118位开始;不包括可变区,除非另有说明。例如,seq id no:2的第一氨基酸,虽然在序列表中指为“1”位,根据eu编号,对应的是ch1区的118位。
[0207]
另一类重链ig结构域是铰链区。本文中的“铰链”或“铰链区”或“抗体铰链区”或“免疫球蛋白铰链区”表示包含抗体第一和第二恒定结构域之间氨基酸的挠性多肽。结构上,igg ch1结构域终止于eu第220位,igg ch2 结构域始于eu第237位残基。因此,对于igg而言,抗体铰链在此定义为包括221(igg1中的d221)至236(igg1中的g236)位,其中编号是根据kabat的 eu索引。某些实施方式中,例如,就fc区而言,包括铰链下部,“铰链下部”一般是指226或230位。如本文所述,也可在铰链区中制造pi变体。
[0208]
轻链一般包括两个结构域,轻链可变结构域(含有轻链cdr并与重链可变结构域一起形成fv区)和轻链恒定区(通常称为cl或cκ)。
[0209]
另一其他取代属意的区域是fc区。
[0210]
因此,本发明提供了不同的抗体结构域。如本文所述和本领域所知,本发明异二聚体抗体的重链和轻链内包含不同结构域,还可以是重叠的。这些结构域包括但不限于,fc结构域、ch1结构域、ch2结构域、ch3结构域、铰链结构域、重链恒定结构域(ch1
‑
铰链
‑
fc结构域或ch1
‑
铰链
‑
ch2
‑
ch3)、可变重链结构域、可变轻链结构域、轻链恒定结构域、fab结构域和scfv结构域。
[0211]
因此,“fc结构域”包括
‑
ch2
‑
ch3结构域和可选的铰链结构域。重链包括可变重链结构域和恒定结构域,这包括ch1
‑
可选的铰链
‑
fc结构域,fc结构域包含ch2
‑
ch3。轻链包括轻链可变结构域和轻链恒定结构域。
[0212]
本发明的一些实施方式包括至少一个scfv结构域,这不是天然的,一般包括通过scfv接头连接在一起的可变重链结构域和可变轻链结构域。如本文所示,可采用多种合适的scfv接头,包括通过重组技术产生的常规肽键。
[0213]
接头肽可主要包括以下氨基酸残基:gly、ser、ala、或thr。接头肽应具有足够的长度以确保两个分子彼此都以正确的构象连接在一起从而保留各自活性。实施方式之一中,接头长约1
‑
50个氨基酸,优选长约1
‑
30个氨基酸。实施方式之一中,可使用长度为1
‑
20个氨基酸的接头,某些实施方式中使用约5至约10个氨基酸的。可用的接头包括甘氨酸
‑
丝氨酸聚合物,包括例如 (gs)n、(gsggs)n、(ggggs)n、和(gggs)n,其中n是至少为1的整数(一般是3
‑
4),甘氨酸
‑
丙氨酸聚合物,丙氨酸
‑
丝氨酸聚合物,以及其他柔性接头。或者,多种非蛋白性聚合物可用作接头,包括但不限于聚乙二醇(peg)、聚丙二醇、聚氧化烯、或聚乙二醇和聚丙二醇的共聚物。
[0214]
其他接头序列可包括cl/ch1结构域内各种长度的序列,但不包括 cl/ch1结构域全部残基;例如,cl/ch1结构域的前5
‑
12个氨基酸残基。接头可衍生自免疫球蛋白轻链,例如cκ或cλ。接头可衍生自各同种型的免疫球蛋白重链,例如,cγ1、cγ2、cγ3、cγ4、cα1、cα2、cδ、cε、和cμ。接头序列也可来自于其它蛋白质,如ig
‑
样蛋白质(如tcr、fcr、kir),来源于绞链区的序列,以及来自其它蛋白质的其它天然序列。
[0215]
某些实施方式中,接头是用于将任意两个本文所述的结构域连接在一起的“结构域接头”。虽然可使用各种合适的接头,许多实施方式采用甘氨酸
‑
丝氨酸聚合物,包括例如(gs)n、(gsggs)n、(ggggs)n、和(gggs)n,其中n 是至少为1的整数(一般是3至4至5),以及具有足够长度和柔性、能将两个结构域重组连接并保留各自生物学功能的各种肽序列。某些情形中,同时注意到“链型”的情况下,如后文所述,可使用带电荷的结构域接头,如scfv接头的一些实施方式中所用。
[0216]
某些实施方式中,scfv接头是带电荷的scfv接头,图33显示了多个这样的接头。因此,本发明还提供了带电荷的scfv接头,用以促进第一和第二单体之间pi的分离。即,通过纳入带电荷的scfv接头,不论正电或负电(或两者,如果是在不同单体上使用scfv的构架),包含带电荷接头的单体能够改变pi而无需在fc结构域中制造其他改变。这些带电荷的接头可被取代成各种含scfv 的标准接头。同样,本领域技术人员可以看出,根据所需的pi,将带电荷的scfv 接头用在正确的“链”或单体上。例如,如本文所述,为了制备三f形式的异二聚体抗体,计算各所需抗原结合结构域的fv区的原始pi,并且选择其中之一来制备scfv,并根据pi选择正电或负电接头。
[0217]
带电荷的结构域接头还可用于增强本发明单体的pi分离,因此,图33中的那些可用于本文中用到接头的各种实施方式。
[0218]
某些实施方式中,抗体是全长抗体。本文中“全长抗体”表示构成抗体天然生物形式的结构,包括可变区和恒定区,包括本文所述的一个或多个修饰,尤其是在fc结构域中,以形成异二聚化或将异二聚体与同二聚体纯化分离。全长抗体一般包括fab和fc结构域,并且还可含有额外的抗原结合结构域,如scfv,如图所示。
[0219]
实施方式之一中,抗体是抗体片段,只要该片段含有可经改造(例如pi改造)以产生异二聚体的至少一个恒定结构域。可使用的其他抗体片段包括含有一个或多个经pi改造的本发明的ch1、ch2、ch3、铰链和cl结构域的片段。例如,fc融合体是fc区(ch2和ch3,可以带有铰链区)与另一个蛋白质融合而成的融合体。本领域已知多个fc融合体,可通过添加本发明的异二聚化变体对其进行改善。在此,用本文各种异二聚化变体组合,抗体融合体可制成包含ch1;ch1,ch2和ch3;ch2;ch3;ch2和ch3;ch1和ch3,其中任一或全部可制备成还可选性地带有铰链区。
[0220]
具体地说,图1所示的形式是抗体,通常称为“异二聚体抗体”,表示该蛋白质具有至少两个关联的fc序列,它们自组装成异二聚体fc结构域。
[0221]
嵌合抗体和人源化抗体
[0222]
某些实施方式中,抗体可以是来自不同物种的混合物,例如,嵌合抗体和 /或人源化抗体。通常,“嵌合抗体”和“人源化抗体”是指组合了超过一个物种的区域的抗体。例如,“嵌合抗体”通常包含小鼠(有时是大鼠)的可变区和人的恒定区。“人源化抗体”一般是指可变结构域的框架区被换成人抗体中序列的非人抗体。一般而言,在人源化抗体中,整个抗体,除了cdr以外,由人源多核苷酸编码,且除cdr以外与该抗体相同。其中部分或全部由非人生物核酸编码的cdr移植到人抗体可变区的β片层构架中以形成抗体,该抗体的特异性由移植过来的cdr决定。这类抗体的产生可见例如wo 92/11018, jones,1986,nature 321:522
‑
525,verhoeyen等,1988,science 239:1534
‑
1536,其全部通过引用纳入本文。经常需要把选定受体的框架区残基“回复突变”成相应的供体残基,从而恢复初始移植构建体中丢失的亲合力(us 5530101、us5585089、us 5693761、us 5693762、us 6180370、us 5859205、us 5821337、 us 6054297、us 6407213,全部通过引用全文纳入本文)。人源化抗体还可或选性地包含免疫球蛋白恒定区的至少一部分,一般是人免疫球蛋白因此通常包含人fc区。人源化还可采用带有经遗传改造的免疫系统的小鼠来生成。roque 等,2004,biotechnol.prog.20:639
‑
654,其全文通过引用纳入本文。本领域有多种熟知的非人抗体人源化和改形技术与方法(参见,tsurushita和vasquez, 2004,抗体的人源化,b细胞分子
生物学(humanization of monoclonal antibodies, molecular biology of b cells),533
‑
545,elsevier science(usa)以及本文所引用的参考文献,其全部通过引用全文纳入本文)。人源化方法包括但不限于:jones 等,1986,nature 321:522
‑
525;riechmann等,1988;nature 332:323
‑
329; verhoeyen等,1988,science,239:1534
‑
1536;queen等,1989,proc natl acad sci, usa 86:10029
‑
33;he等,1998,j.immunol.160:1029
‑
1035;carter等,1992,procnatl acad sci usa 89:4285
‑
9,presta等,1997,cancer res.57(20):4593
‑
9; gorman等,1991,proc.natl.acad.sci.usa 88:4181
‑
4185;o’connor等,1998, protein eng 11:321
‑
8中所述的方法,其全部通过引用全文纳入本文。人源化或其他减少非人抗体可变区免疫原性的方法可包括表面重塑法,如roguska等, 1994,proc.natl.acad.sci.usa 91:969
‑
973所述,其通过引用全文纳入本文。实施方式之一中,亲本抗体是已经亲合力熟化的,如本领域所知的那样。可采用基于结构的方法来进行人源化和亲合力熟化,例如ussn 11/004,590中所述。可采用基于选择的方法来将抗体可变区人源化和/或亲合力熟化,包括但不限于:wu等,1999,j.mol.biol.294:151
‑
162;baca等,1997,j.biol.chem. 272(16):10678
‑
10684;rosok等,1996,j.biol.chem.271(37):22611
‑
22618; rader等,1998,proc.natl.acad.sci.usa 95:8910
‑
8915;krauss等,2003, protein engineering 16(10):753
‑
759中所述的方法,其全部通过引用全文纳入本文。其他人源化方法可包括仅移植部分cdr,包括但不限于ussn 09/810,510; tan等,2002,j.immunol.169:1119
‑
1125;de pascalis等,2002,j.immunol. 169:3076
‑
3084中所述的方法,其全部通过引用全文纳入本文。
[0223]
iv.异二聚体抗体
[0224]
因此,某些实施方式中,本发明提供异二聚体抗体,其依赖于采用两个不同重链变体fc序列,它们会自组装成异二聚体fc结构域和异二聚体抗体。
[0225]
本发明涉及提供异二聚体抗体的新构建体,所述异二聚体抗体允许结合超过一种抗原或配体,例如,允许双特异性结合。异二聚体抗体构建体是基于抗体两个重链fc结构域的自组装性质,例如,两个“单体”自组装成“二聚体”。如下文所述,通过改变各单体的氨基酸序列来制备异二聚体抗体。因此,本发明涉及异二聚体抗体的创制,这依赖于由各链上不同的恒定区内氨基酸变体促进异二聚体形成和/或简化异二聚体与同二聚体的纯化分离,这些异二聚体抗体能够以多种方式共结合多个或多种抗原。
[0226]
因此,本发明提供了双特异性抗体。抗体技术领域当前的一个问题是需要同时结合两个不同抗原的“双特异性”抗体,由此令不同抗原靠近并产生新功能和新疗法。一般而言,这些抗体通过将包含各重链和轻链的基因引入宿主细胞来制备。这一般形成所需的异二聚体(a
‑
b),还有两种同二聚体(a
‑
a和b
‑
b(不包括轻链异二聚体问题))。然而,形成双特异性抗体的主要障碍在于难以将异二聚体抗体与同二聚体抗体纯化分离,和/或难以相对于同二聚体偏向性地更多形成异二聚体。
[0227]
有多种可用于生成本发明异二聚体的机制。另外,本领域技术人员可以看出,这些机制可相互组合以确保高度异二聚化。因此,产生异二聚体的氨基酸变体被称为“异二聚化变体”。如下文所述,异二聚化变体可包括立构变体(例如,下文所述的“球与孔”或“偏向”变体和下文所述的“电荷对”变体)以及“pi变体”,这能将同二聚体与异二聚体纯化分离。如wo2014/145806中所述,该申请通过引用全文纳入,并具体如下文“异二聚化变体”所述,可
用于异二聚化的机制包括“球与孔”(“kih”;本文中有时称为“偏向”变体(参见wo2014/145806中所述)、wo2014/145806中所述的“静电操控”或“电荷对”、wo2014/145806中所述的pi变体、以及wo2014/145806和下文中所示的其他fc变体。
[0228]
在本发明中,有几种基本机制可使异二聚体抗体的纯化变得容易:一种依赖于采用pi变体,使各单体具有不同的pi,由此允许等电纯化a
‑
a、a
‑
b和 b
‑
b二聚体蛋白质。或者,部分构架形式如“三f”形式,允许基于大小的分离。如后文所述,还可以相对于同二聚体“偏向”地更多形成异二聚体。因此,立构异二聚化变体和pi或电荷对变体的组合在本发明中特别有用。
[0229]
一般而言,本发明中特别有用的实施方式依赖于包括偏向变体和pi变体在内的组合变体,偏向变体促进高于同二聚化的优势性异二聚化,pi变体加大两种单体之间的pi差异。
[0230]
另外,如后文所述,根据异二聚体抗体的形式,pi变体既可包含在单体的恒定和/或fc结构域内,也可包含在带电荷的接头中,即可采用结构域接头也可采用scfv接头。即,采用scfv的构架如三f形式可包括带电荷的(正电或负电)scfv接头,这通过pi优化了纯化。本领域技术人员可以看出,某些三f形式只要有带电荷的scfv接头就可用,无需其他pi调整,尽管本发明确实提供存在于单体之一或两者之上的pi变体,和/或带电荷的结构域接头。另外,其他官能团的氨基酸改造也可能造成pi变化,如fc、fcrn和ko变体。
[0231]
在利用pi作为分离机制来纯化异二聚体蛋白质的本发明中,可在单体多肽之一或两者中引入氨基酸变体;即,可将单体之一(简称“单体a”)的pi改造成不同于单体b,或改变单体a和b两者,其中单体a的pi升高而单体b 的pi降低。如后文所述,单体之一或两者的pi改变可如下进行:去除或添加带电荷残基(例如,中性氨基酸取代成带正电或带负电的氨基酸残基,例如,甘氨酸替换为谷氨酸),将正电残基改为负电残基或反之(例如天冬氨酸改成赖氨酸),或将带电荷残基改为中性残基(例如,电荷丢失;赖氨酸改为丝氨酸)。附图显示了多种此类变体。
[0232]
因此,本发明的这一实施方式令人能在至少单体之一中产生足够的pi变化从而将异二聚体与同二聚体分离。本领域技术人员可以看出,并如后文所述,这可以如下进行:使用“野生型”重链恒定区和已被升高或降低其pi的变体区(wt a
‑
b或wt a
‑‑
b),或升高一个区域而降低另一个区域(a
‑
b
‑
或a
‑
b )。
[0233]
因此,总体而言,本发明的部分实施方式内容之一是抗体恒定区中的氨基酸变体,针对的是改变二聚体蛋白质单体至少其一(如果不是两者)的等电点(pi) 以形成“pi抗体”,通过向单体之一或两者中引入氨基酸取代(“pi变体”或“pi取代”)来进行。如本文所示,如果两个单体的pi差仅0.1个ph单位,就能够将异二聚体与两个同二聚体分离,0.2、0.3、0.4和0.5ph单位或更大的pi 差在本发明中都可采用。
[0234]
本领域技术人员可以看出,欲实现良好分离而引入各单体或两单体上的 pi变体数量部分取决于组分的初始pi,以三f形式为例,即目标scfv和fab 的初始pi。即,为了确定对哪个单体进行改造或改造“方向”(例如,是更多正电还是更多负电),计算两种靶抗原的fc序列并且由此进行决定。如本领域所知,不同的fv具有不同的初始pi,本发明利用了这一点。一般而言,如本文所述,对pi进行改造以使各单体的总pi差异至少约0.1log,优选0.2
‑
0.5。
[0235]
此外,本领域技术人员可以看出,并如本文所示,部分实施方式中,可基于大小将异二聚体与同二聚体分离。例如图1所示,有几种形式允许基于大小分离异二聚体和同二聚体。
[0236]
在使用pi变体来实现异二聚化的情形中,通过使用重链的恒定区,提供了设计和纯化双特异性蛋白质(包括抗体)的更模块化的方法。因此,某些实施方式中,异二聚化变体(包括偏向和纯化异二聚化变体)不在可变区中,这样,每个抗体都必须改造。另外,某些实施方式中,通过其他igg同种型引入pi 变体来改变pi而不引入显著的免疫原性,由此降低pi变体导致免疫原性的可能性。因此,有待解决的另一个问题是阐明高人序列含量恒定结构域的低pi,例如,最小化或避免在任何特定位置的非人残基。
[0237]
这种pi改造可能的附带好处还在于血清半衰期延长和fcrn结合增强。即,如ussn 13/194,904所述(通过引用全文纳入本文),降低抗体恒定结构域(包括在抗体和fc融合体中的那些)的pi可产生更长的体内血清存留。此类延长血清半衰期的pi变体也有利于纯化目的的pi改变。
[0238]
另外,需要说明的是,异二聚化变体的pi变体对双特异性抗体的分析和质量控制过程有额外的好处,即存在同二聚体时显著的消除、最小化或区分能力。类似地,可靠地测试异二聚体抗体产生的再现性的能力是重要的。
[0239]
异二聚化变体
[0240]
本发明提供异二聚体蛋白质,包括多种形式的异二聚体抗体,其采用异二聚体变体以允许异二聚体形成和/或与同二聚体纯化分离。
[0241]
存在有多种合适的配对异二聚化偏向变体组合。这些变体以“配对”的“组合”方式出现。即,配对中的一组纳入第一单体而另一组纳入第二单体。需要说明的是,这些组合不一定象“球与孔”变体那样,其中一个单体上的残基与另一个单体上的残基一一对应;即,这些配对的组合在两个单体之间形成一个界面,促进异二聚体的形成而阻碍同二聚体形成,从而生物条件下自发形成的异二聚体的百分比超过90%,而不是原以为的50%(25%同二聚体a/a:50%异二聚体a/b:25%同二聚体b/b)。
[0242]
立构变体
[0243]
某些实施方式中,可通过添加立构变体来促进异二聚体形成。即,通过改变各重链中的氨基酸,不同的重链更可能结合成异二聚体结构而不是与相同的 fc氨基酸序列形成同二聚体。图29中包括合适的立构变体。
[0244]
在此还可采用本领域中一般称为“球与孔(knobs and holes)”的一种机制,指产生立构影响有利于异二聚体形成而不利于同二聚体形成的氨基酸改造;这有时被称为“球与孔”,如ussn 61/596,846,ridgway等,protein engineering9(7):617(1996);atwell等,j.mol.biol.1997 270:26;美国专利号8,216,805中所述,以上全部通过引用全文纳入本文。附图指示了多种依赖于“球与孔”的“单体a
‑
单体b”配对。另外,如merchant等,nature biotech.16:677(1998) 中所述,这些“球与孔”突变可与二硫键组合以偏向性地形成异二聚化。
[0245]
用于生成异二聚体的另一种机制有时被称为“静电操控”,如gunasekaran 等,j.biol.chem.285(25):19637(2010)所述,其通过引用全文纳入本文。这有时在本文中被称为“电荷对”。在该实施方式中,使用静电来偏向于形成异二聚化。本领域技术人员可以看
出,这些也可能对pi有影响,继而对纯化有影响,因此,某些情形下也可被认为是pi变体。然而,由于制造这些是为驱动二聚化而非用作纯化工具,将它们归类为“立构变体”。这些变体包括但不限于:d221e/p228e/l368e配对d221r/p228r/k409r(例如,这些是“单体对应组合”)和c220e/p228e/368e配对c220r/e224r/p228r/k409r。
[0246]
单体a变体和单体b变体可以任选地、独立地与任意数量的其他变体联用,如pi变体或us 2012/0149876中图37所示的其他立构变体,这些附图和附图说明以及seq id no通过引用纳入本文。
[0247]
某些实施方式中,本文所述立构变体可任选地、独立地与各种pi变体(或其他变体如fc变体、fcrn变体等)纳入一个或两个单体,并可独立地、任选地包括或不包括于本发明的蛋白质中。
[0248]
图29显示合适的偏向变体,图34显示某些实施方式中特别有用的一些配对。多个实施方式中特别有用配对组合包括但不限于:s364k/e357q: l368d/k370s;l368d/k370s:s364k;l368e/k370s:s364k; t411t/e360e/q362e:d401k;l368d/k370s:s364k/e357l和k370s: s364k/e357q。命名上,“s364k/e357q:l368d/k370s”配对表示单体之一具有双变体组合s364k/e357q而另一个具有双变体组合l368d/k370s。
[0249]
异二聚体的pi(等电点)变体
[0250]
一般而言,本领域技术人员可以看出,存在两类pi变体:升高蛋白质pi 的(碱性改变)和降低蛋白质pi的(酸性改变)。如本文所述,这些变体可以任意组合:一个单体可以是野生型,或者pi与野生型无明显差异的变体,另一个可以更具碱性或更具酸性。或者,每个单体都改变,一个变得更具碱性而另一个变得更具酸性。
[0251]
pi变体的优选组合见图30。如本文所述和附图所示,这些变化是就igg1 而言的,但所有同种型和同种型杂交体都可照此改变。重链恒定结构域来自 igg2至4时,还可使用r133e和r133q。
[0252]
抗体异二聚体轻链变体
[0253]
如果是基于抗体的异二聚体,例如,至少单体之一除重链结构域之外还包含轻链,也可在轻链中制造pi变体。用于降低轻链pi的氨基酸取代包括但不限于:k126e、k126q、k145e、k145q、n152d、s156e、k169e、s202e、 k207e,以及在轻链的c
‑
端添加肽dede。基于恒定λ轻链的此类改变包括在 r108q、q124e、k126q、n138d、k145t和q199e处的一个或多个取代。另外,也可提高轻链的pi。
[0254]
同种型变体
[0255]
另外,本发明的许多实施方式是基于将一种igg同种型特定位置的pi氨基酸“引入”另一同种型,由此降低或消除在变体中引入不希望有的免疫原性的可能性。就此可见美国公开号2014/0370013的图21,以上通过引用纳入本文。即,出于包括高效应物功能等多种原因,igg1是治疗性抗体的常用同种型。然而,igg1重链恒定区的pi高于igg2的重链恒定区(8.10对比7.31)。通过将特定位置的igg2残基引入igg1主链,所得单体的pi降低(或升高),并且还表现出更长的血清半衰期。例如,igg1在137位处有甘氨酸(pi 5.97),而igg2 为谷氨酸(pi 3.22);引入谷氨酸将影响所得蛋白质的pi。如下文所述,一般需要多个氨基酸取代来显著影响变体抗体的pi。然而,需要说明的是,如下文所述,igg2分子中的改变也能延长血清半衰期。
[0256]
在另一些实施方式中,进行非同种型氨基酸变化,用以降低所得蛋白质的总体电荷状态(例如,将高pi氨基酸换成低pi氨基酸)或是针对稳定性的结构调整等,如后文所述。
[0257]
另外,通过对重链恒定区和轻链恒定区的pi改造,可在异二聚体的各单体中看到显著改变。如本文所述,使两种单体的pi相差至少0.5可允许通过离子交换色谱或等电聚焦或对等电点敏感的其他方法实现分离。
[0258]
计算pi
[0259]
各单体的pi可能取决于变体的重链恒定结构域pi和包括变体重链恒定结构域和融合伴侣在内整个单体的pi。因此,某些实施方式中,使用美国公开号 2014/0370013的图19中的图表,基于变体重链恒定结构域来计算pi的改变。如本文所述,改造哪个单体一般决定于fv和框架区的固有pi决定。或者,可对各单体的pi进行比对。
[0260]
还提供更好fcrn体内结合的pi变体
[0261]
在pi变体降低单体pi的情形中,它们还会额外地改善体内血清留存。
[0262]
虽然仍在验证中,fc区被认为具有较长的体内半衰期,因为核内体中ph 6下与fcrn的结合隔离了fc(ghetie和ward,1997immunol today.18(12): 592
‑
598,通过引用全文纳入本文)。核内体隔室然后将fc再循环至细胞表面。一旦隔室向胞外空间打开,较高ph(~7.4)诱导fc释放回血液中。在小鼠中, dall’acqua等显示在ph 6和ph 7.4fcrn结合增强的fc突变体实际上其血清浓度降低并具有与野生型fc相同的半衰期(dall’acqua等,2002,j.immunol. 169:5171
‑
5180,通过引用全文纳入本文)。在ph 7.4下fc对fcrn亲和性提高被认为抑制了fc释放回血液中。因此,理想的是,增强fc体内半衰期的fc 突变增强低ph下的fcrn结合,同时仍然允许在高ph下释放fc。氨基酸组氨酸在6.0
‑
7.4的ph范围内其电荷状态会变化。因此,不出意外地在fc/fcrn 复合物的重要位置发现有his残基。
[0263]
最近已经提出具有低等电点可变区的抗体也可具有更长的血清半衰期 (igawa等,2010 peds.23(5):385
‑
392,通过引用全文纳入本文)。然而,对其机制尚知之甚少。此外,抗体的可变区各不相同。具有低pi和长半衰期的恒定区能提供更模块化的方法来改善抗体的药代动力学性质,如本文所述。
[0264]
针对其他功能的其他fc变体
[0265]
除了pi氨基酸变体以外,可出于多种原因制造多种其他有用的fc氨基酸修饰,这些原因包括但不限于,改变与一个或多个fcγr受体的结合,改变与 fcrn受体的结合等。
[0266]
因此,本发明的蛋白质可包括氨基酸修饰,包括本文的异二聚化变体,这包括pi变体和立构变体。各种组合变体可独立地、任选地包括或不包括于各种特定异二聚体蛋白质中。
[0267]
fcγr变体
[0268]
因此,可制造多种可用的fc取代来改变与fcγr受体中一种或多种的结合。有用的包括增强结合和降低结合的取代。例如,已知与fcγriiia结合加强通常会增强adcc(抗体依赖性细胞介导的细胞毒作用;细胞介导的反应,其中表达fcγr的非特异性细胞毒性细胞识别靶细胞上结合的抗体然后引起靶细胞裂解)。类似地,某些情形中,与fcγriib(抑制性受体)结合降低是有益的。本发明中有用的氨基酸取代包括ussn 11/124,620(尤其是图41)、11/174,287、 11/396,495、11/538,406中所列的那些,以上全部通过引用全文纳入本文,尤其其中的变体。有用的具体变体包括但不限于:236a、239d、239e、332e、 332d、239d/
332e、267d、267e、328f、267e/328f、236a/332e、239d/332e/330y、 239d、332e/330l、243a、243l、264a、264v和299t。
[0269]
另外,还有其他fc取代用于增强与fcrn受体的结合并延长血清半衰期,如ussn 12/341,769中具体所示,通过引用将其全文纳入本文,包括但不限于: 434s、434a、428l、308f、259i、428l/434s、259i/308f、436i/428l、436i 或v/434s、436v/428l和259i/308f/428l。
[0270]
消除变体
[0271]
类似地,另一类功能性变体是“fcγr消除变体”或“fc敲除(fcko或ko)”变体。在这些实施方式中,对某些治疗性应用而言,需要降低或去除fc结构域与fcγ受体(例如fcγr1、fcγriia、fcγriib、fcγriiia等)之一、多种或全部的正常结合,以避免其他作用机制。即,例如,在许多实施方式中,尤其是单价结合cd3的双特异性抗体的使用中,通常需要消除fcγriiia结合以消除或显著降低adcc活性,其中fc结构域之一含有一个或多个fcγ受体消除变体。这些消除变体见图31,每一个都可以独立地、任选地被包括或不包括,优选采用选自以下的消除变体:g236r/l328r、e233p/l234v/l235a/g236del/s239k、 e233p/l234v/l235a/g236del/s267k、 e233p/l234v/l235a/g236del/s239k/a327g、 e233p/l234v/l235a/g236del/s267k/a327g和e233p/l234v/l235a/g236del。需要说明的是,本文引用的消除变体消除fcγr结合但一般不消除fcrn结合。
[0272]
异二聚体和fc变体的组合
[0273]
本领域技术人员可以看出,提到的所有异二聚化变体(包括偏向变体和/或 pi变体)可任选地、独立地以任意方式组合,只要它们保留其“链型”或“单体分配”。另外,所有这些变体可结合到任意异二聚化形式中。
[0274]
就pi变体而言,虽然附图中显示了若干特别有用的实施方式,但是,按照改变两个单体之间的pi差以促进纯化这一基本原理,可以形成其他实施方式。
[0275]
另外,异二聚化变体、偏向和pi中任一个独立地、任选地与fc消除变体、 fc变体、fcrn变体相互组合,如本文的通用说明。
[0276]
本发明的有用抗体形式
[0277]
本领域技术人员可以看出,并如后文所述,本发明的异二聚体融合蛋白可采用多种构型,总体如图1所示。一些图显示“单末端”构型,其中,分子的一个“臂”上有一种特异性而另一个“臂”上则为不同的特异性。另一些图显示“双末端”构型,其中,分子的“顶部”有至少一种特异性而分子的“底部”有一种或多种其他特异性。因此,本发明涉及共结合不同的第一和第二抗原的新型免疫球蛋白组合物。
[0278]
本领域技术人员可以看出,本发明的异二聚体形式除双特异性外可具有不同的价态。即,本发明的异二聚体抗体可以是二价双特异性的,其中一个靶肿瘤抗原(例如,cd3)被一个结合结构域结合而另一个靶肿瘤抗原(例如,cd20、 cd19、cd38、cd123等)被第二结合结构域结合。异二聚体抗体也可以是三价双特异性的,其中第一抗原被两个结合结构域结合而第二抗原被第二结合结构域结合。如本文所述,当cd3是靶抗原之一时,优选cd3仅被单价结合,旨在降低潜在副作用。
[0279]
本发明将抗
‑
cd3抗原结合结构域与抗
‑
靶肿瘤抗原(tta)抗原结合结构域联合。本领域技术人员可以看出,可采用各附图(具体见图2
‑
7和图68)中所示的抗
‑
cd3 cdr、抗
‑
cd3
可变轻链结构域和可变重链结构域、fab和scfv。类似地,可采用各种抗
‑
tta抗原结合结构域,例如,抗
‑
cd38、抗
‑
cd20、抗
‑
cd19 和抗
‑
cd123抗原结合结构域,可采用各附图中所示的cdr、可变轻链结构域和可变重链结构域、fab和scfv,任选地、独立地任意组合。
[0280]
开瓶器型
[0281]
本发明中特别有用的异二聚体构架之一是图1a、a和b中所示的“三f”或“开瓶器”构架形式。在该实施方式中,抗体的一条重链含有单链fv(本文所述“scfv”)而另一条重链是包含可变重链和可变轻链的“常规”fab形式。这种结构有时在本文中被称为“三f”型(scfv
‑
fab
‑
fc)或“开瓶器”型,由于看上去与开瓶器相当相似(见图1)。两条链通过恒定区(例如,fc结构域、ch1 结构域和/或铰链区)中采用氨基酸变体合在一起,所述变体促进异二聚体抗体的形成,如后文所述。
[0282]“三f”型有诸多优点。如本领域所知,依赖于两种scfv构建体的抗体类似物通常有稳定性和聚集问题,在本发明中这可以通过添加“常规”的重轻链配对来缓解。另外,与依赖于两条重链和两条轻链的形式相反,不存在重链和轻链错配的问题(例如,重链1与轻链2配对,等等)。
[0283]
本文实施方式中许多是基于开瓶器形式,其第一单体包含scfv,该scfv 包含可变重链结构域和可变轻链结构域,用scfv接头(许多情形下带电荷,但非所有情形)共价接合,其中的scfv通常通过结构域接头(带电或不带电,如本文所述)共价接合至第一fc结构域的n
‑
端。开瓶器形式的第二单体是重链,该组合物还包括轻链。
[0284]
一般而言,在许多优选的实施方式中,scfv是结合cd3的结构域,重链和轻链的fab结合tta。另外,本发明的fc结构域一般包含偏向变体(例如,如图29和图34所示的组合氨基酸取代,特别有用的偏向变体选自: s364k/e357q:l368d/k370s;l368d/k370s:s364k;l368e/k370s:s364k; t411t/e360e/q362e:d401k;l368d/k370s:s364k/e357l和k370s: s364k/e357q),可选的消除变体(包括图31中所示的那些),可选的带电scfv 接头(包括图33中所示的那些),重链包含pi变体(包括图30中所示的那些)。
[0285]
本发明提供其中抗
‑
cd3 scfv序列如图2至图7和图68中所示的开瓶器形式。
[0286]
本发明提供具有cd38抗原结合结构域的开瓶器形式,其中抗
‑
cd38序列如图中所示,包括图8
‑
10。
[0287]
本发明提供具有cd20抗原结合结构域的开瓶器形式,其中抗
‑
cd20序列如图所示。
[0288]
本发明提供具有cd19抗原结合结构域的开瓶器形式,其中抗
‑
cd19序列如图所示。
[0289]
本发明提供具有cd123抗原结合结构域的开瓶器形式,其中抗
‑
cd123序列如图所示。
[0290]
mab
‑
fv型
[0291]
本发明中特别有用的异二聚体构架之一是图1所示的mab
‑
fv形式。在该实施方式中,该形式将“额外”的可变重链结构域接合于单体之一的c
‑
端,“额外”可变轻链结构域接合于另一个单体的c
‑
端,由此形成第三抗原结合结构域,其中两个单体的fab部分结合tta而“额外”scfv结构域结合cd3。
[0292]
在该实施方式中,第一单体包括第一重链,第一重链包含第一可变重链结构域和含第一fc结构域的第一恒定重链结构域,第一可变轻链结构域通过结构域接头共价接合于第一fc结构域的c
‑
端。第二单体包括第二可变重链结构域和含第二fc结构域的第二恒定重
链结构域,还包括用结构域接头共价接合至第二fc结构域的c
‑
端的第三可变重链结构域。两个c
‑
端接合的可变结构域组成结合cd3的scfv。该实施方式还采用包含可变轻链结构域和恒定轻链结构域的共同轻链,与重链缔合形成结合tta的两个相同fab。如同本发明许多实施方式,这些构建体根据需要包含偏向变体、pi变体、消除变体、其他fc 变体等,如本文所述。
[0293]
本发明提供其中抗
‑
cd3 scfv序列如图2至图7和图68中所示的mab
‑
fv 型。
[0294]
本发明提供其中抗
‑
cd38序列如图8
‑
10中所示的mab
‑
fv形式。
[0295]
本发明提供具有cd20抗原结合结构域的mab
‑
fv形式,其中抗
‑
cd20序列如图所示。
[0296]
本发明提供具有cd19抗原结合结构域的mab
‑
fv形式,其中抗
‑
cd19序列如图所示。
[0297]
本发明提供具有cd123抗原结合结构域的mab
‑
fv形式,其中抗
‑
cd123 序列如图所示。
[0298]
本发明提供包含图31所示消除变体的mab
‑
fv形式。
[0299]
本发明提供包含图29和34所示偏向变体的mab
‑
fv形式。
[0300]
mab
‑
scfv
[0301]
本发明中特别有用的异二聚体构架之一是图1所示的mab
‑
fv形式。在该实施方式中,此类形式是基于单体之一的c
‑
端接合scfv,由此形成第三抗原结合结构域,其中两个单体的fab部分结合tta而“额外”scfv结构域结合 cd3。因此,第一单体包含第一重链(包含可变重链结构域和恒定结构域),c
‑ꢀ
端共价接合的scfv包含scfv可变轻链结构域,scfv接头和scfv可变重链结构域。该实施方式还采用包含可变轻链结构域和恒定轻链结构域的共同轻链,与重链缔合形成结合tta的两个相同fab。如同本发明许多实施方式,这些构建体根据需要包含偏向变体、pi变体、消除变体、其他fc变体等,如本文所述。
[0302]
本发明提供其中抗
‑
cd3 scfv序列如图2至图7和图68中所示的mab
‑
fv 形式。
[0303]
本发明提供其中抗
‑
cd38序列如图8
‑
10中所示的mab
‑
fv形式。
[0304]
本发明提供具有cd20抗原结合结构域的mab
‑
fv形式,其中抗
‑
cd20序列如图所示。
[0305]
本发明提供具有cd19抗原结合结构域的mab
‑
fv形式,其中抗
‑
cd19序列如图所示。
[0306]
本发明提供具有cd123抗原结合结构域的mab
‑
fv形式,其中抗
‑
cd123 序列如图所示。
[0307]
本发明提供包含图31所示的消除变体的mab
‑
fv形式。
[0308]
本发明提供包含图29和34所示的偏向变体的mab
‑
fv形式。
[0309]
中心scfv
[0310]
本发明中特别有用的异二聚体构架之一是图1所示的中心
‑
scfv形式。该形式采用插入scfv结构域形成第三抗原结合结构域,其中两个单体的fab部分结合tta而“额外”scfv结构域结合cd3。在单体之一的fc结构域和ch1
‑
fv 区之间插入scfv结构域,由此提供第三抗原结合结构域。
[0311]
在该实施方式中,单体之一包括第一重链,第一重链包含第一可变重链结构域、ch1结构域和fc结构域,还包括包含scfv可变轻链结构域、scfv接头和scfv可变重链结构域的scfv。该scfv用结构域接头共价接合在重链恒定结构域的ch1结构域的c
‑
端和第一fc结构域的n
‑
端之间。该实施方式还采用包含可变轻链结构域和恒定轻链结构域的共同轻链,与重链缔合形成结合tta 的两个相同fab。如同本发明许多实施方式,这些构建体根据需要
包含偏向变体、pi变体、消除变体、其他fc变体等,如本文所述。
[0312]
本发明提供其中抗
‑
cd3 scfv序列如图2至图7和图68中所示的中心
‑
scfv 形式。
[0313]
本发明提供其中抗
‑
cd38序列如图8
‑
10中所示的中心
‑
scfv形式。
[0314]
本发明提供具有cd20抗原结合结构域的中心
‑
scfv形式,其中抗
‑
cd20 序列如图所示。
[0315]
本发明提供具有cd19抗原结合结构域的中心
‑
scfv形式,其中抗
‑
cd19 序列如图所示。
[0316]
本发明提供具有cd123抗原结合结构域的中心
‑
scfv形式,其中抗
‑
cd123 序列示于v中。
[0317]
本发明提供包含图31所示消除变体的中心
‑
scfv形式。
[0318]
本发明提供包含图29和34所示偏向变体的中心
‑
scfv形式。
[0319]
中心
‑
fv型
[0320]
本发明中特别有用的异二聚体构架之一是图1所示的中心
‑
fv形式。该形式采用插入的scfv结构域,由此形成第三抗原结合结构域,其中两个单体的 fab部分结合tta而“额外”scfv结构域结合cd3。scfv结构域插入在单体的ch1
‑
fv区和fc结构域之间,由此提供第三抗原结合结构域,其中各单体各含scfv的组分之一(例如,单体之一包含可变重链结构域而另一个包含可变轻链结构域)。
[0321]
在该实施方式中,单体之一包括包含第一可变重链结构域、ch1结构域和fc结构域和附加可变轻链结构域的第一重链。该附加轻链结构域用结构域接头共价接合在重链恒定结构域ch1结构域的c
‑
端和第一fc结构域的n
‑
端之间。另一个单体包括包含第一可变重链结构域、ch1结构域和fc结构域和附加可变重链结构域的第一重链。该附加轻链结构域用结构域接头共价接合在重链恒定结构域ch1结构域的c
‑
端和第一fc结构域的n
‑
端之间。
[0322]
该实施方式还采用包含可变轻链结构域和恒定轻链结构域的共同轻链,与重链缔合形成结合tta的两个相同fab。如同本发明许多实施方式,这些构建体根据需要包含偏向变体、pi变体、消除变体、其他fc变体等,如本文所述。
[0323]
本发明提供其中抗
‑
cd3 scfv序列如图2至图7和图68中所示的中心
‑
fv 形式。
[0324]
本发明提供其中抗
‑
cd38序列如图8
‑
10中所示的中心
‑
fv形式。
[0325]
本发明提供具有cd20抗原结合结构域的中心
‑
fv形式,其中抗
‑
cd20序列如图所示。
[0326]
本发明提供具有cd19抗原结合结构域的中心
‑
fv形式,其中抗
‑
cd19序列如图所示。
[0327]
本发明提供具有cd123抗原结合结构域的中心
‑
fv形式,其中抗
‑
cd123 序列如图所示。
[0328]
本发明提供包含图31所示消除变体的中心
‑
fv形式。
[0329]
本发明提供包含图29和34所示偏向变体的中心
‑
fv形式。
[0330]
单臂中心
‑
scfv
[0331]
本发明中特别有用的异二聚体构架之一是图1所示的单臂中心
‑
scfv形式。在该实施方式中,单体之一仅包含fc结构域,而另一个单体采用插入scfv结构域形成第二抗原结合结构域。在该形式中,fab部分结合tta而scfv结合 cd3,或反之。scfv结构域插入在单体
之一的ch1
‑
fv区和fc结构域之间。
[0332]
在该实施方式中,单体之一包括包含第一可变重链结构域、ch1结构域和fc结构域的第一重链,还带有包含scfv可变轻链结构域、scfv接头和scfv 可变重链结构域的scfv。该scfv用结构域接头共价接合在重链恒定结构域ch1 结构域的c
‑
端和第一fc结构域的n
‑
端之间。第二单体包括fc结构域。该实施方式还采用包含可变轻链结构域和恒定轻链结构域的轻链,与重链缔合形成 fab。如同本发明许多实施方式,这些构建体根据需要包含偏向变体、pi变体、消除变体、其他fc变体等,如本文所述。
[0333]
本发明提供其中抗
‑
cd3 scfv序列如图2至图7和图68中所示的单臂中心
ꢀ‑
scfv形式。
[0334]
本发明提供其中抗
‑
cd38序列如图8
‑
10中所示的单臂中心
‑
scfv形式。
[0335]
本发明提供具有cd20抗原结合结构域的单臂中心
‑
scfv形式,其中抗
ꢀ‑
cd20序列如图所示。
[0336]
本发明提供具有cd19抗原结合结构域的单臂中心
‑
scfv形式,其中抗
ꢀ‑
cd19序列如图所示。
[0337]
本发明提供具有cd123抗原结合结构域的单臂中心
‑
scfv形式,其中抗
ꢀ‑
cd123序列如图所示。
[0338]
本发明提供包含图31所示的消除变体的单臂中心
‑
scfv形式。
[0339]
本发明提供包含图29和34所示的偏向变体的单臂中心
‑
scfv形式。
[0340]
双scfv型
[0341]
本发明还提供如本领域所知亦如图1所示的双scfv形式。
[0342]
本发明提供其中抗
‑
cd3 scfv序列如图2至图7和图68中所示的双scfv 形式。
[0343]
本发明提供其中抗
‑
cd38序列如图8
‑
10中所示的双scfv形式。
[0344]
本发明提供具有cd20抗原结合结构域的双scfv形式,其中抗
‑
cd20序列如图所示。
[0345]
本发明提供具有cd19抗原结合结构域的双scfv形式,其中抗
‑
cd19序列如图所示。
[0346]
本发明提供具有cd123抗原结合结构域的双scfv形式,其中抗
‑
cd123 序列如图所示。
[0347]
本发明提供包含图31所示的消除变体的双scfv形式。
[0348]
本发明提供包含图29和34所示的偏向变体的双scfv形式。
[0349]
靶抗原
[0350]
本发明的双特异性抗体具有两个不同的抗原结合结构域:一个结合 cd3(通常为单价结合),另一个结合靶肿瘤抗原(本文中有时称为“tta”)。合适的靶肿瘤抗原包括,但不限于:cd20、cd38、cd123;ror1、ror2、bcma; psma;sstr2;sstr5、cd19、flt3、cd33、psca、adam 17、cea、 her2、egfr、egfr
‑
viii、cd30、folr1、gd
‑
2、ca
‑
ix、trop
‑
2、cd70、 cd38、间皮素、epha2、cd22、cd79b、gpnmb、cd56、cd138、cd52、 cd74、cd30、cd123、ron、erbb2、和egfr。
[0351]“三f”型特别适合靶向两个(或更多个)不同抗原。(如本文所述,根据抗体形式,这种靶向作用可以是单价结合和二价结合的任意组合)。因此,本文中免疫球蛋白优选共结合两个靶抗原。各单体的特异性可选自本文中的列表。采用抗
‑
cd3结合结构域的其他有用双特异性抗体形式见图1。
[0352]
本文的异二聚体抗体特别合适的应用是单价结合各靶抗原有益或至关重要的合
共靶对(co
‑
target pairs)。这类抗原可以是,例如,免疫复合后活化的免疫受体。许多免疫受体的细胞活化仅通过交联发生,通常由抗体/抗原免疫复合物实现,或通过效应细胞靶与细胞的结合。对于某些免疫受体,例如t细胞上的cd3信号转导受体,在共结合靶标结合后才活化是至关重要的,因为临床环境中的非特异性交联会引发细胞因子风暴和毒性。治疗上,通过使用本文的免疫球蛋白单价而不是多价结合这类抗原,这种活化仅在主靶标抗原的微环境中仅应交联而发生。以不同价态靶向两种不同抗原的能力是本发明创新且有用的地方。治疗上最好或必需以单价共结合的靶抗原的示例包括但不限于免疫活化受体,如cd3、fcγr、toll
‑
样受体(tlr)如tlr4和tlr9、细胞因子、趋化因子、细胞因子受体和趋化因子受体。在许多实施方式中,抗原结合位点之一结合cd3,某些实施方式中,这是含scfv的单体。
[0353]
理论上,本文的免疫球蛋白可靶向任何抗原,这包括但不限于属于以下靶抗原列表的蛋白质、亚基、结构域、基序、和/或表位,包括可溶性因子如细胞因子和膜结合因子,包括跨膜受体:17
‑
ia、4
‑
1bb、4dc、6
‑
酮
‑
pgf1a、8
‑
异
ꢀ‑
pgf2a、8
‑
氧代
‑
dg、a1腺苷受体、a33、ace、ace
‑
2、激活素、激活素a、激活素ab、激活素b、激活素c、激活素ria、激活素ria alk
‑
2、激活素 rib alk
‑
4、激活素riia、激活素riib、adam、adam10、adam12、 adam15、adam17/tace、adam8、adam9、adamts、adamts4、 adamts5、地址素(addressins)、afgf、alcam、alk、alk
‑
1、alk
‑
7、α
‑1‑ꢀ
抗胰蛋白酶、α
‑
v/β
‑
1拮抗剂、ang、ang、apaf
‑
1、ape、apj、app、april、 ar、arc、art、青蒿琥酯、抗
‑
id、aspartic、心房利钠因子、av/b3整联蛋白、axl、b2m、b7
‑
1、b7
‑
2、b7
‑
h、b
‑
淋巴细胞刺激物(blys)、bace、 bace
‑
1、bad、baff、baff
‑
r、bag
‑
1、bak、bax、bca
‑
1、bcam、bcl、 bcma、bdnf、b
‑
ecgf、bfgf、bid、bik、bim、blc、bl
‑
cam、blk、 bmp、bmp
‑
2bmp
‑
2a、bmp
‑
3成骨素、bmp
‑
4bmp
‑
2b、bmp
‑
5、bmp
‑
6vgr
‑
1、 bmp
‑
7(op
‑
1)、bmp
‑
8(bmp
‑
8a、op
‑
2)、bmpr、bmpr
‑
ia(alk
‑
3)、bmpr
‑
ib (alk
‑
6)、brk
‑
2、rpk
‑
1、bmpr
‑
ii(brk
‑
3)、bmp、b
‑
ngf、bok、铃蟾肽、骨源性神经营养因子、bpde、bpde
‑
dna、btc、补体因子3(c3)、c3a、c4、 c5、c5a、c10、ca125、cad
‑
8、降钙素、camp、癌胚抗原(cea)、癌相关抗原、组织蛋白酶a、组织蛋白酶b、组织蛋白酶c/dppi、组织蛋白酶d、组织蛋白酶e、组织蛋白酶h、组织蛋白酶l、组织蛋白酶o、组织蛋白酶s、组织蛋白酶v、组织蛋白酶x/z/p、cbl、cci、cck2、ccl、ccl1、ccl11、 ccl12、ccl13、ccl14、ccl15、ccl16、ccl17、ccl18、ccl19、ccl2、 ccl20、ccl21、ccl22、ccl23、ccl24、ccl25、ccl26、ccl27、ccl28、 ccl3、ccl4、ccl5、ccl6、ccl7、ccl8、ccl9/10、ccr、ccr1、ccr10、 ccr10、ccr2、ccr3、ccr4、ccr5、ccr6、ccr7、ccr8、ccr9、cd1、 cd2、cd3、cd3e、cd4、cd5、cd6、cd7、cd8、cd10、cd11a、cd11b、cd11c、cd13、cd14、cd15、cd16、cd18、cd19、cd20、cd21、cd22、 cd23、cd25、cd27l、cd28、cd29、cd30、cd30l、cd32、cd33(p67蛋白)、cd34、cd38、cd40、cd40l、cd44、cd45、cd46、cd49a、cd52、 cd54、cd55、cd56、cd61、cd64、cd66e、cd74、cd80(b7
‑
1)、cd89、 cd95、cd123、cd137、cd138、cd140a、cd146、cd147、cd148、cd152、 cd164、ceacam5、cftr、cgmp、cinc、肉毒梭菌毒素、产气荚膜梭菌毒素、ckb8
‑
1、clc、cmv、cmv ul、cntf、cntn
‑
1、cox、c
‑
ret、crg
‑
2、 ct
‑
1、ctack、ctgf、ctla
‑
4、cx3cl1、cx3cr1、cxcl、cxcl1、cxcl2、 cxcl3、cxcl4、cxcl5、cxcl6、cxcl7、cxcl8、cxcl9、cxcl10、 cxcl11、cxcl12、cxcl13、cxcl14、cxcl15、cxcl16、cxcr、cxcr1、 cxcr2、cxcr3、cxcr4、cxcr5、cxcr6、细胞角蛋白肿瘤相关抗原、 dan、dcc、dcr3、dc
‑
sign、衰减加速因子、des(1
‑
3)
‑
igf
‑
i(脑igf
‑
1)、 dhh、地高辛、dnam
‑
1、dna酶、dpp、dppiv/cd26、dtk、ecad、eda、 eda
‑
a1、eda
‑
a2、edar、egf、egfr(erbb
‑
1)、ema、emmprin、ena、内皮素受体、脑啡肽酶、enos、eot、嗜酸性粒细
胞趋化因子1、epcam、肝配蛋白b2/ephb4、epo、ercc、e
‑
选择蛋白、et
‑
1、因子iia、因子vii、因子viiic、因子ix、成纤维细胞活化蛋白(fap)、fas、fcr1、fen
‑
1、铁蛋白、 fgf、fgf
‑
19、fgf
‑
2、fgf3、fgf
‑
8、fgfr、fgfr
‑
3、纤维蛋白、fl、flip、 flt
‑
3、flt
‑
4、促卵泡激素、分形趋化因子、fzd1、fzd2、fzd3、fzd4、fzd5、 fzd6、fzd7、fzd8、fzd9、fzd10、g250、gas 6、gcp
‑
2、gcsf、gd2、 gd3、gdf、gdf
‑
1、gdf
‑
3(vgr
‑
2)、gdf
‑
5(bmp
‑
14、cdmp
‑
1)、gdf
‑
6 (bmp
‑
13、cdmp
‑
2)、gdf
‑
7(bmp
‑
12、cdmp
‑
3)、gdf
‑
8(肌肉抑制素)、gdf
‑
9、 gdf
‑
15(mic
‑
1)、gdnf、gdnf、gfap、gfra
‑
1、gfr
‑
α1、gfr
‑
α2、gfr
‑
α3、 gitr、胰高血糖素、glut 4、糖蛋白iib/iiia(gp iib/iiia)、gm
‑
csf、gp130、 gp72、gro、生长激素释放因子、半抗原(np
‑
cap或nip
‑
cap)、hb
‑
egf、hcc、 hcmv gb包膜糖蛋白,hcmv)gh包膜糖蛋白、hcmv ul、造血生长因子 (hgf)、hep b gp120、肝素酶、her2、her2/neu(erbb
‑
2)、her3(erbb
‑
3)、 her4(erbb
‑
4)、单纯疱疹病毒(hsv)gb糖蛋白、hsv gd糖蛋白、hgfa、高分子量黑素瘤相关抗原(hmw
‑
maa)、hiv gp120、hiv iiib gp 120v3环、hla、hla
‑
dr、hm1.24、hmfg pem、hrg、hrk、人心肌肌球蛋白、人巨细胞病毒(hcmv)、人生长激素(hgh)、hvem、i
‑
309、iap、icam、icam
‑
1、icam
‑
3、 ice、icos、ifng、ig、iga受体、ige、igf、igf结合蛋白、igf
‑
1r、igfbp、 igf
‑
i、igf
‑
ii、il、il
‑
1、il
‑
1r、il
‑
2、il
‑
2r、il
‑
4、il
‑
4r、il
‑
5、il
‑
5r、 il
‑
6、il
‑
6r、il
‑
8、il
‑
9、il
‑
10、il
‑
12、il
‑
13、il
‑
15、il
‑
18、il
‑
18r、il
‑
23、干扰素(inf)
‑
α、inf
‑
β、inf
‑
γ、抑制素、inos、胰岛素a
‑
链、胰岛素b
‑
链、胰岛素
‑
样生长因子1、整联蛋白α2、整联蛋白α3、整联蛋白α4、整联蛋白α4/β1、整联蛋白α4/β7、整联蛋白α5(αv)、整联蛋白α5/β1、整联蛋白α5/β3、整联蛋白α6、整联蛋白β1、整联蛋白β2、干扰素γ、ip
‑
10、i
‑
tac、je、激肽释放酶2、激肽释放酶5、激肽释放酶6、激肽释放酶11、激肽释放酶12、激肽释放酶14、激肽释放酶15、激肽释放酶l1、激肽释放酶l2、激肽释放酶l3、激肽释放酶l4、kc、kdr、角质形成细胞生长因子(kgf)、层粘连蛋白5、 lamp、lap、lap(tgf
‑
1)、潜伏性tgf
‑
1、潜伏性tgf
‑
βb1、lbp、ldgf、 lect2、lefty、lewis
‑
y抗原、lewis
‑
y相关抗原、lfa
‑
1、lfa
‑
3、lfo、lif、 light、脂蛋白、lix、lkn、lptn、l
‑
选择素、lt
‑
a、lt
‑
b、ltb4、ltbp
‑
1、肺表面活性剂、促黄体激素、淋巴毒素b受体、mac
‑
1、madcam、mag、 map2、marc、mcam、mcam、mck
‑
2、mcp、m
‑
csf、mdc、mer、 metalloproteases、mgdf受体、mgmt、mhc(hla
‑
dr)、mif、mig、 mip、mip
‑1‑
α、mk、mmac1、mmp、mmp
‑
1、mmp
‑
10、mmp
‑
11、mmp
‑
12、 mmp
‑
13、mmp
‑
14、mmp
‑
15、mmp
‑
2、mmp
‑
24、mmp
‑
3、mmp
‑
7、mmp
‑
8、 mmp
‑
9、mpif、mpo、msk、msp、粘蛋白(muc1)、muc18、muellerian
‑
抑钠素物质、mug、musk、naip、nap、ncad、n
‑
钙粘蛋白、nca 90、ncam、 ncam、脑啡肽酶、神经营养蛋白
‑
3,
‑
4,或
‑
6、神经秩蛋白(neurturin)、神经生长因子(ngf)、ngfr、ngf
‑
β、nnos、no、nos、npn、nrg
‑
3、nt、 ntn、ob、ogg1、opg、opn、osm、ox40l、ox40r、p150、p95、padpr、甲状旁腺激素、parc、parp、pbr、pbsf、pcad、p
‑
钙粘蛋白、pcna、 pdgf、pdgf、pdk
‑
1、pecam、pem、pf4、pge、pgf、pgi2、pgj2、pin、 pla2、胎盘碱性磷酸酶(plap)、plgf、plp、pp14、胰岛素原、松弛素原、蛋白c、ps、psa、psca、前列腺特异性膜抗原(psma)、pten、pthrp、ptk、ptn、r51、rank、rankl、rantes、rantes、松弛素a
‑
链、松弛素 b
‑
链、肾素、呼吸道合胞体病毒(rsv)f、rsv fgp、ret、类风湿因子、rlip76、 rpa2、rsk、s100、scf/kl、sdf
‑
1、serine、血清白蛋白、sfrp
‑
3、shh、 sigirr、sk
‑
1、slam、slpi、smac、smdf、smoh、sod、sparc、stat、 steap、steap
‑
ii、tace、taci、tag
‑
72(肿瘤相关糖蛋白
‑
72)、tarc、tca
‑
3、 t
‑
细胞受体(例如,t
‑
细胞受体α/β)、tdt、teck、tem1、tem5、tem7、 tem8、tert、睾丸plap
‑
样碱性磷酸酶、tfr、tgf、tgf
‑
α、tgf
‑
β、tgf
‑
β泛特异性、tgf
‑
βri(alk
‑
5)、tgf
‑
βrii、
tgf
‑
βriib、tgf
‑
βriii、tgf
‑
β1、 tgf
‑
β2、tgf
‑
β3、tgf
‑
β4、tgf
‑
β5、凝血酶、胸腺ck
‑
1、甲状腺刺激激素、 tie、timp、tiq、组织因子、tmeff2、tmpo、tmprss2、tnf、tnf
‑
α、 tnf
‑
αβ、tnf
‑
β2、tnfc、tnf
‑
ri、tnf
‑
rii、tnfrsf10a(trail r1 apo
‑
2、 dr4)、tnfrsf10b(trail r2 dr5、killer、trick
‑
2a、trick
‑
b)、 tnfrsf10c(trail r3 dcr1、lit、trid)、tnfrsf10d(trail r4 dcr2、 trundd)、tnfrsf11a(rank odf r、trance r)、tnfrsf11b(opgocif、tr1)、tnfrsf12(tweak r fn14)、tnfrsf13b(taci)、tnfrsf13c (baff r)、tnfrsf14(hvem atar、hvea、light r、tr2)、tnfrsf16 (ngfr p75ntr)、tnfrsf17(bcma)、tnfrsf18(gitr aitr)、tnfrsf19 (troy taj、trade)、tnfrsf19l(relt)、tnfrsf1a(tnf ri cd120a、 p55
‑
60)、tnfrsf1b(tnf rii cd120b、p75
‑
80)、tnfrsf26(tnfrh3)、 tnfrsf3(ltbr tnf riii、tnfc r)、tnfrsf4(ox40 act35、txgp1 r)、 tnfrsf5(cd40 p50)、tnfrsf6(fas apo
‑
1、apt1、cd95)、tnfrsf6b(dcr3m68、tr6)、tnfrsf7(cd27)、tnfrsf8(cd30)、tnfrsf9(4
‑
1bb cd137、 ila)、tnfrsf21(dr6)、tnfrsf22(dctrail r2 tnfrh2)、tnfrst23 (dctrail r1 tnfrh1)、tnfrsf25(dr3 apo
‑
3、lard、tr
‑
3、tramp、 wsl
‑
1)、tnfsf10(trail apo
‑
2配体、tl2)、tnfsf11(trance/rank配体odf、opg配体)、tnfsf12(tweak apo
‑
3配体、dr3配体)、tnfsf13 (april tall2)、tnfsf13b(baff blys、tall1、thank、tnfsf20)、 tnfsf14(light hvem配体、ltg)、tnfsf15(tl1a/vegi)、tnfsf18(gitr 配体aitr配体、tl6)、tnfsf1a(tnf
‑
a肌连蛋白、dif、tnfsf2)、tnfsf1b (tnf
‑
b lta、tnfsf1)、tnfsf3(ltb tnfc、p33)、tnfsf4(ox40配体gp34、 txgp1)、tnfsf5(cd40配体cd154、gp39、higm1、imd3、trap)、tnfsf6 (fas配体apo
‑
1配体、apt1配体)、tnfsf7(cd27配体cd70)、tnfsf8(cd30 配体cd153)、tnfsf9(4
‑
1bb配体cd137配体)、tp
‑
1、t
‑
pa、tpo、trail、 trail r、trail
‑
r1、trail
‑
r2、trance、转移受体、trf、trk、trop
‑
2、 tsg、tslp、肿瘤相关抗原ca 125、表达lewis y相关糖的肿瘤相关抗原、 tweak、txb2、ung、upar、upar
‑
1、尿激酶、vcam、vcam
‑
1、vecad、 ve
‑
钙粘蛋白、ve
‑
钙粘蛋白
‑
2、vefgr
‑
1(flt
‑
1)、vegf、vegfr、vegfr
‑
3 (flt
‑
4)、vegi、vim、病毒抗原、vla、vla
‑
1、vla
‑
4、vnr整联蛋白、血管性血友病因子、wif
‑
1、wnt1、wnt2、wnt2b/13、wnt3、wnt3a、 wnt4、wnt5a、wnt5b、wnt6、wnt7a、wnt7b、wnt8a、wnt8b、 wnt9a、wnt9a、wnt9b、wnt10a、wnt10b、wnt11、wnt16、xcl1、 xcl2、xcr1、xcr1、xedar、xiap、xpd、以及激素和生长因子的受体。
[0354]
可被本发明免疫球蛋白特异性靶向的示例性抗原包括但不限于:cd20、 cd19、her2、egfr、epcam、cd3、fcγriiia(cd16)、fcγriia(cd32a)、 fcγriib(cd32b)、fcγri(cd64)、toll
‑
样受体(tlr)如tlr4和tlr9,细胞因子如il
‑
2、il
‑
5、il
‑
13、il
‑
12、il
‑
23、和tnfα,细胞因子受体如il
‑
2r、趋化因子、趋化因子受体、生长因子如vegf和hgf等。为了形成本发明的双特异性抗体,可制造针对这些抗原任意组合的抗体;即这些抗原中的每一个可任选地、独立地被本发明双特异性抗体包括或不包括。
[0355]
双特异性抗体特别优选的组合是针对cd3的抗原结合结构域和选自结合 cd19、cd20、cd38和cd123的结构域的抗原结合结构域,其序列如图所示。
[0356]
本发明的核酸
[0357]
本发明还提供编码本发明双特异性抗体的核酸组合物。本领域技术人员可以看出,核酸组合物将取决于异二聚体蛋白质的形式和构架。因此,例如,当抗体形式需要三个氨基酸序列,如三f形式(例如,第一氨基酸单体包含fc结构域和scfv,第二氨基酸单体包含重链和轻链),可将三个核酸序列纳入一个或多个表达载体进行表达。类似地,有些形式(例
如图1中的双scfv形式)仅需要两个核酸;同样,它们可被放入一个或两个表达载体中。
[0358]
如本领域所知,编码本发明组分的核酸可如本领域所知地、根据用于生产本发明异二聚体抗体的宿主细胞纳入表达载体中。核酸一般可操作地与任意数量的调节元件(启动子,复制起点,选择性标记物,核糖体结合位点,诱导物等)相连。表达载体可以是染色体外载体或是整合载体。
[0359]
然后,本发明的核酸和/或表达载体可如本领域所熟知地转化到任意数量不同类型的宿主细胞中,包括哺乳动物、细菌、酵母、昆虫和/或真菌细胞,许多实施方式中特别有用的是哺乳动物细胞(例如cho细胞)。
[0360]
某些实施方式中,编码各单体的各个核酸和可选的编码轻链的核酸(这取决于抗体的形式)包含在单个表达载体中,通常处于不同或相同启动子控制下。本发明中特别有用的实施方式中,这两个或三个核酸分别包含在不同表达载体上。如本文所述亦如62/025,931(通过引用纳入本文)所述,可采用不同的载体比率来驱动异二聚体形成。即,出人意料地,虽然蛋白质包含1:1:2比率的第一单体:第二单体:轻链(本文许多实施方式中的异二聚体抗体包含三个多肽),但这些并非最佳效果的比率。
[0361]
本发明的异二聚体抗体通过培养包含表达载体的宿主细胞来制备,如本领域所熟知的那样。抗体生成后,进行常规抗体纯化步骤,包括离子交换色谱。如本文所述,使两种单体的pi相差至少0.5可允许通过离子交换色谱或等电聚焦或对等电点敏感的其他方法进行分离。即,包含改变各单体等电点(pi)的pi 取代使得各单体具有不同的pi并使异二聚体也具有不同pi,由此促进“三f”异二聚体的等电纯化(例如,阴离子交换柱,阳离子交换柱)。这些取代还有助于测定和监测纯化(例如,ief凝胶、cief、和分析型iex柱)后的各种污染性双scfv
‑
fc和mab同二聚体。
[0362]
治疗
[0363]
制得的本发明组合物有多种应用。cd20、cd38和cd123在许多造血恶性肿瘤和各种造血恶性肿瘤的细胞系中失调,因此,本发明异二聚体抗体可用于治疗癌症,这些癌症包括但不限于所有b细胞淋巴瘤和白血病,这包括但不限于,非霍奇金淋巴瘤(nhl),伯基特淋巴瘤(bl),多发性骨髓瘤(mm),b型慢性淋巴细胞性白血病(b
‑
cll),b型和t型急性淋巴细胞白血病(all),t细胞淋巴瘤(tcl),急性骨髓性白血病(aml),毛细胞白血病(hcl),霍奇金淋巴瘤(hl),慢性淋巴细胞白血病(cll),非霍奇金淋巴瘤和慢性骨髓性白血病 (cml)。
[0364]
因此,本发明的异二聚体组合物可用于治疗这些癌症。
[0365]
用于体内给药的抗体组合物
[0366]
按照本发明使用的抗体制剂通过如下方式制备保存:将具有所需纯度的抗体与可选的药学上可接受的运载体、赋形剂或稳定剂(remington's pharmaceutical sciences(《雷明顿药物科学》)第16版,osol,a.编,[1980])混合,制成冻干制剂或水性溶液的形式。可接受的载体、赋形剂或稳定剂在所用剂量和浓度下对接受者无毒,这包括:缓冲剂如磷酸盐、柠檬酸盐和其它有机酸缓冲剂;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(如十八烷基二甲基苄基氯化铵;氯化六烃季铵;苯扎氯铵、苄索氯铵;苯酚、丁基或苄基醇;对羟基苯甲酸烷酯,如对羟基苯甲酸甲酯或丙酯;邻苯二酚;间苯二酚;环己醇; 3
‑
戊醇;和间甲酚);低分子量(小于约10个残基)的多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷胺酰胺、天冬酰胺、组氨酸、精氨酸或赖氨
酸;单糖、二糖和其它糖,包括葡萄糖、甘露糖或糊精;螯合剂,如edta;糖,如蔗糖、甘露醇、海藻糖或山梨糖醇;形成盐的抗衡离子,如钠;金属络合物(如zn
‑
蛋白质络合物);和/或非离子型表面活性剂,如吐温(tween
tm
)、普罗流尼克(pluronicstm) 或聚乙二醇(peg)。
[0367]
根据治疗的具体适应症所需,本文制剂还可含有一种以上活性化合物,优选哪些活性互补、不会相互干扰的化合物。例如,可能需要提供具有其他特异性的抗体。或者,或在此之外,组合物可包含细胞毒剂、细胞因子、生长抑制剂和/或小分子拮抗剂。这些分子适合以目标效果有效量存在于组合中。
[0368]
活性成分还可包入微胶囊中,例如通过凝聚技术或界面聚合,例如羟甲基纤维素或明胶
‑
微胶囊和聚
‑
(甲基丙烯酸甲酯)各自的微胶囊,或包入胶体药物递送系统(例如脂质体、白蛋白微球、微乳剂、纳米颗粒和纳米胶囊)或包入乳浊液(macroemulsion)。这些技术可参见《雷明顿药物科学》第16版,osol, a.编(1980)。
[0369]
用于体内给药的制剂应该是无菌的或近乎无菌的。这可通过无菌滤膜过滤容易地实现。
[0370]
可制备缓释制剂。缓释制剂的合适例子包括抗体含于固体疏水性聚合物的半渗透基质中,其中基质为成型制品的形式,例如膜或微胶囊。缓释基质的例子包括:聚酯、水凝胶(例如,聚(2
‑
羟乙基
‑
甲基丙烯酸酯)或聚(乙烯醇)),聚丙交酯(美国专利号3,773,919),l
‑
谷氨酸和γ
‑
乙基
‑
l
‑
谷氨酸的共聚物,不可降解的乙烯
‑
乙酸乙烯酯,可降解的乳酸
‑
乙醇酸共聚物如lupron depottm(由乳酸
‑
乙醇酸共聚物和乙酸亮丙瑞林组成的可注射微球)和聚
‑
d
‑
(
‑
)
‑3‑
羟基丁酸。诸如乙烯
‑
乙酸乙烯酯和乳酸
‑
乙醇酸等聚合物释放分子的时间能够超过100天,某些水凝胶释放蛋白质的时间则较短。
[0371]
包入胶囊的抗体能在体内长期留存,它们会因接触37℃潮湿环境而变性或聚集,导致生物学活性降低、免疫原型也可能改变。可设计合理方案实现稳定化,这取决于相关的机制。例如,如果发现聚集的机制是分子间通过巯基
‑ꢀ
二硫键互变形成s
‑
s键,则稳定化可通过修饰巯基残基、用酸性溶液冻干、控制水分含量、采用合适的添加剂和开发特定聚合物基质组成来实现。
[0372]
给药模式
[0373]
根据已知方法将本发明的抗体和化疗剂给予受治者,例如通过推注或通过一段时间内连续输注等静脉内给药,通过肌内、腹膜内、脊髓内、皮下、关节内、滑膜内、鞘内、口服、局部、或吸入途径。优先静脉内或皮下抗体给药。
[0374]
治疗模式
[0375]
在本发明的方法中,治疗提供就某疾病或病症而言的积极治疗效果。“积极治疗效果”是指疾病或病症的改善和/或与疾病或病症相关症状的改善。例如,积极治疗效果将指一种或多种以下改善:(1)肿瘤细胞数量减少;(2)肿瘤细胞死亡增加;(3)肿瘤细胞生存抑制;(5)肿瘤生长抑制(即减缓到一定程度,最好是停止);(6)患者生存率升高;和(7)与疾病或病症相关的一种或多种症状的一定程度缓解。
[0376]
各种特定疾病或病症中的积极治疗效果可以通过该疾病或病症的专门标准化效果标准来评价。肿瘤疗效可根据肿瘤形态变化(即,总肿瘤负荷,肿瘤大小等)来评估,可以采用诸如磁共振成像(mri)扫描、x射线照相成像、计算机断层扫描(ct)扫描、骨骼扫描成像、内窥镜检查、和肿瘤活检取样,包括骨髓抽吸(bma)等筛查技术和循环肿瘤细胞计数。
[0377]
除了这些积极治疗效果之外,接受治疗的对象还会有疾病相关症状的改善。
[0378]
疾病的改善可以被表征为完全缓解。“完全缓解”指无临床可检疾病,之前异常的放射成像检查、(就骨髓瘤而言)骨髓和脑脊液(csf)或异常单克隆蛋白质正常。
[0379]
在根据本发明的方法处理后,这种效果可持续至少4至8周,有时6至8 周。或者,疾病改善可分类为部分缓解。“部分缓解”是指所有可测肿瘤负荷 (即对象中的恶性细胞数目、或测得的肿瘤块体积或异常单克隆蛋白质的量)降低至少约50%,没有新的病灶,持续4至8周或6至8周。
[0380]
本发明的治疗包括所用药物的“治疗有效量”。“治疗有效量”指按照一定剂量和必要时程能够实现所需治疗效果的量。
[0381]
治疗有效量会根据个体的疾病状态、年龄、性别和体重等因素以及药物在个体中引起所需效果的能力而不同。治疗有效量也是抗体或抗体部分的治疗有益效果胜过毒性或有害效果的量。
[0382]
肿瘤治疗的“治疗有效量”还可以根据其稳定疾病进展的能力来衡量。在动物模型系统中评价化合物抑制癌症的能力,该动物模型可预测在人肿瘤中的功效。
[0383]
或者,组合物的这种性质可通过检测化合物抑制细胞生长或诱导凋亡的能力来评价,如可采用本领域技术人员已知的体外试验。治疗有效量的治疗性化合物可减小肿瘤尺寸,或者缓解对象的症状。本领域一般技术人员能够基于如对象体格、对象症状严重性和特定组合物或所选给药途径等因素来确定治疗有效量。
[0384]
给药方案经调节能提供最优的所需效果(例如治疗效果)。例如,可以是一次推注、按时间分次给药或根据治疗情况的紧急性成比例地降低或增加给药。肠胃外组合物可以配制成单位剂型以便于给药和剂量均匀。本文中单位剂型指作为单个剂量用于待治疗对象的物理上离散的单位,每个单位包含预定量的活性化合物与所需药物运载体,该预定量经测算能够产生所需治疗效果。
[0385]
本发明中单位剂型的规格取决于或直接依赖于(a)活性化合物的独特特性和待实现的具体治疗效果,以及(b)本领域对于这种活性化合物应对个体敏感性的固有限制。
[0386]
本发明双特异性抗体的有效剂量和给药方案取决于待治疗的疾病或病症,可由本领域技术人员来确定。
[0387]
本发明中所用双特异性抗体治疗有效量的示例性而非限制性范围是约0.1
‑
100mg/kg,如约0.1
‑
50mg/kg,例如约0.1
‑
20mg/kg,如约0.1
‑
10mg/kg,例如约0.5、约0.3、约1或约3mg/kg。另一实施方式中,抗体的给药剂量是 1mg/kg或更高,例如1至20mg/kg,例如5至20mg/kg,例如8mg/kg。
[0388]
本领域普通医疗专业人员能够容易地确定和给出所需药物组合物有效量的处方。例如,对于药物组合物中的某药物,医师或兽医可以从低于期望治效所需的水平开始,然后逐渐增加剂量直到达到期望的效果。
[0389]
实施方式之一中,双特异性抗体以10至500mg/kg(例如200至400mg/kg) 的周剂量输注给予。可以重复这样的给药,例如,1至8次,如3至5次。给药可以是2至24小时(例如2至12小时)的持续输注。
[0390]
实施方式之一中,如果需要降低副作用(包括毒性),则长时间例如超过24 小时缓慢连续输注给予双特异性抗体。
[0391]
实施方式之一中,双特异性抗体以250mg至2000mg(例如300mg,500mg, 700mg,1000mg,1500mg或2000mg)的周剂量给药,多达8次,如4到6次。给药可以是2至24小时(例如2至12小时)的连续输注。这种方案可以根据需要重复一次或多次,例如在6个月或12个月后重复。本发明化合物的剂量可通测量给药后血液中化合物的量来确定或调整,所述测量可以是例如采取生物样品和采用靶向双特异性抗体抗原结合区的抗独特型抗体。
[0392]
另一实施方式中,双特异性抗体每周一次,2至12周,例如3至10周,例如4至8周。
[0393]
实施方式之一中,双特异性抗体的给药为维持治疗,例如每周一次,持续 6个月或更长时间。
[0394]
实施方式之一中,双特异性抗体的给药方案包括一次双特异性抗体输注,然后输注与放射性同位素偶联的双特异性抗体。可以重复该方案,例如在7至 9天后。
[0395]
作为非限制性举例,根据本发明的治疗可以是按照约0.1
‑
100mg/kg的日剂量提供抗体,例如,每天0.5、0.9、1.0、1.1、1.5、2、3、4、5、6、7、8、 9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、 26、27、28、29、30、40、45、50、60、70、80、90或100mg/kg,在治疗开始后的第1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、 18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、 35、36、37、38、39、或40天中的至少一天,或者第1、2、3、4、5、6、7、 8、9、10、11、12、13、14、15、16、17、18、19或20周中的至少一周,或其任意组合,使用单剂次或间隔24、12、8、6、4或2小时的分剂次,或其任意组合。
[0396]
某些实施方式中,双特异性抗体分子与一种或多种其他治疗剂例如化疗剂组合使用。dna损伤化疗剂的非限制性举例包括拓扑异构酶i抑制剂(例如伊立替康,拓扑替康,喜树碱及其类似物或代谢物,以及多柔比星);拓扑异构酶ii抑制剂(如依托泊苷,替尼泊苷和柔红霉素);烷化剂(例如美法仑,苯丁酸氮芥,白消安,噻替派,异环磷酰胺,卡莫司汀,洛莫司汀,乌司他丁,链脲佐菌素,去甲基吡嗪,甲氨蝶呤,丝裂霉素c和环磷酰胺);dna嵌入剂(例如顺铂,奥沙利铂和卡铂);dna嵌入剂和自由基发生剂如博来霉素;和核苷模拟物(例如5
‑
氟尿嘧啶,卡培他滨,吉西他滨,氟达拉滨,阿糖胞苷,巯嘌呤,硫鸟嘌呤,喷司他丁和羟基脲)。
[0397]
破坏细胞复制的化疗剂包括:紫杉醇,多西他赛,相关类似物;长春新碱,长春花碱,相关类似物;沙利度胺,来那度胺,相关类似物(例如cc
‑
5013和 cc
‑
4047);蛋白酪氨酸激酶抑制剂(例如甲磺酸伊马替尼和吉非替尼);蛋白酶体抑制剂(例如硼替佐米);nf
‑
κb抑制剂,包括iκb激酶抑制剂;结合癌症中过表达的蛋白质并由此下调细胞复制的抗体(例如曲妥单抗,利妥昔单抗,西妥昔单抗和贝伐单抗);和已知在癌症中上调、过表达或活化的蛋白质或酶的其它抑制剂,这些蛋白质或酶的抑制下调细胞复制。
[0398]
某些实施方式中,本发明的抗体可以在(硼替佐米)治疗之前、同时或之后使用。
[0399]
所有引用的参考文献其全部内容均明确通过引用纳入本文。
[0400]
以上虽然出于说明目的描述了本发明若干具体实施方式,但本领域技术人员可以看出,可以对细节作出许多改变,这些都属于权利要求所述本发明范围之内。
实施例
[0401]
下面通过实施例来说明本发明。这些实施例无意于将本发明限制于任何特定应用
或原理。本发明中所述的所有恒定区位置其编号都是根据kabat的eu 索引(kabat等,1991,《免疫学感兴趣的蛋白质的序列》(sequences of proteinsof immunological interest),第5版,公共卫生署,国立卫生研究院,贝塞斯达,通过引用全文纳入本文)。抗体领域的技术人员知道,这一惯例对免疫球蛋白序列的特定区进行非顺序性编号,从而为免疫球蛋白家族中保守位置给出了标准化参照。因此,由eu索引定义的任何给定免疫球蛋白的位置不必然对应于其顺序性序列。
[0402]
美国公开2015/0307629,2014/0288275和wo2014/145806记载了通用技术和特定技术,这些文献全部通过引用纳入本文,并且其中的技术。
[0403]
实施例
[0404]
实施例1:变换形式
[0405]
双特异性抗体的产生
[0406]
抗
‑
cd38
×
抗
‑
cd3双特异性抗体的示意图见图1。各种变换形式的抗
ꢀ‑
cd38
×
抗
‑
cd3双特异性抗体的氨基酸序列列于图39至图43中。双特异性抗体表达所需三条链的编码dna通过基因合成产生(华盛顿州博塞尔的蓝鹭生物技术公司(blue heron biotechnology)),使用标准分子生物学技术亚克隆到表达载体ptt5中。使用定点诱变(quikchange,stratagene,德克萨斯州锡达溪)或其他基因合成和亚克隆引入取代。将dna转染到hek293e细胞中进行表达,使用蛋白a亲和层析(ge医疗公司)和阳离子交换层析从上清液中纯化所得蛋白质。蛋白a亲和纯化的得率如图35所示。阳离子交换层析纯化采用hitrap sp hp柱(ge医疗公司),50mm mes,ph 6.0洗涤/平衡缓冲液和50mm mes 洗脱缓冲液,ph 6.0 1m nacl线性梯度(见图36的色谱图)。
[0407]
重定向t细胞细胞毒性
[0408]
体外鉴定抗
‑
cd38
×
抗
‑
cd3双特异性抗体对cd38
rpmi8266骨髓瘤细胞系的重定向t细胞细胞毒性(rtcc)。将10k rpmi8266细胞与500k人pbmc 一起孵育24小时。由ldh荧光测定rtcc(见图37)。
[0409]
实施例2
[0410]
重定向t细胞细胞毒性
[0411]
体外鉴定抗cd38
×
抗cd3 fab
‑
scfv
‑
fc双特异性抗体对cd38 rpmi8266骨髓瘤细胞系的重定向t细胞毒性(rtcc)。将40k rpmi8266细胞与400k人pbmc一起孵育96小时。通过流式细胞术测量rtcc,如图44所示。还通过流式细胞术鉴定cd4 和cd8 t细胞的cd69、ki
‑
67和pi
‑
9表达,如图45所示。
[0412]
抗
‑
肿瘤活性的小鼠模型
[0413]
在第
‑
23日,每组五只共四组nodscidγ(nsg)小鼠每只尾静脉注射植入5
ꢀ×
106个rpmi8226trs肿瘤细胞(多发性骨髓瘤,表达荧光素酶)。在第0天,小鼠腹膜内植入10
×
106个人pbmc。在第0天的pbmc植入后,每周(第0、 7天)通过腹膜内注射给予试验品,剂量水平如图4所示。图46概括了实验设计。通过使用体内成像系统测量每只小鼠的总通量来监测肿瘤生长。 xmab13551和xmab15426都显示出显著的抗肿瘤作用(见图47和图48)。
[0414]
猕猴实验
[0415]
给予猕猴单剂量的抗
‑
cd38
×
抗
‑
cd3双特异性抗体。实验还包括抗
‑
rsv
ꢀ×
抗
‑
cd3双特异性抗体对照。剂量水平为:20μg/kg xmab13551(n=2),0.5 mg/kg xmab15426(n=
3),3mg/kg xmab14702(n=3)或3mg/kgxmab13245(抗
‑
rsv
×
抗
‑
cd3对照,n=3)(3次独立实验)。抗
‑
cd38
×
抗
‑
cd3 双特异性抗体迅速清除外周血中的cd38 细胞(见图49)。据cd69表达测定,抗
‑
cd38
×
抗
‑
cd3双特异性抗体导致t细胞活化(见图50)。还测量了血清il
‑
6 水平(见图51)。发现与xmab13551相比,xmab15426的cd38 细胞清除持续时间延长,t细胞活化和il
‑
6生成水平较低。
[0416]
以0.5mg/kg和3mg/kg的单剂量测试xmab15426和xmab14702。两种抗体在这样的高剂量都耐受良好,与此一致的是受治猴的血清il6水平为中等。此外,与以2、5或20μg/kg给药的原高亲和性xmab13551相比,0.5mg/kg 中等cd3亲和性的xmab15426清除cd38 细胞更有效。与此前的最高剂量 xmab13551相比,xmab15426的清除作用持续更久(xmab15426为7天, xmab13551为2天)。值得注意的是,尽管xmab15426的靶细胞清除效力更大,但t细胞活化(cd69,cd25和pd1诱导)低得多,即便是在以比20μg/kgxmab13551组高25倍剂量给药的xmab15426处理的猴子中。cd3亲和性非常低的xmab14702对cd38 细胞和t细胞活化几乎没有效果。
[0417]
这些结果表明,通过减弱cd3亲和性来调节t细胞活化是改善t细胞结合性双特异性抗体治疗窗口的可行方法。这种策略改善耐受性并允许以高剂量克服靶标(如cd38)的抗原沉默清除现象(antigen sink clearance),由此能够扩展适合于靶向t细胞免疫治疗的抗原组。我们已经证明,通过降低对cd3的亲和性,xmab15426有效清除cd38 细胞,同时最大程度降低了其高亲和性对应物xmab13551在相当剂量可见的crs效应。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。