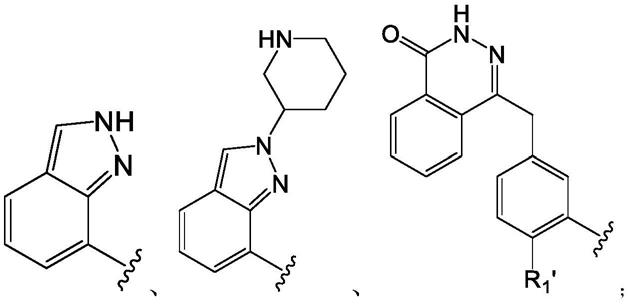
1.本发明涉及生物医药领域,具体涉及一类羟肟酸衍生物及其应用。
背景技术:
2.聚腺苷二磷酸核糖聚合酶(parp)是重要的dna修复酶,存在于真核细胞内具有催化多聚腺苷二磷酸(多聚adp)核糖基化的蛋白酶。它能够识别dna单链断点,启动修复。该修复作用于许多蛋白,涉及到染色体的稳定、dna损伤修复、基因转录、细胞的增长、死亡和凋亡等方面,在生理病理方面与炎症、肿瘤、衰老等疾病密切相关。
3.parp抑制剂能够抑制parp活性,起到增强放疗和dna损伤类化疗药物的效果,单独使用也能选择性杀伤dna修复缺陷的肿瘤细胞。parp抑制剂应用于肿瘤治疗主要基于两个方面的机制:第一,parp抑制剂能够抑制dna单链损伤的修复过程,但这种dna单链损伤可在dna复制形成复制叉过程中转变成双链损伤(dsb),而这种dsb仍可通过同源重组(hr)途径修复完成。如果肿瘤细胞存在同源重组修复缺陷(包括brca1/2突变),使得dsb损伤无法修复,则会导致parp抑制剂和同源重组修复缺陷对肿瘤细胞合成致死的作用。parp抑制剂单药对于brca1和brca2突变的乳腺癌及卵巢癌细胞有明显抑制作用。第二,brca1/2只是hr修复的一部分,其他蛋白如emsy和pten对于hr途径同样重要,如果hr修复途径中这些基因突变或表达沉默,parp抑制剂即可能通过合成致死作用而产生单药抗肿瘤活性。
4.组蛋白去乙酰化酶(histone deacetylase,hdac)是一类蛋白酶,对染色体的结构修饰和基因表达调控发挥着重要的作用。一般情况下,组蛋白的乙酰化有利于dna与组蛋白八聚体的解离,核小体结构松弛,从而使各种转录因子和协同转录因子能与dna结合位点特异性结合,激活基因的转录。在细胞核内,组蛋白乙酰化与组蛋白去乙酰化过程处于动态平衡,并由组蛋白乙酰化转移酶(histone acetyltransferase,hat)和组蛋白去乙酰化酶(histone deacetylase,hdac)共同调控。hat将乙酰辅酶a的乙酰基转移到组蛋白氨基末端特定的赖氨酸残基上,hdac使组蛋白去乙酰化,与带负电荷的dna紧密结合,染色质致密卷曲,基因的转录受到抑制。
5.在癌细胞中,hdac的过度表达导致组蛋白与dna结合力增加使染色体发生异常变构。抑制hdac的活性能有效的抑制癌细胞增殖,诱导细胞周期停滞和促进细胞凋亡。此外,hdac抑制剂可增加dna损伤,干扰双链损伤修复(dsb)识别,抑制dna修复。研究表明,hdac与同源重组修复密切相关,抑制hdac的活性将影响一系列蛋白的功能,包括rad51及其类似体、rad52、rad54、brca1、brca2.mrn以及启动dna修复反应的损伤检测分子atm、atr等。
6.timothy ay等人指出(yap t a等,ca cancer j clin.2011;61(1):31
‑
49.)parp不仅与brca缺陷存在协同致死作用,与同源重组缺陷相关的基因也可能存在相互作用,包括atm.rad51.chk等。已有文献报道parp抑制剂和hdac抑制剂联合使用存在协同增效作用,可以促进dna损伤累计,同时降低肿瘤细胞中同源重组途径的响应,从而促进多种肿瘤细胞死亡,对同源重组修复途径没有缺失的肿瘤细胞也有良好的杀伤效果。但是联合用药存在药代动力学复杂、可能发生药物相互作用、引发更多毒副作用的缺点。而具有多靶点抑制活
性的单个小分子有希望避免这些问题。因此,研究一种具有parp/hdac双靶点抑制活性的小分子化合物,具有重要意义。
技术实现要素:
7.为了解决上述问题,本发明提供了一类羟肟酸衍生物及其应用,其技术方案如下:
8.本发明提供了式i所示的化合物、或其盐、或其立体异构体、或其溶剂合物、或其水合物、或其前药:
[0009][0010]
其中,
[0011]
x1选自无、o、s、nr2或cr3r4;
[0012]
x2选自无、o、s、nr2或cr3r4;
[0013]
z1选自无、o、s、nr2或cr3r4;
[0014]
z2选自无、o、s、nr2或cr3r4;
[0015]
y1、y2分别独立选自n、cr5;
[0016]
r2、r3、r4、r5分别独立选自氢、c1~c8烷基;
[0017]
a环选自6~10元芳基、5~10元杂芳基;
[0018]
r1为a环上的取代基,分别独立选自取代或未取代的c1~c8烷基、c1~c8烷氧基、卤素、取代或未取代的3~10元环烷基、取代或未取代的3~10元饱和杂环基、取代或未取代的3~10元不饱和杂环基;
[0019]
所述烷基的取代基选自取代或未取代的5~10元杂芳基;
[0020]
所述环烷基、杂环基的取代基选自c1~c8烷基、c1~c8烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0021]
所述杂芳基的取代基选自c1~c8烷基、c1~c8烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0022]
n表示a环上取代基r1的个数,选自0~5的整数,当n为0时表示a环上没有取代基。
[0023]
进一步地,
[0024]
x1选自无、o或nr2;
[0025]
x2选自无或cr3r4;
[0026]
z1选自无或cr3r4;
[0027]
z2选自无、o或nr2;
[0028]
y1、y2分别独立选自n、cr5;
[0029]
r2、r3、r4、r5分别独立选自氢、c1~c4烷基;
[0030]
a环选自6~10元芳基、5~10元杂芳基;所述杂芳基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0031]
r1为a环上的取代基,分别独立选自取代或未取代的c1~c4烷基、c1~c4烷氧基、卤素、取代或未取代的3~6元环烷基、取代或未取代的3~6元饱和杂环基;所述杂环基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0032]
所述烷基的取代基选自取代或未取代的5~10元杂芳基;所述杂芳基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0033]
所述环烷基、杂环基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0034]
所述杂芳基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0035]
n表示a环上取代基r1的个数,选自0、1、2或3的整数,当n为0时表示a环上没有取代基。
[0036]
进一步地,
[0037]
x1选自无、o或nr2;
[0038]
x2选自无或cr3r4;
[0039]
z1选自无或cr3r4;
[0040]
z2选自无、o或nr2;
[0041]
且x2和z1不能同时为cr3r4或同时为无;
[0042]
y1、y2分别独立选自n、cr5;
[0043]
且y1和y2不能同时选自n,但可以同时选自cr5;
[0044]
r2、r3、r4、r5分别独立选自氢、c1~c4烷基;
[0045]
优选地,
[0046]
x1和x2同时为无或同时不为无;
[0047]
z1和z2同时为无或同时不为无;
[0048]
y1和y2不相同。
[0049]
进一步地,
[0050]
a环选自苯基、萘基、吲唑基、吲哚基、噻吩基、呋喃基、吡咯基、吡啶基、吡嗪基、哒嗪基、三嗪基;
[0051]
r1为a环上的取代基,分别独立选自取代或未取代的c1~c4烷基、c1~c4烷氧基、卤素、取代或未取代的3~6元环烷基、取代或未取代的3~6元饱和杂环基;所述杂环基中杂原子为n,杂原子个数为1、2或3个;
[0052]
所述烷基的取代基选自取代或未取代的吲唑基、取代或未取代的吲哚基、取代或未取代的噻吩基、取代或未取代的呋喃基、取代或未取代的吡咯基、取代或未取代的吡啶基、取代或未取代的吡嗪基、取代或未取代的哒嗪基、取代或未取代的三嗪基、取代或未取代的二氢酞嗪基;
[0053]
所述环烷基、杂环基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0054]
所述吲唑基、吲哚基、噻吩基、呋喃基、吡咯基、吡啶基、吡嗪基、哒嗪基、三嗪基、二氢酞嗪基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0055]
n表示a环上取代基r1的个数,选自0、1、2或3的整数,当n为0时表示a环上没有取代基;
[0056]
优选地,
[0057]
a环选自
[0058]
r1’
选自卤素。
[0059]
进一步地,所述化合物如式ii所示:
[0060][0061]
其中,
[0062]
x1选自o或nr2;
[0063]
x2选自cr3r4;
[0064]
y1、y2分别独立选自n、cr5;且y1和y2不能同时选自n,但可以同时选自cr5;
[0065]
r2、r3、r4、r5分别独立选自氢、c1~c4烷基;
[0066]
a环选自6~10元芳基、5~10元杂芳基;所述杂芳基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0067]
r1为a环上的取代基,分别独立选自取代或未取代的c1~c4烷基、c1~c4烷氧基、卤素、取代或未取代的3~6元环烷基、取代或未取代的3~6元饱和杂环基;所述杂环基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0068]
所述烷基的取代基选自取代或未取代的5~10元杂芳基;所述杂芳基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0069]
所述环烷基、杂环基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0070]
所述杂芳基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0071]
n表示a环上取代基r1的个数,选自0、1、2或3的整数,当n为0时表示a环上没有取代基;
[0072]
优选地,
[0073]
a环选自苯基、萘基、吲唑基、吲哚基、噻吩基、呋喃基、吡咯基、吡啶基、吡嗪基、哒嗪基、三嗪基;
[0074]
r1为a环上的取代基,分别独立选自取代或未取代的c1~c4烷基、c1~c4烷氧基、卤素、取代或未取代的3~6元环烷基、取代或未取代的3~6元饱和杂环基;所述杂环基中杂原子为n,杂原子个数为1、2或3个;
[0075]
所述烷基的取代基选自取代或未取代的吲唑基、取代或未取代的吲哚基、取代或未取代的噻吩基、取代或未取代的呋喃基、取代或未取代的吡咯基、取代或未取代的吡啶基、取代或未取代的吡嗪基、取代或未取代的哒嗪基、取代或未取代的三嗪基、取代或未取代的二氢酞嗪基;
[0076]
所述环烷基、杂环基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0077]
所述吲唑基、吲哚基、噻吩基、呋喃基、吡咯基、吡啶基、吡嗪基、哒嗪基、三嗪基、二氢酞嗪基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0078]
n表示a环上取代基r1的个数,选自0、1、2或3的整数,当n为0时表示a环上没有取代基;
[0079]
更优选地,
[0080]
a环选自
[0081]
r1’
选自卤素。
[0082]
进一步地,所述化合物如式iii所示:
[0083][0084]
其中,
[0085]
x1选自o或nr2;
[0086]
y1、y2分别独立选自n、cr5;且y1和y2不能同时选自n,但可以同时选自cr5;
[0087]
r2、r5分别独立选自氢、c1~c4烷基;
[0088]
a环选自6~10元芳基、5~10元杂芳基;所述杂芳基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0089]
r1为a环上的取代基,分别独立选自取代或未取代的c1~c4烷基、c1~c4烷氧基、卤素、取代或未取代的3~6元环烷基、取代或未取代的3~6元饱和杂环基;所述杂环基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0090]
所述烷基的取代基选自取代或未取代的5~10元杂芳基;所述杂芳基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0091]
所述环烷基、杂环基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0092]
所述杂芳基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0093]
n表示a环上取代基r1的个数,选自0、1、2或3的整数,当n为0时表示a环上没有取代基;
[0094]
优选地,
[0095]
a环选自苯基、萘基、吲唑基、吲哚基、噻吩基、呋喃基、吡咯基、吡啶基、吡嗪基、哒嗪基、三嗪基;
[0096]
r1为a环上的取代基,分别独立选自取代或未取代的c1~c4烷基、c1~c4烷氧基、卤素、取代或未取代的3~6元环烷基、取代或未取代的3~6元饱和杂环基;所述杂环基中杂原子为n,杂原子个数为1、2或3个;
[0097]
所述烷基的取代基选自取代或未取代的吲唑基、取代或未取代的吲哚基、取代或未取代的噻吩基、取代或未取代的呋喃基、取代或未取代的吡咯基、取代或未取代的吡啶基、取代或未取代的吡嗪基、取代或未取代的哒嗪基、取代或未取代的三嗪基、取代或未取代的二氢酞嗪基;
[0098]
所述环烷基、杂环基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0099]
所述吲唑基、吲哚基、噻吩基、呋喃基、吡咯基、吡啶基、吡嗪基、哒嗪基、三嗪基、二氢酞嗪基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者
同一个碳原子上的两个取代基形成双键连接o;
[0100]
n表示a环上取代基r1的个数,选自0、1、2或3的整数,当n为0时表示a环上没有取代基;
[0101]
更优选地,
[0102]
a环选自
[0103]
r1’
选自卤素。
[0104]
进一步地,所述化合物如式iv所示:
[0105][0106]
其中,
[0107]
x1选自o或nr2;
[0108]
r2选自氢、c1~c4烷基;
[0109]
a环选自6~10元芳基、5~10元杂芳基;所述杂芳基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0110]
r1为a环上的取代基,分别独立选自取代或未取代的c1~c4烷基、c1~c4烷氧基、卤素、取代或未取代的3~6元环烷基、取代或未取代的3~6元饱和杂环基;所述杂环基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0111]
所述烷基的取代基选自取代或未取代的5~10元杂芳基;所述杂芳基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0112]
所述环烷基、杂环基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0113]
所述杂芳基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0114]
n表示a环上取代基r1的个数,选自0、1、2或3的整数,当n为0时表示a环上没有取代基;
[0115]
优选地,
[0116]
a环选自苯基、萘基、吲唑基、吲哚基、噻吩基、呋喃基、吡咯基、吡啶基、吡嗪基、哒嗪基、三嗪基;
[0117]
r1为a环上的取代基,分别独立选自取代或未取代的c1~c4烷基、c1~c4烷氧基、卤素、取代或未取代的3~6元环烷基、取代或未取代的3~6元饱和杂环基;所述杂环基中杂原子为n,杂原子个数为1、2或3个;
[0118]
所述烷基的取代基选自取代或未取代的吲唑基、取代或未取代的吲哚基、取代或未取代的噻吩基、取代或未取代的呋喃基、取代或未取代的吡咯基、取代或未取代的吡啶基、取代或未取代的吡嗪基、取代或未取代的哒嗪基、取代或未取代的三嗪基、取代或未取代的二氢酞嗪基;
[0119]
所述环烷基、杂环基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0120]
所述吲唑基、吲哚基、噻吩基、呋喃基、吡咯基、吡啶基、吡嗪基、哒嗪基、三嗪基、二氢酞嗪基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0121]
n表示a环上取代基r1的个数,选自0、1、2或3的整数,当n为0时表示a环上没有取代基;
[0122]
更优选地,
[0123]
a环选自
[0124]
r1’
选自卤素。
[0125]
进一步地,所述化合物如式v所示:
[0126][0127]
其中,
[0128]
z1选自cr3r4;
[0129]
z2选自o或nr2;
[0130]
y1、y2分别独立选自n、cr5;且y1和y2不能同时选自n,但可以同时选自cr5;
[0131]
r2、r3、r4、r5分别独立选自氢、c1~c4烷基;
[0132]
a环选自6~10元芳基、5~10元杂芳基;所述杂芳基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0133]
r1为a环上的取代基,分别独立选自取代或未取代的c1~c4烷基、c1~c4烷氧基、卤素、取代或未取代的3~6元环烷基、取代或未取代的3~6元饱和杂环基;所述杂环基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0134]
所述烷基的取代基选自取代或未取代的5~10元杂芳基;所述杂芳基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0135]
所述环烷基、杂环基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0136]
所述杂芳基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0137]
n表示a环上取代基r1的个数,选自0、1、2或3的整数,当n为0时表示a环上没有取代基;
[0138]
优选地,
[0139]
a环选自苯基、萘基、吲唑基、吲哚基、噻吩基、呋喃基、吡咯基、吡啶基、吡嗪基、哒嗪基、三嗪基;
[0140]
r1为a环上的取代基,分别独立选自取代或未取代的c1~c4烷基、c1~c4烷氧基、卤素、取代或未取代的3~6元环烷基、取代或未取代的3~6元饱和杂环基;所述杂环基中杂原子为n,杂原子个数为1、2或3个;
[0141]
所述烷基的取代基选自取代或未取代的吲唑基、取代或未取代的吲哚基、取代或未取代的噻吩基、取代或未取代的呋喃基、取代或未取代的吡咯基、取代或未取代的吡啶基、取代或未取代的吡嗪基、取代或未取代的哒嗪基、取代或未取代的三嗪基、取代或未取代的二氢酞嗪基;
[0142]
所述环烷基、杂环基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0143]
所述吲唑基、吲哚基、噻吩基、呋喃基、吡咯基、吡啶基、吡嗪基、哒嗪基、三嗪基、二氢酞嗪基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0144]
n表示a环上取代基r1的个数,选自0、1、2或3的整数,当n为0时表示a环上没有取代基;
[0145]
更优选地,
[0146]
a环选自
[0147]
r1’
选自卤素。
[0148]
进一步地,所述化合物如式vi所示:
[0149][0150]
其中,
[0151]
z2选自o或nr2;
[0152]
y1、y2分别独立选自n、cr5;且y1和y2不能同时选自n,但可以同时选自cr5;
[0153]
r2、r5分别独立选自氢、c1~c4烷基;
[0154]
a环选自6~10元芳基、5~10元杂芳基;所述杂芳基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0155]
r1为a环上的取代基,分别独立选自取代或未取代的c1~c4烷基、c1~c4烷氧基、卤素、取代或未取代的3~6元环烷基、取代或未取代的3~6元饱和杂环基;所述杂环基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0156]
所述烷基的取代基选自取代或未取代的5~10元杂芳基;所述杂芳基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0157]
所述环烷基、杂环基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0158]
所述杂芳基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0159]
n表示a环上取代基r1的个数,选自0、1、2或3的整数,当n为0时表示a环上没有取代基;
[0160]
优选地,
[0161]
a环选自苯基、萘基、吲唑基、吲哚基、噻吩基、呋喃基、吡咯基、吡啶基、吡嗪基、哒嗪基、三嗪基;
[0162]
r1为a环上的取代基,分别独立选自取代或未取代的c1~c4烷基、c1~c4烷氧基、卤素、取代或未取代的3~6元环烷基、取代或未取代的3~6元饱和杂环基;所述杂环基中杂原子为n,杂原子个数为1、2或3个;
[0163]
所述烷基的取代基选自取代或未取代的吲唑基、取代或未取代的吲哚基、取代或未取代的噻吩基、取代或未取代的呋喃基、取代或未取代的吡咯基、取代或未取代的吡啶基、取代或未取代的吡嗪基、取代或未取代的哒嗪基、取代或未取代的三嗪基、取代或未取代的二氢酞嗪基;
[0164]
所述环烷基、杂环基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0165]
所述吲唑基、吲哚基、噻吩基、呋喃基、吡咯基、吡啶基、吡嗪基、哒嗪基、三嗪基、二氢酞嗪基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0166]
n表示a环上取代基r1的个数,选自0、1、2或3的整数,当n为0时表示a环上没有取代基;
[0167]
更优选地,
[0168]
a环选自
[0169]
r1’
选自卤素。
[0170]
进一步地,所述化合物如式vii所示:
[0171][0172]
其中,
[0173]
z2选自o或nr2;
[0174]
r2选自氢、c1~c4烷基;
[0175]
a环选自6~10元芳基、5~10元杂芳基;所述杂芳基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0176]
r1为a环上的取代基,分别独立选自取代或未取代的c1~c4烷基、c1~c4烷氧基、卤
素、取代或未取代的3~6元环烷基、取代或未取代的3~6元饱和杂环基;所述杂环基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0177]
所述烷基的取代基选自取代或未取代的5~10元杂芳基;所述杂芳基中杂原子为n、o或s,杂原子个数为1、2或3个;
[0178]
所述环烷基、杂环基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0179]
所述杂芳基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0180]
n表示a环上取代基r1的个数,选自0、1、2或3的整数,当n为0时表示a环上没有取代基;
[0181]
优选地,
[0182]
a环选自苯基、萘基、吲唑基、吲哚基、噻吩基、呋喃基、吡咯基、吡啶基、吡嗪基、哒嗪基、三嗪基;
[0183]
r1为a环上的取代基,分别独立选自取代或未取代的c1~c4烷基、c1~c4烷氧基、卤素、取代或未取代的3~6元环烷基、取代或未取代的3~6元饱和杂环基;所述杂环基中杂原子为n,杂原子个数为1、2或3个;
[0184]
所述烷基的取代基选自取代或未取代的吲唑基、取代或未取代的吲哚基、取代或未取代的噻吩基、取代或未取代的呋喃基、取代或未取代的吡咯基、取代或未取代的吡啶基、取代或未取代的吡嗪基、取代或未取代的哒嗪基、取代或未取代的三嗪基、取代或未取代的二氢酞嗪基;
[0185]
所述环烷基、杂环基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0186]
所述吲唑基、吲哚基、噻吩基、呋喃基、吡咯基、吡啶基、吡嗪基、哒嗪基、三嗪基、二氢酞嗪基的取代基选自c1~c4烷基、c1~c4烷氧基、卤素、羟基、氨基、羧基、硝基、氰基;或者同一个碳原子上的两个取代基形成双键连接o;
[0187]
n表示a环上取代基r1的个数,选自0、1、2或3的整数,当n为0时表示a环上没有取代基;
[0188]
更优选地,
[0189]
a环选自
[0190]
r1’
选自卤素。
[0191]
进一步地,所述化合物如式viii所示:
[0192][0193]
其中,
[0194]
x1选自无、o、s、nr2或cr3r4;
[0195]
x2选自无、o、s、nr2或cr3r4;
[0196]
z1选自无、o、s、nr2或cr3r4;
[0197]
z2选自无、o、s、nr2或cr3r4;
[0198]
y1、y2分别独立选自n、cr5;
[0199]
r2、r3、r4、r5分别独立选自氢、c1~c8烷基;
[0200]
优选地,
[0201]
x1选自无、o或nr2;
[0202]
x2选自无或cr3r4;
[0203]
z1选自无或cr3r4;
[0204]
z2选自无、o或nr2;
[0205]
且x2和z1不能同时为cr3r4或同时为无;
[0206]
y1、y2分别独立选自n、cr5;
[0207]
且y1和y2不能同时选自n,但可以同时选自cr5;
[0208]
r2、r3、r4、r5分别独立选自氢、c1~c4烷基;
[0209]
更优选地,所述化合物如式viiia所示:
[0210][0211]
其中,
[0212]
x1选自o或nr2;
[0213]
r2选自氢、c1~c4烷基;
[0214]
或者,所述化合物如式viiib所示:
[0215][0216]
其中,
[0217]
z2选自o或nr2;
[0218]
r2选自氢、c1~c4烷基。
[0219]
进一步地,所述化合物如式ix所示:
[0220][0221]
其中,
[0222]
x1选自无、o、s、nr2或cr3r4;
[0223]
x2选自无、o、s、nr2或cr3r4;
[0224]
z1选自无、o、s、nr2或cr3r4;
[0225]
z2选自无、o、s、nr2或cr3r4;
[0226]
y1、y2分别独立选自n、cr5;
[0227]
r2、r3、r4、r5分别独立选自氢、c1~c8烷基;
[0228]
优选地,
[0229]
x1选自无、o或nr2;
[0230]
x2选自无或cr3r4;
[0231]
z1选自无或cr3r4;
[0232]
z2选自无、o或nr2;
[0233]
且x2和z1不能同时为cr3r4或同时为无;
[0234]
y1、y2分别独立选自n、cr5;
[0235]
且y1和y2不能同时选自n,但可以同时选自cr5;
[0236]
r2、r3、r4、r5分别独立选自氢、c1~c4烷基;
[0237]
更优选地,所述化合物如式ixa所示:
[0238][0239]
其中,
[0240]
x1选自o或nr2;
[0241]
r2选自氢、c1~c4烷基;
[0242]
或者,所述化合物如式ixb所示:
[0243][0244]
其中,
[0245]
z2选自o或nr2;
[0246]
r2选自氢、c1~c4烷基。
[0247]
进一步地,所述化合物如式x所示:
[0248][0249]
其中,
[0250]
x1选自无、o、s、nr2或cr3r4;
[0251]
x2选自无、o、s、nr2或cr3r4;
[0252]
z1选自无、o、s、nr2或cr3r4;
[0253]
z2选自无、o、s、nr2或cr3r4;
[0254]
y1、y2分别独立选自n、cr5;
[0255]
r2、r3、r4、r5分别独立选自氢、c1~c8烷基;
[0256]
r1’
选自卤素;
[0257]
优选地,
[0258]
x1选自无、o或nr2;
[0259]
x2选自无或cr3r4;
[0260]
z1选自无或cr3r4;
[0261]
z2选自无、o或nr2;
[0262]
且x2和z1不能同时为cr3r4或同时为无;
[0263]
y1、y2分别独立选自n、cr5;
[0264]
且y1和y2不能同时选自n,但可以同时选自cr5;
[0265]
r2、r3、r4、r5分别独立选自氢、c1~c4烷基;
[0266]
r1’
选自卤素;
[0267]
更优选地,所述化合物如式xa所示:
[0268][0269][0270]
其中,
[0271]
x1选自o或nr2;
[0272]
r2选自氢、c1~c4烷基;
[0273]
r1’
选自卤素;
[0274]
或者,所述化合物如式xb所示:
[0275]
[0276]
其中,
[0277]
z2选自o或nr2;
[0278]
r2选自氢、c1~c4烷基;
[0279]
r1’
选自卤素。
[0280]
进一步地,所述化合物为如下化合物之一:
[0281]
[0282][0283]
本发明还提供了前述的化合物、或其盐、或其立体异构体、或其溶剂合物、或其水合物、或其前药在制备用于抑制parp和/或hdac活性的药物中的用途。
[0284]
进一步地,所述药物是治疗局部缺血性疾病、糖尿病或炎症性疾病的药物。
[0285]
进一步地,所述药物是化疗药物增敏剂、放疗增敏剂或者治疗肿瘤的药物;
[0286]
优选地,所述肿瘤为乳腺癌、卵巢癌、胰腺癌或前列腺癌。
[0287]
本发明还提供了一种药物制剂,它是以前述的化合物、或其盐、或其立体异构体、或其溶剂合物、或其水合物、或其前药中的一种或多种为活性成分,加上药学上可接受的辅料或辅助性成分制备而成的制剂。
[0288]
本发明还提供了一种药物组合物,它包含前述的化合物、或其盐、或其立体异构体、或其溶剂合物、或其水合物、或其前药,以及化疗药物或放疗药物。
[0289]
本发明还提供了前述的化合物、或其盐、或其立体异构体、或其溶剂合物、或其水合物、或其前药与化疗药物或放疗药物在制备联合用药物中的用途。
[0290]
本发明的制剂是由前述的化合物、或其盐、或其立体异构体、或其溶剂合物、或其水合物、或其前药,或者前述的药物组合物中的一种或多种为活性成分,加上药学上可接受的辅料或辅助性成分按照常规方法制备而成的制剂。其剂型包含但不限于:片剂,颗粒剂、胶囊剂、口服液及药学上可接受的其他剂型。该药物组合物及其制剂在治疗通过parp和/或hdac的抑制可直接或间接产生临床有益效果的疾病。
[0291]
本发明因parp和/或hdac活性抑制而改善的疾病包括但不限于预防和/或治疗局部缺血性疾病、糖尿病、炎症性疾病。
[0292]
本发明前述化合物、或其盐、或其立体异构体、或其溶剂合物、或其水合物、或其前药用作癌症治疗的辅助手段或者用于强化放射治疗或化学治疗剂对肿瘤细胞的抑制和/或杀灭时,所述的癌症包括但不限于乳腺癌、卵巢癌、胰腺癌或前列腺癌等。
[0293]
本发明中提供的化合物和衍生物可以根据iupac(国际纯粹与应用化学联合会)或cas(化学文摘服务社,columbus,oh)命名系统命名。
[0294]
关于本发明的使用术语的定义:除非另有说明,本文中基团或者术语提供的初始定义适用于整篇说明书的该基团或者术语;对于本文没有具体定义的术语,应该根据公开内容和上下文,给出本领域技术人员能够给予它们的含义。
[0295]
本发明中,所述化合物的结构均是指能够稳定存在的结构。
[0296]“取代”是指分子中的氢原子被其它不同的原子或分子所替换。
[0297]
本发明中,碳氢基团中碳原子含量的最小值和最大值通过前缀表示,例如,前缀(c
a
~c
b
)烷基表明任何含“a”至“b”个碳原子的烷基。因此,例如,c1~c8烷基是指包含1~8个碳原子的直链或支链烷基,包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基等。
[0298]
卤素为氟、氯、溴或碘。
[0299]“取代或未取代”是所述基团可以是被任一取代的,也可以没有被取代基。
[0300]“芳基”指具有共轭的π电子体系的全碳单环或稠合多环(也就是共享毗邻碳原子对的环)基团,例如苯基和萘基。所述芳基环可以稠合于其它环状基团(包括饱和和不饱和环),但不能含有杂原子如氮,氧,或硫,同时连接母体的点必须在具有共轭的π电子体系的环上的碳原子上。6~10元芳基是指芳基含有6~10个碳原子。
[0301]“杂芳基”指芳基中的一个或多个碳原子被杂原子(如氮,氧,或硫等)代替。5~10元杂芳基是指杂芳基骨架上的原子数为5~10个。
[0302]“环烷基”是指全碳单环烷基或桥环、稠合、螺环烷基。3~10元是指该环烷基由3~10个碳原子构成。
[0303]“饱和杂环基”是指环烷基中的一个或多个碳原子被杂原子(如氮,氧,或硫等)代替。
[0304]“不饱和杂环基”部分不饱和的环烷基中的一个或多个碳原子被杂原子(如氮,氧,或硫等)代替。
[0305]“同一个碳原子上的两个取代基形成双键连接o”指形成结构。“nr
2”指形成结构。“cr3r
4”指形成结构。
[0306]
本发明中“盐”是指“药学上可接受的盐”。“药学上可接受的盐”表示保留母体化合物的生物有效性和性质的那些盐。这类盐包括:
[0307]
(1)与酸成盐,通过母体化合物的游离碱与无机酸或有机酸的反应而得,无机酸包括盐酸、氢漠酸、氢碘酸、硝酸、亚硝酸、磷酸、偏磷酸、硫酸、亚硫酸和高氯酸等,有机酸包括
醋酸、丙酸、丙烯酸、草酸、(d)或(l)苹果酸、富马酸、马来酸、羟基苯甲酸、丫
‑
羟基丁酸、甲氧基苯甲酸、邻苯二甲酸、甲磺酸、乙磺酸、荼
‑1‑
磺酸、荼
‑2‑
磺酸、对甲苯磺酸、水杨酸、酒石酸、柠檬酸、乳酸、扁桃酸、琥珀酸或丙二酸等。
[0308]
(2)存在于母体化合物中的酸性质子被金属离子代替或者与有机碱配位化合所生成的盐,金属例子例如碱金属离子、碱土金属离子或铝离子,有机碱,例如乙胺、二乙胺、二环己胺、三乙胺、丁胺、乙二胺、乙醇胺、二乙醇胺、三乙醇胺、哌嗪、节胺、苯基节胺、胆碱、葡甲胺、氨丁三醇、n
‑
甲基葡糖胺等。
[0309]
术语“溶剂合物”指本发明化合物与药学上可接受的溶剂形成溶剂合物,其中,所述药学上可接受的溶剂包括但并不限于水、乙醇、甲醇、异丙醇、丙二醇、四氢呋喃、二氯甲烷。
[0310]
术语“立体异构体”指本发明化合物所涉及手性碳原子可以为r构型,也可以为s构型,或其组合。
[0311]
parp在细胞dna损伤修复中起着关键作用,同时,parp也参与dna的甲基化修饰和转录、细胞信号转导、细胞周期调控以及细胞有丝分裂。研究表明parp抑制剂具有抗癌效果,更重要的是parp抑制剂与其他抗癌药物联合使用可引起合成致死效应。如parp抑制剂与化疗药物联合使用,既可以减轻化疗药物的不良反应,又可以提高其治疗效果。因此,parp抑制剂不仅可以治疗与parp相关的疾病,作为治疗肿瘤的药物,更是化疗药物增敏剂以及放疗增敏剂,在肿瘤治疗方便效果显著。
[0312]
本发明提供了一类对hdac和parp同时具有良好抑制活性的化合物,此类化合物对hdac和parp都具有良好的抑制效果,可用于制备parp/hdac双靶点抑制剂,预防和/或治疗因parp和/或hdac活性抑制而改善的疾病,如肿瘤、局部缺血性疾病、糖尿病、炎症性疾病等。同时,本发明化合物具有合成致死效应,可作为化疗药物增敏剂以及放疗增敏剂,与其他抗肿瘤药物联合使用,提高治疗效果,减轻不良反应。此外,本发明化合物提高了患者的依从性、更具药物经济学优势,具有良好的应用前景。
[0313]
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
[0314]
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
具体实施方式
[0315]
本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。
[0316]
实施例1、2
‑
(4
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰胺)甲基)哌啶
‑1‑
基)
‑
n
‑
羟基嘧啶
‑5‑
甲酰胺(化合物1)
[0317]
[0318]
a:4
‑
胺甲基哌啶
‑1‑
基
‑
嘧啶
‑5‑
甲酸甲酯
[0319]
向500ml的三口烧瓶中,加入n,n
‑
二甲基乙酰胺200毫升,34.3克(0.3mol)化合物4
‑
氨甲基哌啶和65.5毫升(0.375mol)n,n
‑
二异丙基乙胺,室温下,边搅拌边滴加4
‑
氯代嘧啶
‑5‑
甲酸甲酯25.9克(0.15mol)的100毫升n,n
‑
二甲基乙酰胺溶液,3小时后,将反应液慢慢倒入搅拌下的冰水混合物中,然后分别用300毫升乙酸乙酯萃取三遍,合并有机相,适量饱和食盐水洗涤两遍后,无水硫酸钠干燥,过滤,减压浓缩,得浅黄色蜡状物。再用异丙醚重结晶,析出固体,过滤,烘干,得浅黄色粉末目标化合物25.3克,esi
‑
ms:m/z 251.1。
[0320]
b:2
‑
(4
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰胺)甲基)哌啶
‑1‑
基)
‑
嘧啶
‑5‑
羧酸甲酯
[0321]
向500ml三口烧瓶中,加入2
‑
氟
‑5‑
(4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酸14.9克(50mmol),n,n
‑
二甲基甲酰胺200ml,室温,搅拌下,再加入o
‑
苯并三氮唑
‑
四甲基脲六氟磷酸盐(hbtu)20.8克(55mmol),2小时后,再加入4
‑
胺甲基哌啶
‑1‑
基
‑
嘧啶
‑5‑
甲酸甲酯12.5克(50mmol)。搅拌过夜,第二天,将反应液慢慢倒入搅拌下的冰水混合物中,然后用乙酸乙酯萃取,洗涤,干燥,浓缩,得黄色固体,再柱层析纯化,得目标化合物21克。esi
‑
ms:m/z 531.2。
[0322]
c:2
‑
(4
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰胺)甲基)哌啶
‑1‑
基)
‑
嘧啶
‑5‑
羧酸
[0323]
将2
‑
(4
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰胺)甲基)哌啶
‑1‑
基)
‑
嘧啶
‑5‑
羧酸甲酯21克,加入到500毫升单口烧瓶中,再加入甲醇200毫升,搅拌溶解后,在冰水浴下,再加入50毫升水,6.7克(0.16mol)氢氧化锂一水合物。4小时后,经tlc检测,水解完全,滴加2m盐酸,至中性。减压旋蒸,脱除甲醇后,再用2m盐酸调节溶液ph至5左右,有大量粉末状固体析出,过滤,水洗,烘干,得浅黄色粉末固体15.8克,不需进一步纯化,可直接用于下一步反应。
[0324]
d:2
‑
(4
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰胺)甲基)哌啶
‑1‑
基)
‑
嘧啶
‑5‑
羧酸(四氢吡喃
‑2‑
氧基)
‑
胺
[0325]
在250ml的圆底烧瓶中加入上步所得2
‑
(4
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰胺)甲基)哌啶
‑1‑
基)
‑
嘧啶
‑5‑
羧酸、四氢呋喃100ml及n,n
‑
二甲基甲酰胺30ml,搅拌溶解后加入n,n
‑
二异丙基乙胺2.6ml和2.46g o
‑
苯并三氮唑
‑
四甲基脲六氟磷酸盐,室温搅拌一个小时,再加入0.89g o
‑
(四氢
‑
2h
‑
吡喃
‑2‑
基)羟基胺,tlc监测反应进程,待反应完全后减压浓缩除去四氢呋喃,残留物用乙酸乙酯萃取,合并乙酸乙酯相,浓缩、柱层析得到目标化合物14.8g。
[0326]
e:2
‑
(4
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰胺)甲基)哌啶
‑1‑
基)
‑
n
‑
羟基嘧啶
‑5‑
甲酰胺(化合物1)
[0327]
在100ml单口瓶中,依次加入2
‑
(4
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰胺)甲基)哌啶
‑1‑
基)
‑
嘧啶
‑5‑
羧酸(四氢吡喃
‑2‑
氧基)
‑
胺2.0g和20ml乙酸乙酯的盐酸气体溶液,室温下搅拌反应,tlc监测反应进程,待反应完全后,将析出的固体过滤,再用甲醇重结晶即得产品1.1g,收率70%。esi
‑
ms:m/z 532.21[m h]
;1h nmr(600mhz,dmso
‑
d6)δ:1.10(dd,2h),1.76(d,2h),1.89(m,1h),2.94(t,2h),3.15(t,2h),4.33(s,2h),4.70(d,2h),7.20(t,1h),7.45(m,1h),7.55(d,1h),7.86(dt,2h),7.98(d,1h),8.27(d,
1h),8.34(m,1h),8.66(s,2h),8.99(s,1h),11.04(s,1h),12.60(s,1h)。
[0328]
f:2
‑
(4
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰胺)甲基)哌啶
‑1‑
基)
‑
嘧啶
‑5‑
羧酸苄氧胺
[0329]
在250ml的圆底烧瓶中加入2
‑
(4
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰胺)甲基)哌啶
‑1‑
基)
‑
嘧啶
‑5‑
羧酸2.6g、四氢呋喃100ml及n,n
‑
二甲基甲酰胺30ml,搅拌溶解后加入n,n
‑
二异丙基乙胺2.6ml和o
‑
苯并三氮唑
‑
四甲基脲六氟磷酸盐2.46g,室温搅拌一个小时,再加入o
‑
苄基羟胺盐酸盐1.2g,tlc监测反应进程,待反应完全后减压浓缩除去四氢呋喃,残留物用乙酸乙酯萃取,合并乙酸乙酯相,浓缩、柱层析得到纯品2.0g。
[0330]
g:2
‑
(4
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰胺)甲基)哌啶
‑1‑
基)
‑
n
‑
羟基嘧啶
‑5‑
甲酰胺(化合物1)
[0331]
在100ml单口瓶中,加入2
‑
(4
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰胺)甲基)哌啶
‑1‑
基)
‑
嘧啶
‑5‑
羧酸苄氧胺1.8g,甲醇20ml,搅拌溶解后加入0.2g钯碳,并通入氢气,tlc监测反应进程。待反应完全后,将反应液过滤,浓缩,用甲醇重结晶即得产品1.1g,收率74%。esi
‑
ms:m/z 532.21[m h]
;1h nmr(600mhz,dmso
‑
d6)δ:1.10(dd,2h),1.76(d,2h),1.89(m,1h),2.94(t,2h),3.15(t,2h),4.33(s,2h),4.70(d,2h),7.20(t,1h),7.45(m,1h),7.55(d,1h),7.86(dt,2h),7.98(d,1h),8.27(d,1h),8.34(m,1h),8.66(s,2h),8.99(s,1h),11.04(s,1h),12.60(s,1h)。
[0332]
实施例2、2
‑
(4
‑
((2h
‑
吲唑
‑7‑
甲酰胺)甲基)哌啶
‑1‑
基)
‑
n
‑
羟基嘧啶
‑5‑
甲酰胺(化合物2)
[0333][0334]
a:2
‑
(4
‑
((2h
‑
吲唑
‑7‑
甲酰胺)甲基)哌啶
‑1‑
基)
‑5‑
甲酸甲酯
[0335]
向250ml单口烧瓶中,加入化合物2h
‑
吲唑
‑7‑
甲酸8.1克(50mmol),n,n
‑
二甲基甲酰胺100ml,室温,搅拌下,再加入n,n
‑
碳酰二咪唑8.1克(50mmol),有气体逸出,2小时后,再加入4
‑
胺甲基哌啶
‑1‑
基
‑
嘧啶
‑5‑
甲酸甲酯12.5克(50mmol)。搅拌过夜,第二天,将反应液慢慢倒入搅拌下的冰水混合物中,析出浅黄色固体,静置3小时后,过滤,水洗,烘干,得浅黄色粉末状产物,即目标化合物17.2克,无需纯化,直接用于下一步反应。esi
‑
ms:m/z 395.2。
[0336]
b:2
‑
(4
‑
((2h
‑
吲唑
‑7‑
甲酰胺)甲基)哌啶
‑1‑
基)
‑5‑
甲酸
[0337]
将2
‑
(4
‑
((2h
‑
吲唑
‑7‑
甲酰胺)甲基)哌啶
‑1‑
基)
‑5‑
甲酸甲酯17.2g,加入到500毫升单口烧瓶中,再加入甲醇150毫升,搅拌溶解后,在冰水浴下,再加入50毫升水,6.3克(0.15mol)氢氧化锂一水合物。4小时后,经tlc检测,水解完全,滴加2m盐酸,至中性。减压旋蒸,脱除甲醇后,再用2m盐酸调节溶液ph至5左右,有大量粉末状固体析出,过滤,水洗,烘干,得浅黄色粉末固体13.8克,无需纯化,直接用于下一步反应。esi
‑
ms:m/z 381.1[m h]。
[0338]
c:2
‑
(4
‑
((2h
‑
吲唑
‑7‑
甲酰胺)甲基)哌啶
‑1‑
基)
‑
嘧啶
‑5‑
羧酸(四氢吡喃
‑2‑
氧基)
‑
胺
[0339]
在250ml的圆底烧瓶中加入2
‑
(4
‑
((2h
‑
吲唑
‑7‑
甲酰胺)甲基)哌啶
‑1‑
基)
‑5‑
甲酸
3.8g、100ml四氢呋喃及30ml n,n
‑
二甲基甲酰胺,搅拌溶解后加入5.3ml n,n
‑
二异丙基乙胺和4.93g o
‑
苯并三氮唑
‑
四甲基脲六氟磷酸盐,室温搅拌一个小时,再加入1.76g o
‑
(四氢
‑
2h
‑
吡喃
‑2‑
基)羟基胺,tlc监测反应进程,待反应完全后减压浓缩除去四氢呋喃,残留物用乙酸乙酯萃取,合并乙酸乙酯相,浓缩、柱层析得到目标化合物。
[0340]
d:2
‑
(4
‑
((2h
‑
吲唑
‑7‑
甲酰胺)甲基)哌啶
‑1‑
基)
‑
n
‑
羟基嘧啶
‑5‑
甲酰胺(化合物2)
[0341]
在100ml单口瓶中,加入2
‑
(4
‑
((2h
‑
吲唑
‑7‑
甲酰胺)甲基)哌啶
‑1‑
基)
‑
嘧啶
‑5‑
羧酸(四氢吡喃
‑2‑
氧基)
‑
胺3.0g,及30ml乙酸乙酯的盐酸气体溶液,室温下搅拌反应,tlc监测反应进程,待反应完全后,将析出的固体过滤,用甲醇重结晶即得产品,收率75%。esi
‑
ms:m/z 418.16[m na]
;1h nmr(600mhz,dmso
‑
d6)δ:1.18(dd,2h),1.83(d,2h),1.97(m,1h),2.97(t,2h),3.28(t,2h),4.74(d,2h),7.19(t,1h),7.95(d,2h),8.16(s,1h),8.69(s,1h),8.81(t,1h)。
[0342]
e:2
‑
(4
‑
((2h
‑
吲唑
‑7‑
甲酰胺)甲基)哌啶
‑1‑
基)
‑
嘧啶
‑5‑
羧酸苄氧胺
[0343]
在250ml的圆底烧瓶中加入2
‑
(4
‑
((2h
‑
吲唑
‑7‑
甲酰胺)甲基)哌啶
‑1‑
基)
‑5‑
甲酸3.04g、100ml四氢呋喃及30ml n,n
‑
二甲基甲酰胺,搅拌溶解后加入4.19ml n,n
‑
二异丙基乙胺和3.94g o
‑
苯并三氮唑
‑
四甲基脲六氟磷酸盐,室温搅拌一个小时,再加入1.9g o
‑
苄基羟胺盐酸盐,tlc监测反应进程,待反应完全后减压浓缩除去四氢呋喃,残留物用乙酸乙酯萃取,合并乙酸乙酯相,浓缩、过柱得到目标化合物。
[0344]
f:2
‑
(4
‑
((2h
‑
吲唑
‑7‑
甲酰胺)甲基)哌啶
‑1‑
基)
‑
n
‑
羟基嘧啶
‑5‑
甲酰胺(化合物2)
[0345]
在100ml单口瓶中,加入2
‑
(4
‑
((2h
‑
吲唑
‑7‑
甲酰胺)甲基)哌啶
‑1‑
基)
‑
嘧啶
‑5‑
羧酸苄氧胺2.4g,搅拌溶解后加入0.3g钯碳,甲醇25ml,并通入氢气,tlc监测反应进程。待反应完全后,将反应液过滤,浓缩,用甲醇重结晶即得产品,收率78%。esi
‑
ms:m/z 418.16[m na]
;1h nmr(600mhz,dmso
‑
d6)δ:1.18(dd,2h),1.83(d,2h),1.97(m,1h),2.97(t,2h),3.28(t,2h),4.74(d,2h),7.19(t,1h),7.95(d,2h),8.16(s,1h),8.69(s,1h),8.81(t,1h)。
[0346]
实施例3、2
‑
((1
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰)哌啶
‑4‑
基)甲氨基)
‑
n
‑
羟基嘧啶
‑5‑
甲酰胺(化合物3)
[0347][0348]
a:2
‑
(哌啶
‑4‑
基甲氨基)嘧啶
‑5‑
甲酸甲酯
[0349]
在100ml单口瓶中,加入2
‑
((1
‑
(叔丁氧羰基)哌啶
‑4‑
基)甲氨基嘧啶
‑5‑
羧酸甲酯4.0g,及40ml乙酸乙酯的盐酸气体溶液,室温下搅拌反应,tlc监测反应进程,待反应完全后,将析出的固体过滤,即得目标产品2.8g。
[0350]
b:2
‑
((1
‑
(2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰)哌啶
‑4‑
基)甲氨
基)嘧啶
‑5‑
甲酸甲酯
[0351]
在三口烧瓶中,加入2
‑
氟
‑5‑
(4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酸5.96克,n,n
‑
二甲基甲酰胺100ml,室温,搅拌下,再加入o
‑
苯并三氮唑
‑
四甲基脲六氟磷酸盐(hbtu)8.3克,2小时后,再加入2
‑
(哌啶
‑4‑
基甲氨基)嘧啶
‑5‑
甲酸甲酯5克。搅拌过夜,第二天,将反应液慢慢倒入搅拌下的冰水混合物中,然后用乙酸乙酯萃取,洗涤,干燥,浓缩,得黄色固体,再柱层析纯化,得目标化合物7.6克。esi
‑
ms:m/z 532.21[m h]
[0352]
c:2
‑
((1
‑
(2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰)哌啶
‑4‑
基)甲氨基)嘧啶
‑5‑
羧酸
[0353]
将2
‑
((1
‑
(2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰)哌啶
‑4‑
基)甲氨基)嘧啶
‑5‑
甲酸甲酯10克,加入到烧瓶中,再加入甲醇100毫升,搅拌溶解后,在冰水浴下,再加入水50毫升,氢氧化锂一水合物4.2克。4小时后,经tlc检测,水解完全,滴加2m盐酸,至中性。减压旋蒸,脱除甲醇后,再用2m盐酸调节溶液ph至5左右,有大量粉末状固体析出,过滤,水洗,烘干,得浅黄色粉末固体15.8克,不需进一步纯化,可直接用于下一步反应。
[0354]
d:2
‑
((1
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰)哌啶
‑4‑
基)甲氨基)
‑
n
‑
羟基嘧啶
‑5‑
羧酸(四氢吡喃
‑2‑
氧基)
‑
胺
[0355]
在圆底烧瓶中加入2
‑
((1
‑
(2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰)哌啶
‑4‑
基)甲氨基)嘧啶
‑5‑
羧酸2.6g、四氢呋喃100ml及n,n
‑
二甲基甲酰胺30ml,搅拌溶解后加入n,n
‑
二异丙基乙胺2.6ml和2.46g o
‑
苯并三氮唑
‑
四甲基脲六氟磷酸盐,室温搅拌一个小时,再加入0.89g o
‑
(四氢
‑
2h
‑
吡喃
‑2‑
基)羟基胺,tlc监测反应进程,待反应完全后减压浓缩除去四氢呋喃,残留物用乙酸乙酯萃取,合并乙酸乙酯相,浓缩、柱层析得到目标化合物。
[0356]
e:2
‑
((1
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰)哌啶
‑4‑
基)甲氨基)
‑
n
‑
羟基嘧啶
‑5‑
甲酰胺(化合物3)
[0357]
在100ml单口瓶中,依次加入2
‑
((1
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰)哌啶
‑4‑
基)甲氨基)
‑
n
‑
羟基嘧啶
‑5‑
羧酸(四氢吡喃
‑2‑
氧基)
‑
胺2.0g和20ml乙酸乙酯的盐酸气体溶液,室温下搅拌反应,tlc监测反应进程,待反应完全后,将析出的固体过滤,再用甲醇重结晶即得产品1.12g,收率65%。esi
‑
ms:m/z 532.21[m h]
;1h nmr(600mhz,dmso
‑
d6)δ:1.13(dd,2h),1.71(d,2h),1.85(m,1h),2.78(t,2h),3.08(t,2h),4.31(s,2h),4.58(d,2h),7.18(t,1h),7.43(m,1h),7.54(d,1h),7.87(dt,2h),7.88(d,1h),8.20(d,1h),8.31(m,1h),8.61(s,2h),8.92(s,1h),10.94(s,1h),12.56(s,1h)。
[0358]
f:2
‑
((1
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰)哌啶
‑4‑
基)甲氨基)
‑
n
‑
羟基嘧啶
‑5‑
羧酸苄氧胺
[0359]
在圆底烧瓶中加入2
‑
((1
‑
(2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰)哌啶
‑4‑
基)甲氨基)嘧啶
‑5‑
羧酸2.6g、四氢呋喃100ml和n,n
‑
二甲基甲酰胺30ml,搅拌溶解后加入n,n
‑
二异丙基乙胺2.6ml和o
‑
苯并三氮唑
‑
四甲基脲六氟磷酸盐2.46g,室温搅拌一个小时,再加入o
‑
苄基羟胺盐酸盐1.2g,tlc监测反应进程,待反应完全后减压浓缩除去四氢呋喃,残留物用乙酸乙酯萃取,合并乙酸乙酯相,浓缩、柱层析得到纯品1.8g。
[0360]
g:2
‑
((1
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰)哌啶
‑4‑
基)甲氨基)
‑
n
‑
羟基嘧啶
‑5‑
甲酰胺(化合物3)
[0361]
在100ml单口瓶中,2
‑
((1
‑
((2
‑
氟
‑5‑
((4
‑
氧代
‑
3,4
‑
二氢酞嗪
‑1‑
基)甲基)苯甲酰)哌啶
‑4‑
基)甲氨基)
‑
n
‑
羟基嘧啶
‑5‑
羧酸苄氧胺2g,甲醇25ml,搅拌溶解后加入0.2g钯碳,并通入氢气,tlc监测反应进程。待反应完全后,将反应液过滤,浓缩,用甲醇重结晶即得产品1.3g。esi
‑
ms:m/z 532.21[m h]
;1h nmr(600mhz,dmso
‑
d6)δ:1.13(dd,2h),1.71(d,2h),1.85(m,1h),2.78(t,2h),3.08(t,2h),4.31(s,2h),4.58(d,2h),7.18(t,1h),7.43(m,1h),7.54(d,1h),7.87(dt,2h),7.88(d,1h),8.20(d,1h),8.31(m,1h),8.61(s,2h),8.92(s,1h),10.94(s,1h),12.56(s,1h)。
[0362]
实施例4、2
‑
((1
‑
(2h
‑
吲唑
‑7‑
甲酰基)哌啶
‑4‑
基)甲氨基)
‑
n
‑
羟基嘧啶
‑5‑
甲酰胺(化合物4)
[0363][0364]
a:2
‑
((1
‑
(2h
‑
吲唑
‑7‑
甲酰基)哌啶
‑4‑
基)甲氨基)嘧啶
‑5‑
甲酸甲酯
[0365]
向250ml单口烧瓶中,加入化合物2h
‑
吲唑
‑7‑
甲酸8克,n,n
‑
二甲基甲酰胺100ml,室温,搅拌下,再加入n,n
‑
碳酰二咪唑8克(50mmol),有气体逸出,2小时后,再加入2
‑
(哌啶
‑4‑
基甲氨基)嘧啶
‑5‑
甲酸甲酯12.5克。搅拌过夜,第二天,将反应液慢慢倒入搅拌下的冰水混合物中,析出浅黄色固体,静置3小时后,过滤,水洗,烘干,得浅黄色粉末状产物,即目标化合物16.8克,无需纯化,直接用于下一步反应。esi
‑
ms:m/z 395.2。
[0366]
b:2
‑
((1
‑
(2h
‑
吲唑
‑7‑
甲酰基)哌啶
‑4‑
基)甲氨基)嘧啶
‑5‑
甲酸
[0367]
将2
‑
((1
‑
(2h
‑
吲唑
‑7‑
甲酰基)哌啶
‑4‑
基)甲氨基)嘧啶
‑5‑
甲酸甲酯16g,加入到500毫升单口烧瓶中,再加入甲醇150毫升,搅拌溶解后,在冰水浴下,再加入50毫升水,6克氢氧化锂一水合物。4小时后,经tlc检测,水解完全,滴加2m盐酸,至中性。减压旋蒸,脱除甲醇后,再用2m盐酸调节溶液ph至5左右,有大量粉末状固体析出,过滤,水洗,烘干,得浅黄色粉末固体12.5克,无需纯化,直接用于下一步反应。esi
‑
ms:m/z381.1[m h]。
[0368]
c:2
‑
((1
‑
(2h
‑
吲唑
‑7‑
甲酰基)哌啶
‑4‑
基)甲氨基)嘧啶
‑5‑
羧酸(四氢吡喃
‑2‑
氧基)
‑
胺
[0369]
在250ml的圆底烧瓶中加入2
‑
((1
‑
(2h
‑
吲唑
‑7‑
甲酰基)哌啶
‑4‑
基)甲氨基)嘧啶
‑5‑
甲酸3.5g、100ml四氢呋喃及30ml n,n
‑
二甲基甲酰胺,搅拌溶解后加入5ml n,n
‑
二异丙基乙胺和4.54g o
‑
苯并三氮唑
‑
四甲基脲六氟磷酸盐,室温搅拌一个小时,再加入1.62g o
‑
(四氢
‑
2h
‑
吡喃
‑2‑
基)羟基胺,tlc监测反应进程,待反应完全后减压浓缩除去四氢呋喃,残留物用乙酸乙酯萃取,合并乙酸乙酯相,浓缩、柱层析得到目标化合物3.3g,收率75%。
[0370]
d:2
‑
((1
‑
(2h
‑
吲唑
‑7‑
甲酰基)哌啶
‑4‑
基)甲氨基)
‑
n
‑
羟基嘧啶
‑5‑
甲酰胺(化合物4)
[0371]
在三口瓶中,加入2
‑
((1
‑
(2h
‑
吲唑
‑7‑
甲酰基)哌啶
‑4‑
基)甲氨基)嘧啶
‑5‑
羧酸(四氢吡喃
‑2‑
氧基)
‑
胺5.0g,及50ml乙酸乙酯的盐酸气体溶液,室温下搅拌反应,tlc监测反应进程,待反应完全后,将析出的固体过滤,用甲醇重结晶即得产品2.89g,收率70%。esi
‑
ms:m/z 418.16[m na]
;1hnmr(600mhz,dmso
‑
d6)δ:1.24(dd,2h),1.78(d,2h),1.98(m,
1h),3.07(t,2h),3.48(t,2h),4.54(d,2h),7.21(t,1h),7.88(d,2h),8.09(s,1h),8.65(s,1h),8.76(t,1h)。
[0372]
e:2
‑
((1
‑
(2h
‑
吲唑
‑7‑
甲酰基)哌啶
‑4‑
基)甲氨基)
‑
嘧啶
‑5‑
羧酸苄氧胺
[0373]
在250ml的圆底烧瓶中加入2
‑
((1
‑
(2h
‑
吲唑
‑7‑
甲酰基)哌啶
‑4‑
基)甲氨基)嘧啶
‑5‑
甲酸2.8g、100ml四氢呋喃及30ml n,n
‑
二甲基甲酰胺,搅拌溶解后加入4.19ml n,n
‑
二异丙基乙胺和3.88g o
‑
苯并三氮唑
‑
四甲基脲六氟磷酸盐,室温搅拌一个小时,再加入1.9g o
‑
苄基羟胺盐酸盐,tlc监测反应进程,待反应完全后减压浓缩除去四氢呋喃,残留物用乙酸乙酯萃取,合并乙酸乙酯相,浓缩、过柱得到目标化合物2.78g。
[0374]
f:2
‑
((1
‑
(2h
‑
吲唑
‑7‑
甲酰基)哌啶
‑4‑
基)甲氨基)
‑
n
‑
羟基嘧啶
‑5‑
甲酰胺(化合物4)
[0375]
在100ml单口瓶中,加入2
‑
((1
‑
(2h
‑
吲唑
‑7‑
甲酰基)哌啶
‑4‑
基)甲氨基)
‑
嘧啶
‑5‑
羧酸苄氧胺2.4g,甲醇20ml,搅拌溶解后加入0.3g钯碳,并通入氢气,tlc监测反应进程。待反应完全后,将反应液过滤,浓缩,用甲醇重结晶即得产品1.52g,收率78%。esi
‑
ms:m/z 418.16[m na]
;1hnmr(600mhz,dmso
‑
d6)δ:1.24(dd,2h),1.78(d,2h),1.98(m,1h),3.07(t,2h),3.48(t,2h),4.54(d,2h),7.21(t,1h),7.88(d,2h),8.09(s,1h),8.65(s,1h),8.76(t,1h)。
[0376]
表1列出的化合物均可以采用上述实施例相似的方法制备。反应过程通过tlc监控,纯化采用常规柱层析或者重结晶等方法进行。
[0377]
表1.本发明其余化合物编号、结构及表征数据
[0378]
[0379]
[0380][0381]
以下通过具体试验例证明本发明的有益效果。
[0382]
试验例1、hdac/parp1生物活性测试
[0383]
a、实验方法及原理
[0384]
1.parp1酶学实验
[0385]
parp是存在于真核细胞中催化聚adp核糖化的细胞核酶。parp在dna损伤修复和维持基因组稳定性方面起重要作用。当dna损伤时,parp酶被激活,与dna结合,催化聚腺苷二磷酸核糖基化,从而启动了dna的损伤控制和修复过程。
[0386]
parp
‑
1参与dna缺口的识别,识别dna缺口后活化的parp
‑
1形成同型二聚体并催化nad 分解成尼克酰胺和adp核糖,利用后者为原料使核受体蛋白聚adp核糖化。ht universal chemiluminescent parp assay kit with histone
‑
coated strip wells(cat#4676
‑
096
‑
k)购自trevigen,利用化学发光的方法检测结合到组蛋白上生物素的聚腺苷二磷酸核糖来判断parp1的活性。azd2281为阳性药。
[0387]
2.hdac酶学实验
[0388]
组蛋白去乙酰化酶(histone deacetylase,hdac)异常导致的组蛋白乙酰化状态失衡与肿瘤的发生和发展有密切关系。组蛋白去乙酰酶抑制剂在体外和体内实验中均能引起乙酰化核小体组蛋白的堆积,提高p21基因的表达水平,抑制肿瘤细胞的增殖,诱导细胞分化或凋亡,可用于多种恶性血液病及实体瘤的治疗。
[0389]
hdac在一定的条件下可使底物boc
‑
lys(ac)
‑
amc去乙酰化,然后在胰蛋白酶的作用下水解底物,生成amc,该物质在355nm激发波长下可发射出460nm波长的荧光,因此可通过检测产物量的变化反映酶的活性。本实验从hela细胞核中提取制备hdac酶。lbh
‑
589为阳
性药。
[0390]
b、实验数据
[0391]
本发化合物对hdac和parp1的抑制结果如表2所示。
[0392]
表2.本发明化合物对hdac和parp1的抑制结果
[0393][0394]
注:
‑
表示未测定
[0395]
上述试验结果表明:本发明化合物对hdac和parp同时具有抑制活性,均达到纳摩尔级别。其中化合物11和化合物13对hdac和parp的抑制率均达到90%以上。说明本发明化合物可用于制备hdac/parp双靶点抑制剂。
[0396]
试验例2、mtt法细胞增殖抑制活性测试
[0397]
体外细胞增殖抑制试验采用mmt法,采用以下9种细胞系:人乳腺癌细胞mda
‑
mb
‑
436、人乳腺癌细胞hcc1937、人乳腺导管癌细胞hcc1395、人乳腺癌细胞hcc1428、人乳腺癌细胞sum
‑
149pt、人乳腺癌细胞mda
‑
mb
‑
231、人乳腺癌mcf7、人宫颈癌hela、非突变三阴性乳腺癌mda
‑
mb
‑
157。
[0398]
a、实验方法及原理
[0399]
检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性mtt还原为水不溶性的蓝紫色结晶甲瓒(formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(dmso)能溶解
细胞中的甲瓒,用酶标仪在490nm波长处测定其光吸收值,在一定细胞数范围内,mtt结晶形成的量与细胞数成正比。根据测得的吸光度值(od值),来判断活细胞数量,od值越大,细胞活性越强(如果是测药物毒性,则表示药物毒性越小)。
[0400]
b、实验数据
[0401]
本发明化合物对部分人源肿瘤细胞的抑制活性结果如表3所示:
[0402]
表3.部分化合物的细胞抑制活性数据
[0403][0404]
注:
‑
表示活性低,未测定
[0405]
试验结果表明,本发明所涉及化合物具有良好的体外肿瘤细胞增殖抑制活性,具有较好的应用前景。
[0406]
综上,本发明提供了一类对hdac和parp同时具有良好抑制活性的化合物,此类化合物对hdac和parp都具有良好的抑制效果,可用于制备parp/hdac双靶点抑制剂,预防和/或治疗因parp和/或hdac活性抑制而改善的疾病,如肿瘤、局部缺血性疾病、糖尿病、炎症性疾病等。同时,本发明化合物具有合成致死效应,可作为化疗药物增敏剂以及放疗增敏剂,与其他抗肿瘤药物联合使用,提高治疗效果,减轻不良反应。此外,本发明化合物提高了患者的依从性、更具药物经济学优势,具有良好的应用前景。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。