用于检测番茄叶霉病抗性的snp位点组合及其应用
技术领域
1.本发明涉及植物生物技术领域,具体涉及一种用于检测番茄叶霉病抗性的snp位点组合及其应用。
背景技术:
2.番茄是世界重要的蔬菜经济作物,具有重要的生产应用和基础研究价值。伴随着番茄在全世界范围内的种植面积逐步扩大,番茄病虫害的影响与日俱增。其中,番茄叶霉病(tomato leaf mold)又称“黑毛病”,是番茄生产中一种主要的侵染性病害,尤其在保护地设施栽培的密闭高温高湿环境下发生严重,病原菌是半知菌亚门的黄枝孢菌(fulvia fulva(cooke)cif.)。该病害主要会对番茄的茎、叶营养器官和花、果实生殖器官造成危害。番茄品种对于叶霉病的抗性是依靠着其本身特有的抗病基因r与致病菌中对应的无毒基因avr互作所决定的。目前被发现的抗番茄叶霉病基因主要有24个,且大多为单基因控制的质量性状。其中cf
‑
1、cf
‑
4、cf
‑
9、cf
‑
10均位于chr.01上,cf
‑
2、cf
‑
5、cf
‑
6均位于chr.06短臂上,且cf
‑
2、cf
‑
4、cf
‑
5和cf
‑
9均被成功克隆。由于cf
‑
5和cf
‑
9对多个生理小种有较高抗性,目前在国内外番茄商业化育种中得到了广泛地应用。
3.目前番茄分子标记辅助育种应用研究中常用类型主要包括微卫星位点ssr标记等第一代分子标记,目标位点序列特异性sts标记、插入缺失indel标记、限制性酶切多态性caps标记等第二代分子标记,以及等位基因特异性pcr(as
‑
pcr)、高分辨率溶解曲线(hrm)和竞争性等位基因特异pcr(kasp)等第三代snp分子标记。其中kasp(kompetitive allele specific pcr)标记作为当今世界主流的snp分型方法,具备高特异性、准确率高、快速高效、灵活性强、单数据点成本低、易实现自动化高通量操作等优点,非常适合大量样本的少数标记位点的高通量自动化检测,已经在动植物商业化育种以及基因分型相关基础研究中广泛成熟运用。
4.目前针对番茄叶霉病抗性基因cf
‑
5也有几个kasp标记检测技术方案,尚没有针对cf
‑
9基因的kasp标记检测技术方案。并且,这些方案中目标snp的选择大多基于单一抗感双亲序列差异,或者不是目标基因直接相关的功能分子标记,在不同遗传背景番茄资源及商业化育种中的有效性、通用性和广适性均不能得到保证,可能导致选择失败,或者连锁累赘带来其他不利基因片段,限制了番茄叶霉病抗性检测效率以及抗病新品种的选育效率。
5.因此,开发一种高效、有代表性、通用的,能对番茄叶霉病抗性进行快速有效检测的snp位点组合及高通量检测应用技术方案,对番茄商业化育种应用和遗传学研究具有十分重要的实践和理论意义。
技术实现要素:
6.本发明的目的在于克服现有技术的不足,提供一种用于检测番茄叶霉病抗性的snp位点组合及其应用。通过直接在已知cf
‑
5和cf
‑
9基因上下游临近区域和基因内部的大量变异组数据分析鉴别得到了能对番茄叶霉病抗性进行快速有效检测的多个snp位点,可
实现目标基因区域精准鉴定和选择,从而解决现有技术中snp位点通用性不足,或者不是目标性状/基因直接相关的功能分子标记(仅为连锁标记),导致目标基因选择无效,或者连锁累赘带来其他非目标不利基因片段等问题。
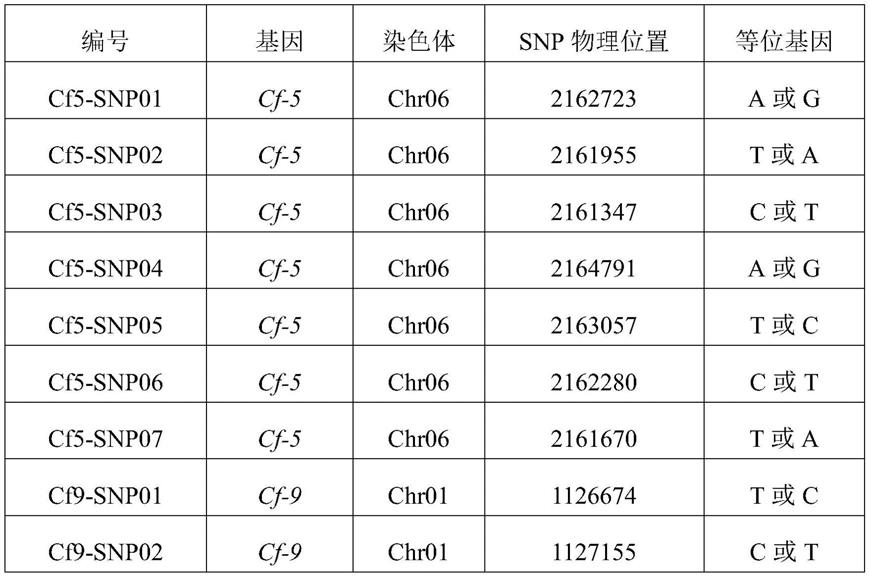
7.为实现上述目的,本发明第一方面提供了一种用于检测番茄叶霉病抗性的snp位点组合,所述snp位点组合包括位于番茄叶霉病抗性基因cf
‑
5内部及两侧的第一snp位点组合和位于番茄叶霉病抗性基因cf
‑
9内部及两侧的第二snp位点组合,所述第一snp位点组合包括以下cf5
‑
snp01位点~cf5
‑
snp07位点中的一种或多种,所述第二snp位点组合包括以下cf9
‑
snp01位点~cf9
‑
snp04位点中的一种或多种:
[0008][0009][0010]
表中,基因序列及snp物理位置信息对应于番茄(heinz 1706)参考基因组sl2.50版本。
[0011]
本发明第一方面所述snp位点组合对应的番茄叶霉病抗性基因cf
‑
5(solyc06g008300)的基因组信息来源于数据库https://solgenomics.net/locus/271/view,cf
‑
9(solyc01g006550)的基因组信息来源于数据库https://solgenomics.net/locus/9550/view。
[0012]
基于本发明第一方面所述snp位点组合,可实现对番茄叶霉病抗性的高通量snp分型检测,结果准确性高,一致性好,通用性强,可实现目标基因区域精准鉴定和选择。
[0013]
在本发明的一个实施方式中,所述cf5
‑
snp01位点~cf5
‑
snp07位点、cf9
‑
snp01位点~cf9
‑
snp04位点及其各自的侧翼序列分别如seq id no:1~11所示;
[0014]
所述cf5
‑
snp01位点~cf5
‑
snp07位点和cf9
‑
snp01位点~cf9
‑
snp04位点分别位于所述seq id no:1~11中的第102位。
[0015]
在本发明的一个实施方式中,所述第一snp位点组合包括所述cf5
‑
snp01位点、所述cf5
‑
snp04位点以及所述cf5
‑
snp06位点中的一个或者多个,所述第二snp位点组合包括所述cf9
‑
snp02位点以及所述cf9
‑
snp03位点组成中的一个或者两个。
[0016]
本发明第二方面提供了一种用于扩增上述snp位点组合的引物组合,所述引物组合包括第一引物组合和第二引物组合,所述第一引物组合包括以下引物组1
‑
01~引物组1
‑
03中的一组或多组,所述第二引物组合包括以下引物组2
‑
01~引物组2
‑
02中的一组或两组:
[0017]
引物组1
‑
01:seq id no:12~14序列,用于扩增所述cf5
‑
snp01位点的引物;
[0018]
引物组1
‑
02:seq id no:15~17序列,用于扩增所述cf5
‑
snp04位点的引物;
[0019]
引物组1
‑
03:seq id no:18~20序列,用于扩增所述cf5
‑
snp06位点的引物;
[0020]
引物组1
‑
04:seq id no:21~23序列,用于扩增所述cf9
‑
snp02位点的引物;
[0021]
引物组1
‑
05:seq id no:24~26序列,用于扩增所述cf9
‑
snp03位点的引物。
[0022]
本发明第三方面提供了一种用于检测番茄叶霉病抗性的试剂盒,其包括粉末状的或液态的本发明第二方面所述所述引物组合中的所述第一引物组合和所述第二引物组合中的一组或者多组引物组。
[0023]
在本发明的一个实施方式中,本发明第三方面所述的试剂盒还包括pcr预混液,所述pcr预混液包括荧光探针、淬灭探针、rox内参染料、kleartaq dna聚合酶、dntp和mgcl2。
[0024]
优选的,所述荧光探针包括荧光探针a和荧光探针b,所述淬灭探针包括淬灭探针a和淬灭探针b;
[0025]
所述荧光探针a的核苷酸序列如seq id no:27所示,其5’端连接荧光基团fam;
[0026]
所述荧光探针b的核苷酸序列如seq id no:28所示,其3’端连接荧光基团vic或hex;
[0027]
所述淬灭探针a的核苷酸序列如seq id no:29所示,其3’端连接淬灭基团bhq;
[0028]
所述淬灭探针b的核苷酸序列如seq id no:30所示,其3’端连接淬灭基团bhq。
[0029]
本发明第四方面提供了本发明第一方面所述的snp位点组合,或本发明第二方面所述的引物组合,或本发明第三方面所述的试剂盒的如下任意一种应用:
[0030]
(1)在检测或辅助检测番茄叶霉病抗性中的应用;
[0031]
(2)在制备检测或辅助检测番茄叶霉病抗性的产品中的应用;
[0032]
(3)在番茄叶霉病抗性育种中的应用;
[0033]
(4)在番茄种质资源及新品种鉴定和保护中的应用;
[0034]
(5)在番茄种质资源改良和创新中的应用。
[0035]
优选的,本发明第四方面提供的应用采用以下技术手段进行:
[0036]
检测本发明第一方面提供的snp位点组合中的一个或多个snp位点的多态性或基因型,检测方法包括飞行质谱、液相色谱、重测序、靶向测序和多重pcr测序中的一种或多种。
[0037]
优选的,本发明第四方面提供的应用采用以下技术手段进行:
[0038]
利用本发明第一方面提供的snp位点组合中的一个或多个snp位点的序列信息开发pcr标记和/或基因芯片,所述pcr标记包括pcr
‑
rflp标记、taqman标记、kasp标记、as
‑
pcr标记和hrm标记中的一种或多种。
[0039]
优选的,本发明第四方面提供的应用采用以下技术手段进行:
[0040]
利用本发明第一方面提供的snp位点组合中的一个或多个snp位点开展分子操作实现番茄叶霉病抗性的分子育种改良和种质资源创新,所述分子操作包括基因编辑或遗传转化。
[0041]
上述应用具体可根据不同项目要求及目的实施优化调整或替代。
[0042]
根据需要,可以选择本发明第一方面所述的第一snp位点组合和第二snp位点组合中的1个或几个或全部进行snp位点多态性或基因型检测。在一些实施例中,通过检测其中1个snp位点来鉴定待测番茄品种中是否含有cf
‑
5和cf
‑
9基因和/或鉴定待测番茄品种中cf
‑
5和cf
‑
9基因区段单倍型(cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9,cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9,cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9;cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9,cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9,cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9;cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9,cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9,或cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9)。在另一些实施例中,通过检测其中2个或2个以上或全部的snp位点来鉴定待测番茄品种中是否含有cf
‑
5和cf
‑
9基因和/或鉴定待测番茄品种中cf
‑
5和cf
‑
9基因区段单倍型。优选的,通过检测第一snp位点组合中的cf5
‑
snp01位点、cf5
‑
snp04位点以及cf5
‑
snp06位点中的1个或多个来鉴定待测番茄品种中是否含有cf
‑
5基因和/或鉴定待测番茄品种中cf
‑
5基因区段单倍型;通过检测第二snp位点组合中的cf9
‑
snp02位点以及cf9
‑
snp03位点中的1个或两个来鉴定待测番茄品种中是否含有cf
‑
9基因和/或鉴定待测番茄品种中cf
‑
9基因区段单倍型。
[0043]
本发明第五方面提供了一种检测番茄叶霉病抗性的方法,其特征在于,对待测番茄品种进行snp分型检测,包括以下步骤:
[0044]
(1)提取所述待测番茄品种的dna;
[0045]
(2)以本发明第二方面所述的引物组合分别对所述dna进行pcr扩增;
[0046]
(3)检查扩增结果,确定所述待测番茄品种在每一引物组对应的snp位点的基因型。
[0047]
在具体实施方案中,所述的待测番茄品种的dna可取自番茄植株的叶片、根、茎、花、果实和种子中的任一种。
[0048]
在本发明的一个实施方式中,所述对待测番茄品种进行snp分型检测采用kasp检测法,所述kasp检测法包括:
[0049]
(1)向所述待测番茄品种的叶片dna中加入引物混合液和pcr预混液,进行kasp扩增;
[0050]
(2)采用荧光定量pcr设备检测pcr产物,确定所述待测番茄品种在每一引物组对应的snp位点的基因型;
[0051]
所述引物混合液由本发明第二方面所述引物组合中同一引物组的引物序列组成。
[0052]
优选的,所述pcr预混液包括荧光探针、淬灭探针、rox内参染料、kleartaq dna聚合酶、dntp和mgcl2。
[0053]
优选的,所述荧光探针包括荧光探针a和荧光探针b,所述淬灭探针包括淬灭探针a和淬灭探针b;
[0054]
所述荧光探针a的核苷酸序列如seq id no:27所示,其5’端连接荧光基团fam;
[0055]
所述荧光探针b的核苷酸序列如seq id no:28所示,其3’端连接荧光基团vic或hex;
[0056]
所述淬灭探针a的核苷酸序列如seq id no:29所示,其3’端连接淬灭基团bhq;
[0057]
所述淬灭探针b的核苷酸序列如seq id no:30所示,其3’端连接淬灭基团bhq。
[0058]
优选的,所述荧光定量设备包括各品牌荧光定量pcr仪、酶标仪以及intelliqube、genematrix等高通量基因分型系统(自动化工作站)。
[0059]
本发明通过基于本发明第一方面提供的snp位点组合成功开发能够快速直观有效鉴定区分目标snp位点基因型状态的引物组合,并采用kasp检测法进行snp分型检测,从而判定被检测番茄材料中cf
‑
5和cf
‑
9基因区段单倍型(cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9,cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9,cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9;cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9,cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9,cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9;cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9,cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9,或cf
‑
5/cf
‑
5/cf
‑
9/cf
‑
9),进而辅助开展番茄抗叶霉病基因快速精准转育应用。
[0060]
在本发明的一个实施方式中,根据本发明第五方面所述方法,所述pcr的反应体系为:10~20ng/μl模板dna 0.8μl;pcr预混液0.8μl;引物混合液0.03μl,其中各引物的终浓度均为100pmol/l;
[0061]
所述pcr的反应条件为:95℃预变性10min;95℃变性20s,61℃退火延伸60s,每个循环的退火温度降低0.6℃,共10个循环,最终退火温度降到55℃;94℃变性20s,55℃退火延伸60s,共28~32个循环。
[0062]
本发明第五方面提供的方法操作简单,只需将引物混合液和pcr预混液加入到含有dna样本的pcr微孔反应板中,进行pcr扩增,然后采用荧光定量pcr设备检测分析pcr产物并进行数据分析即可。
[0063]
区别于现有技术,本发明具有以下有益效果:
[0064]
(1)本发明通过直接在已知cf
‑
5和cf
‑
9基因上下游临近区域和基因内部大量变异组数据分析鉴别得到了高效、有代表性、通用的snp位点组合,通过不同资源材料广泛验证,实现了目标番茄叶霉病抗性基因的分子标记辅助有效选择,打破了番茄叶霉病抗性基因不利连锁;
[0065]
(2)本发明的snp位点组合(及其各自的侧翼序列信息)可以为靶向测序、基因芯片、探针、pcr标记、基因克隆及功能研究等其他技术拓展或研究提供有力支撑帮助;
[0066]
(3)基于本发明的snp位点组合所开发的检测物质/产品(例如本发明的引物组合、试剂盒等)可实现对番茄叶霉病抗性基因cf
‑
5和cf
‑
9区段单倍型的快速、精准和高通量检测,具有操作简单、成本低廉、可自动化、通量效率高、标记稳定、安全无毒无害等优点,可以在番茄苗期快速、准确和高通量的进行番茄叶霉病抗性鉴定,降低人工接种鉴定和田间移栽工作量,提高育种效率、降低育种成本、加速育种进程,非常适合现代商业化育种应用及大规模遗传改良研究。
附图说明
[0067]
图1为本发明检测番茄抗叶霉病基因cf
‑
5和cf
‑
9的通用snp位点发掘及kasp引物组合开发及应用的流程图;
[0068]
图2示出了番茄抗叶霉病基因cf
‑
5(solyc06g008300)上下游及内部区域3个通用snp位点(cf5
‑
snp01、cf5
‑
snp04和cf5
‑
snp06)的变异组及其在番茄基因组(sl2.50版本)上的位置信息;图中,ts
‑
2、ts
‑
3及ts
‑
253(heinz 1706,参考基因组)等为感病基因型对照,其
余ts
‑
12、ts
‑
40、ts
‑
123、ts
‑
124、ts
‑
144和ts
‑
151为抗病基因型对照;
[0069]
图3示出了番茄抗叶霉病基因cf
‑
9(solyc01g006550)上下游及内部区域2个通用snp位点(cf9
‑
snp02和cf9
‑
snp03)的变异组及其在番茄基因组(sl2.50版本)上的位置信息;图中,ts
‑
2、ts
‑
3、ts
‑
4及ts
‑
253(heinz 1706)等为感病基因型对照,其余ts
‑
18、ts
‑
21、ts
‑
123、ts
‑
124、ts
‑
417和ts
‑
418为抗病基因型对照;
[0070]
图4示出了检测番茄抗叶霉病基因cf
‑
5(solyc06g008300)通用snps位点开发的3个kasp引物组合在大群体中的分型情况;图中,a为引物组1
‑
01(chr06:2,162,723),b为引物组1
‑
02(chr06:2,164,791),c为引物组1
‑
03(chr06:2,162,280),横坐标代表fam荧光信号值(i处圆点,代表抗病基因型),纵坐标代表hex荧光信号值(iii处圆点,代表感病基因型),中间ii处圆点代表杂合抗病基因型,靠近原点iv处圆点代表ntc阴性对照;
[0071]
图5示出了番茄抗叶霉病基因cf
‑
9(solyc01g006550)通用snps位点开发的2个kasp引物组合在大群体中的分型情况;图中,a为引物组2
‑
02(chr01:1,127,155),b为引物组2
‑
02(chr01:1,125,319),横坐标代表fam荧光信号值(i处蓝色圆点,代表抗病基因型),纵坐标代表hex荧光信号值(iii处红色圆点,代表感病基因型),中间ii处紫色圆点代表杂合抗病基因型,靠近原点iv处灰色原点代表ntc阴性对照。
具体实施方式
[0072]
为详细说明技术方案的技术内容、构造特征、所实现目的及效果,以下结合具体实施例并配合附图详予说明。本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
[0073]
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中,如无特殊说明,序列表中各核苷酸序列的第1位均为相应dna的5’末端核苷酸,末位均为相应dna的3’末端核苷酸。下述实施例中所用部分已知抗性的番茄检测材料,包括ts系列番茄种质资源为国内外公开资源,社会公众可向中国农业科学院农业基因组研究所或者其他科研单位索取以重复下述实验,其余番茄商品种可依据表2所列来源通过正规商业途径获得。
[0074]
在具体实施方案中,所述的待测番茄样品(dna)可取自番茄植株的叶片、根、茎、花、果实和种子中的任一种。在下述实施例中采用番茄植株的叶片提取dna,但并不用以限制本发明的保护范围。在下述实施例中采用的pcr试剂、反应体系、平台设备及扩增检测程序为本发明的优选方案,其他类似合理的国产或进口试剂、设备平台、反应体系及扩增程序也可以达到相同检测目的,并不用以限制本发明的保护范围。
[0075]
图1为本发明检测番茄抗叶霉病基因cf
‑
5和cf
‑
9的通用snp位点发掘及kasp引物组合开发及应用的流程图。如图1所示,在本发明的具体实施例中,采用kasp检测方法进行snp分型检测,但并不用以限制本发明的保护范围。本领域技术人员可以基于本发明提供的snp位点,通过质谱、色谱测序、基因芯片以及其他pcr技术等手段进行snp分型检测。
[0076]
实施例1snp位点组合的筛选
[0077]
1、实验材料
[0078]
选取世界范围内、不同来源类型、有代表性的660份番茄种质资源的变异组数据用
于本实施例中snp位点筛选,该番茄变异组数据来源主要基于本发明人所在项目组前期工作(lin,t.,zhu,g.,zhang,j.et al.genomic analyses provide insights into the history of tomato breeding[j].nat genet,2014,46:1220~1226;tieman d,zhu g,resende m f r,et al.a chemical genetic roadmap to improved tomato flavor[j].science,2017,355(6323):391)。其中,部分番茄种质资源的基因型数据及cf
‑
5和cf
‑
9基因的抗性表型数据来源于现有公开数据库(https://solgenomics.net/)。
[0079]
2、snp位点组合的筛选
[0080]
利用目标基因cf
‑
5基因(solyc06g008300,数据库来源https://solgenomics.net/locus/271/view)及cf
‑
9基因(solyc01g006550,数据库来源https://solgenomics.net/locus/9550/view)内部及上下游区域2kb范围内的筛选通用snp位点。
[0081]
通过大果番茄、樱桃番茄、鲜食番茄、加工番茄等不同类型品种以及其他野生抗病供体种质资源的全基因组变异图谱分析,获得抗、感材料之间cf
‑
5基因(solyc06g008300)及cf
‑
9基因(solyc01g006550)内部或两侧存在一致差异的snp位点。以ts
‑
2(moneymaker)、ts
‑
3(m
‑
82)、ts
‑
253(heinz1706)等为已知感病基因型(cf
‑
5/cf
‑
5,cf
‑
9/cf
‑
9)对照,以ts
‑
12(yoku improvement)、ts
‑
40(cerise vfnt)、ts
‑
123(trujillo)、ts
‑
124(santa rosa)、ts
‑
144(pichilingue)和ts
‑
151(t
‑
5)等为已知抗病基因型(cf
‑
5/cf
‑
5)对照,以ts
‑
18(la1579)、ts
‑
21(la1375)、ts
‑
123(trujillo)、ts
‑
124(santa rosa)、ts
‑
417(la1933)和ts
‑
418(la2147)等为已知抗病基因型(cf
‑
9/cf
‑
9)对照,其中ts
‑
40为樱桃番茄,ts
‑
2、ts
‑
3、ts
‑
12等为不同地理来源或育种年代的大果栽培番茄,ts
‑
123、ts
‑
124、ts
‑
417等为不同地理来源的野生番茄资源。按照基因上下游及基因内部不同位置选择,并根据分型结果,对每个位点进行筛选分析。最终成功获得11个在已知抗、感基因型对照的变异组中表现高度一致稳定差异的高质量通用snp位点(即本发明的snp位点组合:cf5
‑
snp01位点~cf5
‑
snp07位点和cf9
‑
snp01位点~cf9
‑
snp04位点)。由于这11个snp位点在不同类型及来源的抗、感品种之间表现高度一致变异,因此可以预期其对番茄叶霉病抗性的显著关联表征效果。
[0082]
考虑到测序、pcr扩增及基因芯片等snps不同检测方法的多样性、成功率和基本原理的通用性,以及已克隆基因功能、分子调控网络机制的不确定性,因此本发明进一步提供了上述抗番茄叶霉病基因cf
‑
5和cf
‑
9区域的11个snp位点及其各自的侧翼序列,用于检测番茄叶霉病抗性、制备相关检测或辅助检测产品以及番茄辅助育种和种质资源保护及创新的应用。
[0083]
cf5
‑
snp01位点~cf5
‑
snp07位点、cf9
‑
snp01位点~cf9
‑
snp04位点及其各自的侧翼序列分别如seq id no:1~11所示。
[0084]
实施例2引物合成与试剂盒制备
[0085]
1、引物的设计和筛选
[0086]
根据实施例1提供的cf5
‑
snp01位点~cf5
‑
snp07位点和cf9
‑
snp01位点~cf9
‑
snp04位点的侧翼序列,针对每个snp位点,采用按照kasp标记设计开发原则(目标产物80~150bp,引物在参考基因组上特异匹配目标区域且位于非snp密集区域,避免a\t或g\c含量高等复杂序列区域等),利用primer3.0软件在snp位点的上游设计两条正向引物,下游设计一条反向引物。
[0087]
待测番茄样品包括部分已知基因型和叶霉病表型的种质资源及育种材料中随机选取的21个样品作为抗、感或杂合对照,最后加3个ddh2o作为ntc空白对照,共计24份。
[0088]
dna提取采用常规ctab法或国产磁珠试剂盒从测番茄样品的叶片中提取基因组dna,利用nanodrop 1000进行核酸浓度测定,稀释并控制dna模板浓度为10~20ng/μl。
[0089]
pcr的反应体系(10μl)为:10~20ng/μl dna模板5μl;pcr预混液5μl;引物混合液0.14μl,其中各引物的终浓度均为100pmol/l(优选的,引物混合配比为特异分型引物各12μl、公共引物30μl,再加46μl ddh2o;在其他实施例中,使用其他合理的引物混合配比也可以达到相同的检测目的)。其中,引物混合液由本发明引物组合中同一引物组的引物序列组成。pcr预混液包括荧光探针a、荧光探针b、淬灭探针a、淬灭探针b、rox内参染料、kleartaq dna聚合酶、dntp和mgcl2。其中,荧光探针a的核苷酸序列如seq id no:27所示,其5’端连接荧光基团fam;荧光探针b的核苷酸序列如seq id no:28所示,其3’端连接荧光基团vic或hex;淬灭探针a的核苷酸序列如seq id no:29所示,其3’端连接淬灭基团bhq;淬灭探针b的核苷酸序列如seq id no:30所示,其3’端连接淬灭基团bhq。
[0090]
按照thermo fisher公司的荧光定量pcr仪(applied biosystems quant studio 3,abi
‑
q3)的操作手册,编辑样品及引物排布模板,执行运行程序{30℃读取荧光信号1min;94℃变性15min;94℃变性20s,61℃退火60s,重复此步骤10个循环,每个循环设置touch
‑
down降温0.6℃,最终退火温度降到55℃;94℃变性20s,55℃退火60s,重复此步骤28~32个循环;30℃读取荧光信号1min},分析数据结果,最终分别选取3组和2组fam信号、vic信号以及杂合荧光信号聚集分型趋势显著的位于目标基因上下游或内部的引物组构成本发明的引物组合(包括第一引物组合:引物组1
‑
01、引物组1
‑
02和引物组1
‑
03,以及第二引物组合:引物组2
‑
01和引物组1
‑
02,各引物组所对应的snp信息如图2和3所示,相应扩增目的条带大小及单倍型信息详见表1),开展后续大群体cf
‑
5和cf
‑
9区域基因型或单倍型验证及育种应用。
[0091]
引物组1
‑
01:seq id no:12~14序列,用于扩增所述cf5
‑
snp01位点的引物;
[0092]
引物组1
‑
02:seq id no:15~17序列,用于扩增所述cf5
‑
snp04位点的引物;
[0093]
引物组1
‑
03:seq id no:18~20序列,用于扩增所述cf5
‑
snp06位点的引物;
[0094]
引物组1
‑
04:seq id no:21~23序列,用于扩增所述cf9
‑
snp02位点的引物;
[0095]
引物组1
‑
05:seq id no:24~26序列,用于扩增所述cf9
‑
snp03位点的引物。
[0096]
表1检测番茄cf
‑
5和cf
‑
9基因的引物组合及其对应的snp位点、扩增片段长度和引物信息
[0097]
[0098][0099]
2、试剂盒的制备
[0100]
本实施例将上述引物组合应用于制备试剂盒。该试剂盒除了引物组合,还包括pcr预混液组成。引物混合液由本发明引物组合中同一引物组的引物序列组成。pcr预混液包括荧光探针a、荧光探针b、淬灭探针a、淬灭探针b、rox内参染料、kleartaq dna聚合酶、dntp和mgcl2。其中,荧光探针a的核苷酸序列如seq id no:27所示,其5’端连接荧光基团fam;荧光探针b的核苷酸序列如seq id no:28所示,其3’端连接荧光基团vic或hex;淬灭探针a的核苷酸序列如seq id no:29所示,其3’端连接淬灭基团bhq;淬灭探针b的核苷酸序列如seq id no:30所示,其3’端连接淬灭基团bhq。每个snp位点的三条引物(每个引物组)独立分装后包装在一起;pcr预混液独立包装。
[0101]
实施例3番茄抗叶霉病基因cf
‑
5和cf
‑
9高效kasp标记的验证与育种应用
[0102]
本实施例基于实施例1提供的snp位点,采用实施例2中提供的试剂盒(包括引物组合)进行番茄抗叶霉病基因cf
‑
5和cf
‑
9高效kasp标记的验证与育种应用工作。
[0103]
选取381份包含主流商品种、国家资源库核心公开种质、育种中间材料、杂交新组合等有代表性的番茄样品,涉及大果番茄、樱桃番茄、串收番茄、鲜食番茄、加工番茄以及农家种(地方品种)等各种不同类型栽培番茄,其中121份已经通过第三方商业机构利用紧密连锁scar标记获得了cf
‑
5和cf
‑
9基因型数据(包括19份叶霉病抗性表型已知的番茄种质资源及商品种,详见表2)。
[0104]
具体的,本实施例提供了一种检测番茄叶霉病抗性的方法,采用kasp检测法对待测番茄品种进行snp分型检测,包括以下步骤:
[0105]
(1)提取待测番茄品种的叶片dna;
[0106]
(2)采用实施例2中提供的试剂盒,向待测番茄品种的叶片dna中加入引物混合液和pcr预混液,进行kasp扩增(以实施例2中提供的引物组合中的每一引物组分别对叶片dna进行kasp扩增);
[0107]
(3)采用荧光定量pcr仪检测pcr产物,确定待测番茄品种在每一引物组对应的snp位点的基因型。
[0108]
待测番茄品种为上述381份包含部分已知基因型和表型的种质资源及育种材料,最后加上3个ddh2o作为ntc空白对照,共计384份。
[0109]
待测番茄品种的叶片dna的提取方法及条件与实施例2中的提取方法及条件相同。
[0110]
pcr扩增反应体系(1.6μl)为:10~20ng/μl模板dna 0.8μl;pcr预混液0.8μl;引物
混合液0.03μl,其中各引物的终浓度均为100pmol/l,引物混合配比为特异分型引物各12μl、公共引物30μl,再加46μl ddh2o。
[0111]
按照intelliqube平台操作手册,编辑样品及引物排布模板,执行运行程序{95℃预变性10min;95℃变性20s,61℃退火延伸60s,每个循环的退火温度降低0.6℃,共10个循环,最终退火温度降到55℃;94℃变性20s,55℃退火延伸60s,共28~32个循环},读取荧光数据并酌情增加pcr循环数,分析并去除部分不确定、荧光值太低或者异常的数据点,最终大群体分型情况如图4和图5所示,并导出excel结果(如表2所示)。
[0112]
结果发现,实施例2提供的5组kasp标记在381份不同类型和来源的番茄育种大群体中获得了高度一致且界限清晰的群体分型效果(如图4和图5所示),也即通过实验证实了实施例1提供的snp位点组合在不同遗传背景的番茄品种资源中具备很好的通用性和稳定性。进一步的,在19份叶霉病抗性表型已知的待测样本中,ta039抗性表型为高抗hr,而紧密连锁标记scar
‑
cf5鉴定基因型为ss,scar
‑
cf9鉴定基因型为rr或h,而实施例2提供的5个引物组中多数鉴定基因型为r或h(如表2所示)。除此之外,121份有连锁scar标记结果参照的待测样本中,用于检测cf
‑
5的3个引物组与cf
‑
5连锁scar标记的基因型鉴定结果之间的一致性p为72.7%{一致性计算公式为p=(有效检测样本数
‑
差异样本数)/有效检测样本数*100%};用于检测cf
‑
9的2个引物组与cf
‑
9连锁scar标记的基因型鉴定结果之间的一致性p为96.3%。而用于检测cf
‑
5的3个引物组的检测结果之间的一致性p均超过92%,用于检测cf
‑
9的2个引物组的检测结果之间的一致性p均超过93%。进一步分析发现,scar标记检测结果中出现相同重复材料样本检测结果矛盾情况(例如,编号ta127和ta128为相同重复材料,故意试验设计重复),而本发明提供的引物组的检测结果则无此现象。上述结果证明,本发明提供的kasp标记检测准确率和稳定性均显著高于现有商用scar标记。
[0113]
此外,本实施例还对260份育种中间材料进行了cf
‑
5和cf
‑
9位点基因型检测,结果发现待测样本的基因型检测结果基本与系谱关系相吻合,可通过待测样本cf
‑
5和cf
‑
9位点基因型检测结果准确预测其子代或父代的番茄叶霉病抗性。
[0114]
综上所述,本实施例提供的5组kasp标记在不同类型、来源或遗传背景的栽培番茄品种资源中具备很好的通用性和稳定性,标记相互之间的检测结果基本保持一致,且每组标记检测的准确率和稳定性要显著优于现有的商业化scar标记,每一组都可以单独应用于番茄叶霉病抗性的分子检测。以此类推,同样符合前述变异组特征的其余6个snp位点可以通过测序、基因芯片或其他pcr标记验证并取得相同的预期效果。同时,上述kasp标记组合在一起能更进一步提高检测精确度,可以避免假阳性等实验误差以及目标基因区域未被完整选择或部分丢失等遗传变异因素导致的抗性鉴定错误,取得更好的检测判定效果。因此,本发明提供的高效kasp标记可以直接用于番茄抗叶霉病分子育种商业化应用。
[0115]
表2 121份番茄种质资源、品种及育种中间材料的叶霉病抗性表型及标记基因型
[0116]
[0117]
[0118]
[0119]
[0120]
[0121][0122]
注:表中样品编号为实际检测样品排布顺序编号,为便于结果比较分析和直观判断,按照来源类别调整排序;其中“抗性”栏代表番茄叶霉病抗性表型,“s”代表感病,“r”代表抗病,“hr”代表高抗;其中“scar”栏代表第三方商业机构利用cf
‑
5和cf
‑
9基因连锁scar标记检测结果,“ss”代表纯合感病基因型,“rr”代表纯合抗病基因型,“h”代表杂合基因型;其中“引物组1
‑
01”检测结果中,“t:t”代表纯合感病基因型,“c:c”代表纯合抗病基因型,“t:c”代表杂合基因型;其中“引物组1
‑
02”检测结果中,“a:a”代表纯合感病基因型,“g:g”代表纯合抗病基因型,“a:g”代表杂合基因型;其中“引物组1
‑
03”、“引物组2
‑
01”检测结果中,“g:g”代表纯合感病基因型,“a:a”代表纯合抗病基因型,“g:a”代表杂合基因型;其中“引物组2
‑
02”检测结果中,“g:g”代表纯合感病基因型,“c:c”代表纯合抗病基因型,“g:c”代表杂合基因型;
“‑”
代表数据缺失;“*”标注代表基因连锁scar标记与本发明提供的kasp标记之间或者本发明提供的kasp标记内不同标记之间不一致结果。
[0123]
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念和相关原理流程,则可对这些实施例做出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
[0124]
本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。倘若针对本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
[0125]
虽然本发明给出了特殊的实施例,应该理解为可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术
中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
