1.本发明属于微生物系统分类和环境生物技术领域,涉及一株苯甲酸厌氧降解菌及其应用,特别涉及一株苯甲酸厌氧降解菌(geobacter benzoelyticum)jerry
‑
yx及其应用。
背景技术:
2.随着经济的发展,石油开采、冶炼、运输等活动日益增多,由于开采不合理、技术不成熟等因素引起的石油泄漏现象时有发生。石油进入土壤中后难以自然降解,对土壤组成结构、理化性质以及生物群落的功能与结构等都将产生不利影响,其中石油污染物多环芳烃具有毒性、半挥发性、生物蓄积性,会积累并持续存在于环境中,严重威胁人类健康和生态安全。因此寻找降解石油污染物多环芳烃的方法具有重要的实际意义。
3.苯甲酸通常以苯甲酸盐的形式出现,是多环芳烃厌氧降解重要的中间产物,研究苯甲酸的降解对于研究多环芳烃降解具有重要意义。另外,过量的苯甲酸进入细胞可影响酶活性和细胞完整性,进入土壤会抑制微生物数量和改变群落结构,也会引起一系列的环境污染问题。研究表明,苯甲酸可以以硝酸盐、硫酸盐、fe(iii)为电子受体进行厌氧降解,为微生物供能来支持微生物的生长,并且研究发现厌氧微生物比好氧微生物具有更强的多环芳烃降解能力。因此,发现和引入苯甲酸厌氧降解菌能更快速有效地降解有机污染物,减少异位修复的转运成本,进而将可能产生的环境影响控制在最低限度,对增强多环芳烃的原位生物降解具有重要意义。
4.目前azoarcus sp.cib、沼泽红假单胞菌(rhodopseudomonas palustris)、磁螺菌(magnetospirillum magnetotacticum)ms
‑
1、固氮弧菌(azoarcus evansii)等微生物可以在厌氧条件下降解苯甲酸,硫还原地杆菌(geobacter metallireducens)gs
‑
15
t
对苯甲酸有较好的氧化能力。但目前能以fe(iii)为唯一电子受体氧化苯甲酸的微生物菌株匮乏。
技术实现要素:
5.本发明的第一目的在于克服现有技术的缺点与不足,提供一株苯甲酸厌氧降解菌株。
6.本发明的另一个目的在于提供上述苯甲酸厌氧降解菌的应用。
7.本发明的目的通过下述技术方案实现:
8.一株苯甲酸厌氧降解菌株,命名为(geobacter benzoelyticum)jerry
‑
yx,于2021年03月15日保藏于位于北京市朝阳区北辰西路1号院3号中国科学院微生物研究所的中国普通微生物菌种保藏管理中心(cgmcc),保藏编号为cgmcc no.22016。
9.苯甲酸厌氧降解菌jerry
‑
yx为严格厌氧的革兰氏阴性菌,没有接触酶和氧化酶活性。通过透射电镜对菌株苯甲酸厌氧降解菌jerry
‑
yx细胞形态进行观察,发现菌体呈长形杆状,有多个端生鞭毛,约0.2~0.4μm宽,2.0~2.2μm长。在nbaf培养基中能耐受20~37℃的温度,最适生长温度30℃。培养基nacl浓度在0~1%(w/v)范围内菌株可以生长,但nacl浓度1.5%(w/v)及以上不能生长,生长最适nacl浓度0%(w/v)。
10.所述的nbaf培养基由以下组分组成:800ml超纯水中加入富马酸4.64g,利用naoh溶液将富马酸溶液ph调节至6.5~7.0,然后依次加入cacl2·
2h2o 0.04g,mgso4·
7h2o 0.1g,nahco
3 1.8g,na2co
3 0.43g,ch3coona
·
3h2o 2.04g,100
×
nb盐混合物10ml,1
×
nb矿物质溶液10ml,1
×
dl维生素溶液15ml,1mm na2seo
4 1ml,最后用超纯水定容到1l。
11.100
×
nb盐混合物由以下试剂组成:kh2po
4 42g/l、k2hpo
4 22g/l、nh4cl 20g/l、kcl 38g/l、nacl 36g/l,余量为超纯水。
[0012]1×
nb矿物质溶液由以下组分组成:氨三乙酸三钠2.14g/l、mncl2·
4h2o 0.1g/l、feso4·
7h2o 0.3g/l、cocl2·
6h2o 0.17g/l、znso4·
7h2o 0.2g/l、cucl2·
2h2o 0.03g/l、alk(so4)2·
12h2o 0.005g/l、h3bo
3 0.005g/l、na2moo4·
2h2o 0.09g/l、niso4·
6h2o 0.11g/l、na2wo4·
2h2o 0.02g/l,余量为超纯水。
[0013]1×
dl维生素溶液由以下组分组成:生物素0.002g/l、叶酸0.002g/l、盐酸吡哆醇0.01g/l、核黄素0.005g/l、泛酸0.005g/l、钴胺素0.0001g/l、对氨基苯甲酸0.005g/l、硫辛酸0.005g/l、烟酸0.005g/l、硫胺素0.005g/l,余量为超纯水。
[0014]
一种含有上述苯甲酸厌氧降解菌株的微生物制剂,包括上述苯甲酸厌氧降解菌株和能够维持或提高苯甲酸厌氧降解菌株活力的辅料。
[0015]
所述的苯甲酸厌氧降解菌株或含有苯甲酸厌氧降解菌株的微生物制剂的应用,所述的苯甲酸厌氧降解菌株或含有苯甲酸厌氧降解菌株的微生物制剂中的苯甲酸厌氧降解菌株在厌氧条件下可耦合苯甲酸盐的还原氧化fe(ⅱ),可用于环境修复。
[0016]
所述的环境修复优选为土壤修复。
[0017]
本发明相对于现有技术具有如下的优点及效果:
[0018]
(1)本发明提供了一株苯甲酸厌氧降解菌jerry
‑
yx,该菌可以在厌氧的环境中利用柠檬酸铁为电子受体降解苯甲酸钠,在土壤修复中具有广泛应用前景。
[0019]
(2)本发明的苯甲酸厌氧降解菌jerry
‑
yx或含有上述苯甲酸钠降解菌株的微生物制剂可以很好的应用于土壤修复,改善pahs对土壤的污染。
[0020]
(3)本发明的苯甲酸厌氧降解菌jerry
‑
yx含有3个苯甲酸厌氧降解相关基因,利用柠檬酸铁为电子受体厌氧降解苯甲酸时,降解效率为43%。利用该苯甲酸厌氧降解菌进行原位修复可以有效地减缓苯甲酸盐积累,促进多环芳烃的降解,在环境修复方面具有广泛的应用前景。
附图说明
[0021]
图1为水铁矿的x射线衍射仪图和jade6.0的处理结果比对pdf数据库结果图。
[0022]
图2为苯甲酸厌氧降解菌jerry
‑
yx的透射电镜图。
[0023]
图3为苯甲酸厌氧降解菌jerry
‑
yx的16srna基因系统发育树图。
[0024]
图4为苯甲酸的标准曲线图。
[0025]
图5为fe(ii)的标准曲线图。
[0026]
图6为苯甲酸厌氧降解菌jerry
‑
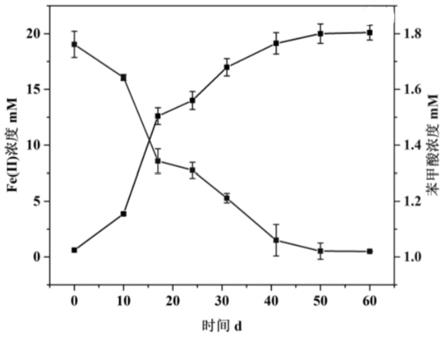
yx以柠檬酸铁为电子受体降解苯甲酸钠结果图。
具体实施方式
[0027]
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限
于此。
[0028]
培养基的配制
[0029]
100
×
nb盐混合物由以下试剂组成:kh2po
4 42g/l、k2hpo
4 22g/l、nh4cl 20g/l、kcl 38g/l、nacl 36g/l,余量为超纯水。
[0030]1×
dl维生素溶液由以下组分组成:生物素0.002g/l、叶酸0.002g/l、盐酸吡哆醇0.01g/l、核黄素0.005g/l、泛酸0.005g/l、钴胺素0.0001g/l、对氨基苯甲酸0.005g/l、硫辛酸0.005g/l、烟酸0.005g/l、硫胺素0.005g/l,余量为超纯水。
[0031]1×
nb矿物质溶液由以下组分组成:氨三乙酸三钠2.14g/l、mncl2·
4h2o 0.1g/l、feso4·
7h2o 0.3g/l、cocl2·
6h2o 0.17g/l、znso4·
7h2o 0.2g/l、cucl2·
2h2o 0.03g/l、alk(so4)2·
12h2o 0.005g/l、h3bo
3 0.005g/l、na2moo4·
2h2o 0.09g/l、niso4·
6h2o 0.11g/l、na2wo4·
2h2o 0.02g/l,余量为超纯水。
[0032]1×
dl矿物质溶液由以下组分组成:氨三乙酸三钠1.5g/l、mgso4·
7h2o 3.0g/l、mnso4·
h2o 0.5g/l、nacl 0.5g/l、feso4·
7h2o 0.1g/l、cacl
2 0.1g/l、cocl2·
6h2o 0.1g/l、znso4·
7h2o 0.1g/l、cuso4·
5h2o 0.01g/l、alk(so4)2·
12h2o 0.01g/l、h3bo
3 0.01g/l、na2moo
4 0.025g/l、nicl2·
6h2o 0.024g/l、na2wo4·
2h2o 0.025g/l,余量为超纯水。
[0033]
水铁矿的制备:取54gfecl3·
6h2o溶于300ml超纯水中,置于磁力搅拌器上搅拌至fecl3·
6h2o全部溶解,在剧烈均匀的搅拌下按每滴3s的速度滴加10m naoh至ph接近2,换成5m naoh滴至ph接近5,再换为1m naoh滴加至ph接近7.0,再搅拌30min后检查ph是否稳定,待ph稳定后避光静置悬浊液老化2
‑
4h,此时ph略微下降,再次使用1m naoh将ph调至7.0;接下来用超纯水清洗水铁矿悬浊液,在4℃下,以3000g的转速离心20min后弃去上清液,加超纯水均匀搅拌重悬铁凝胶后再次离心弃上清,重复上述清洗步骤8次,目的是去除悬浊液中的溶解的cl
‑
直至上清液电导率趋于稳定,最后一次倒掉上清液后,用200ml超纯水重悬水铁矿,即得水铁矿悬浊液,置于4℃冰箱避光保存。
[0034]
水铁矿矿物形态表征:
[0035]
将制备好的水铁矿悬浊液置于磁力搅拌器上搅拌15min至悬浊液均匀分布,取2ml水铁矿于10ml离心管中,用封口膜封住离心管口并置于
‑
80℃冰箱中快速冷冻2h,然后置于真空冷冻干燥机中(提前打开制冷开关,使温度降至
‑
40℃)冷冻干燥12h,得到水铁矿粉末样品。采用x射线衍射仪检测水铁矿粉末样品,具体操作以及参数:待测样品平铺至圆形塑料玻片上,压实样品后放入仪器的检测凹槽内。设置xrd仪器参数:increment 0.02
°
,管电压40kv,扫描区间2θ(10
‑
80
°
),t=0.2s,扫描总时长20min左右,用软件jade 6.0的处理结果比对pdf数据库,fom值低于10且值越低说明矿物成分含有的水铁矿可信度越高。
[0036]
结果如图1所示,由图1可知,水铁矿晶型较弱,但是可信度较低的都是feooh(水铁矿化学式),说明上述方法制备的水铁矿可作为富集培养基组分。
[0037]
(1)富集培养基:每1l超纯水中含有cacl2·
2h2o 0.04g、mgso4·
7h2o 0.1g、nahco
3 1.8g、na2co
3 0.43g、100
×
nb盐混合物10ml、1
×
nb矿物质溶液10ml、1
×
dl维生素溶液10ml、1mm na2seo4溶液1ml,电子供体为苯甲酸钠,电子受体为水铁矿;最终ph=6.8~7.2;其中,富集培养基中,苯甲酸钠的浓度为2mm,水铁矿中铁元素的浓度为50mm(通过测铁元素得出的浓度)。
[0038]
固体培养基通过向上述富集培养基中加入1.5%(w/v)琼脂粉制成。
[0039]
使用前将富集培养基分装到厌氧管或厌氧瓶中,充混合气(co2:n2体积比为20:80)以除去溶解氧。用胶塞和铝盖封住厌氧管管口,于121℃、20min条件下灭菌。
[0040]
(2)nbaf培养基:800ml超纯水中加入富马酸4.64g,利用naoh溶液将富马酸溶液ph调节至6.5~7.0,然后依次加入cacl2·
2h2o 0.04g,mgso4·
7h2o 0.1g,nahco
3 1.8g,na2co
3 0.43g,ch3coona
·
3h2o 2.04g,100
×
nb盐混合物10ml,1
×
nb矿物质溶液10ml,1
×
dl维生素溶液15ml,1mm na2seo
4 1ml,最后用超纯水定容到1l。
[0041]
nbaf固体培养基通过向上述nbaf培养基中加入1.5%(w/v)琼脂粉制成。
[0042]
使用前将nbaf培养基分装到厌氧管或厌氧瓶中,充混合气(co2:n2体积比为20:80)以除去溶解氧。用胶塞和铝盖封住厌氧管管口,于121℃、20min条件下灭菌。
[0043]
(3)fca培养基:称取13.7g柠檬酸铁倒入150ml沸腾的超纯水中,并用玻璃棒搅拌至全部溶解,得到柠檬酸铁溶解液;将上述柠檬酸铁溶解液加入600ml超纯水中,冷却至室温后用naoh溶液调节ph至6.0~6.5,依次加入以下成分:c6h
12
o
6 3.6g、1
×
dl维生素溶液10ml,1
×
dl矿物质溶液10ml,nahco
3 2.5g,kcl 0.6g,1mm na2seo4溶液1ml,最后用超纯水定容至1l。
[0044]
fca固体培养基通过向上述fca培养基中加入1.5%(w/v)琼脂粉制成。
[0045]
使用前将fca培养基分装到厌氧管或厌氧瓶中,充混合气(co2:n2体积比为20:80)以除去溶解氧。用胶塞和铝盖封住厌氧管管口,于121℃、20min条件下灭菌。
[0046]
(4)新鲜培养基:每1l超纯水中含有cacl2·
2h2o 0.04g、mgso4·
7h2o 0.1g、nahco
3 1.8g、na2co
3 0.43g、100
×
nb盐混合物10ml、1
×
nb矿物质溶液10ml、1
×
dl维生素溶液10ml、1mm na2seo4溶液1ml,电子供体为苯甲酸钠,电子受体为柠檬酸铁;最终ph=6.8~7.2;其中,新鲜培养基中电子供体苯甲酸钠1.8mm,电子受体柠檬酸铁50mm。
[0047]
固体培养基通过向上述新鲜培养基中加入1.5%(w/v)琼脂粉制成。
[0048]
使用前将新鲜培养基分装到厌氧管或厌氧瓶中,充混合气(co2:n2体积比为20:80)以除去溶解氧。用胶塞和铝盖封住厌氧管管口,于121℃、20min条件下灭菌。
[0049]
实施例1:苯甲酸厌氧降解菌jerry
‑
yx富集和分离
[0050]
在厌氧环境中以苯甲酸钠为唯一电子供体,以水铁矿为唯一电子受体,分离出苯甲酸厌氧降解菌jerry
‑
yx。具体的富集和分离操作如下:
[0051]
称取采集于中国甘肃庆阳市庆城县(海拔1260m,东经107.73
°
,北纬36.14
°
)的石油污染土壤样品5g,使用研钵充分研磨,取2g磨碎后的土壤加入50ml新鲜的富集培养基中,30℃恒温培养箱中避光培养,随着氧化还原反应的进行,水铁矿颜色由深红色逐渐变深最后变黑,这个过程fe(iii)被还原成fe(ii)。待fe(ii)浓度到达20mm左右,以10%(v/v)接菌量抽取富集液转移至新鲜富集培养基中;重复上述步骤四次以充分富集苯甲酸钠氧化耦合水铁矿还原的微生物菌群。
[0052]
通过平板涂布法和平板划线法进行菌株的分离。对第五次富集液用0.9%生理盐水进行梯度稀释(10
‑1、10
‑2、10
‑3、10
‑4、10
‑5),将稀释后的菌液依次均匀涂布于固体培养基上,分别做3个平行,置于厌氧工作站,30℃避光培养。当固体培养基平板上长出直径1mm左右的单菌落,用无菌牙签挑取优势单菌落至装有100μl 0.9%(w/v)nacl的pe管中重悬,反复吹打完全释放菌体后一次性转移到10ml新鲜富集培养基中,30℃避光培养,最终筛选得到苯甲酸厌氧降解菌jerry
‑
yx。
[0053]
(1)苯甲酸厌氧降解菌jerry
‑
yx菌落形态特性:
[0054]
在厌氧手套箱中将菌株jerry
‑
yx划线于nbaf固体培养基平板上,30℃避光培养7d,苯甲酸厌氧降解菌jerry
‑
yx在平板上形成明显菌落,菌落呈橘红色、圆形、湿润、凸起、边缘整齐、表面光滑。
[0055]
(2)苯甲酸厌氧降解菌jerry
‑
yx菌体形态特性
[0056]
通过透射电镜对菌株苯甲酸厌氧降解菌jerry
‑
yx细胞形态进行观察,发现菌体呈长形杆状,有多个端生鞭毛,约0.2~0.4μm宽,2.0~2.2μm长(见图2)。
[0057]
(3)苯甲酸厌氧降解菌jerry
‑
yx的基本生理生化性质
[0058]
苯甲酸厌氧降解菌jerry
‑
yx为严格厌氧菌,没有接触酶和氧化酶活性,革兰氏染色结果为阴性。在nbaf培养基中能耐受20~37℃的温度,最适生长温度30℃。培养基nacl浓度在0~1%(w/v)范围内菌株可以生长,但nacl浓度1.5%(w/v)及以上不能生长,生长最适nacl浓度0%(w/v)。
[0059]
菌株jerry
‑
yx与其近源菌株的形态和基本理化性质比较见表1。
[0060]
表1:菌株jerry
‑
yx与其近源菌株的形态和基本理化性质比较表
[0061][0062]
表中:1代表菌株jerry
‑
yx;2代表g.mentallireduences gs
‑
15
t
;3代表g.hydrogenophilus h
‑2t
;4代表g.grbiciae tacp
‑2t
;5代表g.pickeringii dsm17153
t
;6代表g.sulfurreducens pca
t
。
[0063]
从表1可以看出,与菌株jerry
‑
yx亲缘关系较近的菌株都是严格厌氧的革兰氏阴性菌,均不产生芽孢,最适生长温度30~35℃,有鞭毛的均为侧生鞭毛,只有jerry
‑
yx为端生鞭毛。研究者发现地杆菌的鞭毛对于其铁还原能力具有重要作用,鞭毛介导的细胞趋化性有助于菌株寻找到铁氧化物。
[0064]
(4)菌株jerry
‑
yx的化学分类学特征
[0065]
1)委托厦门海洋微生物菌种保藏管理中心对菌株jerry
‑
yx的脂肪酸含量进行鉴定,实验仪器为气相色谱仪(agilent6850,美国)。前期样品处理为:在fca培养基中培养菌株jerry
‑
yx至对数生长期后期,然后在室温下6000g离心10min收集菌体,用生理盐水清洗菌体1次,置于冷冻干燥机中冷冻3天,得到冻干菌体送测。而脂肪酸检测的步骤主要包括皂化、甲基化、萃取和洗涤。
[0066]
2)将菌株jerry
‑
yx与其同源性较高的模式菌株g.metallireducens gs
‑
15
t
的胞内脂肪酸含量进行分析对比(结果见表2)。鉴定结果显示,菌株jerry
‑
yx具有地杆菌属的典型化学分类学特征。
[0067]
表2:菌株jerry
‑
yx与模式菌株g.metallireducens gs
‑
15
t
的脂肪酸特征
[0068][0069]
由表2可知,菌株jerry
‑
yx有大量的直链和支链饱和脂肪酸,少量不饱和脂肪酸和羟基脂肪酸,含量最高的是c
16:1
ω7c/c
16:1
ω6c(38.7%),其次是软脂酸c
16:0
(34.1%),菌株jerry
‑
yx的c
16:0
含量和g.metallireducens gs
‑
15
t
相似,较为明显的差异是菌株jerry
‑
yx的c
14:0
含量是g.metallireducens gs
‑
15
t
的两倍。
[0070]
(5)菌株jerry
‑
yx的分子分类地位
[0071]
利用试剂盒(takara minibest dna fragment purification kit ver.4.0)提取菌株jerry
‑
yx的总dna,以提取的总dna为模板,以通用引物27f和1492r扩增菌株jerry
‑
yx的16srrna基因,将pcr扩增产物回收纯化后进行测序,所得序列在genbank中的基因登录号为cp071382。
[0072]
与其同源性较高的模式菌株g.metallireducens gs
‑
15
t
为参考,通过ncbi数据库对菌株jerry
‑
yx进行分析发现jerry
‑
yx有3种苯甲酸代谢相关的基因:wp_207162505、jzm60_15915和jzm60_06550。其中菌株jerry
‑
yx的jzm60_15915基因与g.metallireducens gs
‑
15
t
的bama基因具有85.6%的相似性,bama为烯酰辅酶a水合酶编码基因,这个基因在geobacter bemidjiensis降解苯甲酸中也有重要作用。
[0073]
利用tygs平台对菌株jerry
‑
yx进行了基于基因组序列的亲缘关系分析,结果显示,菌株jerry
‑
yx与g.metallireducens gs
‑
15
t
的相似度最高(相似度为98.2%),其次为g.hydrogenophilus h
‑2t
(相似度为98.1%)和g.grbiciae tacp
‑2t
(相似度为98.0%),与geobacter其他种的相似度低于95%。基于16s rrna基因序列构建的系统发育树(图3)显示,菌株jerry
‑
yx隶属geobacter属,与g.metallireducens gs
‑
15
t
,g.hydrogenophilus h
‑2t
和g.grbiciae tacp
‑2t
形成一个聚类。最新的菌种鉴定标准中,当分离菌种的16s rrna基因与已知菌种的相似度小于98.7%时即可认为该分离菌种为潜在新种,可见菌株jerry
‑
yx为geobacter属的潜在新种。
[0074]
为了进一步确定菌株jerry
‑
yx的分子分类地位,分析了菌株jerry
‑
yx基因组与geobacter其他种基因组之间的平均核算相似度(average nucleotide identity,ani)并进行了数字dna
‑
dna杂交(digital dna
‑
dna hybridization,dddh)计算。dddh计算是明确鉴定新菌种的重要方法,dddh>70%被认为两个基因组是同一个物种,而ani计算是另外一种常被用于鉴定细菌基因组进化亲缘关系的方法,一般ani>95%表示两个基因组为同一物种。计算结果显示,菌株jerry
‑
yx与最近菌株gs
‑
15的dddh值为35.4%(<70%),ani值为83.23%(<95%),这一结果有力地反映了菌株jerry
‑
yx是区别于已知geobacter菌种的新物种。
[0075]
综上所述,结合形态学、生理生化特征、分子生物学和化学等分类技术,确定菌株jerry
‑
yx为geobacter属的一个新种,并以最初分离培养基降解底物命名为苯甲酸厌氧降解菌(geobacter benzoelyticum)jerry
‑
yx。
[0076]
实施例2:菌株jerry
‑
yx在厌氧条件下降解苯甲酸钠的应用
[0077]
将实施例1所得到的苯甲酸降解菌株jerry
‑
yx放置30℃恒温培养箱避光培养至对数期(od
600
≈1),即得对数期苯甲酸降解菌株jerry
‑
yx菌液。
[0078]
然后按照10%(v/v)的接种量,将新鲜对数期苯甲酸降解菌株jerry
‑
yx菌液接入含有1.8mm苯甲酸钠和50mm柠檬酸铁的新鲜培养基中,每个菌株均设置三个平行;置于30℃恒温培养箱避光培养,每7天取样一次。
[0079]
利用液相色谱仪(hplc)检测苯甲酸钠降解情况,采用菲洛嗪法监测柠檬酸铁的还原情况。
[0080]
hplc检测苯甲酸钠法:苯甲酸盐的浓度通过配备wondasil c18反相柱(250mm
×
4.6mm,孔径为5μm;日本岛津公司,日本)的hplc系统测定,设置uv检测器波长为271nm,流动相为50mm,ph=4.5的乙酸钠:乙腈(体积比80%:20%),流速为1.2ml/min。制得苯甲酸标曲如图4所示。
[0081]
铁fe(ii)及fe(iii)浓度测量方法如下:
[0082]
(1)菲洛嗪溶液配制:
[0083]
1)取800ml超纯水中,溶解11.96g hepes(分子量238.3);
[0084]
2)加入1.0g菲洛嗪充分混匀,调节ph至7.0;
[0085]
3)用超纯水定容至1l,得到菲洛嗪溶液,避光存储在4℃冰箱中。
[0086]
(2)fe(ii)标准曲线配置:
[0087]
1)将硫酸亚铁铵配制成以下浓度:0、1mm、5mm、10mm、20mm、40mm、80mm;
[0088]
2)每一个浓度均用0.5m稀盐酸稀释50倍并消解15min,得到消解液;
[0089]
3)吸取0.05ml消解液加入2.45ml菲洛嗪溶液并混匀;
[0090]
4)利用酶标仪在562nm波长下测定吸光值;
[0091]
5)制作50倍稀释fe(ii)标准曲线,如图5所示;
[0092]
(3)样品中fe(ii)的测定:
[0093]
1)在含有4.9ml 0.5m盐酸中迅速加入0.1ml样品混匀,消解15min,得到消解液;
[0094]
2)吸取0.05ml消解液与2.45ml菲啰嗪溶液混匀;
[0095]
3)在562nm波长下测吸光值;
[0096]
4)带入fe(ii)标准曲线(图5),计算样品中的fe(ii)浓度。
[0097]
(4)总铁的测定:
[0098]
1)在含有4.7ml 0.5m盐酸的试管中加入0.2ml 6.25m盐酸羟胺并混匀,得到盐酸与盐酸羟胺混合液;
[0099]
2)迅速吸取0.1ml样品加上述混合液中,混匀,再置于暗处消解2h,得到消解液;水铁矿需要消解12h;
[0100]
3)吸取0.05ml消解液与2.45ml菲啰嗪溶液混匀;
[0101]
4)如有任何沉淀,需要过滤混合液;
[0102]
5)在562nm波长下测定吸光值;
[0103]
6)带入fe(ii)标准曲线(图5)进行计算。
[0104]
结果如图6所示,经过60天的反应,菌株jerry
‑
yx将苯甲酸钠含量由1.8mm降到了1.02mm,降解效率为43%,平均每天降解13μm苯甲酸钠,fe(iii)还原率为40%,平均每天还原0.33mm。前19天氧化还原体系反应速度较快,共生成12mm fe(ii),苯甲酸钠含量由最初的1.8mm被降解到了1.4mm。
[0105]
另外,发明人发现菌株jerry
‑
yx与可以维持或提高其活力的辅料混合,能够制备微生物制剂,用于降解苯甲酸。
[0106]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。