1.本发明涉及肿瘤细胞系的构建,尤其涉及胰腺癌稳转细胞系及其构建方法,本发明进一步涉及该胰腺癌稳转细胞系作为工具细胞用于胰腺癌的发生发展及转移机制、免疫治疗及其相关联合治疗、耐药原理及新药筛选方面等方面的应用,属于胰腺癌稳转细胞系及其应用领域。
背景技术:
2.胰腺癌是发生于胰腺外分泌腺的恶性肿瘤。胰腺恶性肿瘤可来自胰腺外分泌腺、内分泌腺或非上皮组织,其中95%为胰腺癌,该疾病预后最差,其发病率和死亡率很高,5年生存率不足8%。主要是使用手术、放化疗等方法治疗该疾病,但治疗效果均不尽如人意。
3.因此针对这一现状,亟需免疫治疗及其相关联合治疗等替代治疗方式的革新。而免疫治疗及其相关联合治疗等研究至关重要的环节是建立合适的肿瘤细胞系。鉴于鼠胰腺癌免疫治疗及其相关联合治疗等研究细胞系缺乏的现状,亟待需要构建胰腺癌稳转细胞系作为工具细胞应用于肿瘤病因与预防、检测试剂盒、新药研发等。
技术实现要素:
4.本发明的目的之一是提供胰腺癌稳转细胞系及其构建方法;本发明的目的之二是将所述的胰腺癌稳转细胞系作为工具细胞应用于胰腺癌的发生发展及转移机制,免疫治疗及其相关联合治疗,耐药原理及及其相关联合治疗等方面。
5.本发明首提供了胰腺癌细胞系的构建方法包括:(1)构建过表达ova基因的质粒载体;(2)将过表达ova基因的质粒载体扩增后转染到工具细胞中进行病毒包装得到病毒上清液;(3)将病毒上清液转染到目的细胞中进行筛选,得到稳定的胰腺癌细胞系。
6.作为本发明的一种优选的具体实施方案,所述的过表达ova基因的质粒载体是phs
‑
avc
‑
0700,其元件顺序为plv
‑
ef1a
‑
hluc
‑
p2a
‑
mneongreen
‑
cmv
‑
oval
‑
3xflag
‑
p2a
‑
puro。
7.作为本发明的一种优选的具体实施方案,步骤(2)中用脂质体lipofectamine3000转染法将转染将扩增得到的质粒转染到工具细胞中;其中,所述的工具细胞优选为293t。
8.作为本发明的一种优选的具体实施方案,步骤(3)中所述的目的细胞是pan02;作为本发明的一种优选的具体实施方案,步骤(3)中所述的筛选包括:将已转染的目的细胞的培养液中加入嘌呤霉素进行筛选得到稳定的小鼠胰腺癌pan02
‑
ova细胞系。
9.本发明用激光共聚焦显微镜和流式细胞仪观察得到的细胞的病毒包装水平,用小动物活体体内成像系统 ivis spectrum等证明所筛选得到的细胞系是稳定的胰腺癌pan02
‑
hluc
‑
mneongreen
‑
ova细胞系。
10.本发明将筛选得到的稳定的胰腺癌 pan02
‑
hluc
‑
mneongreen
‑
ova细胞系提交到专利认可的机构进行 保藏,其微生物保藏编号是:cgmcc no.22352,分类命名是:小 鼠胰
腺癌稳转细胞系pan02,保藏日期是:2021年6月3日,保 藏单位:中国微生物菌种保藏管理委员会普通微生物中心,保藏 地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研 究所。
11.本发明将构建的稳定的胰腺癌pan02
‑
hluc
‑
mneongreen
‑
ova细胞系接种到小鼠皮下及胰腺原位形成肿瘤;因此,本发明所构建的胰腺癌稳转细胞系能够作为工具细胞或胰腺癌细胞模型应用于研究胰腺癌的发生发展及转移机制,免疫治疗及其相关联合治疗,耐药原理及及其相关联合治疗,耐药原理及新药筛选等方面。
12.优选的,所述小鼠是c57/bl6小鼠。
13.所述胰腺癌细胞模型包括胰腺癌发生、发展或转移的细胞模型。
14.本发明建立的胰腺癌细胞系可稳定传代,成瘤性好,能适用于建立细胞模型和动物模型。本发明构建的胰腺癌细胞系可用于胰腺癌的发生发展及转移机制,免疫治疗及其相关联合治疗,耐药原理及新药筛选等的研究。将免疫制剂和其联合治疗药物施用于胰腺癌动物模型中,观察和测量动物的体重和肿瘤生长情况;施用后导致胰腺癌动物模型胰腺癌症状改善或治愈的待检测物质为用于治疗胰腺癌的候选物质。
15.本发明构建的胰腺癌细胞系具有生长速度稳定、小鼠成瘤率高等特点,为胰腺癌的研究提供良好的肿瘤模型,可作为肿瘤病因与预防、检测试剂盒、新药研发等工具细胞,助力癌症预防与治疗。
[0016] 本发明所涉及到的术语定义除非另外定义,否则本文所用的所有技术及科学术语都具有与本发明所属领域的普通技术人员通常所了解相同的含义。虽然在本发明的实践或测试中可使用与本文所述者类似或等效的任何方法、装置和材料,但现在描述优选方法、装置和材料。
[0017]
术语“多核苷酸”或“核苷酸”意指单股或双股形式的脱氧核糖核苷酸、脱氧核糖核苷、核糖核苷或核糖核苷酸及其聚合物。除非特定限制,否则所述术语涵盖含有天然核苷酸的已知类似物的核酸,所述类似物具有类似于参考核酸的结合特性并以类似于天然产生的核苷酸的方式进行代谢。除非另外特定限制,否则所述术语也意指寡核苷酸类似物,其包括pna(肽核酸)、在反义技术中所用的dna类似物(硫代磷酸酯、磷酰胺酸酯等等)。除非另外指定,否则特定核酸序列也隐含地涵盖其保守修饰的变异体(包括(但不限于)简并密码子取代)和互补序列以及明确指定的序列。特定而言,可通过产生其中一个或一个以上所选(或所有)密码子的第3位经混合碱基和/或脱氧肌苷残基取代的序列来实现简并密码子取代(batzer等人, nucleic acid res. 19:5081 (1991); ohtsuka等人, j. biol. chem. 260:2605
‑
2608 (1985); 和cassol等人, (1992); rossolini等人, mol cell. probes 8:91
‑
98 (1994))。
[0018]
术语
ꢀ“
宿主细胞”:指包含本发明多核苷酸的细胞,而不管使用何种方法 进行插入以产生重组宿主细胞,例如直接摄取、转导、f 配对或所属领域中 已知的其它方法。外源性多核苷酸可保持为例如质粒的非整合载体或者可整 合入宿主基因组中。
[0019]
术语“转染”:指病毒等微生物在宿主细胞内进行增殖或复制。
[0020]
术语“传代”:当细胞增殖达到一定密度后,则需要分离出一部分细胞 和更新营养液的过程,否则将影响细胞的继续生存。
[0021]
术语“贴壁”:当细胞悬液被接种到培养器皿后,首先要发生粘附,结 合到生长基质表面形成贴壁。
[0022]
术语“编码基因”:转录成rna的核酸序列。
[0023] 附图说明
[0024]
图1成功导入目的质粒的pan02细胞的检测结果。
[0025]
图2用激光共聚焦显微镜观察得到的胰腺癌稳转细胞系。
[0026]
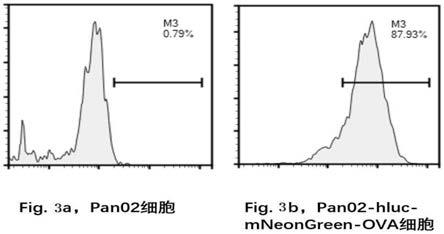
图3用流式细胞仪检测筛选得到的胰腺癌稳转细胞系。
[0027]
图4小鼠胰腺原位接种筛选得到的胰腺癌稳转细胞系得到的细胞第3天活体成像结果图。
具体实施方式
[0028]
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但是应理解所述实施例仅是范例性的,不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改或替换均落入本发明的保护范围。
[0029]
实施例1转化构建过表达oval
‑
gallus gallus等基因的质粒载体phs
‑
avc
‑ꢀ
0700,其元件顺序为plv
‑
ef1a
‑
hluc
‑
p2a
‑
mneongreen
‑
cmv
‑
oval
‑
3xflag
‑ꢀ
p2a
‑
puro。
[0030]
实施例2质粒扩增1、实验材料胰蛋白胨酵母提取物氯化钠琼脂烧杯玻璃棒容量瓶锥形瓶封口膜牛皮纸橡皮筋灭菌锅超净工作台ph计hclnaoh氨苄霉素
10cm培养皿水浴锅感受态大肠杆菌stbl3目的质粒phs
‑
avc
‑
0700包装质粒pspax2、pmd2g移液器浮漂ep管架摇床涂布玻璃棒离心管长镊吸水纸tiangen无内毒素质粒小提中量试剂盒2、实验步骤2.1 lb培养基配制s1、用天平称取胰蛋白胨10g,酵母提取物5g,氯化钠10g于一个洁净的烧杯内,加适量的电导率为18.25 mω.cm的超纯水溶解,然后将此烧杯内的混合液转移至1000ml容量瓶中,烧杯和玻璃棒用前述的超纯水润洗2
‑
3次后将润洗液转移至容量瓶内,用超纯水定容容量瓶内液体至1000ml;s2、将s1配制得到的lb培养基分装700ml至一个洁净的1000ml试剂瓶(用于后续提取质粒);剩余300ml转移至一个洁净的500ml锥形瓶(用于铺平板),加入4.5g琼脂;用封口膜封口、牛皮纸包覆瓶口、橡皮筋扎牢前述试剂瓶和锥形瓶后,将其放置于高压蒸汽灭菌锅内以121℃、20min灭菌后转移至超净工作台,用ph计测量培养基的ph,用hcl和naoh调整培养基的ph至7.40;s3、超净台内操作:琼脂lb培养基温度降至40℃
ꢀ‑
50℃,加入300μl氨苄霉素溶液(100mg/ml)并混匀,然后取10个洁净的直径10cm培养皿,每个培养皿倒入约15ml琼脂lb培养基,待其冷却凝固后用封口膜把培养皿封口,然后放4℃冰箱待用;2.2 质粒扩增s1、准备一盒冰,同时打开水浴锅,设置为42℃;s2、从
‑
80℃冰箱取出4管感受态大肠杆菌stbl3,插置于冰中融化,在管上标记待扩增的目的质粒phs
‑
avc
‑
0700和包装质粒pspax2、pmd2g的名称;s3、超净台内操作:目的质粒、包装质粒每管各取2.5微升(100
‑
500ng)到感受态大肠杆菌stbl3,1000μl移液器吸头充分混合吹打均匀,盖上盖子后用封口膜封口;s4、将s3加入质粒的感受态大肠杆菌stbl3插置于冰中20
‑
30min;s5、将s4得到的样品用浮漂扎牢后放42℃水浴锅热激60
‑
90s;s6、随后立刻将s5得到的样品转移插置于冰中3
‑
5min;s7、超净台内操作:往s6得到的每个样品管中加入700μl lb培养基,盖紧盖子,用封口膜封口包紧样品管;
s8、把s7得到的样品管放置于浮漂上,然后倒扣在一个ep管架上,用橡皮筋捆扎牢固,横向置于摇床,37℃、200rpm、40
‑
60min扩增质粒;s9、超净台内操作:取4个琼脂lb培养皿平板标记(质粒名称等信息)后,撕去封口膜,用1000μl移液器吸头吹打混匀s8得到的样品,然后吸取500μl样品弃去,吸取400μl的lb培养基到样品管后吹打混匀,用移液器吸取600μl样品加到对应标记的琼脂lb培养皿平板,用涂布玻璃棒将培养皿内的样品在琼脂lb培养基上铺匀;s10、上述4个培养皿都按照s9步骤铺好对应样品后,半开培养皿盖子,超净台内自然吹风至样品至“似干未干”状态(约5
‑
10min),合上培养皿盖子,然后将培养皿转移至37℃培养箱,倒扣放置培养过夜12
‑
16h取出培养皿,可见每皿琼脂lb培养基上长有均匀的白色针尖样大小的菌落;s11、准备8个洁净的50ml离心管,按质粒名称标记离心管管身及盖子(每种质粒2管),每管加入15ml的lb培养基及 15μl氨苄霉素溶液(100mg/ml),盖上盖子充分混匀;s12、挑大肠杆菌:取一个长镊,在酒精灯外焰充分灼烧长镊的头部灭菌,冷却10秒左右,用长镊夹持一个10μl吸头的尾部,一手拿s10得到的培养皿对光,透着光线用吸头的头部挑取1个菌落,然后把含菌落的吸头置入s11得到的对应的50ml离心管,拧紧盖子后回旋半圈盖子,上述8个离心管用相同步骤都处理好后放于摇床上,离心管稍倾斜放置,37℃、200rpm摇12
‑
16h;s13、取出s12得到的含有样品的离心管,将离心管拧紧盖子,3000rpm,10min离心后,弃去上清,然后将离心管室温下倒扣在洁净吸水纸上20
‑
30秒使管内上清尽可能充分引出;s14、提取质粒:使用tiangen无内毒素质粒小提中量试剂盒从s13得到的菌体沉淀中提取目的质粒phs
‑
avc
‑
0700、包装质粒pspax2、pmd2g,并测得其浓度:目的质粒phs
‑
avc
‑
0700=927.4ng/μl, 包装质粒pspax2=1907.7 ng/μl、pmd2g =841.5ng/μl。
[0031]
实施例3病毒包装1、实验材料超净台提前复苏传代在6孔板的293t细胞(汇合度为70%
‑
90%)thermo fisher脂质体lipofectamine3000试剂盒目的质粒phs
‑
avc
‑
0700包装质粒pspax2、pmd2g移液器及吸头1.5ml洁净离心管细胞培养6孔板细胞培养箱dmem基础培养基dmem完全培养基2、实验步骤(细胞间超净台内操作)s1、转染工具细胞293t:每份体系:
在1.5ml离心管内配制:管1:125μl的dmem基础培养基 7.5μl lipofectamine3000管2:125μl的dmem基础培养基 2.5μg的dna 5μl的p3000其中,管2的dna中目的质粒phs
‑
avc
‑
0700:包装质粒pspax2:包装质粒pmd2g质量比=6:4.5:1.5;将管1、2分别室温孵育5min,然后将管1、2混合在一起室温孵育10
‑
15min。
[0032]
孵育的同时,用1.75ml的dmem基础培养基给293t细胞换液。
[0033]
管1、2混合液(dna
‑
脂质体复合物)孵育完毕后,将dna
‑
脂质体复合物用移液器吸取后小心逐滴滴加到293t细胞中,放入培养箱37℃、5%co2加湿培养箱中培养。s2、培养12h后换dmem完全培养基2ml。
[0034]
实施例4转染目的细胞1、实验材料超净台移液器及吸头细胞培养6孔板15ml离心管细胞培养箱dmem完全培养基10ml注射器孔径为0.45μm的滤膜提前复苏传代的pan02细胞(汇合度为70%
‑
80%)感染增强剂polybrene(1000
×
)2、实验步骤(细胞间超净台内操作)s1、48小时后收集培养液上清(含有病毒),用10ml注射器吸取上清、0.45μm的滤膜过滤上清除去细胞碎片等杂质,将上清收集至15ml离心管;s2、往每个15ml离心管内上清中加入1/10体积的dmem新鲜培养液,加入2.2μl的感染增强剂polybrene,然后用移液器吹打混匀;s3、取出待转染贴壁汇合度为70%
‑
80%的目的细胞pan02,观察细胞状态。吸弃培养皿内的原有液体,每个培养皿加入s2所得混合液,在培养皿上标记后放置于37℃,5% co2加湿培养箱内培养12h,然后换新鲜dmem培养液2ml置于培养箱中培养;s4、s3换液36h后,观察导入质粒的目的细胞及未导质粒的正常同种细胞生长状态,每孔1:2传代后置于培养箱内37℃,5% co2培养。
[0035]
实施例5胰腺癌稳转细胞系pan02
‑
ova细胞系的筛选1、实验材料嘌呤霉素溶液(5mg/ml)移液器及吸头10cm培养皿15ml离心管细胞培养箱
dmem完全培养基2、实验方法及实验结果s1、之前的预实验:嘌呤霉素溶液杀伤未导入目的质粒的目的细胞pan02,得知最小全部致死浓度为1.75μg/ml;s2、实施例4步骤s3换液36h后,观察导入质粒的目的细胞及未导质粒的正常同种细胞(对照细胞)生长状态,每孔用含2.00μg/ml嘌呤霉素的dmem培养基传代置于37℃,5%co2加湿培养箱内培养。每隔24h换一次含有2.00μg/ml嘌呤霉素溶液的dmem培养液,待对照细胞全部死亡后,再将导入质粒的目的细胞pan02用含有2.00μg/ml嘌呤霉素溶液的dmem培养液传代筛选5次后,可见培养皿中的已成功导入目的质粒的pan02细胞都具有了puro抗性。
[0036]
根据图1的检测结果可见,pan02细胞已成功导入目的质粒。
[0037]
实施例6胰腺癌稳转细胞系pan02
‑
ova细胞系的检测和对比未转染病毒的同种目的细胞用激光共聚焦显微镜和流式细胞仪观察实施例5得到的细胞其病毒包装水平。
[0038]
用激光共聚焦显微镜观察实施例5构建得到的细胞,结果见根据图2可见视野内几乎所有细胞都可见绿色荧光,说明说明慢病毒将mneongreen基因成功转染到pan02细胞中。
[0039]
用流式细胞仪检测实施例5得到的细胞:用flag流式抗体染色,流式细胞仪检测,对比未转染病毒的同种目的细胞pan02,pan02
‑
hluc
‑
mneongreen
‑
ova细胞中表达flag基因(与ova基因在同一启动子之下,可以反映ova基因的表达水平)的阳性细胞达到87.93%,表明pan02
‑
hluc
‑
mneongreen
‑
ova细胞可以稳定表达ova(图3)。
[0040]
实施例7胰腺癌稳转细胞系的成瘤试验将实施例5得到的pan02
‑
hluc
‑
mneongreen
‑
ova细胞,将其6
×
104个细胞用pbs重悬后与基质胶1:1混合后接种到c57/bl6小鼠胰腺原位形成肿瘤,图4是小鼠胰腺原位接种s5得到的细胞第3天活体成像结果图。
[0041]
最后应说明的是:以上所述仅为本发明的优选内容而已,并不用于限制本发明,尽管参照前述内容对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各内容所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。