1.本发明涉及脂肪干细胞分离技术领域,具体地,涉及一种从脂肪中分离提取冻存脂肪干细胞的方法。
背景技术:
2.脂肪干细胞(adipose
‑
derived stem cells,adscs)、adsc多能细胞是近年来从脂肪组织中分离得到的一种具有多向分化潜能的干细胞。主要作用是:恢复组织细胞的修复功能,促进细胞的再生,恢复年轻面容的同时,身体机能也得到充分改善,有效改善亚健康、早衰等疾病,由内而外真正的有效抵抗衰老。
3.传统的脂肪移植手段由于存在免疫排斥、炎症反应等缺陷难以得到让人满意的疗效。据统计,自体脂肪组织移植到缺损部位后,通常其中40
‑
60%会被吸收。通过患者自身的脂肪组织内的干细胞,来构建具有完整生物学结构和功能的脂肪组织无疑是解决这一问题的最佳方案。如何实现干细胞到脂肪细胞的分化,是构建脂肪组织不可回避的问题。早在2001年,zuk等人发现脂肪干细胞以来,就已经证明脂肪干细胞具有向脂肪、软骨、成骨、成肌等多向分化潜能。
4.传统的成脂诱导分化采用方法是混合诱导剂法,用到成脂诱导剂具有一定毒性,对人体有较大的危害。
5.且现有的共培养方式主要采用体外诱导干细胞,而在培养过程中容易产生杂细胞,整个培养过程效率低下。
技术实现要素:
6.为解决上述问题之一,本发明提供了一种从脂肪中分离提取冻存脂肪干细胞的方法,采用复合酶制剂对肉糜状脂肪颗粒进行充分振荡消化,提高脂肪干细胞的分离效率,从而解决了现有从脂肪中分离提取脂肪干细胞过程中,存在的培养效率低等技术问题。
7.一种从脂肪中分离提取冻存脂肪干细胞的方法,包括以下操作步骤:
8.将脂肪组织预处理成肉糜状脂肪颗粒,加入由胶原酶iv和胰蛋白酶组成的复合酶制剂后,在35
‑
38℃的温度条件下振荡15
‑
30min,收集细胞悬液,去掉细胞上清,即得脂肪干细胞。
9.本技术通过对脂肪干细胞的分离提取操作中,消化操作步骤进行创造性改进,采用复合酶制剂,在酶活性的作用下进行充分消化,以达到将脂肪干细胞从脂肪组织中充分分离。
10.其中,脂肪组织在采用复合酶制剂进行消化操作之前,需要将脂肪组织处理成肉糜状的脂肪颗粒,该处理操作可充分将脂肪干细胞和胶原酶裸露出来,从而增加脂肪干细胞与培养液的接触面积,促使脂肪干细胞的体外扩增。
11.在本技术中,肉糜状脂肪颗粒振荡消化温度是在35
‑
38℃,此时酶活性最高,利于消化完全,且消化采用振荡消化的方式,消化时间仅需要15
‑
30min,极大的提高了消化效
率,也进一步加快了下一步脂肪干细胞的培养效率。
12.可选地,所述胶原酶iv的浓度为0.03%
‑
0.05%,所述胰蛋白酶的浓度为0.3%
‑
0.5%,所述胶原酶iv和所述胰蛋白酶按照体积比1:1混匀,即得复合酶制剂。
13.细胞间的物质主要是蛋白质和胶原纤维,胰蛋白酶又称胰酶,可以水解细胞间蛋白质,使细胞分散出来。胶原酶iv是唯一一种可以降解具有三股超螺旋结构的天然胶原纤维的蛋白酶,这种胶原纤维广泛存在结缔组织内。通过胶原酶iv水解细胞间质的胶原纤维使细胞游离出来。
14.其中,所述胶原酶制剂中胶原酶iv的浓度为0.03%
‑
0.05%,胰蛋白酶的浓度为0.3%
‑
0.5%,且所述胶原酶iv和所述胰蛋白酶按照体积比1:1配比,混匀而得。其中胶原酶iv的浓度设置,可对脂肪间隔胶原组织进行消化,避免脂肪组织的胶原组织或者一些筋膜组织的消化效果不好,从而影响脂肪干细胞的分离效率。
15.其中,所述胰蛋白酶浓度的选择,胰蛋白酶是胰腺的外分泌部分泌的,在小肠里对蛋白质消化有着无法替代的作用。胰蛋白酶可用于对脂肪组织中脂肪干细胞的分离,使贴壁生长的细胞脱落。因此,脂肪干细胞从肉糜状脂肪颗粒中分离出来起到协同作用。胶原酶iv和胰蛋白酶相互共同作用提高对肉糜状脂肪颗粒的消化作用,提高脂肪干细胞的分离效率。
16.可选地,振荡的频率为50
‑
100r/min。
17.可选地,脂肪颗粒振荡结束后,加入dmem/f12培养液的上清液混匀后,用生理盐水洗涤,并将洗涤液转移到离心管中,收集细胞悬液,去掉上清液,即得脂肪干细胞。
18.可选地,将脂肪组织预处理成肉糜状颗粒的具体操作为:
19.在废弃的脂肪组织中,加入生理盐水,晃动,然后将生理盐水移去,将脂肪组织用无菌眼科剪剪碎成肉糜状脂肪颗粒。
20.本技术中脂肪组织一般采用的是废弃的脂肪组织,可是医院抽脂手术中废弃的脂肪,可实现废物的重复利用;另外,该废弃的脂肪组织,经简单生理盐水和含青链霉素的无菌蒸馏水清洗后就可直接使用,整个处理步骤简单。
21.在经过生理盐水的处理后,在采用无菌眼科剪将脂肪组织剪碎成肉糜状脂肪颗粒,利于脂肪干细胞的充分裸露,脂肪干细胞与培养液的接触面进一步增大,不仅利于脂肪干细胞从脂肪组织中分离,同时利于脂肪干细胞的体外扩增。
22.可选地,所述脂肪颗粒与复合酶制剂体积比为50:1。这里所述的脂肪颗粒为用眼科手术剪处理成肉糜状脂肪颗粒,呈流体状。
23.可选地,脂肪颗粒加入复合酶制剂后,振荡消化30min。
24.可选地,所述脂肪颗粒振荡在振荡消化箱中进行。
25.可选地,将获得的脂肪干细胞加入dmem/f12培养基,使细胞分散后,加入由dmso、右旋糖酐、dmem/f12培养液和白蛋白组成的冻存保护液,获得细胞悬浮液。
26.可选地,所述dmso质量浓度为30%,所述右旋糖酐的质量浓度为20%,所述dmem/f12培养液的质量浓度为40%,所述白蛋白的质量浓度为10%,所述冻存保护液中dmso、右旋糖酐、dmem/f12培养液、白蛋白的体积配比为3:2:4:1。
27.其中,dmso作为一种冻存保护剂,加入后可以使溶液冰点降低,在缓慢冻结条件下,细胞内的水分透出,减少了冰晶的形成,从而避免细胞的形成,从而避免细胞的损伤,采
用慢冻快融的方法,能较好的保证细胞的存活。
28.其中,右旋糖酐属于非渗透性抗冻剂,能溶于水,但不能进入细胞,使溶液呈过冷状态,可在特定温度下降低溶质浓度,从而起到保护作用,由于其分子量大,分子浓度低,对溶剂的活性作用很小,能降低溶液中低分子溶质浓度,减轻盐损伤,慢速冷冻效果好,对快速冷冻无保护作用。
29.即dmso作为细胞内保护剂、右旋糖酐作为细胞外保护剂,二者共同来保护细胞的活性,防止细胞在解冻的时候重新形成结晶,而影响细胞的活性。
30.dmem/f12培养液作为一种冻存保护液,可有效降低细胞内外渗透压不平衡的产生。
31.白蛋白作为一种非渗透性保护剂不能渗透内,白蛋白作为一种大分子物质,可优先与溶液中的水分子结合,降低自由水的含量,使冰点降低,减少水晶的形成;同时,由于分子量大,使溶液中的电解质浓度降低,减轻了对脂肪干细胞的损伤。
32.本技术方案中采用由dmso、右旋糖酐、dmem/f12培养液、白蛋白组成的冻存保护液,该冻存保护液无论从种类的组成,以及比例的设定,均进行了科学性、合理性的筛选,渗透性保护剂和非渗透性保护剂相结合,渗透性保护剂可渗入到细胞内,从而保护细胞免受高浓度电解质的损伤,避免水分外渗,造成细胞脱水皱缩;非渗透性保护剂,不能渗入到细胞内,可降低自由水的含量,使溶液中电解质浓度降低,减轻对溶质损伤。即从细胞内、细胞外对细胞进行保护,保存细胞的活力。
33.通过采用上述技术方案,本发明具有以下技术效果:
34.1)本技术中通过将脂肪组织处理成肉糜状脂肪颗粒,然后经过复合酶制剂的振荡消化15
‑
30min,处理成肉糜状颗粒可使脂肪干细胞与复合酶制剂充分接触,振荡消化,则脂肪组织中脂肪干细胞分离出来。
35.2)本技术中,采用由dmso、右旋糖酐和dmem/f12培养液、白蛋白组成的冻存保护液,且dmso质量浓度为30%,右旋糖酐的质量浓度为20%,dmem/f12培养液的质量浓度为40%,白蛋白的质量浓度为10%,可对分离提取后的脂肪干细胞进行有效冻存,提高脂肪干细胞的活性。
36.3)本技术中用于脂肪干细胞提取的脂肪来源可为废弃的脂肪,如此可实现废物利用,且废弃脂肪经简单生理盐水、含青链霉素的无菌蒸馏水清洗后直接使用,降低了脂肪干细胞的生产成本。
附图说明
37.图1为本发明实施例1中分离提取的脂肪干细胞培养11天p1代的显微镜图;
38.图2为本发明实施例1中分离提取得到原代脂肪干细胞培养12天p1代的显微镜图;
39.图3为本发明实施例1中分离提取得到原代脂肪干细胞培养14天p2代的显微镜图
40.图4为本发明实施例1中分离提取得到原代脂肪干细胞培养23天p6代的显微镜图;
41.图5为本发明实施例1中分离提取得到原代脂肪干细胞培养32天p8代的显微镜图;
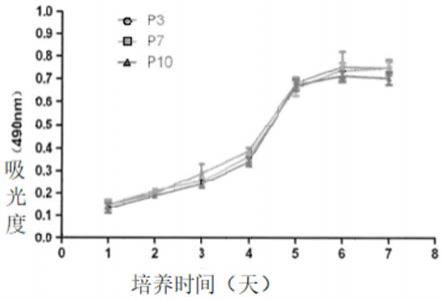
42.图6为本发明中实施例1中脂肪干细胞的生长曲线图;
43.图7为本发明中实施例1中脂肪干细胞的细胞周期图;
44.图8为本发明中实施例1中脂肪干细胞的流式结果图。
具体实施方式
45.为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明中的说明书附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
46.在本文中提及“实施例”意味着,结合实施例描述的特定特征、结构或特性可以包含在本发明的至少一个实施例中。在说明书中的各个位置出现该短语并不一定均是指相同的实施例,也不是与其它实施例互斥的独立的或备选的实施例。本领域技术人员显式地和隐式地理解的是,本文所描述的实施例可以与其它实施例相结合。
47.实施例1:
48.将美容医院抽脂手术中废弃的脂肪,采用眼科手术剪剪成肉糜状脂肪颗粒,100ml肉糜状脂肪颗粒中加入0.04%的胶原酶iv1ml、0.4%胰蛋白酶1ml进行消化,在37℃下振荡消化30min,振荡频率为100r/min,加入dmem/f12培养液上清混匀,用生理盐水洗涤,并将洗涤液转移到离心管中,去掉细胞上清,即得脂肪干细胞。
49.将获得的脂肪干细胞加入质量浓度为30%的dmso、质量浓度为20%的右旋糖酐、质量浓度为40%的dmem/f12培养液、质量浓度为10%白蛋白组成的冻存保护液,获得细胞悬液。
50.实施例2:
51.将美容医院抽脂手术中废弃的脂肪,采用眼科手术剪剪成肉糜状脂肪颗粒,100ml肉糜状脂肪颗粒中加入0.05%胶原酶iv 1ml、0.5%胰蛋白酶1ml进行消化,在38℃下振荡消化20min,振荡频率为80r/min,加入dmem/f12培养液上清混匀,用生理盐水洗涤,并将洗涤液转移到离心管中,去掉细胞上清,即得脂肪干细胞。
52.将获得的脂肪干细胞加入质量浓度为30%的dmso、质量浓度为20%的右旋糖酐、质量浓度为40%的dmem/f12培养液、质量浓度为10%白蛋白组成的冻存保护液,获得细胞悬液。
53.实施例3:
54.将美容医院抽脂手术中废弃的脂肪,采用眼科手术剪剪成肉糜状脂肪颗粒,100ml肉糜状脂肪颗粒中加入0.03%胶原酶iv 1ml、0.3%胰蛋白酶1ml进行消化,在35℃下振荡消化15min,振荡频率为50r/min,加入dmem/f12培养液上清混匀,用生理盐水洗涤,并将洗涤液转移到离心管中,去掉细胞上清,即得脂肪干细胞。
55.将获得的脂肪干细胞加入质量浓度为30%的dmso、质量浓度为20%的右旋糖酐、质量浓度为40%的dmem/f12培养液、质量浓度为10%白蛋白组成的冻存保护液,获得细胞悬液。
56.对比实施例1:
57.与实施例1的区别在于:采用的消化酶为胶原酶i,其余条件不变,获得脂肪干细胞。
58.对比实施例2:
59.与实施例1的区别在于:采用的消化酶为胰蛋白酶,其余条件不变,获得脂肪干细胞。
60.对比实施例3:
61.与实施例1的区别在于:采用冻存保护液为由质量浓度为30%的dmso、质量浓度为20%的右旋糖酐组成。其余条件不变,获得脂肪干细胞。
62.对比实施例4:
63.与实施例1的区别在于:采用冻存保护液为由质量浓度为20%的右旋糖酐、质量浓度为40%的dmem/f12培养液组成。其余条件不变,获得脂肪干细胞。
64.对比实施例5:
65.与实施例1的区别在于:采用冻存保护液为质量浓度为10%的白蛋白,其余条件不变,获得脂肪干细胞。
66.1、对实施例1制备获得脂肪干细胞进行形态学观察
67.实施例1制备获得的脂肪干细胞培养1天后,全量换液1次,丢掉未贴壁细胞,显微镜下观察见细胞贴附于培养瓶壁,呈圆形,椭圆形且少量短梭形,脂肪小滴且明显减少。3天后再换液,观察脂肪干细胞呈梭型,脂肪小滴基本消失。随着换液次数的增加,细胞增殖速度加快,细胞形态逐渐均一,排列趋于方向性,呈长梭型。
68.2、将实施例1分离提取的脂肪干细胞培养11天、12天、14天、23天、32天,显微镜下图,分别如图1、图2、图3、图4、图5所示。
69.3、将实施例1、对比实施例1、对比实施例2中分离提取的脂肪干细胞进行培养,培养的数量对比如下表1
‑
表3所示,其中,表1为实施例1脂肪干细胞培养数量,表2为对比实施例1脂肪干细胞培养数量,表3为对比实施例2脂肪干细胞培养数量。
[0070][0071]
表1
[0072][0073]
表2
[0074]
[0075][0076]
表3
[0077]
综合分析可得:1)实施例1制备获得脂肪干细胞,与对比实施例1、对比实施例2制备获得的脂肪干细胞在进行细胞培养时,可见,在培养相同代数的情况下,从收获细胞个数、扩增倍数、总收获细胞个数、总扩增倍数来看,对比实施例1、对比实施例2的数量均明显低于实施例1。
[0078]
2)可见,实施例1采用复合酶制剂由胶原酶iv、胰蛋白酶制成,相对于只采用胶原酶iv或胰蛋白酶,在对已预处理成肉糜状脂肪颗粒进行充分消化,在消化效率上,复合酶制剂明显优于采用单一的胶原酶iv或胰蛋白酶,使肉糜状脂肪颗粒中的脂肪细胞充分分离提取出来。
[0079]
综合上述分析可知,该方法不仅分离效率高,且分离出来的脂肪干细胞具有强大的增殖能力。
[0080]
4、对实施例1获得的脂肪干细胞动力学检测
[0081]
采用mtt法,培养第1
‑
3天处于生长适应期,在第6天达到一个生长高峰,7天以后生长明显减缓,如图6所示,不同代数之间的增殖情况没有明显的差异,说明我们该方法得到的脂肪干细胞具有强大稳定性。
[0082]
5、对实施例1获得的脂肪干细胞周期检测
[0083]
采用流式检测方法,对实施例1制备获得脂肪干细胞进行检测,结果显示脂肪干细胞90%处于静止期,10%处于活跃期,第8代细胞仍有88%处于静止期,12%处于活跃期,如图7所示,表明该方法获得的脂肪干细胞分裂增殖能力稳定。
[0084]
6、对实施例1获得的脂肪干细胞流式表型检测
[0085]
如图8所示,对实施例1获得的脂肪干细胞进行流式细胞仪检测,结果显示,脂肪干细胞高表达cd29,cd73,cd105,cd166,阳性率分别为91.95%,91.08%,99.14%,99.90%,低表达cd31,cd34,cd45,hla
‑
dr,阴性率分别为0.26%,1.28%,1.12%,0.01%。
[0086]
7、将实施例1、对比实施例3、对比实施例4、对比实施例5的细胞活性进行比较:
[0087]
实施例1相对于对比实施例3、对比实施例4、对比实施例5,细胞存活率明显提升,且脂肪干细胞的形态也保持的更好,可见,由dmso、右旋糖酐和dmem/f12培养液和白蛋白组成的冻存保护液,相对于由质量浓度为30%的dmso、质量浓度为20%的右旋糖酐组成的冻存保护液或由质量浓度为20%的右旋糖酐、质量浓度为40%的dmem/f12培养液或质量浓度为10%白蛋白组成的冻存保护液,更能有效保持脂肪干细胞活性、提高脂肪干细胞存活率,减少甚至避免机械性损伤,具有良好的冻存效果。
[0088]
综上所述,本技术提供的从脂肪中分离提取冻存脂肪干细胞的方法,简单可靠,且所获得的脂肪干细胞具有贴壁生长、增殖能力强、扩增能力强、细胞表型稳定、活性强等优质特性。
[0089]
最后应说明的是:本发明实施例公开的仅为本发明较佳实施例而已,仅用于说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解;其依然可以对前述各项实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或替换,并不使相应的技术方案的本质脱离本发明各项实施例技术方案的精神和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。