α
‑
乳白蛋白小分子量水解物、其制备方法和降尿酸的应用
技术领域
1.本发明属于食品和药品技术领域,具体地说,是关于一种具有降尿酸及肾脏保护功能的α
‑
乳白蛋白(α
‑
lactalbumin)的小分子量水解物其制备方法和降尿酸的应用。
背景技术:
2.高尿酸血症是由嘌呤代谢紊乱以及尿酸排泄出现障碍而导致的疾病。近年来,随着人们生活水平的提高和不当的饮食习惯,我国的高尿酸血症的发病率逐年上升,2017年我国具有1.7亿高尿酸血症患者。人体长期血清尿酸过多会引发尿酸性肾结石、痛风,甚至导致肾脏炎症,高脂血症、高血压、二型糖尿病、心血管疾病,严重危害人类健康。
3.体内尿酸由嘌呤经代谢产生,其中黄嘌呤氧化酶(xo)起重要作用,次黄嘌呤在xo作用下生成黄嘌呤,然后生成尿酸。而尿酸在人体的排泄分为肾脏排泄(2/3)和肠道排泄(1/3)。现有的治疗高尿酸血症的药物也针对于尿酸的生成及排泄途径,如别嘌醇和非布索坦是xo的强力抑制剂,能够有效减少体内尿酸的产生;苯溴马隆和丙磺舒能够抑制肾小管对尿酸的重吸收,以增加尿酸的排泄来降低血尿酸的水平。而现有的这些药物虽能具有良好的降尿酸效果,但是具有较大的副作用,服用后会导致腹泻腹痛,肝功能损伤,肾功能损伤,头痛等症状,不能够长期服用。研发新型、低毒的高尿酸血症治疗药物,或能够改善高尿酸血症的功能食品及保健品,依旧是该领域的研究热点。其中具有降尿酸功能的食源性生物活性肽,因为其天然、低毒和来源广泛的特点,受到关注。
技术实现要素:
4.本技术的发明人在研究α
‑
乳白蛋白(α
‑
lactalbumin)的过程中惊奇地发现,α
‑
乳白蛋白小分子量水解物具有降尿酸及肾脏保护功能,可用于开发具有此类功能的功能食品或保健品。
5.因此,本发明的第一个目的,在于提供一种α
‑
乳白蛋白小分子量水解物,其分子量<1500da。
6.本发明的第二个方面,提供了所述α
‑
乳白蛋白小分子量水解物的制备方法,通过以下步骤得到:
7.依次以胃蛋白酶和胰酶对α
‑
乳白蛋白进行水解,然后对水解产物进行超滤分离,最后通过葡聚糖凝胶色谱,得到小分子量的α
‑
乳白蛋白水解物。
8.根据本发明的优选实施例,所述胃蛋白酶水解的条件为:调节α
‑
乳白蛋白水溶液至ph 1.5~2.5,加入胃蛋白酶,在温度35~40℃和转速150~200rpm的条件下酶解2~4小时。
9.根据本发明的优选实施例,所述胰酶水解的条件为:调节胃蛋白酶的水解液至ph 6.5~7.5的条件下,加入胰酶,在温度35~40℃和转速150~200rpm的条件下酶解3~5小时。
10.根据本发明的优选实施例,所述超滤分离是将胰酶水解液通过滤径为3kda的超滤
管进行超滤。
11.根据本发明的优选实施例,所述葡聚糖胶色谱是将超滤分离得到的滤液通过葡聚糖凝胶g15和g25进行进一步分离。
12.根据本发明的优选实施例,所述胰酶水解结束后以及超滤分离前还包括将胰酶水解液体系ph调至6.5~7.5、于90~100℃水浴灭活的步骤。
13.根据本发明的优选实施例,所述葡聚糖胶色谱得到小分子量水解液进一步进行冷冻干燥,得到粉末状α
‑
乳白蛋白小分子量水解物。
14.本发明的第三个方面,提供了上述的α
‑
乳白蛋白小分子量水解物用于制备黄嘌呤氧化酶抑制剂的应用。
15.本发明的第四个方面,提供了上述的α
‑
乳白蛋白小分子量水解物用于制备降尿酸的功能食品或保健品的应用。
16.本发明的第五个方面,提供了上述的α
‑
乳白蛋白小分子量水解物用于制备肾脏保健用功能食品或保健品的应用。
17.本发明的α
‑
乳白蛋白小分子量水解物具有降尿酸和减轻高尿酸血症引起的肾脏损伤的效果,在治疗和预防高尿酸血症的保健品和药物等方面具有良好的潜力和应用前景。
附图说明
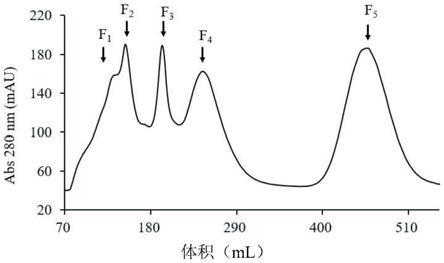
18.图1为实施例1的水解液葡聚糖凝胶色谱图。
19.图2显示了实施例4的各组小鼠的肾脏病理切片。
20.图3
‑
图5分别显示了实施例5中各实验组对阴离子转运体1(urat1)、葡萄糖转运体9(glut9)以及有机阴离子转运体1(oat1)的表达水平的影响。
21.图6和图7分别为实施例6中各实验组小鼠肠道微生物的主成分分析(pca)图和门水平物种丰度热图。
22.图8显示了实施例6中在科水平对一些相对丰度较高的muribaculaceae菌科和普雷沃氏菌科(prevotellaceae)进行分析的结果。
23.图9分别显示了实施例6中各实验组的高尿酸模型小鼠肠道的alistipes菌属、parabacteroides菌属和螺杆菌属(helicobacter)三种菌属的相对丰度。
24.图10分别显示了各实验中组的小鼠肠道微生物中的拟杆菌属(bacteroides)、罗斯氏菌属(roseburia)、rikenellaceae_rc9_gut_group和ruminococcaceae_ucg
‑
014进行丰度分析的结果。
具体实施方式
25.下面结合附图,以具体实施例对本发明的技术方案进行清楚、完整地描述。应理解,所描述的实施例仅是本发明的一部分实施例,而不是全部的实施例。基于本发明的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明的范围。
26.以下实施例中,体外xo抑制活性的测定原理和方法如下:
27.体外xo抑制活性的测定原理为:黄嘌呤为底物,在xo的催化作用下可以生成在
290nm处具有特定吸收的尿酸,通过酶标仪测定尿酸的含量从而测定xo的活性。当xo抑制剂存在时,xo活性被抑制导致尿酸的生成减少,通过计算尿酸减少的量计算抑制活性。
28.具体的测定步骤为:以96孔板为反应器,进行a、b两组实验,a组加入50μl的xo溶液(100mu/ml,溶解于ph 7.0,20mm的pbs中)与50μl的待测样品(空白对照为50μl的去离子水),b组加入50μl的pbs溶液(ph 7.0,20mm)与50μl的待测样品(空白对照为50μl的去离子水),在37℃孵育5min,然后加入25μl的黄嘌呤溶液(浓度为0.5mm,溶解于上述pbs缓冲液中),37℃反应30min,反应结束加入25μl 0.5m的hcl终止反应。之后通过酶标仪测定290nm处的吸光值。xo抑制率(x)按下式计算:
29.x=[(od
a对照
–
od
b对照
)
‑
(od
a实验
–
od
b实验
)]/(od
a对照
–
od
b对照
)
×
100%。
[0030]
式中:x为xo抑制率(%),od
a对照
为空白对照的a组吸光值,od
b对照
为空白对照的b组吸光值,oda
实验
为实验组的a组吸光值,odb
实验
为实验组的b组吸光值。
[0031]
在本发明以下实施例中,依次利用胃蛋白酶和胰酶对α
‑
乳白蛋白进行水解,再对水解产物进行逐步分离,得到分子量<1500da的小分子量组分,该组分在体外对黄嘌呤氧化酶具有显著抑制作用,在2mg/ml浓度时对黄嘌呤氧化酶抑制率达90.0%。
[0032]
为验证分子量<1500da的小分子量组分的体内降尿酸作用,通过高尿酸小鼠模型进行实验验证。
[0033]
研究表明,从α
‑
乳白蛋白经胃蛋白酶和胰酶水解得到的水解液中分离得到的分子量<1500da的小分子量组分,能显著的降低高尿酸模型小鼠的血清尿酸、血清尿素氮及血清肌酐。通过对体内的相关作用机制研究发现,所述小分子量组分通过降低肝脏的黄嘌呤氧化酶的活性,降低尿酸重吸收相关转运蛋白尿酸阴离子转运体1(urat1)和葡萄糖转运体9(glut9)的表达水平,提高尿酸分泌蛋白有机阴离子转运体1(oat1)的表达水平,此外所述小分子量组分还能通过减轻高尿酸血症引起的炎症反应和肾脏损伤,起到保护肾脏的作用。
[0034]
因此,本发明的α
‑
乳白蛋白小分子量水解物可以开发用于制备黄嘌呤氧化酶抑制剂、用于制备降尿酸的功能食品或保健品的应用、以及用于制备肾脏保健用功能食品或保健品。
[0035]
实施例1、α
‑
乳白蛋白水解液f5组分的制备
[0036]
α
‑
乳白蛋白溶于去离子水配制成40mg/ml的溶液,用5m的hcl将ph调至1.5~2.5,加入胃蛋白酶(250u/mg),胃蛋白酶与底物比为1:30(w/w),在35~40℃和转速150~200rpm的条件下酶解2~4h;之后将体系用6m naoh溶液调ph至6.5~7.5,加入胰酶(8
×
usp),胰酶与底物比为1:25(w/w),在温度为35~40℃,摇床转速为150~200rpm的条件下水解3~5h。
[0037]
水解结束后,将体系ph调至6.5~7.5,90~100℃水浴灭活。然后将水解液在12000rpm的转速下离心10min,取上清用滤径为3kda的超滤管(规格为50ml)进行超滤,收集滤液,即为<3kda的水解液。
[0038]
在akta系统中用葡聚糖凝胶柱(g15和g25两根凝胶柱联用)对<3kda的水解液进行进一步的分离,并检测280nm处的吸光值。
[0039]
如图1所示,样品根据分子量分为f1至f5五个组分,收集分子量<1500da的组分(f5组分),将其进行冷冻干燥,得到粉末状样品待用。
[0040]
实施例2、体外xo抑制活性的测定
[0041]
分别取完整的α
‑
乳白蛋白水解液、经过超滤得到的滤液(<3kda的水解液)以及f5组分(分子量<1500da),以2mg/ml的浓度测定抑制活性,结果如表1所示。
[0042]
表1、不同样品的xo抑制活性
[0043][0044]
由表1的结果可知,f5组分在2mg/ml的浓度下,能够抑制90%的xo活性,明显优于α
‑
乳白蛋白水解液和<3kda的水解液。
[0045]
实施例3、f5组分的对高尿酸小鼠模型的降尿酸效果的测定
[0046]
实验建模采用的是清洁级、六周龄的icr雄性小鼠,所有实验动物自由进食进水,环境为24
±
2℃,每日光照12h。高尿酸建模方法为每天灌胃250mg/kg的尿酸氧化酶抑制剂氧嗪酸钾,以及300mg/kg的次黄嘌呤,周期为3周。实验分为正常组,模型组,别嘌醇组(阳性对照),<3kda的水解液组和f5组。除正常组外,其他各组进行高尿酸建模。具体给药情况如下:
[0047]
1)正常组:实验周期内每日灌胃同体积的0.5%羧甲基纤维素钠溶液;
[0048]
2)模型组:实验周期内每日灌胃同体积的0.5%羧甲基纤维素钠溶液;
[0049]
3)别嘌醇组:实验周期内每日灌胃剂量为5mg/kg bw的别嘌醇;
[0050]
4)<3kda的水解液组:实验周期内每日灌胃剂量为100mg/kg bw的<3kda的水解液;
[0051]
5)f5组:实验周期内每日灌胃剂量为100mg/kg bw的f5组分。
[0052]
上述所有试剂通过0.5%羧甲基纤维素钠溶液进行溶解,在造模1小时后进行给药。造模及给药三周后,在最后一次给药前12小时进行空腹,给药1小时后进行取血,3000rpm转速离心得到血清,之后按实验动物管理规定进行处死,解剖,取小鼠的肾脏、肝脏及其他组织。
[0053]
肾三项指标(血清尿酸,血清尿素氮,血清肌酐)通过全自动生化分析仪分析测定,结果如表2所示。
[0054]
表2、给药对高尿酸模型鼠肾三项指标的影响
[0055][0056]
注:与模型组比较
*
表示p<0.05,
**
表示p<0.01,
***
表示p<0.001
[0057]
实施例4、f5组分对高尿酸小鼠模型肾脏的影响
[0058]
一、肾脏病理学切片分析
[0059]
小鼠肾脏切片病理分析:解剖得到的小鼠肾脏经4%多聚甲醛固定,固定状态良好
后,严格按照病理实验检测sop程序进行修剪、脱水、包埋、切片,然后通过苏木精染色,得到的切片在显微镜下用不同倍数观察与拍照。病理切片的结果如图2所示。
[0060]
正常组小鼠肾脏组织皮髓质分界清晰,肾小球毛细血管袢结构清晰,形态结构未见明显异常,无炎症细胞浸;而模型组小鼠肾脏存在肾间质炎,局部肾小管坏死,正常结构消失,间质少量结缔组织增生,出现炎性细胞灶性浸润;别嘌醇组小鼠肾脏出现全肾性肾小管损伤,大量肾小管萎缩,间质较多结缔组织增生及炎症细胞浸润,大量肾小管扩张,多处肾间质炎;<3kda水解液组小鼠肾脏髓质可见肾小管扩张,个别管腔有上皮细胞脱落,未见明显的炎性细胞浸润;f5组分组小鼠髓质可见个别肾小管扩张,个别管腔中可见脱落的上皮细胞(蓝色箭头),未见明显炎性细胞浸润。说明f5组分能够改善高尿酸血症带来的肾脏损伤,降低炎症反应,保护肾脏。
[0061]
二、肾脏炎症因子测定
[0062]
肾脏中炎症因子的测定:取适量的肾脏样品,通过液氮研磨及组织裂解液破碎,得到组织破碎液,然后以12000rpm的转速离心,取上清用于后续测定;组织破碎液的炎症因子通过elisa试剂盒测定,分别测定促炎因子肿瘤坏死因子
‑
α(tnf
‑
α)、白细胞介素
‑
1β(il
‑
1β)和白细胞介素
‑
6(il
‑
6)和抗炎因子白细胞介素
‑
10(il
‑
10)的水平,结果如以下表3所示。
[0063]
表3、给药对高尿酸模型鼠肾组织炎症因子的影响
[0064][0065]
注:与模型组比较*表示p<0.05,**表示p<0.01,***表示p<0.001
[0066]
由表3的结果可知,高尿酸血症造模导致小鼠肾脏产生炎症反应,模型组的促炎因子(tnf
‑
α,il
‑
1β和il
‑
6)水平都显著高于正常组,抗炎因子(il
‑
10)水平显著低于正常组;长期给药别嘌醇使小鼠肾脏发生严重损伤,别嘌呤组小鼠肾脏正常的炎症反应受到严重影响,炎症因子水平都极其显著低于各组小鼠;而灌胃f5组分,能够显著降低高尿酸模型小鼠肾脏中的促炎因子水平,同时提高抗炎因子的水平,说明f5组分能够减轻高尿酸血症导致的炎症反应。
[0067]
实施例5、f5组分对高尿酸小鼠尿酸排泄相关蛋白表达水平的影响
[0068]
肾脏中尿酸排泄相关蛋白表达水平的测定:取适量的肾脏样品,通过液氮研磨及组织裂解液破碎,得到组织破碎液,然后以12000rpm的转速离心,取上清,即为全蛋白提取液。以β
‑
肌动蛋白(β
‑
actin)为内参蛋白,通过western blotting测定其中尿酸阴离子转运体1(urat1)、葡萄糖转运体9(glut9)以及有机阴离子转运体1(oat1)的表达水平,实验结果如图3
‑
图5所示。
[0069]
urat1和glut9是肾脏中主要对尿酸进行重吸收的转运蛋白,而oat1能尿酸分泌到肾小管进而促进尿酸排泄。图3
‑
图5的实验结果显示,f5组分组小鼠的urat1和glut9表达水
平显著低于模型组小鼠,而oat1的表达水平显著高于模型组小鼠。结果证明,服用f5组分能够显著降低urat1和glut9的表达水平,提高oat1的表达水平,从而有利于尿酸的排泄。
[0070]
实施例6、f5组分对高尿酸小鼠尿酸肠道微生物的影响
[0071]
肠道微生物多样性的测定:各组小鼠的结肠内容物取出后通过粪便dna提取试剂盒提取结肠中的基因组,之后对细菌16s rrna基因的v3
‑
v4区域进行测序。测序得到raw reads之后,进行过滤、组装和再过滤,得到有效数据进行otu聚类,然后依次进行物种注释、α多样性分析和相关微生物丰度分析。
[0072]
图6和图7为各组小鼠肠道微生物的主成分分析(pca)图和门水平物种丰度热图,结果显示,f5组分组和<3kda水解液组小鼠与模型组的肠道微生物otu主成分具有显著不同,门水平上的物种丰度差异较大,说明灌胃f5组分和<3kda水解液能够显著改变高尿酸小鼠的肠道微生物组成。
[0073]
在科水平对一些相对丰度较高的菌科进行分析,结果如图8所示。其中,muribaculaceae菌科是小鼠肠道中的最具优势的菌科,并且muribaculaceae的丰度与丙酸浓度有很强的正相关性,而肠道微生物产生的丙酸和丁酸等短链脂肪酸能够以atp的形式为肠壁细胞代谢尿酸供能。f5组分组小鼠肠道中muribaculaceae菌科的丰度出现显著升高(p<0.001),说明灌胃f5组分和<3kda水解液可以通过提高muribaculaceae菌科的丰度,产生更多的短链脂肪酸来调节尿酸的代谢,并且维护高尿酸血症小鼠的肠道稳态。
[0074]
普雷沃氏菌科(prevotellaceae)作为高尿酸血症的指示菌,与高尿酸血症的发生具有一定关系。而灌胃f5组分可以使普雷沃氏菌科的丰度出现明显的下降(p=0.053),说明f5组分可以通过降低普雷沃氏菌科的丰度进而调控尿酸的代谢。
[0075]
此外,图9显示高尿酸模型小鼠肠道的alistipes菌属、parabacteroides菌属和螺杆菌属(helicobacter)三种和炎症相关的菌属相对于正常组都出现显著性上调,而灌胃<3kda水解液和f5组分都可以不同程度地降低这三种菌属的丰度,其中f5组分的效果更加显著。上述结果与肾脏组织的炎症水平相吻合,别嘌呤醇组小鼠的这三种菌属总体丰度水平出现上升。
[0076]
对于一些产短链脂肪酸的菌属,如拟杆菌属(bacteroides)、罗斯氏菌属(roseburia)、rikenellaceae_rc9_gut_group和ruminococcaceae_ucg
‑
014进行丰度分析,结果如图10所示。高尿酸血症小鼠肠道中产短链脂肪酸的微生物相对于正常组小鼠其丰度总体出现下降,而f5组分组小鼠中这四个菌属的丰度相较于模型组都具有显著上升。<3kda水解液组与f5组分组的趋势相同,产短链脂肪酸的菌属的丰度都有一定上升。可见灌胃<3kda水解液与f5组分可以显著提高高尿酸模型小鼠肠道微生物中产短链脂肪酸菌的丰度,从而有利于尿酸的代谢。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
![一种5-卤代-2[(烷氧基羰基)氨基]-3-甲基苯甲酸的制备方法与流程](/upload/img/202111/alq13fxki5y.jpg)