一种基于三组分反应合成3,5
‑
二取代异恶唑类化合物的方法
技术领域
1.本发明属于有机合成技术领域,特别涉及一种基于三组分反应合成3,5
‑
二取代异恶唑类化合物的方法。
背景技术:
2.早在1888年,claisen等人采用β
‑
酮酯和羟胺反应环化生成了3
‑
羟基异恶唑。此后,大量学者通过[3 2]环加成反应,环化异构化反应,缩合反应等方式,不断丰富着异恶唑的合成方法学研究(图1所示)。现将异恶唑合成方法按类型分类后总结如下:
[0003]
1、通过[3 2]环加成反应合成异恶唑(cycloaddition):合成异恶唑最常用的方法是氯代肟乙酸酯与炔或烯的1,3
‑
偶极环加成反应。先将芳醛与盐酸羟胺反应得到醛肟,醛肟经氯代丁二酸亚胺(ncs)作用得到氯肟,氯肟在三乙胺作用下得到腈氧化物,随即与炔或烯进1,3
‑
偶极加环加成反应获得目标物异恶唑(图2a)。其合成条件较为温和,制备的异恶唑化合物种类多样,可以直接制备含有氨基、羟基、活泼卤素等活性基团的化合物,而且此种方法在合成方法学上也有重要应用,如发展金属催化、催化剂负载等方法,但是缺点在于底物需要含有末端炔键的化合物,给合成增加一定的限制和难度。朱敏等采用催化量有机高价碘试剂,发展了端基炔烃与醛肟的[3 2]环合反应,合成了一系列3,5
‑
二取代异恶唑类化合物。该反应简单、方便,区域选择性强,实现了无碱条件下的异恶唑合成(如图2b所示)。
[0004]
2、通过环化异构化反应合成异恶唑(cycloisomerization):通过底物炔酮肟分子内成环也是一种常用的异恶唑合成法。在1970年,sisido等研究炔酮肟成环时发现,反应体系的酸碱性对成环有明显决定作用(图3a所示)。炔基酮酸酯和盐酸羟胺反应成肟后,若在酸性条件下关环,得到5
‑
取代异恶唑
‑3‑
甲酸乙酯(i)若在弱碱性条件下关环,则主要生成异恶唑啉
‑3‑
甲酸乙酯(ii)。以炔肟形成异恶唑的报道较多,以烯肟形成异恶唑环则比较少见。2009年,兰州大学厍学功课题组利用α,β
‑
不饱和酮酸酯和tsnhoh一锅法合成一系列3,5
‑
二取代的异恶唑化合物,其中以65%的收率合成了3
‑
苯基异恶唑
‑5‑
羧酸乙酯(图3b所示)。其可能的成环机理是tsnhoh首先对羰基的α
‑
不饱和烯键发生加成反应,然后脱去苯亚磺酸得到α
‑
羰基肟,该肟脱水形成异恶唑环。
[0005]
此后,在2011年miyata课题组发展了以苯酚为质子源,ag
催化下合成了异恶唑(图3c所示)。作者推断催化成环的机理是ag
与缺电子的炔键结合,从而活化炔键。肟氧原子因连接有供电子基团苄基而使电子云密度增加,肟氧的孤对电子进攻活化的炔键,进而发生加成反应形成异恶唑环,同时肟氧上苄基和ag
脱离,ag
在反应中循环催化。但反应收率总体较低,且反应时间较长。
[0006]
zhu课题组在2014年报道了一种钯/银协同催化的新方法(图3d所示)。为了体现方法的适用性,他们将该方法成功应用到药物valdecoxib和oxacillin的合成中。然而,贵金属的使用降低了该方法在工业化应用中的可能性。
[0007]
最近,chang课题组通过碘介导的氧化性c
‑
o键形成反应由易得的α,β
‑
不饱和肟合成了一系列单、双和三取代(芳基、烷基和/或烯基)的异恶唑类化合物(图3e所示)。该合成
方法具有不使用过渡金属、操作简单、反应条件温和、反应时间短,以及底物适用范围广等优点。
[0008]
3、通过缩合反应合成异恶唑(condensation):1888年,claisen等人采用β
‑
酮酯和羟胺反应环化生成了3
‑
羟基异恶唑(图4a所示)。反应可以在非金属条件下实现异恶唑的一锅法合成,但该体系中会生成副产物5
‑
异恶唑酮,降低了主产物的产率。为了弄清楚副反应生成的机理,cocivera等在1976年通过核磁进行了研究,认为5
‑
异恶唑酮是由热力学不稳定的顺式异构体转变而来的。2000年,larsen等人通过改进方法,避免副产物5
‑
异恶唑酮的生成(图4b所示)。反应通过将原料进行n,o保护,三步法合成了3
‑
羟基5
‑
甲基异恶唑衍生物。
[0009]
综上所述,自从1888年claisen等首次发展了异恶唑合成方法以来,研究学者通过新的策略如[3 2]环加成反应,环化异构化反应,缩合反应等方式丰富了异恶唑的合成新方法。
[0010]
在[3 2]环加成反应策略中,原料醛肟或酮肟存在不易商业化获得,需要提前制备等缺点;此外,在环化异构化反应和缩合反应策略中,需要使用盐酸羟胺试剂,该试剂在大规模使用时存在安全性等制约因素。随着环境问题的日益突出,发展高效、绿色、简便的合成方法学将是未来合成化学的发展方向。
技术实现要素:
[0011]
针对上述问题,本发明提供一种基于三组分反应合成3,5
‑
二取代异恶唑类化合物的方法。
[0012]
为实现上述目的,采用以下技术方案:
[0013]
一种基于三组分反应合成3,5
‑
二取代异恶唑类化合物的方法,将醛、烯烃和亚硝酸酯混合加热反应生成3,5
‑
二取代异恶唑类化合物。
[0014]
优选地,所述反应在水中进行。
[0015]
优选地,所述反应在有机溶剂中进行。
[0016]
优选地,所述有机溶剂为四氢呋喃、氯苯、丙酮、n,n
‑
二甲基甲酰胺、n
‑
甲基吡咯烷酮、乙腈、二甲亚砜、甲醇或乙醇中的任意一种。
[0017]
优选地,向所述反应中加入过硫酸盐作为氧化剂。
[0018]
优选地,向所述反应中加入酸性物质或碱性物质。
[0019]
优选地,向所述反应中加入硫酸钠。
[0020]
优选地,所述醛选自脂肪族醛、芳香族醛或稠环类醛。所述烯烃选自芳香族烯烃或稠环类烯烃;所述亚硝酸酯选自亚硝酸烷基酯。
[0021]
优选地,所述有机溶剂中含有水,有机溶剂和水的体积比为5:1。
[0022]
优选地,所述过硫酸盐为过硫酸钠、过硫酸钾或过硫酸铵中任意一种或几种。
[0023]
优选地,所述酸性物质为甲酸、醋酸、三氟乙酸、盐酸、氢氟酸、三氟化硼乙醚或氟硼酸;所述碱性物质为咪唑、叔丁醇钾、碳酸钠、4
‑
二甲氨基吡啶、醋酸钠、哌嗪、磷酸钾、三乙胺、碳酸氢钠、1,4
‑
二氮杂二环[2.2.2]辛烷、碳酸铯或1,8
‑
二氮杂二环十一碳
‑7‑
烯。
[0024]
优选地,所述醛、烯烃和亚硝酸酯的摩尔比为:1~5:1~10:1~20。
[0025]
优选地,所述反应的加热温度为20
‑
140℃,反应时间为0.5
‑
24h。
[0026]
优选地,所述反应的加热温度为100℃,反应时间为8h。
[0027]
本发明具有以下有益效果:1、异恶唑分子中的氮原子来源于亚硝酸酯而不是盐酸羟胺,反应的安全性大大提升;2、所用原料均可商业化购买,不需要提前制备,反应实施起来更加容易,反应操作也更加简便;3、底物的适用范围更广,脂肪烃,芳烃,稠环类等底物均可适用于我们的反应体系;4、反应在酸性环境和碱性环境中均可进行;5、反应在空气条件下可以进行,无需惰性气体保护。
[0028]
本发明的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本发明而了解。本发明的目的和其他优点可通过在说明书、权利要求书以及附图中所指出的结构来实现和获得。
附图说明
[0029]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0030]
图1为现有技术中异恶唑合成方法示意图;
[0031]
图2为[3 2]环加成法合成异恶唑的方法示意图;
[0032]
图3为环化异构化反应合成异恶唑的方法示意图;
[0033]
图4为缩合反应合成异恶唑的方法示意图;
[0034]
图5为本发明实施例1中生成物3,5
‑
二苯基异恶唑的反应式示意图;
[0035]
图6为示例性给出本发明改变底物所得到的不同产物;
[0036]
图7为本发明反应机理示意图;
[0037]
图8为本发明各实施例反应条件和产率结果图。
具体实施方式
[0038]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地说明,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0039]
实施例1:
[0040]
一种基于三组分反应合成3,5
‑
二取代异恶唑类化合物的方法,采用0.5mmol苯乙烯、0.25mmol对溴苯甲醛,0.5mmol亚硝酸叔丁酯(tbn),在0.6ml溶剂水中100℃下加热下反应8小时,柱色谱分离得到白色透明晶体3aa,产率为5%。
[0041]
实施例2:
[0042]
一种基于三组分反应合成3,5
‑
二取代异恶唑类化合物的方法,与实施例1的区别在于,所用溶剂为dmf,产率为15%。
[0043]
实施例3:
[0044]
一种基于三组分反应合成3,5
‑
二取代异恶唑类化合物的方法,与实施例1的区别在于,所用溶剂为dmf和水的混合溶液,dmf和水的比例为5:1,产率为35%。
[0045]
实施例4:
[0046]
一种基于三组分反应合成3,5
‑
二取代异恶唑类化合物的方法,与实施例3的区别在于,反应时还添加0.125mmolk2s2o8作为氧化剂,产率为47%。
[0047]
实施例5:
[0048]
一种基于三组分反应合成3,5
‑
二取代异恶唑类化合物的方法,与实施例4的区别在于,反应时还添加0.625mmol醋酸,产率为51%。
[0049]
实施例6:
[0050]
一种基于三组分反应合成3,5
‑
二取代异恶唑类化合物的方法,与实施例5的区别在于,反应时还添加0.25mmol硫酸钠,产率为58%。
[0051]
实施例7:
[0052]
一种基于三组分反应合成3,5
‑
二取代异恶唑类化合物的方法,与实施例6的区别在于,反应时添加0.5mmol硫酸钠,产率为61%。
[0053]
实施例8:
[0054]
一种基于三组分反应合成3,5
‑
二取代异恶唑类化合物的方法,与实施例6的区别在于,反应温度为80℃,产率为52%。
[0055]
实施例9:
[0056]
一种基于三组分反应合成3,5
‑
二取代异恶唑类化合物的方法,与实施例6的区别在于,反应温度为110℃,产率为61%。
[0057]
实施例10:
[0058]
一种基于三组分反应合成3,5
‑
二取代异恶唑类化合物的方法,与实施例6的区别在于,反应温度为120℃,产率为40%。
[0059]
实施例11:
[0060]
一种基于三组分反应合成3,5
‑
二取代异恶唑类化合物的方法,与实施例6的区别在于,采用的苯乙烯为0.25mmol,产率为22%。
[0061]
实施例12:
[0062]
一种基于三组分反应合成3,5
‑
二取代异恶唑类化合物的方法,与实施例6的区别在于,采用的苯乙烯为0.75mmol,产率为71%。
[0063]
实施例13:
[0064]
一种基于三组分反应合成3,5
‑
二取代异恶唑类化合物的方法,首先采用2mmol苯乙烯、1mmol苯甲醛,2mmol亚硝酸叔丁酯,在2ml溶剂dmf中30℃加热下反应3小时,柱色谱分离得到白色透明晶体4a,产率为5%。将所制备的化合物进行核磁分析,结果显示4a为3,5
‑
二苯基异恶唑,反应式如图5所示。以上各实施例反应条件和产率结果见图8。
[0065]
进一步地,本发明所述方法不仅限于上述反应底物,脂肪醛,芳基醛基和稠环类的醛等醛类底物均适用于此反应,如图6所示,对应反应物1和反应物2采用不同的底物,分别得到不同的生成物4,示例性地,如化合物4a、4b......4u或5a、5b......5f等。
[0066]
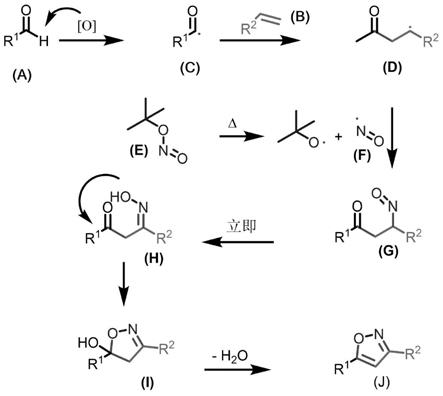
本发明所用方法经过以下反应路线,如图7所示:即采用醛a和烯烃b以及亚硝酸酯e做反应物,在反应体系中,醛a在氧化剂作用下产生的醛自由基c对烯烃进行加成,生成自由基d。此时,自由基d与由亚硝酸酯e受热产生的亚硝基自由基f发生自由基偶联反应,可生成化合物g,并快速异构化成1,3
‑
二羰基酮肟中间体h,随后发生分子内的关环反应,生成化
合物i,通过失去1分子水生成目标物异恶唑类化合物j。结合图6所示,该反应体系中,醛类底物如脂肪族醛环己甲醛(反应后生成产物4u),芳香族醛苯甲醛(反应后生成产物4a),杂环类醛4
‑
吡啶甲醛(反应后生成产物4r)等均可适用,烯烃类底物如脂肪族烯烃1
‑
己烯(反应后生成产物5f),芳香族烯烃4
‑
溴苯乙烯(反应后生成产物5a),稠环类烯烃2
‑
萘烯(反应后生成产物5d)等均可适用;亚硝酸酯类底物如亚硝酸异丁酯、亚硝酸正丁酯、亚硝酸异戊酯等均可适用;反应在酸性环境和碱性环境中均可进行。
[0067]
综上所述,本发明中异恶唑分子中的氮原子来源于tbn分子而不是盐酸羟胺,采用盐酸羟胺做来源,通常需提前通过底物醛或酮反应制备醛肟或酮肟,操作繁琐,且盐酸羟胺在大规模反应时存在安全性问题。采用tbn做原料时,原料无需提前准备,可一锅法完成,安全性相对盐酸羟胺较好。
[0068]
尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。