1.本发明涉及生物医药技术领域,具体涉及一种超灵敏抗体检测方法,特别是对sars
‑
cov
‑
2抗体的超灵敏检测方法。
背景技术:
2.确定血液中抗体水平的血清学测试是诊断感染性疾病(例如新型冠状病毒疾病(covid
‑
19))的重要工具。虽然鼻咽拭子核酸检测(nucleic acid test,nat)是鉴定严重sars
‑
cov
‑
2感染个体的主要方法,灵敏检测针对sars
‑
cov
‑
2的抗体可以有助于识别nat结果为阴性的有症状患者,或在nat受限的资源受限地区诊断感染。此外,血清学抗体测试还提供了有关疾病进展和患者免疫的基本信息,其对于预估sars
‑
cov
‑
2流行、治疗开发和评价covid
‑
19疫苗的有效性是关键的。
3.迄今为止,已经开发了许多抗sars
‑
cov
‑
2抗体的免疫测定法,但其具有各自的局限性。最广泛使用的酶联免疫吸附测定法(elisa)通常需要繁琐的洗涤和温育步骤,其对于实验室外使用并不适用(s.k.elledge,et al.,nat biotechnol 2021,doi:10.1038/s41587
‑
021
‑
00878
‑
8)。已经开发并商业化了几种高度自动化的化学发光免疫测定(clia),但是由于需要高度专业化的仪器,其仅能用于实验室环境(d.d.rhoads,et al.,j clin microbiol 2020,58,doi:10.1128/jcm.00760
‑
20)。侧流测定法(lateral flow assay,lfa)检测快速且便携,但由于其定性性质和较差的灵敏度而通常不可靠(c.h.geurtsvankessel,et al.,nat commun 2020,11,3436,doi:10.1038/s41467
‑
020
‑
17317
‑
y;j.d.whitman,et al.,nat biotechnol 2020,38,1174
‑
1183)。此外,所有上述测定法缺乏在感染早期检测抗体的灵敏性,并且在症状发作时需要至少一周时间才能达到可检测的抗体浓度。与标准elisa相比,分析灵敏度提高1000倍的抗
‑
sars
‑
cov
‑
2抗体的超灵敏检测是可能的,但只能通过使用高度专业化且昂贵的单分子阵列(simoa)平台来实现(m.norman,et al.,nat biomed eng 2020,4,1180
‑
1187;d.ter
‑
ovanesyan,et al.,analytical chemistry 2021,93,5365
‑
5370.)。
技术实现要素:
4.为克服现有技术的不足,本发明提供了一种超灵敏抗体检测方法,其通过以下技术方案来实现:
5.设计一种目标核酸,其由依次连接的片段s1、s2和s3组成,即,其可表示为s1
‑
s2
‑
s3。
6.具体地,s1和s3的长度可以独立地为5以上nt,例如5
‑
45nt,5
‑
20nt,5
‑
10nt,例如5、6、7、8、9、10、15、20、25、30、35、40、45nt。
7.在本发明的一些实施例中,s1的长度为7nt。
8.在本发明的一些实施例中,s3的长度为8nt。
9.在本发明的一些实施例中,s1为ggtcgag。
10.在本发明的一些实施例中,s3为cggcgacg。
11.具体地,s2的长度可以为5
‑
8nt,例如5、6、7、8nt;在本发明的一些实施例中,s2的长度为5nt。
12.在本发明的一些实施例中,s2为ctgga。
13.在本发明的一些实施例中,目标核酸为cgtcgccgtccagggtcgag。
14.第一方面,本发明提供一种crrna,其包含:(1)与cas核酸酶相互作用的框架核酸片段,以及(2)与目标核酸结合的特异性核酸片段。
15.在本发明的一些实施例中,crrna由(1)与cas核酸酶相互作用的框架核酸片段,以及(2)与目标核酸结合的特异性核酸片段组成。
16.具体地,该特异性核酸片段的长度为18以上bt,例如20
‑
100bt,20
‑
50bt,例如18、20、22、24、25、26、28、30、35、40、45、50、60、70、80、90、100bt;在本发明的一些实施例中,该特异性核酸片段的长度为20bt。
17.具体地,该特异性核酸片段由依次连接的片段s1’、s2’和s3’组成,即,其可表示为s1
’‑
s2
’‑
s3’。
18.具体地,s1’和s3’的长度可以独立地为5以上nt,例如5
‑
45nt,5
‑
20nt,5
‑
10nt,例如5、6、7、8、9、10、15、20、25、30、35、40、45nt。
19.在本发明的一些实施例中,s1’的长度为7nt。
20.在本发明的一些实施例中,s3’的长度为8nt。
21.在本发明的一些实施例中,s1’为cucgacc。
22.在本发明的一些实施例中,s3’为cgucgccg。
23.具体地,s2’的长度可以为5
‑
8nt,例如5、6、7、8nt;在本发明的一些实施例中,s2’的长度为5nt。
24.在本发明的一些实施例中,s2’为uccag。
25.在本发明的一些实施例中,该特异性核酸片段包含seq id no:1所示的核苷酸序列,或由其组成。
26.在本发明的一些实施例中,框架核酸片段包含seq id no:2所示的核苷酸序列,或由其组成。
27.在本发明的一些实施例中,该crrna包含seq id no:3所示的核苷酸序列,或由其组成。
28.第二方面,本发明提供一种单链dna探针,其包含片段s
a
,片段s
a
与片段s1
‑
s2相同(即与片段s1
’‑
s2’互补)。
29.具体地,片段s
a
包含seq id no:4所示的核苷酸序列,或由其组成。
30.更具体地,该单链dna探针还包含片段s
r
,其与片段s
a
连接。
31.具体地,片段s
r
的长度可以为10
‑
100nt,例如15
‑
50nt,20
‑
40nt,25
‑
35nt,30nt。
32.具体地,片段s
r
包含seq id no:5所示的核苷酸序列,或由其组成。
33.在一些实施例中,该单链dna探针包含seq id no:6所示的核苷酸序列,或由其组成。
34.第三方面,本发明提供一种单链dna探针,其包含片段s
b
,片段s
b
与片段s2
‑
s3互补(即与片段s2
’‑
s3’相对应,即将片段s2
’‑
s3’中的u替换为t(如果片段s2
’‑
s3’含u的话))。
35.具体地,片段s
b
包含seq id no:7所示的核苷酸序列,或由其组成。
36.更具体地,该单链dna探针还包含pam序列,其与片段s
b
连接。
37.具体地,该pam序列为tttx,其中x可以为任意脱氧核苷酸(a、t、c、g);在本发明的一些实施例中,该pam序列为ttta。
38.具体地,片段pam
‑
s
b
包含seq id no:8所示的核苷酸序列,或由其组成。
39.更具体地,该单链dna探针还包含片段sr’,其与片段pam
‑
s
b
连接。
40.具体地,片段sr’的长度可以为10
‑
100nt,例如15
‑
60nt,30
‑
50nt,35
‑
45nt,42nt。
41.具体地,片段sr’包含seq id no:9所示的核苷酸序列,或由其组成。
42.在一些实施例中,该单链dna探针包含seq id no:10所示的核苷酸序列,或由其组成。
43.第四方面,本发明提供一种第三方面或第四方面所述的探针与目标抗原部分的偶联物。
44.具体地,上述目标抗原可以为任何能刺激机体产生抗体并与抗体发生特异性结合的物质,例如病毒、细菌、细菌外毒素等等。
45.在本发明的一些实施例中,上述目标抗原为病毒。
46.具体地,上述病毒可以为腺病毒科、疱疹病毒科(如ebv)、乳头多瘤空泡病毒科、小rna病毒科、痘病毒科(如天花病毒)、嗜肝dna病毒科(如乙型肝炎病毒)、冠状病毒科(如hcov
‑
229e、hcov
‑
oc43、hcov
‑
nl63、hcov
‑
hku1、sars
‑
cov、mers
‑
cov、sars
‑
cov
‑
2等)、玻那病毒科、丝状病毒科(如埃博拉病毒)、正粘病毒科(如流感病毒)、副粘病毒科、反转录病毒科(如hiv)、呼肠孤病毒科、弹状病毒科(如狂犬病毒)、黄病毒科的病毒。
47.在本发明的一些实施例中,上述病毒为冠状病毒,具体如hcov
‑
229e、hcov
‑
oc43、hcov
‑
nl63、hcov
‑
hku1、sars
‑
cov、mers
‑
cov、sars
‑
cov
‑
2等。
48.在本发明的一些实施例中,上述病毒为正粘病毒,如流感病毒(如甲型流感病毒、乙型流感病毒、丙型流感病毒等)。
49.在本发明的一些实施例中,上述病毒为副粘病毒,如1型人副流感病毒(hpiv)、2型hpiv、3型hpiv、4型hpiv、仙台病毒、腮腺炎病毒、麻疹病毒、呼吸道合胞病毒、新城疫病毒等。
50.中中,上述病毒为黄病毒,如登革热病毒、寨卡病毒、乙型脑炎病毒、基孔肯亚病毒、黄热病病毒、丙型肝炎病毒、西尼罗病毒等。
51.具体地,该偶联物中目标抗原部分可以为病毒蛋白,例如,病毒的完整蛋白或其部分蛋白。
52.在本发明的一些实施例中,该偶联物中,目标抗原为sars
‑
cov
‑
2;具体地,该偶联物中目标抗原部分可以为sars
‑
cov
‑
2的结构蛋白(如s蛋白、m蛋白、e蛋白、n蛋白)中的一种或多种,或各结构蛋白的一部分(例如s蛋白的受体结合结构域(rbd))。
53.具体地,该偶联物还包含linker,所述探针与目标抗原部分通过linker偶联。
54.具体地,该linker可以为任何合适的连接基,例如,通过标记物
‑
抗标记物复合物所形成的连接基,其中,标记物
‑
抗标记物复合物中标记物/抗标记物的组合包括,但不限于:生物素或其衍生物/链霉亲和素,生物素或其衍生物/亲和素,生物素或其衍生物/中性抗生物素蛋白,半抗原/抗体,抗原/抗体,受体/配体,地高辛/地高辛配基,碳水化合物/凝
集素和多核苷酸/互补的多核苷酸,等等。在本发明的一些实施例中,linker可以为通过生物素/生物素结合的蛋白所形成的连接基,生物素结合的蛋白包括上述的链霉亲和素、亲和素和中性抗生物素蛋白,每个蛋白都能够以高度的亲和力和特异性结合四个生物素分子。
55.在本发明的一些实施例中,linker可以为
‑
生物素
‑
链霉亲和素
‑
生物素
‑
。
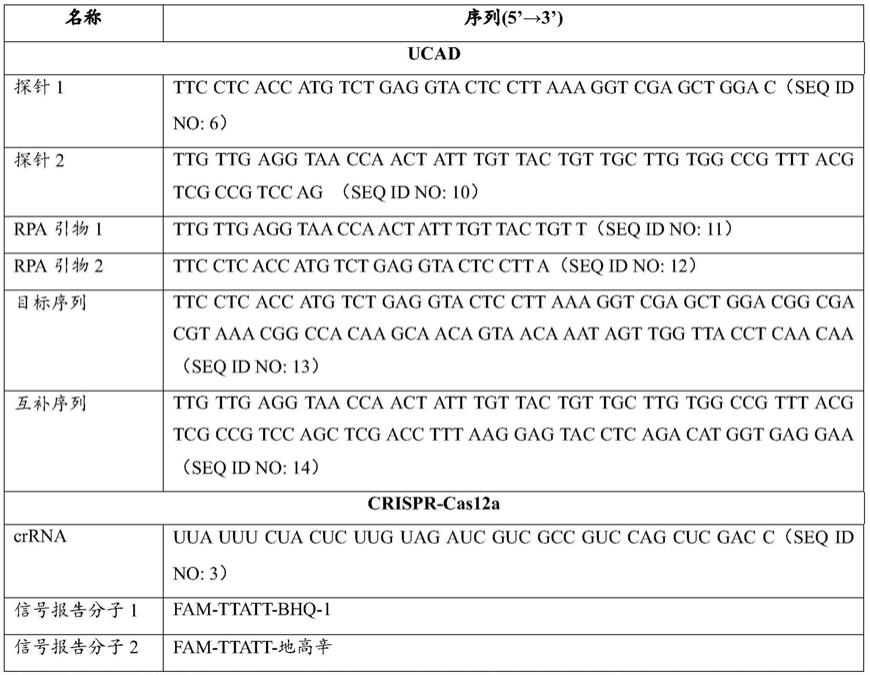
56.在本发明的一些实施例中,该偶联物可以为探针
‑
生物素
‑
链霉亲和素
‑
生物素
‑
目标抗原部分(如sars
‑
cov
‑
2 s蛋白的rbd)。
57.第五方面,本发明提供一种本发明第三方面或第四方面所述的探针与目标抗体的配体部分的偶联物。
58.具体地,该目标抗体为针对目标抗原的抗体,目标抗原具有本发明第四方面中所述定义。
59.具体地,目标抗体可以为igg、iga、igm、igd、ige中的任一种,特别是igg、igm。
60.在本发明的一些实施例中,目标抗体为sars
‑
cov
‑
2抗体,特别是抗sars
‑
cov
‑
2igg、sars
‑
cov
‑
2igm。
61.在一些实施例中,该配体为抗体,特别是单克隆抗体;具体地,目标抗体为sars
‑
cov
‑
2抗体时,该配体为抗sars
‑
cov
‑
2抗体的抗体,例如,目标抗体为抗sars
‑
cov
‑
2igg或sars
‑
cov
‑
2igm时,相应地,配体可以为抗sars
‑
cov
‑
2igg的抗体或抗sars
‑
cov
‑
2igm的抗体。
62.具体地,该偶联物还包含linker,所述探针与配体部分通过linker偶联。
63.具体地,该linker可以为任何合适的连接基,其具有本发明第四方面中所述定义;在本发明的一些实施例中,linker可以为
‑
生物素
‑
链霉亲和素
‑
生物素
‑
。
64.在本发明的一些实施例中,该偶联物可以为探针
‑
生物素
‑
链霉亲和素
‑
生物素
‑
目标抗体的配体。
65.第六方面,本发明提供一种组合产品,其包含本发明第二方面所述的探针和第三方面所述的探针。
66.具体地,该组合产品还包含如上所述的目标抗原原料、配体原料,以及任选地,形成linker所需的物质。
67.具体地,目标抗原原料可以为病毒蛋白,例如,病毒的完整蛋白或其部分蛋白;在本发明的一些实施例中,目标抗原原料为sars
‑
cov
‑
2的结构蛋白(如s蛋白、m蛋白、e蛋白、n蛋白)中的一种或多种,或结构蛋白的一部分(例如s蛋白的受体结合结构域(rbd))。
68.具体地,配体原料为抗目标抗原抗体的抗体;例如,目标抗原sars
‑
cov
‑
2,目标抗体为抗sars
‑
cov
‑
2igg或sars
‑
cov
‑
2igm时,相应地,配体原料可以为抗igg抗体或抗igm抗体。
69.具体地,linker可以为通过标记物
‑
抗标记物复合物所形成的连接基,此时,形成linker所需的物质可以包括标记物和抗标记物,标记物/抗标记物的组合如本发明第三方面所述,特别是,生物素和生物素结合的蛋白(例如链霉亲和素、亲和素和中性抗生物素蛋白)。
70.具体地,该组合产品还可以包含dna聚合所需试剂,例如dna聚合酶(例如t4聚合酶)、dntp、mg
2
、缓冲体系等。
71.具体地,该组合产品中各组分分别单独包装。
72.第七方面,本发明提供一种组合产品,其包含本发明第四方面所述的偶联物和第五方面所述的偶联物。
73.具体地,该组合产品还包含dna聚合所需试剂,例如dna聚合酶(例如t4聚合酶)、dntp、mg
2
、缓冲体系等。
74.具体地,该组合产品中各组分分别单独包装。
75.第八方面,本发明提供一种组合产品,其包含本发明第一方面所述的crrna、crisper蛋白、信号报告分子。
76.具体地,crisper蛋白为具备侧切割活性(collateral cleavage activity)的crisper蛋白,例如cas12a、cas12b、cas13a、cas13b、cas14、csm6,特别是cas12a。
77.具体地,信号报告分子包含单链dna。
78.具体地,该单链dna的长度为5
‑
10nt(例如5、6、7、8、9、10nt)。
79.具体地,该单链dna由t和a组成。
80.在本发明的一些实施例中,该单链dna为ttatt。
81.在本发明的一个实施方式中,信号报告分子的5’端和3’端分别标记荧光报告基团和荧光淬灭基团。
82.具体地,荧光报告基团可以为,例如,fam、texas red、rox、tet、vic、joe、hex、cy3、cy3.5、cy5、cy5.5、lc red640、lc red705等。
83.具体地,荧光淬灭基团可以为,例如,tamra、dabcyl、eclipse、bhq
‑
1、bhq
‑
2、bhq
‑
3等。
84.在本发明的一些实施例中,信号报告分子为fam
‑
ttatt
‑
bhq
‑
1。
85.在本发明另一个实施方式中,信号报告分子的5’端和3’端分别标记第一标记物和第二标记物,且第一标记物和第二标记物不同。
86.具体地,信号报告分子上还标记有与所述标记物不同的信号物质,且该信号物质上还标记有第二标记物的抗体,由此,当该信号报告分子被crispr检测体系切割时,信号物质与第二标记物位于同一核酸片段。
87.具体地,信号物质可以选自:荧光团、比色标记、金纳米粒子、量子点、生物素以及其他可以用于探测的标签分子(如用于拉曼衍射成像的炔烃基团,用于click反应的环烯烃,用于聚合物标记的引发基团),也可以选自多肽/蛋白分子,lna/pna,非天然氨基酸及其类似物(如拟肽),非天然核酸及其类似物(拟核苷酸)和纳米结构(包括无机纳米颗粒,nv
‑
center,聚集/组装诱导发光分子,稀土离子配体分子,多金属氧簇等)。
88.具体地,该组合产品还可以包含crisper切割所需的其他试剂,例如,缓冲体系,等。
89.具体地,该组合产品还可以包含阳性对照品和/或阴性对照品。
90.具体地,该组合产品中各组分分别单独包装。
91.第九方面,本发明提供一种试纸,其包含底板、样品垫、结合垫、层析基质和吸收垫,其中,样品垫、结合垫、层析基质和吸收垫依次粘附在底板上并采用搭接的方式连接。
92.具体地,结合垫上含有针对第一标记物的第一抗标记物的信号物质(例如如上所述的信号物质)。
93.具体地,层析基质上靠近结合垫的一侧设有质控(c)区,靠近吸收垫的一侧设有检
测(t)区。
94.具体地,质控区包被有针对第二标记物的第二抗标记物。
95.具体地,检测区包被有针对第一抗标记物的抗第一抗标记物。
96.在本发明的一些实施例中,信号物质为金纳米粒子。
97.在本发明的一些实施例中,第一标记物为fam,第一抗标记物为抗fam抗体,例如,兔抗fam多克隆抗体。
98.在本发明的一些实施例中,第二标记物为地高辛,第二抗标记物为抗地高辛抗体,例如,山羊抗地高辛多克隆抗体。
99.在本发明的一些实施例中,抗第一抗标记物为针对第一抗标记物的抗体,例如,山羊抗兔抗体。
100.具体地,层析介质可以为硝酸纤维素膜。
101.具体地,样品垫和结合垫可以为玻璃纤维素膜。
102.具体地,底板可以为pvc底板。
103.第十方面,本发明提供一种引物,其包含引物1和引物2,其中,引物1和引物2分别如seq id no:11和seq id no:12所示。
104.第十一方面,本发明提供一种扩增组合产品,其包含本发明第十方面所述的引物。
105.具体地,该扩增组合产品可用于执行以下扩增方法中的任一种:重组酶聚合酶扩增(rpa)、pcr扩增、nasba等温扩增、环介导等温扩增、链置换扩增、解旋酶依赖性扩增和切口酶扩增反应等,特别是rpa。
106.具体地,该扩增组合产品还包括核酸扩增所需试剂,例如,rpa所需试剂,包括:能结合单链核酸的重组酶、单链dna结合蛋白(ssb)、链置换dna聚合酶、dntp、mg
2
、缓冲体系等。
107.具体地,该扩增组合产品中各组分分别单独包装。
108.第十二方面,本发明提供一种试剂盒,其包含本发明第六方面所述的组合产品和第八方面所述的组合产品。
109.具体地,该试剂盒还可包含本发明第九方面所述的试纸。
110.具体地,该试剂盒还可包含本发明第十一方面所述的扩增组合产品。
111.第十三方面,本发明提供一种试剂盒,其包含本发明第七方面所述的组合产品和第八方面所述的组合产品。
112.具体地,该试剂盒还可包含本发明第九方面所述的试纸。
113.具体地,该试剂盒还可包含本发明第十一方面所述的扩增组合产品。
114.第十四方面,本发明提供第一方面所述的crrna、第二、三方面所述的探针、第四、五方面所述的偶联物、第七、八方面所述的组合产品、第九方面所述的试纸、第十方面所述的引物、第十一方面所述的组合产品、第十二、三方面所述的试剂盒在制备检测针对目标抗原的抗体的产品中的应用。
115.在本发明的一些实施例中,该抗体为sars
‑
cov
‑
2抗体,例如抗sars
‑
cov
‑
2igg、抗sars
‑
cov
‑
2igm。
116.具体地,检测目标抗体所用样品可以为受试者的血液或其级分(例如血清),特别是血清,或其稀释后的产物。
117.具体地,受试者为携带或疑似携带目标抗原(如sars
‑
cov
‑
2)的动物,特别是哺乳动物,例如蝙蝠、果子狸、灵长类动物,特别是人类。
118.具体地,上述检测产品可用于诊断目的,也可用于非诊断目的。
119.第十五方面,本发明提供第一方面所述的crrna、第二、三方面所述的探针、第四、五方面所述的偶联物、第七、八方面所述的组合产品、第九方面所述的试纸、第十方面所述的引物、第十一方面所述的组合产品、第十二、三方面所述的试剂盒在制备诊断由目标抗原所引起的疾病或病症的产品中的应用。
120.具体地,上述疾病或病症可以选自:鼻炎、鼻窦炎、哮吼、咽炎、扁桃体炎、腮腺炎、喉炎、气管炎、哮喘、肺炎、流行性感冒、寨卡病毒病、艾滋病(aids)等中的一种或多种。
121.在本发明的一些实施例中,疾病为新型冠状病毒肺炎(covid
‑
19)(目标抗原为sars
‑
cov
‑
2)。
122.第十六方面,本发明提供一种抗体检测方法,其包括如下步骤:
123.(1)将待测样品与本发明第七方面所述的组合产品混合,温育;
124.(2)将步骤(1)的温育产物与本发明第八方面所述的组合产品混合,温育;
125.(3)检测。
126.具体地,待测样品为受试者的血液或其级分(例如血清),特别是血清,或其稀释后的产物。
127.具体地,步骤(1)中的温育体系中,dna聚合酶(例如t4聚合酶)的浓度为1
‑
6u/50μl温育体系,特别是2u/50μl温育体系。
128.具体地,步骤(1)中的温育体系中,第四方面所述的偶联物和第五方面所述的偶联物的浓度为100fm
‑
10pm/50μl温育体系,特别是10pm/50μl温育体系。
129.具体地,步骤(1)中的温育体系中,样品浓度可以为5μl/50μl温育体系。
130.具体地,步骤(1)中的温育温度可以为37
‑
42℃,特别是37℃。
131.具体地,步骤(1)中的温育时间可以为10
‑
30分钟,例如20分钟。
132.在本发明的一些实施例中,步骤(1)中还包括将温育产物进行扩增的步骤。
133.具体地,扩增步骤包括:将温育产物与本发明第十一方面所述的组合产品混合,扩增温育。
134.具体地,扩增温育的温度可以为37
‑
42℃,特别是37℃。
135.具体地,扩增温育的时间可以为10
‑
30分钟,例如20分钟。
136.具体地,步骤(2)中的温育温度可以为37
‑
42℃,特别是37℃。
137.具体地,步骤(2)中的温育时间可以为10
‑
120分钟;在步骤(1)不包含扩增步骤时,步骤(2)中的温育时间可以为50
‑
120分钟;在步骤(1)包含扩增步骤时,步骤(2)中的温育时间可以为10
‑
60分钟。
138.在本发明的一些实施例中,步骤(3)的检测包括对步骤(2)的温育产物检测荧光的步骤。
139.在本发明另一些实施例中,步骤(3)中的检测包括将步骤(2)的温育产物加样至本发明第九方面所述的试纸的步骤。
140.在本发明的一些实施例中,上述抗体检测方法为sars
‑
cov
‑
2抗体检测方法。
141.具体地,上述抗体检测方法可以为定量检测方法,也可以为定性检测方法。
142.具体地,上述抗体检测方法可以用于诊断用途,也可用于非诊断用途。
143.第十七方面,本发明提供一种抗体检测方法,其包括如下步骤:
144.(1)将待测样品与本发明第四、五方面所述的偶联物、dna聚合所需试剂混合,温育;
145.(2)将步骤(2)的温育产物与本发明第一方面所述的crrna、crisper蛋白、信号报告分子混合,温育;
146.(3)检测。
147.具体地,待测样品为受试者的血液或其级分(例如血清),特别是血清,或其稀释后的产物。
148.具体地,步骤(1)中,dna聚合所需试剂包括,例如,dna聚合酶(例如t4聚合酶)、dntp、mg
2
、缓冲体系等。
149.具体地,步骤(1)中的温育体系中,dna聚合酶(例如t4聚合酶)的浓度为1
‑
6u/50μl温育体系,特别是2u/50μl温育体系。
150.具体地,步骤(1)中的温育体系中,第四方面所述的偶联物和第五方面所述的偶联物的浓度为100fm
‑
10pm/50μl温育体系,特别是10pm/50μl温育体系。
151.具体地,步骤(1)中的温育体系中,样品浓度可以为5μl/50μl温育体系。
152.具体地,步骤(1)中的温育温度可以为37
‑
42℃,特别是37℃。
153.具体地,步骤(1)中的温育时间可以为10
‑
30分钟,例如20分钟。
154.在本发明的一些实施例中,步骤(1)中还包括将温育产物进行扩增的步骤。
155.具体地,扩增步骤包括:将温育产物与本发明第十一方面所述的组合产品混合,扩增温育。
156.具体地,扩增温育的温度可以为37
‑
42℃,特别是37℃。
157.具体地,扩增温育的时间可以为10
‑
30分钟,例如20分钟。
158.具体地,步骤(2)中的温育温度可以为37
‑
42℃,特别是37℃。
159.具体地,步骤(2)中的温育时间可以为10
‑
120分钟;在步骤(1)不包含扩增步骤时,步骤(2)中的温育时间可以为50
‑
120分钟;在步骤(1)包含扩增步骤时,步骤(2)中的温育时间可以为10
‑
60分钟。
160.在本发明的一些实施例中,步骤(3)的检测包括对步骤(2)的温育产物检测荧光的步骤。
161.在本发明另一些实施例中,步骤(3)中的检测包括将步骤(2)的温育产物加样至本发明第九方面所述的试纸的步骤。
162.具体地,该方法还可以包括制备本发明第四、五方面所述的偶联物的步骤。
163.在本发明的一些实施例中,制备第四方面所述的偶联物的步骤可以包括:
164.将本发明第二方面或第三方面所述的探针生物素化,然后与链霉亲和素混合,温育,再然后与目标抗原原料(例如sars
‑
cov
‑
2刺突蛋白rbd)混合,温育。
165.在本发明的一些实施例中,制备第五方面所述的偶联物的步骤可以包括:
166.将本发明第三方面或第二方面所述的探针生物素化,然后与链霉亲和素混合,温育,再然后与目标抗体的配体(例如抗人igg抗体或抗人igm抗体)混合,温育。
167.在本发明的一些实施例中,上述抗体检测方法为sars
‑
cov
‑
2抗体检测方法。
168.具体地,上述抗体检测方法可以用于诊断用途,也可用于非诊断用途。
169.第十八方面,本发明提供一种抗体检测方法,其包括如下步骤:
170.(a)设计目标核酸,其由依次连接的片段s1、s2和s3组成,即,其可表示为s1
‑
s2
‑
s3;
171.(b)设计crrna,其包含:(1)与cas核酸酶相互作用的框架核酸片段,以及(2)与目标核酸结合的特异性核酸片段;其中,特异性核酸片段由依次连接的片段s1’、s2’和s3’组成,即,其可表示为s1
’‑
s2
’‑
s3’,s1、s2和s3分别与s1’、s2’和s3’互补;
172.(c)设计单链dna探针1和2,其中,单链dna探针1包含片段s
a
,片段s
a
与片段s1
‑
s2相同(即与片段s1
’‑
s2’互补),单链dna探针2包含片段s
b
,片段s
b
与片段s2
‑
s3互补(即与片段s2
’‑
s3’相对应)。
173.其中片段s1、s2和s3,片段s1’、s2’和s3’,片段s
a
、s
b
具有本发明上述相应定义。
174.具体地,上述目标核酸、crrna、单链dna探针具有本发明上述相应定义。
175.具体地,上述方法还包括:
176.(d)分别将单链dna探针1和2与目标抗原部分和目标抗体的配体部分偶联的步骤,或,分别将单链dna探针2和1与目标抗原部分和目标抗体的配体部分偶联。
177.具体地,上述方法还包括:
178.(e)将偶联物与待测样品、dna聚合所需试剂混合,温育。
179.具体地,dna聚合所需试剂包括,例如,dna聚合酶(例如t4聚合酶)、dntp、mg
2
、缓冲体系等。
180.具体地,温育体系中,dna聚合酶(例如t4聚合酶)的浓度为1
‑
6u/50μl温育体系,特别是2u/50μl温育体系。
181.具体地,温育体系中,偶联物的浓度为100fm
‑
10pm/50μl温育体系,特别是10pm/50μl温育体系。
182.具体地,温育温度可以为37
‑
42℃,特别是37℃。
183.具体地,温育时间可以为10
‑
30分钟,例如20分钟。
184.在本发明的一些实施例中,步骤(e)中还包括将温育产物进行扩增的步骤。
185.具体地,上述方法还包括:
186.(f)将步骤(e)的温育产物(或扩增产物)与所设计的crrna、crisper蛋白、信号报告分子混合,温育。
187.具体地,温育温度可以为37
‑
42℃,特别是37℃。
188.第十九方面,本发明提供一种诊断由目标抗原所引起的疾病或病症的方法。
189.具体地,该方法可以包括采用第十六、十七、十八方面所述的方法的步骤,或,使用第一方面所述的crrna、第二和三方面所述的探针的步骤,或,使用第一方面所述的crrna、第四和五方面所述的偶联物的步骤,或,使用第一方面所述的crrna、第七方面所述的组合产品的步骤,或,使用第七和八方面所述的组合产品的步骤。
190.具体地,该方法还可以包括使用第十一方面所述的扩增组合产品的步骤。
191.具体地,该方法还可以包括使用第九方面所述的试纸的步骤。
192.具体地,该方法可以包括使用第十二或十三方面所述的试剂盒的步骤。
193.具体地,上述疾病或病症可以选自:鼻炎、鼻窦炎、哮吼、咽炎、扁桃体炎、腮腺炎、
喉炎、气管炎、哮喘、肺炎、流行性感冒、寨卡病毒病、艾滋病(aids)等中的一种或多种。
194.在本发明的一些实施例中,疾病为新型冠状病毒肺炎(covid
‑
19)(目标抗原为sars
‑
cov
‑
2)。
195.本发明提供了一种基于crispr技术的超灵敏抗体检测方法,其可用于检测机体中由抗原引起的免疫反应所产生的抗体(例如抗sars
‑
cov
‑
2抗体),灵敏度非常高,检测限可低至1am,操作简单,无需任何洗涤步骤,其可以在实验室环境中以高通量方式进行,也可以在资源有限的环境中用作poc诊断工具,且发明人经过大量实验验证了该方法的临床有效性。本发明还提供了用于该方法的crrna、探针、偶联物、组合产品、试纸、试剂盒等,其可灵活用于抗体检测,具有较高的开发和应用价值。
附图说明
196.图1所示为用于检测抗sars
‑
cov
‑
2刺突蛋白rbd mab的ucad测定的工作流程示意图(未对预先设计的dsdna条形码进行核酸扩增)。
197.图2所示为dsdna模板的序列设计,以激发crispr cas12a的侧切割活性,以及拆分dsdna模板的策略。
198.图3所示为两个ucad探针通过亲和基序与同一抗sars
‑
cov
‑
2抗体的就近结合将双链结构域的tm从10℃提高到46℃。
199.图4所示为使用无rpa的ucad检测mab的动力学曲线。mab浓度为125pm至8nm,并与空白(0)进行比较(p<0.01)。设定阈值(虚线)以确定达到相同荧光信号的临界时间τ。[ucad探针]=10pm,[t4聚合酶]=2单位,[dntp]=40μm,[cas12a]=40nm,[crrna]=40nm,[fq标记的报告分子]=40nm。
[0200]
图5所示为ucad测定的工作流程示意图。
[0201]
图6所示为ucad检测sars
‑
cov
‑
2刺突蛋白rbd人单克隆抗体(mab)中t4聚合酶的优化。[mab]=100fm,[ucad探针]=10pm,[dntps]=40μm,[cas12a]=40nm,[crrna]=40nm,[fq标记的报告分子]=40nm。
[0202]
图7所示为检测sars
‑
cov
‑
2刺突蛋白rbd人单克隆抗体的ucad探针浓度的优化。[mab]=100fm,[t4聚合酶]=2单位,[dntps]=40μm,[cas12a]=40nm,[crrna]=40nm,[fq标记的报告分子]=40nm。
[0203]
图8所示为使用ucad检测浓度范围为1am至1pm的抗
‑
sars
‑
cov
‑
2mab的动力学曲线。设定阈值(虚线)以确定达到相同荧光信号的临界时间τ。
[0204]
图9所示为δτ(δτ=τ空白
‑
τ样品)作为靶标浓度的函数来建立校准曲线,并将其与未经rpa扩增的ucad进行比较。每个误差条代表三次分析的一个标准偏差。
[0205]
图10所示为使用ucad测定法分析临床人血液样品中抗sars
‑
cov
‑
2抗体的工作流程示意图。
[0206]
图11所示为使用ucad在covid
‑
19阳性和阴性血清样品中检测抗
‑
sars
‑
cov
‑
2igg和igm的动力学曲线。
[0207]
图12所示为使用ucad和市售elisa试剂盒在稀释于阴性人血清样品中的covid
‑
19阳性人血清样品中检测抗
‑
sars
‑
cov
‑
2igg或igm,稀释倍数为1
‑
100000。
[0208]
图13所示为用阴性人血清稀释抗sars
‑
cov
‑
2igg阳性或igm阳性血清样品,并用
ucad检测抗病毒igg和igm。[ucad探针]=10pm,[t4聚合酶]=2单位,[dntp]=40μm,[cas12a]=40nm,[crrna]=40nm,[fq标记的报告分子]=40nm。
[0209]
图14所示为ucad用于测定人血清样品中抗sars
‑
cov
‑
2igg(或igm)的评价。对6个igg(或igm)阳性血清样品和6个阴性血清样品进行δτ的非参数t检验。两组间信号差异有统计学意义。***:p<0.001。
[0210]
图15所示为使用ucad检测6个抗
‑
sars
‑
cov
‑
2igg阳性样品中的每一个以及阴性人血清样品中的每一个的动力学曲线。[ucad探针]=10pm,[t4聚合酶]=2单位,[dntp]=40μm,[cas12a]=40nm,[crrna]=40nm,[fq标记的报告分子]=40nm。
[0211]
图16所示为使用ucad检测6个抗
‑
sars
‑
cov
‑
2igm阳性样品中的每一个以及阴性人血清样品中的每一个的动力学曲线。[ucad探针]=10pm,[t4聚合酶]=2单位,[dntp]=40μm,[cas12a]=40nm,[crrna]=40nm,[fq标记的报告分子]=40nm。
[0212]
图17所示为用于检测抗sars
‑
cov
‑
2igg和igm的ucad侧流读数的示意图。
[0213]
图18所示为在没有目标抗体的情况下,在c线捕获所有抗fam标记的aunp的侧流层析试纸条的设计。在存在抗sars
‑
cov
‑
2igg或igm的情况下,fam
‑
dig双重标记的报告分子被cas12a
‑
crrna切割,使aunp逃避c线处的捕获,并通过固定化二抗在t线处累积。
[0214]
图19所示为ucad结合侧流层析试纸条目测抗sars
‑
cov
‑
2igg/igm阳性和阴性血清样品。
具体实施方式
[0215]
除非另有定义,本发明中所使用的所有科学和技术术语具有与本发明涉及技术领域的技术人员通常理解的相同的含义。
[0216]
aunp
ꢀꢀꢀꢀꢀ
金纳米粒子
[0217]
ucad
ꢀꢀꢀꢀꢀ
ultrasensitive crispr
‑
based antibody detection,超灵敏crispr基抗体检测
[0218]
dsdna
ꢀꢀꢀꢀ
双链dna
[0219]
crrna
ꢀꢀꢀꢀ
crispr
‑
derived rna
[0220]
rbd
ꢀꢀꢀꢀꢀꢀ
receptor binding domain,受体结合结构域
[0221]
mab
ꢀꢀꢀꢀꢀꢀ
单克隆抗体
[0222]
rpa
ꢀꢀꢀꢀꢀꢀ
重组酶聚合酶扩增
[0223]
lod
ꢀꢀꢀꢀꢀꢀ
检测限
[0224]
nt
ꢀꢀꢀꢀꢀꢀꢀ
核苷酸
[0225]
本文所引用的各种出版物、专利和公开的专利说明书,其公开内容通过引用整体并入本文。
[0226]
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0227]
实施例的实验中所用部分试剂和材料如下:
[0228]
六水氯化镁(mgcl2·
6h2o)、氯化钠(nacl)、tween 20和生物素购自tansoole(上
海,中国)。a.s.cas12a(cpf1)v3购自integrated dna technologies(coralville,ia)。所有缓冲液、脱氧核苷酸(dntp)溶液混合物、t4聚合酶、链霉亲和素、生物素化抗人igg抗体、生物素化抗人igm抗体均购自sangon biotech(上海,中国)。所有dna序列均使用高效液相色谱法纯化。抗地高辛兔多克隆抗体购自abclonal biotech(武汉,中国)。金纳米粒子(aunp)(20nm)溶液购自西安瑞希生物技术有限公司(西安,中国)。生物素化sars
‑
cov
‑
2 spike rbd
‑
his重组蛋白购自sino biological(北京,中国)。sars
‑
cov
‑
2 spike rbd单克隆抗体(克隆名:otih 401)购自origene(北京,中国)。twistdx
tm rpa基础试剂盒购自twistdx(cambridge,u.k)。sars
‑
cov
‑
2 igg和igm elisa试剂盒,以及所有抗sars
‑
cov
‑
2igg和igm阳性和阴性人血清样品均购自bgi genomics(深圳,中国)。硝酸纤维素膜购自sigma aldrich(成都,中国)。
[0229]
实施例1
[0230]
ucad工作原理:
[0231]
将针对sars
‑
cov
‑
2的免疫球蛋白g(igg)和免疫球蛋白m(igm)的检测转化为合理设计的dna条形码的形成,该dna条形码可以被呈指数扩增并使用crispr
‑
cas12a特异性检测(工作流程如图1所示)。
[0232]
首先设计了可通过crrna
‑
cas12a复合物检测的双链dna(dsdna)模板(如图2所示)。然后将该dsdna模板分成两个单链dna(ssdna)探针,仅剩下5
‑
8nt互补结构域(蓝色结构域)。通过dna analyzer软件预估该短互补结构域的tm仅为~10℃,因此它们无法在37℃形成稳定的双链体。然后将两种ssdna探针分别与sars
‑
cov
‑
2刺突蛋白受体结合结构域(rbd)和抗人igg(或igm)抗体偶联。选择rbd是因为它的高特异性,能够将sars
‑
cov
‑
2与其它sars样冠状病毒区分开。然后,这两个ssdna探针可以与同一抗sars
‑
cov
‑
2抗体结合,并使两个互补结构域靠近。然后可以形成稳定的双链体,估计tm为46℃(如图3所示)。然后在t4聚合酶的驱动下,crispr
‑
可检测dsdna模板可以被再生并作为条形码用于检测抗sars
‑
cov
‑
2抗体。
[0233]
通过cas12a的目标诱导的侧切割活性(target
‑
induced collateral cleavage activity)对dsdna条形码进行直接定量,得到对sars
‑
cov
‑
2刺突蛋白rbd人单克隆抗体(mab)的线性检测。
[0234]
实验方法步骤如下:
[0235]
ucad探针的制备:
[0236]
将25μl的2.5μm生物素化ssdna探针1(如表1所示)与等体积的2.5μm链霉亲和素混合并在37℃下温育30分钟。冷却至室温后,将50μl的1.25μm生物素化sars
‑
cov
‑
2刺突蛋白rbd与反应溶液混合,并在25℃下再温育30分钟,得到ssdna探针1
‑
rbd偶联物。采用相同的方案将ssdna探针2(如表1所示)与抗人igg抗体或抗人igm抗体进行偶联,得到ssdna探针2
‑
抗人igg抗体/抗人igm抗体偶联物。偶联后,将制备的偶联物用tris
‑
生物素缓冲液(20mm tris
‑
hcl,0.01%bsa,1mm生物素)稀释至250nm,并在4℃下储存直至使用。
[0237]
抗体修饰的aunp的制备
[0238]
将100μl的9.5μg/ml兔抗fam多克隆抗体加入900μl的7
×
10
11
/ml aunp溶液中,并在室温下温育90分钟。然后向反应溶液中加入500μl的5%bsa,并在室温下再温育1小时。在4℃下将反应溶液在17000g下离心1小时,并收集aunp沉淀物。将沉淀物用pbs缓冲液洗涤两
次,然后重悬于20mm na3po4、5%bsa、0.25%tween 20和10%蔗糖的1ml缓冲液中。抗体修饰的aunp在4℃下储存直至使用。
[0239]
侧流层析试纸条(lateral flow strip)构建
[0240]
侧流层析试纸条由样品垫、结合垫、硝酸纤维素膜和吸附垫四部分组成。样品垫用含有0.25%triton x
‑
100、0.05m tris
‑
hcl和0.15m氯化钠的缓冲液饱和。将优化体积的aunp
‑
抗fam偶联物加样至结合垫上。将山羊抗地高辛多克隆抗体分配在对照(c)线处的硝酸纤维素膜上,并使用xyz平台分液器hm3030(上海金标生物科技有限公司)在测试(t)线处分配山羊抗兔igg。将所有膜和垫在37℃下干燥2小时,然后进行组装和切割。
[0241]
使用ucad进行蛋白检测
[0242]
(1)对于典型的测定,50μl反应混合物包含5μl不同浓度的样品、10pm ssdna探针1
‑
rbd偶联物、10pm ssdna探针2
‑
抗人igg抗体/抗人igm抗体偶联物、40μm dntp和2单位的t4聚合酶(在1x nebuffer
tm
2缓冲液中)。将该溶液在37℃下温育20分钟。(ssdna探针1经引物延伸后所形成的序列如seq id no:13所示,其为cas12a可识别的目标序列,ssdna探针2经引物延伸后所形成的序列如seq id no:14所示,其与seq id no:13所示序列互补)。
[0243]
(2)将10μl溶液与twistdx
tm rpa基础试剂盒中提供的试剂混合,并在37℃下温育20分钟。
[0244]
(3)对于荧光读数,在96孔微孔板中,将步骤(1)的温育产物或步骤(2)的rpa产物与40nm cas12a、40nm crrna(如表1所示)以及40nm fam
‑
bhq
‑
1标记的ssdna报告分子(如表1所示)在100μl1
×
nebuffer
tm
2中混合。使用cytation 5细胞成像多模式读数器(biotek),在495/520nm激发/发射,立即测量荧光并在37℃下每1分钟测量一次,持续2小时。
[0245]
(3’)对于侧流读数,将步骤(1)的温育产物或步骤(2)的rpa扩增产物与40nm cas12a、40nm crrna(如表1所示)和40nm fam
‑
dig ssdna报告分子(如表1所示)在20μl 1
×
nebuffer
tm
2中在37℃下温育30分钟,然后用30μl 4
×
ssc缓冲液加样至侧流层析试纸条的样品垫上。显影后,侧流层析试纸条上的结果可以直接使用肉眼读取或使用数码相机捕获。
[0246]
使用市售elisa试剂盒检测抗体(对比实验)
[0247]
按照试剂盒手册的说明进行抗sars
‑
cov
‑
2igg和igm的elisa。对于抗sars
‑
cov
‑
2igg检测,将10μl人血清与100μl稀释剂混合,并在elisa微板孔中在37℃下温育30分钟。然后将板用350μl洗涤缓冲液洗涤5次,然后加入100μl igg酶工作溶液。之后,将板在37℃下温育30分钟,并用5
×
350μl洗涤缓冲液再次洗涤。将50μl底物a和50μl底物b在微板孔中混合,并在37℃下避光温育10分钟,然后加入50μl淬灭溶液。淬灭后立即测量每个样品的od值(450
‑
620nm)。为了检测抗sars
‑
cov
‑
2igm抗体,将10μl人血清与100μl稀释剂混合,并在微板孔中在37℃下温育60分钟。5
×
350μl洗涤后,向板中加入100μl igm酶工作溶液,并在37℃下再温育30分钟。用350μl洗涤缓冲液洗涤5次,将igm elisa板与50μl底物a和50μl底物b在37℃下避光温育10分钟。在加入50μl淬灭溶液后立即测量od值(450
‑
620nm)。
[0248]
表1核酸序列和修饰
[0249][0250]
表1中的核酸序列均为发明人设计,然后委托合成公司进行合成所得。
[0251]
实验结果:
[0252]
采用无重组酶聚合酶扩增(rpa)的ucad检测mab的动力学曲线如图4所示,其中mab浓度为125pm至8nm,并与空白(0)进行比较(p<0.01)。设定阈值(虚线)以确定达到相同荧光信号的临界时间τ。如图4所示,ucad检测mab的lod为125pm。
[0253]
实施例2
[0254]
为了进一步降低ucad的lod,使用rpa来预扩增dsdna条形码,工作流程如图5所示。
[0255]
对ucad检测sars
‑
cov
‑
2刺突蛋白rbd人单克隆抗体(mab)中t4聚合酶的浓度进行优化,结果如图6所示。比较使用不同单位的t4聚合酶在每组(mab与空白)中产生的荧光信号,由于mab和空白样品之间的最大信号差异,选择2单位用于后续实验。
[0256]
对检测sars
‑
cov
‑
2刺突蛋白rbd人单克隆抗体的ucad探针浓度进行优化,结果如图7所示。10pm至100fm的ucad探针产生mab的荧光信号,其与空白区分开来,而100pm的ucad探针产生显著的非特异性结合。基于该优化,选择10pm ucad探针进行后续实验,以确保更大的检测动态范围。
[0257]
通过优化ssdna探针和t4聚合酶的浓度,发明人成功地实现了在pbs缓冲液中检测mab,其中lod可低至1am(如图8和9所示)。
[0258]
实施例3
[0259]
在缓冲液系统中实现了抗rbd mab的超灵敏检测(如实施例1和2中所述)后,发明人接下来验证了ucad针对真实covid阳性人血清样品的有效性,工作流程如图10所示,实验步骤参照实施例1中所述,结果如图11所示。
[0260]
值得注意的是,ucad测定成功地在商业covid阳性(或阴性)人血清样品中检测到抗sars
‑
cov
‑
2igg(图11a)和igm(图11b),阳性样品具有高荧光信号,而阴性样品具有低背景信号。
[0261]
值得注意的是,与缓冲液系统中的动力学曲线(图8)相比,图11a和11b中的结果显示背景信号显著降低,表明高浓度的人血清蛋白有助于防止在不存在目标抗体的情况下rbd与抗人igg(或igm)之间的非特异性结合。
[0262]
实施例4
[0263]
为了进一步评估ucad在临床血清样品中的灵敏性,用阴性人血清样品稀释covid阳性血清样品,稀释倍数为1
‑
100000。实验步骤参照实施例1中所述,结果如图12
‑
16所示。
[0264]
结果显示,ucad能够在所有稀释的样品中检测抗sars
‑
cov
‑
2igg(如图12a和图13a所示)和igm(如图12b和图13b所示)。作为比较,标准elisa试剂盒仅对10倍稀释的血清样品起作用(如图12a和12b所示),表明ucad测定在临床人血清样品中比标准elisa至少高10000倍。
[0265]
发明人成功鉴定了6份igg阳性(如图14a和15所示)和6份igm阳性(如图14b和16所示)人血清样品与阴性血清样品,进一步证实了ucad的临床有效性。
[0266]
实施例5发明人的最终目标是评估在即时(point
‑
of
‑
care,poc)设置中部署ucad作为covid
‑
19血清学测试的潜力,用于检测抗sars
‑
cov
‑
2igg和igm的ucad侧流读数的示意图如图17所示。发明人将用于cas12a的荧光猝灭剂标记的荧光ssdna报告分子转换为一端用fam标记而另一端用地高辛(dig)标记的ssdna报告分子(如上表1中所示),然后用固定在对照线(c线)上的抗
‑
dig和固定在测试线(t线)上的抗兔igg构建侧流测试条。在没有目标抗sars
‑
cov
‑
2抗体的情况下,fam
‑
dig标记的ssdna报告分子保持完整,这有助于在c线捕获所有兔抗fam标记的金纳米粒子(aunp)。在存在抗sars
‑
cov
‑
2igg或igm的情况下,ssdna报告分子被cas12a的靶标诱导的侧活性切割。结果,在t线处捕获了aunp。如图18所示。
[0267]
参照实施例1中所述实验步骤,通过测流层析试纸条对样品进行检测,结果如图19所示。通过目测图19中的结果,发明人能够从未感染的人血清样品中清楚地鉴定6个抗sars
‑
cov
‑
2igg阳性和6个igm阳性人血清样品。
[0268]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换等,均应包含在本发明的保护范围之内。
[0269]
本发明中描述的前述实施例和方法可以基于本领域技术人员的能力、经验和偏好而有所不同。
[0270]
本发明中仅按一定顺序列出方法的步骤并不构成对方法步骤顺序的任何限制。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。