用于重组多种逆转录病毒毒株中的不对称靶位点的良好耐受且高度特异性的修整重组酶
本技术是申请日为2015年9月1日的中国专利申请201580036183.5“用于重组多种逆转录病毒毒株中的不对称靶位点的良好耐受且高度特异性的修整重组酶”的分案申请。
1.本发明涉及制备编码良好耐受且高度特异性修整重组酶的表达载体的方法,以及获得的表达载体,用这些转染的细胞,表达的重组酶和包含所述表达载体、细胞和/或重组酶的药物组合物,所述修整重组酶能够重组可以插入宿主细胞的基因组中的多种逆转录病毒毒株的原病毒dna的长末端重复(ltr)内的不对称靶序列。药物组合物可用于,例如,治疗和/或预防逆转录病毒感染,特别是hiv感染。具体而言,本发明涉及良好耐受且高度特异性修整重组酶,其能够组合超过90%的hiv
‑
1毒株中的不对称靶序列,由此切除hiv
‑
1序列和编码它们的表达载体。
2.逆转录病毒感染诸如例如人免疫缺陷病毒(hiv)的感染仍然是最重要和最广泛的人类疾病之一。
3.治疗逆转录病毒例如hiv的一种方法是靶向插入宿主细胞的基因组中的原病毒。从宿主的基因组切除原病毒dna例如将防止进一步hiv复制,并且与当前方法的不同在于其具有根除存在于宿主的基因组中的甚至是休眠病毒的潜力。
4.考虑用于该替代方法的一类蛋白是位点特异性重组酶(flowers等人,1997)。位点特异性重组酶介导从基因重排至基因组分离的性质中的许多功能,诸如例如限定的dna单位的切除、导致或整合(在stark等人,1992中综述)。
5.最简单和最好理解的重组酶之一是来自噬菌体p1的cre重组酶,其通过特定序列的两个相同的(即对称的)双链dna位点之间的重组将基因组二聚体分解成单体(hoess&abremski,1985)。已经发现在小鼠遗传学中广泛使用cre重组酶(nagy,2000)。cre是38kda蛋白,以其功能命名,因为其引起重组(sternberg&hamilton,1981)。该重组的先决条件是由cre识别的两个重组位点以反向平行取向对齐,然后由接合形成环的四个相同的cre亚单位结合,其中每个亚单位接触两个相邻亚单位和一个重组位点的半个位点(hoess&abrems i,1985)。由cre识别的重组位点是称为loxp(来自跨越(x)的基因座,p1(locus of crossing over(x),p1);sternberg&hamilton,1981)的34
‑
bp双链dna序列,其是回文的,除了其八个最内部碱基对(称为间隔区),所述碱基对为位点赋予方向性。
6.一些位点特异性重组系统,包括cre/loxp
‑
系统,在没有辅助蛋白或辅因子的情况下发挥作用,并且在各种各样细胞条件下发挥作用。然而,由于位点特异性重组酶通过重组酶亚单位与其同源dna靶序列的特异性相互作用而发挥作用,因此这些酶的使用受到被靶向dna区必须含有适当定位的靶位点的需求的限制(lewandoski,2001)。到目前为止,没有鉴定到识别天然逆转录病毒序列作为其dna靶序列的野生型重组酶。
7.近年来已经实施位点特异性重组酶的广泛突变和结构分析,以改变它们的特性并且实现这些酶的复杂机制的更好理解(对于综述,参见van duyne,2001;和coates等人,2005)。许多研究集中于cre重组酶来探索其进化。几个研究表明,当改变cre的loxp识别位点中的几个核苷酸时,可以改变其靶特异性(buchholz&stewart,2001;santoro&schultz,
2002;rufer&sauer,2002)。进一步研究解决了含有来自hiv
‑
1的ltr的序列的突变的loxp靶位点的工程改造,以开发可能的靶位点,用于使用cre作为抗病毒策略(lee&park,1998;lee等人,2000)。
8.定向进化的方法是选择具有改变的特异性的酶的有效方法(yuan等人,2005综述;和johannes&zhao,2006)。在开始时,该方法用于通过基于rna选择具有改变的底物位点的rna分子来分离改进的酶。基于pcr的方法的使用允许筛选非常大型的文库并从候选物的汇集物中回收成功的编码区。相比之下,在蛋白的定向进化中,通过蛋白特性的改变鉴定的改进突变体的筛选和回收需要回收编码所述蛋白的核酸序列的方法。已经经常通过区室化来维持蛋白与其编码序列之间的联系。因此,定向蛋白进化中的文库筛选受限于维持区室的“一个接一个(one
‑
by
‑
one)”方法,并且还没有与筛选候选物的汇集物相关的优点。
9.已经通过开发允许使用mrna
‑
蛋白融合和核糖体展示使蛋白与其各自的信使rna(mrna)交联的方法克服了该限制。因此,改进蛋白特性的功能筛选与相应编码分子的直接回收相联系,并且已经体外筛选大型的汇集物(参见例如buchholz等人,1998)。通过所谓的底物连接的蛋白进化实现了定向蛋白进化的进一步改进(slipe;buchholz&stewart,2001),其中重组酶的底物位于与蛋白编码区相同的dna分子上。以该方式,当在区室内表达重组酶时,其作用改变紧邻其自身编码区的dna底物。因此,可以通过pcr筛选文库作为汇集物,以仅扩增紧邻改变的底物的候选编码区。这允许方便地筛选大型文库以快速回收成功的编码区。该方法用于改变cre重组酶的dna特异性并使其适于新识别靶位点(buchholz&stewart,2001)。
10.鉴于位点特异性重组酶的潜力以及发现从宿主细胞的基因组消除hiv
‑
1原病毒的aids疗法的需求,wo 2008/083931公开了修整重组酶(tre)的生成,所述修整重组酶(tre)能够重组插入宿主细胞的基因组中的逆转录病毒的原病毒dna的ltr内的不对称靶位点,因此从宿主细胞的基因组切除原病毒。实施例中公开的工程改造的重组酶,tre,识别存在于特定hiv
‑
1毒株中的特定不对称位点。不对称靶位点与由cre识别的对称loxp位点具有某些同源性。wo 2008/083931认识到,由于逆转录病毒、特别是hiv的高序列变异性,对于具有不同hiv毒株的患者的治疗,可能必须调整不同的修整重组酶,或者制备含有对各种靶序列有特异性的修整重组酶的重组酶的集合。
11.相比之下,wo 2011/147590 a2提供了能够切除多种逆转录病毒、例如hiv毒株的修整重组酶。因此,生成的重组酶可以用于多种hiv感染,而无需为每种毒株生成新的重组酶。本发明人发现,尽管逆转录病毒存在高序列变异性,但使用创新方法,可鉴定存在于高比例特定亚型的病毒中的不对称靶序列。令人惊讶地,可鉴定存在于96%的hiv
‑
1亚型b毒株(即欧洲和美洲的流行毒株)中的靶序列(seq id no:1)。还鉴定了存在于较低百分比的hiv
‑
1毒株中的另一靶序列(seq id no:2)。使用cre(seq id no:6)作为分子定向进化的基础,他们还鉴定了能够重组所述不对称靶序列的几种修整重组酶,并提供这些修整重组酶的共有序列,例如seq id no:7或tre 3.0(seq id no:8,能够重组seq id no:1)。
12.鉴于此,本发明人解决了提供能够重组存在于多种hiv
‑
1毒株中的不对称靶序列的改进的修整重组酶的问题。本发明人已经令人惊讶地发现,具有与如wo 2011/147590 a2所教导的共有序列seq id no:8不同的序列的修整重组酶对存在于96%的所有hiv
‑
1亚型b毒株(即欧洲和美洲的流行毒株)的不对称靶序列seq id no:1也具有高度活性,并且具有
改进的特征。根据本发明的修整重组酶优选包含seq id no:9的共有氨基酸序列,更优选地,seq id no:10或seq id no:11
‑
13中任一个的更特定共有序列。本发明的修整重组酶与根据现有技术的修整重组酶相比具有改进的特异性,并且因此被人类,特别是在人类t细胞中被更好地耐受。所述重组酶优选地是高度特异性的,因为它们对由其开发它们的重组酶的已知靶序列,例如对loxp(seq id no:4)、loxh(seq id no:5)或还有对loxltr tre 1.0(seq id no:3),不具有任何可检测的残余活性。
13.本发明首次提供用于生成编码良好耐受且高度特异性的修整重组酶的表达载体的方法,所述修整重组酶能够重组插入宿主细胞的基因组中的一种毒种的多种逆转录病毒毒株的原病毒dna的ltr内的不对称靶序列。已经通过将底物分成与原始靶具有较小差异的多个新子集并逐步修整重组酶以识别这些子集而修整重组酶,以识别不同于可以存在于多种逆转录病毒毒株中的其天然对称靶位点的不对称靶位点(wo 2008/083931和wo 2011/147590)。组合方法允许选择识别给定序列内的不对称靶位点的功能分子。因此,在定向分子进化期间穿过底物中间物,已经有可能产生具有远程新型不对称靶特异性的酶。该方法也用于本发明中。本发明补充了wo 2008/083931和wo 2011/147590教导的方法,因为其引入选择被人细胞、特别是人t细胞良好耐受的修整重组酶的步骤。
14.具体地,本发明提供用于制备编码良好耐受的修整重组酶的表达载体的方法,所述修整重组酶能够重组可以插入宿主细胞的基因组中的多种逆转录病毒毒株的原病毒dna的ltr内的不对称靶序列,包括以下步骤:在多种逆转录病毒毒株的原病毒dna的ltr序列中鉴定序列,所述序列与至少一个已知重组酶靶位点的左半位点序列和右半位点序列具有至少30%的同源性,其中所述同源序列被5
‑
12个核苷酸的间隔区分开,且其中发现所述不对称靶序列存在于多种逆转录病毒毒株中;和通过以下的重复步骤生成:i)使用基于不对称靶序列的序列、但经修饰以仅含有来自已知靶序列的有限数目的变异的修饰的靶序列作为底物,对至少一种识别已知同源靶位点的重组酶的分子定向进化;其中在每轮中,所述靶序列可以与已知重组酶对其上的一个、两个或三个核苷酸起作用的靶序列不同:和ii)改组重组酶文库以获得能够重组与所述不对称靶序列更同源的靶序列的重组酶文库;直到获得对逆转录病毒dna的ltr内的不对称靶序列具有活性的至少一种重组酶;通过分子定向进化和文库的改组来针对已知靶位点的重组阴性选择的重复步骤;通过在人细胞、特别是人t细胞中表达文库,和将表达修整重组酶的所述人细胞培养至少1周、优选至少2周,以及从表达可选择标记的培养的细胞分离重组酶的核酸,来选择一种或多种所述修整重组酶;和,任选地,将编码所述重组酶的核酸克隆至合适的表达载体中。
15.本发明具体地提供了用于制备编码良好耐受且高度特异性修整重组酶的核酸或表达载体的方法,所述修整重组酶能够重组多种逆转录病毒毒株的原病毒dna的ltr内的不对称靶序列,其包括以下步骤:(a)鉴定与多种逆转录病毒毒株的原病毒dna的ltr的序列中的至少一个已知重组酶靶位点的左半位点序列和右半位点序列具有至少30%同源性的序列,其中所述同源序列被5
‑
12个核苷酸的间隔区分开,且其中发现所述不对称靶序列存在于多种逆转录病毒毒株
中;(b)鉴定两个序列,其中第一序列对应于与所述已知靶位点的左半位点同源的步骤(a)的不对称靶序列的序列,并称为“半位点序列1”,且其中第二序列对应于与右半位点同源的步骤(a)的不对称靶序列的序列,并称为“半位点序列2”;(c)测定与步骤(a)的至少一个已知同源靶位点的相应同源左半位点和右半位点序列不同的步骤(b)的序列内的核苷酸;(d)生成包含靶序列的两个靶核酸的第一子集,其中第一靶序列被称为亚位点1,且以5
′
至3
′
顺序包含彼此相邻的步骤(b)的半位点序列1、不对称靶序列的间隔区序列和半位点序列1的反向重复,且其中第二靶序列被称为亚位点2,且以5
′
至3
′
顺序包含彼此相邻的半位点序列2的反向重复、不对称靶序列的间隔区序列和步骤(b)的半位点序列2;(e)基于步骤(d)的第一子集中的靶序列生成包含修饰的靶序列的靶核酸的第二子集,其中,在基于亚位点1的序列中,在左半位点序列中,与步骤(a)的至少一个已知靶位点的相应同源半位点序列不同的一部分核苷酸被所述已知靶位点中发现的天然核苷酸替代,直至所述半位点序列含有与所述已知靶位点不同的一个、两个或三个核苷酸,其中所述修饰的靶序列的右半位点由所述修饰的左半位点序列的反向重复形成,所述修饰的左半位点序列的反向重复通过不对称靶序列的间隔区序列与所述修饰的左半位点序列分开,且其中,在基于亚位点2的序列中,在右半位点序列中,与步骤(a)的至少一个已知靶位点的相应同源半位点序列不同的一部分核苷酸被所述已知靶位点中发现的天然核苷酸替代,直至所述半位点序列含有与所述已知靶位点不同的一个、两个或三个核苷酸,其中所述修饰的靶序列的左半位点由所述修饰的右半位点序列的反向重复形成,所述修饰的左半位点序列的反向重复通过不对称靶序列的间隔区序列与所述修饰的右半位点序列分开,使得在放在一起的源自步骤(d)的第一子集的一个靶序列的所有修饰的半位点序列中,可以发现所有偏差核苷酸,而所述修饰的半位点序列无一单独包含所有偏差核苷酸,(f)使用步骤(e)中获得的第二子集中的每个核酸作为底物,对识别根据步骤(a)的已知同源靶位点的至少一种重组酶分别应用分子定向进化;(g)改组步骤(f)中进化的重组酶文库,其中组合并改组在基于亚位点1的序列上进化的所有重组酶文库,且其中组合并改组在基于亚位点2的序列上进化的所有重组酶文库;(h)使用根据步骤(d)的子集的每个核酸作为底物对步骤(g)中获得的改组文库应用分子定向进化,优选底物连接的蛋白进化;(i)改组步骤(h)中进化的重组酶文库;(j)使用包含步骤(a)的不对称靶序列的核酸作为底物,对步骤(g)中获得的改组文库应用分子定向进化,优选底物连接的蛋白进化,直至获得至少一种重组酶,所述重组酶对步骤(a)的逆转录病毒dna的ltr内的不对称靶序列具有活性;(k)从所述文库分离编码步骤(j)中获得的至少一种重组酶的核酸,并将其克隆至进化载体中,所述进化载体允许阴性选择重组根据步骤(a)的已知靶位点的修整重组酶,由此获得文库;(l)对步骤(k)中获得的文库应用分子定向进化,优选底物连接的蛋白进化;(m)改组步骤(1)中获得的文库;
(n)分离编码步骤(m)中获得的至少一种修整重组酶的核酸,并将其克隆至用于在人细胞中表达编码的重组酶和可选择标记的载体中,由此获得载体文库,(o)用步骤(n)中获得的所述载体文库转化人细胞,优选人t细胞;(p)将表达所述可选择标记的细胞培养至少1周,并选择所述可选择标记的高表达;(q)从步骤(p)中获得的表达所述可选择标记的细胞分离编码重组酶的核酸;(r)选择编码重组酶的核酸,所述重组酶能够重组步骤(a)的不对称靶序列;(s)从所述文库分离编码步骤(f)中获得的至少一种重组酶的核酸;和,(t)任选地,将步骤(s)中获得的核酸克隆至合适的表达载体中。
16.在本发明方法的步骤(a)中,可以确定原病毒dna的ltr的序列,诸如例如通过使用链终止抑制剂的dna测序(sanger等人,1977)。然而,如果已经确定插入宿主的基因组中的逆转录病毒dna的ltr的序列,则可以通过参考数据库来确定该序列。基于序列信息,进行序列信息的基于计算机的分析,以在其中鉴定分别与已知重组酶的已知靶位点的左半位点序列和右半位点序列具有至少30%的同源性的序列,所述已知重组酶的已知靶位点的左半位点序列和右半位点序列由5
‑
12个核苷酸的合适间隔区分开,其中所述不对称靶序列被发现存在于多种逆转录病毒毒株中。优选地,与已知靶位点的左半位点序列和右半位点序列的同源性为至少40%或至少50%。优选地,这些逆转录病毒毒株具有一种毒种或其一种亚型。优选地,多种毒株包含多于10种毒株,更优选地,多于100种毒株,多于130种毒株,多于200种毒株或多于300种毒株,例如hiv毒株。所述毒株可以来自病毒的一种亚型,例如hiv
‑
1,hiv
‑
1亚型a、b和c,优选地,hiv
‑
1亚型b。因此,获得的重组酶或编码其的表达载体可用于治疗多种毒株(例如,逆转录病毒或其亚型的多于50%、多于70%、多于80%、多于90%或所有已知毒株)的感染。
17.如本文所使用的术语“重组酶”是指参与重组的蛋白。因此,重组酶识别并结合称为“重组位点”或“靶位点”的两个特定dna序列,并介导这两个靶位点之间的重组。因此,术语“重组酶”意指介导特定dna基因座中的dna重排的任何重组系统的任何蛋白组分。天然存在的重组酶识别由形成反向重复的近似9
‑
20bp的称为“半位点”的两个相同序列组成的对称靶位点,其中半位点序列由5
‑
12bp的间隔区序列分开。来自酪氨酸整合酶家族的重组酶的特征在于具有酪氨酸作为用于dna切割的活性位点亲核体,而来自丝氨酸整合酶家族的重组酶使用丝氨酸、而非酪氨酸。
18.在本发明的一个实施方案中,其靶序列用于步骤(a)中且在步骤(h)和(j)中对其应用分子定向进化的至少一种已知重组酶属于丝氨酸整合酶的家族。属于丝氨酸整合酶的家族的优选重组酶选自phic31整合酶(combes等人,2002)、gln或hin重组系统的任何组分、tn3解离酶(krasnow&cozzarelli,1983)或大丝氨酸重组酶的任何其它成员、rag1、rag2或vdj重组系统的任何其它组分或其变体。
19.在另一个实施方案中,所述重组酶属于酪氨酸整合酶的家族。属于酪氨酸整合酶的家族的优选重组酶选自来自噬菌体p1的cre(abremski等人,1983,1984)、来自酵母的flp重组酶(volert&broach,1986)、来自噬菌体d6的dre(sauer&mcdermott,2004)、来自鲁氏接合酵母(zygosaccharomyces rouxii)质粒psr1的r重组酶、来自果蝇克鲁维酵母(kluveromyces drosophilarium)质粒pkd1的a重组酶、来自沃氏克鲁维酵母
(kluveromyces waltii)质粒pkw1的a重组酶、来自芽孢杆菌转座子tn4430的tnpi、λint重组系统的任何组分或其变体。优选地,所述重组酶是cre重组酶或其变体。
20.此上下文中的术语变体是指通过氨基酸的缺失、取代和/或添加而衍生自上述蛋白且保留衍生它们的蛋白中固有的一些或全部功能的蛋白。
21.在优选的实施方案中,已知重组酶是通过例如如crameri等人(1998)所述的“家族改组”获得的嵌合重组酶。采用家族改组的先决条件是用于生成嵌合重组酶的重组酶之间的显著同源性。可用于本发明中的嵌合重组酶的实例是分别由重组酶cre的序列和重组酶dre的序列组成的嵌合重组酶。
22.在一个更优选实施方案中,所述重组酶是识别称为loxp的34bp的对称靶位点的cre重组酶。loxp位点(和还有野生型重组酶的其它重组位点)是回文的,其具有由八个最内部碱基对分开的两个13bp重复,所述八个最内部碱基对代表所谓的间隔区,其为位点赋予方向性。通过在间隔区序列内的切割发生重组。根据两个参与loxp位点的相对位置和取向,cre催化dna整合、切除或重排(hoess&abremski,1985)。
23.一种有用的重组酶是分离自肠沙门氏菌(salmonella enterica)的zre或其变体、片段和同源物,例如与野生型序列具有至少约70%、至少约80%、至少约90%或至少约95%的同源性,且具有重组酶功能。zre重组酶在zox位点重组dna。它们可以单独或在文库的情况下用于开始本发明的方法。
24.在最优选实施方案中,重组酶文库用作分子进化的起始点,例如,包含不同野生型和/或适应/改组的重组酶的重组酶文库,例如,如例如wo 2011/147590 a2的实施例2中所述。此类文库优选用作用于生成能够识别seq id no:1或可替代地seq id no:2的修整重组酶的起始点。
25.通过本发明的方法获得的修整重组酶能够重组多种逆转录病毒毒株的原病毒dna的ltr内的不对称靶序列。由重组酶靶向的原病毒dna可以插入宿主细胞的基因组中。或者,本发明的修整重组酶可以重组多种逆转录病毒毒株的原病毒dna的ltr内的不对称靶序列,所述多种逆转录病毒毒株尚未(仍未)整合至宿主细胞的基因组中,即作为非整合的整合前复合物(pic)存在。因此,尚未整合至宿主细胞的基因组中的hiv以及已经整合的hiv可以由本发明的修整重组酶灭活。
26.应当注意,在本发明中和还在本领域中,术语“靶序列”、“靶位点”和“重组位点”可互换使用。
27.与识别对称靶位点的天然存在的重组酶相反,本发明的方法提供修整重组酶,其识别并非由通过间隔区分开的回文序列组成的靶位点。而是,在不对称靶位点中,所述序列不形成对称的反向重复。因此,能够识别不对称靶位点的修整重组酶应当识别和重组由不同序列的半位点组成的靶位点。
28.在不对称靶位点内,分别称为“左半位点”和“右半位点”的序列通过其与已知靶位点的左半位点和右半位点的同源性来定义。位于与已知靶位点的左半位点和右半位点同源的序列之间的序列称为间隔区。
29.然而,如果在ltr中发现仅与已知靶位点的左半位点或右半位点序列具有同源性的序列,则这些序列仍可用于本发明的实践中。属于重组酶(其天然靶序列显示与ltr内的序列的同源性)的靶位点的大小是本领域技术人员已知的。例如,如果在ltr序列内发现与
由cre重组酶识别的靶序列的同源性,则由cre重组酶识别的不对称靶位点应当由34个核苷酸组成,其具有各自由8个核苷酸的间隔区分开的两个13个核苷酸的半位点序列。因此,ltr内的同源序列被定义为不对称靶位点的左半位点或右半位点或间隔区,这取决于与已知靶位点的序列的同源性。因此,与已知靶序列的左半位点具有同源性的序列被定义为左半位点,与已知靶序列的右半位点具有同源性的序列被定义为右半位点。从该定义开始,在考虑已知靶位点的结构的情况下,定义不对称靶位点的其它部分。因此,已经例如相对于与loxp位点(由cre重组酶识别)的同源性定义ltr内的右半位点序列,可以容易地定义对应于间隔区和不对称靶序列的左半位点的其它序列。间隔区序列例如通过计数定义为右半位点序列的序列的5
′
末端上游的8个核苷酸来定义,而左半位点序列类似地通过计数先前定义的间隔区序列的5
′
末端上游的13个核苷酸来定义。
30.在此上下文中以及在整个申请中的同源性意为序列同一性。对于同源目的的优选比较是使用本领域已知的标准技术比较至少两个序列,所述标准技术包括但不限于,smith&waterman(1981)的局部同源性算法、needleman&wunsch(1970)的同源性比对算法或pearson&lipman(1988)的相似性搜索方法。为了本技术的目的,除非另有说明,序列同源性优选使用可得自欧洲生物信息学研究所(european bioinformatics institute,ebi)的clustalw计算机程序确定。
31.鉴于原病毒的基因组中必须存在两个相同靶位点以允许重组酶切除这两个靶位点之间的序列的要求,在本发明方法的步骤(a)中查看在基因组中至少存在两次的原病毒dna的序列。此类序列是例如原病毒dna的ltr序列。因此,优选查看ltr的序列,因为原病毒dna的5
′‑
ltr和3
′‑
ltr是相同的。存在于5
′‑
ltr中的不对称靶位点也存在于3
′‑
ltr中,因此允许切除位于ltr之间的原病毒dna。
32.在ltr序列内鉴定的与已知靶位点具有足够同源性的序列中,优选选择与已知重组酶的靶位点的序列具有最高同源性的序列。然而,也可选择除了具有最高同源性的序列以外的序列,例如,存在于最高数目的逆转录病毒毒株中或存在于目标逆转录病毒毒株中的那些序列,例如,如果患者感染特定毒株。
33.应当注意,本发明方法的潜力甚至允许修整识别与已知靶位点具有小于30%同源性、例如至少11%或至少20%同源性的不对称靶位点的重组酶。然而,为了确保各个不对称靶位点或其亚位点的残余重组活性的存在,优选查看与已知重组酶的已知靶位点的左半位点和右半位点序列具有至少30%的同源性的序列。在进一步优选实施方案中,选择与已知重组酶的已知靶位点的左半位点和右半位点序列具有至少31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、更优选85%、特别优选90%、并且最优选95%的同源性的不对称靶序列。
34.在本发明的一个实施方案中,在ltr内选择的序列与由位点特异性重组酶cre识别的对称loxp靶位点具有同源性。
35.在一个优选实施方案中,重组酶文库用作分子进化的起始点,例如,包含不同野生型和/或适应/改组的重组酶的重组酶文库,诸如wo 2011/147590 a2的实施例2中描述的文库。示例性文库包含cre和由其衍生的重组酶。其还可以包含tre、dre、来自沙门氏菌属和希
瓦氏菌属的重组酶和/或由其衍生的重组酶。所述文库可以包含,例如,cre、dre、dre
″
cre
‑
ed
″
、希瓦氏菌重组酶(shew)、shew
″
cre
‑
ed
″
和/或zre,如wo 2011/147590 a2中所公开。tre是如wo 2008/083931所公开的修整重组酶,其也进一步称为tre 1.0。
36.在一个实施方案中,所述文库中的所有重组酶识别具有相同长度的间隔区的靶序列。包括间隔区的半位点序列1和2的总长度优选为34个核苷酸。
37.如果所述至少一种重组酶是重组酶文库,则同源性是与已知重组酶靶位点的汇集物的同源性(即,在给定位置与至少一个靶序列的同源性被定义为同源性)。因此,在步骤(c)中,仅仅是不对应于至少一个已知靶序列中的核苷酸的那些核苷酸被定义为偏差核苷酸。在重组酶文库的情况下,步骤(e)中的“天然核苷酸”可以是存在于任何已知靶序列中的该位置的核苷酸,优选地,其为存在于几个或大多数已知靶序列中的该位置的核苷酸。
38.为了鉴定存在于多种逆转录病毒毒株中的靶序列,已经在文献中描述的重组酶的已知识别位点可以用作对基因组的一段序列检索保守的不对称靶序列的查询。然而,鉴于区域的重复性质,排除使用标准序列相似性检索工具。sarkar等人,2007,使用blast(altschul等人,1997)以在整个hiv毒株中发现lox样结合位点。当横跨hiv
‑
1ltr序列进行时,对lox样位点的blast检索导致发现存在于单一毒株中的仅一个位点。blast对于此类短冗余序列不能很好地进行,并且替代程序诸如hmmer(eddy等人,1998)、repeatmasker或来自软件包的embosssuite的回文程序也证明是不合适的。用使用以基于重组酶的已知识别位点的侧翼区域的位置权重矩阵为基础的算法和在序列被转换成比特串之后对其使用二进制运算的特定程序,wo 2011/147590 a2鉴定了多种逆转录病毒毒株中发现的不对称靶序列。
39.对于hiv
‑
1,测定合适的不对称靶序列,其具有如下seq id no:1或seq id no:2所述的序列。这使得有可能生成重组酶,其实际上可用作针对显著数目的患者中的逆转录病毒基因组的治疗剂,因为这些重组酶靶向存在于尽可能多的逆转录病毒毒株中的识别位点。
40.seq id no:1和2的左半位点和右半位点序列加下划线,且间隔区以粗体印刷:seq id no:1存在于96%的检索的hiv
‑
1亚型b毒株中(1024/1067),92%的检索的hiv
‑
1亚型c毒株中(624/679)和82%的检索的hiv
‑
1亚型a毒株中(71/87)。seq id no:2在较低百分比的b亚型和c亚型毒株中是相同的。
41.seq id no:1与已知重组酶靶位点的汇集物具有54%的同源性,且seq id no:2与这些序列的汇集物具有42%的同源性(分别关于左半位点和右半位点)。与单独已知靶位点的同源性较低,例如对于seq id no:1为至少30%,且对于seq id no:2为至少11%。具体而言,在与已知靶位点具有低单独同源性的情况下,使用重组酶文库作为起始材料可以是有利的,例如用于生成能够重组seq id no:1或seq id no:2的修整重组酶,所述文库为包含cre、fre、dre、zre和tre的文库。
42.在本发明方法的步骤(b)中,与已知靶位点的左半位点同源的原病毒的ltr内的不对称靶位点的序列被定义为“半位点序列1”。与已知靶位点的右半位点同源的原病毒的ltr内的不对称靶位点的序列被定义为半位点序列2。代表左半位点和右半位点的序列之间的
序列被称为间隔区。
43.在步骤(c)中,通过序列比对和序列比较来确定与已知靶的相应的同源左半位点和右半位点序列的序列不同的步骤(b)的序列的分别在“半位点序列1”和“半位点序列2”内的核苷酸。在此上下文中,将“半位点序列1”的序列与相应的天然半位点(其优选为左半位点序列)进行比较,而将“半位点序列2”的序列与形成回文天然靶位点的另一半位点(其优选为右半位点序列)进行比较。
44.wo 2011/147590 a2的图1显示了这种seq id no:1和2与重组酶文库相比的比较的结果。在暗背景前显示偏差核苷酸。
45.该比较不必在本发明方法的步骤(b)之后和步骤(d)之前进行,但也可以在步骤(a)之后和步骤(e)之前的该方法的不同阶段中进行。
46.在步骤(d)中,生成包含靶序列的两个靶核酸的第一子集,其中第一靶序列被称为亚位点1,并且以5
′
至3
′
顺序包含彼此相邻的步骤(b)的半位点序列1、不对称靶序列的间隔区序列和半位点序列1的反向重复,且其中第二靶序列被称为亚位点2,并且以5
′
至3
′
顺序包含彼此相邻的半位点序列2的反向重复、不对称靶序列的间隔区序列和步骤(b)的半位点序列2。第一子集的靶序列是具有对称靶位点的结构的回文寡核苷酸序列。这些人工对称靶位点基于步骤(b)的半位点序列通过作为反向重复与每个寡核苷酸序列中缺失的半位点序列互补来合成,其中“半位点序列1”和“半位点序列2”的序列分别用于与在间隔区序列相对末端的第二半位点序列互补。因此,第一子集中的第一靶序列(称为“亚位点1”)包含由通过间隔区序列分开的“半位点序列1”和反向重复的“半位点序列”组成的反向重复,而第一子集中的第二靶序列(称为“亚位点2”)包含由通过间隔区序列分开的反向重复的“半位点序列2”和“半位点序列2”组成的反向重复。在“亚位点1”中,所述序列如下排列:5
′‑″
半位点序列1
″‑
间隔区
‑″
半位点序列1的反向重复
’″‑3′
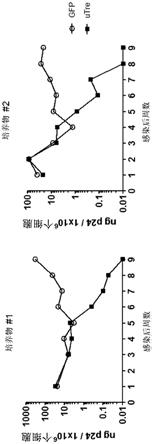
,在“亚位点2”中,所述序列如下排列:5
′‑″
半位点序列2的反向重复
”’‑
间隔区
‑″
半位点序列2
″‑3′
。
47.所述第一子集的每两个合成靶序列内的间隔区序列是优选相同的,并且对应于代表或定义为不对称靶位点的间隔区序列的ltr的序列。然而,在另一个实施方案中,所述间隔区序列可以包含源自核苷酸取代的一个或两个序列偏差。
48.通常,该步骤代表选择用于修整特异性重组酶的不对称靶位点的序列的第一分割(参见wo 2008/083931的图1,其完全通过引用并入本文,和wo 2011/147590 a2的图2,其也完全通过引用并入本文)。在此步骤中生成序列,其携带衍生自选择用于修整特定重组酶的不对称靶位点的半位点的对称靶位点。结果是,存在于所述不对称靶位点的一个半位点中的每个突变(即,与原始(野生型)重组酶识别的靶位点的差异)现在已经分布于第一子集中的对称靶标序列之间。
49.在本发明方法的步骤(e)中,基于步骤(d)的第一子集中的靶序列生成包含修饰的靶序列的靶核酸的第二子集。在基于亚位点1的序列中,在左半位点序列中,与步骤(a)的至少一个已知靶位点的相应同源半位点序列不同的一部分核苷酸被所述已知靶位点中发现的天然核苷酸替代,直至所述半位点序列含有与所述已知靶位点不同的一个、两个或三个(优选两个)核苷酸,其中所述修饰的靶序列的右半位点由所述修饰的左半位点序列的反向重复形成,所述修饰的左半位点序列的反向重复通过不对称靶序列的间隔区序列与所述修饰的左半位点序列分开。
50.在基于亚位点2的序列中,在右半位点序列中,与步骤(a)的至少一个已知靶位点的相应同源半位点序列不同的一部分核苷酸被所述已知靶位点中发现的天然核苷酸替代,直至所述半位点序列含有与所述已知靶位点不同的一个、两个或三个(优选两个)核苷酸,其中所述修饰的靶序列的左半位点由所述修饰的右半位点序列的反向重复形成,所述修饰的右半位点序列的反向重复通过不对称靶序列的间隔区序列与所述修饰的右半位点序列分开。
51.例如,如果一个亚位点包含六个偏差核苷酸,诸如关于wo 2011/147590 a2的图1中显示的重组酶的文库,基于seq id no:1的两个亚位点或seq id no:2的亚位点2,则可以基于所述亚位点生成三个修饰的靶序列,其各自在左半位点(如果基于亚位点1)或右半位点(如果基于亚位点2)含有两个(不同的)偏差核苷酸。因此,在每个修饰的靶序列中,将各自亚位点的序列修饰为对应于四个核苷酸中的已知靶序列(或至少一个已知靶序列)的序列(wo 2011/147590 a2的图2)。当然,也可生成六个修饰的靶序列(其各自含有偏差核苷酸之一)或两个靶序列(其各自含有偏差核苷酸中的三个)。
52.在另一个实例中,如果一个亚位点包含九个偏差核苷酸,诸如关于wo 2011/147590 a2的图1中显示的重组酶的文库,seq id no:2的亚位点1,则可以基于所述亚位点生成三个修饰的靶序列,其各自在半位点中含有三个(不同的)偏差核苷酸。
53.结果是,在放在一起的源自步骤(d)的第一子集的一个靶序列的所有修饰的半位点序列中,可以发现所有偏差核苷酸,而所述修饰的半位点序列无一单独包含所有偏差核苷酸。
54.再次,基于修饰的半位点序列生成反向重复,使得间隔区序列将形成所述反向重复的两个序列分开(参见wo 2011/147590 a2的图2)。衍生自较高子集的靶序列的新子集的每个修饰的靶序列内的间隔区序列是优选相同的,并且对应于代表或定义为不对称靶位点的间隔区序列的ltr的序列。然而,在另一个实施方案中,所述间隔区序列可以包含源自核苷酸取代的一个或两个序列偏差。使用该方法,代表每个子集的靶序列中的突变(即与野生型重组酶识别的靶位点的差异)的数目小于起始不对称靶序列中的数目,但所有突变仍然在靶序列之一中表示(参见wo 2008/083931的图1,wo 2011/147590 a2的图2)。
55.如本文所使用的术语“偏差核苷酸”是指ltr内鉴定或定义的不对称靶序列内的核苷酸或根据本发明生成的子集的靶序列内的核苷酸,其与本发明方法的步骤(a)中选择的已知重组酶的已知同源对称靶序列的相应同源序列中的相同位置存在的核苷酸有偏差(即不同)。在此上下文中,术语“偏差核苷酸”和“突变”可互换使用。
56.wo 2008/083931教导,如果用作底物的靶序列与天然靶序列相差不超过3个核苷酸,则可以使用分子定向进化使用靶序列作为底物来修整重组酶。因此,上述不同顺序的子集的生成用于将每个靶序列的偏差核苷酸的数目减少至3个或更少(参见wo 2008/083931的图1)。偏差核苷酸的数目的逐步减少最终得到具有减少数目的偏差核苷酸的不同顺序的靶序列的许多子集,直至产生可以用作分子定向进化的底物的最终子集。当生成不同的子集并由此减少偏差核苷酸的数目时,与野生型重组酶识别的靶位点的差异分布于各自不包含这些偏差核苷酸中的多于3个的几个靶序列之间,而作为整体的最终顺序的靶序列仍然代表所有偏差核苷酸。
57.任选地,在本发明的方法中,可以从第二子集的靶序列开始通过如下生成靶序列
的其它子集:逐步重复步骤(e)的过程,即,将靶序列分成各自半位点序列,且在改变衍生自第二子集的靶序列的半位点的序列之后基于这些半位点序列生成新的回文结构,每次生成靶序列的新子集,其中用于生成反向重复的半位点序列含有与至少一个已知靶位点的相应同源半位点序列不同的较少核苷酸。这些额外靶序列可以用于定向分子进化和重组酶文库的改组的额外步骤。当然,此额外步骤也可以仅对所述序列中的一些、例如对其中获得具有低重组效率的重组酶的序列进行。如果生成额外子集且在这些上进化的重组酶,则在本发明方法的步骤(f)中使用重组酶的进化文库。
58.从步骤(e)中获得的靶序列的第二子集开始,可以生成第三子集,随后如果需要,生成第四、第五、第六子集等。然而,如果第二子集的靶序列仍然含有多于三个偏差核苷酸,则第三子集的生成通常仅是必需的。然而,如果先前子集的靶序列仍然含有多于三个偏差核苷酸,则其适用于生成下一子集,这仅是必需的。应当注意,在一个实施方案中,将生成靶序列的子集,直至最终子集的靶序列仅包含一个偏差核苷酸。因此,根据每个半位点序列中的偏差核苷酸的数目,对于不对称靶位点的每个半位点序列生成的子集的数目可以不同。例如可能需要为左半位点序列仅生成两个子集,而对于右半位点必须生成三个或四个子集,以便将所述偏差核苷酸分布于几个靶序列之间,使得单个靶序列不包含这些偏差核苷酸的多于3个。
59.wo 2008/083931的图1中举例说明了生成靶序列的进一步子集以将偏差核苷酸的数目减少至低于3的数目的原理,且wo 2011/147590 a2的图2提供了修饰的靶序列的具体实例。
60.在步骤(f)中,使用步骤(e)中获得的含有一个、两个或三个与步骤(a)的已知同源靶位点的相应同源半位点序列不同的核苷酸的最终或第二子集的靶序列作为底物,对识别所述已知同源靶位点的至少一种重组酶应用分子定向进化的方法。
61.如本文所使用的术语“最终子集”是指步骤(e)中生成的最后子集,即,如果对第二子集没有生成额外子集。取决于不对称靶位点中的偏差核苷酸的数目和必须生成以便将每个靶序列的偏差核苷酸的数目减少至低于3的子集的数目,所述“最终子集”可以对应于任何子集,例如第二、第三、第四或更后面的子集,并且对于ltr内的不对称靶序列的半位点序列可以不同。如果先前已经在具有与所述已知同源靶位点的相应同源半位点序列不同的较少核苷酸的修饰靶序列的额外子集上进化了重组酶,则使用该步骤中获得的重组酶。
62.当然,可以用针对特定修饰靶序列的特定重组酶和针对另一特定修饰靶序列的另一重组酶(或文库)开始本发明的方法。分子定向进化的方法,也称为实验室进化或体外进化,是本领域已知的(对于综述,参见yuan等人,2005及其中的参考文献;johannes&zhao,2006)。
63.在分子定向进化的第一步骤中,通过本领域已知的方法,例如,通过使用易错pcr和dna改组(在例如yuan等人,2005中综述)或国际专利申请wo 2002/44409中公开的方法,生成随机突变的重组酶序列的文库。包含突变的重组酶的每个文库的质粒也含有步骤(f)中获得的最终子集的靶序列之一。在将生成的质粒文库转染至适当细胞中之后,能够进行重组酶的表达,并且实施分子定向进化,如本领域技术人员已知。
64.在一个优选实施方案中,本发明方法的步骤(f)中采用的分子定向进化是底物连接的蛋白进化(slipe;buchholz&stewart,2001;国际专利申请wo 02/44409)。可以实施底
物连接的蛋白进化,如wo 2008/083931或wo 2011/147590 a2的实施例中所详细描述。简言之,将步骤(e)中获得的靶序列与随机突变的重组酶的编码序列一起克隆至质粒(所谓的进化载体)中。随机突变通过易错pcr实施(参见buchholz&stewart,2001)。然后将生成的质粒文库转染至大肠杆菌细胞中以允许重组酶的表达。通过使用诱导型启动子以驱动重组酶的表达,可以调节表达水平。孵育过夜之后,从细胞分离质粒dna,并用ndei消化以切割未重组的质粒,并且随后用引物仅扩增重组的质粒。重组形式的质粒的pcr产物产生1.7kb条带。pcr产物用bsrgi和xbai消化,并亚克隆回类似消化的进化载体用于下一进化循环。
65.在步骤(g)中,组合并改组步骤(f)中进化的重组酶文库。dna改组的技术是本领域已知的(对于综述,参见m1nshull&stemmer,1999;stemmer,1994)。组合并改组基于亚位点1在修饰靶序列上进化的重组酶文库,并且分开地,组合并改组基于亚位点2在修饰靶序列上进化的重组酶文库。然后将组合和改组的文库克隆至包含下一更高子集的靶序列的新一代载体中,即如果生成生两个子集,则下一更高子集为步骤(d)中生成的子集。例如,基于亚位点1在序列上进化的文库的载体包含亚位点1的序列作为靶序列,并且基于亚位点2在序列上进化的文库的载体包含亚位点2的序列作为靶序列。
66.在步骤(h)中,使用下一更高子集的靶序列对步骤(g)中获得的改组文库应用分子定向进化的方法,其如所讨论可以是根据步骤(d)的子集。在该步骤中,可以使用与步骤(f)中之前应用方法相同的分子定向进化方法,但也可以在本发明方法的该步骤中使用不同的分子定向进化方法。分子定向进化的不同方法的实例描述于例如yuan等人(2005)。优选地,底物连接的蛋白进化的方法也应用于组合和改组的文库。
67.该步骤得到识别并重组携带来自较低子集的不同靶序列的的突变的组合(并且因此增加数目)的靶序列的重组酶。来自靶序列的较低子集的不同文库的突变的组合产生协同效应,并导致重组酶的产生,其现在重组更高子集的靶序列,证明穿过中间物的进化策略可以用于实现期望活性。
68.在步骤(i)中,重复步骤(g),即重组酶文库的组合和改组,和(j),即对组合和改组文库应用分子定向进化,直至获得至少一种重组酶,其对存在于原病毒dna的ltr中的不对称靶序列具有活性。
69.在其中必需生成靶序列的两个子集以生成仅具有一个、两个或三个核苷酸偏差的靶序列的方法中,将例如对于靶序列的第二子集进化的重组酶文库组合和改组,并且使用第一子集的靶序列对此改组文库应用分子定向进化。在下一步骤中,使用原病毒dna的ltr内的步骤(a)的不对称靶序列通过分子定向进化以使包含识别第一子集的靶序列的重组酶的重组酶文库进化,以获得至少一种重组酶,其对逆转录病毒dna的ltr内的不对称靶序列具有活性。在此步骤中,分子定向进化的方法优选是底物连接的蛋白进化的方法。
[0070]“至少一种重组酶”是指以下事实:本发明的方法可导致一种或多种(单一)重组酶,其各自本身在重组不对称靶序列中具有活性。其不意欲涵盖几种不同的重组酶,所述几种不同的重组酶仅在一起能够重组不对称靶序列。事实上,本发明的方法不会导致选择重组酶,所述重组酶需要与其它、不同的重组酶组合以重组不对称靶序列,因为每个单独细胞仅表达一种重组酶。
[0071]
方法步骤(a)
‑
(j)本质上是本领域已知的,特别是从wo2011/147590已知。
[0072]
在步骤(j)之后,针对根据步骤(a)的已知对称靶位点的重组,例如针对loxp和/或
loxh的重组,阴性选择修整重组酶的文库。
[0073]
可以通过包含靶向分子进化和载体文库的改组的一个或多个步骤的至少一个循环来实现该选择。
[0074]
为此,编码先前步骤中进化的至少一种修整重组酶的核酸可以从其中使用的载体分离,并克隆至合适的进化载体中。所述载体允许阴性选择重组根据步骤(a)的已知靶位点,例如用于重组loxp(seq id no:4)和/或loxh(seq id no:5)的修整重组酶。由此获得载体的文库。然后利用如本领域技术人员已知且根据上述原理的分子定向进化,优选地,底物连接的蛋白进化(slipe)。
[0075]
例如,可以构建进化载体,使得其包含最终不对称靶序列(例如seq id no:1)和已知靶位点(例如,loxp和/或loxh),各两次以允许重组。在已知靶位点处的重组和随后的限制性消化导致线性产物,其不包含以允许产物的pcr扩增的顺序的两个特异性引物位点。如果完全不发生重组,则通过限制性消化将载体线性化,并且不发生通过pcr的扩增。相比之下,在最终不对称靶位点(例如seq id no:1)处的重组切除限制性位点,即载体不通过限制性消化线性化,并且可以通过pcr扩增修整重组酶。固有地产生误差的pcr用于产生变异性。可以在大肠杆菌中实施进化。
[0076]
可以改组在一个或多个、优选地约十个循环的分子定向进化之后获得的文库。可以实施分子定向进化和/或改组的一个或多个进一步循环。
[0077]
任选地,可以交替地实施用于重组几个已知靶位点、例如用于重组loxp和loxh的阴性选择,例如,对loxp的阴性选择的进化的一个循环可以与对loxh的阴性选择的进化的一个循环交替。例如,可以实施约10至约30或约15
‑
20个循环的阴性选择,其与约两轮的dna改组组合。在这些进化循环之间,可以改变转录激活物l
‑
阿拉伯糖的量,例如100μg/ml至1μg/ml。优选的载体和方法显示于图2和实施例中。
[0078]
在已经实施多个进化循环之后,可以针对一个或多个克隆检查修整重组酶对最终不对称靶序列的特异性和对已知靶序列的潜在残余活性。
[0079]
如果特异性还不令人满意,则应当实施进一步进化循环。
[0080]
如图3中所示,所述阴性选择去除修整重组酶(诸如由wo 2011/147590 a2(tre3)教导的那些)对loxp和loxh的已知靶序列的残余活性。本发明的生成的重组酶对已知靶位点(例如loxp和/或loxh)的残余活性甚至在大量(50或100μg/ml)转录激活物l
‑
阿拉伯糖存在的情况下,即,在大量重组酶存在的情况下是检测不到的。这显示获得的修整重组酶对于其靶序列(在该情况下,对于seq id no:1)是高度特异性的,因为特定不对称靶序列被重组,但已知对称靶序列不被重组。
[0081]
这具有这样的优点,当对于人疗法应用本发明的修整重组酶时,宿主细胞中与人序列的交叉反应和人序列的重组的风险是最小的。这是有助于修整重组酶在人细胞中的耐受性的一个因素。然而,不仅重组酶的表达的短期结果在这里是问题,而且,甚至在低效力下,安全方面,诸如非特异性重组的可能致癌作用也是问题。修整重组酶的甚至残余活性的消除因此有助于所得修整重组酶在治疗环境中的安全性和可靠性。
[0082]
针对已知对称靶序列的重组的选择之后是选择在人细胞中良好耐受的修整重组酶。
[0083]
在本发明方法的步骤(n)中,分离编码步骤(m)中获得的至少一种修整重组酶的核
酸并克隆至用于在真核细胞(优选地,人细胞)中表达编码的重组酶和可选择标记的载体中,由此获得载体文库。可以使用适当的限制性酶从文库内的各自的质粒分离核酸。限制性内切酶消化的方法是技术人员已知的。然后可以通过已知方法诸如凝胶电泳回收编码重组酶的核酸。可以将其克隆至用于在真核细胞(例如人细胞)中表达的适当的表达载体中,如本领域已知或如下所述。例如,可以使用逆转录病毒,例如慢病毒载体,例如,如图4a中所示。编码的修整重组酶和可选择标记的表达优选是组成型的,或者其可以通过合适的试剂诱导。
[0084]
所述可选择标记可以赋予对抗生素的抗性,或者其可以是荧光蛋白诸如绿色荧光蛋白(gfp)或其衍生物(例如,ebfb、ecfp、yfp)。荧光蛋白诸如gfp允许根据表达强度容易地分选细胞。
[0085]
在步骤(1)中,用步骤(k)中获得的所述载体文库转化真核细胞,优选人细胞,优选人t细胞。可以使用现有技术中已知的方法。转化的细胞通常是人细胞,然而,如果意欲治疗非人患者,则建议测试在该患者物种的细胞中的耐受性。所述人细胞优选是造血细胞,例如优选t细胞,特别是cd4 t细胞,但也可以使用干细胞,诸如cd34 干细胞。可以使用原代细胞,例如原代t细胞,优选原代cd4 t细胞,但也可以采用细胞系,诸如jurkat t细胞。
[0086]
在步骤(p)中,将表达所述可选择标记的细胞培养足以选择被人细胞良好耐受的tre重组酶的一段时间。所述选择基于标记和修整重组酶的表达相关的假设。针对标记的表达选择细胞,例如选择gfp阳性细胞,优选具有gfp强表达的细胞。由于可选择标记和修整重组酶的表达相关,这些细胞也将表达修整重组酶。因此,在量上消除或减少表达对其存活或其繁殖能力有害的修整重组酶的细胞。优选地,将表达该标记的细胞培养至少1周、至少两周、至少3周或至少4周。因此,t细胞中表达的修整重组酶将被人细胞、例如人t细胞良好耐受,即其对所述细胞无毒,或者优选地也对所述细胞的存活和繁殖无害。优选地,在培养期间,针对可选择标记的高表达,将细胞选择至少一次,优选2、3或4次。例如,用荧光蛋白,可以通过荧光激活的细胞分选进行选择。用抗生素抗性基因,可以向培养基中添加渐增量的抗生素。
[0087]
尽管野生型cre重组酶在人细胞中的表达已经长时间建立且已经以合理表达水平显示没有问题,但cre的过表达可以是有毒的(loonstra等人,2001)。本发明人发现,显著数目的根据本发明的突变的修整重组酶在强过表达时对人t细胞的存活和/或繁殖是有害的。有趣的是,即使可以预期相对低的修整重组酶的特异性以及对靶位点诸如loxp和loxh(人基因组中存在的序列)的残余活性导致人细胞中的低耐受性,仅选择人t细胞中的耐受性,而无先前对高特异性的选择,不足以消除对loxp或loxh的残余交叉反应性。因此,仅两个选择步骤与本发明的先前已知方法的组合导致良好耐受和高度特异性的修整重组酶。
[0088]
在步骤(q)中,培养和选择步骤之后是从步骤(p)中获得的表达所述可选择标记的细胞分离编码至少一种重组酶的核酸。
[0089]
步骤(r)是任选的,并且增加编码重组酶的核酸的另一选择,所述重组酶能够重组步骤(a)的不对称靶序列、优选以高活性重组。优选在人细胞、特别是人cd4 t细胞中测试重组活性,但其也可以在大肠杆菌中测试。
[0090]
在步骤(s)中,从文库中分离对逆转录病毒dna的ltr内的步骤(a)的不对称靶序列具有活性的重组酶的核酸。可以使用适当的限制性酶从文库内的各自质粒分离核酸。限制
性内切酶消化的方法是技术人员已知的。然后可以通过已知方法诸如凝胶电泳回收编码重组酶的核酸。
[0091]
核酸可以储存(优选在低于
‑
80℃的温度下),或者可以任选地在步骤(t)中克隆至表达载体中,其用于进一步分析,用于蛋白表达方法,或用于施用于受试者以供治疗和/或预防逆转录病毒感染,特别是hiv感染和/或aids。合适的表达载体在现有技术中是已知的或如下公开。
[0092]
特异性靶向多个hiv
‑
1 ltr内的不对称序列诸如seq id no:1的修整重组酶的开发允许从大多数感染hiv
‑
1的受试者的原病毒染色体整合切除各自的原病毒。编码此重组酶的表达载体,用其转染的细胞和/或由其衍生的重组酶蛋白具有医学用途,例如治疗和/或预防hiv
‑
1感染。制备此修整重组酶或编码其的表达载体的优选方法在wo 2011/147590中教导。本发明人向wo 2011/147590中描述的方法添加以下步骤:对于高特异性进行活性选择,即对步骤(a)的已知靶序列(或对例如loxp和loxn)没有可检测的交叉反应性,和对于修整重组酶在人细胞(诸如人t细胞)中的耐受性进行活性选择。如所述,这显著改善修整重组酶用于从人t细胞切除hiv原病毒基因组的医学用途。
[0093]
可以插入宿主细胞的基因组中或可能尚未插入的原病毒dna优选是逆转录病毒的dna。逆转录病毒包含包膜rna病毒的大型和多种家族。所述家族的标志特征是其复制策略,其包括将病毒rna逆转录成线性双链dna和随后将该dna(原病毒dna)整合至宿主细胞的基因组中作为必要步骤。将逆转录病毒被细分为由进化相关性定义的七个组。这些组中的5个(d
‑
、β
‑
、δ
‑
、ε
‑
和γ
‑
逆转录病毒)代表具有致癌潜力的逆转录病毒,并且其它两组是慢病毒和泡沫病毒。人致病性人t细胞白血病病毒i型和ii型(htlv
‑
i和htlv
‑
ii)属于δ
‑
逆转录病毒组,而aids病毒人免疫缺陷病毒1型和2型(hiv
‑
1和hiv
‑
2)属于慢病毒组(关于综述,参见标准教科书“逆转录病毒”,coffin jm、hughes sh、var us he(编),1997,cold spring harbor laboratory press,new york)。
[0094]
在一个实施方案中,可以插入宿主细胞的基因组的原病毒dna是逆转录病毒的dna,所述逆转录病毒选自以下:小鼠乳腺肿瘤病毒(mmtv)、mason pfizer猴病毒(mpmv)、人t细胞白血病病毒i型(htlv
‑
i)、人t细胞白血病病毒ii型(htlv
‑
ii)、猿猴t细胞白血病病毒i型(stlv
‑
i)、猿猴t细胞白血病病毒ii型(stlv
‑
ii)、牛白血病病毒(blv)、猫白血病病毒(felv)和莫洛尼鼠白血病病毒(momlv)。
[0095]
在另一个实施方案中,所述逆转录病毒是慢病毒,其选自人免疫缺陷病毒1型(hiv
‑
1)、人免疫缺陷病毒2型(hiv
‑
2)、猿猴免疫缺陷病毒(siv)、猫免疫缺陷病毒(fiv)、牛免疫缺陷病毒(biv)、maedi
‑
visna病毒(mvv)、马感染性贫血病毒(eiav)和山羊关节炎脑炎病毒(caev)。如上所述,hiv、特别是hiv
‑
1是优选的。
[0096]
本发明方法的步骤(a)中鉴定的不对称靶序列位于hiv原病毒的5
′‑
ltr和3
′‑
ltr中。优选地,所述位于hiv原病毒的5
′‑
ltr和3
′‑
ltr中的不对称靶序列具有如seq id no:1或seq idno:2所述的序列。
[0097]
在一个优选实施方案中,本发明方法中应用的分子定向进化的方法是底物连接的蛋白进化的方法(slipe;buchholz&stewart,2001;还参见wo 02/44409)。
[0098]
通过实施如本文所述的本发明方法,本发明人生成了编码良好耐受的修整重组酶的几种核酸和修整重组酶本身。因此,本发明提供了良好耐受的修整重组酶,或编码其的核
2011/147590产生),尽管与其它重组酶相比已经相当有特异性,但在所示条件下对loxp和loxh具有残余活性,而对于utre(本发明的重组酶),重组产物仅对于包含seq id no:1的loxltr可见。此高度特异性尽可能降低人基因组中的不期望重组的风险。
[0106]
wo 2008/083931或wo 2011/147590中没有公开本发明的修整重组酶的序列。具体而言,现有技术没有教导或暗示能够重组seq id no:1的不对称靶序列的修整重组酶具有氨基酸交换q89l。相比之下,wo 2011/147590明确地教导,该位置应当保持为q(参见所述公开的所有特定序列或共有序列)。本发明的修整重组酶的序列也不同于天然存在的重组酶,诸如cre、dre、fre或zre,这从其能够重组可以插入宿主细胞的基因组中的多种逆转录病毒毒株的原病毒dna的ltr内的不对称靶序列、优选seq id no:1的特征显而易见。
[0107]
如果能够重组插入宿主细胞的基因组中的多种逆转录病毒毒株的原病毒dna的ltr内的不对称靶序列的修整重组酶将重组seq id no:1的靶序列,则其优选包含共有序列tre 31 85%,seq id no:9,或tre 3.1共有序列100%,seq id no:10,或特定序列seq id no:11
‑
13之一。
[0108]
能够重组可以插入宿主细胞的基因组中的多种逆转录病毒毒株的原病毒dna的ltr内的不对称靶序列的功能性修整重组酶(其可以例如通过本发明方法获得)可以与所述序列不同,但所述序列为本领域技术人员提供有价值的指导以产生能够重组不对称靶侧诸如seq id no:1的修整重组酶,甚至不实施本发明方法。
[0109]
优选地,相对于参考序列的氨基酸交换是保守取代,这是本领域技术人员众所周知的(例如creighton(1984),proteins.w.h.freeman和company(编辑))。例如,保守取代用另一氨基酸取代来自带负电荷的氨基酸组的一个氨基酸。最优选地,该交换导致在相关位置存在于seq id no:11
‑
13中任一个中的氨基酸之一。
[0110]
能够重组可以插入宿主细胞的基因组中的多种逆转录病毒毒株的原病毒dna的ltr内的不对称靶序列的修整重组酶还可以包含2种或更多种序列的组合,所述序列选自seq id no:11
‑
13,例如这些序列中任一个例如seq id no:11的c
‑
末端部分,和这些序列中任何其它序列例如seq id no:12的n
‑
末端部分。所述c
‑
末端部分可以具有1
‑
342个氨基酸的长度。在两个序列的组合中,n
‑
末端部分可以具有1
‑
342个氨基酸的长度。所述修整重组酶还可以是衍生自这些序列的三个或更多个部分的组合。所述组合包含tre 3.1共有基序,例如seq id no:10或优选seq id no:9。
[0111]
本发明还提供了编码修整重组酶的核酸,所述重组酶能够重组可以插入宿主细胞的基因组中的多种逆转录病毒毒株的原病毒dna的ltr内的不对称靶序列诸如seq id no:1,所述修整重组酶包含如上所定义的氨基酸序列。
[0112]
在本发明的上下文中,包含序列的核酸或蛋白可以由所述序列组成。
[0113]
其可以替代地包含其它序列,例如提供在特定细胞区室中的表达/定位的信号序列,诸如核定位信号,如seq id no:14中(所述核定位信号在seq id no:14的位置2
‑
9)。如果蛋白待用于药物组合物中,则特别优选将其表达为具有蛋白转导结构域诸如tat蛋白转导结构域(其允许靶细胞的蛋白转导)的融合蛋白。优选地,将待用于药物组合物中的本发明的修整重组酶制备为具有核定位序列和具有蛋白转导结构域(例如,来自tat)的融合蛋白,且编码本发明的修整重组酶的核酸可以编码此融合蛋白。例如,以下蛋白转导结构域可用于具有本发明的修整重组酶的融合蛋白,其优选进一步包括核定位信号:
‑
hiv
‑
1 tat反式激活物的基本结构域(fawell s,seery j,daikh y,moore c,chen ll,pepinsky b,barsoum j,异源蛋白至细胞的tat介导的递送(tat
‑
mediated delivery of heterologous proteins into cells),proc natl acad sci u s a.1994jan 18;91(2):664
‑
8)
‑
果蝇触角(antp)的同源结构域(derossi d,joliot ah,chassaing g,pro
‑
chiantz a.,触角同源结构域的第三螺旋通过生物膜易位(the third helix of the antennapedia homeodomain translocates through biological membranes.),j biol chem.1994apr 8;269(14):10444
‑
50.)
‑
hsv vp22转录因子(elliott g,o
′
hare p.,通过疱疹病毒结构蛋白的细胞内运输和蛋白递送(intercellular trafficking and protein delivery by a herpesvirus structural protein).,cell.1997jan 24;88(2):223
‑
33.)
‑
乙型肝炎病毒(hbv)的pre s2表面抗原的细胞可渗透易位基序(tlm)(oess s,hildt e.,衍生自乙型肝炎病毒表面抗原的pre s2结构域的新细胞可渗透易位基序(novel cell permeable motif derived from the pres2
‑
domain of hepatitis
‑
b virus surface antigens.),gene ther.2000may;7(9):750
‑
8.)。
[0114]
在蛋白待纯化的情况下,还可以添加促进蛋白纯化的标签,诸如his标签。
[0115]
本领域技术人员可以选择编码如上定义的tre重组酶的本发明的核酸的密码子使用。例如,可以选择适合于在人细胞中表达的密码子使用,特别是如果意欲在人细胞中表达,例如用于治疗目的。密码子使用也可以基于例如cre重组酶的密码子使用。
[0116]
所述修整重组酶或编码所述修整重组酶的核酸可以通过本文所述的本发明方法获得,或者其可以通过该方法可获得。还可以基于本文公开的序列,任选地通过组合和/或进一步改变这些序列,任选地测试重组不对称靶位点诸如seq id no:1的活性来获得。
[0117]
本发明进一步提供了组合物,例如文库,其包含两种或更多种核酸,其编码如上所定义的修整重组酶,例如编码包含根据seq id no:9、优选地根据seq id no:10或seq id no:11
‑
13中任一个的不同序列的两种或更多种修整重组酶。在一个实施方案中,所述组合物包含编码修整重组酶的核酸,所述修整重组酶包含两种或更多种、三种或更多种、四种或更多种、五种或更多种、十种或更多种、20种或更多种或25种或更多种重组酶,其包含根据seq id no:9
‑
13中任一个的序列或这些序列的组合。此类组合物,特别是其中核酸是表达载体的组合物,可以特别适合作为如下所述的药物组合物。
[0118]
在本发明的方法中,优选将编码修整重组酶的核酸克隆至表达载体中,所述修整重组酶对逆转录病毒dna的ltr内的不对称靶序列具有活性。表达载体是用于表达由载体内的核酸编码的蛋白的遗传构建体。此类表达载体可以是自我复制的染色体外载体或整合入宿主基因组中的载体。通常,这些表达载体包括可操作连接至编码本发明的修整重组酶的核酸的转录和翻译调节核酸。
[0119]
术语“控制序列”是指在特定宿主生物体中表达可操作连接的编码序列所必需的dna序列。适合于原核生物的控制序列,例如,包括启动子,任选地操纵子序列和核糖体结合位点。已知真核细胞利用启动子、多聚腺苷酸化信号和增强子。
[0120]
当将核酸置于与另一核酸序列的功能关系中时,其是“可操作连接的”。例如,如果启动子或增强子影响编码序列的转录,则其与该序列可操作连接;或者如果将核糖体结合
位点定位以便于翻译,则其与编码序列可操作连接。通过在方便的限制性位点处连接来完成连接。如果此类位点不存在,则根据常规实践使用合成的寡核苷酸适配子或接头。转录和翻译调节核酸通常适于用于表达所述修整重组酶的宿主细胞。对于各种宿主细胞,许多类型的适当的表达载体和合适的调节序列是本领域已知的。
[0121]
用于本发明中的表达载体可以是逆转录病毒载体、慢病毒载体、泡沫病毒载体、腺病毒载体或腺相关病毒载体。然而,在一个优选实施方案中,所述表达载体是慢病毒载体,其选自hiv
‑1‑
、siv
‑
、fiv
‑
或eiav
‑
衍生的慢病毒载体。慢病毒载体例如描述于schambach等人(2006)或欧洲专利申请号1 1000751.5中。
[0122]
在本发明的优选实施方案中,所述表达载体包含细胞启动子、细菌启动子、病毒启动子或杂合启动子。
[0123]
通常,为了本发明的目的,所述启动子可以是组成型或诱导型启动子。此外,所述启动子可以是天然存在的启动子,诸如细菌启动子、细胞启动子或病毒启动子,或杂合启动子。组合多于一种启动子的元件的杂合启动子是本领域已知的,并且可用于本发明中。此外,用于本发明中的启动子也可以是天然存在的启动子的衍生物。如本文所使用的天然存在的启动子的“衍生物”可以是获得自不同来源的启动子或序列的顺式活性元件的组合,或者可替代地,可以通过特定天然存在的启动子中的顺式活性元件的缺失或突变来获得(edelman等人,2000;alper等人,2006;hartenbach&fussenegger,2006)。
[0124]
在本发明的一个实施方案中,所述组成型启动子或其衍生物选自或衍生自巨细胞病毒、劳斯肉瘤病毒、鼠白血病病毒相关逆转录病毒、磷酸甘油激酶基因、小鼠脾脏病灶形成病毒或人延伸因子1α的启动子。
[0125]
在本发明的另一个实施方案中,所述诱导型启动子或其衍生物选自或衍生自从慢病毒、泡沫病毒和δ逆转录病毒衍生的ltr或其衍生物。
[0126]
在此上下文中,术语“ltr”是指具有启动子功能的原病毒的5
′
和3
′
长末端重复(关于综述,参见标准教科书
″
逆转录病毒
″
(coffin jm,hughes sh,varmus he(编)1997,cold spring harbor laboratory press,new york))。
[0127]
优选地,所述诱导型启动子或其衍生物选自或衍生自从hiv
‑
1、hiv
‑
2、mvv、eiav、caev、siv、fiv、biv、htlv
‑
i和htlv
‑
ii衍生的ltr或其衍生物。
[0128]
本发明进一步提供了用于制备修整重组酶的方法,其中所述方法包括前述用于制备编码修整重组酶的表达载体的方法,和在合适的宿主细胞中从所述表达载体表达所述修整重组酶(或包含所述修整重组酶的氨基酸序列的融合多肽)的其它步骤。
[0129]
优选地,在哺乳动物细胞中测试最终获得的重组酶,以确保它们在哺乳动物细胞环境中发挥功能。此外,为了在哺乳动物细胞中获得良好的表达,可以针对这些细胞中的表达优化所述重组酶(例如使用本领域众所周知的方法进行密码子使用优化。参见例如shimshe等人,2002)或者可以将引导蛋白至哺乳动物细胞的核所需的信号序列,诸如nls序列(macara,2001)添加至所述修整重组酶的核酸。可以使用例如细菌、昆虫或哺乳动物表达系统实施克隆至表达载体中的编码修整重组酶的核酸的表达,例如根据用于制备编码修整重组酶的表达载体的方法的步骤(1)。然而,也可以采用本领域已知的其它表达系统。将外源核酸引入哺乳动物、昆虫或细菌宿主以及其它宿主的方法也是本领域众所周知的,并且将随所使用的宿主细胞而变化。技术包括葡聚糖介导的转染、磷酸钙沉淀、聚凝胺介导的转
染、原生质体融合、电穿孔、病毒感染、将多核苷酸包封于脂质体中以及将dna直接显微注射至核中。
[0130]
融合蛋白通过本领域众所周知的方法制备。例如,其中克隆编码所述修整重组酶的核酸的表达载体已经包含编码第二多肽或蛋白的核酸序列。通过克隆编码与第二多肽或蛋白的序列同框的修整重组酶的核酸,两个序列将表达为融合蛋白。
[0131]
用于从表达载体表达所述修整重组酶的宿主细胞包括原核细胞,诸如例如细菌细胞或酵母细胞,或优选真核细胞,诸如例如昆虫细胞或哺乳动物细胞,最优选人细胞。所述宿主细胞可以是造血细胞,例如成体造血干细胞或t
‑
细胞,例如cd4 细胞。所述细胞可以衍生自感染逆转录病毒的受试者,并且可以在转化、和任选培养和/或繁殖后,将细胞施用回受试者。
[0132]
本发明进一步提供了用于制备转化的成体干细胞的方法,其中所述方法包括用于制备编码修整重组酶的表达载体的前述方法,以及将用于制备编码修整重组酶的表达载体的前述方法中获得的表达载体体外引入合适的成体干细胞的其它步骤。
[0133]
在另一个方面,本发明涉及如本文公开和/或从本发明的前述方法可获得的核酸。本文还提供了编码由序列定义的修整重组酶的核酸。
[0134]
如本文所使用的“核酸”是由共价连接的称为核苷酸的亚单位构成的聚合化合物。核酸包括多核糖核酸(rna),例如mrna和多脱氧核糖核酸(dna),其两者可以是单链或双链的。dna包括cdna、基因组dna、合成dna和半合成dna。
[0135]
在另一个方面,本发明还涉及从本发明的前述方法可获得的表达载体,以及涉及包含编码如本文定义的修整重组酶的核酸的表达载体。
[0136]
如本文所使用的术语“蛋白”包括蛋白、多肽和肽。如本领域技术人员将理解,本发明的核酸序列可用于生成蛋白序列。本发明的另一个方面是如例如从本发明的前述方法可获得的修整重组酶蛋白,所述重组酶可以任选地是包含功能性重组酶的融合蛋白。在一个实施方案中,使用本领域众所周知的技术,可以将修整重组酶蛋白制备为融合多肽。在一个优选实施方案中,所述修整重组酶蛋白与第二多肽连接。优选地,所述融合多肽从本发明的前述方法获得,其中所述修整重组酶与第二多肽连接。
[0137]
在一个实施方案中,将所述修整重组酶蛋白制备为融合多肽以增加表达。在另一个实施方案中,将所述修整重组酶蛋白制备为融合多肽,以允许将该多肽引入活细胞中。通常,纯化的蛋白不能进入细胞,因为它们由于其大小而不能通过细胞膜。然而,特定肽序列与蛋白的融合可以导致这些融合蛋白摄入细胞中。在细胞中,所述蛋白可以行使其功能。位点特异性重组酶,包括cre重组酶,已经用该方法成功地递送至细胞中(peitz等人,2002)。细胞透性重组酶已经由nolden等人(2006)和lin等人(2004)进一步描述。因此,此策略可以用于将所述修整重组酶递送至细胞中以从感染的细胞去除原病毒。因此,所述融合多肽中的第二多肽可以包含信号肽。所述信号肽可以是蛋白转导结构域诸如tat肽或来自触角同源结构域的第三螺旋的肽(derossi等人,1994,1996;vives等人,1997;vives,2003;richard等人,2005)或用于将融合多肽递送至真核细胞的核中的nls(核定位序列)(macara,2001)。
[0138]
本发明的另一个方面涉及从用于制备本发明的转化的成体干细胞的前述方法可获得的成体干细胞。所述干细胞优选地用根据本发明的表达载体感染或转染。在一个优选
实施方案中,所述成体干细胞是表达所述修整重组酶、前述融合多肽或包含前述述表达载体的来自造血谱系的干细胞。造血干细胞(hsc)是骨髓来源的cd34 细胞,其可以例如通过常规白细胞去除法从供体(例如,hiv感染的患者)的g
‑
csf动员的外周血纯化(scherr&eder,2002)。然后可以配制体外遗传修饰的细胞用于再输注至患者中。
[0139]
在现有技术中,术语“干细胞”表示这样的细胞,其(a)具有自我更新的能力和(b)由于其不对称分裂能力而形成至少一种和经常多种专门细胞类型的能力(donovan&gearhart,2001)。成体干细胞可以分离自成体的不同组织,即分化的个体。此类干细胞在现有技术中称为“多能成体干细胞”。胚胎多能干细胞和成体多能干细胞之间的本质区别在于可以从各自细胞获得的分化组织的数目。
[0140]
在另一个实施方案中,本发明的表达载体用于转化逆转录病毒(例如,hiv)感染的患者的t
‑
细胞,例如cd4 原代细胞(血细胞)。
[0141]
或者,本发明的修整重组酶可以经配制用于通过病毒样颗粒(vlp)递送。vlp可以用于包装tre mrna、tre蛋白,例如融合蛋白,或dna,例如表达tre的dna质粒,或包含启动子
‑
tre cdna
‑
多聚a位点的构建体。因此,本发明的核酸可以进一步含有包装信号。
[0142]
在本发明方法的另一个步骤中,将通过本发明的方法获得的本发明的核酸、包含编码本发明的修整重组酶的核酸序列的表达载体、重组酶蛋白、融合蛋白或成体干细胞配制为药物组合物,其用于预防和/或治疗逆转录病毒感染和/或减少被逆转录病毒、例如hiv、特别是hiv
‑
1感染的受试者中的病毒载量。本发明的另一个目标是通过前述方法获得的药物组合物。所述药物组合物优选以适于静脉内应用(输注)的溶液的形式存在。
[0143]
所述药物制备物可以进一步包含一种或多种药学上可接受的载体、赋形剂和/或佐剂。适用于药物组合物中的载体、赋形剂和佐剂是本领域已知的。
[0144]
当施用于受试者时,本发明的药物组合物优选将被逆转录病毒感染的受试者中的病毒载量降低至低于5000基因组当量/ml血浆,优选低于500基因组当量/ml血浆,且更优选低于50基因组当量/ml血浆。因此,包含编码修整重组酶的表达载体(或作为蛋白或融合多肽的修整重组酶或包含所述表达载体的干细胞)的本发明的药物组合物能够通过根除宿主细胞内的逆转录病毒的遗传储库、由此防止病毒的进一步生活周期而减少逆转录病毒感染的受试者中的病毒载量。
[0145]
如本文所使用的术语“病毒载量”是指例如与1ml患者血浆相关的hiv rna当量(即基因组)(dybul等人,2002)。因此,所述病毒载量通过测量获自患者的样品中的病毒dna的含量来测定。目前,存在三种主要类型的病毒载量测定法可用:1)hiv rna逆转录
‑
聚合酶链式反应(rt
‑
pcr):amplicor(tm)hiv
‑
1 monitor test;roche diagnostics;2)支链dna(bdna):versant(tm)hiv rna assay;bayer diagnostics;和3)基于核酸序列的扩增(nasba):nuclisens(tm)assay;biomerieux。
[0146]
在一个优选实施方案中,本发明的药物组合物能够将逆转录病毒感染的受试者中的病毒载量降低至低于5000基因组当量/ml血浆,优选低于500基因组当量/ml血浆,且更优选低于50基因组当量/ml血浆。病毒载量低于5000基因组当量/ml血浆的患者被认为相对良好地适应于药物治疗。然而,目前aids疗法的目标是将病毒载量减少至低于病毒载量测定的检测限值,其目前低于约50基因组当量/ml血浆。所述药物组合物优选地降低选自以下的
逆转录病毒的病毒载量:小鼠乳腺肿瘤病毒(mmtv)、mason pfizer猴病毒(mpmv)、人t细胞白血病病毒i型(htlv
‑
i)、人t细胞白血病病毒ii型(htlv
‑
ii)、猿猴t细胞白血病病毒i型(stlv
‑
i)、猿猴t细胞白血病病毒ii型(stlv
‑
ii)、牛白血病病毒(blv)、猫白血病病毒(felv)和莫洛尼鼠白血病病毒(momlv)。在又一个优选实施方案中,要用本发明的药物治疗的逆转录病毒是慢病毒。所述慢病毒优选地选自人免疫缺陷病毒1型(hiv
‑
1)、人免疫缺陷病毒2型(hiv
‑
2)、猿猴免疫缺陷病毒(siv)、猫免疫缺陷病毒(fiv)、牛免疫缺陷病毒(biv)、maedi
‑
visna病毒(mvv)、马感染性贫血病毒(eiav)和山羊关节炎脑炎病毒(caev)。最优选地,所述逆转录病毒是hiv,特别是hiv
‑
1。然而,对于本领域技术人员显而易见的是,本发明也适用于除上述那些之外的其它逆转录病毒的逆转录病毒感染。
[0147]
被针对其施用所述药物组合物的逆转录病毒感染的受试者选自人、灵长类动物、猴、牛、马、山羊、绵羊和家猫。然而,所述受试者优选是人类。
[0148]
通常,应当向所述受试者施用有效量的本发明的表达载体、修整重组酶或转化的细胞。施用可以是例如静脉内或肌内施用。
[0149]
在一个实施方案中,将所述药物组合物配制用于与高活性抗逆转录病毒疗法(haart)的其它活性剂伴随施用。所述高活性抗逆转录病毒疗法haart是靶向病毒逆转录酶、蛋白酶和融合体的组合疗法(gulic等人,1997;lalezari等人,2003)。
[0150]
在另一个实施方案中,将所述药物组合物配制用于在全身免疫激活疗法或原病毒基因表达的特异性激活的同时或之后施用。免疫激活治疗的前提是基于这样的假设:潜伏hiv感染的细胞的有意激活可以加速持续性病毒储库的根除。通过活跃表达hiv
‑
1(促凋亡)产物的那些细胞的程序性死亡经由免疫清除发生消除(kulkosky&bray,2006)。全身免疫激活(免疫细胞、包括静息细胞的激活)通常通过例如施用免疫毒素、细胞因子(例如,il
‑
2)或t细胞激活抗体(例如,okt3)来实现。
[0151]
鉴于由于全身t细胞激活显然也诱导病毒复制并使潜在的hiv
‑
1靶细胞的数目增加超过haart可以包含的水平的事实(fraser等人,2000)而导致进行有意激活haart抗性潜伏储库的免疫激活不幸地未能永久消除hiv
‑
1和病毒反弹(对于综述,参见kulosky&bray 2006;marcello,2006;shehu
‑
xhilaga等人,2005),必需进一步特异性治疗来治疗hiv。一种方法是激活否则静止病毒基因组的转录。潜伏原病毒基因表达的特异性激活可以通过施用佛波酯酪氨酸激酶抑制剂(prostratin)或人细胞因子il
‑
7(其两者似乎在细胞增殖不存在的情况下重新激活潜伏的hiv
‑
1)来实现(marcello,2006)。此外,hiv
‑
1的选择性转录激活也可以通过组蛋白
‑
脱乙酰酶(hdac1)抑制剂(诸如例如丙戊酸,其最终在细胞激活不存在的情况下诱导hiv
‑
1从静止细胞的生长晕)来实现(marcello,2006;lehrman等人,2005)。
[0152]
然而,全身免疫激活疗法或原病毒基因表达的特异性激活或类似的治疗策略大大受益于原病毒dna的同时去除,由此减少患者中的受感染细胞的汇集物。
[0153]
本发明还提供了治疗和/或预防受试者中的逆转录病毒感染、特别是hiv感染的方法。在一个实施方案中,在获得自受试者的样品中分析感染受试者的逆转录病毒的序列,并且如果来自受试者的原病毒dna包含已经对其选择所述重组酶的步骤(a)中鉴定的不对称靶序列,则向所述受试者施用至少一种编码修整重组酶的表达载体、至少一种修整重组酶或至少一种用所述表达载体转化的细胞,例如,一种成体干细胞。获得自所述受试者的样品可以是血液样品,例如包含感染的cd4 细胞。
[0154]
附图简述图1:图1提供了以下蛋白序列的比对:(a)cre重组酶seq id no:6;(b)根据wo 2011/147590的tre共同共有序列,seq id no:7,对hiv
‑
1 ltr内的不对称靶位点特异性的tre重组酶的共有序列;(c)根据wo 2011/147590的tre重组酶3.0共有序列,seq id no:8,对seq id no:1特异性的tre重组酶;(d)tre重组酶3.1共有序列85%,seq id no:9,共有序列中相比于cre序列的单独突变存在于通过本发明的方法生成并通过高通量测序(独特200bp
‑
序列的33,000个读数)的所有克隆的85%中;(e)tre重组酶3.1共有序列100%,seq id no:10,针对对seq id no:1的高特异性(对loxp、loxh或loxltr tre 1.0(seq id no:3
‑
5)无活性)和人的耐受性选择的三种tre重组酶3.1的共有序列;(f)示例性tre 3.1重组酶utre,seq id no:11,对seq id no:1高度特异性且被人良好耐受。根据此序列的修整重组酶称为utre,分别为“通用tre”。
[0155]
粗体字母标记表示保守的氨基酸,可变和非指定的位置用x表示。seq id no:9、10和/或11中突变的cre的位置在cre序列中加下划线,并且突变的位置在序列上方提供。tre3.1中唯一发现的q89l交换以斜体标记。
[0156]
图2:图2显示用于针对loxp上的重组进行进化选择的示例性进化载体。可以容易地构建用于针对loxh上的重组进行选择的相应载体。loxltr包含seq id no:1。tre3进化循环51
‑
69用pevoloxltr
‑
loxp和pevoloxltr
‑
loxh,或者100
‑
1μg/ml转录激活物l
‑
ara进行,包括两轮dna改组。
[0157]
图3:图3显示utre相比于tre3的高特异性。tre3:克隆分离自tre3.0文库循环43。utre:克隆分离自tre3.1文库循环71。重组产物用一个三角形标记,非重组产物用两个三角形标记。在其中表达所述修整重组酶(通过l
‑
阿拉伯糖诱导)的条件下,utre在大肠杆菌中重组包含seq id no:1的loxltr。相比之下,tre3重组loxltr和loxp以及loxh,即,其具有相对宽松的特异性。
[0158]
图4:图4a显示用于在人细胞中组成型表达可选择标记egfp和tre文库的示例性慢病毒表达载体。图4b显示针对良好耐受的高度特异性tre的细胞筛选的流程图。针对高度活性tre的最终筛选证实了人细胞中的活性。选择重组酶的单个克隆并进行进一步分析。
[0159]
图5:图5显示在两种代表性培养物中的组织培养物中的抗病毒utre活性。pm1 t细胞用编码单独的gfp(对照,空心圆形)或编码utre和gfp(utre,实心正方形)的载体转导。随后,用hiv
‑
1感染培养物,并使用p24抗原elisa随时间监测病毒载量。该实验显示,所述修整重组酶在降低病毒载量方面是有效的。几周(8或9周)之后,病毒载量通过p24抗原elisa不再可检测到。
[0160]
图6显示了源自hiv感染的患者的原代人cd4 细胞中显著的抗病毒utre活性。细胞用表达单独的gfp的载体(对照实验;左小图)或表达utre和gfp的载体(utre;右小图)转导。通过hiv
‑
1 p24抗原释放(空心圆圈)监测病毒复制,并通过facs监测转导的(gfp )人cd4 细胞的百分比(实心正方形)。utre的表达导致显著的抗病毒效应和cd4 细胞的保护。值得
注意的是,对照实验中第15天和第20天之间的病毒载量的下降反映了由于未受抑制的病毒复制导致的细胞死亡。
[0161]
图7图7显示hiv感染的人源化小鼠中的抗病毒utre活性。用人cd34 造血干细胞/hsc(对照)或表达utre的cd34 hsc(动物#1和#2)移植免疫缺陷小鼠。随后,动物被hiv
‑
1感染,并随时间监测病毒载量(检测为hiv
‑
1rna拷贝数/ml;空心圆形)和所有淋巴细胞中人cd45 cd4 细胞的百分比(实心正方形)。
[0162]
实施例
[0163]
实施例1:如果没有另外指定,则使用如wo 2008/083931、wo 2011/147590和buchholz&stewart,2001中所述的材料和方法。如wo 2011/147590中所述制备能够重组多种不同hiv
‑
1毒株中的不对称靶序列的修整重组酶。所得tre文库用于进一步实验中。
[0164]
实施例2:为了增强utre特异性,进行针对loxp和loxh上的重组活性选择的额外进化循环。为此目的,将获得自进化循环50的进化tre文库克隆至含有分别缠绕有两个loxp位点或两个loxh位点的两个loxltr位点(seq id no:1)的进化载体。示例性载体显示于图2中。诱导重组酶表达后,loxltr上的重组导致去除仅存在的ndei位点,而loxp或loxh上的重组不会如此。每个进化循环之后分离的质粒dna用ndei消化,并且已经成功重组loxltr、而非loxp或loxh的重组酶编码序列通过pcr扩增,并亚克隆回进化载体中,用于下一进化循环。进行总共19个额外的tre3进化循环,包括两轮dna改组,交替针对loxp和loxh上的重组进行选择。
[0165]
实施例3:为了筛选具有显著降低的细胞毒性(即致细胞病变性)的utre
‑
重组酶,将tre文库连接至从内部sffv ltr启动子组成型表达egfp和从组成型ef1α启动子表达tre文库的慢病毒载体中(图4a)。jurkat t细胞的转导允许依次分选(通过facs)高gfp表达细胞,随后分离无毒性的utre克隆(图4b)。为此,在转导后第3天、第10天和第24天用egfp表达的增加的严格性对转导的t细胞培养物进行细胞分选。再培养一周之后,分离剩余的tre文库并关于增强的tre活性分析选择的克隆。实施例4:为了分析细胞系中的utre活性,用表达utre和gfp或单独的gfp(阴性对照载体)的aslv衍生的逆转录病毒载体转导pm
‑
1 t细胞的培养物。值得注意的是,gfp表达允许追踪转导的细胞。在转导后第10天,用hiv
‑1bal
感染细胞。通过每周elisa测量培养上清液中的病毒p24抗原的量来监测utre表达对hiv
‑
1复制的影响。如所示(图5),p24释放在utre转导的培养物中显著减少,而其在对照培养物(仅表达gfp)中保持稳定或甚至增加。
[0166]
实施例5:源自hiv
‑
1感染的患者的原代cd4 细胞中的utre活性的分析。cd4 细胞用cd3/cd28磁珠刺激48小时。随后,用仅表达gfp(充当阴性对照)或表达utre连同gfp的慢病毒载体转导细胞。将细胞在100iu的il2存在的情况下培养20天。在转导后的指定天数监测病毒
载量(通过p24抗原elisa测量)和人转导的cd4 细胞计数(通过facs分析)。如图6中所示,utre表达导致显著的抗病毒效应(由空心圆形表示)和cd4 细胞的保护(由实心正方形表示)。相比之下,对照实验中的第15天和第20天之间病毒载量的下降反映了由于未受抑制的病毒复制导致的细胞死亡。
[0167]
实施例6:体内utre活性的分析。用人cd34 造血干细胞/hsc(对照)或表达utre的cd34 hsc移植免疫缺陷nog小鼠(nod.cg
‑
prkdc
scid
il2rg
tm1wjl
/szj)。随后,用hiv
‑1bal
感染动物,并随时间监测病毒载量(通过基于超灵敏pcr的测定法检测)和人cd45 cd4 细胞的百分比(通过facs分析)。如所示(图7),utre表达导致显著的体内抗病毒活性。参考文献列表abremski k,hoess rh,sternberg n(1983)
″
关于pi位点特异性重组的特性的研究:重组后拓扑未连接产物的证据。(studies on the properties of pi site
‑
specific recombination:evidence for topologically unlinked products following recombination.)
″
cell 32,1301
‑
1311.abremski k,hoess r(1983)
″
噬菌体pi位点特异性重组。cre重组酶蛋白的纯化和特性。(bacteriophage pi site
‑
specific recombination.purification and properties of the cre recombinase protein.)
″
j biol.chem.259,1509
‑
1514.adachi a,gendelman he,koenig s,folks t,willey r,rabson a,martin ma(1986)
″
在用感染性分子克隆转染的人和非人细胞中产生获得性免疫缺陷综合征相关的逆转录病毒。(production of acquired immunodeficiency syndrome
‑
associated retrovirus in human and nonhu
‑
man cells transfected with an infectious molecular clone.)
″
j virol.59,284
‑
291.alper h,fischer c,nevoigt e,stephanopoulos g(2006)
″
通过启动子工程改造调整遗传控制(tuning genetic control through promoter engineering)
″
proc.natl.acad.sci.usa 102,12678
‑
12683altschul,s.f,madden,t.l.,schaffer,a.a.,zhang,j.,zhang,z.,miller,w.和lipman,d.j.(1997)gapped blast和psi
‑
blast:新一代蛋白数据库搜索程序。(gapped blast and psi
‑
blast:a new generation of protein database search programs)nucleic acids research,25,3389
‑
3402beyer wr,westphal m,ostertag w,yon laer d(2002)
″
用淋巴细胞性脉络丛脑膜炎病毒糖蛋白进行假型化的致癌逆转录病毒和慢病毒载体:生成、浓度和宽宿主范围。(oncoretrovirus and lentivirus vectors pseudotyped with lymphocytic choriomeningitis virus glycoprotein:generation,concentration and broad host range.)
″
j virol.76,1488
‑
1495.blackard jt,renjifo br,mwakagile d,montano ma,fawzi ww,essex m(1999)
″
具有子类型间重组长末端重复序列的人免疫缺陷1型病毒的传播。(transmission of human immunodeficiency type 1 viruses with intersubtype recombinant long terminal repeat sequences.)
″
virology 254,220
‑
225.bloom jd,meyer mm,meinhold p,otey cr,macmillan d,arnold fh(2005)
″
用于
immunodeficiency virus intection and prior antiretroviral therapy.)
″
n engl.j.med.337,734
‑
739.guzman lm,belin d,carson mj,beckwith j(1995)
″
通过含有阿拉伯糖pbad启动子的载体的紧密调控、调节和高水平表达。(tight regulation,modulation,and high
‑
level expression by vectors containingthe arabinose pbad promoter.)
″
j.bacteriol.ill,4121
‑
4130.hartenbach s,fussenegger m(2006)
″
衍生自内部核糖体进入位点的新型合成哺乳动物启动子。(a novel synthetic mammalian promoter derived from an internal ribosome entry site.)
″
biotechnology and bioengineering 95,547
‑
559.hauber i,bevec d,heukeshoven j,kratzer f,horn f,choidas a,harrer t,hauber j(2005)
″
鉴定细胞脱氧羟丁赖氨酸合酶作为抗逆转录病毒疗法的新靶点。(identification of cellular deoxyhypusine synthase as a novel target for antiretroviral therapy.)
″
j.clin.invest.115,76
‑
85.hazuda dj,young sd,guare jp,anthony nj,gomez rp,wai js,vacca jp,handt l,motzel sl,klein hj,dornadula g,danovich rm,witmer mv,wilson ka,tussey l,schleif wa,gabryelski ls,jin l,miller md,casimiro dr,emini ea,shiver jw(2004)
″
整合酶抑制剂和细胞免疫抑制恒河猴中的逆转录病毒复制。(integrase inhibitors and cellular immunity suppress retroviral replication in rhesus macaques.)
″
science 305,528
‑
532hoess rh,abremski k(1985)
″
cre
‑
lox位点特异性重组系统中的链切割和交换的机制。(mechanism of strand cleavage and exchange in the cre
‑
lox site
‑
specific recombination system.)
″
j.mol.biol.181,351
‑
362.johannes tw,zhao h(2006)
″
酶和生物合成途径的定向进化。(directed evolution of enzymes and biosynthetic pathways.)
″
curr.opin.microbiol.9,261
‑
267.krasnow ma,cozzarelli nr(1983)
″
通过tn3解离酶的位点特异性松弛和重组:定向res位点之间的dna路径的识别。(site
‑
specific relaxation and recombination by the tn3 resolvase:recognition ofthe dna path between oriented res sites)
″
cell 32,1313
‑
1324.kulkosky j,bray s(2006)
″
haart持续性hiv
‑
1潜伏储库:其起源、稳定机制和潜在根除策略。(haart
‑
persistent hiv
‑
1 latent reservoirs:their origin,mechanisms of stability and potential strategies for eradication.)
″
curr.hiv res.4,199
‑
208.lalezari jp,henry k,o
′
hearn m,montaner js,piliero pj,trottier b,walmsley s,cohen c,kuritzkes dr,eron jr.jj,chung j,demasi r,donatacci l,drobnes c,delehanty j,salgo m(2003)
″
恩夫韦地,用于北美和南美的耐药性hiv感染的一种hiv
‑
1融合抑制剂。(enfuvirtide,an hiv
‑
1 fusion inhibitor,for drug
‑
resistant hiv infection in north and south america.)
″
n.engl.j.med.348,2175
‑
2185.lee ys,park js(1998)
″
在间隔区中含有hiv
‑
1的长末端重复序列的部分的新型突变lox?:使用位点特异性重组酶呈现抗病毒策略的可能靶位点。(a novel mutant lox?
sequencing with chain
‑
terminating inhibitors.)
″
proc.natl.acad.sci.usa 74,5463
‑
5467.santoro sw,schultz pg(2002)
″
cre重组酶的位点特异性的定向进化。(directed evolution of the site specificity of cre recombinase.)
″
proc.natl.acad.sci.usa 99,4185
‑
4190.saraf
‑
levy t,santoro sw,volpin h,kushnirsky t,eyal y,schultz pg,gidoni d,carmi n(2006)
″
异源四聚cre重组酶复合物介导的不对称lox位点的位点特异性重组。(site
‑
specific recombination of asymmetric lox sites mediated by a heterotetrameric cre recombinase complex.)
″
bioorg.med.chem.14,3081
‑
3089.sauer b,mcdermott j(2004)
″
与从pi相关噬菌体的pac
‑
c1区域的比较鉴定的异种特异性cre同源物的dna重组。(dna recombination with a heterospecific cre homolog identified from comparison of the pac
‑
cl regions of pi
‑
related phages)
″
nucl.acids.res.32,6086
‑
6095.schambach a,bohne j,chandra s,will e,margison gp,williams da,baum c(2006)
″
γ逆转录病毒和慢病毒sin载体用于在造血细胞中表达o6
‑
甲基鸟嘌呤
‑
dna甲基转移酶的相等效力。(equal potency of gammaretro viral and lenti viral sin vectors for expression of o6
‑
methylguanine
‑
dna methyltransferase in hematoietic cells)
″
molecular therapy 13,391
‑
400.scherr m,eder m(2002)
″
使用慢病毒载体基因转移至造血干细胞中。(gene transfer into hematopoietic stem cells using lentiviral vectors.)
″
current gene therapy 2,45
‑
55.shehu
‑
xhilaga m,tachedjian g,crowe sm,kedzierska k(2005)
″
抗逆转录病毒化合物:haart根除hiv
‑
1的潜在失败机制。(antiretro viral compounds:mechanisms underlying failure of haart to eradicate hiv
‑
1.)
″
curr.med.chem.12,1705
‑
1719shimshek dr,kim j,hubner mr,spergel dj,buchholz f,casanova e,stewart af,see
‑
burg ph,sptengel r(2002)
″
小鼠中的密码子改善的cre重组酶(icre)表达。(codon
‑
improved cre recombinase(icre)expression in the mouse.)
″
genesis 32(1),19
‑
26smith tf,waterman ms(1981)
″
重叠基因和信息理论。(overlapping genes and information theory.)
″
j theor.biol.91,379
‑
380.stark wm,boocock mr,sherratt dj(1992)
″
通过位点特异性重组酶催化。(catalysis by site
‑
specific recombinases.)
″
trends genet.8,432
‑
439.stemmer wpc(1994)
″
蛋白在体外通过dna改组的快速进化。(rapid evolution of a protein in vitro by dna shuffling.)
″
nature 370,389
‑
391.sternberg n,hamilton d(1981)
″
噬菌体pi位点特异性重组。i.loxp位点之间的重组。(bacteriophage pi site
‑
specific recombination.irecombination between loxp sites.)
″
j.mol.biol.150,467
‑
486.van duyne gd(2001)
″
cre
‑
loxp位点特异性重组的结构视图。(a structural view of cre
‑
loxp site
‑
specific recombination.)
″
annu.rev.biophys.biomol.struct.30,87
‑
104.
vives e,brodin p,lebleu b(1997)
″
截短的hiv
‑
1 tat蛋白基本结构域通过质膜快速易位并积聚在细胞核中。(a truncated hiv
‑
1 tat protein basic domain rapidly translocates through the plasma membrane and accumulates in the cell nucleus.)
″
j.biol.chem.272,16010
‑
16017.vives e(2003)
″
tat肽的细胞摄取:在<
″
>离子相互作用之后的内吞机制。(cellular uptake of the tat peptide:an endocytosis mechanism following<
″
>ionic interactions.)
″
j.mol.recognit.16,265
‑
271volkert fc,broach jr(1986)
″
位点特异性重组促进酵母中的质粒扩增。(site
‑
specific recombination promotes plasmid amplification in yeast)
″
cell 46,541
‑
550voziyanov y,konieczka jh,stewart af,jayaram m(2003)
″
flp重组酶中的dna特异性的逐步操纵:针对其靶位点中的单独和组合突变渐进性调整flp。(stepwise manipulation of dna specificity in flp recombinase:progressively adapting flp to individual and combinatorial mutations in its target site.)
″
j.mol.biol.326,65
‑
76.yuan l,kurek i,english j,keenan r(2005)
″
实验室定向的蛋白进化(laboratory
‑
directed protein evolution)
″
microbiol.mol.biol.rev.69,373
‑
92.wo 2002/44409wo 2008/083931wo 2011/147590。本发明还涉及以下实施方案:1.编码修整重组酶的核酸,所述修整重组酶能够重组多种hiv
‑
1毒株的原病毒dna的长末端重复内的不对称靶序列seq id no:1,其中所述修整重组酶的氨基酸序列与根据seq id no:10的序列具有至少95%序列同一性,更优选99%序列同一性,其中所述修整重组酶与seq id no:6相比包含以下限定的氨基酸交换:v7l、p12s、p15l、m30v、h40r、m44v、s51t、y77h、k86n、q89l、g93a、s108g、c155g、a175s、a249v、r259d、e262r、t268a、d278g、p307a、n317t、1320s。2.根据实施方案1所述的核酸,其中所述修整重组酶包含根据seq id no:10的氨基酸序列。3.根据实施方案1或2中任一项所述的核酸,其中所述修整重组酶包含根据seq id no:11
‑
13的氨基酸序列,或所述序列的任何序列的组合。4.实施方案1至3中任一项的核酸,其中所述修整重组酶对seq id no:1的重组是高度特异性的,因为所述修整重组酶不以可检测活性重组loxp(seq id no:4)或ioxh(seq id no:5)序列。5.由实施方案1至4中任一项的核酸编码的修整重组酶,其任选地表达为融合蛋白;或包含实施方案1至4中任一项的核酸的转化的细胞,其中所述细胞优选地是来自造血谱系的干细胞。6.药物组合物,其包含实施方案1至4中任一项的核酸,实施方案5的修整重组酶和/或根据实施方案5所述的转化的细胞。
7.实施方案6的药物组合物,其中所述药物组合物用于治疗或预防受试者中的逆转录病毒感染,其中所述逆转录病毒是hiv,特别是hiv
‑
1,其中如果获得自受试者的样品中发现的原病毒dna包含已经对其选择所述重组酶的步骤(a)中鉴定的不对称靶序列,则所述药物组合物任选地配制用于施用于受试者。8.用于制备编码良好耐受的修整重组酶的核酸或表达载体的方法,所述修整重组酶能够重组多种逆转录病毒毒株的原病毒dna的ltr内的不对称靶序列,其包括以下步骤:(a)鉴定与多种逆转录病毒毒株的原病毒dna的ltr的序列中的至少一个已知重组酶靶位点的左半位点序列和右半位点序列具有至少30%同源性的序列,其中所述同源序列由5
‑
12个核苷酸的间隔区分开,且其中所述不对称靶序列被发现存在于多种逆转录病毒毒株中;(b)鉴定两个序列,其中第一序列对应于与所述已知靶位点的左半位点同源的步骤(a)的不对称靶序列的序列,且称为“半位点序列1”,且其中第二序列对应于与右半位点同源的步骤(a)的不对称靶序列的序列,且称为“半位点序列2”;(c)测定与步骤(a)的至少一个已知同源靶位点的相应同源左半位点和右半位点序列不同的步骤(b)的序列内的核苷酸;(d)生成包含靶序列的两个靶核酸的第一子集,其中第一靶序列被称为亚位点1,且以5
′
至3
′
顺序包含彼此相邻的步骤(b)的半位点序列1、不对称靶序列的间隔区序列和半位点序列1的反向重复,且其中第二靶序列被称为亚位点2,且以5
′
至3
′
顺序包含彼此相邻的半位点序列2的反向重复、不对称靶序列的间隔区序列和步骤(b)的半位点序列2;(e)基于步骤(d)的第一子集中的靶序列生成包含修饰的靶序列的靶核酸的第二子集,其中,在基于亚位点1的序列中,在左半位点序列中,与步骤(a)的至少一个已知靶位点的相应同源半位点序列不同的一部分核苷酸被所述已知靶位点中发现的天然核苷酸替代,直至所述半位点序列含有与所述已知靶位点不同的一个、两个或三个核苷酸,其中所述修饰的靶序列的右半位点由所述修饰的左半位点序列的反向重复形成,所述修饰的左半位点序列的反向重复通过不对称靶序列的间隔区序列与所述修饰的左半位点序列分开,且其中,在基于亚位点2的序列中,在右半位点序列中,与步骤(a)的至少一个已知靶位点的相应同源半位点序列不同的一部分核苷酸被所述已知靶位点中发现的天然核苷酸替代,直至所述半位点序列含有与所述已知靶位点不同的一个、两个或三个核苷酸,其中所述修饰的靶序列的左半位点由所述修饰的右半位点序列的反向重复形成,所述修饰的右半位点序列的反向重复通过不对称靶序列的间隔区序列与所述修饰的右半位点序列分开,使得在放在一起的源自步骤(d)的第一子集的一个靶序列的所有修饰的半位点序列中,可以发现所有偏差核苷酸,而所述修饰的半位点序列无一单独包含所有偏差核苷酸,(f)使用步骤(e)中获得的第二子集中的每个核酸作为底物,对识别根据步骤(a)的已知同源靶位点的至少一种重组酶分别应用分子定向进化;(g)改组步骤(f)中进化的重组酶文库,其中组合并改组在基于亚位点1的序列上进化的所有重组酶文库,且其中组合并改组在基于亚位点2的序列上进化的所有重组酶文库;(h)使用根据步骤(d)的子集的每个核酸作为底物对步骤(g)中获得的改组文库应
用分子定向进化,优选底物连接的蛋白进化;(i)改组步骤(h)中进化的重组酶文库;(j)使用包含步骤(a)的不对称靶序列的核酸作为底物,对步骤(g)中获得的改组文库应用分子定向进化,优选底物连接的蛋白进化,直至获得至少一种重组酶,所述重组酶对步骤(a)的逆转录病毒dna的ltr内的不对称靶序列具有活性;(k)从所述文库分离编码步骤(j)中获得的至少一种重组酶的核酸并将其克隆至进化载体中,所述进化载体允许阴性选择重组根据步骤(a)的已知靶位点的修整重组酶,由此获得文库;(i)对步骤(k)中获得的文库应用分子定向进化,优选底物连接的蛋白进化;(m)改组步骤(1)中获得的文库;(n)分离编码步骤(m)中获得的至少一种修整重组酶的核酸并将其克隆至用于在人细胞中表达编码的重组酶和可选择标记的载体中,由此获得载体文库,(o)用步骤(n)中获得的所述载体文库转化人细胞,优选人t细胞;(p)将表达所述可选择标记的细胞培养至少1周,并针对所述可选择标记的高表达进行选择;(q)从步骤(p)中获得的表达所述可选择标记的细胞分离编码重组酶的核酸;(r)选择编码能够重组步骤(a)的不对称靶序列的重组酶的核酸;(s)从所述文库分离编码步骤(f)中获得的至少一种重组酶的核酸;和,(t)任选地,将步骤(s)中获得的核酸克隆至合适的表达载体中。9.根据实施方案8所述的方法,其中所述逆转录病毒是hiv,优选hiv
‑
1,且其中所述不对称靶序列优选具有如seq id no:1或seq id no:2、优选seq id no:1所述的序列。10.根据实施方案8至9中任一项所述的方法,其中其靶序列用于步骤(a)中且在步骤(f)中对其应用分子定向进化的至少一种已知重组酶是重组酶文库的一部分。11.根据实施方案8至10中任一项所述的方法,其中步骤(t)中的表达载体选自逆转录病毒载体、慢病毒载体、泡沫病毒载体、腺病毒载体和腺相关病毒载体。12.用于制备修整重组酶的方法,其中所述方法包括根据实施方案8至11中任一项所述的方法和在合适的宿主细胞中从插入表达载体中的编码重组酶的核酸表达修整重组酶的其它步骤,其中所述重组酶任选地表达为包含所述修整重组酶的氨基酸序列的融合多肽。13.用于制备转化的细胞的方法,其中所述方法包括根据实施方案8至12中任一项所述的方法和将所述表达载体体外引入细胞中的其它步骤,其中所述细胞优选地是成体干细胞。14.根据实施方案8至13中任一项所述的方法,其进一步包括将所述表达载体、所述重组酶或细胞制备为药物组合物的步骤。15.从根据实施方案8至14中任一项所述的方法可获得的核酸,其中所述核酸任选地是根据实施方案1
‑
4中任一项所述的核酸。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。