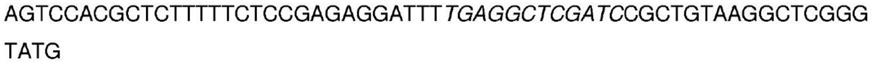
1.本发明的实施方案涉及特异性结合伊立替康的适体及其使用方法。例如,本发明的某些实施方案涉及使用本文所描述的适体检测样品中伊立替康的存在、不存在或含量的方法。本发明的某些实施方案涉及采用本文所描述的适体监测经历伊立替康疗法的受试者的样品的方法。
背景技术:
2.伊立替康(irinotecan)(7
‑
乙基
‑
10
‑
[4
‑
(1
‑
哌啶)
‑1‑
哌啶]羰基喜树碱,cpt
‑
11)是一种合成设计的喜树碱类似物,其可抑制dna拓扑异构酶i。伊立替康是一种前药。伊立替康通过羧酸酯酶转化酶转化为生物活性代谢物7
‑
乙基
‑
10
‑
羟基喜树碱(sn
‑
38)。sn
‑
38抑制拓扑异构酶i的活性,从而抑制dna复制和转录。伊立替康用于治疗癌症,特别是结肠癌、胰腺癌和肺癌。例如,伊立替康作为治疗转移性结直肠癌的一线疗法(例如,与5
‑
氟尿嘧啶和亚叶酸一起施用)。伊立替康也可与顺铂组合施用来治疗广泛性小细胞肺癌。
[0003]
伊立替康治疗的特征在于剂量限制性毒性和个体间药代动力学差异较大。例如,伊立替康会导致严重腹泻和免疫系统极度抑制等副作用。监测药物的治疗水平(并调整到所需目标水平)对于最大程度降低毒性和最大程度提高受试者肿瘤响应的可能性很有价值。
[0004]
伊立替康是一种低分子量药物(c
33
h
38
n4o6,摩尔质量586.678da),不利于开发出针对该靶标的免疫测定。例如,小分子对许多亲和试剂的靶向性很差。通常,小分子官能团数量非常少,因此亲和试剂难以与这些底物特异性结合。此外,小分子可能存在毒性问题和/或缺乏免疫原性。
[0005]
尽管存在这些问题,但是,仍然需要开发出能够更简单、更容易适应分析平台、生产更可靠、不依赖于一对亲和配体并提供信号增益读出;同时能够与伊立替康及其药理活性盐特异性结合,与密切相关的化合物或药物代谢物无交叉反应的试剂。例如,仍然需要开发出能够与伊立替康及其药理活性盐特异性结合而不与其生物活性代谢物sn
‑
38发生任何交叉反应的试剂。仍然需要开发出能够对从接受伊立替康治疗的患者所采集样品中的伊立替康和/或sn
‑
38进行定量的试剂。
[0006]
人们已经采用色谱法(例如联用质谱或不联用质谱的hplc)对癌症受试者血清中的伊立替康水平进行了评估(chen,x.et al,j pharm biomed anal.2012 mar 25;62:140
‑
148)。但是,这种方法成本高、耗时长,需要专业实验室、昂贵的设备、大量使用生物材料、溶剂和其他材料。
[0007]
在伊立替康的情况下,已经开发了几种基于抗体的测试,但这些测试都具有与小分子靶向免疫分析有关的相同局限性;它们依赖于一对抗体(很难分离,生产成本很高)和/或依赖于使用“信号损失”输出的竞争性分析形式。据了解,这种性质的竞争性分析容易产生高背景信号和缺乏灵敏性。由于传统免疫分析的这些局限性,因此,需要采用替代的检测方法。
[0008]
本发明一些实施方案的目的是开发出与基于抗体的测试相比速度更快、生产更可靠并且提供信号增益读出的检测试剂,至少部分缓解现有技术中识别的一些问题。
[0009]
本发明某些实施方案的
技术实现要素:
[0010]
本发明的实施方案涉及伊立替康结合适体及其使用方法的开发。本文所描述的适体被证明有效,并且提供了采用简单的信号增益分析形式测定样品中伊立替康的存在、不存在或含量的简单方法。特别是,本文所描述的适体能够以高亲和力与伊立替康结合。有利的是,本文所描述的适体能够检测生物流体中临床范围的活性伊立替康(例如大约10ng/ml至大约10000ng/ml)和/或sn
‑
38(例如大约0.1ng/ml至大约100ng/ml)。
[0011]
因此,本发明的某些方面特别提供:
[0012]
能够特异性结合伊立替康的适体,其中所述适体包括以下项或由以下项组成:
[0013]
(a)选自seq id no:3至7或10至12中任一个的核酸序列;
[0014]
(b)与seq id no:3至7或10至12中的任一个具有至少85%同一性的核酸序列;
[0015]
(c)具有seq id no 3至7或10至12中任一个的至少大约30个连续核苷酸的核酸序列;或
[0016]
(d)具有序列的至少大约30个连续核苷酸的核酸序列,所述序列具有与seq id no 3至7或10至12中的任一个具有至少85%同一性;
[0017]
‑
与本文所述任何适体竞争与伊立替康结合的适体;
[0018]
‑
包含本文所述任何适体和可检测分子的复合物;
[0019]
‑
包含本文所述任何适体的生物传感器或测试条。
[0020]
‑
用于检测样品中伊立替康的存在、不存在或水平的装置,所述装置包括:
[0021]
(i)载体;及
[0022]
(ii)本文所述的任何适体;
[0023]
‑
本文所述任何适体、复合物、生物传感器或测试条用于检测、富集、分离和/或隔离伊立替康的用途。
[0024]
‑
检测样品中伊立替康的存在、不存在或含量的方法,所述方法包括:
[0025]
(i)使样品与本文所述的任何适体相互作用;和
[0026]
(ii)检测伊立替康的存在、不存在或含量;
[0027]
‑
检测样品中sn
‑
38的存在、不存在或含量的方法,所述方法包括:
[0028]
(a)使样品与本文所描述的第一适体(例如cp13适体)相互作用并检测伊立替康的含量;
[0029]
(b)使样品与本文所描述的第二适体(例如cp11适体)相互作用并检测伊立替康和sn
‑
38的含量;及
[0030]
(c)比较(a)和(b)中检测到的含量,以确定样品中sn
‑
38的存在、不存在或含量;
[0031]
‑
治疗或预防受试者癌症的方法,所述方法包括:
[0032]
(i)向受试者施用初始剂量的伊立替康;
[0033]
(ii)按照本文所述的任何方法检测受试者样品中伊立替康和/或sn
‑
38的含量;和
[0034]
(iii)(a)如果伊立替康和/或sn
‑
38的水平低于下阈值水平,则增加向受试者施用的伊立替康剂量;
[0035]
(b)如果伊立替康和/或sn
‑
38的水平高于上阈值水平,则减少向受试者施用的伊
立替康剂量。
[0036]
‑
用于检测和/或定量伊立替康的试剂盒,所述试剂盒包含本文所描述的任何适体。
[0037]
本发明某些实施方案的具体实施方式
附图说明
[0038]
下面将参考附图更详细地描述本发明的某些实施方案,其中:
[0039]
图1示出了伊立替康适体的预测二级结构(a
‑
适体cp11,b
‑
适体cp13,c
‑
适体片段cp11
‑
f3e,d
‑
适体片段cp13
‑
f4c)。二级结构采用mfold确定(zuker,m.(2003)nucleic acid res.31(13),3406
‑
15.)。固定寡核苷酸的结合位点以绿色突出显示。
[0040]
图2示出了采用置换筛选法筛选高亲和力适体群体。在每一轮中对“背景洗脱”、“反筛选”和“靶结合”的“置换”适体文库的数量进行监测。一旦看到靶诱导的置换显著增加(第6轮),则开始使用sn
‑
38(cs1)开展反筛选,以及从第9轮开始采用40%人血浆中的sn
‑
38(cs2)开展反筛选。在第11cs1轮和第11cs2轮之后,分离出靶特异性多克隆群体。
[0041]
图3示出了用于监测适体与其靶结合、识别最佳适体克隆和用于动力学分析的“浸读(dip and read)”生物膜层干涉法(bli)分析的模型数据。模型数据显示“适体固定”到传感器表面上,“清洗”过程中建立了新的基线,随后随着适体与其靶结合并与传感器表面“分离”,信号减少。
[0042]
图4示出了生物膜层干涉法置换试验中监测到的多克隆适体群体irip cs1和irip cs2的结合情况。数据仅显示了图3所述的“靶结合分离”,并且已经进行了背景减去和“翻转”,以允许使用软件steady state analysis(稳态分析)算法。bli置换分析显示,与初始文库相比,筛选出的适体群体irip cs1和irip cs2与筛选靶cpt11(伊立替康)的结合明显改善。伊立替康的主要代谢物(sn
‑
38)及(结构上和功能上相关的)阴性靶伊马替尼(imatinib)均未检测到任何适体结合。
[0043]
图5示出了用于“选中(hit picking)”最佳表现单克隆适体的bli置换分析数据。数据仅显示了图3所述的“靶结合分离”,并且已经进行了背景减去和“翻转(flipped)”。结果表明,鉴定了与包括初始文库(浅棕色=初始文库)的其他筛选序列相比与10μm cpt11(伊立替康)的结合得到改善的适体。
[0044]
图6示出了bli置换分析,用于监测6个适体克隆与初始文库相比的与10μm sn38的靶结合情况。(灰色=初始文库)。数据仅显示了图3所述的“靶结合分离”,并且已经进行了背景减去和“翻转”。
[0045]
图7表明,正如bli置换分析所监测的那样,适体cp11与靶(a)伊立替康(cpt
‑
11)和(b)sn
‑
38的结合以浓度依赖性方式进行。表观适体亲和力采用翻转数据和稳态分析测定。在伊立替康(cpt
‑
11)和代谢物sn
‑
38存在的情况下,适体cp11显示出靶浓度依赖性置换。表观亲和常数(k
d
值)采用fortebio data analysis 8.0软件计算。适体cp11对(a)伊立替康(pbs6中)的亲和力采用1.0x10
‑7m
±
0.32(100nm
±
32)计算。适体cp11对(b)sn
‑
38(pbs6中)的亲和力采用8.7x10
‑8m
±
4.2(87nm
±
42)计算。(注:稳态动力学适合适体置换分析数据。由于响应不是结合曲线,因此,这并不是真实的k
d
测定,仅用于比较用途。)
[0046]
图8示出了适体cp13以浓度依赖性方式与(a)伊立替康(cpt
‑
11)结合,但不与(b)
sn
‑
38结合;正如bli置换分析所监测的那样。表观适体亲和力采用翻转数据和稳态分析测定。在伊立替康(cpt
‑
11)存在但代谢物sn
‑
38不存在的情况下,适体cp13显示出靶浓度依赖性置换。为了进行比较,表观亲和常数(k
d
值)采用fortebio data analysis 8.0软件计算。适体cp13对(a)伊立替康(pbs6中)的亲和力采用2.7x10
‑7m
±
0.34(270nm
±
34)计算。适体cp13与(b)sn
‑
38(pbs6中)的亲和力未进行检测。(注:稳态动力学适合适体置换分析数据。由于响应不是结合曲线,因此,这并不是真实的k
d
测定,仅用于比较用途。)
[0047]
图9示出了测定适体特异性的比较结合研究。bli置换分析证明了适体cp13的高度特异性和适体cp11的中等特异性。图中显示适体cp11与伊立替康cpt
‑
11的结合增加(红色迹线)。记录了代谢物sn
‑
38(绿色迹线)的信号较低但可以检测到。阴性靶伊马替尼的结合水平非常低(蓝色迹线)。图中显示适体cp13与伊立替康(cpt
‑
11,红色迹线)的结合增加。代谢物sn
‑
38(绿色迹线)和阴性靶伊马替尼(蓝色迹线)未检测到任何结合。特异性研究采用图3所述的bli分析进行。数据仅显示了图3所述的“靶结合分离”,并且已经进行了背景减去和“翻转”。
[0048]
图10示出了适体cp11和cp13在类似elisa的分析形式中使用,与缓冲人血浆中的靶结合。通过基于微量滴定板的适体置换分析(荧光分析),证明了这些适体的功能性。这些数据表明了置换(靶结合)适体相对于适体输入的百分含量。在人血浆中的不同靶浓度下,所筛选的适体cp11和cp13与其靶伊立替康表现出强烈的浓度依赖性结合(导致信号增益响应)。这些分析在反映伊立替康治疗范围的靶浓度下进行。
[0049]
图11示出了适体cp11和cp13在缓冲人血浆(20%血浆)中的适体特异性。将荧光响应对照靶浓度作图,在类似elisa的形式中采用基于微量滴定板的荧光置换分析进行测试。将适体cp11与伊立替康和sn
‑
38结合的结果(分别为红色和绿色)及适体cp13与伊立替康和sn
‑
38结合的结果(分别为紫色和蓝色)作图。
[0050]
图12示出了用于鉴定适体13最小有效片段的bli置换分析结合研究。对适体cp13的一组截短片段开展其与靶伊立替康(pbs6中10μm)结合的测试。适体cp13的最小最佳片段在此鉴定为seq id no:3(cp13
‑
f4c,橙色结合曲线)。最小片段鉴定研究采用图3所示的bli置换分析进行。数据仅显示了图3所述的“靶结合分离”,并且已经进行了背景减去和“翻转”。
[0051]
图13示出了适体片段cp13
‑
f4c与不同浓度梯度伊立替康的结合,以采用稳态分析测定表观适体亲和力。适体片段cp13
‑
f4c表现出靶浓度依赖性适体置换。信号(r平衡,req)被“翻转”并采用稳态分析拟合。表观亲和常数(k
d
值)采用fortebio data analysis 8.0软件计算。为了进行比较,适体cp13
‑
f4c对伊立替康(pbs6中)的亲和力采用1.6x10
‑
7 m
±
0.4(160nm
±
40)计算。(注:稳态动力学适合适体置换分析数据。由于响应不是结合曲线,因此,这并不是真实的k
d
测定,仅用于比较用途。)
[0052]
图14示出了测定适体特异性的结合研究。采用基于微量滴定板的适体置换分析(类elisa荧光分析),测定了适体片段cp13
‑
f4c的靶结合特异性。最小适体片段与靶伊立替康(cpt
‑
11)的结合表现出非常强烈的浓度依赖性,导致信号增益响应。该片段还与伊立替康代谢物sn
‑
38和apc结合,但结合程度低于伊立替康。这些分析在缓冲pbs6中、在反映这些药物治疗范围的靶浓度下进行。
[0053]
图15示出了适体cp13
‑
f4c在类似elisa的分析形式中使用,与缓冲人血浆中的靶
结合的情况。采用基于微量滴定板的适体置换分析(类elisa荧光分析),测定了最佳适体片段cp13
‑
f4c的功能性。在人血浆中的不同靶浓度下,所筛选的适体与其靶伊立替康(cpt
‑
11)表现出强烈的浓度依赖性结合(导致信号增益响应)。这些分析在反映这种药物治疗范围的靶浓度下进行。
[0054]
图16示出了用于鉴定适体cp11最小有效片段的bli置换分析结合研究。对适体cp11的一组截短片段开展与靶伊立替康及代谢物sn
‑
38结合的测试。适体cp11的最小最佳片段在此鉴定为seq id no:10(cp11
‑
f3e;红色:伊立替康结合曲线,粉色:sn
‑
38结合曲线)。采用bli置换分析开展最小片段鉴定研究(翻转数据,减去缓冲液)。
[0055]
序列表
[0056]
seq id no:1示出了适体cp13的第一随机化区(r1)。
[0057]
gagaggattt
[0058]
seq id no:2示出了适体cp13的第二随机化区(r2)。
[0059][0060]
seq id no:3示出了适体cp13的最佳最小有效核酸片段(f4c)。
[0061][0062]
seq id no:4示出了与全长cp13相比与伊立替康结合改善的适体cp13的核酸片段(f4)。
[0063][0064]
seq id no:5示出了与全长cp13相比与伊立替康结合改善的适体cp13的核酸片段(f4e)。
[0065][0066]
seq id no:6示出了与全长cp13相比与伊立替康结合改善的适体cp13的核酸片段(f5)。
[0067][0068]
seq id no:7示出了适体cp13的全核酸序列。
[0069][0070]
seq id no:8示出了适体cp11的第一随机化区(r1)。
[0071]
tggtctttaga
[0072]
seq id no:9示出了适体cp11的第二随机化区(r2)。
[0073][0074]
seq id no:10示出了适体cp11的最佳最小有效核酸片段(f3e)。
[0075][0076]
seq id no:11示出了与全长cp11相比与伊立替康结合改善的适体cp11的核酸片段(f3)。
[0077]
[0078]
seq id no:12示出了适体cp11的全核酸序列。
[0079][0080]
seq id no:13示出了示例性固定区(i)。
[0081]
tgaggctcgatc
[0082]
seq id no:14示出了示例性第一引物区(p1)。
[0083]
atccacgctctttttctcc
[0084]
seq id no:15示出了示例性第二引物区(p2)。
[0085]
gcattgagggtgacatagg
[0086]
seq id no:16示出了示例性固定序列。
[0087]
gatcgagcctca
[0088]
seq id no:17示出了示例性反向第二引物区(p2)
[0089]
cctatgtcaccctcaatgc
[0090]
正如下文进一步解释的那样,任何带下划线的序列指的是第一(p1)和第二(p2)引物位点,任何斜体序列指的是适体的固定区(i)(即能够与至少一部分固定序列结合的适体核酸序列)。r1和r2分别指第一和第二随机化区。
具体实施方式
[0091]
下面对本发明某些实施方案的进一步特征进行说明。除非另有说明,否则本发明实施方案的实施将采用分子生物学、微生物学、重组dna技术和免疫学的常规技术,这些技术是本领域技术人员熟悉的。
[0092]
大多数通用分子生物学、微生物学重组dna技术和免疫学技术可以在sambrook et al,molecular cloning,a laboratory manual(2001)cold harbor
‑
laboratory press,cold spring harbor,n.y.or ausubel et al.,current protocols in molecular biology(1990)john wiley and sons,n.y.中找到。除非特别规定,本发明使用的所有词语(包括技术名词和科学术语)的意义与本发明所属领域技术人员通常理解的相同。例如,concise dictionary of biomedicine and molecular biology(《生物医学与分子生物学简明词典》),juo,pei
‑
show,2nd ed.,2002,crc press;the dictionary of cell and molecular biology(《细胞与分子生物学词典》),3rd ed.,academic press;以及牛津大学出版社为本领域技术人员提供了本发明中使用的许多术语的通用词典。
[0093]
单位、前缀和符号以国际单位制(si)公认的形式表示。数字范围包括定义范围的数字。除非另外说明,氨基酸序列以氨基到羧基的方向从左到右书写,核酸序列以5'到3'的方向从左到右书写。
[0094]
在下文中,将通过具体实施方案的非限制性实施例对本发明进行更详细地说明。在实施例的实验中,采用无污染的标准试剂和缓冲液。
[0095]
伊立替康
[0096]
本发明提供能够与伊立替康特异性结合的适体。
[0097]
伊立替康具有以下结构:
[0098][0099]
伊立替康及其药学上可接受的盐(例如盐酸伊立替康)用于治疗癌症。例如,伊立替康在许多实体瘤中表现出抗癌活性,目前广泛用于治疗结直肠癌、胰腺癌和肺癌。
[0100]
伊立替康及其药学上可接受的盐是施用活性sn
‑
38及其药学上可接受的盐的前药。sn
‑
38具有以下结构:
[0101][0102]
sn
‑
38的细胞毒性比伊立替康高100倍到1000倍。伊立替康向活性代谢物sn
‑
38的代谢转化由羧酸酯酶介导,主要发生在肝脏中。sn
‑
38随后主要被udp
‑
葡萄糖醛酸转移酶1a1(ugt1a1)结合,形成葡萄糖醛酸苷代谢物。
[0103]
如本文所使用的,术语“伊立替康”理解为包括伊立替康和/或其任何药理学活性盐(包括盐酸伊立替康)。
[0104]
在某些实施方案中,本发明的适体与伊立替康和/或其药理学活性盐特异性结合。在某些实施方案中,本发明的适体与盐酸伊立替康特异性结合。
[0105]
在某些实施方案中,本发明的适体与伊立替康和/或其药理学活性盐特异性结合,并且与sn
‑
38不结合或仅以低亲和力与sn
‑
38结合。
[0106]
在某些实施方案中,本发明的适体与盐酸伊立替康特异性结合,并且与sn
‑
38不结合或仅以低亲和力与sn
‑
38结合。
[0107]
在某些实施方案中,本发明的适体与伊立替康和/或其药理学活性盐特异性结合,并且还与sn
‑
38特异性结合。
[0108]
在某些实施方案中,本发明的适体与盐酸伊立替康特异性结合,并且还与sn
‑
38特异性结合。
[0109]
与伊立替康“特异性”结合的适体是指与伊立替康和/或其药理学活性盐优先或高亲和力结合,但与其他功能上和结构上相关的小分子(例如伊马替尼)不结合或仅以低亲和
力结合的适体。例如,适体可以与伊立替康结合,而不会与其他功能上和结构上相关的小分子(例如伊马替尼)发生明显的交叉反应。
[0110]
在某些实施方案中,如果适体以小于约1μm、小于约500nm、小于约400nm、小于约300nm、小于约200nm、小于约100nm、小于约90nm、小于约80nm、小于约70nm、小于约60nm、小于约50nm、小于约40nm、小于约30nm、小于约20nm、小于约10nm、小于约1nm或更小的结合解离平衡常数(k
d
)结合,则适体为优先或高亲和力结合。适体的结合亲和力可采用本领域技术人员熟悉的任何方法测定,包括例如表面等离子体共振(spr)、生物膜层干涉法(bli)、置换分析和/或稳态分析。
[0111]
在某些实施方案中,本发明的适体与伊立替康和/或其药理学活性盐特异性结合,并且与sn
‑
38不结合或仅以低亲和力与sn
‑
38结合。不结合或仅以低亲和力结合的适体可以与伊立替康和/或其药理学活性盐结合,但与sn
‑
38不会发生明显的交叉反应。
[0112]
在某些实施方案中,如果适体以大于约1μm、大于约2μm、大于约3μm、大于约4μm、大于约5μm、大于约10μm或更高的结合解离平衡常数(k
d
)结合,则其以低亲和力结合。适体的结合亲和力可以例如采用本文所述的方法测定。
[0113]
在某些实施方案中,适体(例如cp11或其片段)与伊立替康和sn
‑
38特异性结合。例如,适体与伊立替康结合的k
d
小于约1μm、小于约500nm、小于约400nm、小于约300nm、小于约200nm、小于约100nm、小于约90nm、小于约80nm、小于约70nm、小于约60nm、小于约50nm、小于约40nm、小于约30nm、小于约20nm、小于约10nm、小于约1nm或更小。例如,适体与sn
‑
38结合的k
d
小于约1μm、小于约500nm、小于约400nm、小于约300nm、小于约200nm、小于约100nm、小于约90nm、小于约80nm、小于约70nm、小于约60nm、小于约50nm、小于约40nm、小于约30nm、小于约20nm、小于约10nm、小于约1nm或更小。在这样的实施方案中,适体对伊立替康和sn
‑
38具有交叉反应性。
[0114]
在某些实施方案中,适体(例如,cp13或其片段)与伊立替康特异性结合,并且与sn
‑
38不结合或仅以低亲和力结合。例如,适体与伊立替康结合的k
d
小于约1μm、小于约500nm、小于约400nm、小于约300nm、小于约200nm、小于约160nm、小于约100nm、小于约90nm、小于约80nm、小于约70nm、小于约60nm、小于约50nm、小于约40nm、小于约30nm、小于约20nm、小于约10nm、小于约1nm或更小。适体可能不与sn
‑
38结合或与sn
‑
38结合的k
d
大于约1μm、大于约2μm、大于约3μm、大于约4μm、大于约5μm、大于约10μm或更高。在所述实施方案中,适体与伊立替康结合,但不与sn
‑
38交叉反应。
[0115]
适体
[0116]
本文所述的适体是小的人工亲和配体,包含dna、rna或其修饰,能够以高亲和力和特异性与伊立替康特异性结合。
[0117]
如本文所使用的,“适体”、“核酸分子”或“寡核苷酸”可互换使用,指的是对靶分子(即伊立替康)具有期望作用的非天然核酸分子。
[0118]
本发明的适体可以是dna适体。例如,所述适体可以由单链dna(ssdna)形成。或者,本发明的适体可以是rna适体。例如,所述适体可以由单链rna(ssrna)形成。本发明的适体可包含本文所述的修饰核酸。
[0119]
在某些实施方案中,本发明的适体采用本领域熟悉的体外筛选原理制备,包括靶结合的迭代循环、靶结合序列的划分和优先扩增。
[0120]
在某些实施方案中,适体选自核酸分子文库,例如单链dna或rna核酸分子文库。通常,适体是从“通用适体筛选文库”中筛选的,所述文库的设计使任何筛选的适体几乎不需要改变就可以转换成任何列出的分析形式。在某些实施方案中,“通用适体筛选文库”包括以下功能部分:第一引物区、至少一个固定区、至少一个随机化区和第二引物区。
[0121]
在某些实施方案中,适体文库的核苷酸序列具有以下结构(5’至3’方向):
[0122]
p1
–
r1
–
i
–
r2
–
p2,
[0123]
其中p1是第一引物区,r1是第一随机化区,i是固定区,r2是另一随机化区,p2是另一引物区,其中至少r1和/或r2或它们的一部分参与靶分子结合。
[0124]
一旦筛选好,适体可在使用前进一步修饰,例如去除靶结合不需要的一个或两个引物序列和/或部分随机化区或固定区。
[0125]
通常本发明的适体包含固定区(即对接序列)。适体的固定区可在“固定寡核苷酸”的至少一部分上杂交。通常,固定区与固定寡核苷酸的至少一部分互补。通常,固定区的长度是大约10至大约20个核苷酸,例如,长度是10、11、12、13、14、15、16、17、18、19或20个核苷酸。
[0126]
如本文所使用的术语“使杂交”和“杂交”是指在常规杂交条件下,优选在严格条件下,适体文库内的固定区和“固定寡核苷酸”内的互补序列之间形成基于watson
‑
crick碱基配对的相互作用,例如,如sambrook et al.,molecular cloning,a laboratory manual,3.ed.(2001)cold spring harbor laboratory press,cold spring harbor,ny所描述。
[0127]
本领域技术人员将理解的是,可以根据例如初始文库和/或适体筛选方案来筛选适体的固定区。各种组合随机文库可通过商业来源获得。例如,所述固定区可以包含seq id no:13和/或所述固定寡核苷酸可以包含seq id no:16。
[0128]
通常,本发明的适体包含第一引物区(例如在5’端)、第二引物区(例如在3’端)或两者。引物区可作为文库和筛选适体pcr扩增的引物结合位点。
[0129]
本领域技术人员将理解的是,可以根据例如初始文库和/或适体筛选方案来筛选不同的引物序列。例如,本发明的适体可包含seq id no:14和/或15序列。
[0130]
第一引物区和/或第二引物区可包含如本文所述的可检测和/或靶向标记。例如,第一和/或第二引物区可被荧光(例如fam)标记。在某些实施方案中,第一和/或第二引物区的引物被磷酸盐(po4)标记。
[0131]
本发明的适体可选自具有第一随机化区(r1)和/或第二随机化区(r2)的核酸分子文库。本发明的适体可包含r1和/或r2的至少一部分。在某些实施方案中,本发明的适体包含seq id no:1或8序列的至少一部分(例如,至少8个或更多个核苷酸)和/或seq id no:2或9序列的至少一部分(例如,至少8个或更多个连续核苷酸)。在某些实施方案中,本发明的适体包含seq id no:1或8。在某些实施方案中,本发明的适体包含seq id no:2或9的至少30个或更多个连续核苷酸。
[0132]
在某些实施方案中,本发明的适体包含选自seq id no:3至7或10至12序列中任何一个序列的核酸序列(例如,涉及“cp13”和/或“cp11”适体)或由选自seq id no:3至7或10至12序列中任何一个序列的核酸序列(例如,涉及“cp13”和/或“cp11”适体)组成。
[0133]
在某些实施方案中,本发明的适体包含选自seq id no:3至7序列中任何一个序列的核酸序列(例如,涉及“cp13”适体)或由选自seq id no:3至7序列中任何一个序列的核酸
序列(例如,涉及“cp13”适体)组成。本文所述的cp13适体能够与伊立替康特异性结合,并且与sn
‑
38不结合或仅以低亲和力结合。
[0134]
在某些实施方案中,本发明的适体包含选自seq id no:3至6中任何一个序列的核酸序列,或由选自seq id no:3至6中任何一个序列的核酸序列组成。这些序列涉及与全长cp13相比与伊立替康的结合得到改善的cp13片段。在某些实施方案中,本发明的适体包含seq id no:3或由seq id no:3组成。本文表明,这种最小有效片段是伊立替康的最佳适体。
[0135]
在某些实施方案中,本发明的适体包含选自seq id no:10至12序列中任何一个序列的核酸序列(例如,涉及“cp11”适体)或由选自seq id no:10至12序列中任何一个序列的核酸序列(例如,涉及“cp11”适体)组成。正如本文所述,cp11适体能够与伊立替康和sn
‑
38特异性结合。
[0136]
在某些实施方案中,本发明的适体包含选自seq id no:10或11序列的核酸序列,或由选自seq id no:10或11序列的核酸序列组成。这些序列涉及与全长cp11相比与伊立替康的结合得到改善的cp11片段。在某些实施方案中,本发明的适体包含seq id no:10或由seq id no:10组成。本文表明,这种最小有效片段是能够与伊立替康和sn
‑
38特异性结合的最佳适体。
[0137]
在某些实施方案中,本发明的适体包含cp13适体(例如,seq id no:3至7中的任何一个序列)和cp11适体(例如,seq id no10至12中的任何一个序列),或由cp13适体(例如,seq id no:3至7中的任何一个序列)和cp11适体(例如,seq id no10至12中的任何一个序列)组成。这些适体的组合(例如,本文所述的“第一”和“第二”适体)可以测定样品中伊立替康和/或sn
‑
38的存在、不存在或水平。
[0138]
在某些实施方案中,本发明的适体包含与seq id no:3至7或10至12中任一序列的核苷酸序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多序列同一性的核酸序列,或由与seq id no:3至7或10至12中任一序列的核苷酸序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多序列同一性的核酸序列组成。
[0139]
在某些实施方案中,本发明的适体包含与seq id no:3至6中任一序列的核苷酸序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多序列同一性的核酸序列,或由与seq id no:3至6中任一序列的核苷酸序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多序列同一性的核酸序列组成。
[0140]
在某些实施方案中,本发明的适体包含与seq id no:3的核苷酸序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多序列同一性的核酸序列,或由与seq id no:3的核苷酸序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多序列同一性的核酸序列组成。
[0141]
在某些实施方案中,本发明的适体包含与seq id no:10或11中任一序列的核苷酸序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多序列同一性的核酸序列,或由与seq id no:10或11中任一序列的核苷酸序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多序列同一性的核酸序列组成。
[0142]
在某些实施方案中,本发明的适体包含与seq id no:10的核苷酸序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多序列同一性的核酸序列,或由与seq id no:10的核苷酸序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多序列同一性的核酸序列组成。
[0143]
本文所使用的,“序列同一性”是指在比对序列并引入空位(gap)(如有必要的话)以实现最大百分序列同一性之后,候选序列中与所述序列中核苷酸相同的核苷酸百分数。用于确定核酸序列同一性百分数的比对可以通过本领域熟悉的各种方式实现,例如,使用公开可用的计算机软件,例如blast、blast
‑
2、align、clustalw或megalign(dnastar)软件。例如,%核酸序列同一性数值可以使用欧洲生物信息学研究所网站(http://www.ebi.ac.uk)上的序列比较计算机程序产生。
[0144]
在某些实施方案中,本发明的适体包含seq id no:7(全长cp13)或seq id no:12(全长cp11)的最小有效片段,或由seq id no:7(全长cp13)或seq id no:12(全长cp11)的最小有效片段组成。本文“最小有效片段”理解为能够以与全长适体相同、相当或改进的亲和力与伊立替康结合的全长适体的最小尺寸片段(例如部分)(例如,seq id no:7或12)。最小有效片段可与全长适体(例如seq id no:7或12)竞争与伊立替康的结合。
[0145]
在某些实施方案中,本发明的适体包含与seq id no:3至7或10至12中任一序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性的序列的至少大约30个、35个、40个、45个或更多个连续核苷酸的核酸序列,或由与seq id no:3至7或10至12中任一序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性的序列的至少大约30个、35个、40个、45个或更多个连续核苷酸的核酸序列组成。本文所述术语“大约”通常是指参考核苷酸序列长度加上或减去所述参考长度的10%。
[0146]
在某些实施方案中,本发明的适体包含与seq id no:3至7中任一序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性的序列的至少大约30个、35个、40个、45个或更多个连续核苷酸的核酸序列,或由与seq id no:3至7中任一序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性的序列的至少大约30个、35个、40个、45个或更多个连续核苷酸的核酸序列组成。
[0147]
在某些实施方案中,本发明的适体包含与seq id no:3至6中任一序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性的序列的至少大约30个、35个、40个、45个或更多个连续核苷酸的核酸序列,或由与seq id no:3至6中任一序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性的序列的至少大约30个、35个、40个、45个或更多个连续核苷酸的核酸序列组成。
[0148]
在某些实施方案中,本发明的适体包含与seq id no:3序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性的序列的至少大约30个、35个、40个、45个或更多个连续核苷酸的核酸序列,或由与seq id no:3序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性的序列的至少大约30个、35个、40个、45个或更多个连续核苷酸的核酸序列组成。
[0149]
在某些实施方案中,本发明的适体包含与seq id no 10至12中任一序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性的序列的至少大约30个、35个、40个、45个、46个、47个、48个、49个、50个或更多个连续核苷酸的核酸序列,或由与seq id no 10至12中任一序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性的序列的至少大约30个、35个、40个、45个、46个、47个、48个、49个、50个或更多个连续核苷酸的核酸序列组成。
[0150]
在某些实施方案中,本发明的适体包含与seq id no:10或11序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性的序列的至少大约30个、35个、40个、45个、46个、47个、48个、49个、50个或更多个连续核苷酸的核酸序列,或由与seq id no:10或11序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性的序列的至少大约30个、35个、40个、45个、46个、47个、48个、49个、50个或更多个连续核苷酸的核酸序列组成。
[0151]
在某些实施方案中,本发明的适体包含与seq id no:10序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性的序列的至少大约30个、35个、40个、45个、46个、47个、48个、49个、50个或更多个连续核苷酸的核酸序列,或由与seq id no:10序列具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性的序列的至少大约30个、35个、40个、45个、46个、47个、48个、49个、50个或更多个连续核苷酸的核酸序列组成。
[0152]
本发明的适体可包含天然或非天然核苷酸和/或碱基衍生物(或其组合)。在某些实施方案中,适体包含一个或多个修饰,使得它们包含除脱氧核糖、核糖、磷酸盐、腺嘌呤(a)、鸟嘌呤(g)、胞嘧啶(c)、胸腺嘧啶(t)或尿嘧啶(u)以外的化学结构。适体可以在核碱基、糖或磷酸盐主链上修饰。
[0153]
在某些实施方案中,适体包含一个或多个修饰核苷酸。示例性修饰包括例如包含烷基化、芳基化或乙酰化、烷氧基化、卤化、氨基或另一官能团的核苷酸。修饰核苷酸的实例包括用于rna适体的2'
‑
氟核糖核苷酸、2'
‑
nh2‑
、2'
‑
och3‑
和2'
‑
o
‑
甲氧基乙基核糖核苷酸。
[0154]
本发明的适体可以是全部或部分硫代磷酸酯或dna、二硫代磷酸酯或dna、硒代磷酸酯或dna、二硒代磷酸酯或dna、锁核酸(lna)、肽核酸(pna)、n3'
‑
p5’磷酰胺rna/dna、环己烯核酸(cena)、三环dna(tcdna)或镜像(spiegelmer),或磷酰胺吗啉(pmo)组分或本领域技术人员熟悉的任何其他修饰(亦参见chan et al.,clinical and experimental pharmacology and physiology(2006)33,533
‑
540)。
[0155]
一些修饰使适体能够对核酸裂解酶稳定。在适体的稳定化过程中,通常可以区分适体的后续修饰和采用已修饰的rna/dna进行选择。这种稳定化不会显著影响修饰rna/dna适体的亲和力,但可防止适体在生物体或生物溶液中被rna酶/dna酶快速分解。在本发明中,如果适体在样品(例如生物培养基)中的半衰期大于1分钟,优选大于1小时,更优选大于1天,则适体被称为是稳定的。适体也可以采用报告分子修饰,除了检测标记适体外,报告分子还可以增加稳定性。
[0156]
适体的特征在于形成一种依赖于核酸序列的特定三维结构。适体的三维结构是由于watson和crick分子内碱基配对、hoogsteen碱基配对(四重)、摆动配对形成或其他非典型碱基相互作用而产生的。这种结构使适体(类似于抗原
‑
抗体结合)能够与靶结构准确结
合。适体的核酸序列具有在规定条件下对规定靶结构具有特异性的三维结构。
[0157]
在某些实施方案中,适体包含如图1所示的二级结构。适体的二级结构分析采用最小自由能算法mfold执行(m zuker.mfold web server for nucleic acid folding and hybridization prediction.nucleic acids res.31(13),3406
‑
3415,2003)。在某些实施方案中,与seq id no:3至7或10至12序列中的任一序列相比,本发明的适体可包含至少1、2、3、4、5、6、7、8、9、10或更多个核苷酸变异。例如,可以根据图1所示的二级结构来确定可以引入这种变异的位置。
[0158]
本发明还提供与本文所述适体竞争与伊立替康结合的适体。在某些实施方案中,本发明提供与seq id no:3至7或10至12序列中任一序列提出的适体竞争与伊立替康结合的适体。在某些实施方案中,竞争分析可用于鉴定竞争与伊立替康结合的适体。在示例性竞争分析中,将固定的伊立替康在包含结合伊立替康的第一标记适体及与第一适体竞争结合伊立替康的能力待测的第二未标记适体的溶液中培养。作为对照,固定的伊立替康可在包含第一标记适体但不包含第二未标记适体的溶液中培养。在允许第一适体与伊立替康结合的条件下培养后,可清除多余的未结合适体,并测定与固定伊立替康结合的标记含量。如果测试样品中与固定伊立替康结合的标记含量相对于对照样品显著减少,则表明第二适体与第一适体竞争与伊立替康的结合。
[0159]
固定寡核苷酸
[0160]
在某些实施方案中,在没有任何固定寡核苷酸的情况下检测适体。例如,本发明的适体可采用本文所述的连接序列固定到载体上。
[0161]
在某些实施方案中,本发明的适体包含固定区。适体的固定区可与适当设计的固定寡核苷酸的至少一部分杂交。
[0162]
在某些实施方案中,所述固定寡核苷酸包含核酸序列,所述核酸序列经配置以在其长度的至少一部分上与适体的固定区杂交。例如,固定寡核苷酸(或其一部分)可被配置为与适体的固定区(或其一部分)形成双链双螺旋结构。
[0163]
在某些实施方案中,固定寡核苷酸的长度是大约10个至大约20个核苷酸,例如长度是大约10、11、12、13、14、15、16、17、18、19或20个核苷酸。通常,固定寡核苷酸与适体的固定区互补。在某些实施方案中,固定寡核苷酸是能够与多个适体中包括的固定区杂交的“通用”寡核苷酸。
[0164]
在某些实施方案中,固定寡核苷酸或适体包含具有适当功能单元的接头部分,以允许固定寡核苷酸的表面连接。功能单元可选自生物素、硫醇、胺或本领域技术人员熟悉的其他合适基团。
[0165]
在某些实施方案中,固定寡核苷酸或适体包含间隔分子,例如,选自多核苷酸分子、c6间隔分子、c12间隔分子、另一长度c间隔分子、六乙二醇分子、己二醇和/或聚乙二醇间隔分子。接头可以是例如生物素接头。在某些实施方案中,固定寡核苷酸或适体可与链霉亲和素、抗生物素蛋白和/或中性抗生物素蛋白结合。
[0166]
在某些实施方案中,固定寡核苷酸或适体可经修饰与载体表面连接。例如,固定寡核苷酸或适体可通过硅烷键连接。固定寡核苷酸或适体可经琥珀酰化(例如,将固定寡核苷酸或适体与氨基苯基或氨基丙基衍生玻璃连接)。适当地,载体是氨基苯基或氨基丙基衍生物。在某些实施方案中,固定寡核苷酸或适体包含nh2修饰(例如,与环氧硅烷或异硫氰酸酯
涂层玻璃连接)。通常,载体表面涂布环氧硅烷或异硫氰酸酯。在某些实施方案中,固定寡核苷酸或适体经酰肼修饰以与醛或环氧化物分子连接。
[0167]
载体
[0168]
在某些实施方案中,适体或固定寡核苷酸与载体连接。通常,载体是固体载体,例如膜或珠粒。载体可以是二维载体(例如微孔板)或三维载体(例如珠粒)。在某些实施方案中,载体可包括至少一种磁珠。
[0169]
在某些实施方案中,载体可包括至少一种纳米颗粒,例如金纳米颗粒等。在另一个实施方案中,所述载体包含微量滴定板或其他分析板、条带、膜、薄膜、凝胶、芯片、微粒、纳米纤维、纳米管、胶束、微孔、纳米孔或生物传感器表面。在某些实施方案中,生物传感器表面可以是探针表面、生物传感器流道或类似物。
[0170]
在某些实施方案中,适体或固定寡核苷酸可直接或间接与磁珠连接,磁珠可以是例如羧基封端的、抗生物素蛋白修饰的或环氧活化的或采用相容反应基团修饰的磁珠。
[0171]
将寡核苷酸固定到载体(例如固相载体)上可通过本领域技术人员熟悉的用于将dna或rna固定在固体上的多种方式和任何方式来实现。适体在纳米颗粒上的固定是例如如wo2005/13817中所述。例如,可以用液相适体润湿纸或多孔材料的固相,随后液相挥发,将适体留在纸或多孔材料中。
[0172]
在某些实施方案中,载体包括膜,例如硝化纤维素、聚乙烯(pe)、聚四氟乙烯(ptfe)、聚丙烯(pp)、醋酸纤维素(ca)、聚丙烯腈(pan)、聚酰亚胺(pi)、聚砜(ps)、聚醚砜(pes)膜或包括氧化铝(al2o3)、氧化硅(sio2)和/或氧化锆(zro2)的无机膜。特别合适的载体制造材料包括例如无机聚合物、有机聚合物、玻璃、有机和无机晶体、矿物、氧化物、陶瓷、金属(特别是贵金属)、碳和半导体。特别适合的有机聚合物是基于聚苯乙烯的聚合物。可官能化的生物聚合物,例如纤维素、葡聚糖、琼脂、琼脂糖和交联葡聚糖,尤其是硝化纤维素或溴化氰交联葡聚糖,可作为提供固体载体的聚合物。
[0173]
可检测标记
[0174]
在某些实施方案中,本发明的适体用于检测和/或定量样品中伊立替康的含量。通常,所述适体包含可检测的标记。本文可使用能够方便适体检测和/或定量的任何标记。
[0175]
在某些实施方案中,所述可检测标记是荧光单元,例如荧光/猝灭剂化合物。荧光/猝灭剂化合物是本领域熟悉的。参见,例如mary katherine johansson,methods in molecular biol.335:fluorescent energy transfer nucleic acid probes:designs and protocols,2006,didenko,ed.,humana press,totowa,nj,and marras et al.,2002,nucl.acids res.30,el22(通过引用而并入本文中)。
[0176]
在某些实施方案中,所述可检测标记是fam。在某些实施方案中,所述fam标记位于适体的第一或第二引物区。本领域技术人员将理解的是,所述标记可位于适体内的任何适当位置。本文也可以使用彼此接近时导致可检测信号增加的单元,例如由于荧光共振能量转移(“fret”)的结果;合适的配对包括但不限于例如荧光素和四甲基罗丹明;罗丹明6g和孔雀绿,及fitc和缩氨基硫脲等。
[0177]
在某些实施方案中,所述可检测标记选自荧光团、纳米颗粒、量子点、酶、放射性同位素、预定义序列部分、生物素、脱硫生物素、巯基(thiol group)、氨基、叠氮化物、氨基烯丙基、地高辛(digoxigenin)、抗体、催化剂、胶体金属颗粒、胶体非金属颗粒、有机聚合物、
乳胶颗粒(latex particle)、纳米纤维、纳米管、树状聚合物(dendrimer)、蛋白质和脂质体。
[0178]
在某些实施方案中,可检测标记是荧光蛋白,例如绿色荧光蛋白(gfp)或本领域技术人员熟悉的任何其他荧光蛋白。
[0179]
在某些实施方案中,可检测标记是酶。例如,所述酶可选自辣根过氧化物酶、碱性磷酸酶、脲酶、β
‑
半乳糖苷酶或本领域技术人员熟悉的任何其他酶。
[0180]
在某些实施方案中,检测的性质将取决于所使用的可检测标记。例如,可通过其颜色(例如金纳米颗粒)来检测标记。颜色可由光学读取器或相机(例如带有成像软件的相机)定量检测。
[0181]
在某些实施方案中,所述可检测标记是荧光标记,例如量子点。在这些实施方案中,所述检测装置可包括经配置记录荧光强度的荧光板读取器、条带读取器或类似装置。
[0182]
在可检测标记是酶标记的实施方案中,检测装置可以例如是比色、化学发光和/或电化学装置(例如,采用电化学检测器)。通常,电化学传感是通过将氧化还原报告物(例如亚甲蓝或二茂铁)与适体的一端结合,并将传感器表面与另一端结合。通常,靶结合时适体构象发生变化,改变了报告物和传感器之间的距离,从而提供读数。
[0183]
在某些实施方案中,可检测标记可进一步包含酶,例如辣根过氧化物酶(hrp)、碱性磷酸酶(app)或类似物,以催化翻转底物而提供放大信号。
[0184]
在某些实施方案中,本发明提供包含本发明适体和可检测分子的复合物(例如缀合物)。通常,本发明的适体与可检测分子共价连接或物理连接。
[0185]
在某些实施方案中,可检测分子是可视的、光学的、光子的、电子的、声学的、光声的、质量的、电化学的、电光的、光谱的、酶的或其他物理的、化学的或生物化学的可检测标记。
[0186]
在某些实施方案中,可检测分子通过发光、uv/vis光谱、酶法、电化学或放射性检测。发光是指发射光。例如,光致发光、化学发光和生物发光用于检测标记。在光致发光或荧光中,通过吸收光子而激发。示例性荧光团包括但不限于双苯并咪唑、荧光素、吖啶橙、cy5、cy3或碘化丙啶(可共价连接到适体)、四甲基
‑6‑
羧基罗丹明(tamra)、德克萨斯红(tr)、罗丹明、alexa荧光染料(不同公司生产的不同波长的荧光染料等)。
[0187]
在某些实施方案中,可检测分子是胶体金属颗粒,例如金纳米颗粒、胶体非金属颗粒、量子点、有机聚合物、乳胶颗粒、纳米纤维(例如碳纳米纤维)、纳米管(例如碳纳米管)、树状聚合物、蛋白质或具有信号产生物质的脂质体。胶体颗粒可以用比色法检测。
[0188]
在某些实施方案中,可检测分子是酶。在某些实施方案中,
[0189]
酶可将底物转化成有色产物,如过氧化物酶、荧光素酶、β
‑
半乳糖苷酶或碱性磷酸酶。例如,无色底物x
‑
gal通过β
‑
半乳糖苷酶的活性转化为颜色可肉眼检测的蓝色产物。
[0190]
在某些实施方案中,可检测分子是放射性同位素。检测也可以通过标记适体的放射性同位素进行,所述放射性同位素包括但不限于3h、14c、32p、33p、35s或125i,更优选32p、33p或125i。在闪烁计数中,间接测定放射性标记适体
‑
靶复合物的放射性辐射。闪烁体物质被同位素的放射性发射激发。在闪烁材料转变回到基态的过程中,激发能以闪光的形式再次释放,并被光电倍增管放大和计数。
[0191]
在某些实施方案中,可检测分子选自地高辛和生物素。因此,适体也可以用被抗体
或链霉亲和素结合的地高辛或生物素标记,而抗体或链霉亲和素可以携带标记,例如酶缀合物。以前适体与酶的共价连接(结合)可以通过几种已知的方式实现。适体结合的检测也可以通过在ria(放射性免疫测定)中用放射性同位素标记(优选用125i)适体来实现,或通过在fia(荧光免疫测定)中采用荧光团,优选采用荧光素或fitc发射荧光来实现。
[0192]
装置
[0193]
本发明所述的装置可以以多种不同的形式提供。在某些实施方案中,本发明提供用于检测样品中伊立替康的存在、不存在或水平的装置,所述装置包含本文所述的适体。
[0194]
在某些实施方案中,所述装置包含本文所述的载体。例如,在没有伊立替康的情况下,所述适体可以直接或间接固定在载体上以进行固定。
[0195]
在某些实施方案中,所述装置包含本文所述的固定寡核苷酸。
[0196]
在某些实施方案中,适体可以通过与固定寡核苷酸杂交的方式连接,而固定寡核苷酸直接或间接连接到载体上。或者,适体本身可以直接或间接(例如通过接头)与载体表面连接。在此实施方案中,固定寡核苷酸被配置为与适体的至少一部分杂交。在此实施方案中,可以测定固定寡核苷酸和适体之间相互作用的破坏,作为伊立替康存在的间接测定。
[0197]
本发明的某些实施方案利用适体与伊立替康结合时改变构象的能力。所述构象变化可能导致适体与固定寡核苷酸分离,从而根据是固定寡核苷酸或是适体与载体连接,释放出固定寡核苷酸或与伊立替康复合的适体。如果不存在伊立替康,则适体不会经历构象变化,因此仍然与固定寡核苷酸杂交。
[0198]
在某些实施方案中,所述装置包含与载体连接的接头分子,其中所述接头分子被配置为与适体杂交,并且进一步其中当适体与接头分子杂交时,固定寡核苷酸被配置为与适体杂交。
[0199]
适当地,接头分子与载体连接,其中所述接头分子被配置为与固定寡核苷酸杂交,并且进一步其中当固定寡核苷酸与接头分子杂交时,适体被配置为与固定寡核苷酸杂交。在某些实施方案中,所述接头分子是dna或rna分子或混合的dna/rna分子,其中任选所述接头分子包含一个或多个修饰核苷酸。
[0200]
在某些实施方案中,所述装置可以是生物传感器。生物传感器有许多不同的形式。在某些实施方案中,生物传感器包含适体和将适体与伊立替康之间的结合事件转化为电学上可量化信号的传感器。生物传感器可以包含在容器或探针等中。
[0201]
此外,所述装置还可以包括其他元件,例如信号处理
[0202]
设备、输出电子设备、显示设备、数据处理设备、数据存储设备及与其他设备的接口。在某些实施方案中,使含有伊立替康的样品与生物传感器接触。然后,通过伊立替康与适体特异性结合后适体特性的变化来鉴定伊立替康。
[0203]
传感器的灵敏度可能受所使用的传感器的影响。传感器将来自结合事件的信号(与样品中靶分子的浓度成比例)转换为电学上可量化的测量信号。
[0204]
由于适体和伊立替康之间的分子相互作用,产生信号。
[0205]
利用本发明所述的生物传感器,可以获得定性、定量和/或半定量的分析信息。
[0206]
光学传感器的测定可以基于光度学原理,由此例如检测颜色或发光强度变化。光学方法包括荧光、磷光、生物发光和化学发光、红外跃迁和光散射的测定。光学方法还包括测定伊立替康与适体结合时的层厚变化。例如,层厚可以通过表面等离子体共振(spr)、反
射干涉光谱法(rifs)、生物膜层干涉法(bli)或类似方法测定。
[0207]
此外,可以测定薄层上的干涉(spr或rlfs)和渐逝场的变化。声学传感器利用压电石英晶体的频率变化,所述压电石英晶体能检测到靶与适体结合时发生的高度敏感的质量变化。将使用的石英晶体置于振荡电场中,并测量晶体的谐振频率。对石英晶体表面的质量变化进行定量。
[0208]
在某些实施方案中,所述装置是bli(生物膜层干涉测量)装置或类似
[0209]
装置。bli是一种用于测量生物分子相互作用的无标记技术。它是一种光学分析技术,可分析从两个表面反射的白光干涉图的变化:生物传感器尖端上的固定配体层,及内部参考层。与生物传感器尖端结合的分子数量的任何变化都会导致可以实时测量的干涉图变化。只有与生物传感器结合或解离的分子才能改变干涉图并在bli传感器上生成响应曲线。未结合的分子、周围介质折射率的变化或流速的变化不会影响干涉图。置换选择原理允许根据适体的固定序列和固定寡核苷酸之间的双链体形成开发检测分析。靶
‑
依赖性构象变化可能导致适体从双链结构中释放出来。从适体的杂交双链体到置换阶段的这种转换可用于产生可记录的信号,即靶浓度依赖性信号。
[0210]
根据设计,采用所述测量装置可以获得
[0211]
关于待测靶的定性、定量和/或半定量分析信息。检测装置可以是例如便携式仪表。
[0212]
本发明还提供包含本文所述任何适体或复合物的测试条和/或侧流装置。侧流装置也可称为侧流试验、侧流测定(lateral flow assay)和侧流免疫测定。
[0213]
在某些实施方案中,侧流装置包括连接固定寡核苷酸的载体。所述固定寡核苷酸经配置与本文所述适体固定区的至少一部分杂交。可引入本文所述的任何样品(例如,血液或血浆样品)。如果样品包含伊立替康,则适体可与伊立替康结合并出现构象变化,导致适体与固定寡核苷酸分离。
[0214]
在某些实施方案中,所述装置可适于在例如elisa(酶联免疫吸附测定)中使用。当采用适体代替抗体时,所开展的分析通常被称为“elona”(酶联寡核苷酸分析)、“elasa”(酶联适体吸附分析)、“elaa”(酶联适体分析)或类似叫法。由于适体可以与包括荧光团、猝灭分子和/或本文所述的任何其他检测单元的多种报告分子结合,因此,在这些类似elisa的分析平台中加入适体可以提高灵敏度,允许检测更多的分析物;包括没有可用抗体和广泛输出的分析物。
[0215]
在某些实施方案中,所述装置可以包含容器。对伊立替康具有特异性的适体可以通过与容器(例如容器的表面)中的固定寡核苷酸杂交而被固定。可以将可能含有伊立替康的样品添加到容器中。如果样品含有伊立替康,这种靶可能与适体结合,导致构象变化,进而导致适体从固定寡核苷酸上置换。然后,可使用本文所述的任何合适方法检测被置换的适体。
[0216]
伊立替康的检测方法
[0217]
在某些实施方案中,本发明提供用于检测样品中伊立替康的存在、不存在或含量的方法。
[0218]
在某些实施方案中,所述样品是合成样品(例如非生物样品)。例如,所述样品可以是包含(或怀疑包含)伊立替康的药物组合物。在某些实施方案中,本发明提供一种用于在
药物组合物制造期间定量伊立替康含量的方法。
[0219]
在某些实施方案中,所述样品是生物样品。例如,所述样品可包括全血、白细胞、外周血单核细胞、血浆、血清、痰、呼气、尿液、精液、唾液、脑膜液、羊水、腺液、淋巴液、乳头抽吸物、支气管抽吸物、滑液、关节抽吸物、细胞、细胞提取物、粪便、组织、组织活检或脑脊液。通常,所述样品是血液(例如血浆)样品。在某些实施方案中,所述样品例如通过混合、添加酶、缓冲液、盐溶液或标记物,或纯化进行预处理。
[0220]
在某些实施方案中,所述样品来自接受伊立替康治疗的受试者。所述受试者可以是任何动物(例如猫、狗或马)。通常,所述受试者是人类。通常,受试者患有或怀疑患有癌症,例如结肠癌、胰腺癌或肺癌。例如,受试者可能患有转移性结直肠癌或广泛性小细胞肺癌。
[0221]
在检测样品中伊立替康的存在、不存在或含量的方法中,使样品与本文所述的适体相互作用(即接触)。例如,可以将样品和本文所述的适体在足以使适体的至少一部分与样品中的伊立替康结合的条件下培养。
[0222]
本领域技术人员将理解本文所述适体与伊立替康之间发生结合所需的条件。在某些实施方案中,样品和适体可在温度大约20℃至大约37℃,优选大约22℃条件下培养。在某些实施方案中,可采用合适的缓冲液(例如pbs等)将样品和适体稀释至不同浓度(例如至少大约1%、5%、10%、20%、25%、30%、40%、50%、60%、70%、80%v/v或更高)。在某些实施方案中,样品和适体可在振动和/或混合的条件下培养。在某些实施方案中,将样品和适体培养至少1分钟、至少5分钟、至少15分钟、至少1小时或更长时间。
[0223]
在某些实施方案中,适体与伊立替康的结合导致形成适体
‑
伊立替康复合物。如本文所述,结合或结合事件可以例如通过视觉、光学、光子、电子、声学、光声、质量、电化学、电光、光谱、酶或化学、生物化学或物理方法检测。
[0224]
在某些实施方案中,如本文所述,所述方法包括使样品与本发明的适体和固定寡核苷酸相互作用。如上所述,与伊立替康的结合可能使适体的构象改变,导致其从固定寡核苷酸中置换。例如,当固定寡核苷酸与载体连接时,伊立替康与适体的结合可能导致适体从载体上置换。
[0225]
在某些实施方案中,适体与固定寡核苷酸的结合在固定寡核苷酸固定到载体上之前进行。在替代实施方案中,固定寡核苷酸在核酸分子与固定寡核苷酸杂交之前连接到载体上。固定寡核苷酸和/或核酸分子可以连接到载体上。所述连接可以例如通过接头或其它连接单元直接或间接连接。
[0226]
适体和伊立替康的结合可以采用任何合适的方法检测。如上文所述,例如,可以采用生物传感器检测适体和伊立替康的结合。在某些实施方案中,如本文所述,适体和伊立替康的结合采用spr、rlfs、bli、lfd或elona检测。
[0227]
有利的是,本文所述适体允许检测临床有效含量的伊立替康。例如,本文所述的适体可以检测约10ng至约10000ng/ml的伊立替康。因此,适体能够以高特异性和亲和力与伊立替康结合,并允许检测样品中临床范围的活性伊立替康。
[0228]
sn
‑
38的检测方法
[0229]
在某些实施方案中,本发明提供用于检测本文所述任何样品中sn
‑
38的存在、不存在或含量的方法。
[0230]
有利的是,本文所述的cp11适体(例如seq id no:10至12中的任一个序列)能够与伊立替康和sn
‑
38特异性结合,而本文所述的cp13适体(例如seq id no 3至7中的任一个序列)能够与伊立替康特异性结合并且与sn
‑
38不结合或以低亲和力结合。因此,这些适体可以组合使用,以测定伊立替康与其活性代谢物sn
‑
38之比。这样做可以对样品中sn
‑
38的含量进行定量。
[0231]
在某些实施方案中,所述方法包括使样品与第一适体(例如cp13适体或其片段)相互作用,其中所述适体包括以下项或由以下项组成:
[0232]
(a)选自seq id no:3至7中任一个的核酸序列;
[0233]
(b)选自seq id no:3至6中任一个的核酸序列;
[0234]
(c)选自seq id no:3的核酸序列;
[0235]
(d)与(a)至(c)的序列中的任一个具有至少大约85%、90%、95%或更多同一性的核酸序列;和/或
[0236]
(e)具有(a)至(d)的序列中任一个的至少大约30个、35个、40个或更多个连续核苷酸的核酸序列;
[0237]
其中所述适体不与sn
‑
38结合或仅以低亲和力与sn
‑
38结合。
[0238]
在某些实施方案中,所述方法进一步包括使样品与第二适体(例如cp11或其片段)相互作用,其中所述适体包括以下项或由以下项组成:
[0239]
(a)选自seq id no:10至12中任一个的核酸序列;
[0240]
(b)选自seq id no:10或11的核酸序列;
[0241]
(c)选自seq id no:10的核酸序列;
[0242]
(d)与(a)至(c)的序列中的任一个具有至少大约85%、90%、95%或更多同一性的核酸序列;和/或
[0243]
(e)具有(a)至(c)的序列中任一个的至少大约30个、35个、40个或更多个连续核苷酸的核酸序列;
[0244]
其中所述适体还能够与sn
‑
38特异性结合。
[0245]
在某些实施方案中,所述方法包括采用第一适体检测样品中伊立替康的存在、不存在或含量。在某些实施方案中,所述方法进一步包括采用第二适体检测样品中sn
‑
38的存在、不存在或含量。可以采用任何合适的方法,包括但不限于本文所述的任何方法检测伊立替康和/或sn
‑
38的存在、不存在或含量。
[0246]
在某些实施方案中,所述方法进一步包括将采用第一适体检测的伊立替康含量与采用第二适体检测的伊立替康和sn
‑
38的含量进行比较。伊立替康和/或sn
‑
38的含量可以例如利用适体和相应靶的适当校准曲线进行计算。
[0247]
在某些实施方案中,所述方法进一步包括将采用第一适体检测的伊立替康含量与采用第二适体检测的伊立替康和sn
‑
38的含量进行比较。例如,可以将采用第一适体检测的伊立替康含量除以采用第二适体检测的伊立替康和sn
‑
38的总含量,得到样品中伊立替康与sn
‑
38之比。
[0248]
在某些实施方案中,可以将采用第一适体检测的伊立替康含量除以采用第二适体检测的伊立替康和sn
‑
38的总含量,测定样品中sn
‑
38的存在、不存在或含量。
[0249]
有利的是,本文所述适体可以检测临床有效含量的伊立替康。例如,本文所述的适
体可以检测约0.1ng/ml至约100ng/ml的sn
‑
38。因此,适体能够以高特异性和亲和力与伊立替康结合,并可以检测样品中临床范围的活性伊立替康。
[0250]
癌症治疗期间监测伊立替康
[0251]
在某些实施方案中,本发明提供了监测伊立替康治疗的受试者样品中伊立替康水平的方法。因此,本发明提供了根据受试者的个人需要调整治疗方案的机会,从而允许更有效和个性化的治疗。
[0252]
在某些实施方案中,本发明提供了根据本文所述的任何方法检测受试者样品中伊立替康和/或sn
‑
38的含量,然后根据检测的伊立替康的水平治疗或预防受试者的癌症。
[0253]
在某些实施方案中,所述方法包括在检测受试者样品中伊立替康和/或sn
‑
38的含量之后向受试者施用一定剂量(例如初始剂量)的伊立替康。
[0254]
通常,癌症是结肠癌(例如转移性结直肠癌)、胰腺癌或肺癌(例如广泛性小细胞肺癌)。通常,所述受试者是人类。通常,所述受试者是成年人。
[0255]
伊立替康的初始剂量是向受试者施用的治疗或预防有效的伊立替康剂量。通常,伊立替康的初始剂量是注射的(例如静脉注射)。
[0256]
初始剂量可以根据各种参数来确定,尤其是接受治疗的受试者的年龄、体重和状况以及所需的方案。医生将能够确定任何受试者所需的给药途径和剂量。
[0257]
在某些实施方案中,在第1、8、15和22天,在90分钟内采用初始静脉内剂量125mg/m2的伊立替康治疗患有转移性结直肠癌的成人(例如,任选联用静脉内剂量20mg/m2的亚叶酸,然后在第1、8、16和22天施用静脉内剂量500mg/m2的5
‑
氟尿嘧啶)。
[0258]
在某些实施方案中,患有广泛性小细胞肺癌的成人在第1、8和15天,在90分钟内接受初始静脉剂量60mg/m2的伊立替康治疗(例如,任选第1天联用静脉内剂量60mg/m2的顺铂)。在治疗或预防癌症的方法中,根据本文所述的方法检测受试者样品中伊立替康和/或sn
‑
38的水平。通常,所述样品是血液样品。通常,检测血液样品中伊立替康的最低血浆浓度(plasma trough)水平(cmin)(例如,在施用下一剂量之前伊立替康达到的最低浓度)。
[0259]
如果所测伊立替康和/或sn
‑
38的水平低于下阈值水平,则增加向受试者施用的伊立替康的剂量。本文“下阈值水平”理解为是指被认为不可能在受试者中导致肿瘤响应的血浆中的任何伊立替康和/或sn
‑
38的水平。熟悉本领域的技术人员可以根据例如癌症的类型和/或受试者的年龄、性别或体重来选择合适的下阈值水平。亦参见,例如adiwijaya bs,kim j,lang i,et al.clin.pharmacol.ther.2017;102(6):997
‑
1005(通过引用而并入本文中)。
[0260]
在某些实施方案中,伊立替康的下阈值水平可以是约50ng/ml、约40ng/ml、约30ng/ml、约10ng/ml、约5ng/ml或更低。
[0261]
在某些实施方案中,sn
‑
38的下阈值水平可以是约1ng/ml、约0.5ng/ml、约0.4ng/ml、约0.3ng/ml、约0.2ng/ml、约0.1ng/ml、约0.05ng/ml或更低。
[0262]“增加剂量”可能指的是比初始剂量更高的剂量,其作用是进一步将样品中伊立替康的水平增加到下阈值水平之上。本领域技术人员例如根据伊立替康的初始剂量和样品中伊立替康的水平,将能够计算适当的增加剂量。
[0263]
如果所测伊立替康和/或sn
‑
38的水平高于上阈值水平,则减少受试者的伊立替康施用剂量。本文“上阈值水平”理解为是指被认为可能在受试者中导致毒性(嗜中性白细胞
减少症和/或腹泻)的血浆中的任何伊立替康和/或sn
‑
38的水平。熟悉本领域的技术人员可以根据例如癌症的类型和/或受试者的年龄、性别或体重来选择合适的上阈值水平。亦参见,例如adiwijaya bs,kim j,lang i,et al.clin pharmacol.ther.2017;102(6):997
‑
1005(通过引用而并入本文中)。
[0264]
在某些实施方案中,伊立替康的上阈值水平可以是约3000ng/ml、约4000ng/ml、约5000ng/ml、约6000ng/ml、约7000ng/ml、约8000ng/ml、约9000ng/ml、约10000ng/ml、约15000ng/ml或更高。
[0265]
在某些实施方案中,sn
‑
38的上阈值水平可以是约3ng/ml、约5ng/ml、约10ng/ml、约20ng/ml、约30ng/ml、约40ng/ml、约50ng/ml、约60ng/ml、约70ng/ml、约80ng/ml、约90ng/ml、约100ng/ml或更高。
[0266]“减少剂量”理解为指的是比初始剂量更低的剂量,其作用是进一步将样品中伊立替康的水平减少到更可能降低受试者毒性的水平。本领域技术人员将能够根据伊立替康的初始剂量和样品中伊立替康的水平,计算适当的减少剂量。在某些实施方案中,停止施用伊立替康。
[0267]
如果所测sn
‑
38的水平低于下阈值水平,则增加受试者的伊立替康施用剂量。“增加剂量”理解为指的是比初始剂量更高的剂量,其作用是将sn
‑
38的水平增加到更可能引发受试者肿瘤响应的水平。本领域技术人员将能够根据伊立替康的初始剂量和样品中sn
‑
38的水平,计算适当的增加剂量。
[0268]
如果所测sn
‑
38的水平高于上阈值水平,则减少受试者的伊立替康施用剂量。“减少剂量”理解为指的是比初始剂量更低的剂量,其作用是将sn
‑
38的水平减少到更可能降低受试者毒性的水平。本领域技术人员将能够根据伊立替康的初始剂量和样品中sn
‑
38的水平,计算适当的减少剂量。在某些实施方案中,停止施用伊立替康。
[0269]
在某些实施方案中,伊立替康的下阈值水平是约10ng/ml和/或伊立替康的上阈值水平是约10000ng/ml。
[0270]
在某些实施方案中,伊立替康的下阈值水平是约5ng/ml和/或伊立替康的上阈值水平是约2000ng/ml。
[0271]
在某些实施方案中,sn
‑
38的下阈值水平是约0.5ng/ml和/或sn
‑
38的上阈值水平是约100ng/ml。
[0272]
在某些实施方案中,sn
‑
38的下阈值水平是约0.1ng/ml和/或sn
‑
38的上阈值水平是约25ng/ml。
[0273]
在某些实施方案中,在向受试者施用初始剂量的伊立替康(任选与其他药物(例如亚叶酸、5
‑
氟尿嘧啶和/或顺铂)组合施用)后的4周、2个月、3个月、4个月、5个月、6个月或12个月(或周期)内检测伊立替康和/或sn
‑
38的水平。伊立替康的水平可检测一次或多次,例如在伊立替康治疗开始后定期检测。通常,在伊立替康治疗的第一年内,在伊立替康治疗的大约第3、6和/或12个月时检测伊立替康的水平,以便监测伊立替康的治疗水平(必要时调整到目标水平)。
[0274]
试剂盒
[0275]
本发明还提供用于检测和/或定量伊立替康的试剂盒,其中所述试剂盒包含本文所述的一种或多种适体。通常,所述试剂盒还包含本文所述的可检测分子。
[0276]
在一些实施方案中,所述试剂盒还包含本文所述任何方法的使用说明。
[0277]
在某些实施方案中,所述试剂盒还包括本文所述的固定序列、载体和/或接头。
[0278]
通常,所述试剂盒包括用于试剂盒预期反应或将要开展的方法的其它组分,例如用于富集、分离和/或隔离程序预期检测的组分。例如缓冲溶液、显色反应底物、染料或酶底物。在试剂盒中,适体可以以多种形式提供,例如预先固定在载体(例如固体载体)上、冷冻干燥或在液体介质中。
[0279]
本发明的试剂盒可用于执行本文所述的任何方法。应当理解的是,试剂盒的各部分可以单独包装在小瓶中,或者组合包装在容器中或多容器单元中。通常,试剂盒的制造遵循本领域技术人员熟悉的标准程序。
[0280]
实施例
[0281]
在下文中,将通过特定实施方案的非限制性实施例对本发明进行更详细地说明。在实施例的实验中,采用无污染的标准试剂和缓冲液。
[0282]
实施例1
–
适体筛选
[0283]
采用置换筛选法进行单链dna适体的筛选。插入的荧光标记允许在方法的不同步骤后通过荧光测量对dna进行定量。
[0284]
在筛选过程中,将适体文库的ssdna寡聚体通过互补的固定寡核苷酸固定在磁珠上。在不同的洗涤步骤去除未结合和仅弱结合的ssdna分子后,在相同的条件下进行背景洗脱和随后的靶结合步骤。靶结合导致适体构象改变。构象改变导致适体与固定寡核苷酸分离,从而释放/置换与靶分子复合的适体。如果不存在靶分子,则适体分子不会发生构象变化,因此仍然与固定寡核苷酸杂交。
[0285]
直接比较背景步骤中非特异性洗脱物质的含量和由于靶结合而置换的适体的含量,可以跟踪筛选过程。如果与非特异性背景相比,靶结合材料呈指数富集,则适体筛选过程是成功的。富集的适体池可用作“多克隆适体”,也可以从池中分离出单个适体分子。
[0286]
通过引入反筛选步骤,提高了筛选过程的严格性。在这些步骤中,将固定文库采用非特异性的/“不需要的”靶分子固定,以去除与这些非特异性的/“不需要”的靶具有亲和力的ssdna分子。
[0287]
适体文库和寡核苷酸
[0288]
在筛选过程中,适体文库(由比利时idt制造)的ssdna寡核苷酸序列通过互补的固定寡核苷酸(seq id no:16)固定到磁珠上。
[0289]
适体文库的核苷酸序列具有以下结构(5’至3’方向):
[0290]
p1
–
r1
–
i
–
r2
–
p2,
[0291]
其中p1是第一引物区,r1是第一随机化区,i是固定区,r2是另一随机化区,p2是另一引物区,其中至少r1和/或r2或它们的一部分参与靶分子结合。
[0292]
采用以下修饰引物通过pcr扩增寡聚体:具有以下序列的荧光素(fam)标记正向引物(p1):5
’‑
/56fam/atccacgctctttttctcc
–3’
和具有以下序列的po4‑
修饰反向引物(p2):5’/5phos/cctatgtcaccctcaatgc
‑3’
。
[0293]
示例性生物素化固定寡核苷酸(i)具有以下结构:5’bio
‑
gtc
‑
hegl
‑
gatcgagcctca
‑3’
。所有寡核苷酸均由比利时idt公司化学合成。
[0294]
文库的第一随机化区(r1)是任何10个核酸的序列。文库的第二随机化区(r2)是任
何40个核酸的序列。
[0295]
荧光测定
[0296]
将荧光标记混入适体内,可通过荧光板读取器分析,在过程的不同步骤后定量适体dna。
[0297]
采用bmg荧光板读取器(英国bmg fluostar optima公司)在以下测量条件下对荧光素(fam)标记的dna进行荧光测量:激发485nm/发射520nm。
[0298]
将适体文库固定到磁珠上
[0299]
将适体文库的ssdna寡聚体通过固定寡核苷酸固定在磁珠上。所述固定寡核苷酸包含12个核苷酸的定义区,所述定义区与ssdna初始文库的区互补,从而使两个分子之间能够杂交。此外,固定寡核苷酸携带通过六乙二醇(hegl)残基结合的5'生物素,所述生物素负责将固定寡核苷酸与链霉亲和素修饰的磁珠偶联。
[0300]
为了进行固定,将3nmol初始文库和2nmol固定寡核苷酸在250μl结合缓冲液“bb”(20mm tris
‑
hcl ph 7.4、100mm nacl、5mm kcl、2mm mgcl2、1mm cacl2、0.01%tween 20)中在95℃下加热混合物5分钟开展预杂交。冷却至4℃后,根据制造商的说明,采用b&w(5mm tris
‑
hcl ph 7.5、0.5mm edta、1m nacl、0.01%tween 20)缓冲液,将预杂交文库
‑
固定寡核苷酸混合物固定到109个m
‑
270链霉亲和素磁珠(英国thermo fisher scientific公司)上。
[0301]
从第2轮开始,将300pmol fam标记的适体文库和200pmol固定寡核苷酸在100μl结合缓冲液(bb)中使用与上述相同的方案进行杂交。根据制造商的说明,将预杂交的适体文库
‑
固定寡核苷酸混合物固定到108个m
‑
270链霉亲和素磁珠上。
[0302]
置换法体外筛选
[0303]
采用置换筛选法进行dna适体的筛选。将荧光标记混入适体文库,可通过荧光板读取器分析,在过程的每个步骤后定量适体dna。采用bmg荧光板读取器(英国bmg fluostar optima公司)在以下测量条件下对荧光素(fam)标记的dna进行荧光测量:激发485nm/发射520nm。靶置换和回收的适体dna的定量基于利用fam标记的ssdna(寡核苷酸文库)的校准曲线进行计算,所述校正曲线的范围为0
‑
50pmol/ml,是为相关适体筛选缓冲液中的每个适体文库配制的。
[0304]
将靶cpt
‑
11(盐酸伊立替康,英国sigma
‑
aldrich公司)在dmso中稀释至1mg/ml储备溶液,并于
‑
20℃储存。使用前在筛选缓冲液pbs6(10mm na2hpo4/2mm kh2po4,ph 6.0,137mm nacl,2.7mm kcl,2mm mgcl2,1mm cacl2,0.01%tween 20)中配制10μm的工作储备溶液。对伊立替康靶向适体筛选中采用的缓冲液进行优化以提高筛选效率。
[0305]
使用biomek fx(美国beckman
‑
coulter公司,目录编号717004,序列号50111125)作为自动化方法开展连续几轮置换筛选过程,包括以下步骤;经过优化以减少与不需要的靶的相互作用,去除弱结合序列或机械过程释放的序列;并提高伊立替康的筛选效率:
[0306]
‑
根据上述方案将初始适体文库(或从上一轮制备的富集适体文库)与磁珠结合。
[0307]
‑
对固定适体文库的含量进行定量(荧光测量),第一轮筛选输入500pmol固定初始文库,然后每轮筛选输入80pmol固定适体文库。
[0308]
‑
在筛选缓冲液pbs6中,于28℃高温洗涤步骤中保持15分钟,去除弱结合的寡聚体。
scientic公司clonejet pcr克隆试剂盒pjet正向引物和pjet反向引物)通过“菌落pcr”对96个阳性转化体/克隆进行了分析。同时,使用适体特异性fam标记的正向引物和po4修饰的反向引物,通过“适体pcr”从相同的转化体/克隆产生适体dna。
[0322]
单个适体的鉴定
[0323]
根据上述克隆方案,为来源于适体池irip cs2的单个适体克隆制备单链dna。然后使用上述bli分析测定每个克隆与靶cpt
‑
11的结合。然后分析6个最佳结合克隆与代谢物sn
‑
38的结合情况。比较这6个适体克隆与cpt
‑
11和sn
‑
38结合的响应信号,找出最佳结合和最具特异性的适体克隆(图5、图6和下表1)。
[0324]
表1:与cpt
‑
11和sn
‑
38结合的适体克隆响应信号比较。
[0325]
适体克隆cpt
‑
11响应sn
‑
38响应cpt
‑
11/sn
‑
38之比cp11(最佳结合适体)0.61920.30752.014cp100.55870.21862.556cp50.46340.16822.755cp40.44810.18702.396cp13(最具特异性适体)0.44160.14043.145cp80.3290.13632.413
[0326]
克隆cp11和cp13的dna由(英国邓迪大学mrc ppu dna测序和服务部门)进行测序。使用ebi网络服务器(http://www.ebi.ac.uk/tools/msa/clustalw2/)提供的网络工具clustalw对获得的序列数据进行分析和比对。适体的二级结构分析采用最小自由能算法mfold进行[[zuker,m.(2003)mfold web server for nucleic acid folding and hybridization prediction.nucleic acid res.31(13)(http://mfold.rna.albany.edu/?q=mfold)(图1)。
[0327]
适体与靶伊立替康(cpt
‑
11)和代谢物sn
‑
38的表观结合亲和力的测定
[0328]
根据上述方案,使用bli分析(置换分析)测定适体的表观亲和力。
[0329]
将适体与固定寡核苷酸预杂交,并固定到如上所述的链霉亲和素生物传感器探针上。伊立替康(cpt
‑
11)和sn
‑
38这两种靶分别以浓度系列(10μm、5μm、2.5μm、1.25μm、0.625μm、0.3125μm、0μm,在pbs6中稀释)使用。
[0330]
适体置换响应呈浓度依赖性。所述响应可以采用“翻转”数据进行比较,并采用稳态分析拟合。k
d
值采用fortebio软件计算(fortebio data analysis 8.0,steady state analysis)。由于响应不是结合曲线,因此,这并不是真实的k
d
测定,仅用于比较用途。)
[0331]
为了进行比较,适体cp11对(a)伊立替康(pbs6中)的亲和力采用1.0x10
‑7m
±
0.32(100nm
±
32)计算。适体cp11对(b)sn
‑
38(pbs6中)的亲和力采用8.7x10
‑8m
±
4.2(87nm
±
42)计算(图7)。
[0332]
为了进行比较,适体cp13对(a)伊立替康(pbs6中)的亲和力采用2.7x10
‑7m
±
0.34(270nm
±
34)计算。适体cp13对(b)sn
‑
38(pbs6中)的亲和力未进行检测(图8)。
[0333]
适体特异性的测定
[0334]
根据上述方案,使用bli分析测定适体特异性。靶伊立替康(cpt
‑
11)、代谢物sn
‑
38和阴性靶伊马替尼以10μm(pbs6中)浓度使用。
[0335]
bli测试证明了适体cp13的高度特异性和适体cp11的中等特异性。表明了适体
cp11与伊立替康cpt
‑
11的结合增加。代谢物sn
‑
38测量到较低的信号。阴性靶伊马替尼的结合水平非常低。表明了适体cp13与伊立替康(cpt
‑
11)的结合增加。代谢物sn
‑
38和阴性靶伊马替尼未检测到任何结合(图9)。
[0336]“类elisa”适体置换测定(基于微量滴定板的荧光测定)和人血浆中适体选择性的评估
[0337]
为了将适体固定到链霉亲和素包被的mtp(pierce链霉亲和素包被,hbc,black 96
‑
孔板,包括superblock阻断缓冲液,美国thermo scientific公司)上,将0.75μm适体1和0.5μm固定寡核苷酸在缓冲液bb中通过加热混合物至95℃保持10分钟开展预杂交,然后立即冷却至4℃保持5分钟,然后与等体积的2x b&w缓冲液混合。将微量滴定板mtp 1采用所述预杂交混合物在室温下培养1h,同时在mtp摇床(德国ikawerke gmbh&co.kg公司ika sch
ü
ttler mts 4,)上以1000rpm振动。通过分别比较培养前和培养后的输入和输出荧光来测定固定效率。这样可以通过荧光测量计算负载适体的近似含量。适体负载板(mtp 1)用筛选缓冲液pbs6充分清洗以去除松散固定的dna,然后在室温下采用梯度靶伊立替康(10μm、5μm、2.5μm、1.25μm、0.625μm、0μm)培养1小时(1000rpm转速mtp摇床),梯度靶伊立替康在4种浓度(缓冲液pbs6中0%、10%、20%和25%v/v基质)的缓冲人血清(英国bioivt公司humanpl32ncu2n)中配制。测定保留在streptawell板上的荧光适体(在洗涤以去除释放的适体和任何剩余基质后),并利用靶培养前后的测量值计算靶结合材料的含量。该数据用于计算相对靶培养前固定适体的适体结合率[%]。该数据通过减去相应的“0um靶”对照孔读数进行校正。然后,将数据以“适体结合率[%]”相对“靶浓度”以及不同血浆浓度作图。
[0338]
在所有四种血浆浓度下,都可以观察到适体cp11和cp13与靶伊立替康的结合呈现明显的浓度依赖性(图10)。在反映伊立替康这种治疗分子治疗范围的浓度下进行分析。伊立替康的检测限小于1μm,在这种药物的临床范围内,具有明显的浓度依赖性响应。
[0339]
采用上述类elisa分析测定适体cp11和cp13的结合特异性。伊立替康和代谢物sn38均在缓冲人血浆(20%血浆)中进行测试(图11)。适体cp11与人血浆中的两种靶都呈现靶浓度依赖性结合;而适体cp13显示与代谢物sn
‑
38不结合,但与伊立替康(cpt
‑
11)呈现强烈的浓度依赖性结合。因此,适体cp11和cp13可以组合使用,以测定伊立替康(cpt
‑
11)与其活性代谢物sn
‑
38之比。
[0340]
实施例2
–
适体cp13最小结合片段的鉴定
[0341]
为了鉴定适体cp13的最小功能片段,产生了一组片段(亲本适体的截短片段)(由比利时idt制造)。对这组片段与靶伊立替康(10μm,pbs6中)的结合进行测定。特别是,采用bli置换结合研究来鉴定适体cp13的最小有效片段。对适体cp13的一组截短片段与靶伊立替康(10μm,pbs6中)的结合能力进行测试(图12)。采用bli置换分析开展最小片段鉴定研究(翻转数据,减去缓冲液)。许多适体片段失去了结合能力,表明结合位点已被去除或受损。其他片段相对于亲本适体(cp13)显示出结合得到改善。这组片段中最小且性能最佳的适体片段是cp13
‑
f4c(图12,seq id no:3)。
[0342]
采用如上所述的bli置换分析测试该适体片段的表观结合亲和力。适体片段cp13
‑
f4c表现出靶浓度依赖性适体置换。信号(r平衡,req)进行“翻转”,并采用稳态分析拟合。亲和常数(k
d
值)采用fortebio data analysis 8.0软件计算。为了进行比较,适体cp13
‑
f4c对伊立替康(pbs6中)的亲和力采用1.6x10
‑7m
±
0.4(160nm
±
40)计算(图13)。
[0343]
采用基于微量滴定板的适体置换分析(类elisa荧光分析),测定了适体片段cp13
‑
f4c的靶结合特异性。采用几个相关靶监测靶诱导的置换,并证明了最小功能片段与其靶伊立替康(cpt
‑
11)结合。它还与伊立替康代谢物sn
‑
38和apc结合,但结合程度低于伊立替康。这些测试在缓冲pbs6中、在反映这些药物治疗范围的靶浓度下进行(图14)。
[0344]
如上所述,通过“类似elisa”的适体置换分析(基于微量滴定板的荧光分析)证实了适体与其人血浆中的靶(伊立替康cpt
‑
11)结合。图15示出了人血浆中最小功能片段cp13
‑
f4c的靶结合情况。结果表明,在人血浆存在下,最小片段cp13
‑
f4c能够与靶伊立替康(cpt
‑
11)特异性结合。测试在反映这种药物治疗范围的靶浓度下进行。
[0345]
如上所述,cp13
‑
f4c的二级结构分析采用互联网工具mfold,按照zuker,2003的自由能最小化算法进行(图1d)。
[0346]
实施例3
–
适体cp11最小结合片段的鉴定
[0347]
适体cp11最小功能片段的鉴定按照与实施例2相同的方案进行。产生一组片段(亲本适体的截短片段)(由比利时idt公司制造)。对这组片段与靶伊立替康(10μm,pbs6中)和代谢物sn
‑
38(10μm,在pbs6中)的结合进行测定。特别是,采用bli置换结合研究来鉴定适体cp11的最小有效片段。采用bli置换分析开展最小片段鉴定研究(翻转数据,减去缓冲液)。许多适体片段失去了结合能力,表明结合位点已被去除或受损。其他片段相对于亲本适体(cp11)显示出结合得到改善。这组片段中最小且性能最佳的适体片段是cp11
‑
f3e(图12,seq id no:10)(图16)。
[0348]
如上所述,cp11
‑
f3e的二级结构分析采用互联网工具mfold,按照zuker,2003的自由能最小化算法进行(图1c)。
[0349]
读者应注意与此说明书同时提交、或在本说明书之前提交的与本技术有关的、可供公众查阅的所有论文和文件,通过引用,所有这些论文和文件都并入本文中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。