1.本发明涉及功能微生物筛选技术领域,具体涉及一株新型昆明假单胞菌及其在环保水处理中的应用。
背景技术:
2.近年来随着人们生活节奏的加快和工业发展规模的快速提升,环境污染问题越来越引起重视。其中水体环境的污染问题尤为突出。
3.无论是在生活污水、畜禽养殖污水还是在生物发酵、食品加工等工业废水中,氮元素作为一种重要的污染因子,容易造成水体的富营养化并引起微生物的大量增殖消耗水中的溶解氧,进而使厌氧微生物大量生长繁殖,产生硫化氢、氨气等恶臭气体并形成黑臭水体。
4.氮元素超标的一种表现是水体氨氮超标。目前污水处理工艺中,氨氮的去除工艺主要包括物理化学法和生物法两类。常用的理化法有折点加氯法、选择性离子交换法、空气吹脱法和催化氧化法。而生物法除氨氮由于投资运行成本低,操作简单,无二次污染等优点,已经成为应用最为广泛的除氨但的技术。
5.微生物去除氨氮的过程主要靠硝化细菌来完成。硝化细菌主要分为氨氧化细菌和亚硝酸氧化细菌,分别实现氨氮转化成亚硝酸盐氮和亚硝酸盐氮转化为硝酸盐氮的过程。一般认为自然界中的硝化作用主要由自养型硝化细菌完成的。
6.硝化过程反应是在好氧条件下发生的,在好氧段中提供充足的氧气,氨氮被硝化细菌转化成硝酸盐氮,然后处理液被回流至前置式的缺氧段或流入后置式缺氧段进行反硝化作用。特别是在后置式反硝化工艺中,由于处理液中有机物的匮乏,一般需要人工添加碳源才能保证足够好的脱氮效果。
7.在实际的污水处理调控过程中,好氧段经常出现碳源升高,由于自养型硝化细菌生长缓慢,对氧气和营养物质的竞争能力低于异养型细菌,从而导致异养细菌大量繁殖造成溶氧降低,影响硝化效率。此外,自养型硝化细菌很难维持较高的生物浓度,特别是在低温的冬季,往往会造成水力停留时间过长,增加了基建成本和运行成本。
8.正是由于上述原因,增殖速度快,环境耐受度高的异养型硝化菌近年来越来越受到关注,相关产品在市场上也越来越受到青睐。
9.在水产养殖过程中,大量的残余饵料和排泄废物排入水体中,都极易造成水体污染,特别是水体中氨氮的升高。我国《渔业水质标准》(gb 11607)要求,养殖水中非离子氨不得高于0.02mg/l。水产养殖尾水如果得不到及时有效地解决,会进一步造成养殖环境恶化,导致养殖产品爆发疾病甚至大量死亡,严重影响水产品产量和质量。利用海水养殖过程中,由于水体盐度约为35
‰
,一般硝化细菌难以发挥应有的作用。因此市场上对耐盐硝化细菌的需求异常迫切。
10.氮元素超标的另一种表现是总氮超标。同样,目前的脱氮技术中,利用微生物进行生物脱氮是应用最为广泛的氮脱除技术。传统的微生物反硝化过程主要是利用反硝化细菌
在缺氧或厌氧的条件下将硝酸盐氮转化为n2o和n2等气态产物,实现废水中氮的去除。
11.在传统脱氮工艺中,由于硝化和反硝化是两个相互独立的过程,对环境条件的要求也不同,因此都是将硝化、反硝化按序列式进行,需要分别配置相对独立的缺氧区和好氧区反应器。好氧区硝化作用产生的硝酸盐氮流入厌氧区,由反硝化细菌进行反硝化脱氮作用。因此反应器建设成本较高。
12.另外,硝化过程容易受到有机物负荷影响,严重影响硝化细菌活性,从而进一步影响反硝化的脱氮效果。同时,传统的脱氮微生物生长速率慢活性低,脱氮效果会受低温、高盐等特殊条件的影响而大幅降低。
13.近年来,国内外越来越多的研究和报道都已经证明,反硝化可以在有氧的条件下进行,即存在好氧反硝化作用。
14.相比传统生物脱氮工艺,好氧反硝化可以实现在同一个反应器中进行硝化和反硝化作用,无需另建厌氧反应器,运行和维护的费用较低;能缩短生物脱氮的历程,提高污水处理效率;节省传统反硝化过程中的碳源投加,降低运行成本;无需回流装置,降低动力消耗等等。此外还发现,好氧反硝化菌大多同时具有异养硝化的能力,可同时实现废水中有机物和氮的去除且在处理过程中基本没有硝酸盐和亚硝酸盐的积累。
15.鉴于上述诸多优点,好氧反硝细菌越来越受到人们的重视。
技术实现要素:
16.本发明为解决现有技术问题,提供了一种昆明假单胞菌菌株及其在环保水处理中的应用。所述菌株能高效降解废水中的总氮,使其达到出水水质要求,可广泛应用于环保领域。
17.本发明一方面提供了一株昆明假单胞菌zsdb122(pseudomonas kunmingensis zsdb122),已于2020年4月2日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏编号为cgmcc no.19546。
18.本发明另一方面提供了一种微生物制剂,包含上述昆明假单胞菌。
19.所述微生物制剂还包含假单胞菌属、亚硝化单胞菌属、芽孢杆菌属、动胶菌属、从毛单胞菌属、产碱杆菌属、微球菌属、酵母菌属中的任意一种或两种或多种的组合。
20.所述微生物制剂中上述昆明假单胞菌的活菌量不低于109cfu/g。
21.本发明还提供了上述微生物制剂在污水处理中的应用。
22.本发明所述昆明假单胞菌可耐受约8%的高盐度,且具有极好的总氮降解能力,硝酸盐氮和总氮降解率在16h时达到86.38%和80.75%;24h达到100%和95.61%,同时,该菌在降氮过程中没有或只有微量亚硝酸盐氮积累。所述昆明假单胞菌zsdb122在异养和自养条件下,24h氨氮降解率分别高达96.77%和73.89%,效果非常显著。
23.在酶制剂发酵污水处理过程中,投加昆明假单胞菌zsdb122的实验组1和3,总氮降解率最高,尤其是实验组3,在提供菌剂营养补充剂的保障下,总氮降解率高达84.01%,出水总氮降至37.2mg/l,达到了出水水质要求。在对虾养殖尾水处理过程中,投加昆明假单胞菌zsdb122的实验组经过72h作用,水体氨氮降至0.130mg/l,总氮降至3.81mg/l,水质符合排放标准要求。昆明假单胞菌zsdb122对养殖尾水的氨氮降解效率高达94.2%,总氮降解效
率高达83.8%,取得了意料不到的技术效果。
24.所述昆明假单胞菌可广泛应用于环保水处理领域,有利于大幅减少工业、养殖等领域的废水排放,保护生态环境,应用前景广阔。
附图说明
25.图1为昆明假单胞菌zsdb122在不同盐度条件下的生长曲线。
具体实施方式
26.本发明实施例中选用的设备和试剂可以选自市售任意一种。对于实施例中所用到的具体方法或材料,本领域技术人员可以在本发明技术思路的基础上,根据已有的技术进行常规的替换选择,而不仅限于本发明实施例的具体记载。
27.下面结合具体实施例进一步阐述本发明。
28.实施例1 菌株筛选与性能检测
29.1、富集培养
30.采集潍坊高密市的某工业企业污水处理站曝气工段污水,吸取10ml污水转接至装有100ml富集培养基(kno
3 2.0,k2hpo
4 0.5,mgso4·
7h2o 0.2g,酒石酸钾钠20.0g,自来水1000ml,ph7.2)的250ml三角瓶中,30℃、220rpm条件下培养72h,进行第一次富集。然后,再吸取10ml一次富集液,加入新鲜的富集培养基中,30℃、220rpm条件下培养72h,进行第二次富集。按上述富集方法再进行第三次富集。
31.2、初筛
32.采用梯度稀释法将第三次富集液稀释到10
‑6,分别吸取10
‑3、10
‑4、10
‑5、10
‑6稀释液各200ul至分离培养基(kno
3 2.0,k2hpo
4 0.5,mgso4·
7h2o 0.2g,酒石酸钾钠20.0g,琼脂粉20.0g,自来水1000ml,ph7.2),涂布均匀后倒置于30℃条件下培养约72h至长出单菌落。挑选形态相异的单菌落转接至试管斜面分离培养基上,30℃条件下培养约72h,然后转移至4℃冰箱中保藏备用。
33.按上述分离方法共得到6株菌株,分别编号:zsdb121、zsdb122、zsdb123、zsdb131、zsdb132、zsdb133。
34.3、复筛
35.无菌环境中,将初筛得到的6株菌各挑取1环接种于盛有100ml富集培养基的250ml三角瓶中,30℃、220rpm条件下培养48h,进行活化。
36.分别吸取1ml活化液接种至含100ml新鲜富集培养基的250ml三角瓶中,30℃、220rpm条件下培养。用无菌水代替活化液作为空白组,各实验组设置3个平行。定期检测培养基中硝酸盐氮、亚硝酸盐氮和总氮含量。
37.硝酸盐氮、亚硝酸盐氮和总氮的检测方法分别按照《hj/t 346水质硝酸盐氮的测定紫外分光光度法》、《gb/t 7493水质亚硝酸盐氮的测定分光光度法》、《hj 636水质总氮的测定碱性过硫酸钾消解紫外分光光度法》执行。具体结果见表1。
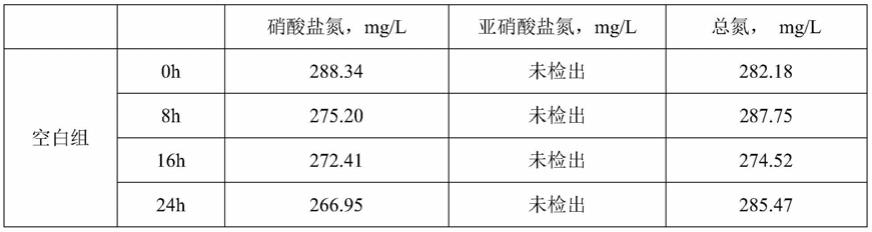
38.表1.各菌株降解硝酸盐氮、亚硝酸盐氮和总氮的效果
[0039][0040][0041]
从表1的结果可知,本发明初筛获得的6株菌中,zsdb122具有极好的总氮降解能力,硝酸盐氮和总氮降解率在8h时分别达到60.04%和45.07%;16h时达到86.38%和80.75%;24h达到100%和95.61%。同时,该菌在降氮过程中没有或只有微量亚硝酸盐氮积累,取得了意料不到的技术效果。
[0042]
实施例2 zsdb122菌株的鉴定
[0043]
将zsdb122菌株送中国科学院微生物研究所进行检测鉴定。根据菌株的细胞形态、生理生化特征、16s rrna基因序列、gyrb基因序列等数据综合分析,参考《伯杰氏系统细菌学手册》以及international journal of systematic and evolutionary microbiology有关研究论文,该菌种被鉴定为昆明假单胞菌(pseudomonas kunmingensis)。
[0044]
zsdb122菌株的细胞形态和理化实验结果如表2所示。
[0045]
表2 zsdb122菌株细胞形态和理化实验结果
[0046][0047]
[0048]
zsdb122菌株的gyrb基因序列为seq id no:1,如下所示:
[0049]
agcttgtcgatgttgtactcttcacgcccgataccacacccgagcagtaatcaggcctcctgggatgagatcatcttgtcgaaacgcgccttctcgacgttaaggatcttgcccttgagcggcaaattgcttgagtgtggttacgaccttcttgggcgagccacccgcggaatcaccctccactatgtagagttcggaaagcgcgggatccttttcctggcagtcagcaagtttgccggcagaccggcgatatccagagcgcctttacgacgggtcatttcccgagccttgcgcgcagcctcgcgagcagcggcatcgatcatcttgccgaccacggccttggcctcgcccggatgctcgaggaggaaatcaccgaagtacttgcccatctcctgttccacggccgttttcacttccgaggaaaccagtttgtccttggtctgcgagctgaacttaggatccggaaccttcaccgaaatgatcgcagtcaggccttcgcgggcatcgtcgccggtagtggcgatcttgtgcttcttggccaggccttcctgctcgatgtaggaattcaggtttcgcgtcagcgcggagcggaagccggccaggtgggtaccaccgtcacgctgaggaatattgttggtaaagcagagaatgttctcgttaaagctgtcgttccactgcagcgccacctcgacaccaacgccgtcgtcacgctgaacgttgaagtggaatacctcgttgacgggggttttgtttgtgttcagtaagcaacgaacgcgctcagaccgccctcgtacttgaacagctcttcccttggcggtacgctcgtcccgcaggacgataccgacccccgagttcaggaatgacagttcgcgcagacgcttggccagaatatcccagctgaaatggatgttctggaargtctcggacgacggcttgaagtgaatctgtgtacccgaggtatcagtttcacctaccggagccaaaggtgcctggggcacgccatgacggtagarctgttcccagaccttgccctccggcggatggtcagcatcaattcctcggacagcgcattgacccgaacaccta。
[0050]
zsdb122菌株的16s rrna基因序列为seq id no:2,如下所示:
[0051]
tctggagcaacccactcccatggtgtgacgggcggtgtgtacaaggcccgggaacgtattcaccgtgacattctgattcacgattactagcgattccgacttcacgcagtcgagttgcagactgcgatccggactacgatcggttttatgggattagctccacctcgcggcttggcaaccctttgtaccgaccattgtagcacgtgtgtagcccaggccgtaagggccatgatgacttgacgtcatccccaccttcctccggtttgtcaccggcagtctccttagagtgcccaccttaacgtgctggtaactaaggacaagggttgcgctcgttacgggacttaacccaacatctcacgacacgagctgacgacagccatgcagcacctgtgtcagagttcccgaaggcaccaatccatctctggaaagttctctgcatgtcaaggcctggtaaggttcttcgcgttgcttcgaattaaaccacatgctccaccgcttgtgcgggcccccgtcaattcatttgagttttaaccttgcggccgtactccccaggcggtcgacttaatgcgttagctgcgccactaagatctcaaggatcccaacggctagtcgacatcgtttacggcgtggactaccagggtatctaatcctgtttgctccccacgctttcgcacctcagtgtcagtattagcccaggtggtcgccttcgccactggtgttccttcctatatctacgcatttcaccgctacacaggaaattccaccaccctctgccatactctagcttgccagttttggatgcagttcccaggttgagcccgggctttcacattcaacttaacaaaccacctacgcgcgctttacgcccagtaattccgattaacgcttgcacccttcgtattaccgcggctgctggcacgaagttagccggtgcttattctgtcggtaacgtcaaaacactaacgtattaggttaatgcccttcctcccaacttaaagtgctttacaatccgaagaccttcttcacacacgcggcatggctggatcaggctttcgcccattgtccaatattccccactgctgcctcccgtaggagtctggaccgtgtctcagttccagtgtgactgatcatcctctcagaccagttacggatcgtcgccttggtgagccgttacctcaccaactagctaatccgacctaggctcatctgatagcgcaaggcccgaaggtcccctgctttctcccgtaggacgtatgcggtattagcgttcctttcgaaacgttgtcccccactatcaggcagattcctaggcattactcacccgtccgccgctgaatcagaga。
[0052]
实施例3 昆明假单胞菌zsdb122异养硝化能力评价
[0053]
1、菌种的活化
[0054]
无菌环境中分别挑取1环昆明假单胞菌zsdb122菌种接入装有100ml异养培养基(丁二酸钠5.62g,(nh4)2so
4 0.5g,k2hpo4·
3h2o 1.31g,nacl 0.3g,feso4·
7h2o 0.03g,
mgso4·
7h2o 0.03g,caco
3 5.0g,自来水1000ml,ph7.8)的250ml三角瓶中和装有100ml自养培养基((nh4)2so
4 0.5g,k2hpo4·
3h2o 1.31g,nacl 0.3g,feso4·
7h2o 0.03g,mgso4·
7h2o 0.03g,caco
3 5.0g,自来水1000ml,ph7.8)的250ml三角瓶中,置于30℃、220rpm条件下培养24h,得到活化菌液。
[0055]
2、异养硝化能力评价实验
[0056]
向装有100ml异养培养基的250ml三角瓶中加入异养活化菌液1.0ml,置于30℃、220rpm条件下培养,每隔8h检测培养基中氨氮含量。共设置3个平行实验组,和1个用无菌水替代活化菌液的空白对照组。
[0057]
3、自养硝化能力评价实验
[0058]
向装有100ml自养培养基的250ml三角瓶中加入自养活化菌液1.0ml,置于30℃、220rpm条件下培养,每隔8h检测培养基中氨氮含量。共设置3个平行实验组,和1个用无菌水替代活化菌液的空白对照组。
[0059]
4、实验结果
[0060]
评价实验结果见表3。
[0061]
表3 异养硝化和自养硝化能力的评价
[0062][0063][0064]
从表3的结果可知,异养硝化实验组的平均初始氨氮浓度为441.4mg/l,0h
‑
8h可降解约197.57mg/l的氨氮,降解率达到为44.76%;9h
‑
16h继续降解约156.56mg/l的氨氮,降解率增加至80.23%;17h
‑
24h又降解约73.02mg/l的氨氮,24h氨氮降解率最终达到96.77%。从而说明,本发明提供的昆明假单胞菌zsdb122具有较强的异养硝化降解氨氮的能力。
[0065]
在自养条件下,平均初始氨氮浓度为442.88mg/l,0h
‑
8h可降解约141.63mg/l的氨氮浓度,降解率达到为32.01%;9h
‑
16h继续降解约100.57mg/l的氨氮浓度,降解率增加至54.79%;17h
‑
24h又降解约84.43mg/l的氨氮,降解率增加至73.89%。从而说明,本发明提供的昆明假单胞菌zsdb122同时具有比较强的自养硝化降解氨氮的能力。
[0066]
实施例4 昆明假单胞菌zsdb122耐盐能力评价
[0067]
1、菌种的活化
[0068]
无菌环境中挑取1环昆明假单胞菌zsdb122菌种接入装有100ml lb液体培养基的250ml三角瓶中,30℃、220rpm培养24h,获得活化菌液。
[0069]
2、耐盐能力评价实验
[0070]
向lb液体培养基中加入适量nacl,使培养基中nacl含量分别为0%、2%、4%、6%、8%、10%。各实验组设3个平行。
[0071]
分别向各实验组加入0.5ml的活化菌液,30℃、220rpm培养24h。培养过程中,每2h取发酵液利用细菌浊度计测定试样浊度值,用未接种活化菌液的0%nacl的lb培养基作为空白对照。然后分别以培养时间为横坐标,浊度值为纵坐标绘制生长曲线。
[0072]
实验结果如图1所示。
[0073]
从图1可以看出,在0%
‑
8%浓度的nacl条件下,昆明假单胞菌zsdb122在24h内均呈现出典型的微生物适应期
‑
指数期
‑
稳定期的生长曲线,该菌生长没有受到明显的抑制。当nacl的浓度增加至10%时,培养基浊度一直处于较低的水平,zsdb122的生长受到明显抑制。因此,本发明提供的昆明假单胞菌zsdb122可耐受约8%的高盐度。
[0074]
实施例5 昆明假单胞菌zsdb122缺氧反硝化、好氧反硝化能力评价
[0075]
1、菌种的活化
[0076]
无菌环境中挑取1环昆明假单胞菌zsdb122菌种接入装有100ml lb液体培养基的250ml三角瓶中,30℃、220rpm培养24h,获得活菌量为108‑
109cfu/ml的活化菌液。
[0077]
2、反硝化能力评价实验
[0078]
向装有100ml培养基(kno
3 2.0,k2hpo
4 0.5,mgso4·
7h2o 0.2g,酒石酸钾钠20.0g,自来水1000ml,ph7.2)的三角瓶中加入活化菌液,置于特定条件下培养,每隔8h检测培养基中总氮含量。具体实验安排如下:
[0079]
(1)空白对照组1:不加活化菌液;
[0080]
(2)实验组2:活化菌液添加量1
‰
;
[0081]
(3)实验组3:活化菌液添加量2
‰
;
[0082]
(4)实验组4:活化菌液添加量5
‰
;
[0083]
(5)实验组5:活化菌液添加量10
‰
。
[0084]
上述实验组1
‑
5,各设3个平行实验组,一并置于30℃、静置条件下培养。
[0085]
(6)空白对照组6:不加活化菌液;
[0086]
(7)实验组7:活化菌液添加量1
‰
;
[0087]
(8)实验组8:活化菌液添加量2
‰
;
[0088]
(9)实验组9:活化菌液添加量5
‰
;
[0089]
(10)实验组10:活化菌液添加量10
‰
。
[0090]
上述实验组6
‑
10,各设3个平行实验组,一并置于30℃、220rpm(溶氧约为6mg/l)条件下培养。
[0091]
实验结果见表4。
[0092]
表4.昆明假单胞菌zsdb122反硝化能力评价
[0093][0094][0095]
从表4的结果可知,实验组4和5、实验组9和10的培养基24h时总氮的含量最低,总氮降解率均超过97%。从而说明,无论是在静置缺氧的状态下,还是在震荡好氧的状态下,昆明假单胞菌zsdb122的接种量达到5
‰
和10
‰
时,降氮效果最好。而且,在0
‑
24h期间内,随着昆明假单胞菌zsdb122接种量的增大,其降氮的起效时间越早,效率也越高。当接种量增加至5
‰
时,其16h时的降氮效果与接种量10
‰
的降氮效果相当。
[0096]
实施例6 昆明假单胞菌zsdb122在酶制剂发酵污水处理中的应用
[0097]
1、昆明假单胞菌zsdb122菌剂的制备
[0098]
将昆明假单胞菌zsdb122进行3吨规模的三级液体有氧发酵,当菌体湿重达到50g/l以上时停止发酵。经管式离心机10000rpm离心收集菌泥,添加淀粉、甘油、麸皮等辅料,经低温干燥制得活菌数约为20亿/g的固体菌剂。
[0099]
2、酶制剂发酵污水基本情况
[0100]
该酶制剂发酵企业位于山东省潍坊市,污水为植酸酶、酸性纤维素酶、木聚糖酶、中温淀粉酶、普鲁兰酶等发酵废液。污水处理站设计日处理能力为300m3/天,污水处理工艺为:原污水经过调节池、初沉池后进入ic塔,再经过2级ao后经过二沉池、混凝池进入终沉池,最后排放。
[0101]
两级ao水力停留时间各约40h,其中a池约20h,o池约20h。原污水总氮浓度约420.7mg/l,出水总氮浓度约为150.1mg/l,要求出水总氮浓度为≤70mg/l。
[0102]
3、应用对比实验
[0103]
实验条件:从污水处理站二沉池取活性污泥20l,取一级ao的a池入口处污水30l,加入ao污水处理模拟实验装置,控制模拟器运行参数如下:
[0104]
(1)环境温度:25℃;
[0105]
(2)污泥龄20d;
[0106]
(3)污泥回流比25%;
[0107]
(4)混合液回流比100%;
[0108]
(5)溶解氧,a池0.5mg/l;o池2.0mg/l。
[0109]
实验设计。具体实验安排如下,每个实验组设置3个重复:
[0110]
(1)空白对照组:不投加菌液,也不投加营养补充剂;
[0111]
(2)实验组1:仅投加菌剂1.5g;
[0112]
(3)实验组2:仅投加营养补充剂43.5g;
[0113]
(4)实验组3:投加菌剂1.5g,投加营养补充剂43.5g。
[0114]
为避免对o池造成较大干扰,选择在a池入口处投加菌液。
[0115]
经两级ao处理40h后,取出水样进行总氮含量的测定。测定并记录原污水总氮含量和出水总氮含量。总氮含量的检测方法按《hj 636 水质 总氮的测定碱性过硫酸钾消解紫外分光光度法》执行。实验结果见表5。
[0116]
表5 昆明假单胞菌zsdb122在酶制剂发酵污水中的降氮效果
[0117][0118]
从表5的结果可知,与空白对照组相比,各实验组出水总氮均有显著降低,其中投加昆明假单胞菌zsdb122的实验组1和3,总氮降解率最高,尤其是实验组3,在提供菌剂营养补充剂的保障下,总氮降解率高达84.01%,出水总氮降至37.2mg/l,达到了出水水质要求。
[0119]
实施例7 昆明假单胞菌zsdb122在养殖尾水处理中的应用
[0120]
1、昆明假单胞菌zsdb122菌液的制备
[0121]
将昆明假单胞菌zsdb122进行3吨规模的三级液体有氧发酵,当菌体湿重达到50g/l以上时停止发酵。经管式离心机10000rpm离心收集菌泥,添加水、缓冲液、液体保护剂、营养盐等制得活菌数约为20亿/ml的菌剂。
[0122]
2、养殖尾水基本情况
[0123]
养殖企业位于江苏省南通市,养殖种类为南美白对虾,养殖塘面积为2000
㎡
,塘深0.8m。
[0124]
养殖尾水初始氨氮2.235mg/l,总氮13.55mg/l;排放要求,氨氮≤0.2mg/l,总氮5.0mg/l。
[0125]
3、应用方案
[0126]
按照以下条件进行菌剂产品的应用和条件控制:
[0127]
(1)环境温度:20~30℃;
[0128]
(2)溶解氧≤0.5mg/l;
[0129]
(3)菌剂投加量:3mg/l,在养殖水面均匀喷洒。
[0130]
喷洒菌剂后,每24h测定养殖尾水中的氨氮含量和总氮含量。水样取样按照五点取
样法进行。氨氮含量的检测方法按《hj535水质氨氮的测定纳氏试剂分光光度法》执行;总氮含量的检测方法按《hj636水质总氮的测定碱性过硫酸钾消解紫外分光光度法》执行。
[0131]
应用后的水质监测结果见表6。
[0132]
表6 昆明假单胞菌zsdb122在养殖尾水中的降氮效果
[0133][0134]
由表6的结果可知,昆明假单胞菌zsdb122在养殖尾水中,既具有去除氨氮的能力,也具有去除总氮的能力。在初始氨氮为2.235mg/l,总氮为23.55mg/l的养殖尾水中,经过72h作用,水体氨氮降至0.130mg/l,总氮降至3.81mg/l,水质符合排放标准要求。昆明假单胞菌zsdb122对养殖尾水的氨氮降解效率高达94.2%,总氮降解效率高达83.8%,取得了意料不到的技术效果。
[0135]
申请人已于2020年4月2日将上述昆明假单胞菌zsdb122(pseudomonas kunmingensis zsdb122)保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏编号为cgmcc no.19546。
[0136]
所述昆明假单胞菌zsdb122可广泛应用于环保水处理领域,有利于大幅减少工业、养殖等领域的废水排放,保护生态环境,应用前景广阔。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。