1.本发明属于有机合成技术领域,具体涉及一种芳基或杂芳基甲氧基化反应的方法。
背景技术:
2.甲基芳基醚以及二芳基醚是化学中一种非常重要的结构片段,在聚丙烯聚合物和许多农药中普遍存在,它们是哌嗪霉素(抗真菌药)、万古霉素、k
‑
13(ace抑制剂)等药物活性化合物的普遍通用的中间体,也是罂粟碱、阿尼西坦、吉非替尼、泮托拉唑、萘普生、α
‑
细辛脑等药物分子及天然产物中的重要片段。因此,甲基(杂)芳基醚的合成具有重大意义。传统的甲基芳基醚的合成往往需要使用碘甲烷、重氮甲烷、硫酸二甲酯等有毒试剂,为工业化生产带来了许多不便。因此,有必要开发反应体系条件温和、实验操作简便、底物适用性好、无需使用有毒或强腐蚀性化学试剂的合成方法。
3.目前,已报道的甲氧基化反应大多是由钯催化的,所需成本太高,而且还存在许多其他问题。如2009年,clarke课题组报道了以甲氧基硅为亲核试剂的甲氧基化反应(organic&biomolecular chemistry.2009,7(12)),该反应以醋酸钯为催化剂,120℃下反应可以86%的得到甲氧基化产物。2012年,beller课题组(chemistry.2012,18(9),2498)和peruncheralathan课题组(eur.j.org.chem.2012,6,4914)均报道了(杂)芳基卤化物与甲醇的偶联反应,该反应体系中缺电子和电中性的芳基卤化物均能高效得到甲氧基化产物,而富电子的芳基卤化物则产率很低。2013年,buchwald课题组报道了以高活性环钯物种为催化剂的(杂)芳基卤化物的甲氧基化反应(org.lett.2013,15(15),3998)。该反应可以在温和的条件下高效构建甲基(杂)芳基醚,着重于杂环以及多元环(五元环及六元环)芳基卤化物的甲氧基化反应。2014年,novak小组(adv.synth.catal.2014,356(1),125)报道了以kb(ome)4以及nab(ocd3)4为甲氧基化试剂的芳基氯化物甲氧基化反应,该反应时间较短仅3h,但杂芳基卤化物不适用于该体系。
4.目前,关于廉价过渡金属催化的甲氧基化反应的报道相对较少。2015
‑
2016年,马大为课题组以碘化亚铜为催化剂,陆续设计出一系列新型的可用于铜催化的碳
‑
杂键偶联反应(j.am.chem.soc.2015,137(37),11942;org.lett.2015,17(23),5934;angew.chem.,int.ed.2016,55(21),6211;j.am.chem.soc.2016,138(41),13493),反应可在温和条件下进行,富电子和缺电子的芳基和杂芳基氯化物都能高效地得到偶联产物,催化剂和配体的用量也低,当活性较大的(杂)芳基溴化物和碘化物与酚类化合物偶联时,反应可在相对较低的温度下完成,并且铜和配体的用量也降低为0.5mol%。2019年,该小组还报道了两种配体共同促进的铜催化(杂)芳基卤化物的烷氧基化反应,该反应体系中,芳基氯化物也可以高效得到对应的醚类产物,许多碳水化合物衍生物也适用于该偶联反应,产率29
‑
98%。
5.以上现有技术的方法并不适用于碱敏感基团,而且需要水作为共溶剂。基于以上现状,需要发展一种的新型的甲氧基源,并且该甲氧基源可用于铜催化的芳基卤化物的甲氧基化反应。
技术实现要素:
6.针对上述现有技术的缺点,本发明提供一种芳基或杂芳基甲氧基化反应的方法。
7.为实现上述目的,本发明采取的技术方案为:
8.一种芳基或杂芳基甲氧基化反应的方法,包括如下步骤:将底物、偶联剂、配体、溶剂、催化剂和碱混合均匀,在惰性气体中反应得到所述芳基或杂芳基甲氧基化合物;所述芳基或杂芳基甲氧基化合物的结构式如式(1):
[0009][0010]
式(1)中,所述m为苯环上的h被取代基r取代的个数,m为0~5的自然数;m=2~5时,表示苯环上的多个h被多个取代基r取代,不同取代位置上的取代基r为相同基团或不同基团;r为苯环、取代苯环、芳香杂环、甲硫基、酯基、羰基、c1~c6的烷氧基、c1~c6的烷基、乙烯基、氰基、环烷基、c1~c6的醇羟基、磺酸基或硝基。
[0011]
本发明所述芳基或杂芳基甲氧基化反应的方法的反应路径:
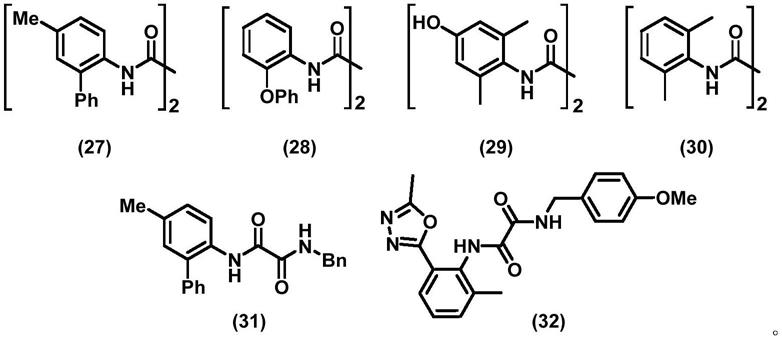
[0012][0013]
本发明以卤化亚铜为催化剂,开发了一种铜催化下的芳基卤化物或杂芳基卤化物的甲氧基化反应,可克服现有技术的方法不适用于碱敏感基团,而且需要水作为共溶剂的缺点,该反应体系条件温和,实验操作简单,底物适用性相对较好,无须使用有毒的或有强腐蚀性的化学试剂,采用本发明制备的芳基或杂芳基甲氧基化合物的产率为36%
‑
89%。
[0014]
本发明所述m为苯环上取代基r的个数,m为0~5的自然数;m=0时,苯环上的h不被取代;m=1时,表示苯环上的一个h被取代基r;m=2
‑
5时,表示苯环上的h被取代基r取代的个数为2
‑
5,不同取代位置上的取代基r为相同基团或不同基团;r独立选自取代苯环、取代苯环、芳香杂环、甲硫基、酯基、c1~c6的烷氧基、c1~c6的烷基、c1~c6的醇羟基、磺酸基或硝基。
[0015]
作为本发明的优选实施方式,所述芳基或杂芳基甲氧基化反应的方法,包括如下步骤:在室温下于干燥的反应管中依次加入底物、配体,再将反应管放入手套箱中,依次加入催化剂、碱和溶剂,然后将反应管取出,置换氮气三次后,加入偶联剂,密封后置于80℃油浴中反应12h,反应结束后,加入水淬灭,再用乙酸乙酯萃取,合并有机相,减压浓缩后经柱层析分离得到所述芳基或杂芳基甲氧基化合物。
[0016]
作为本发明的优选实施方式,所述底物、偶联剂、配体、催化剂和碱的摩尔比为底物:偶联剂:配体:催化剂:碱=0.2:0.3:0.01:0.01:0.02。
[0017]
作为本发明的优选实施方式,所述芳基或杂芳基甲氧基化合物的结构式为式(2)~(25)中的一种:
[0018][0019]
作为本发明的优选实施方式,所述偶联剂为meo
‑9‑
bbn;所述溶剂为n
‑
甲基吡咯烷酮;所述催化剂为卤化亚铜;所述碱为碳酸铯。
[0020]
作为本发明的优选实施方式,所述底物的结构式如式(26):
[0021][0022]
式(1)中,所述x为卤素,优选为
‑
cl、
‑
br中的一种。
[0023]
作为本发明的优选实施方式,反应的温度为80℃,反应时间为12h。
[0024]
作为本发明的优选实施方式,所述配体的结构式为式(27)~(32)中的一种:
[0025][0026]
本发明所述配体在反应体系中主要起到稳定催化剂的作用,本技术发明人通过大量试验证明,配体对甲氧基化反应的产率自高至低依次为:结构式为式(29)的配体,结构式为式(30)的配体,结构式为式(27)
‑
(28)和(31)
‑
(32)的配体。
[0027]
作为本发明的优选实施方式,所述结构式为式(27)
‑
(30)中的一种的配体的制备方法,包括如下步骤:
[0028]
(1)在0
‑
4℃下,将化合物a、四氢呋喃、三乙胺依次加入容器中,然后加入草酰氯,
在室温下搅拌反应2h,得到反应液a;
[0029]
(2)将反应液a去除溶剂,得到残留物,加入水后过滤,洗涤,干燥后得到结构式为式(27)
‑
(30)中的一种的配体;
[0030]
化合物a为2
‑
苯基
‑4‑
甲基苯胺,2
‑
苯氧基苯胺、3,5
‑
二甲基
‑4‑
氨基苯酚、2,6
‑
二甲基苯胺中的一种;化合物a、三乙胺、草酰氯的物质的量浓度比为化合物a:三乙胺:草酰氯=1:1.1:0.5。
[0031]
所述结构式为式(27)
‑
(30)的配体的合成路线:
[0032][0033]
更优选地,所述步骤(2)具体为:将反应液a真空浓缩除去溶剂,得到残留物,将残留物中加入水,过滤后,再依次使用水、乙醚洗涤过滤固体三次以上,然后真空干燥得到结构式为式(27)
‑
(30)中的一种的配体。
[0034]
所述将残留物中加入水是为了溶解体系中的et3n
·
hcl,提高产物的纯度。
[0035]
作为本发明的优选实施方式,所述结构式为式(31)的配体的制备方法,包括如下步骤:
[0036]
s1:将化合物a、四氢呋喃、三乙胺依次加入容器中,然后加入单甲基草酰氯,在室温下搅拌反应2h,得到反应液b;
[0037]
s2:将反应液b去除溶剂,得到残留物,加入水后,萃取取上层有机相,用无水硫酸钠干燥、过滤旋干后得到固体c;
[0038]
s3:将固体c溶于四氢呋喃中,加入bnnh2后在70℃下搅拌反应1h,冷却后去除溶剂得到残留物,将残留物加入水后过滤,洗涤,干燥得到结构式为式(31)的配体;
[0039]
所述s1中,化合物a的结构式为化合物a、三乙胺、单甲基草酰氯的物质的量浓度比为化合物a:三乙胺:单甲基草酰氯=0.5:1.2:1;所述s3中,固体c和bnnh2的物质的量比为固体:bnnh2=10:1.2。
[0040]
所述结构式为式(31)的配体的合成路线:
[0041][0042]
更优选地,所述步骤s2具体为:将反应液b真空浓缩除去溶剂,得到残留物,将残留物中加入水,然后用乙酸乙酯萃取三次以上,取上层有机相,导入容器中,加入无水硫酸钠干燥后,过滤旋干,经过柱层析得到固体c。
[0043]
所述步骤s3具体为:将搅拌反应后的反应液真空浓缩去除溶剂,得到残留物,将残留物中加入水,过滤后,再依次使用水、乙醚洗涤过滤固体三次以上,然后真空干燥得到结构式为式(31)的配体。
[0044]
所述将残留物中加入水是为了溶解体系中的et3n
·
hcl,提高产物的纯度。
[0045]
作为本发明的优选实施方式,所述结构式为式(32)的配体的制备方法,包括如下步骤:
[0046]
a:在0
‑
4℃下,依次将2
‑
氨基
‑3‑
甲基苯甲酸、四氢呋喃和n,n'
‑
羰基二咪唑混合,在室温下搅拌过夜,过滤、洗涤、干燥得到产物a;所述2
‑
氨基
‑3‑
甲基苯甲酸和n,n'
‑
羰基二咪唑的物质的量比为:1:1.2;
[0047]
b:将产物a溶于乙醇,加入n2h4后在室温下搅拌反应4h,去除溶剂,洗涤,干燥后得到产物b;所述产物a和n2h4的物质的量比为1:5;
[0048]
c:将产物b溶于乙醇,依次加入nh4cl和原乙酸三乙酯在85℃中回流6h,去除溶剂,加水淬灭,萃取后取上层有机相,用无水硫酸钠干燥、过滤旋干后得到产物c;所述产物b、nh4cl和原乙酸三乙酯的物质的量比为产物b:nh4cl:原乙酸三乙酯=1:0.5:1.2;
[0049]
d:在0
‑
4℃下,将产物c溶于四氢呋喃,依次加入三乙胺和单甲基草酰氯,在室温下搅拌反应2h,去除溶剂,加水淬灭,萃取取上层有机相,用无水硫酸钠干燥、过滤旋干后得到产物d;所述产物c、三乙胺和单甲基草酰氯的物质的量比为产物c:三乙胺:草酰氯单甲酯=1:1.2:1.1;
[0050]
e:将产物d溶于四氢呋喃,加入4
‑
甲氧基苄胺在65℃中回流30min,去除溶剂,加水淬灭,萃取取上层有机相,用无水硫酸钠干燥、过滤旋干后得到结构式为式(32)的配体;所述产物d与4
‑
甲氧基苄胺的物质的量比1:1.5。
[0051]
所述结构式为式(32)的配体的合成路线:
[0052]
a:
[0053]
b:
[0054]
c:
[0055]
d:
[0056]
e:
[0057]
本发明相对于现有技术,具有如下有益效果:本发明采用价格低廉的卤化亚铜为催化剂,实现了在卤化亚铜催化下,配体调控芳基卤化物或杂芳基卤化物的甲氧基化反应,与现有技术的甲氧基化反应的方法比较,本发明所述方法的反应体系条件温和,催化剂和配体的使用量分别低至底物物质的量的5%,提高了催化效率;且所述方法对不同底物拓展发现对不同官能团的芳基卤化物或杂芳基卤化物有较好的兼容性。采用本发明所述方法制备的芳基或杂芳基甲氧基化合物的产率为36%
‑
89%。
具体实施方式
[0058]
为更好地说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明作进一步说明。
[0059]
实施例1
[0060]
本发明结构式为式(27)的配体的制备方法,具体如下:
[0061]
(1)取50ml圆底烧瓶,将20ml thf、5mmol 2
‑
苯基
‑4‑
甲基苯胺、5.5mmol三乙胺依次加入圆底烧瓶中,在0
‑
4℃下,缓慢加入2.5mmol草酰氯,反应液在室温下搅拌2h得到反应液a;
[0062]
(2)将反应液a真空浓缩除去溶剂得到残留物,将残留物中加水,以溶解et3n
·
hcl;过滤浆液,依次用水和乙醚洗涤滤纸上的固体三次,真空干燥就可以得到1.6g结构式为式(27)的配体l1白色固体;所述配体l1的产率为78%,所述配体l1的结构式如下:
[0063][0064]
目标产物配体l1的氢谱、碳谱数据如下:1h nmr(400mhz,cdcl3)δ9.48(s,2h),8.26(d,j=8.0hz,2h),7.54
‑
7.50(m,4h),7.46
‑
7.42(m,2h),7.39(d,j=7.2hz,4h),7.18(d,j=8.4hz,2h),7.12(s,2h),2.36(s,6h).
13
c nmr(100mhz,cdcl3)δ157.3,137.4,135.0,132.8,130.9,130.8,129.2,129.1,128.9.128.3,120.3,20.9.
[0065]
实施例2
[0066]
本发明结构式为式(28)的配体的制备方法,具体如下:
[0067]
(1)取50ml圆底烧瓶,将20ml thf、5mmol 2
‑
苯氧基苯胺、5.5mmol三乙胺依次加入圆底烧瓶中,在0
‑
4℃下,缓慢加入2.5mmol草酰氯,反应液在室温下搅拌2h得到反应液a;
[0068]
(2)将反应液a真空浓缩除去溶剂得到残留物,将残留物中加水,以溶解et3n
·
hcl;过滤浆液,依次用水和乙醚洗涤滤纸上的固体三次,真空干燥就可以得到1.7g,结构式为式(28)的配体l2白色固体;所述配体l2的产率为81%,所述配体l2的结构式如下:
[0069][0070]
目标产物配体l2的氢谱、碳谱数据如下:1h nmr(400mhz,cdcl3)δ9.97(s,1h),8.48(d,j=7.6hz,2h),7.40
‑
7.36(m,4h),7.54
‑
7.50(m,4h),7.19
‑
7.13(m,4h),7.11
‑
7.07(m,6h),6.91(d,j=7.6hz,2h).
13
c nmr(100mhz,cdcl3)δ157.4,156.1,146.7,130.0,128.0,125.4,124.2,123.8,120.5,119.0,117.6.
[0071]
实施例3
[0072]
本发明结构式为式(29)的配体的制备方法,具体如下:
[0073]
(1)取50ml圆底烧瓶,将20ml thf、5mmol 3,5
‑
二甲基
‑4‑
氨基苯酚、5.5mmol三乙胺依次加入圆底烧瓶中,在0
‑
4℃下,缓慢加入2.5mmol草酰氯,反应液在室温下搅拌2h得到反应液a;
[0074]
(2)将反应液a真空浓缩除去溶剂得到残留物,将残留物中加水,以溶解et3n
·
hcl;过滤浆液,依次用水和乙醚洗涤滤纸上的固体三次,真空干燥就可以得到1.38g,结构式为式(29)的配体l3白色固体;所述配体l3的产率为85%,所述配体l3的结构式如下:
[0075][0076]
目标产物配体l3的氢谱、碳谱数据如下:1h nmr(400mhz,dmso)δ9.96(s,2h),6.50(s,4h),2.06(s,12h).
13
c nmr(100mhz,dmso)δ159.3,155.9,136.1,125.5,114.3,18.1.
[0077]
实施例4
[0078]
本发明结构式为式(30)的配体的制备方法,具体如下:
[0079]
(1)取50ml圆底烧瓶,将20ml thf、5mmol 2,6
‑
二甲基苯胺、5.5mmol三乙胺依次加入圆底烧瓶中,在0
‑
4℃下,缓慢加入2.5mmol草酰氯,反应液在室温下搅拌2h得到反应液a;
[0080]
(2)将反应液a真空浓缩除去溶剂得到残留物,将残留物中加水,以溶解et3n
·
hcl;过滤浆液,依次用水和乙醚洗涤滤纸上的固体三次,真空干燥就可以得到1.15g,结构式为式(30)的配体l4白色固体;所述配体l4的产率为78%,所述配体l4的结构式如下:
[0081][0082]
目标产物配体l4的氢谱、碳谱数据如下:1h nmr(400mhz,dmso)δ10.31(s,2h),7.13(s,6h),2.18(s,12h).
13
c nmr(100mhz,dmso)δ159.3,135.5,134.5,128.2,127.4,18.4.
[0083]
实施例5
[0084]
本发明结构式为式(31)的配体的制备方法,具体如下:
[0085]
s1:将0.5mmol 4
‑
甲基
‑2‑
苯基苯胺、20ml四氢呋喃、0.6mmol三乙胺依次加入容器中,在0
‑
4℃下,然后加入0.5mmol甲基草酰氯,在室温下搅拌反应2h,得到反应液b;
[0086]
s2:将反应液b真空浓缩除去溶剂得到残留物,将残留物中加水,以溶解et3n
·
hcl;然后用乙酸乙酯萃取三次,取上层有机相,倒入锥形瓶中,用无水硫酸钠干燥、过滤旋干,柱层析经过后得到固体c;
[0087]
s3:将步骤s2所得固体c溶于1.0m四氢呋喃中,再加入bnnh2,固体c与bnnh2的物质的量比为固体c:bnnh2=1:1.2,然后在70℃下搅拌反应1h,冷却后真空浓缩除去溶剂得到残留物,将残留物中加水,以溶解et3n
·
hcl;过滤浆液,依次用水和乙醚洗涤滤纸上的固体三次,真空干燥就可以得到1.26g,结构式为式(31)的配体l5白色固体;所述配体l5的产率为73%,所述配体l5的结构式如下:
[0088][0089]
目标产物配体l5的氢谱、碳谱数据如下:1h nmr(400mhz,dmso)δ9.83(s,1h),9.53(s,1h),7.90(d,j=8.0hz,1h),7.49
‑
7.45(m,2h),7.42
‑
7.40(m,3h),7.32
‑
7.29(m,2h),7.25(d,j=7.2hz,4h),7.16(s,1h),4.32(d,j=6.4hz,2h),2.34(s,3h).
13
c nmr(100mhz,dmso)δ159.8,157.9,138.5,137.9,135.1,134.5,131.1,130.8,128.8(4c),128.6,128.3(2c),127.7,127.4(2c),127.0,122.7,42.6,20.5.
[0090]
实施例6
[0091]
所述结构式为式(32)的配体的制备方法,包括如下步骤:
[0092]
a:在0
‑
4℃下,依次将1mmol 2
‑
氨基
‑3‑
甲基苯甲酸、100ml四氢呋喃和1.2mmol n,n'
‑
羰基二咪唑混合,在室温下搅拌过夜,过滤反应液,然后用乙醚洗涤滤纸上的固体,真空干燥得到产物a;
[0093]
b:将1mmol产物a溶于30ml乙醇,加入5mmol n2h4后在室温下搅拌反应4h,冷却后真空浓缩除去溶剂,依次用水和乙醚洗涤固体三次,真空干燥得到产物b;
[0094]
c:将1mmol产物b溶于30ml乙醇,依次加入0.5mmol nh4cl和1.2mmol原乙酸三乙酯在85℃中回流6h,真空浓缩以除去溶剂,然后加水淬灭后,用乙酸乙酯萃取三次,取上层有机相,倒入锥形瓶中,用无水硫酸钠干燥,过滤旋干,经柱层析得产物c;
[0095]
d:在0
‑
4℃下,将1mmol产物c溶于20ml四氢呋喃,依次加入1.2mmol三乙胺和1.1mmol单甲基草酰氯,在室温下搅拌反应2h,真空浓缩以除去溶剂,然后加水淬灭后,用乙酸乙酯萃取三次,取上层有机相,倒入锥形瓶中,用无水硫酸钠干燥,过滤旋干,经柱层析得产物d;
[0096]
e:将1mmol产物d溶于20ml四氢呋喃,加入1.5mmol 4
‑
甲氧基苄胺在65℃中回流30min,冷却至室温后,真空浓缩以除去溶剂,然后加水淬灭后,用乙酸乙酯萃取三次,取上层有机相,倒入锥形瓶中,用无水硫酸钠干燥,过滤旋干,经柱层析得到239mg,结构式为式(32)的配体l6白色固体;所述配体l6的产率为63%,所述配体l6的结构式如下:
[0097][0098]
目标产物配体l6的氢谱、碳谱数据如下:1h nmr(400mhz,dmso)δ11.86(s,1h),9.59(t,j=6.0hz,1h),7.93(d,j=8.0hz,1h),7.73(d,j=7.2hz,1h),7.43(t,j=7.6hz,1h),7.26(d,j=8.4hz,2h),6.91(d,j=8.4hz,2h),4.32(m,1h),3.73(s,3h),2.53(s,3h),2.40(s,3h).
13
c nmr(100mhz,dmso)δ159.2,158.3,158.1,154.3,144.8,135.5,135.3,130.3,129.0,126.5,124.1,120.4,113.8,55.1,41.9,21.3,17.1.
[0099]
实施例7
[0100]
本发明一种芳基或杂芳基甲氧基化反应的方法,具体包括:
[0101]
将0.2mmol底物、0.3mmol偶联剂、0.01mmol配体、1ml溶剂、0.01mmol催化剂和0.4mmol碱混合均匀在氩气氛围中,80℃下反应12h,得到28mg 4
‑
甲氧基苯甲酸甲酯白色固体;4
‑
甲氧基苯甲酸甲酯的产率为83%;
[0102]
所述底物的结构式为所述偶联剂为meo
‑9‑
bbn;所述溶剂为n
‑
甲基吡咯烷酮;所述催化剂为卤化亚铜;所述碱为碳酸铯;所述配体为l3;
[0103]
所述4
‑
甲氧基苯甲酸甲酯的结构式如下:
[0104][0105]
目标产物4
‑
甲氧基苯甲酸甲酯的氢谱、碳谱数据如下:1h nmr(400mhz,cdcl3)δ7.99(d,j=8.8hz,2h),6.91(d,j=8.8hz,2h),3.87,(s,3h),3.84(s,3h).
13
c nmr(100mhz,cdcl3)δ166.8,163.3,131.5,122.5,113.5,55.3,51.8.
[0106]
实施例8
[0107]
本发明一种芳基或杂芳基甲氧基化反应的方法,具体包括:
[0108]
将0.2mmol底物、0.3mmol偶联剂、0.01mmol配体、1ml溶剂、0.01mmol催化剂和0.4mmol碱混合均匀在氩气氛围中,80℃下反应12h,得到29mg(4
‑
甲氧基苯基)环丙基甲酮白色固体;(4
‑
甲氧基苯基)环丙基甲酮的产率为82%;
[0109]
所述底物的结构式为所述偶联剂为meo
‑9‑
bbn;所述溶剂为n
‑
甲基吡咯烷酮;所述催化剂为卤化亚铜;所述碱为碳酸铯;所述配体为l3;
[0110]
所述(4
‑
甲氧基苯基)环丙基甲酮的结构式如下:
[0111][0112]
目标产物(4
‑
甲氧基苯基)环丙基甲酮的氢谱、碳谱数据如下:1h nmr(400mhz,cdcl3)δ8.13
‑
7.92(m,2h),7.02
‑
6.90(m,2h),3.86(s,3h),2.66
‑
2.60(m,1h),1.24
‑
1.16(m,2h),0.99(dt,j=7.2,3.5hz,2h).
13
c nmr(100mhz,cdcl3)δ199.2,163.4,131.1,130.3,113.7,55.6,16.7,11.4.
[0113]
实施例9
[0114]
本发明一种芳基或杂芳基甲氧基化反应的方法,具体包括:
[0115]
将0.2mmol底物、0.3mmol偶联剂、0.01mmol配体、1ml溶剂、0.01mmol催化剂和0.4mmol碱混合均匀在氩气氛围中,80℃下反应12h,得到30mg 4
‑
甲氧基苯基乙酸乙酯黄色液体;4
‑
甲氧基苯基乙酸乙酯的产率为77%;
[0116]
所述底物的结构式为所述偶联剂为meo
‑9‑
bbn;所述溶剂为n
‑
甲基吡咯烷酮;所述催化剂为卤化亚铜;所述碱为碳酸铯;所述配体为l3;
[0117]
所述4
‑
甲氧基苯基乙酸乙酯的结构式如下:
[0118][0119]
目标产物4
‑
甲氧基苯基乙酸乙酯的氢谱、碳谱数据如下:1h nmr(400mhz,cdcl3)δ7.20(d,j=8.4hz,2h),6.85(d,j=8.8hz,2h),7.36(q,j=7.2hz,2h),3.78(s,3h),3.53(s,2h),1.23(d,j=7.2hz,3h).
13
c nmr(100mhz,cdcl3)δ171.9,158.6,130.2,126.2,113.9,60.7,55.2,40.5,14.2.
[0120]
实施例10
[0121]
本发明一种芳基或杂芳基甲氧基化反应的方法,具体包括:
[0122]
将0.2mmol底物、0.3mmol偶联剂、0.01mmol配体、1ml溶剂、0.01mmol催化剂和0.4mmol碱混合均匀在氩气氛围中,80℃下反应12h,得到26mg 4
‑
甲氧基硫代苯甲醚无色油状物;4
‑
甲氧基硫代苯甲醚的产率为84%;
[0123]
所述底物的结构式为所述偶联剂为meo
‑9‑
bbn;所述溶剂为n
‑
甲基吡咯烷酮;所述催化剂为卤化亚铜;所述碱为碳酸铯;所述配体为l3;
[0124]
所述4
‑
甲氧基硫代苯甲醚的结构式如下:
[0125][0126]
目标产物4
‑
甲氧基硫代苯甲醚的氢谱、碳谱数据如下:1h nmr(400mhz,cdcl3)δ7.28(d,j=8.8hz,2h),6.86(d,j=8.8hz,2h),3.79(s,3h),2.44(s,3h).
13
c nmr(100mhz,cdcl3)δ158.2,130.2,128.8,114.7,55.4,18.2.
[0127]
实施例11
[0128]
本发明一种芳基或杂芳基甲氧基化反应的方法,具体包括:
[0129]
将0.2mmol底物、0.3mmol偶联剂、0.01mmol配体、1ml溶剂、0.01mmol催化剂和0.4mmol碱混合均匀在氩气氛围中,80℃下反应12h,得到34mg 1
‑
甲氧基
‑4‑
环己基苯白色固体;1
‑
甲氧基
‑4‑
环己基苯的产率为89%;
[0130]
所述底物的结构式为所述偶联剂为meo
‑9‑
bbn;所述溶剂为n
‑
甲基吡咯烷酮;所述催化剂为卤化亚铜;所述碱为碳酸铯;所述配体为l3;
[0131]
所述1
‑
甲氧基
‑4‑
环己基苯的结构式如下:
[0132][0133]
目标产物1
‑
甲氧基
‑4‑
环己基苯的氢谱、碳谱数据如下:1h nmr(400mhz,cdcl3)δ7.14(d,j=8.4hz,2h),6.85(d,j=8.4hz,2h),3.79(s,3h),2.45(br,1h),1.84(s,4h),1.75
‑
1.72(m,1h),1.43
‑
1.33(m,1h),1.25(br,1h).
13
c nmr(100mhz,cdcl3)δ157.6,140.3,127.6,113.6,55.2,43.7,34.7,26.9,26.1.
[0134]
实施例12
[0135]
本发明一种芳基或杂芳基甲氧基化反应的方法,具体包括:
[0136]
将0.2mmol底物、0.3mmol偶联剂、0.01mmol配体、1ml溶剂、0.01mmol催化剂和0.4mmol碱混合均匀在氩气氛围中,80℃下反应12h,得到28mg 5
‑
甲氧基苯并噻吩白色固体;5
‑
甲氧基苯并噻吩的产率为85%;
[0137]
所述底物的结构式为所述偶联剂为meo
‑9‑
bbn;所述溶剂为n
‑
甲基吡咯烷酮;所述催化剂为卤化亚铜;所述碱为碳酸铯;所述配体为l3;
[0138]
所述5
‑
甲氧基苯并噻吩的结构式如下:
[0139][0140]
目标产物5
‑
甲氧基苯并噻吩的氢谱、碳谱数据如下:1h nmr(400mhz,cdcl3)δ7.75(d,j=8.8hz,1h),7.45(d,j=5.6hz,1h),7.29(d,j=2.4hz,1h),7.27(d,j=5.6hz,1h),7.02(dd,j=8.8,2.4hz,1h),3.88(s,3h).
13
c nmr(100mhz,cdcl3)δ157.4,140.6,132.1,127.5,123.6,123.0,114.6,105.5,55.5.
[0141]
实施例13
[0142]
本发明一种芳基或杂芳基甲氧基化反应的方法,具体包括:
[0143]
将0.2mmol底物、0.3mmol偶联剂、0.01mmol配体、1ml溶剂、0.01mmol催化剂和0.4mmol碱混合均匀在氩气氛围中,80℃下反应12h,得到15mg 7
‑
甲氧基
‑1‑
四氢萘酮白色固体;7
‑
甲氧基
‑1‑
四氢萘酮的产率为42%;
[0144]
所述底物的结构式为所述偶联剂为meo
‑9‑
bbn;所述溶剂为n
‑
甲基吡咯烷酮;所述催化剂为卤化亚铜;所述碱为碳酸铯;所述配体为l3;
[0145]
所述7
‑
甲氧基
‑1‑
四氢萘酮的结构式如下:
[0146][0147]
目标产物7
‑
甲氧基
‑1‑
四氢萘酮的氢谱、碳谱数据如下:1h nmr(400mhz,cdcl3)δ7.49(s,1h),7.14(d,j=8.4hz,1h),7.04
‑
7.02(m,1h),3.81(s,3h),2.88(t,j=5.9hz,2h),2.61(t,j=6.4hz,2h),2.12
‑
2.06(m,2h).
13
c nmr(100mhz,cdcl3)δ198.4,158.3,137.2,133.4,130.1,121.8,109.1,55.5,39.1,28.9,23.6.
[0148]
实施例14
[0149]
本发明一种芳基或杂芳基甲氧基化反应的方法,具体包括:
[0150]
将0.2mmol底物、0.3mmol偶联剂、0.01mmol配体、1ml溶剂、0.01mmol催化剂和0.4mmol碱混合均匀在氩气氛围中,80℃下反应12h,得到14mg 1
‑
甲氧基
‑
9h
‑
芴白色固体;1
‑
甲氧基
‑
9h
‑
芴的产率为36%;
[0151]
所述底物的结构式为所述偶联剂为meo
‑9‑
bbn;所述溶剂为n
‑
甲基吡咯烷酮;所述催化剂为卤化亚铜;所述碱为碳酸铯;所述配体为l3;
[0152]
所述1
‑
甲氧基
‑
9h
‑
芴的结构式如下:
[0153][0154]
目标产物1
‑
甲氧基
‑
9h
‑
芴的氢谱、碳谱数据如下:1h nmr(400mhz,cdcl3)δ7.69(dd,j=7.9,4.8hz,2h),7.51(d,j=7.4hz,1h),7.37
‑
7.34(m,1h),7.26
‑
7.22(m,1h),7.11
‑
7.10(m,1h),6.94(dd,j=8.4,2.3hz,1h),3.88(s,5h).
13
cnmr(100mhz,cdcl3)δ159.4,145.2,142.8,141.8,134.9,126.9,125.7,125.0,120.6,119.2,113.1,110.7,55.7,37.1.
[0155]
实施例15
[0156]
本发明一种芳基或杂芳基甲氧基化反应的方法,具体包括:
[0157]
将0.2mmol底物、0.3mmol偶联剂、0.01mmol配体、1ml溶剂、0.01mmol催化剂和0.4mmol碱混合均匀在氩气氛围中,80℃下反应12h,得到29mg 4
‑
戊基苯甲醚无色油状物;4
‑
戊基苯甲醚的产率为81%;
[0158]
所述底物的结构式为所述偶联剂为meo
‑9‑
bbn;所述溶剂为n
‑
甲基
吡咯烷酮;所述催化剂为卤化亚铜;所述碱为碳酸铯;所述配体为l4;
[0159]
所述4
‑
甲氧基苯甲酸甲酯的结构式如下:
[0160][0161]
目标产物4
‑
甲氧基苯甲酸甲酯的氢谱、碳谱数据如下:1h nmr(400mhz,cdcl3)δ7.12(d,j=8.4hz,2h),6.85(d,j=8.4hz,2h),3.80(s,3h),2.56(t,j=8.0hz,2h),1.61
‑
1.58(m,2h),1.38
‑
1.30(m,4h),0.91(t,j=6.8hz,3h).
13
cnmr(100mhz,cdcl3)δ157.6,135.0,129.2,113.6,55.2,35.0,31.5,22.6,14.0.
[0162]
实施例16
[0163]
本发明一种芳基或杂芳基甲氧基化反应的方法,具体包括:
[0164]
将0.2mmol底物、0.3mmol偶联剂、0.01mmol配体、1ml溶剂、0.01mmol催化剂和0.4mmol碱混合均匀在氩气氛围中,80℃下反应12h,得到11mg 4
‑
甲氧基苯甲酸甲酯白色固体;4
‑
甲氧基苯甲酸甲酯的产率为34%;
[0165]
所述底物的结构式为所述偶联剂为meo
‑9‑
bbn;所述溶剂为n
‑
甲基吡咯烷酮;所述催化剂为卤化亚铜;所述碱为碳酸铯;所述配体为l3;
[0166]
所述4
‑
甲氧基苯甲酸甲酯的结构式如下:
[0167][0168]
目标产物4
‑
甲氧基苯甲酸甲酯的氢谱、碳谱数据如下:1h nmr(400mhz,cdcl3)δ7.99(d,j=8.8hz,2h),6.91(d,j=8.8hz,2h),3.87,(s,3h),3.84(s,3h).
13
c nmr(100mhz,cdcl3)δ166.8,163.3,131.5,122.5,113.5,55.3,51.8.
[0169]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。