1.本发明涉及基因检测领域,尤其涉及一种用于检测人类微卫星不稳定状态的引物组、检测试剂盒及其检测方法。
背景技术:
2.微卫星(microsatellite,ms)是指细胞基因组中以少数几个核苷酸(多为1-6个)为单位的短串联重复序列,又称短串联重复(short tandem repeat,str)或简单重复串联序列(simple sequence repeat,ssr)。dna错配修复(mismatch repair,mmr)功能异常时,微卫星出现的复制错误得不到纠正并不断累积,使得微卫星序列长度发生改变,称为微卫星不稳定(microsatellite instability,msi)。大量研究表明,微卫星不稳定与肿瘤发生相关,尤其是结直肠癌、子宫内膜癌和胃癌等,已发现在中国人群中msi-h在子宫内膜癌、胃癌和结直肠癌的发病率分别为33%、22%和13%。nccn(national comprehensive cancer network,美国国家综合癌症网络)和csco等多个指南陆续推荐所有结直肠癌和胃癌患者进行msi状态检测、晚期实体瘤患者(如胃癌、小肠癌、子宫内膜癌、尿路上皮癌、胰腺癌和胆管癌等)如考虑免疫治疗应进行msi状态监测以及所有新诊断的胃癌患者需进行msi检测等。研究表明,对于具有dmmr/msi-h表型的ⅱ期crc患者,给予5-fu单药辅助化疗非但不能使生存获益,反而对长期生存产生不利影响。国内外权威指南均明确提出,具有dmmr/msi表型的ⅱ期crc患者预后较好,不建议使用氟尿嘧啶类单药辅助治疗。临床上已将msi作为结直肠癌预后和制定辅助治疗方案的重要分子标志物,并应用于协助lynch综合征筛查。此外,早在2017年,美国fda批准pd-1抑制剂帕博利珠单抗(pembrolizumab)治疗带有微卫星高度不稳定(msi-h)/错配修复缺陷(dmmr)的实体瘤患者,瘤种覆盖结直肠、小细胞肺癌、宫颈癌等15个不同部位的恶性肿瘤。在2021年结肠癌、直肠癌nccn指南中新增了纳武利尤单抗(nivolumab)
±
伊匹木单抗(ipilimumab)或帕博利珠单抗用于msi-h/dmmr患者辅助治疗。可见,msi检测对于辅助诊断林奇综合征、判断预后、预测辅助化疗疗效以及预测免疫治疗疗效等都具有重要的意义。
3.目前检测msi的金标准是pcr 毛细管电泳法,检测位点包括1997年nci提出的2b3d panel(bat-25、bat-26、d17s250、d2s123、d5s346)、2002年nci对msi检测进行修订和补充后提出的pentaplex panel(bat-25、bat-26、nr-21、nr-22、nr-24)以及2006年promega推出的5个单核苷酸位点(bat-25、bat-26、mono-27、nr-21、nr-24)。不同位点组合对msi-h的检出率也具有一定的差异。据报道,在中国人群中2b3d nci panel的msi-h检出率为13.5%、promega panel为12.9%,而6个单核苷酸位点只有7.7%。2b3d nci panel被提出以来,至今一直被广泛使用,nccn指南和中国临床肿瘤学会(csco)指南中一致推荐选择2b3d nci panel。另外,研究表明,单核苷酸位点较双核苷酸位点而言具有更高的灵敏度和特异性,因此,本发明在2b3d的基础上增加了在单核苷酸位点中灵敏度和特异性性都较高的mono-27位点。
4.现阶段,检测微卫星不稳定状态的方法有免疫组化(immunohistochemistry,ihc)、多重荧光pcr 毛细管电泳法以及二代测序法(next generation sequencing,ngs)。目前已有方法主要存在以下问题:(1)免疫组化法受样本异质性影响,准确性低,可能会出现误判的情况;(2)二代测序法虽然通量大,涉及基因范围广,灵敏度和特异性高,但是评判标准及msi算法均未统一,检测技术流程复杂,对实验室环境条件、人员能力及质量管理要求高,任何一个环节出现问题,均会影响检测结果的准确性,并且检测时间长、成本高;(3)被认为是目前检测msi“金标准”的多重荧光pcr 毛细管电泳法虽然检测的位点组合是经过临床验证且被认可,检测结果的准确性高且被专家所认可,但是毛细管电泳的成本较高,研发成本和顾客的使用成本都较高。此外,进行多重pcr时会出现各位点的荧光峰容易交叉重叠、位点间会互相抑制以及非特异性扩增难以排除等问题,到目前为止检测msi的试剂盒难以做到商品化并被普及,因此,急需开发一种特异性强、荧光峰独立、灵敏度高、操作简单、快速的msi检测试剂盒。
技术实现要素:
5.基于上述问题,本发明提供了一种用于检测人类微卫星不稳定状态的引物组、检测试剂盒及其检测方法;实现肿瘤组织样本和正常对照样本的配对石蜡切片中bat-25、bat-26、d17s250、d2s123、d5s346和mono-27这6个位点的微卫星不稳定状态的检测方法、荧光引物、包括该引物混合液的检测体系和试剂盒,具有操作流程简单、检测时间短、分辨率高以及检测结果准确等优点。
6.本发明通过三方面的技术来实现。
7.第一方面的技术方案如下:
8.本发明提供一种用于检测人类微卫星不稳定状态的引物组,包括针对微卫星位点bat-25、bat-26、d17s250、d2s123、d5s346和mono-27,及内控位点penta c设计的上下游引物,具体如下:
9.所述检测bat-25位点的微卫星不稳定状态的上游引物核苷酸序列如seq id no:1所示;
10.所述检测bat-25位点的微卫星不稳定状态的下游引物核苷酸序列如seq id no:2所示;
11.所述检测bat-26位点的微卫星不稳定状态的上游引物核苷酸序列如seq id no:3所示;
12.所述检测bat-26位点的微卫星不稳定状态的下游引物核苷酸序列如seq id no:4所示;
13.所述检测d17s250位点的微卫星不稳定状态的上游引物核苷酸序列如seq id no:5所示;
14.所述检测d17s250位点的微卫星不稳定状态的下游引物核苷酸序列如seq id no:6所示;
15.所述检测d2s123位点的微卫星不稳定状态的上游引物核苷酸序列如seq id no:7所示;
16.所述检测d2s123位点的微卫星不稳定状态的下游引物核苷酸序列如seq id no:8
所示;
17.所述检测d5s346位点的微卫星不稳定状态的上游引物核苷酸序列如seq id no:9所示;
18.所述检测d5s346位点的微卫星不稳定状态的下游引物核苷酸序列如seq id no:10所示;
19.所述检测mono-27位点的微卫星不稳定状态的上游引物核苷酸序列如seq id no:11所示;
20.所述检测mono-27位点的微卫星不稳定状态的下游引物核苷酸序列如seq id no:12所示;
21.所述内控位点penta c的上游引物核苷酸序列如seq id no:13所示;
22.所述内控位点penta c的下游引物核苷酸序列如seq id no:14所示。
23.一实施例,所述引物组中,如seq id no:1和seq id no:13所示核苷酸的5’端标记有fam;如seq id no:3和seq id no:5所示核苷酸的5’端标记有ned;如seq id no:7和seq id no:9所示核苷酸的5’端标记有pet;如seq id no:11所示核苷酸的5’端标记有vic。
24.一实施例,所述引物组中,所述bat-25、bat-26、d17s250、d2s123、d5s346和mono-27位点以及内控位点penta c的引物序列分别对应核苷酸序列如下:
25.bat-25位点的上游引物seq id no:1对应核酸序列:5’-fam-caagaatgtaagtgggagtgat-3’;
26.bat-25位点的下游引物seq id no:2对应核酸序列:5’-aactatggctctaaaatgctctg-3’;
27.bat-26位点的上游引物seq id no:3对应核酸序列:5’-ned-ttggatattgcagcagtcagag-3’;
28.bat-26位点的下游引物seq id no:4对应核酸序列:5’-accaatcaacatttttaacc-3’;
29.d17s250位点的上游引物seq id no:5对应核酸序列:5’-ned-gcataaaaaggaagaatcaaatagac-3’;
30.d17s250位点的下游引物seq id no:6对应核酸序列:5’-agccactcagctggccata-3’;
31.d2s123位点的上游引物seq id no:7对应名核酸序列:5’-pet-aaacaggatgcctgccttta-3’;
32.d2s123位点的下游引物seq id no:8对应核酸序列:5’-gactttccacctatgggactgtg-3’;
33.d5s346位点的上游引物seq id no:9对应核酸序列:5’-pet-gttagttagttagttactcactc-3’;
34.d5s346位点的下游引物seq id no:10对应核酸序列:5’-acagtattactagtttttcaggg-3’;
35.mono-27位点的上游引物seq id no:11对应核酸序列:5’-vic-ctacactccagcctgggtg-3’;
36.mono-27位点的下游引物seq id no:12对应核酸序列:5’-
tccctaaacaattctactgaaat-3’;
37.penta c位点的上游引物:seq id no:13对应核酸序列:5’-fam-catgaacacactttgcacctg-3’;
38.penta c位点的下游引物seq id no:14对应核酸序列:5’-tacaagagagcattccaacac-3’。
39.一实施例,所述引物组中,应用于多重荧光pcr反应时,各所述引物组的浓度如下:
40.所述bat-25位点上游引物在反应体系中的终浓度为0.05μmol/l;
41.所述bat-25位点下游引物在反应体系中的终浓度为0.05μmol/l;
42.所述bat-26位点上游引物在反应体系中的终浓度为0.06μmol/l;
43.所述bat-26位点下游引物在反应体系中的终浓度为0.06μmol/l;
44.所述d17s250位点上游引物在反应体系中的终浓度为0.10μmol/l;
45.所述d17s250位点下游引物在反应体系中的终浓度为0.10μmol/l;
46.所述d2s123位点上游引物在反应体系中的终浓度为0.04μmol/l;
47.所述d2s123位点下游引物在反应体系中的终浓度为0.04μmol/l;
48.所述d5s346位点上游引物在反应体系中的终浓度为0.05μmol/l;
49.所述d5s346位点下游引物在反应体系中的终浓度为0.05μmol/l;
50.所述mono-27位点上游引物在反应体系中的终浓度为0.07μmol/l;
51.所述mono-27位点下游引物在反应体系中的终浓度为0.07μmol/l;
52.所述penta c位点上游引物在反应体系中的终浓度为0.03μmol/l;
53.所述penta c位点下游引物在反应体系中的终浓度为0.03μmol/l。
54.第二方面的技术方案如下:
55.本发明还提供一种人类微卫星不稳定状态的检测试剂盒,所述检测试剂盒包括上述所述的引物组。
56.一实施例中,所述检测试剂盒,还包括pcr反应液和热启动酶反应液。
57.一实施例中,所述检测试剂盒,所述pcr反应液包括:(nh4)2so4、tris-hcl、mgcl2、triton、tween-20、bsa和甜菜碱。
58.一实施例中,所述检测试剂盒,所热启动酶反应液包括:dntps、热启动taq酶、udg酶和热启动taq酶稀释液。
59.一实施例中,所述检测试剂盒,所热启动酶反应液还包括用于防污染的尿嘧啶dna糖基化酶。
60.第三方面的技术方案如下:
61.本发明提供的一种人类微卫星不稳定状态的检测方法,使用上述检测试剂盒;该检测方法包括步骤如下:
62.选取人体肿瘤组织样本和正常对照样本的配对石蜡切片,并分别提取基因组dna;
63.分别取肿瘤组织样本和正常对照样本dna加入pcr反应体系中,利用检测试剂盒中的引物进行多重荧光pcr扩增反应;
64.pcr扩增反应结束后,将肿瘤组织样本和正常对照样本的pcr扩增产物进行毛细管电泳,对比分析两者数据,以判断人类微卫星位点的稳定性。
65.与现有技术相比,本发明的有益效果如下:
66.(1)采用多重荧光pcr技术,实现了6个待测位点和1个内控位点可在同一管pcr反应中进行,且在实际操作过程中只需要加入pcr反应液a、pcr反应液b和样本dna,操作简单、快速,扩增效率高、扩增反应时间短,并可通过荧光标记将位点区分;
67.(2)使用了毛细管电泳技术,提高了检测的分辨率和灵敏度,最低可检测到1个碱基的位移;
68.(3)在pcr反应体系中添加了防污染组分尿嘧啶dna糖基化酶(udg酶),该酶可选择性水解断裂含有du的双链或者单链dna中的尿嘧啶糖苷键,形成有缺失碱基的dna链,在碱性介质以及高温下会进一步水解断裂而被消除,该酶的加入提高了检测结果的准确性;
69.(4)检测试剂盒灵敏度可达到1ng/μl石蜡切片样本,且检测试剂盒使不同位点间的非特异性扩增的可能性降到最低,防止了各位点间的互相干扰,使结果判读更准确。
附图说明
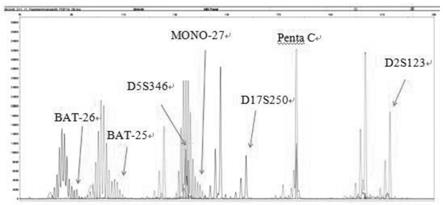
70.图1为质控品1的pcr产物的毛细管电泳结果图;
71.图2为质控品2的pcr产物的毛细管电泳结果曲线图;
72.图3为空白对照的pcr产物的毛细管电泳结果图;
73.图4表示1个单位位移质粒的毛细管电泳结果图;其中,mss表示没有发生位移的质粒组合;mu1表示突变率为30%的1个单位位移质粒组合,虚线是位点的参考线,箭头表示发生位移的位点;
74.图5表示2个单位位移质粒的毛细管电泳结果图;其中,mss表示没有发生位移的质粒组合;mu2表示突变率为20%的2个单位位移质粒组合,虚线是位点的参考线,箭头表示发生位移的位点;
75.图6表示5个单位位移质粒的毛细管电泳结果图;其中,mss表示没有发生位移的质粒组合;mu5表示突变率为20%的5个单位位移质粒组合,虚线是位点的参考线,箭头表示发生位移的位点;
76.图7为msi-h型样本检测结果图;其中,a图为同一个体肿瘤组织的检测结果;b图为同一个体的正常组织的检测结果;a图中的箭头所示为位点的位移峰。
77.图8为一实施例中msi-h型样本检测结果图;其中,a图为同一个体肿瘤组织的检测结果;b图为同一个体的正常组织的检测结果;a图中的箭头所示为位点的位移峰。
78.图9为一实施例中msi-h型样本检测结果图;其中,a图为同一个体肿瘤组织的检测结果;b图为同一个体的正常组织的检测结果;a图中的箭头所示为位点的位移峰;
79.图10为一实施例中mss型样本检测结果图;其中,a图为同一个体肿瘤组织的检测结果;b图为同一个体的正常组织的检测结果;a图中的箭头所示为位点的位移峰。
具体实施方式
80.下面结合附图,对本发明的较佳实施例作进一步详细说明。
81.本发明提供了一种用于检测人类微卫星不稳定状态的引物组、检测试剂盒及其检测方法;实现肿瘤组织样本和正常对照样本的配对石蜡切片中bat-25、bat-26、d17s250、d2s123、d5s346和mono-27这6个位点的微卫星不稳定状态的检测。
82.所述用于检测人类微卫星不稳定状态的引物组,其包括针对微卫星位点bat-25、
bat-26、d17s250、d2s123、d5s346和mono-27,及内控位点penta c设计的上下游引物,具体如下:
83.所述检测bat-25位点的微卫星不稳定状态的下游引物核苷酸序列如seq id no:2所示;
84.所述检测bat-26位点的微卫星不稳定状态的上游引物核苷酸序列如seq id no:3所示;
85.所述检测bat-26位点的微卫星不稳定状态的下游引物核苷酸序列如seq id no:4所示;
86.所述检测d17s250位点的微卫星不稳定状态的上游引物核苷酸序列如seq id no:5所示;
87.所述检测d17s250位点的微卫星不稳定状态的下游引物核苷酸序列如seq id no:6所示;
88.所述检测d2s123位点的微卫星不稳定状态的上游引物核苷酸序列如seq id no:7所示;
89.所述检测d2s123位点的微卫星不稳定状态的下游引物核苷酸序列如seq id no:8所示;
90.所述检测d5s346位点的微卫星不稳定状态的上游引物核苷酸序列如seq id no:9所示;
91.所述检测d5s346位点的微卫星不稳定状态的下游引物核苷酸序列如seq id no:10所示;
92.所述检测mono-27位点的微卫星不稳定状态的上游引物核苷酸序列如seq id no:11所示;
93.所述检测mono-27位点的微卫星不稳定状态的下游引物核苷酸序列如seq id no:12所示;
94.所述内控位点penta c的上游引物核苷酸序列如seq id no:13所示;
95.所述内控位点penta c的下游引物核苷酸序列如seq id no:14所示。
96.进一步地,所述引物组中,如seq id no:1和seq id no:13所示核苷酸的5’端标记有fam;如seq id no:3和seq id no:5所示核苷酸的5’端标记有ned;如seq id no:7和seq id no:9所示核苷酸的5’端标记有pet;如seq id no:11所示核苷酸的5’端标记有vic。
97.优选地,所述引物组中,应用于多重荧光pcr反应时,各所述引物组的浓度如下:
98.所述bat-25位点上游引物在反应体系中的终浓度为0.05μmol/l;
99.所述bat-25位点下游引物在反应体系中的终浓度为0.05μmol/l;
100.所述bat-26位点上游引物在反应体系中的终浓度为0.06μmol/l;
101.所述bat-26位点下游引物在反应体系中的终浓度为0.06μmol/l;
102.所述d17s250位点上游引物在反应体系中的终浓度为0.10μmol/l;
103.所述d17s250位点下游引物在反应体系中的终浓度为0.10μmol/l;
104.所述d2s123位点上游引物在反应体系中的终浓度为0.04μmol/l;
105.所述d2s123位点下游引物在反应体系中的终浓度为0.04μmol/l;
106.所述d5s346位点上游引物在反应体系中的终浓度为0.05μmol/l;
107.所述d5s346位点下游引物在反应体系中的终浓度为0.05μmol/l;
108.所述mono-27位点上游引物在反应体系中的终浓度为0.07μmol/l;
109.所述mono-27位点下游引物在反应体系中的终浓度为0.07μmol/l;
110.所述penta c位点上游引物在反应体系中的终浓度为0.03μmol/l;
111.所述penta c位点下游引物在反应体系中的终浓度为0.03μmol/l。
112.一实施例,所述引物组中,所述bat-25、bat-26、d17s250、d2s123、d5s346和mono-27位点以及内控位点penta c的引物序列分别对应核苷酸序列如下:
113.bat-25位点的上游引物seq id no:1对应核酸序列:5’-fam-caagaatgtaagtgggagtgat-3’;
114.bat-25位点的下游引物seq id no:2对应核酸序列:5’-aactatggctctaaaatgctctg-3’;
115.bat-26位点的上游引物seq id no:3对应核酸序列:5’-ned-ttggatattgcagcagtcagag-3’;
116.bat-26位点的下游引物seq id no:4对应核酸序列:5’-accaatcaacatttttaacc-3’;
117.d17s250位点的上游引物seq id no:5对应核酸序列:5’-ned-gcataaaaaggaagaatcaaatagac-3’;
118.d17s250位点的下游引物seq id no:6对应核酸序列:5’-agccactcagctggccata-3’;
119.d2s123位点的上游引物seq id no:7对应名核酸序列:5’-pet-aaacaggatgcctgccttta-3’;
120.d2s123位点的下游引物seq id no:8对应核酸序列:5’-gactttccacctatgggactgtg-3’;
121.d5s346位点的上游引物seq id no:9对应核酸序列:5’-pet-gttagttagttagttactcactc-3’;
122.d5s346位点的下游引物seq id no:10对应核酸序列:5’-acagtattactagtttttcaggg-3’;
123.mono-27位点的上游引物seq id no:11对应核酸序列:5’-vic-ctacactccagcctgggtg-3’;
124.mono-27位点的下游引物seq id no:12对应核酸序列:5’-tccctaaacaattctactgaaat-3’;
125.penta c位点的上游引物:seq id no:13对应核酸序列:5’-fam-catgaacacactttgcacctg-3’;
126.penta c位点的下游引物seq id no:14对应核酸序列:5’-tacaagagagcattccaacac-3’。
127.上述给出了不同类型荧光pcr引物对应的核苷酸序列,可分别用于对bat-25、bat-26、d17s250、d2s123、d5s346和mono-27等6个位点的微卫星不稳定进行检测。根据肿瘤组织样本和配对的正常组织样本的比对分析,通过分析这6个位点是否发生位移来判定微卫星的不稳定状态。上述引物将根据人bat-25、bat-26、d17s250、d2s123、d5s346和
mono-27等6个位点的微卫星区域和内控位点penta c微卫星区域的dna序列设计并合成,可以检测bat-25、bat-26、d17s250、d2s123、d5s346和mono-27等6个位点的微卫星不稳定状态。
128.这些特异性荧光pcr引物能够准确检测bat-25、bat-26、d17s250、d2s123、d5s346和mono-27等6个位点的微卫星不稳定状态。
129.本发明还提供一种使用上述引物组的检测试剂盒,用于检测bat-25、bat-26、d17s250、d2s123、d5s346和mono-27等6个位点的微卫星不稳定状态。该检测试剂盒包括用于配制pcr反应液的荧光引物混合液、pcr buffer、热启动taq酶反应液、质控品和纯化水。其中,引物混合液所包括的组分如表1所示。
130.表1引物混合液所包括的组分
[0131][0132]
其中,表1的引物混合液组分中,用于检测bat-25、bat-26、d17s250、d2s123、d5s346和mono-27等6个位点微卫星不稳定状态的引物分别如下:
[0133]
所述检测bat-25位点的微卫星不稳定状态的上游引物核苷酸序列如seq id no:1所示,其5’端有fam荧光基团;
[0134]
所述检测bat-25位点的微卫星不稳定状态的下游引物核苷酸序列如seq id no:2所示;
[0135]
所述检测bat-26位点的微卫星不稳定状态的上游引物核苷酸序列如seq id no:3所示,其5’端有ned荧光基团;
[0136]
所述检测bat-26位点的微卫星不稳定状态的下游引物核苷酸序列如seq id no:4所示;
[0137]
所述检测d17s250位点的微卫星不稳定状态的上游引物核苷酸序列如seq id no:5所示,其5’端有ned荧光基团;
[0138]
所述检测d17s250位点的微卫星不稳定状态的下游引物核苷酸序列如seq idno:6所示;
[0139]
所述检测d2s123位点的微卫星不稳定状态的上游引物核苷酸序列如seq id no:7所示,其5’端有pet荧光基团;
[0140]
所述检测d2s123位点的微卫星不稳定状态的下游引物核苷酸序列如seq id no:8所示;
[0141]
所述检测d5s346位点的微卫星不稳定状态的上游引物核苷酸序列如seq id no:9所示,其5’端有pet荧光基团;
[0142]
所述检测d5s346位点的微卫星不稳定状态的下游引物核苷酸序列如seq id no:10所示;
[0143]
所述检测mono-27位点的微卫星不稳定状态的上游引物核苷酸序列如seq id no:11所示,其5’端有vic荧光基团;
[0144]
所述检测mono-27位点的微卫星不稳定状态的下游引物核苷酸序列如seq id no:12所示;
[0145]
所述内控位点penta c的上游引物核苷酸序列如seq id no:13所示,其5’端有fam荧光基团;
[0146]
所述内控位点penta c的下游引物核苷酸序列如seq id no:14所示。
[0147]
bat-25、bat-26、d17s250、d2s123、d5s346和mono-27等6个位点的微卫星不稳定状态,是在同一pcr反应体系中进行检测,检测这6个位点的微卫星不稳定状态时,6个位点的上下游引物、pcr buffer、热启动taq酶反应液和样本dna组成msi pcr反应液,分别与各位点的目的片段进行结合,得到的pcr产物分别带上相应的荧光标记;其中,bat-25和penta c位点的pcr产物所带的荧光标记为fam;bat-26和d17s250位点的pcr产物所带的荧光标记为ned;d2s123和d5s346位点的pcr产物所带的荧光标记为pet;mono-27位点的pcr产物所带的荧光标记为vic;所述内控引物是根据penta c位点设计并合成的,用于样本和实验过程的监控;
[0148]
所述pcr反应液中,pcr buffer组分包括(nh4)2so4、tris-hcl、mgcl2、triton、tween-20、bsa和甜菜碱;热启动taq酶反应液组分包括dntps、热启动taq酶、udg酶和热启动taq酶稀释液。
[0149]
所述对照样本组分包括纯化水组分的空白对照样本、质粒组分的质控品1和质控品2。其中,质控品2是质控品1的配对样本;其中质控品1由微卫星稳定质粒与20%微卫星不稳定质粒的混合液组成,质控品2由微卫星稳定质粒的混合溶液组成;空白对照样本为纯化水。
[0150]
本发明检测试剂盒使用样本为肿瘤组织样本和配对的正常对照样本的石蜡切片。
[0151]
本发明检测试剂盒用于判定检测有效性的标准为:
[0152]
每次检测均设置空白对照组和质控品,检测结果两个质控品(质控品1和质控品2)的6个待测位点和1个内控位点的有效峰均需检测到,两个质控品的内控位点有效峰位置<1bp;同时质控品1中的6个待测位点均不稳定,质控品2的6个位点均稳定,质控品1中的6个待测位点位移峰与质控品2中的6个位点待测位点有效峰位置均≥1个重复单位。
[0153]
本发明还提供使用上述检测试剂盒针对人类微卫星不稳定状态的检测方法,步骤如下:
[0154]
s1.处理待测样本。待测样本为肿瘤组织样本和正常对照样本的配对石蜡切片。
[0155]
选取肿瘤组织切片和正常组织切片数量≥5张,石蜡切片厚度≥4μm,组织面积≥1cm
×
1cm,保存时间不超过3年。肿瘤组织样本中肿瘤细胞含量不低于20%。推荐使用本公司核酸提取或纯化试剂盒(备案号:粤穗械备20170666号)对石蜡切片进行核酸提取,样本处理及核酸提取均按说明书进行操作。样本dna提取后通过核酸定量仪器对dna浓度进行检测,并将样本稀释到1-10ng/μl后备用。
[0156]
s2、配制pcr反应体系。取出试剂盒中的pcr反应液a和pcr反应液b置于pcr反应管中,室温融化后涡旋震荡混匀,再分别加入处理后的待测样本和配对样本2μl,制备得到msi pcr反应液;其中,pcr反应体系中,pcr反应液a共6μl,包括6个待测位点引物和内控引物混
合液1.6μl、pcr buffer 2.5μl、及余量为纯水;pcr反应液b包括热启动taq酶反应液2μl;样本dna 2ul。
[0157]
s3、将pcr反应管放入pcr仪样品槽内,设置反应条件和循环数,反应体系体积设置为10μl;设置完后,保存文件,运行程序随后进行多重荧光pcr扩增反应;运行步骤如下:
[0158]
第1步、温度为50℃、时间为2分钟,循环次数1次;
[0159]
第2步、温度为95℃、时间为10分钟,循环次数1次;
[0160]
第3步、温度为95℃、时间为30秒,温度为56℃、时间为30秒、温度为72℃、时间为30秒,循环次数,35次;
[0161]
第4步、温度为72℃、时间为5分钟,循环次数1次。
[0162]
s4、待pcr反应结束后,将pcr产物按样本浓度稀释后(1-4ng/μl的样本的pcr产物不稀释,5-10ng/μl的样本的pcr产物稀释20倍),并取2μl pcr产物用于后续分析。
[0163]
s5、毛细管电泳。量取genescan600liz标准品和甲酰胺进行涡旋混匀,离心后取9μl加入到八联管中;其中,genescan600liz标准品0.25ul,甲酰胺8.75ul。
[0164]
s6、取2μl上述待测样本和配对的对照样本、质控品(包括质控品1和质控品2)和空白对照的pcr产物分别加入到上述加有genescan600liz标准品和甲酰胺的八联管中,混匀并离心后,将八联管放入到金属浴95℃加热3min,并在加热结束后立即冰浴2min,冷却后将其转移到96孔板中,转移时应避免产生气泡,待所有样品加入后,将96孔板离心后待用。
[0165]
s7、结果分析。打开基因分析仪3500dx和电脑中的3500dx软件,对基因进行检测分析并保存分析数据,再使用genemapper软件对检测基因进行分析,对比分析两者数据,以判断人类微卫星的bat-25、bat-26、d17s250、d2s123、d5s346和mono-27位点的稳定性。
[0166]
本发明采用的pcr检测原理如下:
[0167]
基于多重荧光pcr 毛细管电泳法,实现石蜡切片样本中6个msi位点的微卫星不稳定状态的检测。本试剂盒针对6个微卫星位点设计特异的检测引物,使各个位点之间的间距至少在10bp以上,并在上游引物的5’端分别标记不同的荧光,pcr产物通过基因分析仪进行检测后便可通过物理距离和荧光染料进行区分,避免位点由于位移所产生的干扰;6个待测位点和内控位点的扩增长度均小于250bp,并通过调整引物量使各个位点的扩增效率较一致,可避免因样本质量等问题导致漏检;在待测位点的反应液中加入了内控位点,通过内控可以对待测样本的采集、核酸提取、pcr检测全过程实行监控,避免样本被污染或者混杂其他样本而导致结果误判;另外,本产品添加了防污染组分(尿嘧啶dna糖基化酶,即udg酶),其作用机理是选择性水解断裂含有du的双链或者单链dna中的尿嘧啶糖苷键,形成的有缺失碱基的dna链,在碱性介质以及高温下会进一步水解断裂,从而被消除。
[0168]
下面结合具体实施例对本发明进行清晰地描述,以使本领域技术人员更好地理解并实施本发明方案。显然,以下实施例仅用于对本发明的进一步说明,不能理解为对本发明保护范围的限制,本领域的技术人员可以基于本发明的精神和宗旨对本发明做出部分改进与调整。下述实施例所用实验方法如无特殊说明,均为普通方法;下述实施例所用试剂如无特殊说明,均可由商业渠道获得。
[0169]
一种针对bat-25、bat-26、d17s250、d2s123、d5s346和mono-27等6个位点的微卫星不稳定的检测方法。具体实施步骤如下:
[0170]
步骤一、待测样本处理
[0171]
待测样本为肿瘤组织样本和配对的正常对照样本的石蜡切片;
[0172]
选取肿瘤组织切片和正常组织切片数量≥5张,石蜡切片厚度≥4μm,组织面积≥1cm
×
1cm,保存时间不超过3年。肿瘤组织样本中肿瘤细胞含量不低于20%。推荐使用本公司核酸提取或纯化试剂盒(备案号:粤穗械备20170666号)对石蜡切片进行核酸提取,样本处理及核酸提取均按说明书进行操作。样本dna提取后通过核酸定量仪器对dna浓度进行检测,并将样本稀释到1-10ng/μl后待用。
[0173]
步骤二、多重荧光pcr体系制备
[0174]
pcr体系配制前准备:取出试剂盒中的pcr反应液a、pcr反应液b和纯化水等,室温融化,涡旋震荡混匀后离心10秒,配制pcr体系,pcr体系组分如表2所示,其中,pcr反应液a共6μl,包括6个待测位点引物和内控引物混合液1.6μl、pcr buffer 2.5μl、及余量为纯水:pcr反应液b包括热启动taq酶反应液2μl;样本dna 2ul。
[0175]
表2 msi pcr反应体系组分表
[0176]
pcr反应液a6μlpcr反应液b2μldna2μl
[0177]
对bat-25、bat-26、d17s250、d2s123、d5s346和mono-27位点以及内控位点penta c的引物序列进行多重荧光标记引物设计,各自对应核苷酸序列如表3所示。
[0178]
表3引物序列与其对应的核苷酸序列表
[0179]
引物序列号核苷酸序列(5
’‑3’
)bat
‑
25位点的上游引物seq id no:15
’‑
fam
‑
caagaatgtaagtgggagtgat
‑3’
bat
‑
25位点的下游引物seq id no:25
’‑
aactatggctctaaaatgctctg
‑3’
bat
‑
26位点的上游引物seq id no:35
’‑
ned
‑
ttggatattgcagcagtcagag
‑3’
bat
‑
26位点的下游引物seq id no:45
’‑
accaatcaacatttttaacc
‑3’
d17s250位点的上游引物seq id no:55
’‑
ned
‑
gcataaaaaggaagaatcaaatagac
‑3’
d17s250位点的下游引物seq id no:65
’‑
agccactcagctggccata
‑3’
d2s123位点的上游引物seq id no:75
’‑
pet
‑
aaacaggatgcctgccttta
‑3’
d2s123位点的下游引物seq id no:85
’‑
gactttccacctatgggactgtg
‑3’
d5s346位点的上游引物seq id no:95
’‑
pet
‑
gttagttagttagttactcactc
‑3’
d5s346位点的下游引物seq id no:105
’‑
acagtattactagtttttcaggg
‑3’
mono
‑
27位点的上游引物seq id no:115
’‑
vic
‑
ctacactccagcctgggtg
‑3’
mono
‑
27位点的下游引物seq id no:125
’‑
tccctaaacaattctactgaaat
‑3’
penta c位点的上游引物:seq id no:135
’‑
fam
‑
catgaacacactttgcacctg
‑3’
penta c位点的下游引物seq id no:145
’‑
tacaagagagcattccaacac
‑3’
[0180]
相应地,多重荧光pcr反应中时,各引物组的浓度如下:
[0181]
所述bat-25位点上游引物在反应体系中的终浓度为0.05μmol/l;
[0182]
所述bat-25位点下游引物在反应体系中的终浓度为0.05μmol/l;
[0183]
所述bat-26位点上游引物在反应体系中的终浓度为0.06μmol/l;
[0184]
所述bat-26位点下游引物在反应体系中的终浓度为0.06μmol/l;
[0185]
所述d17s250位点上游引物在反应体系中的终浓度为0.10μmol/l;
[0186]
所述d17s250位点下游引物在反应体系中的终浓度为0.10μmol/l;
[0187]
所述d2s123位点上游引物在反应体系中的终浓度为0.04μmol/l;
[0188]
所述d2s123位点下游引物在反应体系中的终浓度为0.04μmol/l;
[0189]
所述d5s346位点上游引物在反应体系中的终浓度为0.05μmol/l;
[0190]
所述d5s346位点下游引物在反应体系中的终浓度为0.05μmol/l;
[0191]
所述mono-27位点上游引物在反应体系中的终浓度为0.07μmol/l;
[0192]
所述mono-27位点下游引物在反应体系中的终浓度为0.07μmol/l;
[0193]
所述penta c位点上游引物在反应体系中的终浓度为0.03μmol/l;
[0194]
所述penta c位点下游引物在反应体系中的终浓度为0.03μmol/l。
[0195]
步骤三、样本添加
[0196]
取步骤一所制备的肿瘤组织样本和正常对照样本的配对石蜡切片的核酸、质控品1、质控品2和空白对照各2μl,加入至步骤二配制的pcr反应体系的八联管中,使每管pcr反应液的总体积为10μl;盖紧八联管管盖,充分混匀,高速离心10秒;检测试剂盒的对照样本如表4:
[0197]
表4检测试剂盒的对照样本表
[0198]
编号组分组分中的主要成分1空白对照纯化水2质控品1质粒3质控品2质粒
[0199]
所述质控品1是质控品2的配对样本,其中质控品1由微卫星稳定性质粒与20%微卫星不稳定质粒的混合液组成,质控品2由微卫星稳定性质粒的混合溶液组成。空白对照为纯化水。
[0200]
步骤四、pcr扩增
[0201]
将pcr反应管放入pcr仪样品槽内,并记录放置顺序;设置反应条件和循环数如下表,反应体系体积设置为10μl;设置完成后,保存文件,运行程序随后进行多重荧光的pcr扩增反应,运行步骤如下:
[0202]
第1步、温度为50℃、时间为2分钟,循环次数1次;
[0203]
第2步、温度为95℃、时间为10分钟,循环次数1次;
[0204]
第3步、温度为95℃、时间为30秒,温度为56℃、时间为30秒、温度为72℃、时间为30秒,循环次数,35次;
[0205]
第4步、温度为72℃、时间为5分钟,循环次数1次。
[0206]
步骤五、毛细管电泳检测
[0207]
将0.25ul的genescan600liz标准品和8.75ul的甲酰胺混匀并离心后取9μl加入到八联管中。取2μl稀释后的上述待测样本和配对样本、质控品以及空白对照的pcr产物分别加入到上述加有genescan600liz标准品和甲酰胺的八联管中,混匀并离心后,将八联管放入到金属浴95℃加热3min,并在加热结束后立即冰浴2min,冷却后将其转移到96孔板中,转移时应避免产生气泡,待所有样品加入后,将96孔板离心后通过3500dx基因分析仪进行检测。
[0208]
步骤六、数据读取和分析
[0209]
(1)结果分析
[0210]
检测完毕后,将数据保存后使用genemapper软件进行分析,按照说明书操作。
[0211]
(2)结果判读
[0212]
同一次实验中,阳性质控品和阴性质控品需同时满足质量控制要求,否则,本次实验无效,需重新进行。
[0213]
质控结果判读:检测结果两个质控品的7个位点的有效峰均需检测到,两个质控品的内控位点有效峰位置<1bp;同时质控品1中的6个待测位点均不稳定,质控品2的6个位点均稳定,质控品1中的6个待测位点位移峰与质控品2中的6个位点待测位点有效峰位置均≥1个重复单位。
[0214]
步骤七、微卫星状态判读
[0215]
1)在肿瘤组织和正常配对样本的penta c位点没有发生位移的情况下,肿瘤组织样本相较正常配对样本,有≥2个位点发生位移,判定为微卫星高度不稳定型(msi-h)(如图7和8所示);有1个位点发生位移时,判定为微卫星低度不稳定型(msi-l)(如图9所示);当没有位点发生位移时,判定为微卫星稳定型(mss)(如图10所示)。
[0216]
2)可以根据以下几点原则判断位点发生位移
[0217]
①
与正常对照相比,肿瘤组织样本新增了≥1组独立的峰,且新增的峰也有各自的主峰,主要可以分为以下两种情况:
[0218]
i.如图7中bat-26所示,新增的这组峰的主峰峰高大于正常对照对应的峰的峰高,新增这组峰的最高峰则为位移峰;
[0219]
ii.如图8中bat-26和mono-27所示,新增的这组峰的主峰峰高低于正常对照对应的峰的峰高,新增这组峰的最高峰也为位移峰。
[0220]
②
与正常对照相比,肿瘤组织新增了一簇连续的峰。主要可以分为以下三种情况:
[0221]
iii.如图7中mono-27所示,与正常对照相比,新增的这一簇连续的峰有明显的主峰,且主峰峰高比正常对照对应的主峰峰高更高,其最高峰则为位移峰;
[0222]
iv.如图8中bat-25所示,与正常对照相比,新增的这一簇连续的且有明显的主峰的峰,但其最高峰低于正常对照对应的峰高,其最高峰也为位移峰;
[0223]
v.如图7中bat-25所示,与正常对照相比,新增的这一簇连续的峰没有明显的主峰,但由虚线标出的峰的基部峰宽可见,肿瘤组织的峰宽明显大于正常对照对应的峰宽,则在正常对照峰宽外的峰为位移峰。
[0224]
3)如图9中d5s346所示,与正常对照相比,肿瘤组织没有新增峰,而同一组峰的主峰偏移,则发生偏移的主峰为位移峰。
[0225]
实施例1:一种结直肠癌微卫星不稳定状态检测试剂盒的组成成分、包装及数量(48人份/盒),如表5:
[0226]
表5试剂盒的组成成分、包装及数量
[0227][0228][0229]
实施例2:检测试剂盒的样本灵敏度检测实验
[0230]
选取1个单位位移、2个单位位移和5个单位位移的三种微卫星不稳定状态的质粒以及其对应的配对微卫星稳定状态质粒,配制突变率分别为20%、30%和40%的模拟样本,其中突变率为20%的1个单位位移的质粒编号为a1~a5,2个单位位移质粒的编号为a6~a10,5个单位位移质粒的编号为a11~a15;突变率为30%的1个单位位移的质粒编号为a16~a20,2个单位位移质粒的编号为a21-a25,5个单位位移质粒的编号为a26-a30;突变率为40%的1个单位位移的质粒编号为a31~a35,2个单位位移质粒的编号为a36-a40,5个单位位移质粒的编号为a41-a45;其对应的配对阴性质粒的编号为b1-b45。对以上模拟样本进行检测,加样至步骤二配制的pcr反应体系的八联管中,使每管pcr反应液总体积为10μl;盖紧八联管管盖,充分混匀,高速离心10秒。
[0231]
对bat-25、bat-26、d17s250、d2s123、d5s346和mono-27位点以及内控位点penta c的引物序列进行多重荧光标记引物设计,各自对应核苷酸序列如表6所示。
[0232]
表6引物序列与其对应的核苷酸序列表
[0233]
引物序列号核苷酸序列(5
’‑3’
)bat
‑
25位点的上游引物seq id no:15
’‑
fam
‑
caagaatgtaagtgggagtgat
‑3’
bat
‑
25位点的下游引物seq id no:25
’‑
aactatggctctaaaatgctctg
‑3’
bat
‑
26位点的上游引物seq id no:35
’‑
ned
‑
ttggatattgcagcagtcagag
‑3’
bat
‑
26位点的下游引物seq id no:45
’‑
accaatcaacatttttaacc
‑3’
d17s250位点的上游引物seq id no:55
’‑
ned
‑
gcataaaaaggaagaatcaaatagac
‑3’
d17s250位点的下游引物seq id no:65
’‑
agccactcagctggccata
‑3’
d2s123位点的上游引物seq id no:75
’‑
pet
‑
aaacaggatgcctgccttta
‑3’
d2s123位点的下游引物seq id no:85
’‑
gactttccacctatgggactgtg
‑3’
d5s346位点的上游引物seq id no:95
’‑
pet
‑
gttagttagttagttactcactc
‑3’
d5s346位点的下游引物seq id no:105
’‑
acagtattactagtttttcaggg
‑3’
mono
‑
27位点的上游引物seq id no:115
’‑
vic
‑
ctacactccagcctgggtg
‑3’
mono
‑
27位点的下游引物seq id no:125
’‑
tccctaaacaattctactgaaat
‑3’
penta c位点的上游引物:seq id no:135
’‑
fam
‑
catgaacacactttgcacctg
‑3’
penta c位点的下游引物seq id no:145
’‑
tacaagagagcattccaacac
‑3’
[0234]
相应地,多重荧光pcr反应中时,各引物组的浓度如下:
[0235]
所述bat-25位点上游引物在反应体系中的终浓度为0.05μmol/l;
[0236]
所述bat-25位点下游引物在反应体系中的终浓度为0.05μmol/l;
[0237]
所述bat-26位点上游引物在反应体系中的终浓度为0.06μmol/l;
[0238]
所述bat-26位点下游引物在反应体系中的终浓度为0.06μmol/l;
[0239]
所述d17s250位点上游引物在反应体系中的终浓度为0.10μmol/l;
[0240]
所述d17s250位点下游引物在反应体系中的终浓度为0.10μmol/l;
[0241]
所述d2s123位点上游引物在反应体系中的终浓度为0.04μmol/l;
[0242]
所述d2s123位点下游引物在反应体系中的终浓度为0.04μmol/l;
[0243]
所述d5s346位点上游引物在反应体系中的终浓度为0.05μmol/l;
[0244]
所述d5s346位点下游引物在反应体系中的终浓度为0.05μmol/l;
[0245]
所述mono-27位点上游引物在反应体系中的终浓度为0.07μmol/l;
[0246]
所述mono-27位点下游引物在反应体系中的终浓度为0.07μmol/l;
[0247]
所述penta c位点上游引物在反应体系中的终浓度为0.03μmol/l;
[0248]
所述penta c位点下游引物在反应体系中的终浓度为0.03μmol/l。
[0249]
将pcr反应管放入pcr仪样品槽内,并记录放置顺序;设置反应条件和循环数如下表,反应体系体积设置为10μl;设置完成后,保存文件,运行程序随后进行多重荧光的pcr扩增反应,如表7所示。
[0250]
表7 pcr扩增反应步骤和反应条件表
[0251][0252]
pcr反应结束后,将pcr产物通过3500dx基因分析仪进行检测。具体步骤如下:
[0253]
将0.25ul的genescan600liz标准品和8.75ul的甲酰胺按下表混匀并离心后取9μl加入到八联管中。取2μl稀释后的上述待测样本和配对样本、质控品以及空白对照的pcr产物分别加入到上述加有genescan600liz标准品和甲酰胺的八联管中,混匀并离心后,将八联管放入到金属浴95℃加热3min,并在加热结束后立即冰浴2min,冷却后将其转移到96孔板中,转移时应避免产生气泡,待所有样品加入后,将96孔板离心后通过3500dx基因分析仪进行检测。实际检测到的结果如表8所示。
[0254]
表8样本检测范围实验结果
[0255]
[0256]
本检测试剂盒的检测限为30%突变率的1个单位位移;20%突变率的2个单位位移。通过对不同位点的20%、30%和40%突变率的1个单位位移、2个单位位移和5个单位位移的质粒dna进行检测,灵敏度检测良好,代表性位点峰图见图4、图5、图6;质控品1和质控品2的峰图如图1、图2所示;空白对照如图3所示。因此,本发明的样本检测限为30%突变率的1个单位位移和20%突变率的2个单位位移的微卫星不稳定状态。
[0257]
实施例3:检测试剂盒的准确性检测
[0258]
选取检测结果为mss、msi-h和msi-l三种微卫星不稳定质粒和配对的微卫星稳定性质粒,mss质粒dna编号为p1-p5,msi-h质粒的dna编号为p6-p10,msi-l质粒dna的编号为p11-p15,质粒的突变率都为50%,对应的配对微卫星稳定状态质粒的编号为d1-d15;选取检测结果为mss、msi-h和msi-l三种微卫星不稳定状态的肿瘤组织样本和配对的正常对照样本(石蜡切片或白细胞),其中mss肿瘤组织样本的编号为p16-p20,正常对照样本编号为d16-d20,msi-h肿瘤组织样本的编号为p21-p25,正常对照样本编号为d21-d25,msi-l肿瘤组织样本的编号为p26-p30,正常对照样本编号为d26-d30。分别取上述样本及其正常对照样本2μl加至步骤二配制的pcr反应体系的八联管中,使每管pcr反应液总体积为10μl;盖紧八联管管盖,充分混匀,高速离心10秒。
[0259]
对bat-25、bat-26、d17s250、d2s123、d5s346和mono-27位点以及内控位点penta c的引物序列进行多重荧光标记引物设计,各自对应核苷酸序列如表9所示。
[0260]
表9引物序列与其对应的核苷酸序列表
[0261]
引物序列号核苷酸序列(5
’‑3’
)bat
‑
25位点的上游引物seq id no:15
’‑
fam
‑
caagaatgtaagtgggagtgat
‑3’
bat
‑
25位点的下游引物seq id no:25
’‑
aactatggctctaaaatgctctg
‑3’
bat
‑
26位点的上游引物seq id no:35
’‑
ned
‑
ttggatattgcagcagtcagag
‑3’
bat
‑
26位点的下游引物seq id no:45
’‑
accaatcaacatttttaacc
‑3’
d17s250位点的上游引物seq id no:55
’‑
ned
‑
gcataaaaaggaagaatcaaatagac
‑3’
d17s250位点的下游引物seq id no:65
’‑
agccactcagctggccata
‑3’
d2s123位点的上游引物seq id no:75
’‑
pet
‑
aaacaggatgcctgccttta
‑3’
d2s123位点的下游引物seq id no:85
’‑
gactttccacctatgggactgtg
‑3’
d5s346位点的上游引物seq id no:95
’‑
pet
‑
gttagttagttagttactcactc
‑3’
d5s346位点的下游引物seq id no:105
’‑
acagtattactagtttttcaggg
‑3’
mono
‑
27位点的上游引物seq id no:115
’‑
vic
‑
ctacactccagcctgggtg
‑3’
mono
‑
27位点的下游引物seq id no:125
’‑
tccctaaacaattctactgaaat
‑3’
penta c位点的上游引物:seq id no:135
’‑
fam
‑
catgaacacactttgcacctg
‑3’
penta c位点的下游引物seq id no:145
’‑
tacaagagagcattccaacac
‑3’
[0262]
相应地,多重荧光pcr反应中时,各引物组的浓度如下:
[0263]
所述bat-25位点上游引物在反应体系中的终浓度为0.05μmol/l;
[0264]
所述bat-25位点下游引物在反应体系中的终浓度为0.05μmol/l;
[0265]
所述bat-26位点上游引物在反应体系中的终浓度为0.06μmol/l;
[0266]
所述bat-26位点下游引物在反应体系中的终浓度为0.06μmol/l;
[0267]
所述d17s250位点上游引物在反应体系中的终浓度为0.10μmol/l;
[0268]
所述d17s250位点下游引物在反应体系中的终浓度为0.10μmol/l;
[0269]
所述d2s123位点上游引物在反应体系中的终浓度为0.04μmol/l;
[0270]
所述d2s123位点下游引物在反应体系中的终浓度为0.04μmol/l;
[0271]
所述d5s346位点上游引物在反应体系中的终浓度为0.05μmol/l;
[0272]
所述d5s346位点下游引物在反应体系中的终浓度为0.05μmol/l;
[0273]
所述mono-27位点上游引物在反应体系中的终浓度为0.07μmol/l;
[0274]
所述mono-27位点下游引物在反应体系中的终浓度为0.07μmol/l;
[0275]
所述penta c位点上游引物在反应体系中的终浓度为0.03μmol/l;
[0276]
所述penta c位点下游引物在反应体系中的终浓度为0.03μmol/l。
[0277]
将pcr反应管放入pcr仪样品槽内,并记录放置顺序;设置反应条件和循环数如下表,反应体系体积设置为10μl;设置完成后,保存文件,运行程序随后进行多重荧光的pcr扩增反应,如表10所示。
[0278]
表10 pcr扩增反应步骤和反应条件表
[0279][0280]
pcr反应结束后,将pcr产物通过3500dx基因分析仪进行检测。具体步骤如下:将0.25ul的genescan600liz标准品和8.75ul的甲酰胺按下表混匀并离心后取9μl加入到八联管中。取2μl稀释后的上述待测样本和配对样本、质控品以及空白对照的pcr产物分别加入到上述加有genescan600liz标准品和甲酰胺的八联管中,混匀并离心后,将八联管放入到金属浴95℃加热3min,并在加热结束后立即冰浴2min,冷却后将其转移到96孔板中,转移时应避免产生气泡,待所有样品加入后,将96孔板离心后通过3500dx基因分析仪进行检测。实际检测到的结果如表11所示。
[0281]
表11准确性检测结果
[0282]
[0283][0284]
根据上表所述结果,各质控品准确性的检测结果阳性率为100%,表明本发明试剂盒的准确性检测符合要求。
[0285]
实施例4:临床应用实验
[0286]
选取30例肿瘤组织样本和正常对照样本的配对石蜡切片,使用本公司核酸提取或纯化试剂盒(备案号:粤穗械备20170666号)对石蜡切片进行核酸提取,样本处理及核酸提取均按说明书进行操作。
[0287]
取上述样本及其配对的正常对照样本2μl加至步骤二配制的pcr反应体系的八联管中,使每管pcr反应液总体积为10μl;盖紧八联管管盖,充分混匀,高速离心10秒。
[0288]
将pcr反应管放入pcr仪样品槽内,并记录放置顺序;设置反应条件和循环数如下表,反应体系体积设置为10μl;设置完成后,保存文件,运行程序随后进行多重荧光的pcr扩增反应,如表12所示。
[0289]
表12 pcr扩增反应步骤和反应条件表
[0290][0291]
pcr反应结束后,将pcr产物通过3500dx基因分析仪进行检测。具体步骤如下:将0.25ul的genescan600liz标准品和8.75ul的甲酰胺按下表混匀并离心后取9μl加入到八联管中。取2μl稀释后的上述待测样本和配对样本、质控品以及空白对照的pcr产物分别加入到上述加有genescan600liz标准品和甲酰胺的八联管中,混匀并离心后,将八联管放入到金属浴95℃加热3min,并在加热结束后立即冰浴2min,冷却后将其转移到96孔板中,转移时应避免产生气泡,待所有样品加入后,将96孔板离心后通过3500dx基因分析仪进行检测。实际检测到的结果如表13所示。
[0292]
表13人肿瘤组织样本和正常对照样本的配对石蜡切片样本检测结果
[0293]
[0294][0295]
表检测结果为:30例样本中有16例mss型样本、4例msi-l型样本和10例msi-h型样本。
[0296]
以上描述公开了本发明的产品、用途、使用方法及优点,应当指出的是,上述实施
例仅为了清楚说明本技术所举的实例,并不能用来限定本专利的权利要求。对于本领域的技术人员,在未背离本发明精神实质与原理的前提下,可以做出一定的改进与替换,均在本发明要求保护的范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。