1.本发明涉及酵母菌高密度发酵技术领域,尤其涉及一种黄酒酵母高密度发酵工艺。
背景技术:
2.酵母是一种单细胞蛋白,含蛋白质50%左右,氨基酸含量齐全,富含b族维生素,还有丰富的酶系和多种经济价值很高的生理活性物质,如一些结构复杂的生化药物和生化试剂产品—辅酶a、辅酶i、辅酶q、细胞色素c、凝血质、谷胱甘肽、卵磷脂、麦角固醇和核糖核酸等,因此它是一种应用价值很高的微生物,在食品、医药、饲料等行业中应用广泛。
3.酵母的呼吸作用与发酵作用彼此之间相互作用,成为酵母糖代谢的自我调节措施,酵母的这些自我调节作用有巴斯德效应、克雷布特效应、卡斯特效应和反巴斯德效应。如何根据生产利用好酵母的糖代谢调节,是工业生产以及实验室研究的重点和难点。克雷布特效应能直接影响酵母对糖的得率进而影响高密度发酵的最终得率。酵母菌的克雷布特效应是指,在有氧条件下较高的糖浓度抑制呼吸作用,使之进行发酵作用产生乙醇,而酵母的得率下降。因此酵母高密度发酵的重点和难点是如何有效的控制发酵过程中的糖浓度,使酵母对糖的得率维持在较高水平,从而保障得率的同时节约成本。
4.在保障酵母氮源、无机盐、生长因子、生物素充足的情况下,如何将可发酵性糖添加到培养液中成为了研究工业发展及实验室研究的趋势。刘开放等(布拉酵母高密度发酵培养基及发酵工艺优化[j].食品科学)通过人工神经网络(artificial neural network,ann)和响应面试验建立菌体布拉酵母产量与培养基之间的关系模型,利用遗传算法(genetic algorithm,ga)进行全局寻优,得出最佳的培养基组合,在此培养基三角瓶培养条件下布拉迪酵母的干物质得率为8.21g/l。进而对此培养基进行温度、ph、接种量、溶氧等培养条件优化,最后进行流加葡萄糖、蛋白胨最终布拉迪酵母的干物质得率达到51.21g/l。其研究碳源的选择为葡萄糖、玉米浆粉,葡萄糖在饲料行业生产中,性价比上不如糖蜜,糖蜜价格低廉,并且富含酵母生长的几乎所有微量元素,米浆粉中有部分不容物质,容易在罐体中存在残留,对于罐体的清洗上不够方便,氮源的选择上利用的是的蛋白胨,蛋白胨成本较高,不利于饲料等基础行业规模化生产。
[0005]
王宇等(一种酵母高密度培养方法:中国,201811381662.2[p].)利用指数流加和溶氧反馈脉冲流加策略对培养过程进行控制,溶氧低于设定范围时停止补料、溶氧高于设定范围时开始补料。由于通过溶氧来自动控制系统对设备灵敏度要求高,设备成本也相对较高,对于一些饲料等基础发酵行业并不能达到很高的精度来控制发酵,往往会造成控制偏差,达不到预期的要求,甚至会造成控制失灵给生产带来额外的麻烦,这就有了需要更加简单的控制方法来达到更高的预期的需求。
[0006]
目前的大部分的研究结论都只关注最终的得率,会将发酵周期控制的很长,这样最终的培养可能会达到一个较高的得率,但是这个较高得率中真正的活性酵母数量不一定是最高值,因为,可能有一部分酵母活性已经减弱甚至是以死菌体的形式在里面待着。因此
关注酵母得率的同时也需要关注最终活菌的数量,这就对于我们的酵母高密度培养结果有了更高的需求,需要我们在高密度培养时多一个有价值的参考指标,对于酵母行业的发展推动有着更加深远的意义。
技术实现要素:
[0007]
本发明的目的是提供一种生产周期短、成本低、且不含不溶基质,杂菌污染较少、最终菌体得率、活菌数量和活菌品质较高的黄酒酵母高密度发酵工艺。
[0008]
为实现上述目的,本发明采用以下技术方案:
[0009]
本发明提供一种黄酒酵母高密度发酵工艺,包括如下步骤:
[0010]
s1:将优良黄酒酵母菌菌种活化培养,然后按照2%~8%接种量接种至种子培养基进行种子扩大培养得到种子培养液;
[0011]
s2:将种子培养液接种至发酵罐的发酵培养基中进行发酵培养,首先维持溶氧30%
‑
40%进行间歇培养,然后进行流加补糖培养;流加补糖过程中维持发酵罐内残糖含量为1.5%
‑
2%;发酵培养过程中发酵罐内ph为4.4~5.3;
[0012]
发酵培养包括如下步骤:
[0013]
s2
‑
1:0~3h,间歇培养,调节控制发酵罐通气比为0.6~0.8vvm,搅拌速率200
‑
250r/min进行培养;
[0014]
s2
‑
2:3~10h,开始流加补糖培养,调节控制发酵罐通气比为0.8
‑
1.2vvm,搅拌速率250
‑
300r/min;
[0015]
s2
‑
3:10~18h,调节控制发酵罐通气比为1.2
‑
1.6vvm,搅拌速率300
‑
350r/min;
[0016]
s2
‑
4:18~32h,调节控制发酵罐通气比为1.6
‑
2.0vvm,搅拌速率350
‑
400r/min。
[0017]
进一步地,步骤s1之前,发酵工艺还包括优良黄酒酵母菌菌种的保存制备:
[0018]
采用无菌生理盐水稀释黄酒酵母菌菌粉,然后进行分区划线,长出明显菌落后挑选优良单菌落进入活化培养基,进行菌种培养,培养结束后静置,弃上清液,得到黄酒酵母菌悬液,最后冻存。
[0019]
进一步地,冻存的方法为将黄酒酵母菌悬液与30~50%甘油混合保存在1~5ml甘油管进行冻存,冻存温度为
‑
100~
‑
70℃。
[0020]
进一步地,无菌生理盐水与黄酒酵母菌菌粉0.8~1:1~1.5混合,分区划线采用的为无菌ypd平皿。
[0021]
进一步地,黄酒酵母菌悬液与甘油混合比例为1~1.2:0.8~1。
[0022]
进一步地,菌种培养条件为150~200r/min、28~35℃,培养20~28h;静置为1~5℃,静置2~5h。
[0023]
进一步地,步骤s1中活化培养为150~200r/min,培养时间为20~28h;种子扩大培养为160~220r/min,培养时间为16~24h。
[0024]
进一步地,步骤s1中的种子培养基包括如下组分:70~120g/l糖蜜,5~15g/l(nh4)2so4,1~10g/l kh2po4,5~15g/lmgso4·
7h2o。
[0025]
进一步地,步骤s2中的发酵培养基包含以下组分:15~25g/l糖蜜,15~30g/l(nh4)2so4,5~15g/l kh2po4,10~25g/lmgso4·
7h2o,0.01~0.03g/l盐酸硫胺,0.1~0.5g/l肌醇。
[0026]
进一步地,步骤s2
‑
1和s2
‑
2中,控制发酵罐内ph为4.4
‑
4.8;s2
‑
3中,控制发酵罐内ph为4.8
‑
5.0;s2
‑
4中,控制发酵罐内ph为5.0
‑
5.3。
[0027]
进一步地,控制ph的方法为通过向发酵罐内流加0.5~1.5mol/l的na2co3溶液或者0.5~5mol/l的naoh溶液。
[0028]
进一步地,步骤s1和s2中的活化培养、种子扩大培养和发酵培养温度均为28~35℃。
[0029]
进一步地,流加补糖培养采用糖蜜,糖蜜的浓度为300~350g/l。
[0030]
本发明采用上述技术方案,与现有技术相比,具有如下技术效果:
[0031]
本发明提供的一种黄酒酵母高密度发酵工艺对于发酵设备的要求不高,对诸多基础行业的高密度发酵具有指导意义,通过调节通气比来调节溶氧来满足酵母对氧气的需求,根据酵母的不同生长时期多节点调控通气比,对于酵母的好氧需求更精确,可以有效减少克雷布特效应带来的影响,提升酵母对糖的得率,最终提高酵母培养的最终得率;发酵采用的培养基均为可溶性物质,避免发酵后发酵罐内残渣残留,方便输送、清洗,减少储罐及管道杂菌污染的可能性,采用糖蜜作为碳源,糖蜜价格低廉,富含多种微量元素,不需要额外添加微量元素,可以最大限度的节约成本;另外无机盐、生物素含量的添加也是经过大量分析及试验验证得出能满足酵母生长需求而不过剩,更为经济实用;当前技术中的高密度发酵培养工艺,通常保持恒定的ph,恒定ph培养对于酵母的生长最有利,但是在杂菌控制上不具有优势,可能会造成杂菌污染,另外碳源采用糖蜜作为碳源较低的ph可能会造成菌体中色素积累过多,影响菌体颜色,本发明提供的发酵工艺在培养的前期采用较低的ph值,这样可以有效抑制杂菌的生长繁殖,使酵母菌更快的占据菌群优势,减少由于发酵初期带来杂菌污染的风险,培养中后期采用较高的ph,可以减少酵母菌体对于糖蜜中色素的吸收,改善酵母菌体颜色。
附图说明
[0032]
图1为本发明一实施例中黄酒酵母高密度发酵工艺中步骤s0的流程示意图;
[0033]
图2为本发明一实施例中黄酒酵母高密度发酵工艺中步骤s1的流程示意图;
[0034]
图3为本发明一实施例中黄酒酵母高密度发酵工艺中步骤s2的流程示意图;
[0035]
图4为本发明提供的黄酒酵母高密度发酵工艺一实施例提供的黄酒酵母菌发酵后1600倍显微镜视野下的酵母镜检形态照片。
具体实施方式
[0036]
本发明提供了一种黄酒酵母高密度发酵工艺该发酵工艺包括如下步骤:
[0037]
s1:将优良黄酒酵母菌菌种活化培养,然后按照2%~8%接种量接种至种子培养基进行种子扩大培养得到种子培养液;
[0038]
s2:将种子培养液接种至发酵罐的发酵培养基中进行发酵培养,首先维持溶氧30%
‑
40%进行间歇培养,然后进行流加补糖培养;流加补糖过程中维持发酵罐内残糖含量为1.5%~2%;在发酵培养过程中,发酵罐内ph为4.4~5.3;
[0039]
发酵培养包括如下步骤:
[0040]
s2
‑
1:0~3h,间歇培养,调节控制发酵罐通气比为0.6~0.8vvm,搅拌速率200
‑
250r/min进行培养;
[0041]
s2
‑
2:3~10h,开始流加补糖培养,调节控制发酵罐通气比为0.8
‑
1.2vvm,搅拌速率250
‑
300r/min;
[0042]
s2
‑
3:10~18h,调节控制发酵罐通气比为1.2
‑
1.6vvm,搅拌速率300
‑
350r/min;
[0043]
s2
‑
4:18~32h,调节控制发酵罐通气比为1.6
‑
2.0vvm,搅拌速率350
‑
400r/min。
[0044]
在本发明一具体的实施方式中,在步骤s1之前,发酵工艺还包括优良黄酒酵母菌菌种的保存制备:
[0045]
采用无菌生理盐水稀释黄酒酵母菌菌粉,然后进行分区划线,长出明显菌落后挑选优良单菌落进入活化培养基,进行菌种培养,培养结束后静置,弃上清液,得到黄酒酵母菌悬液,最后冻存。
[0046]
在本发明一具体的实施方式中,冻存的方法为将黄酒酵母菌悬液与30~50%甘油混合保存在1~5ml甘油管进行冻存,冻存温度为
‑
100~
‑
70℃。
[0047]
在本发明一具体的实施方式中,无菌生理盐水与黄酒酵母菌菌粉0.8~1:1~1.5混合,分区划线采用的为无菌ypd平皿。
[0048]
在本发明一具体的实施方式中,黄酒酵母菌悬液与甘油混合比例为1~1.2:0.8~1。
[0049]
在本发明一具体的实施方式中,菌种培养条件为150~200r/min、28~35℃,培养时间为20~28h;静置的温度为1~5℃,时间为2~5h。
[0050]
在本发明一具体的实施方式中,步骤s1中活化培养的条件为150~200r/min,培养时间为20~28h;种子扩大培养的条件为160~220r/min,培养16~24h。
[0051]
在本发明一具体的实施方式中,步骤s1中的种子培养基包括如下组分:70~120g/l糖蜜,5~15g/l(nh4)2so4,1~10g/l kh2po4,5~15g/l mgso4·
7h2o。
[0052]
在本发明一具体的实施方式中,步骤s2中的发酵培养基包含以下组分:15~25g/l糖蜜,15~30g/l(nh4)2so4,5~15g/l kh2po4,10~25g/lmgso4·
7h2o,0.01~0.03g/l盐酸硫胺,0.1~0.5g/l肌醇。
[0053]
在本发明一具体的实施方式中,步骤s2
‑
1和s2
‑
2中,控制发酵罐内ph为4.4
‑
4.8;s2
‑
3中,控制发酵罐内ph为4.8
‑
5.0;s2
‑
4中,控制发酵罐内ph为5.0
‑
5.3。
[0054]
在本发明一具体的实施方式中,控制ph的方法为通过向发酵罐内流加0.5~1.5mol/l的na2co3溶液或者0.5~5mol/l的naoh溶液。
[0055]
在本发明一具体的实施方式中,步骤s1和s2中的活化培养、种子扩大培养和发酵培养的温度均为28~35℃。
[0056]
在本发明一具体的实施方式中,流加补糖培养采用糖蜜,糖蜜的浓度为300~350g/l。
[0057]
下面通过结合附图和具体实施例对本发明进行详细和具体的介绍,以使更好的理解本发明,但是下述实施例并不限制本发明范围。
[0058]
实施例1
[0059]
本实施例提供了一种黄酒酵母高密度发酵工艺,包括如下步骤:
[0060]
s0:如图1所示,取实验室保存的安瓿管中的黄酒酵母菌纯菌粉,与无菌生理盐水1:1稀释,将稀释液在无菌ypd平皿上进行分区划线,24h待ypd平板上长出明显菌落,挑取优
良的单菌落进入装液量50ml的250ml活化培养基的三角瓶,30℃、180r/min培养24h,培养结束后4℃下静置3h,弃2/3上清液,剩余菌悬液部分和40%的甘油1:1混合在2ml甘油管中保存后放入
‑
80℃冰箱备用;
[0061]
s1:如图2所示,从
‑
80℃冰箱取出一支甘油管,30℃水浴10
‑
15min解冻后,无菌操作倒入ypd三角瓶培养基,30℃、180r/min培养24h,培养好后5%接种量至100ml/500ml三角瓶种子培养基,种子培养基成分为100g/l糖蜜,10g/l(nh4)2so4,5g/lkh2po4,8g/l mgso4·
7h2o,在30℃、180r/min条件下培养20h,得到种子液;
[0062]
s2:如图3所示,将种子液接种至2l/5l发酵罐的发酵培养基中,发酵培养基包括以下浓度的组分:15g/l糖蜜,15g/l(nh4)2so4,10g/l kh2po4,15g/lmgso4·
7h2o,0.01g/l盐酸硫胺,0.2g/l肌醇;首先维持溶氧30%进行间歇培养,然后进行流加补料培养,流加补料过程维持发酵罐内残糖含量为1.5%;具体培养过程为:0h
‑
3h调节控制发酵罐通气比为0.6vvm,搅拌250r/min进行培养;3
‑
10h调节控制发酵罐通气比为0.8,搅拌300r/min,同时开始流加糖蜜;10
‑
18h调节控制发酵罐通气比为1.2vvm、搅拌转速350r/min;18
‑
32h调节控制发酵罐通气比为1.6vvm,搅拌转速400r/min;发酵罐内ph通过流加1.0mol/l的na2co3控制控制,0
‑
10h控制ph为4.5;10
‑
18h控制ph为4.8;18
‑
32h控制ph在5.0。
[0063]
实施例2
[0064]
本实施例提供了一种黄酒酵母高密度发酵工艺,包括如下步骤:
[0065]
s0:如图1所示,取实验室保存的安瓿管中的黄酒酵母菌纯菌粉,与无菌生理盐水1:1稀释,将稀释液在无菌ypd平皿上进行分区划线,24h待ypd平板上长出明显菌落,挑取优良的单菌落进入装液量50ml的250ml活化培养基的三角瓶,30℃、180r/min培养24h,培养结束后4℃下静置3h,弃2/3上清液,剩余菌悬液部分和40%的甘油1:1混合在2ml甘油管中保存后放入
‑
80℃冰箱备用;
[0066]
s1:如图2所示,从
‑
80℃冰箱取出一支甘油管,30℃水浴10
‑
15min解冻后,无菌操作倒入ypd三角瓶培养基,30℃、180r/min培养24h,培养好后5%接种量至100ml/500ml三角瓶种子培养基,种子培养基成分为100g/l糖蜜,10g/l(nh4)2so4,5g/l kh2po4,8g/l mgso4·
7h2o,在30℃、180r/min条件下培养20h,得到种子液;
[0067]
s2:如图3所示,将种子液接种至2l/5l发酵罐的发酵培养基中,发酵培养基包括以下浓度的组分:20g/l糖蜜,20g/l(nh4)2so4,12g/l kh2po4,20g/lmgso4·
7h2o,0.015g/l盐酸硫胺,0.3g/l肌醇;首先维持溶氧40%进行间歇培养,再进行流加补料培养,流加补料过程维持罐子中残糖含量在2.0%;具体培养过程为,0h
‑
3h调节控制发酵罐通气比为0.8vvm,搅拌200r/min进行培养;3
‑
10h调节控制发酵罐通气比为1.2vvm,搅拌250r/min,同时开始流加糖蜜;10
‑
18h调节控制发酵罐通气比为1.6vvm、搅拌转速300r/min;18
‑
32h调节控制发酵罐通气比为2.0vvm,搅拌转速350r/min;发酵罐内ph通过流加1.0mol/l的na2co3控制,0
‑
10h控制ph在4.5;10
‑
18h控制ph在4.8;18
‑
32h控制ph在5.0。
[0068]
实施例3
[0069]
本实施例提供了一种黄酒酵母高密度发酵工艺,包括如下步骤:
[0070]
s0:如图1所示,取实验室保存的安瓿管中的黄酒酵母菌纯菌粉,与无菌生理盐水1:1稀释,将稀释液在无菌ypd平皿上进行分区划线,24h待ypd平板上长出明显菌落,挑取优良的单菌落进入装液量50ml的250ml活化培养基的三角瓶,28℃、180r/min培养28h,培养结
束后4℃下静置3h,弃2/3上清液,剩余菌悬液部分和40%的甘油1:1混合在2ml甘油管中保存后放入
‑
80℃冰箱备用;
[0071]
s1:如图2所示,从
‑
80℃冰箱取出一支甘油管,28℃水浴10
‑
15min解冻后,无菌操作倒入ypd三角瓶培养基,28℃、180r/min培养28h,培养好后5%接种量至100ml/500ml三角瓶种子培养基,种子培养基成分为100g/l糖蜜,10g/l(nh4)2so4,5g/lkh2po4,8g/l mgso4·
7h2o,在28℃、180r/min条件下培养24h,得到种子液;
[0072]
s2:如图3所示,将种子液接种至2l /5l发酵罐的发酵培养基中,发酵培养基包括以下浓度的组分:25g/l糖蜜,25g/l(nh4)2so4,13g/l kh2po4,25g/lmgso4·
7h2o,0.025g/l盐酸硫胺0.4g/l肌醇;首先维持溶氧40%进行间歇培养,再进行流加补料培养,流加补料过程维持罐子中残糖含量在2.0%。具体培养过程为,0h
‑
3h调节控制发酵罐通气比为0.8vvm,搅拌200r/min进行培养;3
‑
10h调节控制发酵罐通气比为1.2,搅拌250r/min,同时开始流加糖蜜;10
‑
18h调节控制发酵罐通气比为1.6vvm、搅拌转速300r/min;18
‑
32h调节控制发酵罐通气比为2.0,搅拌转速350r/min;发酵罐内ph通过流加0.5mol/l的naoh控制,0
‑
10h控制ph在4.6;10
‑
18h控制ph在5.0;18
‑
32h控制ph在5.3。
[0073]
实施例4
[0074]
本实施例提供了一种黄酒酵母高密度发酵工艺,包括如下步骤:
[0075]
s0:如图1所示,取实验室保存的安瓿管中的黄酒酵母菌纯菌粉,与无菌生理盐水1:1稀释,将稀释液在无菌ypd平皿上进行分区划线,24h待ypd平板上长出明显菌落,挑取优良的单菌落进入装液量50ml的250ml活化培养基的三角瓶,35℃、180r/min培养20h,培养结束后4℃下静置3h,弃2/3上清液,剩余菌悬液部分和40%的甘油1:1混合在2ml甘油管中保存后放入
‑
80℃冰箱备用;
[0076]
s1:如图2所示,从
‑
80℃冰箱取出一支甘油管,35℃水浴10
‑
15min解冻后,无菌操作倒入ypd三角瓶培养基,35℃、180r/min培养20h,培养好后5%接种量至100ml/500ml三角瓶种子培养基,种子培养基成分为100g/l糖蜜,10g/l(nh4)2so4,5g/lkh2po4,8g/l mgso4·
7h2o,在35℃、180r/min条件下培养18h,得到种子液;
[0077]
s2:如图3所示,将种子液接种至2l/5l发酵罐的发酵培养基中,发酵培养基包括以下浓度的组分:25g/l糖蜜,25g/l(nh4)2so4,13g/lkh2po4,25g/lmgso4·
7h2o,0.025g/l盐酸硫胺,0.4g/l肌醇;首先维持溶氧40%进行间歇培养,再进行流加补料培养,流加补料过程维持罐子中残糖含量在2.0%。具体培养过程为,0
‑
3h调节控制发酵罐通气比为0.8vvm,搅拌200r/min进行培养;3
‑
10h调节控制发酵罐通气比为1.2vvm,搅拌250r/min,同时开始流加糖蜜;10
‑
18h调节控制发酵罐通气比为1.6vvm、搅拌转速300r/min;18
‑
32h调节控制发酵罐通气比为2.0vvm,搅拌转速350r/min;发酵罐内ph通过流加5mol/l的naoh控制,0
‑
10h控制ph在4.4;10
‑
18h控制ph在5.0;18
‑
32h控制ph在5.3。
[0078]
验证实施例
[0079]
本实施例采用实施例1~4提供的黄酒酵母高密度发酵工艺进行发酵,检测其发酵后发酵罐内酵母菌体的酵母菌总数量、酵母菌活菌数量、干物质得率和酵母菌得率。采用的检测方法为:
[0080]
(1)酵母菌体总数量:血球计数板检测。
[0081]
(2)检测酵母菌活菌数量:血球计数板与平皿稀释涂布结合,采用血球计数板测定
酵母菌体总数量,通过平皿稀释涂布检测酵母活菌数量,结合两种方法判定发酵产物中酵母菌的活菌数量和占比;
[0082]
(3)检测干物质得率:取一定量发酵液,将发酵液于8 000r/min离心5min去上清液,用生理盐水洗涤菌体2次,于105℃烘干至恒质量后称质量,用烘干至恒重的菌体质量比所取发酵液的体积即得到菌体干物质得率;
[0083]
(4)酵母菌的得率:是指酵母菌相对于可发酵性还原糖的得率,检测方法为,用dns发测出糖蜜中还原糖的含量,再根据计算得出加入发酵罐中的总还原糖的质量;根据酵母菌干物质得率算出发酵罐产酵母干物质的质量;酵母菌的得率=发酵罐产酵母干物质的质量/加入发酵罐中还原糖的总量。
[0084]
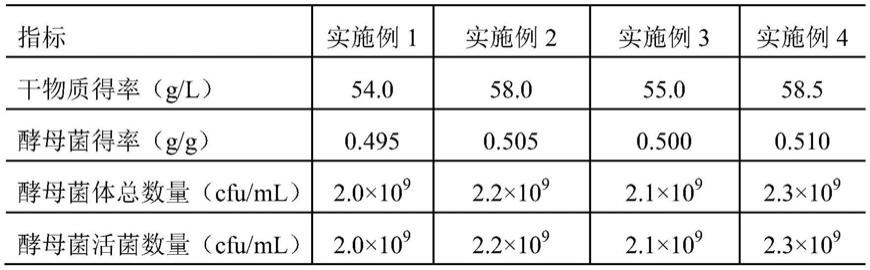
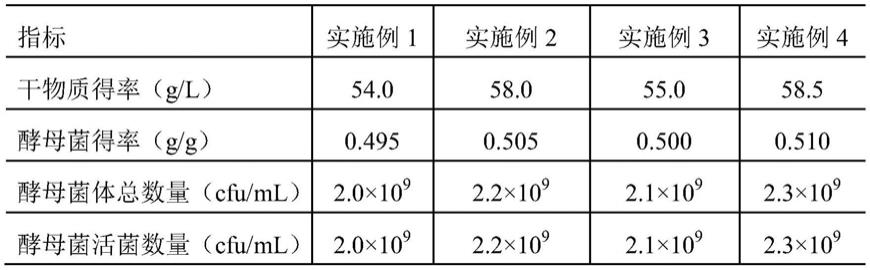
采用实施例1~4提供的黄酒酵母高密度发酵工艺进行发酵,检测其发酵后发酵罐内酵母菌体的干物质得率、酵母菌相对于还原糖的得率、酵母菌总数量和酵母菌活菌数量,结果如表1所示。
[0085]
表1发酵后酵母菌体的干物质得率、酵母菌得率、酵母菌总数量和酵母菌活菌数量
[0086][0087]
如表1所示,采用实施例1~4提供的发酵工艺发酵得到的发酵产物中酵母菌体的干物质得率以及酵母菌相对于还原糖的得率都处于较高水平,且酵母菌活性保持极佳,均为活性酵母菌,其培养后的状态如图4镜检图所示。传统的酵母菌株高密度发酵仅仅关注最终的酵母得率,而不太关注活菌数量,这就造成发酵培养周期的延长。本发明提供的发酵工艺培养时间短,不仅关注酵母菌体得率问题,同时也注重酵母的活菌数量,最终酵母菌体有着较高的活力,这是目前其他技术中难以达到的。在检测方法上通过平皿稀释涂布法和血球计数板法相互对照,两者值接近说明所得到的酵母都是活性酵母。且在此基础上,本发明提供的发酵工艺成本极低,适用于诸多基础行业中的高密度发酵。
[0088]
以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。