1.本发明涉及一种来自耐辐射奇球菌的金属依赖性蛋白酶drjamm,尤其涉及该蛋白酶的结构保守性、活性反应体系、最适温度与耐温性。
背景技术:
2.蛋白酶是水解蛋白质肽链的一类酶的总称,同时也是最重要的一种工业酶制剂,广泛存在于动物内脏、植物茎叶、果实和微生物中。由于动植物资源有限,工业上生产蛋白酶制剂主要利用枯草杆菌、栖土曲霉等微生物发酵制备。到本世纪初,已经报导的微生物蛋白酶估计超过 900 种,并且随着蛋白酶的深入研究,其工业应用越来越受到人们的关注。
3.蛋白酶应用广泛,已渗入到食品、酿造和发酵、纺织、医药、皮革、日用化学、饲料以及水产加工等部门。如在啤酒生产上,早就利用植物蛋白酶防止啤酒混浊,提高啤酒非生物稳定性。也可利用植物蛋白酶或微生物中性蛋白酶与α
‑
淀粉酶、葡萄糖淀粉酶、异淀粉酶、β
‑
葡聚糖酶一起配合使用,用于啤酒外加酶法糖化。皮革工业的脱毛和软化也已大量利用蛋白酶,既节省时间,又改善劳动卫生条件。在面包的生产中,蛋白酶用来添加到面粉中以缩短面团搅拌时间和改善面团的黏稠性等。另外,蛋白酶广泛应用于生化分子实验,作为蛋白质的手术刀,是生命科学研究不可或缺的。蛋白酶与人类密切相关,涉及到生活的各个方面,因而蛋白酶工业化利用重要性也日益明显。
4.随着工业生产水平的日益提高,微生物高温蛋白酶、适冷蛋白酶等适应于特殊生产环境的蛋白酶逐渐引起了研究者的重视。高温蛋白酶相比普通蛋白酶具有在高温下催化效率高、热稳定性强等特点,比常温蛋白酶更适合工业化应用中的高温催化过程。因此,耐高温蛋白酶的开发利用就显得尤为重要。目前的研究发现,添加一定量的金属离子可以显著提高蛋白酶的活性,并且金属离子作为蛋白酶结构的一部分或作为酶激活因子对蛋白酶稳定性起着重要作用,但是大多数蛋白酶被发现特异性的依赖一种或几种金属离子。因此,泛金属依赖性蛋白酶的发现对于蛋白酶的利用和研究有着显著的意义。本发明所涉及的耐高温蛋白酶drjamm来源于耐辐射奇球菌,是一种具有jab1/mpn结构域的金属离子依赖性蛋白酶。虽然有同源蛋白广泛存在于自然界中,但目前其对金属离子广泛适应性尚未见报道。同时,除在嗜热菌中报道了其同源蛋白在高温条件下保持活性,目前尚无在其它生物中报道。
技术实现要素:
5.为了克服现有的难题,本发明的目的是提供一种一种耐高温的泛金属依赖性蛋白酶及其应用。
6.一种耐高温的泛金属依赖性蛋白酶drjamm,其氨基酸序列如seq id no .1所示。
7.一种所述的耐高温的泛金属依赖性蛋白酶的重组载体,将所述耐高温蛋白酶基因插入到质粒pet28a上的ndei和bamhi限制酶切位点之间,使该基因位于t7启动子的下游并受其调控,得到重组载体。
8.一种所述的耐高温的泛金属依赖性蛋白酶的体外蛋白纯化方法,将重组载体转化进大肠杆菌bl21(de3)中进行表达,并使用0.4mm的iptg进行诱导,最后通过镍柱、70℃水浴和分子筛得到纯度为95%以上的drjamm蛋白。
9.一种根据所述的耐高温的泛金属依赖性蛋白酶的反应缓冲液,含100
‑
500 mm nacl、10
‑
50mm tris
‑
hcl 8.0、0.2mm
‑
1mm dtt、0.2
‑
2mm edta和0.02
‑
1mm金属离子。
10.所述的反应缓冲液,所述的金属离子包括以下的一种或多种:zn
2
、mn
2
、mg
2
、ba
2
、co
2
、fe
2
、ni
2
、ca
2
、sr
2
、cd
2
。
11.所述的耐高温的泛金属依赖性蛋白酶的反应优化方法,采用所述的反应缓冲液,与底物蛋白drmoad
‑
moae,蛋白序列id:np_296326,在温度4
‑
100℃反应20
‑
60min。
12.所述的反应优化方法,酶活性温度范围为30
‑
100℃。
13.所述的反应优化方法,最高酶活性温度范围为70℃
‑
100℃。
14.所述的耐高温的泛金属依赖性蛋白酶的应用方法,将drjamm蛋白所示识别的特异性氨基酸序列与目的蛋白连接,用于目的蛋白的高温切割或纯化。
15.所述的耐高温的金属依赖性蛋白酶,在基础研究和医药、化工、饲料行业中具有良好的应用价值。
16.本发明的有益效果:本发明中的蛋白酶保守性强,耐热性极好,且对金属离子选择性宽泛,为基础研究和蛋白酶工业利用提供了良好的工具。
附图说明
17.下面结合附图和实例对本发明进一步说明。
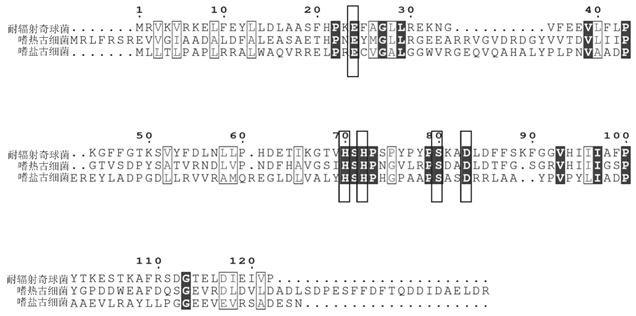
18.图1是蛋白酶drjamm的序列比对图。
19.图2是纯化的蛋白酶drjamm的sds
‑
page胶电泳图,显示其纯度在95%以上。
20.图3是不同金属离子催化条件下的蛋白酶活性比较。
21.图4是同种金属离子存在条件下,该蛋白酶能在不同温度反应比较。
22.图5是常规蛋白酶tev和drjamm处理带标签耐高温蛋白的模式图。
具体实施方式
23.实施例1: 耐辐射奇球菌drjamm蛋白表达菌株的构建根据2016年重新测序注释的耐辐射奇球菌r1基因组(asm163882v1),drjamm(蛋白序列id:np_294125)包含136个氨基酸。将drjamm与嗜热古细菌和嗜盐古细菌的同源蛋白比对,结果显示drjamm具有保守的exnhxhx7sx2d结构域(图1方框内标示)。
24.使用天根生物的细菌基因组dna提取试剂盒(dp302
‑
02)提取耐辐射奇球菌r1的基因组,用nanodrop 1000(thermo公司)测定其浓度和纯度。根据蛋白酶drjamm的氨基酸序列和pet28a质粒设计一对同源重组引物,上游引物drjamm
‑
f为5
’‑
ccgcgcggcagccatatggtgctcctgaccctgcctg
‑3’
,下划线为酶切位点ndei,ndei前为pet28a载体上的同源片段;下游引物drjamm
‑
r为5
’‑
gagctcgaattcggatcctcaattgctctcatcggcg
‑3’
, 下划线为酶切位点bamhi,ndei前为pet28a载体上的同源片段。以耐辐射奇球菌r1基因组dna为模板,用全式金transstart fastpfu dna polymerase对目的片段
、sr
2
、cd
2
,反应结束后,将产物在金属浴100℃加热15min,使产物充分变性,经sds
‑
page电泳检测。
36.(2)实验结果如图3所示,结果表明除去对蛋白有毒性的cu
2
外,在其它金属离子催化的反应中drjamm蛋白酶能将底物酶切成两段,。
37.实施例5: 耐辐射奇球菌drjamm蛋白能在高温条件下行使功能(1)为了进一步确认温度对drjamm蛋白酶活性的影响,将纯化的drjamm蛋白与其底物蛋白moad
‑
moae在反应缓冲液(100mm kcl、20mm tris
‑
hcl 8.0,1mm dtt、1mm edta)孵育,并根据实施例4添加ca
2
在4℃、16℃、30℃、37℃、70℃、100℃反应30min。反应结束后,将产物在金属浴100℃加热15min,使产物充分变性,经sds
‑
page电泳检测。
38.(2)实验结果如图4所示,结果表明蛋白酶和底物发生酶切反应的最适温度在30℃
‑
100℃之间,并且蛋白酶活性十分稳定,即使在100℃反应依旧充分。
39.实施例6: drjamm蛋白酶在带标签的耐高温蛋白纯化过程中的应用基于蛋白纯化过程中特异性蛋白酶的广泛利用,应用原理如下:在部分难表达或不溶的耐高温蛋白表达纯化前,会在目的蛋白前连接一段有助于表达或可溶性的片段,两者之间通过特异性切割位点连接,在纯化过程中使用特异性的蛋白酶切割位点分离标签和目的蛋白,以完成蛋白的纯化。如图5所示,本发明中的drjamm能高效的在高于70摄氏度的条件下特异性切割识别位点,并且该温度条件下杂蛋白和标签会变性沉淀。最后,不仅能达到标签和目的蛋白的分离,还能在切割过程中达到蛋白纯化的目的,从而简略了这类耐高温蛋白的纯化过程。
40.本发明实施例中所用的菌株为耐辐射奇球菌(deinococcus radiodurans,atcc no.13939),耐辐射奇球菌蛋白酶jamm,以上仅是本发明的优选实施方式,但本发明并不局限于上述详细方法,根据本发明的教导和启示,任何熟悉此技术的人,利用本发明公开的耐高温蛋白酶drjamm以及衍生物,均在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。