一种靶向人claudin和人pdl1蛋白的双特异抗体及其应用
技术领域
1.本发明涉及一种靶向人claudin和人pdl1蛋白的双特异抗体及其应用,属于生物医药领域。
背景技术:
2.双特异性抗体(bsab)又称双功能抗体,可同时识别和结合两种不同的抗原和表位,并阻断两种不同的信号通路以发挥其作用。bsab与普通抗体相比增加了一个特异性抗原结合位点,在治疗方面表现出了以下优势:
3.介导免疫细胞对肿瘤的杀伤:双特异性抗体的一个重要作用机制是介导免疫细胞杀伤,双特异性抗体有两条抗原结合臂,其中一条与靶抗原结合,另一条与效应细胞上的标记抗原结合,后者可以激活效应细胞,使其靶向杀伤肿瘤细胞。
4.双靶点信号阻断,发挥独特的或重叠的功能,有效防止耐药:同时结合双靶点,阻断双信号通路是双特异性抗体的另一个重要作用机制。受体络氨酸激酶(receptor tyrosine kinase,rtks)是最大的一类酶联受体,在细胞增殖过程中发挥重要的调节作用,如her家族等。rtks在肿瘤细胞表面异常高表达,导致肿瘤细胞恶性增生,因此也是肿瘤治疗的重要靶点。针对rtks的单靶点单克隆抗体已在肿瘤治疗中得到广泛应用,但是,肿瘤细胞可以通过转换信号通路或通过her家族成员自身或不同成员之间的同源或异源二聚体激活细胞内信号进行免疫逃逸。因此采用双特异性抗体药物同时阻断两个或多个rtks或其配体,可以减少肿瘤细胞逃逸,提高治疗效果。
5.具备更强特异性、靶向性和降低脱靶毒性:利用双特异性抗体两个抗原结合臂可以结合不同抗原的特点,两个抗原结合臂分别结合癌细胞表面2种抗原,可以有效增强抗体对癌细胞的结合特异性和靶向性,降低脱靶等副作用;
6.有效降低治疗成本:以bite为例,与传统抗体相比在组织渗透率、杀伤肿瘤细胞效率、脱靶率和临床适应症等指标方面都具有较强的竞争力,临床优势显著。特别在使用剂量方面,由于其治疗效果可以达到普通抗体的100-1000倍,使用剂量最低可将为原来的1/2000,显著降低药物治疗成本。相对于组合疗法,双特异性抗体的成本也远远低于两个单药联合治疗。
7.pd-1(cd279)最早于1992年被报道,人pd-1编码基因pdcd1位于2q37.3,全长2097bp,由6个外显子组成,翻译产物为288个氨基酸组成的pd-1前体蛋白,剪切前20个氨基酸组成的信号肽后得到成熟蛋白质。pd-1包括胞外免疫球蛋白可变区igv结构域,疏水跨膜结构域和胞内结构域,胞内尾部结构域n端itim基序包含2个磷酸化位点,c端则是一个itsm基序。pd-1是膜蛋白,属于cd28免疫球蛋白超家族,主要表达在激活后的t细胞表面,此外还在胸腺的cd4-cd8-t细胞、活化的nk细胞和单核细胞有低丰度表达。pd-1有2个配体,分别是b7蛋白家族的pd-l1(cd274,b7-h1)和pd-l2(cd273,b7-dc),pd-l1和pd-l2氨基酸序列有40%相同。两者区别主要在于表达模式不同,pd-l1组成性的低表达于apcs、非造血细胞(如血管内皮细胞、胰岛细胞)和免疫豁免部位(如胎盘、睾丸和眼睛),炎性细胞因子如i型和ii
型干扰素、tnf-α和vegf等均可以诱导pd-l1的表达。pd-l2则只在被激活的巨噬细胞和树突细胞中有表达。pd-1与pd-l1在激活的t细胞结合后,pd-1的itsm基序发生酪氨酸磷酸化,进而导致下游蛋白激酶syk和pi3k的去磷酸化,抑制下游akt、erk等通路的活化,最终抑制t细胞活化所需基因及细胞因子的转录和翻译,发挥负向调控t细胞活性的作用。
8.在肿瘤细胞中,肿瘤细胞及肿瘤微环境通过上调pd-l1表达并与肿瘤特异的cd8
t细胞表面的pd-1结合,负调控t细胞活性,抑制免疫反应。肿瘤细胞可以通过以下4种途径上调pd-l1表达:1.编码pd-l1的基因扩增(9p24.1);2.egfr、mapk、pi3k-akt信号通路激活,hif-1转录因子等可以从转录水平上调pd-l1的表达;3.eb病毒的诱导(eb病毒阳性的胃癌和鼻咽癌表现为pd-l1高表达);4.表观遗传学的调控。在肿瘤微环境中,interferon-γ等炎症因子的刺激同样可以诱导pd-l1和pd-l2的表达。炎症因子可以诱导肿瘤微环境中其他细胞,包括巨噬细胞、树突状细胞和基质细胞表达pd-l1和pd-l2,而能够识别肿瘤抗原的肿瘤浸润性t细胞能够分泌interferon-γ,进而诱导pd-l1表达上调,这一过程被称为“适应性免疫抵抗”,肿瘤细胞通过这一机制可以实现自我保护。有越来越多的证据表明肿瘤利用pd-1依赖的免疫抑制免疫逃避。在各种实体瘤和血液系统恶性肿瘤种均已经发现pd-l1和pd-l2的高表达。此外,pd-ls的表达与肿瘤细胞的不良预后之间具有很强相关性,证明了包括食道癌、胃癌、肾癌、卵巢癌、膀胱癌、胰腺癌和黑色素瘤等。
9.在过去的几十年里,美国和许多发达国家的胃癌发病率和死亡率都大幅度下降。然而,起源于胃(gc)、食道或食管胃交界处癌(gej)仍然是一个主要的全球健康问题,特别是在低收入和中等收入国家。胃癌的全球发病率显示出广泛的地理差异,高发病率和低发病率区域之间的差异为15至20倍。在全球范围内,2018年估计有103万例胃癌导致了超过78万人死亡,使胃癌成为世界上第五大最常诊断的癌症和第三大癌症相关死亡原因,但是在西欧、澳大利亚和北美,胃癌是罕见的癌症之一。2019年,估计美国将有27510人被确诊,11140人死于这种疾病,在美国是第15大最常见的确诊癌症和第15大癌症相关死亡原因。胃癌的最高发病率发生在东亚、南美和中美洲以及东欧,其中东亚三国(中国、日本和韩国)的发病率特别高。在中国,胃癌是男性最常见的癌症,也是导致癌症相关死亡率的主要原因。紧密连接蛋白-18a2(claudin18.2)在近年来被视为消化道肿瘤、特别是胃癌的肿瘤特异性抗原而愈发受到重视。
10.紧密连接(tightjunction,tj)在细胞间物质流转中起到关键作用,还通过阻断膜蛋白和膜脂径向扩散维持细胞极性,此外还参与招募调控细胞增殖、分化和运动的信号分子。紧密连接由紧密连接蛋白(claudin,cldn)形成,而紧密连接蛋白家族由超过20种蛋白分子组成,其成员均含有一个四次跨膜的结构域和相似的氨基酸序列,但组织分布具有一定特异性。cldn在调控细胞旁路的选择性渗透中起到关键作用,cldn2和cldn15参与形成阳离子通道和阳离子孔隙,cldn4/7/10则参与构成阴离子通道和孔隙。cldn蛋白的差异性表达被认为与多种癌症相关联。cldn1和cldn7在侵入性乳腺癌、前列腺癌和食管癌中发生下调,而在宫颈癌、结肠癌、食管癌、胃癌等多种癌症中发现cldn3/4发生不同程度上调。sahin等发现在正常组织中,cldn18的isoform 2亚型(claudin18.2)只在胃黏膜的分化后表皮细胞中表达,在胃干细胞区域则未见表达,但在原发性胃癌及其转移灶中均发现异常高表达。在胰腺癌、食管癌和肺癌中也有claudin18.2高表达的报道。由于claudin18.2定位于细胞膜表面,其生物学功能和特征决定了它是一种理想的治疗靶点,而近年来针对该靶点也有
单抗面世。
技术实现要素:
11.本发明的目的在于提供一种靶向人claudin和人pdl1蛋白的双特异抗体及其应用。
12.本发明采用了如下技术方案:
13.一种靶向人claudin18.2和人pdl1蛋白的双特异抗体,其特征在于,包括:
14.抗人claudin18.2的抗体部分和抗pd-l1抗体部分。
15.进一步,本发明的靶向人claudin18.2和人pdl1蛋白的双特异抗体,其特征在于:
16.序列如:seq id no:59、seq id no:60、seq id no:61、seq id no:62、seq id no:63、seq id no:64、seq id no:65或seq id no:66所示。
17.进一步,本发明的靶向人claudin18.2和人pdl1蛋白的双特异抗体,其特征在于:
18.所述抗人claudin18.2抗体部分结合人claudin18.2蛋白胞外区,抗人claudin18.2抗体部分的序列如:seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13、seq id no:14、seq id no:15、seq id no:16、seq id no:17、seq id no:18、seq id no:19、seq id no:20、seq id no:21、seq id no:22、seq id no:23、seq id no:24、seq id no:25、seq id no:26、seq id no:27、seq id no:28、seq id no:29、seq id no:30、seq id no:31、seq id no:32、seq id no:33或seq id no:34所示。
19.进一步,本发明的靶向人claudin18.2和人pdl1蛋白的双特异抗体,其特征在于:
20.抗pd-l1抗体,其序列如seq id no:49、seq id no:50、seq id no:51、seq id no:52、seq id no:53或seq id no:54所示。
21.上述任一项所述的双特异抗体,在制备治疗癌症、感染或免疫调节疾病的药物中的应用。
22.上述任一项所述的双特异抗体,在制备抑制肿瘤生长的药物中的应用。
23.进一步,本发明的应用,其特征在于:
24.所述癌症或肿瘤选自下组或部位:结直肠、乳腺、卵巢、胰腺、胃、食管、前列腺、肾、宫颈、骨髓癌、淋巴癌、白血病、甲状腺、子宫内膜、子宫、膀胱、神经内分泌、头部颈部、肝、鼻咽、睾丸、小细胞肺癌、非小细胞肺癌、黑素瘤、基底细胞皮肤癌、鳞状细胞皮肤癌、隆突性皮肤纤维肉瘤、梅克尔细胞癌、成胶质细胞瘤、胶质瘤、肉瘤、间皮瘤,和骨髓增生异常综合症。
25.发明的有益效果:本发明同时靶向claudin18.2和pd-l1的双特异性抗体,该双特异性抗体分子可以高效率靶向claudin18.2和pd-l1。本发明能够提高表达claudin18.2肿瘤的治疗效果。该双特异性抗体在结合人claudin18.2蛋白的同时,也可以阻断pd-1/pd-l1的结合,既能在先天性免疫中起到激活nk细胞杀伤肿瘤细胞,又能在获得性免疫重起到促进杀伤性t淋巴细胞对肿瘤的杀伤作用。该双特异性抗体比单独使用抗claudin18.2抗体具有更好的抗肿瘤疗效。
附图说明
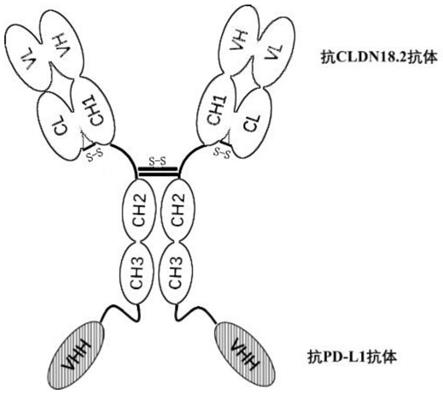
26.图1是抗cldn18.2/抗pd-l1双特异抗体分子的结构示意图。
27.图2是人源化claudin18.2抗体活性鉴定采用elisa鉴定的第一组抗体的结果。
28.图3是人源化claudin18.2抗体活性鉴定采用elisa鉴定的第二组抗体的结果。
29.图4是人源化claudin18.2抗体活性采用elisa鉴定的第三组抗体的结果。
30.图5是人源化claudin18.2抗体活性采用elisa鉴定的第四组抗体的结果。
31.图6是人源化claudin18.2抗体活性采用elisa鉴定的第五组抗体的结果。
32.图7人源化claudin18.2抗体活性采用facs鉴定的第一组抗体的结果。
33.图8人源化claudin18.2抗体活性采用facs鉴定的第二组抗体的结果。
34.图9人源化claudin18.2抗体活性采用facs鉴定的第三组抗体的结果。
35.图10人源化claudin18.2抗体活性采用facs鉴定的第四组抗体的结果。
36.图11人源化claudin18.2抗体活性采用facs鉴定的第五组抗体的结果。
37.图12是人源化claudin18.2抗体adcc的结果。
38.图13是人源化claudin18.2抗体cdc的结果。
39.图14是人源化claudin18.2抗体在免疫缺陷小鼠cb.17-scid模型中的体内药效结果。
40.图15是人源化抗pd-l1单域抗体活性鉴定binding-elisa的结果。
41.图16是人源化抗pd-l1单域抗体活性鉴定blocking-elisa的结果。
42.图17是抗cldn18.2/抗pd-l1双特异抗体表达纯化第一个抗体的结果。
43.图18是抗cldn18.2/抗pd-l1双特异抗体表达纯化第二个抗体的结果。
44.图19是抗cldn18.2/抗pd-l1双特异抗体表达纯化第三个抗体的结果。
45.图20是抗cldn18.2/抗pd-l1双特异抗体表达纯化第四个抗体的结果。
46.图21是抗cldn18.2/抗pd-l1双特异抗体活性鉴定binding-elisa的结果。
47.图22是抗cldn18.2/抗pd-l1双特异抗体活性鉴定pd-l1/pd-1 blocking-elisa的结果。
48.图23是抗cldn18.2/抗pd-l1双特异抗体活性鉴定pd-l1/cd80 blocking elisa的结果。
49.图24抗cldn18.2/抗pd-l1双特异抗体活性鉴定中elisa检测cldn18.2活性的结果。
50.图25抗cldn18.2/抗pd-l1双特异抗体pd-l1功能活性鉴定(混合淋巴细胞反应mlr中候选分子cho14对t细胞激活后产生的细胞因子ifnγ的浓度依赖结果。
51.图26抗cldn18.2/抗pd-l1双特异抗体pd-l1功能活性鉴定(混合淋巴细胞反应mlr中候选分子cho14对t细胞激活后产生的细胞因子il-2的浓度依赖结果。
52.图27抗cldn18.2/抗pd-l1双特异抗体pbmc介导的细胞杀伤实验的结果。
53.图28抗cldn18.2/抗pd-l1双特异抗体在免疫靶点人源化转基因小鼠c57bl/6-hpdl1模型mc38-hpdl1-mclaudin18.2中的体内药效评估的结果。
54.图29抗cldn18.2/抗pd-l1双特异抗体在免疫系统人源化小鼠pbmc engrafted-ncg模型hcc827-hclaudin18.2中的体内药效评估的结果。
具体实施方式
55.以下结合具体实施方式来详细说明本发明的技术方案。
56.下列实施方式中中未注明具体条件的实验方法,是按照常规条件,或按照原料或商品制造厂商所建议的条件。或者生物技术教科书如分子克隆,实验室手册,冷泉港实验室,当代分子生物学方法,细胞生物学等记载的实验方法进行。未注明具体来源的试剂,为通过商业途径购买的常规试剂。
57.实施例1:抗claudin18.2杂交瘤单克隆抗体的人源化
58.通过比对imgt人类抗体重轻链可变区种系基因数据库和moe软件,分别挑选与qp190191、qp192193、qp199200、qp201202、qp207208同源性高的重轻链可变区种系基因作为模板,将鼠源抗体的cdr分别移植到相应的人源模板中,形成次序为fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4的可变区序列。再选择一些重要的氨基酸残基做回复突变组合。其中氨基酸残基由kabat编号系统确定并注释。
59.1.抗claudin18.2抗体人源化分子克隆
60.设计引物pcr搭建各人源化抗体vh/vk基因片段,再与带信号肽及恒定区基因(ch1-fc/cl)片段的表达载体pqd进行同源重组,构建抗体全长表达载体vh-ch1-fc-pqd/vk-cl-pqd。
61.利用在线软件dnaworks(v3.2.2)(http://helixweb.nih.gov/dnaworks/)设计多条引物合成vh/vk含重组所需基因片段:5
’-
30bp信号肽 vh/vk 30bp ch1/cl-3’。按照takara公司primer star gxl dna聚合酶操作说明书,用上面设计的多条引物,分两步pcr扩增得到vh/vk含重组所需基因片段。表达载体pqd(带信号肽及恒定区基因(ch1-fc/cl)片段)构建及酶切,利用限制性内切酶bsmbi,识别序列与酶切位点不同的特性设计构建表达载体pqd(带信号肽及恒定区基因(ch1-fc/cl)片段)。bsmbi酶切载体,切胶回收备用。重组构建表达载体vh-ch1-fc-pqd/vk-cl-pqd.vh/vk含重组所需基因片段与bsmbi酶切回收表达载体pqd按3:1比例分别加入dh5h感受态细胞中,0℃冰浴30min,42℃热击90s,加入5倍体积lb介质,37℃孵育45min,涂布lb-amp平板,37℃培养过夜,挑取单克隆送测序得到各目的克隆。
62.各克隆人源化设计轻重链可变区序列及蛋白表达编号如下所示,此表中所有抗体轻链采用kappa轻链恒定区cl(seq id no:67),抗体重链采用人igg1恒定区(seq id no:68):
63.表1:人源化设计轻重链可变区序列及蛋白表达编号
[0064][0065]
同时设计克隆表达人源化前嵌合抗体及对照抗体如下表所示,此表中所有抗体轻
链采用kappa轻链恒定区cl,抗体重链采用人igg1恒定区:
[0066]
表2:人源化前嵌合抗体及对照抗体(imab362为对照抗体,对应蛋白编号qp024025)
[0067]
杂交瘤克隆编号蛋白编号重链质粒编号序列编号 轻链质粒编号序列编号175d10(imab362)qp024025qd025seq d no:36 qd024seq d no:3536a2qp190191qd191seq d no:38 qd190seq d no:3740f1qp192193qd193seq d no:40 qd192seq d no:3943c11qp199200qd200seq d no:42 qd199seq d no:4144c6qp20122qd202seq d no:44 qd201seq d no:4351a3qp207208qd208seq id no:46 qd207seq d no:45phage screeninaqp11151116qd1115seq id no:48 qd1116seq id no:47
[0068]
2.抗claudin18.2抗体人源化蛋白表达
[0069]
293e细胞培养密度维持在0.2-3
×
106/ml之间,使用维护阶段培养基(gibco freestyle 293 expression medium)进行培养,转染前一天将待转染细胞离心换液,调整细胞密度为0.5-0.8
×
106/ml。转染当天,293e细胞密度为1-1.5
×
106/ml。准备质粒和转染试剂pei,需转染质粒量为100ug/100ml细胞,使用pei和质粒的质量比为2∶1。将质粒和pei进行混匀,静置15min,不宜超过20min。将质粒和pei混合物缓慢加入293e的细胞中,放入8%c02,120rpm,37℃的摇床中培养,转染第五天,水平离心机4700rpm离心20min收集细胞上清。
[0070]
3.抗claudin18.2抗体人源化蛋白纯化
[0071]
protein a亲和层析纯化
[0072]
用平衡液过柱,至少3cv,实际体积20m1,确保最终仪器中流出的溶液ph和电导与平衡液一致,流速1ml/min;将离心后培养液上清过柱,上样40m1,流速0.33ml/min;用平衡液过柱,至少3cv,实际体积20ml,确保最终仪器中流出的溶液ph和电导与平衡液一致,流速0.33ml/min;用洗脱液过柱,uv280上升至15mau时开始收集洗脱峰(pac-ep),uv280下降至15mau时停止收集,流速1ml/min。样品收集完成后,用ph调节液将pac-ep调至中性。
[0073]
4.人源化claudin18.2抗体活性鉴定(chos-cldn18.2 cell-elisa)
[0074]
检测试剂:脱脂奶粉(bd,232100),pbs(生工,b548117-0500);hrp-anti human igg(h l)(jackson,109-035-088);tmb(洛阳佰奥通实验材料中心,c060201);elisa板(costa,9018)1
×
pbs缓冲液:称取nacl 8.00g、kc1 0.20g、na2hpo4
·
12h202.9g、kh2po4 0.2g至800ml ddh2o中溶解,充分溶解后定容至1l,调节ph至7.4,高温灭菌备用。或购买商品化10
×
、20
×
的pbs溶液稀释至1
×
pbs缓冲液使用。封闭液:称取5g的奶粉至pbs中,封闭液需现配现用。终止液(1mol/lh2so4):取109ml 98%的浓h2so4缓慢滴加至2000mlddh2o中。tmb 37℃显色10min,置于摇床中(120rpm),100ul/孔;
[0075]
实验步骤:种2e5/孔细胞chos-cld18.2-16-2于u型板,冰pbs洗一遍,1200rpm,离心3min。vcd:1.21e6,实际铺165ul/孔;清洗结束后,按200μl/孔加入封闭液,冰上孵育1h。封闭结束后,1200rpm离心3min后,甩掉上清,孵育cld18.2对照抗体14-1和样品,按照100ug/ml 1∶2稀释比例,共稀释12个梯度,最后设置一个空白对照,按照100ug/ml、33.33333333ug/ml、11.11111111ug/ml、3.703703704ug/ml、1.234567901ug/ml、0.411522634ug/ml、0.137174211ug/ml、0.045724737ug/ml、0.015241579ug/ml、0.005080526ug/ml、0.001694ug/ml、0ug/ml加入100ul/孔充分混匀后,冰上孵育2h,冰pbs
洗3遍;加酶标抗体:孵育hrp-anti human igg(h l)抗体,按照1:10000稀释比例,100ul/孔,充分混匀后,冰上1h,冰pbs洗3遍。加底物显色液:按100μl/孔用量加底物显色液tmb,置于摇床中,200rpm,35℃避光显色10min。
[0076]
终止:显色完成后,按100μl/孔用量快速加入终止液终止反应。检测:3500rpm离心5min后,取120ul上清转移至elisa板上,在酶标仪上,测其a450nm的od值,使用graphpadprism软件分析结果:如图2、图3、图4、图5和图6所示。
[0077]
5.人源化claudin18.2抗体活性鉴定(chos-cldn18.2 facs)
[0078]
分别收集细胞chos,chos-cldn18.2,2e5/孔,1000r离心5min,3%bsa/pbs buffer200ul/孔封闭60min,4℃。抗体20ug/ml初始浓度,1:4稀释,4℃孵育60min。pbs洗2遍,孵育pe-anti-human fc(1:200)50ul/孔,4℃孵育30min,pbs洗3遍,pbs重悬,facs结果如下:表3、表4、表5、表6、表7和图7、图8、图9、图10和图11所示。
[0079]
表3:人源化claudin18.2抗体活性鉴定facs的第一组抗体的结果
[0080][0081]
表4:人源化claudin18.2抗体活性鉴定facs的第二组抗体的结果
[0082][0083]
表5:人源化claudin18.2抗体活性鉴定facs的第三组抗体的结果
[0084][0085]
表6:人源化claudin18.2抗体活性鉴定facs的第四组抗体的结果
[0086][0087]
表7:人源化claudin18.2抗体活性鉴定facs的第五组抗体的结果
[0088][0089]
6.人源化claudin18.2抗体特异性鉴定
[0090]
流式细胞荧光分选技术facs鉴定本发明的人源化抗体结合claudin18.2不结合claudin18.1的特异性
[0091]
分别收集细胞chos,chos-cldn18.2,chos-cldn18.1,2e5/孔,1000r离心5min,3%bsa/pbs buffer200ul/孔封闭60min,4℃。抗体20ug/ml初始浓度,1:4稀释,4℃孵育60min。pbs洗2遍,孵育pe-anti-human fc(1:200)50ul/孔,4℃孵育30min,pbs洗3遍,pbs重悬,facs读数的平均荧光值如下表所示:
[0092]
表8:facs读数的平均荧光值
[0093][0094]
7.人源化claudin18.2抗体adcc(抗体依赖性细胞介导的细胞毒作用)
[0095]
准备target cell(hek293-cldn18.2):hek293-cldn18.2用胰酶消化,1000rpm 5min。换新鲜培养基铺96孔板,20000cell/孔,37度5%co2孵育过夜。准备抗体:用培养基1∶5梯度稀释抗体(80ug/ml0.000512ug/ml,0ug/ml)10个浓度。吸掉96孔板中的培养基,加入上面稀释各浓度的抗体70ul/孔,每个浓度设复孔。准备pbmc:将第一天复苏的pbmc离心,用培养基重悬,计数。按pbmc:target cell=50∶1,加入上面的孔板中70ul/孔,37度孵育4小时。max lysis well加入15ul lysis缓冲液(1%triton-x100),37度孵育10min。
[0096]
准备ldh试剂:96孔板离心200g,5分钟,转移上清100ul/孔到一块新的透明的96孔板上。取出ldh细胞毒性检测试剂盒(cayman,10008882-480well),配制反应液,加入100ul/孔,37温和震荡30分钟。吸收490nm读值,按照公式con(ug/ml)%maximal signal=(test-control)/(max-control)-con(0ug/ml)%maximal signal分析数据。如图12、表9和表10所示。
[0097]
表9:490nm读值
[0098]
od490conc.(ug/ml)4081.60.320.0640.01280.002560.0005120.00010240max qp143314371.0121.0051.0120.9560.8560.7520.5960.5610.550.561.21 qp144014450.980.9190.8560.9070.8610.7260.5730.5570.4630.5271.17 qp146114630.8440.9470.9030.9080.8350.6780.5670.5160.5130.5221.144 qp111511161.1760.9270.8850.8630.7710.7520.580.5210.5210.5081.321 qp0240250.7940.790.7910.7770.6750.5610.4870.4790.4480.4651.141 target ab0.4880.4180.3580.3610.2720.2530.2740.2610.2740.279 [0099]
表10:杀伤百分率
[0100]
conc.(ug/ml)qp14331437qp14401445qp14611463qp11151116qp0240254052.32%47.80%28.62%75.45%21.57%853.76%42.72%46.32%43.75%26.16%1656.36%37.77%43.37%4122%30.02%0.3249.58%43.72%43.84%38.46%28.17%0.06441.55%42.09%39.27%32.36%21.98%0.012831.27%28.52%23.43%31.27%11.04%0.0025613.30%10.80%10.15%11.56%1.49%0.00051210.46%10.03%5.65%6.19%1.70%0.00010248.31%-1.11%4.30%5.17%-2.74%09.02%5.43%4.88%3.36%-1.33%ec500.016150.0082020.011480.0071640.01562
[0101]
8.人源化claudin18.2抗体cdc(补体依赖的细胞毒性)
[0102]
试剂:细胞hek293-hcldn18.2-h11,补体:normal human serum complement(quidel,a113),抗体:qp024025(imab362),qp14631461来自本实施例中合成。
[0103]
实验步骤:
[0104]
铺细胞/培养基:设置背景对照组culture media background,即只加入培养基40ul/孔,设置最大释放组maximum ldh release,即加入40ul靶细胞后,检测前45min加入12ul lysis solution。设置体积矫正组volume correction,即加入培养基40ul/孔;设置ldh阳性对照组,即1ul阳性对照涡旋后,进行5000倍(5ml)稀释,稀释液为pbs 1%bsa。可以以10倍梯度稀释。设置实验组experimental,即加入40ul/孔target cell。加入补体 抗体mix:加入20%补体(用细胞培养基稀释),40ul/孔,对照组和实验组都要加入。37℃,5%co2培养细胞,1h15min后,加入12ul/孔lysis solution至最大释放组和体积矫正组。继续37℃培养45min后,ldh检测试剂盒检测,490nm吸光值读数,应在加入终止液stop solution后1h内完成读数。计算:实验组去除背景对照组,最大释放组去除体积矫正组,公式如下:percent cytotoxicity=100*od490(experimental ldh release)/od490(maximum ldh release)
[0105]
cdc结果如图13所示。
[0106]
9.人源化claudin18.2抗体在免疫缺陷小鼠cb.17-scid模型hek293-hclaudin18.2中的体内药效
[0107]
实验方法:收集对数生长期稳定表达人claudin18.2(hclaudin18.2)的稳转细胞株hek293-hclaudin18.2细胞,用pbs缓冲液调整细胞浓度为5
×
107/ml,接种0.1ml(1∶1 matrigel)细胞悬液于cb-17scid小鼠右侧胁腹部皮下。观察接种后小鼠并监测肿瘤的生
长,在接种当天小鼠体重进行分组并给药观察。
[0108]
实验结果:如图14和表11所示。
[0109]
表11:肿瘤体积
[0110][0111]
待测分子为人源化claudin18.2抗体qp14331437和qp14611463,阳性对照抗体为imab362(qp024025)。给药方案10mpk
×
10,q2d,i.v.给药。给药后第37天pbs组(阴性对照组)平均肿瘤体积达到1091.34mm3,qp14331437组平均肿瘤体积260.65mm3,tgi=76.12%,qp14611463组平均肿瘤体积225.01mm3,tgi=79.38%,imab362组平均肿瘤体积324.19mm3,tgi=70.29%;该三组与pbs组的肿瘤体积均有统计学意义极显著差异(t检验,p<0.01)。
[0112]
该实验说明在hek293-cldn18.2模型中我们的人源化claudin18.2抗体均表现出优于对照抗体imab362的抗肿瘤能力的趋势。
[0113]
实施例2:抗pd-l1单域抗体的人源化
[0114]
通过比对imgt人类抗体重轻链可变区种系基因数据库和moe软件,分别挑选与qp1162、qp1166同源性高的重轻链可变区种系基因作为模板,将鼠源抗体的cdr分别移植到相应的人源模板中,形成次序为fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4的可变区序列。再选择一些重要的氨基酸残基做回复突变组合。其中氨基酸残基由kabat编号系统确定并注释。
[0115]
1.抗pd-l1单域抗体人源化分子克隆
[0116]
设计引物pcr搭建各人源化抗体vh基因片段,再与带信号肽及恒定区基因(fc)片段的表达载体pqd进行同源重组,构建抗体全长表达载体vh-fc-pqd。
[0117]
利用在线软件dnaworks(v3.2.2)(http://helixweb.nih.gov/dnaworks/)设计多条引物合成vh/vk含重组所需基因片段:5
’-
30bp信号肽 vh 30bp fc-3’。按照takara公司primer star gxl dna聚合酶操作说明书,用上面设计的多条引物,分两步pcr扩增得到vh/vk含重组所需基因片段。带信号肽及恒定区基因(fc)片段的表达载体pqd的构建及酶切,利用限制性内切酶,如bsmbi,识别序列与酶切位点不同的特性设计构建带信号肽及恒定区基因(fc)片段的表达载体pqd。bsmbi酶切载体,切胶回收备用。重组构建表达载体vh-fc-pqd。vh含重组所需基因片段与bsmbi酶切回收表达载体pqd(带信号肽及恒定区基因(fc)片段)按3:1比例分别加入dh5h感受态细胞中,0℃冰浴30min,42℃热击90s,加入5倍体积lb介质,37℃孵育45min,涂布lb-amp平板,37℃培养过夜,挑取单克隆送测序得到各目的克隆。
[0118]
各克隆人源化设计轻重链可变区序列及蛋白表达编号如下所示,此表中抗体在其c端融合人igg1-fc恒定区:
[0119]
表12:qp1162和qp1166人源化设计
[0120][0121]
同时设计克隆表达人源化前嵌合抗体及对照抗体如下表所示:
[0122]
表13:人源化前嵌合抗体及对照抗体
[0123][0124]
2.抗pd-l1单域抗体人源化蛋白表达
[0125]
293e细胞培养密度维持在0.2-3
×
106/ml之间,维护阶段培养基(gibco freestyle 293 expression medium)进行培养,转染前一天将待转染细胞离心换液,调整细胞密度为0.5-0.8
×
106/ml。转染当天,293e细胞密度为1-1.5
×
106/ml。准备质粒和转染试剂pei,需转染质粒量为100ug/100ml细胞,使用pei和质粒的质量比为2:1。将质粒和pei进行混匀,静置15min,不宜超过20min。将质粒和pei混合物缓慢加入293e的细胞中,放入8%co2,120rpm,37℃的摇床中培养,转染第五天,水平离心机4700rpm离心20min收集细胞上清。
[0126]
3.抗pd-l1单域抗体人源化蛋白纯化
[0127]
proteina亲和层析纯化
[0128]
用平衡液过柱,至少3cv,实际体积20ml,确保最终仪器中流出的溶液ph和电导与平衡液一致,流速1ml/min;将离心后培养液上清过柱,上样40ml,流速0.33ml/min;用平衡液过柱,至少3cv,实际体积20ml,确保最终仪器中流出的溶液ph和电导与平衡液一致,流速0.33ml/min;用洗脱液过柱,uv280上升至15mau时开始收集洗脱峰(pac-ep),uv280下降至15mau时停止收集,流速1ml/min。样品收集完成后,用ph调节液将pac-ep调至中性。
[0129]
4.人源化抗pd-l1单域抗体活性鉴定(binding-elisa)
[0130]
包被抗体qp1162/qp320/qp321/qp322/qp1166/qp323/qp324/qp3250.75ug/ml,qp118011811.5ug/ml 50ul/孔,4℃过夜。pbs 3times。封闭:3%bsa250ul/孔,rt 1h。分别孵育2ug/ml biotin qp004.3(biotin-pdl1-fc)1:4稀释不同浓度,rt 1h。pbst 3 times,pbs 3 times。孵育二抗:hrp-strepavidin(1:5000)50ul/孔,pbst 6 times,pbs 3 times。显色:tmb 100ul/孔,显色10min。2m h2so4 50ul/孔终止。结果如图15和表14所示。
[0131]
表14:人源化抗pd-l1单域抗体活性鉴定(binding-elisa)结果
[0132] qp11621162-v11162-v21162-v3qp11661166-v11166-v21166-v3 conc.(ug/ml)qp1162qp320qp321qp322qp1166qp323qp324qp325qp118011812.00003.43660.22970.22513.00423.41432.85640.41303.42163.4911
0.50003.44820.14190.13782.78613.28051.87730.20123.20903.47780.16673.25970.09570.08362.78113.13430.78930.12853.10593.71960.05562.83550.08430.07562.70083.23270.31410.08822.78283.23500.01852.50160.07920.09602.07152.56600.18100.10702.12462.57470.00621.53960.10760.12011.27351.54640.16630.15021.31891.94960.00210.52320.11400.15610.41070.56050.25770.14140.59780.87020.00070.12140.12480.15620.17560.21690.18100.19170.18170.1986
[0133]
5.人源化抗pd-l1单域抗体活性鉴定(blocking-elisa)
[0134]
6.包被蛋白qp1138(pd1-fc)2ug/ml 50ul/孔,4℃过夜。pbs 3 times。封闭:3%bsa 250ul/孔,rt 1h。分别配制2ug/ml biotin qp004.3(biotin-pdl1-fc)和不同浓度qp1120 15ug/m1,qp11801181 30ug/ml,1∶3稀释,等体积混匀,rt 1h。pbst 3 times,pbs 3 times。孵育二抗:hrp-strepavidin(1∶5000)50u1/孔,pbst 6 times,pbs 3 times。显色:tmb 100ul/孔,显色10min。2m h2so4 50ul/孔终止。结果如图16和表15所示。
[0135]
表15:人源化抗pd-l1单域抗体活性鉴定(blocking-elisa)
[0136][0137]
7.人源化抗pd-l1单域抗体spr鉴定亲和力
[0138]
表面等离子体共振(spr)检测亲和力
[0139]
通过biacore t200(ge)测定待检分子与蛋白人pd-l1及cynopd-l1的亲和力
[0140]
抗原信息如下:
[0141]
表16:蛋白编号
[0142]
蛋白编号蛋白描述货号qpp09.1pd-l1 protein,human,recombinant(his tag)sinobiologic,10084-h08hqpp10.1pd-l1 protein,cynomolgus,recombinant(his tag)sinobiologic,90251-c08h
[0143]
表17:spr亲和力结果
[0144][0145]
实施例3:抗cldn18.2/抗pd-l1双特异抗体
[0146]
设计抗cldn18.2/抗pd-l1双特异抗体分子,形式如图1所示。
[0147]
1.抗cldn18.2/抗pd-l1双特异抗体分子克隆
[0148]
设计引物pcr搭建各人源化抗体vh基因片段,再与表达载体pqd(带信号肽及恒定区基因片段)进行同源重组,构建抗体全长表达载体pqd。
[0149]
抗cldn18.2/抗pd-l1双特异抗体序列及蛋白表达编号如下所示:
[0150]
表18:抗cldn18.2/抗pd-l1双特异抗体序列及蛋白表达编号
[0151][0152]
2.抗cldn18.2/抗pd-l1双特异抗体蛋白表达
[0153]
293e细胞培养密度维持在0.2-3
×
106/ml之间,维护阶段培养基(gibco freestyle 293 expression medium)进行培养,转染前一天待转染细胞离心换液,调整细胞密度为0.5-0.8
×
106/ml。转染当天,293e细胞密度为1-1.5
×
106/ml。准备质粒和转染试剂pei,需转染质粒量为100ug/100ml细胞,使用pei和质粒的质量比为2:1。将质粒和pei进行混匀,静置15min,不宜超过20min。将质粒和pei混合物缓慢加入293e的细胞中,放入8%co2,120rpm,37℃的摇床中培养,转染第五天,水平离心机4700rpm离心20min收集细胞上清。
[0154]
3.抗cldn18.2/抗pd-l1双特异抗体表达纯化
[0155]
proteina亲和层析纯化
[0156]
用平衡液过柱,至少3cv,实际体积20ml,确保最终仪器中流出的溶液ph和电导与平衡液一致,流速1ml/min;将离心后培养液上清过柱,上样40ml,流速0.33ml/min;用平衡液过柱,至少3cv,实际体积20ml,确保最终仪器中流出的溶液ph和电导与平衡液一致,流速0.33ml/min;用洗脱液过柱,uv280上升至15mau时开始收集洗脱峰(pac-ep),uv280下降至15mau时停止收集,流速1ml/min。样品收集完成后,用ph调节液将pac-ep调至中性。
[0157]
4个抗cldn18.2/抗pd-l1双特异抗体经过proteina纯化,sec纯化,浓缩,再跑sec测其纯度一系列评估,总表如下表所示:
[0158]
表19:sec纯度
[0159][0160]
sec纯度鉴定由hplc完成,表中4个分子图谱如下所示:如图17、图18、图19和图20所示。qp3691433如图17,qp3701440纯化如图18,qp3711461纯化如图19,qp3721116纯化如图20。
[0161]
4.抗cldn18.2/抗pd-l1双特异抗体活性鉴定(pd-l1 binding)
[0162]
pd-l1 binding elisa:
[0163]
包被抗体qp322 0.75ug/ml,qp11801181 1.5ug/ml,qp3691433,qp3701440,qp3711461,qp3721116 50ul/孔,4℃过夜。pbs 3 times。封闭:3%bsa 250ul/孔,rt 1h。分别孵育1ug/ml biotin qp004.3(biotin-pdl1-fc)1:5稀释不同浓度,rt 1h。pbst 6 times,pbs 3 times。孵育二抗:hrp-strepavidin(1:5000)50ul/孔,pbst 6 times,pbs 3 times。显色:tmb 100ul/孔,显色10min。2m h2so4 50ul/孔终止。结果如图21和表20所示。
[0164]
表20:pd-l1 binding elisa
[0165][0166]
5.抗cldn18.2/抗pd-l1双特异抗体活性鉴定(pd-l1/pd-1 blocking)
[0167]
pd-l1/pd-1 blocking elisa
[0168]
包被:抗体qp1138 2ug/ml 50ul/孔,4℃过夜。pbs 3 times。封闭:3%bsa 250ul/孔,rt 1h。分别配制2ug/ml biotin qp004.3(biotin-pdl1-fc)和不同浓度qp322 15ug/ml,qp11801181 30ug/ml,qp3691433,qp3701440,qp3711461,qp3721116 36ug/ml,1:3稀释,等体积混匀,rt 1h。pbst 3 times,pbs 3 times。孵育二抗:hrp-strepavidin(1:5000)50ul/孔,pbst 3 times,pbs 3 times。显色:tmb 100ul/孔,显色10min。2m h2so4 50ul/孔
终止。结果如图22和表21所示。
[0169]
表21:pd-l1/pd-1 blocking elisa结果
[0170][0171]
6.抗cldn18.2/抗pd-l1双特异抗体活性鉴定(pd-l1/cd80 blocking)
[0172]
pd-l1/cd80 blocking elisa
[0173]
包被cd80-fc 4ug/ml,4℃过夜。pbs洗3遍,5%脱脂奶粉封闭,rt 1h。孵育终浓度0.5ug/ml biotin-qp004 cho14(10ug/ml,1:5稀释),rt 1h。pbst洗5遍。hrp-strepavidin(1:5000),pbst洗6遍,pbs洗3遍。tmb显色。注:cho14蛋白为qp3711461蛋白用cho细胞表达。结果如图23和表22所示。
[0174]
表22:pd-l1/cd80 blocking elisa结果
[0175][0176]
7.抗cldn18.2/抗pd-l1双特异抗体活性鉴定(elisa检测cldn18.2活性)
[0177]
检测试剂:脱脂奶粉(bd,232100),pbs(生工,b548117-0500);hrp-anti human igg(h l)(jackson,109-035-088);tmb(洛阳佰奥通实验材料中心,c060201);elisa板(costa,9018)1
×
pbs缓冲液:称取nacl 8.00g、kcl 0.20g、na2hpo4
·
12h20 2.9g、kh2po4 0.2g至800ml ddh2o中溶解,充分溶解后定容至1l,调节ph至7.4,高温灭菌备用。或购买商品化10
×
、20
×
的pbs溶液稀释至1
×
pbs缓冲液使用。封闭液:称取5g的脱脂奶粉至pbs中,封闭液需现配现用。终止液(1mol/lh2so4):取109ml 98%的浓h2so4缓慢滴加至2000ml ddh2o中。tmb 37℃显色10min,置于摇床中(120rpm),100ul/孔;
[0178]
实验步骤:种2e5/孔细胞chos-cld18.2-16-2于u型板,冰pbs洗一遍,1200rpm,离
心3min;。vcd:1.21e6,实际铺165ul/孔;清洗结束后,按200μl/孔加入封闭液,冰上孵育1h。封闭结束后,1200rpm离心3min后,甩掉上清,孵育cho14样品,按照100ug/ml 1:2稀释比例,共稀释12个梯度,最后设置一个空白对照,按照100ug/ml、33.33333333ug/ml、11.11111111ug/ml、3.703703704ug/ml、1.234567901ug/ml、0.411522634ug/ml、0.137174211ug/ml、0.045724737ug/ml、0.015241579ug/ml、0.005080526ug/ml、0.001694ug/ml、0ug/ml加入100ul/孔充分混匀后,冰上孵育2h,冰pbs洗3遍;加酶标抗体:孵育hrp-anti human igg(h l)抗体,按照1:10000稀释比例,100ul/孔,充分混匀后,冰上1h,冰pbs洗3遍。加底物显色液:按100μl/孔用量加底物显色液tmb,置于摇床中,200rpm,35℃避光显色10min。
[0179]
终止:显色完成后,按100μl/孔用量快速加入终止液终止反应。检测:3500rpm离心5min后,取120ul上清转移至elisa板上,在酶标仪上,测其a450nm的od值,使用graphpad prism软件分析结果。
[0180]
cho14与chos-cldn18.2高表达细胞株的结合ec50为0.2653nm。证明候选分子cho14中claudin18.2抗体的体外生物学功能,结果如图24所示。
[0181]
8.抗cldn18.2/抗pd-l1双特异抗体pd-l1功能活性鉴定(混合淋巴细胞反应mlr)
[0182]
准备dc(donor1)细胞:复苏pbmc,用easysep
tm
human monocyte isolation kit(stemcell 19359)分离monocytes,加入rhgm-csf(1000u/ml)和rhil4(500u/ml),37℃培养细胞6天诱导为idc;每2-3天半换液,同时补充rhgm-csf(1000u/ml)和rhil4(500u/ml);收集细胞300x g离心5min,用加入rhgm-csf(1000u/ml)和rhil4(500u/ml)的培养基重悬,同时加入lps(1μg/ml),37℃继续培养细胞1天诱导为成熟dc;收集细胞,计数备用。准备t(donor2)细胞:复苏pbmc,用easysep
tm
human cd4 t cell isolation kit(stemcell 17952)分离cd4 tcell。准备抗体:用培养基1:5梯度稀释抗体(初始浓度10ug/ml)6个浓度。将dc细胞:t细胞为1:10的比例混合,加入不同浓度的抗体,混合培养,第2天检测培养上清中il2的表达,第5天检测培养上清中ifng的表达。
[0183]
在混合淋巴细胞反应实验中,候选分子cho14对t细胞激活后产生的细胞因子ifnγ及il-2的浓度有明显的抗体浓度依赖。证明候选分子cho14中pd-l1抗体的生物学功能。如图25和图26所示。
[0184]
9.抗cldn18.2/抗pd-l1双特异抗体pbmc介导的细胞杀伤实验
[0185]
准备target cell(hcc827-cldn18.2):hek293-cldn18.2用胰酶消化,1000rpm 5min。换新鲜培养基铺96孔板,20000cell/孔,37度5%co2孵育过夜。准备抗体:用培养基1:5梯度稀释抗体(200nm—0.000512nm,0)10个浓度。吸掉96孔板target cell的培养基,加入上面稀释各浓度的抗体70ul/孔,每个浓度设复孔。准备pbmc:将第一天复苏的pbmc离心,用培养基重悬,计数。按pbmc:target cell=50:1,加入上面的孔板中70ul/孔,37度孵育4小时。max lysis well加入15ul lysis buffer(1%triton-x100),37度孵育10min。
[0186]
准备ldh reagents:96孔板离心200g,5分钟,转移上清100ul/孔到一块新的透明的96孔板上。取出ldh cytotoxcity assaykit(cayman,10008882-480well),配制reaction solution,加入100ul/孔,37温和震荡30分钟。吸收490nm读值,按照公式con(ug/ml)%maximal signal=(test-control)/(max-control)
–
con(0ug/ml)%maximal signal分析数据。如图27、表23和表24所示。
[0187]
表23:490nm读值
[0188][0189]
表24:杀伤百分率
[0190]
conc.(nm)qp024025qp14611463qp3711461200.0000033.192%37.917%37.267%40.0000042.996%39.807%37.976%8.0000038.980%34.727%42.346%1.6000026.341%33.546%41.460%0.320006.024%17.364%27.286%0.064004.252%3.662%11.044%0.012802.953%2.244%2.658%0.002561.299%1.890%6.201%0.000512.008%-3.189%0.709%0-10.513%-12.875%0.000%
[0191]
10.抗cldn18.2/抗pd-l1双特异抗体在免疫靶点人源化转基因小鼠
[0192]
c57bl/6-hpdl1模型mc38-hpdl1-mclaudin18.2中的体内药效评估
[0193]
实验方法:取对数生长期小鼠结肠癌细胞mc38-hpdl1(tg)-mclaudin18.2(tg)细胞(该细胞过表达人的pdl1和小鼠的claudin18.2,同时敲除小鼠的pdl1),去除培养液并用pbs洗两次后接种于c57bl/6-hpdl1小鼠右侧胁腹部皮下,接种量:5
×
105/100μl/只。观察接种后小鼠并监测肿瘤的生长,接种后第8天,平均肿瘤体积达到82.85mm3时,根据肿瘤体积随机分成4组,每组9只。分组当天定义为d0天,并于d0天开始给药。
[0194]
实验结果:如图28和表25所示。
[0195]
表25:肿瘤体积
[0196][0197]
待测分子为抗cldn18.2/抗pd-l1双特异抗体qp3711461,给药剂量分别为1.5mpk、4mpk、10mpk,biw
×
3,i.v.给药。给药后第28天pbs组(阴性对照组)平均肿瘤体积达到1033.97mm3,qp3711461(1.5mpk)组平均肿瘤体积932.52mm3,tgi=12.19%,qp3711461
(4mpk)组平均肿瘤体积360.92mm3,tgi=61.81%,qp3711461(10mpk)组平均肿瘤体积294.50mm3,tgi=69.53%;4mpk组、10mpk组与pbs组的肿瘤体积均有统计学意义极显著差异(t检验,p<0.01)。
[0198]
该实验说明在免疫靶点人源化转基因小鼠的mc38-hpdl1-mclaudin18.2模型中我们的抗cldn18.2/抗pd-l1双特异抗体表现出优越的抗肿瘤能力。
[0199]
11.抗cldn18.2/抗pd-l1双特异抗体在免疫系统人源化小鼠pbmc engrafted-ncg模型hcc827-hclaudin18.2中的体内药效评估
[0200]
实验方法:取对数生长期人肺腺癌稳转细胞株hcc827-hclaudin18.2细胞(该细胞天然高表达人pdl1,过表达人claudin18.2),去除培养液并用pbs洗两次后接种于ncg小鼠右侧胁腹部皮下,接种量:5
×
106/100μl/只。观察接种后小鼠并监测肿瘤的生长,接种后第7天,平均肿瘤体积达到约150mm3时,接种人pbmc(5
×
106/100μl/只)。根据肿瘤体积随机分成4组,每组9只。分组当天定义为d0天,并于d0天开始给药。
[0201]
实验结果:如图29和表26所示。
[0202]
表26:免疫系统人源化小鼠pbmc engrafted-ncg模型hcc827-hclaudin18.2中的体内药效评估中肿瘤体积
[0203][0204]
待测分子为抗cldn18.2/抗pd-l1双特异抗体qp3711461,给药剂量分别为4mpk、10mpk,biw
×
3,i.v.给药;对照抗体分子tecentriq,给药剂量5mpk,biw
×
3,i.v.给药。给药后第24天pbs组(阴性对照组)平均肿瘤体积达到1306.8mm3,qp1461371(4mpk)组平均肿瘤体积258.51mm3,tgi=80.22%,qp1461371(10mpk)组平均肿瘤体积104.81mm3,tgi=91.98%,tecentriq(5mpk)组平均肿瘤体积90.90mm3,tgi=93.04%;qp3711461(4mpk)组、qp3711461(10mpk)组和tecentriq(5mpk)组与pbs组的肿瘤体积均有统计学意义极显著差异(t检验,p<0.01)。
[0205]
该实验说明在免疫系统人源化小鼠的hcc827-hclaudin18.2模型中我们的抗cldn18.2/抗pd-l1双特异抗体也表现出优越的抗肿瘤能力。
[0206]
[0207]
[0208]
[0209]
[0210]
[0211]
[0212]
[0213]
[0214]
[0215]
[0216]
[0217]
[0218]
[0219]
[0220]
[0221]
[0222]
[0223]
[0224]
[0225]
[0226]
[0227]
[0228]
[0229]
[0230]
[0231]
[0232]
[0233]
[0234]
[0235]
[0236]
[0237]
[0238]
[0239]
[0240]
[0241]
[0242]
[0243]
[0244]
[0245]
[0246]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。