促进多能干细胞的胸腺上皮细胞和胸腺上皮细胞祖细胞的分化的方法
1.相关申请的交叉引用
2.本技术要求于2019年4月1日提交的美国专利申请序列号62/827,383的优先权,其全部内容通过引用结合于此。
3.政府资助的声明
4.本发明是在由国立卫生研究院(national institutes of health)授予的授权号dk104207、dk103585和a1045897的政府支持下完成的。政府在本发明中拥有某些权利。
技术领域
5.本公开提供了促进多能干细胞分化成胸腺上皮细胞或胸腺上皮细胞祖细胞的方法,以及从所述方法获得的细胞,以及包含此类细胞的溶液、组合物和药物组合物。本公开还提供了将胸腺上皮细胞或胸腺上皮细胞祖细胞用于治疗和预防疾病、产生器官以及用于其他用途的方法和试剂盒。
背景技术:
6.胸腺是负责t细胞发育和培养的主要淋巴器官。胸腺上皮细胞(tec)是胸腺基质的关键组分。胸腺皮质中的tec(ctec)专门用于t细胞阳性选择,而骨髓tec(mtec)参与t细胞阴性选择。tec介导的选择促进可识别由自身mhc分子呈递的外源抗原的自身耐受且高度多样化的t细胞库。除tec外,正常的胸腺生成还涉及高度组织化的基质和造血细胞类型网络。
7.来自人多能干细胞(hpsc)的功能性tec或tec祖细胞(tep)的体外产生可产生这样的细胞、组织或器官,所述细胞、组织或器官有助于患有因先天性病症(诸如迪格奥尔格综合征(digeorge syndrome))所致的胸腺功能障碍以及因hiv感染、高剂量化疗和放疗治疗、植入物抗宿主病和与高龄结合的长期免疫抑制疗法所致的获得性功能障碍的患者中的t细胞重建,这本身导致较差的胸腺生成功能。由于成人胸腺中tec的数量是有限的并且从出生后的胸腺中扩增它们的可靠方法一直难以实现,因此从多能干细胞(psc)产生tec是重要的目标。创建hpsc向tec的紧密受控分化的体外方案需要精确的发育时间和细胞因子线索的知识和应用。虽然从支持鼠(parent等人2013;sun等人2013;soh等人2014;bredenkamp等人2014))或人(su等人2015)t细胞发育的鼠或人psc产生功能性tep已经被描述,但高水平的幼稚人t细胞的重建尚未得到证明。因此,本领域需要一种产生人tep和tec的方法。
技术实现要素:
8.本文示出了一种体外诱导包括胚胎干细胞(esc)和诱导性多能干细胞(ipsc)的人多能干细胞(hpsc)分化成胸腺上皮细胞祖细胞(tec祖细胞)的有效方法,其中胸腺上皮细胞(tec)或胸腺上皮细胞祖细胞(tep)能够体内产生胸腺器官和t细胞。
9.这个方案在没有蛋白质转导或遗传修饰的情况下实现了迄今为止所描述的foxn1的最高体外表达。培养后,细胞表达上皮标记物epcam、角蛋白5和角蛋白8。当与人胸腺间充
质细胞(thymes)混合时,体内植入的细胞在静脉内接受人造血干细胞(hsc)的切除胸腺的nod
‑
scid il2rγ
null
(nsg)小鼠中支持幼稚人t细胞重建(khosravi
‑
mahrarlooei等人2020)。
10.本公开的一个实施方案是一种诱导包括胚胎干细胞(esc)和诱导性多能干细胞(ipsc)的人多能干细胞(hpsc)分化成胸腺上皮细胞(tec)或胸腺上皮细胞祖细胞(tec祖细胞)(tep)的方法,所述方法包括以下步骤:
11.1.使人多能干细胞分化成内胚层细胞;
12.2.培养所得的内胚层细胞,并且通过如下方法使内胚层细胞分化成前部前肠细胞:将内胚层细胞与抑制bmp的剂和抑制tgfβ信号传导的剂接触或一起孵育,并且进一步将所述细胞与刺激hoxa3表达的剂和刺激tbx1表达的剂接触或一起孵育;
13.3.进一步培养所得的前部前肠细胞,并且通过如下方法使前部前肠细胞分化成咽内胚层细胞:将前部前肠细胞与刺激tbx1表达的剂和刺激pax9和pax1表达的剂接触或一起孵育;
14.4.进一步培养所得的咽内胚层细胞,并且通过如下方法使咽内胚层细胞分化成远端咽囊(pp)特化细胞、胸腺上皮细胞或胸腺上皮细胞祖细胞:将咽内胚层细胞与抑制bmp的剂接触或一起孵育并随后将咽内胚层细胞与bmp接触或一起孵育;以及
15.5.将所述方法结束时的tec或tep与存活素抑制剂接触或一起孵育。
16.进一步的实施方案是一种从包括胚胎干细胞(esc)和诱导性多能干细胞(ipsc)的人多能干细胞(hpsc)获得胸腺上皮细胞(tec)或胸腺上皮细胞祖细胞(tep)的方法,所述方法包括以下步骤:
17.1.使人多能干细胞分化成内胚层细胞;
18.2.培养所得的内胚层细胞,并且通过如下方法使内胚层细胞分化成前部前肠细胞:将内胚层细胞与抑制bmp的剂和抑制tgfβ信号传导的剂接触或一起孵育,并且进一步将所述细胞与刺激hoxa3表达的剂和刺激tbx1表达的剂接触或一起孵育;
19.3.进一步培养所得的前部前肠细胞,并且通过如下方法使前部前肠细胞分化成咽内胚层细胞:将前部前肠细胞与刺激tbx1表达的剂和刺激pax9和paxl表达的剂接触或一起孵育;
20.4.进一步培养所得的咽内胚层细胞,并且通过如下方法使咽内胚层细胞分化成远端咽囊(pp)特化细胞、胸腺上皮细胞:将咽内胚层细胞与抑制bmp的剂接触或一起孵育并随后将咽内胚层细胞与bmp接触或一起孵育;以及
21.5.将所述方法结束时的tec或tep与存活素抑制剂接触或一起孵育。
22.本公开的进一步实施方案是一种诱导包括胚胎干细胞(esc)和诱导性多能干细胞(ipsc)的人多能干细胞(hpsc)分化成胸腺上皮细胞(tec)或胸腺上皮细胞祖细胞(tec祖细胞)(tep)的方法,所述方法包括以下步骤:
23.1.通过如下方法使多能干细胞分化成内胚层细胞:在无血清分化培养基中培养多能干细胞并且将所述细胞与人骨形态发生蛋白(bmp)、人碱性成纤维细胞生长因子(bfgf)和人活化素a接触或一起孵育;
24.2.通过如下方法使来自第一步骤的内胚层细胞分化成前部前肠细胞:在分化培养基中培养内胚层细胞并且将所述细胞与头蛋白(noggin)、sb431542、视黄酸和fgf8b接触或
一起孵育;
25.3.通过如下方法使来自第二步骤的前部前肠细胞分化成咽内胚层细胞:在分化培养基中培养所述细胞并且将所述细胞与fgf8b和视黄酸接触或一起孵育并随后与fgf8b和音猬因子(sonic hedgehog)(shh)接触或一起孵育;
26.4.通过如下方法使来自步骤3的咽内胚层细胞分化成第3咽囊特化细胞:在分化培养基中培养所述细胞并且将所述细胞与头蛋白接触或一起孵育;
27.5.通过如下方法使来自步骤3或步骤4的咽内胚层细胞进一步分化成第3咽囊特化细胞、tep或tec:在分化培养基中培养所述细胞并且将所述细胞与bmp接触或一起孵育;以及
28.6.使所述细胞暴露于存活素抑制剂中。
29.进一步的实施方案是一种从包括胚胎干细胞(esc)和诱导性多能干细胞(ipsc)的人多能干细胞(hpsc)获得胸腺上皮细胞(tec)或胸腺上皮细胞祖细胞(tep)的方法,所述方法包括以下步骤:
30.1.通过如下方法使多能干细胞分化成内胚层细胞:在无血清分化培养基中培养多能干细胞并且将所述细胞与人骨形态发生蛋白(bmp)、人碱性成纤维细胞生长因子(bfgf)和人活化素a接触或一起孵育;
31.2.通过如下方法使来自第一步骤的内胚层细胞分化成前部前肠细胞:在分化培养基中培养内胚层细胞并且将所述细胞与头蛋白、sb431542、视黄酸和fgf8b接触或一起孵育;
32.3.通过如下方法使来自第二步骤的前部前肠细胞分化成咽内胚层细胞:在分化培养基中培养所述细胞并且将所述细胞与fgf8b和视黄酸接触或一起孵育,随后与fgf8b和音猬因子(shh)接触或一起孵育;
33.4.通过如下方法使来自步骤3的咽内胚层细胞分化成第3咽囊特化细胞:在分化培养基中培养所述细胞并且将所述细胞与头蛋白接触或一起孵育;
34.5.通过如下方法使来自步骤3或步骤4的咽内胚层细胞进一步分化成第3咽囊特化细胞、tep或tec:在分化培养基中培养所述细胞并且将所述细胞与bmp接触或一起孵育;以及
35.6.使所述细胞暴露于存活抑制剂中。
36.在一些实施方案中,细胞与各种剂的接触或一起孵育通过在包含所述剂的培养基中培养细胞来完成。
37.本公开还提供了使用本文所描述的方法获得的细胞,以及包含使用本文所描述的方法获得的细胞的溶液、组合物和药物组合物。
38.在一些实施方案中,这些细胞表达foxn1、epcam、角蛋白5和角蛋白8。在一些实施方案中,这些细胞是胸腺上皮细胞(tec)。在一些实施方案中,这些细胞是胸腺上皮细胞祖细胞(tec祖细胞)(tep)。
39.包括细胞,包含所述细胞的溶液、组合物和药物组合物在内的所有前述实施方案都可用于治疗和/或预防疾病。
40.在一些实施方案中,所述疾病是胸腺疾病。
41.在进一步的实施方案中,所述疾病是自身免疫性疾病,包括但不限于1型糖尿病、
类风湿性关节炎(ra)、银屑病、银屑病关节炎、多发性硬化、系统性红斑狼疮(sle)、炎性肠病、阿狄森氏病(addison’s disease)、格雷夫斯氏病(graves’disease)、肖格伦综合征(syndrome)、桥本氏甲状腺炎(hashimoto’s thyroiditis)、重症肌无力、自身免疫性血管炎、恶性贫血、乳糜泻、白癜风和斑秃。
42.包括细胞,包含所述细胞的溶液、组合物和药物组合物在内的所有前述实施方案都可用于恢复或复原胸腺功能受损,其中功能受损是由于衰老或损伤或诸如hiv的感染性疾病引起的。
43.包括细胞,包含所述细胞的溶液、组合物和药物组合物在内的所有前述实施方案都可用于在骨髓移植后重建t细胞。
44.包括细胞,包含所述细胞的溶液、组合物和药物组合物在内的所有前述实施方案都可用于产生包含所述细胞和胸腺或者其他细胞或包含胸腺的组织的杂交胸腺。在一些实施方案中,所述胸腺来自不同的个体。在一些实施方案中,所述胸腺来自不同的物种。在一些实施方案中,所述胸腺来自猪。在一些实施方案中,所述猪是胎儿猪。在一些实施方案中,所述猪是幼猪。
45.包括细胞,包含所述细胞的溶液、组合物和药物组合物在内的所有前述实施方案都可用于开发小鼠模型和执行药物测试。
46.包括细胞,包含所述细胞的溶液、组合物和药物组合物在内的所有前述实施方案都可用于开发胸腺,以用于治疗存在其中胸腺功能部分或完全受损的先天性异常的个体,如患有迪格奥尔格综合征、22q.11.2缺失综合征或努德综合征(nude syndrome)的个体。
47.在又另外的实施方案中,本公开涉及用于实践本公开的方法以获得本文公开的细胞、溶液、组合物和药物组合物的剂盒。本公开还包括包括所述细胞、溶液、组合物和药物组合物的剂盒。
48.如本文所描述,所述方法、系统和试剂盒适用于胸腺上皮细胞或胸腺上皮细胞祖细胞(tep)的大规模、可再现的生产。
附图说明
49.出于说明本发明的目的,在附图中描绘了本发明的某些实施方案。然而,本发明不限于附图中描绘的实施方案的精确布置(arrangements)和手段(instrumentalities)。
50.图1
‑
用于使hesc直接分化为第3pp偏向的咽内胚层的方案的建立。图1a是假定的朝向所需细胞命运的hesc分化步骤的示意图,反映了图1b中所示处理的目的。图1b是使hesc分化为第3pp偏向的咽内胚层直至第15天的所测试方案的示意图。将方案#1(在图1b中被指示为“1”)(fgf8b ra
250
)视为参考方案,在图1d中将其与方案#2(在图1b中被指示为“2”)(fgf8b)(#1对比#2)和#3(在图1b中被指示为“3”)(fgf8b ra250与fgf8b shh)(#1对比#3)进行比较。在图1b中,“ns”指示头蛋白和sb431542。图1c示出了在第4.5天分离的胚状体上的epcam和cxcr4(内胚层标记物)表达的代表性流式细胞术分析。图1d是显示在第15天在图1b所示的方案条件下分化的hesc中的基因表达的比较分析的图表。所述图表表示如通过qpcr测量的rna表达的倍数变化。(n=3
‑
11,值表示平均值
±
sem,*p<0.05,**p<0.01,***p<0.001,双尾比率配对t检验)。图1e示出了在第15天使用方案#1分化的hesc与分化为
‘
肝’的hesc中的pp标记物表达的比较(
‘
肝脏病状’(gouon
‑
evans等人2006))。条形
图表示如通过qpcr测量的rna表达的倍数变化(n=6,值表示平均值
±
sem,*p<0.05,**p<0.01,***p<0.001,双尾比率配对t检验)。图1f是示出在第15天在图1b所示的方案条件下分化的hesc中的基因表达的比较分析的图表。所述图表表示如通过qpcr测量的rna表达的倍数变化。(n=9
‑
11,值表示平均值
±
sem,*p<0.05,**p<0.01,***p<0.001,双尾比率配对t检验)。
51.图2
‑
第3pp和/或tec远端化的方案的制定。图2a是第30天之前第3pp偏向的细胞的远端化的所测试方案的示意图。在图2a中,“3b”和“3c”指示基于图1b中的方案#3的修改;“4b”和“4c”指示基于图1b中的方案#4的修改。图2b示出了从第6.5天开始在不同培养条件下测试的多种hesc分化方案的示意图。使hesc分化为定形内胚层(de)持续4.5天,并且随后将其用头蛋白 sb(ns)和视黄酸(ra)前化。然后用ra和所指示因子的不同组合将细胞模式化(patterned)8.5天,直到第15天。图2c是来自含有ra和fgf8b(方案#1)的培养物的hesc来源的细胞中的foxa2、hoxa3、six1、tbx1、eya1、pax9和pax1相比于如图2b中所示的取代fgf8b的ra 因子的表达分析的图。条形图表示如通过qpcr测量的rna表达的倍数变化(n=3,值表示平均值
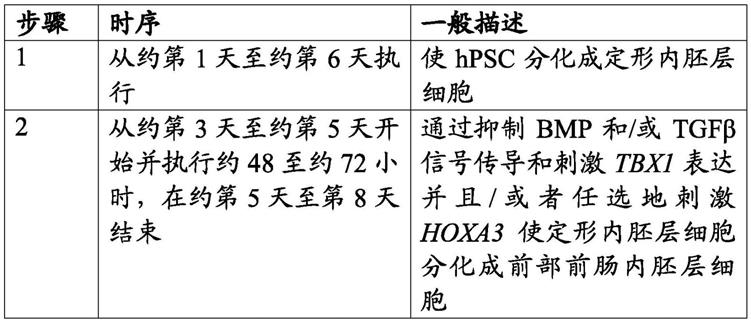
±
sem,*p<0.05,**p<0.01,***p<0.001,带有邓尼特多重比较检验(dunnett
′
s multiple comparisons test)的单向anova)。图2d示出了在第30天头蛋白暴露对pax9表达的影响。条形图表示方案#3b相比于#3c和#4b相比于#4c之间的pax9表达的倍数变化。(n=4,值代表平均值
±
sem,*p<0.05,**p<0.01,***p<0.001,双尾比率配对t检验)。图2e示出了如通过qpcr测量的在第4.5天相比于第6.5天(方案#3c相比于#4c)开始fgf8b处理后第30天的foxn1表达的倍数变化(n=4
‑
8,值表示平均值
±
sem,*p<0.05,**p<0.01,***p<0.001,双尾比率配对t检验)。图2f示出了如通过qpcr测量的在方案#4c的第21天相比于第30天(bmp4暴露之前和之后)的foxn1表达的倍数变化(n=4
‑
8,值表示平均值
±
sem,*p<0.05,**p<0.01,***p<0.001,双尾比率配对t检验)。图2g示出了如通过qpcr测量的在方案#4c的第15天相比于第30天的foxn1表达的倍数变化(n=4
‑
8,值表示平均值
±
sem,*p<0.05,**p<0.01,***p<0.001,双尾比率配对t检验)。
52.图3
‑
第30天体外分化的tec祖细胞的特征。图3a示出了与胎儿胸腺(fthy)相比,所培养细胞(d30;方案#4c)中的tec标记物表达。(ct相对于β
‑
肌动蛋白,n=3
‑
22,值表示平均值
±
sem,*p<0.05,**p<0.01,***p<0.001,双尾未配对韦尔奇t检验(two
‑
tailed unpaired welch's t
‑
test))。每个点表示一个独立的实验。图3b显示了与胎儿胸腺相比,在方案#4c条件下培养30天的h9细胞中的第3pp标记物表达。条形图表示相对于β
‑
肌动蛋白的平均ct值 sem(n=3
‑
6)。双尾未配对韦尔奇t检验。每个点表示一个独立的实验。图3c是foxn1和gcm2、foxn1和il7以及foxn1和cd205的基因表达水平的皮尔森相关性分析(pearson correlation analysis)的图。两个轴描绘相对于β
‑
肌动蛋白的ct值。每个点表示一个独立的实验。
53.图4
‑
用存活素抑制剂ym155处理第30天的hes
‑
tep培养物耗尽了多能细胞。图4a是示出ym155处理的时间段的方案#4c的示意图。所述示意图还显示了完整的分化方案。图4b是foxn1和oct4表达的皮尔森相关性分析的图。两个轴描绘相对于β
‑
肌动蛋白的ct值。每个点表示一个独立的实验。图4c是在耗竭多能细胞后第30天的oct4表达的倍数变化的图(方案#4c相比于#4c ym155;n=5,值表示平均值
±
sem,*p<0.05,双尾比率配对t检验)。图4d是显示hes
‑
tep移植后数周内无明显畸胎瘤形成的存活百分比的图。来自方案#4c第15天的
植入了hes
‑
tep的小鼠(n=8,灰色线)与来自用(n=15,黑色虚线)或不用(n=12,黑色实线)ym155处理的第30天培养物的植入了hes
‑
tep的小鼠进行比较。对数秩曼特尔考克斯检验(log
‑
rank mantel cox test)显示,与单独的hes
‑
tep第30天或hes
‑
tep第30天 ym155处理相比,hes
‑
tep第15天存活率p<0.005。
54.图5
‑
再聚集使用图4a中所示的方案制备的hes
‑
tep并且胸腺间充质细胞形成支持胸腺生成的胸腺类器官。图5a显示了当从注射有人hsc的nsg小鼠中手术去除(atx)或不去除天然胸腺雏形时t细胞的百分比。外周血的ack裂解产生白细胞(wbc),该白细胞在hsc注射后的指定周针对hucd45 cd3 t细胞被染色。nsg n=12,atx nsg n=4.图5b是在hucd45 cd19
‑
cd14
‑
细胞上门控的代表性facs曲线图。nsg n=10,atx n=14.图5c
‑
5f示出了当将与一或多种胸腺间充质细胞(tmc)混合的所培养hes
‑
tep簇单独植入到注射有人hsc的atx nsg小鼠的肾囊下时各种细胞的频率。图5c示出了单个hes
‑
tec/tmc小鼠的pbmc中总小鼠 人cd45 细胞中的hucd45 细胞的频率和植入了tmc的小鼠(n=6)的平均值(灰色线)。图5d示出了单个hes
‑
tep/tmc小鼠的pbmc中总小鼠 人cd45 细胞中的cd3 细胞的频率和植入了tmc的小鼠(n=6)的平均值(灰色线)。图5e示出了单个hes
‑
tep/tmc小鼠的pbmc中总小鼠 人cd45 细胞中的cd4 细胞的频率和植入了tmc的小鼠(n=6)的平均值(灰色线)。图5f示出了针对cd45ra cd45ro
‑
幼稚细胞被染色的cd4 细胞的频率。排除cd4 事件少于100的时间点。图5g示出了人源化后30周来自健康人(左)、hes
‑
tec/tmc(中)和tmc小鼠(右)的pbmc中的人t细胞。hes
‑
tec/tmc曲线图代表发育出cd4 和cd8 t细胞的n=4只小鼠,并且tmc曲线图代表n=6。图5h显示了来自hes
‑
tec/tmc(n=3)的细胞上的cd4 和cd8 表达。在hucd45 cd19
‑
cd14
‑
细胞上对细胞悬浮液进行门控。
55.图6
‑
使用图4a中所示的方案制备的tep产生的hes
‑
tec存留于猪胸腺中并促进胸腺生成。图6a是体内测试hes
‑
tec的方案的示意图。给猪胸腺注射或不注射hes
‑
tep,并且将该猪胸腺植入在静脉注射有人hsc的atx nsg小鼠的肾囊下。图6b显示了移植后18
‑
22周胸腺植入物的流式细胞术分析的结果。将来自一半胸腺植入物的释放酶(1iberase)消化的基质部分的单细胞悬浮液染色并通过流式细胞术分析。制备人类儿童胸腺作为对照。将非造血细胞门控为hucd45
‑
hla
‑
abc 。示出了胸腺成纤维细胞(cd105 )的标记物和上皮细胞标记物epcam。图6c是swthy hes
‑
tec(左侧条,正方形)和swthy(右侧条,三角形)植入物中hucd45
‑
hla
‑
abc cd105
‑
epcam 上皮细胞的频率的图。图6d是人类儿童胸腺以及注射或未注射有hes
‑
tep(从左至右)的猪胸腺的针对cd4/cd8分布门控为hucd45 cd19
‑
cd14
‑
细胞的胸腺细胞的代表性流式细胞术曲线图。图6e是显示了在双阳性cd4 cd8 、单阳性cd4 cd8
‑
和cd4
‑
cd8 中,来自一半胸腺植入物的胸腺细胞的绝对计数的图,其中与更成熟的cd45ra 胸腺细胞相比,进一步分裂为未成熟的cd45ro 。显示了来自两个独立实验的swthy hes
‑
tec(n=6,正方形)和swthy(n=5,三角形)的平均值
±
sem。从分析中除去产生少于6x105(n=1,各自来自swthy hes
‑
tec和swthy)细胞的胸腺植入物。使用曼
‑
惠特尼检验(mann
‑
whitney test)来确定p值,将swthy hes
‑
tec与swthy组进行比较,其中p<0.05被视为显著的。 p=0.05,*p<0.05,**p<0.005。图6f是在人源化后指定周,针对pbmc中总人(hucd45 )细胞进行测定的人免疫细胞的图。显示了来自两个独立的hes
‑
tec分化的单独猪胸腺(n=9,带三角形的黑线)和注射有hes
‑
tep的猪胸腺(n=11,带正方形的绿线)的平均值
±
sem。图6g是在人源化后指定周,针对pbmc中总b细胞(hucd19 )细胞进行测定的人免疫细胞
的图。示出了来自两个独立的hes
‑
tep分化的单独猪胸腺(n=9,带黑色三角形的黑线)和注射有hes
‑
tep的猪胸腺(n=11,带正方形的绿线)的平均值
±
sem。图6h是通过流式细胞术分析的脾中人源化后18
‑
22周的总人cd45 免疫细胞的图。示出了来自两个独立的hes
‑
tec分化的注射有hes
‑
tep的猪胸腺(n=7,正方形)和单独猪胸腺(n=6,三角形)的平均值
±
sem。图6i是通过流式细胞术分析的脾中人源化后18
‑
22周的总人cd19 b细胞的图。示出了来自两个独立的hes
‑
tep分化的注射有hes
‑
tep的猪胸腺(n=7,正方形)和单独猪胸腺(n=6,三角形)的平均值
±
sem。图6j是通过流式细胞术分析的脾中人源化后18
‑
22周的总人cd14 骨髓细胞的图。示出了来自两个独立的hes
‑
tep分化的注射有hes
‑
tep的猪胸腺(n=7,正方形)和单独猪胸腺(n=6,三角形、)的平均值
±
sem。
56.图7
‑
与植入了猪胸腺的对照小鼠相比,将使用图4a中所示的方案制备的hes
‑
tep注射至猪胸腺中促进了血液中cd4 t细胞比例的增加以及脾中幼稚t细胞和cd4 最近胸腺迁移物的数量的增加。图7a
‑
7c示出了在人源化后指定周,在pbmc中测定的人免疫细胞的结果。示出了来自两个独立的hes
‑
tep分化的单独猪胸腺(n=9,带三角形的黑线)和注射有hes
‑
tep的猪胸腺(=11,带正方形的绿线)的平均值
±
sem。图7a示出了cd3 细胞。图7b示出了cd8 细胞。图7c示出了cd4 细胞。通过双向anova揭示tep注射的显著效果,其中p<0.05被视为在cd3 和cd4 动力学上是显著的。*指示每个时间点p<0.05的事后邦费罗尼多重比较(post
‑
hoc bonferroni multiple comparison)。图7d示出了人源化后18
‑
22周脾脏中cd3 t细胞的绝对数量。图7e示出了人源化后18
‑
22周脾脏中cd8 t细胞的绝对数量。图7f示出了人源化后18
‑
22周脾脏中cd4 t细胞的绝对数量。图7g示出用于在cd8 (中间图)或cd4 t细胞(右图)中区分幼稚、效应记忆(em)、中央记忆(cm)和再表达cd45ra的终末分化效应记忆细胞(emra)(左组)的cd45ra与ccr7的比较。图7h示出了如在脾单核细胞中被定义为cd45ra ccr7 细胞的最近胸腺迁移物cd31 cd4 幼稚细胞的绝对数量。示出了来自两个独立的hes
‑
tep分化的注射有hes
‑
tep的猪胸腺(n=7,正方形)和单独猪胸腺(n=6,三角形)的平均值
±
sem。使用曼
‑
惠特尼检验来测定p值,将单独swthy与swthy hes
‑
tep注射组进行比较,其中p<0.05被视为显著的。*p<0.05。
具体实施方式
57.定义
58.本说明书中使用的术语一般具有其在本领域中、在本发明的情形以及使用每个术语所处的特定情形内的普通含义。在以下或在说明书中其他地方讨论某些术语以在描述本发明方法以及如何使用其方面对从业者提供额外指导。此外,应了解同一事物可以超过一种方式加以讲述。因此,可针对本文讨论的术语中的任何一个或多个术语使用替代性措辞和同义语,无论术语是否在本文中被详尽阐述或讨论都不附加有任何特殊意义。提供了某些术语的同义语。对一种或多种同义语的叙述不排除对其他同义语的使用。说明书中任何地方的实例的使用(包括本文讨论的任何术语的实例)仅是说明性的,并且决不限制本发明或任何示例性术语的范围和含义。同样地,本发明不限于它的优选实施方案。
59.如本文所用,通常缩写为ips细胞或ipsc的术语“诱导性多能干细胞”是指由非多能细胞(通常为成体体细胞)或终末分化细胞(诸如成纤维细胞、造血细胞、肌细胞、神经元、表皮细胞等)人工产生的多能干细胞类型。
60.如本文所用,术语“分化”和“细胞分化”是指较不特化的细胞(即干细胞)发育或成熟或分化成具有更独特形式和/或功能的更特化细胞或分化细胞(即胸腺上皮细胞)的过程。
61.如本文所用,表述“细胞”、“细胞系”和“细胞培养物”可互换使用,并且所有此类名称都包括子代。因此,词语“转化体”和“经转化细胞”包括原代主题细胞以及由其获得的培养物而不考虑转移的次数。还应了解由于故意或无意突变,所以并非所有子代都将具有精确同一的dna内含物。包括具有与如在最初转化细胞中筛选的功能或生物活性相同的功能或生物活性的突变子代。当意指不同名称时,这将根据上下文而是清楚的。
62.关于细胞,术语“经分离”是指已从其天然环境(例如从组织或受试者)分离出来的细胞。术语“细胞系”是指能够在体外连续或延长生长和分裂的细胞群体。经常地,细胞系是源于单一祖细胞的克隆群体。本领域进一步已知,在此类克隆群体的储存或转移期间,核型可发生自发或诱导的变化。因此,源于提及的细胞系的细胞可不与祖先细胞或培养物精确同一,并且提及的细胞系包括此类变体。如本文所用,术语“重组细胞”是指其中已引入有外源性dna区段的细胞,所述外源性dna区段是诸如导致生物活性多肽的转录或生物活性核酸(诸如rna)的产生的dna区段。
63.缩写
64.hpsc
‑ꢀꢀꢀꢀꢀꢀꢀ
人多能干细胞
65.es或esc
‑ꢀꢀꢀꢀ
胚胎干细胞
66.ipsc
‑ꢀꢀꢀꢀꢀꢀꢀ
诱导性多能干细胞
67.tec
‑ꢀꢀꢀꢀꢀꢀꢀꢀ
胸腺上皮细胞
68.tep
‑ꢀꢀꢀꢀꢀꢀꢀꢀ
胸腺上皮细胞祖细胞
69.pe
‑ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
咽内胚层
70.de
‑ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
定形内胚层
71.afe
‑ꢀꢀꢀꢀꢀꢀꢀꢀ
前部前肠或前部前肠内胚层
72.pa
‑ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
咽弓
73.第3pp
‑ꢀꢀꢀꢀꢀꢀ
第三咽囊
74.shh
‑ꢀꢀꢀꢀꢀꢀꢀꢀ
音猬因子
75.ra
‑ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
视黄酸
76.sp
‑ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
单阳性
77.dp
‑ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
双阳性
78.为了将de分化成第三pp,使用fgf8和视黄酸(ra)的组合诱导tbx1和hoxa3的共表达。ra治疗先前已被证明可增强hoxa3活性(parent等人2013;diman等人2011),但tbx1上调fgf8的潜能是本文公开的新发现。据信fgf8在所公开的分化方案中起双重作用:i)活化素暴露后立即的fgf8信号传导驱动tbx1,从而将de前化为咽偏向的afe(green等人2011)。早期暴露于fgf8(第4.5天相比于第6.5天;方案#3c相比于#4c)强烈地将培养物推向咽afe,显著增加第30天foxn1 细胞的数量;ii)在前化之后,fgf8b促进pe的发育,现在在tbx1的下游起作用并与tbx1结合(vitelli等人2002;vitelli等人2010)。
79.在pe发育中起关键作用的另一种细胞因子是音猬因子(shh)(moore
‑
scott和manley 2005)。减少ra暴露并将其替换为shh(方案#1相比于#3)作为另一项创新。这上调了
pax9、pax1和tbx1,但下调了hoxa,这与显示shh信号传导在pe中诱导tbx1的先前报道一致(garg等人2001)。高水平的hoxa3对早期咽区模式化至关重要,但其表达在后期减弱。实际上,pax1表达在hoxa3无效突变体中降低,而hoxa3表达在pax1;pax9双突变体胚胎中是正常的(moore
‑
scott和manley 2005)。hoxa3表达在shh
‑
/
‑
突变体中也不受影响。因此,在所公开的方案中,hoxa3和pax1
‑
pax9的时间上相反的梯度对第三pp发育的贡献进一步证明了最初使用ra,随后用shh治疗的合理性。
80.在方案的最后部分,使细胞暴露于头蛋白中,然后暴露于bmp4中。尽管bmp信号传导已经被证明是foxn1表达所需的(patel等人2006;swann等人2017),但这是首次报道使用头蛋白(bmp4拮抗剂和/或抑制剂)进行体外胸腺分化。头蛋白在第3个pp内胚层中的存在与表达bmp4的甲状旁腺结构域而不是胸腺相关(patel等人2006)。在公开的方案中,向培养物中添加异位头蛋白进一步增强第30天pax9的表达。由于bmp4表达刚好在头蛋白在e9.5处表达后在第3pp内胚层的细胞中在e10.5处开始(patel等人2006),因此从第21天到第30天,使细胞暴露于bmp4中(紧接在头蛋白之后)。与第21天和第15天相比,这引起第30天foxn1的增加。有趣的是,没有预先暴露于头蛋白中的bmp4处理未引起任何foxn1增加,从而证实需要头蛋白暴露以产生对bmp4的敏感性。
81.几个小组已经报道了从psc产生鼠和人tep的能力(parent等人2013;sun等人2013;soh等人2014;su等人2015;lai和jim2009)。在三篇报道中,由这些细胞组成的植入物,往往与来自tep培养物的支持性间充质或epcam
‑
细胞一起,在裸鼠中重建了鼠t细胞,但是在正常出现的胸腺结构中的强健的、连续的胸腺生成没有得到证实。实际上,不排除一波胸腺生成之后是外周淋巴细胞减少驱动的成熟t细胞扩增的可能性。在一篇报道中,证明了外周组织中的人t细胞群体恢复和植入的组织中的人胸腺生成,但没有证明植入的细胞的胸腺结构。此外,该研究中未包括最近胸腺迁移的外周标记物,因此不清楚胸腺生成有多稳健或持久。
82.本文所述,在植入有hpsc
‑
tep加胸腺间充质细胞并接受人hsc的小鼠外周中幼稚人t细胞的hpsc
‑
tec依赖性出现得到了明确的证明。因为nsg小鼠胸腺也能够支持人胸腺生成,所以在植入hpsc
‑
tep之前将所有nsg小鼠切除胸腺(khosravi等人2020),从而确保所有外周t细胞都来自植入的组织。这些小鼠中外周人t细胞的表型最终转化为记忆型。
83.不能从“独立的(stand
‑
alone)”细胞植入物产生持久的、结构化的胸腺导致开发了一种用于评定体内hpsc
‑
tep的胸腺生成功能的新途径。先前已经证明,胎儿猪胸腺组织支持在nsg小鼠中具有不同tcr库(shimizu等人20008)和稳健的外周幼稚t细胞群体的表型正常的人胸腺生成(nikolic和sykes 1999),但与针对在人胸腺植入物中发育的t细胞所观察到的具有一些细微的差异(kalscheuer等人2014)。这些胎儿猪胸腺片段显著生长,并且在正常出现的胸腺结构中含有多达数亿人胸腺细胞(nikolic和sykes 1999;kalscheuer等人2014)。本文公开了将hpsc
‑
tep注射至胎儿猪胸腺组织的片段中的方法,该方法将人细胞维持在猪胸腺组织附近并最终导致人细胞在猪胸腺生长时并入到猪胸腺中。并入到猪胸腺中的人tep清楚地表达人ctec和mtec相关的细胞角蛋白(cytokeratin)并似乎整合到植入物的高度组织化的胸腺结构中。最重要的是,它们具有显著的功能作用,从而显著地增加人胸腺细胞的总数和包括具有cd31 rte表型的cd4 cd34ra t细胞在内的外周幼稚人t细胞的数量。
84.获得胸腺上皮细胞和/或胸腺上皮细胞祖细胞的方法和系统
85.本文所描述的方法和系统不仅提供了通过诱导人多能干细胞分化成胸腺上皮细胞(tec)或tec祖细胞(tep)来获得胸腺上皮细胞(tec)或tec祖细胞(tep)的可再现方法,而且还提供了胸腺上皮细胞(tec)或tec祖细胞(tep)的纯度和同质性的增加,从而增加了功能。
86.本文所阐述的方法和系统产生在移植后具有完全的功能的确定的且可再现的细胞群体。此外,本文所阐述的方法和系统提供了胸腺上皮细胞(tec)或tec祖细胞的基本上同质的群体。
87.人多能干细胞是本发明方法的起始材料。人多能干细胞(hpsc)可以是胚胎干细胞(esc)或诱导性多能干细胞(ipsc)。
88.所述方法的步骤和时序阐述于表1和图4a中。
89.表1
‑
分化方法的时间线
[0090][0091][0092]
所述方法的第一步骤是使用本领域中已知的任何方法使hpsc分化成定形内胚层
(de)细胞。此处示例的是采用使用含有bmp4、bfgf和活化素a的无血清分化培养基的先前公布的方案。然而,可以使用本领域中已知的其他方案。
[0093]
所述方法的下一步骤是培养来自第一步骤的所得的定形内胚层细胞以使其进一步分化成前部前肠内胚层(afe)。用于分化方案的任何培养基都可用于在这个步骤培养细胞。无血清分化培养基是优选的。另外,可将生长因子(诸如egf和fgf)添加至培养基中以促进细胞生长。
[0094]
然后将内胚层细胞与抑制bmp的剂和抑制tgfβ信号传导的剂接触或一起孵育,以促进定形内胚层细胞分化成前部前肠祖细胞。实现此的最有效的方法是向培养细胞的培养基中添加所述剂。然而,可以使用本领域中已知的将细胞与所述剂接触或一起孵育的任何其他方法。可以同时或并行地将细胞与所述剂接触或一起孵育。
[0095]
抑制bmp的剂包括但不限于头蛋白和多索莫芬(dorsomorphin)。抑制tgfβ信号传导的剂包括但不限于sb431542。
[0096]
多索莫芬可以以从约0.5μm至约2μm范围内的量使用。
[0097]
头蛋白可以以从约25ng/ml至约500ng/ml范围内,或从约50ng/ml至约400ng/ml范围内,或从约100ng/ml至约300ng/ml范围内的量使用,其中约200ng/ml是优选的量。
[0098]
用于抑制tgfβ信号传导的剂是从约1μm至约50μm范围内,或从约2μm至约30μm范围内,或从约5μm至约20μm的范围内的量的sb431542。在一些实施方案中,用于抑制tgfβ信号传导的剂是约10μm的量的sb431542。
[0099]
然而,在所述方法中可以使用抑制tgfβ信号传导的其他剂。
[0100]
另外,发现在afe阶段tbx1和hoxa3表达的联合刺激对于生理性第3pp内胚层发育是必需的。因此,将细胞进一步与刺激这些基因表达的剂接触或一起孵育。用于刺激tbx1的剂是fgf8b,其可以从约10ng/ml至约200ng/ml范围内,或从约20ng/ml至约150ng/ml范围内,或从约30ng/ml至约100ng/ml范围内的量使用。在一些实施方案中,fgf8b可以约50ng/ml使用。
[0101]
从约第4.5天至约第15天,将细胞与这种剂接触或一起孵育。
[0102]
用于刺激hoxa3的剂是以从约0.1μm至约0.6μm范围内,或从约0.2μm至约0.5μm范围内的量使用的视黄酸(ra)。在一些实施方案中,视黄酸可以约0.6μm的量使用。从约第4.5天至约第7.5天,可以将细胞与这种剂接触或一起孵育。除第4.5天至第7.5天外,可以在前15天期间的任何其他3天的时段内执行hoxa3的刺激。
[0103]
如图1d
‑
1f中所示,这个方案以高效率产生afe。
[0104]
在用于细胞分化的任何无血清培养基(在本文被称为“分化培养基”或“无血清分化培养基”)中继续培养细胞。另外,可将生长因子(诸如egf和fgf)添加至分化培养基中以促进细胞生长。在这个步骤开始约一至两天时,将所述细胞与从约0.1μm至约0.6μm范围内,或约0.2μm至约0.5μm范围内的量的ra接触或一起孵育。在一些实施方案中,将细胞与约0.25μm ra接触或一起孵育。在整个这个步骤中,还将所述细胞继续与从约10ng/ml至约200ng/ml范围内,或从约20ng/ml至约150ng/ml范围内,或从约30ng/m1至约100ng/ml范围内的量的fgf8b接触或一起孵育。作为非限制性实例,可使细胞与约50ng/m1 fgf8b接触。
[0105]
下一步骤促进前部前肠细胞分化成咽内胚层(pe)细胞。
[0106]
在这个步骤中,使细胞与诱导pax9和pax1表达的剂接触或或一起孵育。实现此的
最有效的方法是向培养细胞的培养基中添加所述剂。然而,可以使用本领域中已知的将细胞与所述剂接触或一起孵育的任何其他方法。可以同时或并行地将细胞与所述剂接触或一起孵育。用于刺激pax9和pax1两者的剂是从约10ng/ml至约400ng/ml范围内,或从约25ng/ml至约300ng/ml范围内,或从约50ng/ml至约200ng/ml范围内的量的音猬因子(shh)。在一些实施方案中,shh可以约100ng/ml使用。
[0107]
在整个这个步骤中,还将细胞继续与从约10ng/ml至约200ng/ml范围内,或从约20ng/ml至约150ng/ml范围内,或从约30ng/ml至约100ng/ml范围内的量的fgf8b接触或一起孵育。在一些实施方案中,可以将细胞与约50ng/ml fgf8b接触或一起孵育。
[0108]
头蛋白也可用于诱导pax9和pax1的表达。头蛋白可以以从约50ng/ml至约400ng/ml范围,或从约60ng/ml至约300ng/ml范围,或从约75ng/ml至约200ng/ml范围内的量使用。在一些实施方案中,头蛋白可以约100ng/ml的量使用。
[0109]
这个步骤被执行约4至约10天。
[0110]
下一步骤是使pe细胞分化成远端第三pp/tec。这个步骤分为两个步骤:首先,将所述细胞与抑制bmp的剂接触或一起孵育。抑制bmp的剂包括但不限于头蛋白和多索莫芬。
[0111]
多索莫芬可以以从约0.5μm至约2μm范围内的量使用。
[0112]
头蛋白可以从约50ng/ml至约400ng/ml范围内,或从约60ng/ml至约300ng/ml范围内,或从约75ng/ml至约200ng/ml范围内的量使用。作为非限制性实例,头蛋白可以约100ng/ml的量使用。
[0113]
该步骤的这个部分被执行约5天至约7天。
[0114]
该步骤的第二部分将细胞与从约5ng/ml至约300ng/ml范围内,或从约15ng/ml至约200ng/ml范围内,或从约25ng/ml至约100ng/ml范围内,或约50ng/ml的量的bmp4接触或一起孵育。该步骤的这个部分被执行约5天至约10天。
[0115]
按照所述方法获得的最终细胞可以显示出包括foxn1、pax9、pax1、dll4、isl1、eya1、six1、il7、k5、k8和aire在内的tec标记物的基因表达。参见图3a和3b。
[0116]
虽然上文阐述的方法是一种诱导hpsc分化成tec或tep的新的、可再现的且稳健的方法,但是本发明的方法也提供了减少和消除可在最终被植入的细胞中造成畸胎瘤的多能细胞的进一步的步骤。在这个步骤中,将所述细胞与从约5nm至约50nm范围内的量的存活素抑制剂(诸如ym155)在所述方法的约最后24小时接触或一起孵育。作为非限制性实例,可以将所述细胞与20nm ym155接触或一起孵育。也可以与bmp4处理并行地将所述细胞与存活素抑制剂接触或一起孵育。在一些实施方案中,可以将所述细胞在并行的bmp4孵育的前24至48小时期间与存活素抑制剂接触或一起孵育。
[0117]
本发明还包括用于实践所公开的从hpsc获得tec或tep的方法的系统。这些系统可包括子系统,其中所述子系统包括分化培养基和抑制bmp和tgfβ信号传导的剂,刺激hoxa3、tbx1、pax1和pax9表达的剂,抑制存活的剂以及bmp4。这些系统可以包括子系统,其中所述子系统包括分化培养基,和头蛋白、视黄酸、fgf8b、音猬因子、bmp和ym155。
[0118]
细胞
[0119]
本公开的进一步实施方案是通过本文所阐述的分化方案产生的胸腺上皮细胞(tec)或tec祖细胞(tep)。
[0120]
在一些实施方案中,这些细胞表达foxn1、epcam、角蛋白5和角蛋白8。在一些实施
方案中,这些细胞是胸腺上皮细胞(tec)。在一些实施方案中,这些细胞是胸腺上皮细胞祖细胞(tec祖细胞)(tep)。
[0121]
因此,本公开的一个方面是通过本文所描述的方法产生的适合于施用、移植和植入至受试者中的胸腺上皮细胞(tec)或tec祖细胞(tep)。
[0122]
在另一方面,本文提供了一种组合物,其包含通过如本文所描述的方法产生的胸腺上皮细胞或tec祖细胞(tep)。在一些实施方案中,这些细胞适合于施用、移植和植入至受试者中。在一些实施方案中,所述组合物是进一步包含任何药学上可接受的载体或赋形剂的药物组合物。
[0123]
在某些实施方案中,所述组合物或药物组合物包含通过如本文所描述的方法产生的至少10,000个、至少50,000个、至少100,000个、至少500,000个、至少1x106个、至少5x106个、至少1x107个、至少5x107个、至少1x108个、至少5x108个、至少1x109个、至少5x109个或至少1x1010个胸腺上皮细胞(tec)或tec祖细胞(tep)。在一些实施方案中,这些细胞适合于施用、移植和植入至受试者中。
[0124]
在某些实施方案中,本公开提供了通过如本文所描述的方法产生的胸腺上皮细胞(tec)或tec祖细胞(tep)的冷藏的组合物或溶液。在一些实施方案中,这些细胞适合于施用、移植和植入至受试者中。
[0125]
在某些实施方案中,所述冷藏的组合物或溶液包含通过如本文所描述的方法产生的至少10,000个、至少50,000个、至少100,000个、至少500,000个、至少1x106个、至少5x106个、至少1x107个、至少5x107个、至少1x108个、至少5x108个、至少1x109个、至少5x109个或至少1x1010个胸腺上皮细胞(tec)或tec祖细胞(tep)。在一些实施方案中,这些细胞适合于施用、移植和植入至受试者中。
[0126]
在某些实施方案中,本公开提供了包含通过如本文所描述的方法产生的胸腺上皮细胞(tec)或tec祖细胞(tep)的细胞培养物。在某些实施方案中,所述细胞培养物包含通过如本文所描述的方法产生的至少1x107个、至少5x107个、至少1x108个、至少5x108个、至少1x109个、至少5x109个或至少1x1010个胸腺上皮细胞(tec)或tec祖细胞(tep)。在一些实施方案中,这些细胞适合于施用、移植和植入至受试者中。
[0127]
在某些实施方案中,本公开提供了通过如本文所描述的方法产生的适合于施用、移植和植入至受试者中的胸腺上皮细胞(tec)或tec祖细胞(tep)以及包含此类细胞的组合物、溶液和细胞培养物的治疗用途。
[0128]
在其他实施方案中,本公开提供了通过如本文所描述的方法产生的基本上同质的胸腺上皮细胞(tec)或tec祖细胞(tep)的群体。在一些实施方案中,这些细胞适合于施用、移植和植入至受试者中。在一些实施方案中,细胞群体包含至少约90%、91%、92%、93%、94%、95%、96%、97%、98%或99%胸腺上皮细胞(tec)或tec祖细胞(tep)。
[0129]
在另一方面,本文提供一种组合物,其包含通过如本文所描述的方法产生的基本上同质的胸腺上皮细胞(tec)或tec祖细胞(tep)的群体。在一些实施方案中,这些细胞适合于施用、移植和植入至受试者中。在一些实施方案中,所述组合物是进一步包含任何药学上可接受的载体或赋形剂的药物组合物。
[0130]
在某些实施方案中,所述群体或组合物或药物组合物包含通过如本文所描述的方法产生的至少10,000个、至少50,000个、至少100,000个、至少500,000个、至少1x106个、至
少5x106个、至少1x107个、至少5x107个、至少1x108个、至少5x108个、至少1x109个、至少5x109个或至少1x1010个胸腺上皮细胞(tec)或tec祖细胞(tep)。在一些实施方案中,这些细胞适合于施用、移植和植入至受试者中。
[0131]
在某些实施方案中,本公开提供了通过如本文所描述的方法产生的基本上同质的胸腺上皮细胞(tec)或tec祖细胞(tep)的群体的冷藏的组合物或溶液。在某些实施方案中,所述冷藏的组合物或溶液包含通过如本文所描述的方法产生的至少10,000个、至少50,000个、至少100,000个、至少500,000个、至少1x106个、至少5x106个、至少1x107个、至少5x107个、至少1x108个、至少5x108个、至少1x109个、至少5x109个或至少1x1010个胸腺上皮细胞(tec)或tec祖细胞(tep)。在一些实施方案中,这些细胞适合于施用、移植和植入至受试者中。
[0132]
在某些实施方案中,本公开提供了包含通过如本文所描述的本发明产生的基本上同质的胸腺上皮细胞(tec)或tec祖细胞(tep)的群体的细胞培养物。在某些实施方案中,所述细胞培养物包含通过如本文所描述的方法产生的至少1x107个、至少5x107个、至少1x108个、至少5x108个、至少1x109个、至少5x109个或至少1x1010个胸腺上皮细胞(tec)或tec祖细胞(tep)。在一些实施方案中,这些细胞适合于施用、移植和植入至受试者中。
[0133]
在某些实施方案中,本公开提供了通过如本文所描述的方法产生的适于移植和植入至受试者中的基本上同质的胸腺上皮细胞(tec)或tec祖细胞(tep)的群体以及包含此类细胞的组合物、溶液和细胞培养物的治疗用途。
[0134]
进一步的实施方案是胸腺器官,其包含与构成胸腺的其他细胞组合在一起的本文所公开的tec或tep。
[0135]
治疗用途
[0136]
本文所描述的用于从干细胞产生tec或tec祖细胞(tep)的新方法以及由这个方法产生的细胞和基本上同质的细胞群体提供了疾病的新疗法。
[0137]
从人多能干细胞产生功能性tec的能力将在小鼠的人免疫反应建模以及胸腺缺乏综合征(诸如迪格奥尔格综合征、努德综合征和白血病的免疫缺陷并发骨髓移植)的建模和治疗中具有重要应用。细胞也可以在临床上用于细胞疗法并移植于患者中以实现t细胞重建,或产生免疫耐受性以防止器官移植后的植入物排斥反应,或用于恢复因损伤或衰老所致的胸腺功能受损。
[0138]
因此,一个实施方案是治疗或预防有需要的受试者的胸腺疾病的方法,其包括向有需要的受试者施用、移植或植入治疗有效量的本公开的细胞、包含本公开的细胞的溶液、包含本公开的细胞的组合物,或包含本公开的细胞的药物组合物的步骤。所述受试者优选是哺乳动物,并且最优选是人。
[0139]
进一步的实施方案是治疗或预防有需要的受试者的自身免疫性疾病的方法,其包括向有需要的受试者施用、移植或植入治疗有效量的本公开的细胞、包含本公开的细胞的溶液、包含本公开的细胞的组合物,或包含本公开的细胞的药物组合物的步骤。所述受试者优选是哺乳动物,并且最优选是人。
[0140]
另一个实施方案是恢复或复原有需要的受试者的胸腺功能受损的方法,其包括向有需要的受试者施用、移植或植入治疗有效量的本公开的细胞、包含本公开的细胞的溶液、包含本公开的细胞的组合物,或包含本公开的细胞的药物组合物的步骤。所述受试者优选
是哺乳动物,并且最优选是人。在一些实施方案中,受损是由于损伤引起的。在一些实施方案中,受损是由于衰老引起的。在一些实施方案中,受损是由于先天性异常引起的。
[0141]
又进一步的实施方案是在有需要的受试者中在骨髓移植后重建t细胞的方法,其包括向有需要的受试者施用、移植或植入治疗有效量的本公开的细胞、包含本公开的细胞的溶液、包含本公开的细胞的组合物,或包含本公开的细胞的药物组合物的步骤。所述受试者优选是哺乳动物,并且最优选是人。
[0142]
使用本文公开的方法获得的细胞可用于产生杂交胸腺。在一些实施方案中,所述杂交胸腺包含使用本文公开的方法获得的胸腺上皮细胞和来自相同物种的第二个体的胸腺组织。在一些实施方案中,所述杂交胸腺包含使用本文公开的方法获得的胸腺上皮细胞和来自第二物种的胸腺组织。在一些实施方案中,第二物种是猪。在一些实施方案中,第二物种是小型猪。在一些实施方案中,猪是幼猪。在一些实施方案中,猪是胎儿。在共同拥有的专利申请号pct/us2019/051865中公开了获得此类杂交猪的方法。
[0143]
进一步的实施方案是使用所述细胞来开发小鼠模型。自从发现细胞重编程(ipsc),现在可以从患者组织中产生代表无数遗传疾病的多能干细胞,开创了疾病建模的新时代。可以使来自患有涉及中枢耐受性的不同自身免疫性疾病的患者的ipsc分化成tec(或tep),然后将其注射或植入到小鼠中,在小鼠中该细胞可以再生并发育成各种病状或病症。人源化小鼠模型可以由患有自身免疫性疾病(诸如多发性硬化),或i型糖尿病,或先天性异常(congenic abnormality)(诸如迪格奥尔格综合征)的患者的tec产生。该小鼠的体内环境然后可用于研究原本不能在体外发展的病症的进展。
[0144]
另外,可使用本文所描述的细胞产生个性化人源化小鼠模型。迄今为止,最发达的人源化小鼠模型含有人造血干细胞(hsc)和植入在肾囊下的儿童或人胎儿胸腺的样品。这些小鼠模型的局限性在于来自这两种类型的细胞群体(hsc和tec)的hla不匹配,因为它们来自两个不同的个体。利用本文公开的分化方案,可使tec(或tep)从与hsc相同的ipsc分化,因此免疫系统细胞hla将与移植于小鼠上的人tec上的hla匹配。这个技术可用于个体患者,从而产生个性化免疫(pi)小鼠。
[0145]
进一步的实施方案是细胞用于体内(使用先前描述的小鼠模型,包括但不限于个性化免疫(pi)小鼠模型)或体外药物测试的用途。体外分化的tec培养物可用于测试药物对抗影响tec的不同病状,诸如癌症(胸腺瘤)或感染性或自身免疫性疾病的功效。
[0146]
试剂盒
[0147]
本公开还提供了试剂盒。
[0148]
在一个实施方案中,试剂盒包括一种或多种组分,包括人多能干细胞、用于培养和分化hpsc的培养基,此种培养基包含生长因子以及抑制bmp和tgfβ信号传导的剂,刺激hoxa3、tbx1、pax1和pax9表达的剂,抑制存活的剂以及bmp4。
[0149]
在另一个实施方案中,试剂盒包括一种或多种组分,包括人多能干细胞、用于培养和分化hpsc的培养基,此种培养基包含生长因子和头蛋白、视黄酸、fgf8b、音猬因子、bmp和ym155。
[0150]
在进一步的实施方案中,试剂盒可以包括通过本公开的当前方法和系统获得的tec或tec祖细胞(tep)。试剂盒还包括用于培养细胞的试剂。
[0151]
在进一步的实施方案中,试剂盒可包括包含通过本公开的当前方法和系统获得的
tec或tec祖细胞(tep)的药物组合物。
[0152]
在进一步的实施方案中,试剂盒可包括包含通过本公开的当前方法和系统获得的tec或tec祖细胞(tep)的冷藏的组合物。
[0153]
试剂盒可进一步包括包装插页(package insert),该包装插页包含关于试剂盒中的药物组合物和剂型的信息。举例来说,可以在插页中提供关于本发明的组合的以下信息:供给方式(how supplied)、适当的储存条件、参考资料、制造商/经销商信息,和专利信息。
[0154]
实施例
[0155]
通过参考为更充分说明本发明的优选实施方案而给出的以下非限制性实施例,本发明可得以更好理解。其决不应被解释为限制本发明的广泛范围。
[0156]
实施例1
‑
材料和方法
[0157]
hpsc的维持
[0158]
如先前所描述的那样在小鼠胚胎成纤维细胞上培养rues2(rockefeller university embryonic stem cell line 2,nih批准文号nihhesc
‑
09
‑
0013,登记号0013;第13
‑
24页)(green等人2011)。以约25,000个细胞/cm2的密度平板接种小鼠胚胎成纤维细胞(globalstem,rockville,md)。在含有20%基因敲除血清替代物[gibco(life technologies,grand island,ny)]、0.1mmβ
‑
巯基乙醇(sigma
‑
aldrich,st.louis,mo)和20ng/ml fgf
‑
2(r&d systems,minneapolis,mn)的dmem/f12中培养hpsc。每天更换培养基,并且每4天用细胞消化液/edta(innovative cell technologies,san diego,ca)以1∶24稀释度传代细胞。将未分化的hpsc维持在5%co2/空气环境中。人h9 es细胞系也用方案#4c进行处理。每6个月使用pcr对细胞系进行核型分析并验证支原体污染。
[0159]
内胚层的诱导
[0160]
如huang等人2014所描述的那样在由补充有n2[gibco(life technologies)]、b27(gibco)、抗坏血酸(50μg/ml,sigma)、glutamax(2mm,life technologies)、单硫代甘油(0.4μm,sigma)、0.05%牛血清白蛋白(bsa)(life technologies)和1%青霉素
‑
链霉素(thermo fisher scientific,waltham,ma)的dmem/f12(3∶1)(life technologies)组成的无血清分化(sfd)培养基中执行分化。然后将细胞短暂地胰蛋白酶化(0.05%,37℃下1min)成单细胞悬浮液并平板接种至低粘附性6孔平板[costar 2(coming incorporated,tewksbury ma)]上,以在84小时(约3.5天)内在低粘附性平板上在含有人bmp4 0.5ng/ml、人bfgf 2.5ng/ml(r&d systems)和人活化素a 100ng/ml(r&d systems)的无血清分化培养基中形成胚状体。然后收集胚状体,将其短暂地胰蛋白酶化(0.05%,37℃下1min)成3
‑
10个小细胞块,并且再次重悬浮于内胚层诱导培养基中持续另外24小时。每24
‑
48小时喂养细胞(取决于密度)并将其维持在5%co2/5%o2/90%n2环境中。
[0161]
前部前肠内胚层、咽内胚层和远端第3咽囊的诱导
[0162]
在含有内胚层诱导培养基(如上所描述)的低粘附性平板上总共108小时后,收集胚状体,并且将其在不进行胰蛋白酶化的情况下平板接种在基质胶涂布的24孔组织培养平板(约50,000
‑
70,000个细胞/孔)上的补充有200ng/ml重组人(rh)头蛋白和10μm sb431542(ns)(如确立的方案green等人2011中所描述)与视黄酸(0.25μm)和fgf8b 50ng/ml(作为这个方案的新修改)的sfd培养基中并保持48小时。对于咽内胚层,然后将所得细胞用fgf8b(50ng/ml)和视黄酸(0.25μm)处理24小时,随后用fgf8b(50ng/ml)和音猬因子(shh)
(100ng/ml)处理8天(图1b)。对于第3咽囊特化,然后使细胞暴露于重组人头蛋白(200ng/ml)中6天,然后暴露于bmp4(10ng/ml)中直到分化的第30天(图2a)。为了避免在小鼠中植入后形成畸胎瘤,在后续实验的最后一个步骤期间,还使细胞暴露于存活素抑制剂ym155(20nm)(lee等人2013))中24小时(图4a)。在整个过程中,使细胞培养物维持在37℃的5%co2/空气环境中。每24小时喂养细胞。
[0163]
定量实时pcr
[0164]
使用trizol(invitrogen)和direct
‑
zol rna miniprep试剂盒(zymo research),根据制造商的说明书提取来自用所指示培养方法分化所指示时间的es细胞簇的总rna。使用nanodrop 2000分光光度计(thermofisher scientific)来测定rna浓度。使用superscript iii试剂盒(invitrogen),根据制造商的说明书,通过逆转录用随机六聚体扩增500ng rna。在20ul体积中使用abi power sybr green pcr主混合物在abi viia7热循环仪(applied biosystems life technologies)上执行实时定量pcr。将pcr循环条件设定为50℃2分钟,95℃10分钟,随后是95℃15秒和60℃1分钟,持续40个循环。针对所有反应和引物对验证单峰解离/熔解曲线。通过将一式三份的实验ct值的平均值与每个引物靶标的连续稀释基因组dna的标准曲线进行比较来获得每个基因转录物的定量,然后通过将其除以ct管家基因b
‑
肌动蛋白进行归一化。引物序列列于表2中。
[0165]
表2
‑
定量pcr引物
[0166]
[0167]
[0168][0169]
免疫组织化学和免疫荧光
[0170]
将24孔组织培养平板中的hes培养物在室温下用含多聚甲醛的pbs(4%)固定10分钟。将细胞在pbs中洗涤两次,在含有0.1%triton的pbs中透化20min,并且在室温下在5%胎儿驴血清中封闭1小时。
[0171]
提取胸腺植入物,将其包埋在oct(tissue
‑
tec,torrance ca)培养基中,冷冻并切取5
‑
7um厚的切片以进行免疫染色。将切片用h&e染色以观察胸腺植入物与小鼠肾组织的大体组织学和界面。对于免疫荧光染色,将组织切片固定并在100%冰冷的丙酮中透化并使其完全干燥。在补充有0.1%tween和0.1%牛血清白蛋白的pbs中封闭组织切片。将载玻片在pbs 0.1%tween中洗涤并在室温下用一级抗体染色2小时,然后洗涤并在室温下在二级抗体中孵育2小时。
[0172]
将培养物或组织切片与表3中列出的下列一级抗体和适当的二级抗体中的一种,或两种或三种的组合一起孵育。在leica scn 400全载玻片扫描平台上收集h&e染色切片的图像,并在leica tcs sp82光子激光扫描显微镜上收集免疫荧光图像。
[0173]
[0174][0175]
动物和人组织
[0176]
nod
‑
scid il2rγ
null
(nsg,stock 005557)小鼠获自jackson laboratory,并且在
微隔离笼中在不合螺杆菌(helicobacter)和侵肺巴斯德菌(pasteurella pneumotropica)的spf屏障中饲养和图养。人胎儿胸腺和肝组织(胎龄17
‑
20周)获自advanced biosciences resource。将胎儿肝组织切成小块,并且在37℃下在补充有0.01mg/ml来自牛胰腺的dnase i(sigma)、2.5mm hepes、4ug/ml庆大霉素(gentamicin)(gibco)和1wu/ml liberase
tm
(roche)的培养基199(corning)中孵育,以产生单细胞悬浮液。将细胞通过70um目细胞过滤器过滤到至多100ml培养基199中,所述培养基199如上所列的那样被补充而不含释放酶。通过在15ml ficoll(histopaque
‑
1077 sigma)上对肝细胞悬浮液分层来通过密度梯度离心来富集人单核细胞。收集单核细胞,洗涤,将其重悬于macs缓冲液中,并且根据制造商的方案(miltenyi)通过磁活化细胞分选(macs)富集cd34 细胞,至约80%cd34 的纯度。将cd34 细胞以等分试样冷冻在含10%dmso(sigma)的人血清ab(gemcell)中。
[0177]
将来自经受心脏手术的患者的人儿童胸腺的三至五mm3片段冷冻保存在含10%dmso的人ab血清中。为产生原代胸腺间充质,将胸腺块解冻,如上所描述的那样用liberase
tm
消化解离,并且以约2x104个细胞/cm2平板接种在补充有10%胎牛血清的dmem培养基(gemini bio
‑
products)中。48小时后更换培养基以去除未粘附的细胞,并且每3
‑
4天更换直至3周,一直到细胞汇合。将第7
‑
10代的细胞用于实验,并且通过流式细胞术(cd45
‑
cd105 cd90 epcam
‑
)验证细胞的身份(siepe等人2009)。人组织/细胞的使用由哥伦比亚大学欧文医学中心(columbia university irving medical center;cuimc)机构审查委员会批准,并且所有实验根据批准的方案执行。
[0178]
人源化小鼠
[0179]
将六至十周龄的nsg小鼠如所描述(khosravi
‑
maharlooei等人2020)的那样进行胸腺切除并使其恢复至少3周。恢复后,通过x射线用1.8gy全身辐射(tbi)调节动物。将冷冻保存的胎儿猪胸腺(60
‑
90天孕期)在补充有上述dnase、庆大霉素和hepes的培养基199中解冻。用28号注射器给胎儿猪片段(1
‑
2mm3)注射或不注射2x105hes来源的tep,并且在培养基199中用50%基质胶(corning)涂布。tbi后4
‑
24小时,将与1
‑
2x106胸腺间充质细胞混合的1
‑
2x106hes来源的tep、单独的1
‑
2x106胸腺间充质细胞、注射有hes
‑
tep的胎儿猪胸腺或单独的胎儿猪胸腺植入肾囊下,并且静脉内注射2x105个胎儿人cd34 细胞。如所指示的,在完全恢复后,植入后每2
‑
3周测定外周人免疫重建。从尾静脉收集血液,并且如上所描述的那样用ficoll通过密度梯度离心富集免疫群体。在安乐死时,收集胸腺、脾和外周血以用于分析。从小鼠肾切下胸腺植入物并将其分成两片。将一个胸腺片段压碎以析出胸腺细胞,并且将剩余的基质组分如上所描述的那样用liberase
tm
消化以产生用于流式细胞术分析的单细胞悬浮液。将第二个胸腺片段包埋在oct中。将脾压碎,通过70um尼龙滤器过滤并用低渗裂解缓冲液(ack gibco)裂解红细胞。通过在ficoll上进行密度梯度离心,使来自心脏穿刺的外周血富集有白细胞。按照哥伦比亚大学机构动物护理和使用委员会(columbia university institutional animal care and use committee)批准的方案执行所有动物实验。
[0180]
流式细胞术
[0181]
通过多参数流式细胞术测定hes
‑
tep培养物的人免疫重建和分化效率。为测定人免疫重建,如上所描述的那样制备由胸腺植入物、来自前纵隔的组织、脾脏和外周血制备的单细胞悬浮液。用0.05%胰蛋白酶/edta将来自hes
‑
tep培养物的第4.5天胚状体解离成单
个细胞。将细胞用抗小鼠和人细胞表面抗原的荧光染料标记的单克隆抗体染色(表4)。在lsrii或fortessa(bd biosciences)上获得细胞,并且用flowjo软件(treestar,ashland or)完成数据分析。
[0182]
表4
‑
抗小鼠和人细胞表面抗原的单克隆抗体
[0183][0184]
统计学
[0185]
用graph
‑
pad prism 7.0(graphpad software)执行统计学分析和比较。单个小鼠的值显示在条形图中,其中条形的高度描绘平均值 平均值的标准误差。对于qpcr数据,绘制相对于内部对照β
‑
肌动蛋白归一化的ct值,并且使用双尾比率配对学生t检验(two
‑
tailed ratio paired student t
‑
test)来比较相对基因表达。对于来自数个实验组的相对于单一对照组的多重比较(多于两个),使用带有邓尼特多重比较检验的单向anova。用皮尔森相关性系数评估基因相关性,其中p<0.05被视为显著;还执行线性回归并确定r
‑
平方。将因畸胎瘤生长所致的安乐死绘制在卡普兰
‑
迈耶曲线图(kaplan
‑
meyer plot)上,并且通过曼特尔考克斯对数秩检验进行分析以确定p值。用非参数曼
‑
惠特尼u检验执行小鼠组之间的比较。通过计算双向方差分析(anova)解析移植组之间的影响。当双向anova显著(p<0.05)时,在各个时间点进行邦弗罗尼多重比较检验(bonferonni’s multiple comparison test)。p<0.05被视为显著。
[0186]
实施例2
‑
hesc向第3pp偏向的咽内胚层的直接分化
[0187]
胸腺来源于咽内胚层(pe),即内胚层的最前部分。tec从esc的定向分化需要依次诱导定形内胚层(de)、前部前肠(afe)和pe,随后特化第三咽囊(第3pp)的胸腺结构域(gordon和manley 2011)(图1a和2a)。如先前所描述的那样,使用活化素a,然后使用头蛋白加sb431542(ns)将esc分化成de至afe(kubo等人2004;d'amour等人2005;green等人2011)(图1b)。流式细胞仪分析示出在第4.5天来自解离胚状体的98.3%细胞中内胚层标记物epcam和cxcr4的共表达(图1c)。de诱导后的双重bmp/tgf
‑
β抑制以高效率(>90%)产生afe(soh等人2014)。一致地,第9天的免疫荧光染色显示大多数细胞表达foxa2(内胚层)和sox2(前肠),从而证实了向afe(foxa2 sox2 )的有效特化(结果未示出)。
[0188]
其次,afe向胸腺命运的分化集中在hoxa3\tbx1\pax9\pax1\six1和eya1上,其是参与pe发育和第3pp形成的基因(manley和condie 2010)。因此,将它们的表达用作培养第15天的读数。
[0189]
在人中,在整个第3pp内胚层和周围的间充质中观察到hoxa3,而tbx1在第1、第2和第3咽弓(pa)的核心间充质中和在第3pp内胚层中表达(farley等人2013)。在pe中,这两个基因的表达仅在第3pp中重叠(farley等人2013)。视黄酸(ra)(一种pa(kopinke等人2006)和pp(wendling等人2000)形态发生所必需的因子)已经与hoxa3表达相关(diman等人2011),而pp中的fgf8盛行与小鼠中e10.5处的tbx1重叠(vitelli等人2002)。为了模拟生理性第3pp内胚层发育,通过方案#1中afe细胞的组合ra和fgf8b刺激来诱导tbx1和hoxa3的同时表达(图1b)。为确认ra的作用,在方案#2中测试了没有ra的方案。ra的添加对于hoxa3表达是必需的(图1d,方案#1相比于#2),与parent等人2013显示的结果一致。
[0190]
fgf10、fgf7、chir(wnt信号传导活化子)和bmp4也是已知调节读出基因的因子(parent等人2013;sun等人2013;soh等人2014;su等人2015)。在方案#1中研究了用这些细胞因子单独取代fgf8的作用。不仅fgf8b ra引起大多数读出基因的最高表达,它是可以驱动tbx1表达(图2b和2c)的唯一组合(图2b)。向使用fgf8b ra的方案中添加bmp4、chir、fgf7和fgf10并没有改善任何第3pp标记物的表达(未示出)。
[0191]
尽管表达大多数读出基因foxn1,但是在培养第15天几乎检测不到tec分化的主要调节因子(romano等人2013)(未示出),从而留下改进的空间。在小鼠中,pax9和pax1在四种pp中表达,并且在出生后局限于tec的亚群(wallin等人1996;hetzer
‑
egger等人2002)。因此,除了作为afe标记物,pax1和pax9也是tec标记物。尽管在方案#1和#2中pax9和pax1的表达在统计学上高于阴性对照(肝脏,
′
肝脏病状
′
(gouon
‑
evans等人2006))(图1e),但在培养第7.5天引入shh作为进一步上调pax9和pax1的策略,因为shh诱导腹侧体节中pax1和pax9的表达(furumoto等人1999)。shh和其受体ptc1都在人tec中表达,并且已经被报道有助于tec分化(saldana等人2016;sacedon等人2003)。
[0192]
由于shh提高了ra清除率(probst等人2002),因此在第6.5天减少ra暴露并用shh替换(图1b)。这导致pax9显著增加(2.5倍;p<0.0001)并且也在pax1中接近显著性(5倍;p=0.053)(图1d,方案#1相比于#3)。tbx1表达也显著增加,与显示shh在pe中诱导tbx1表达的报道一致(图1d)(garg等人2001)。
[0193]
接下来测试从培养第4.5天开始增加向fgf8b中的暴露是否能起到使afe发育朝向pe并增强第3pp基因的表达的作用。在方案#3和#4中均观察到第3pp标记物的等效表达,这
使得我们继续努力并行优化这两个标记,以探究它们在分化第15天以后的潜力(图1f)。
[0194]
实施例3
‑
第3pp的远端化
[0195]
尽管在前化和/或用shh培养期间添加fgf8b提高了第3pp标记物的表达,但第15天培养物显示出低foxn1表达(结果未示出)。在小鼠中,bmp4与foxn1在第3pp内胚层的腹侧/后侧前瞻性胸腺结构域中在e11.5处共表达(moore
‑
scott和manley 2005;bleul和boehm 2005)。因此假设添加bmp4可能会产生更好的foxn1表达。因此,使第15天培养物暴露于bmp4中(图2a,方案#3b和#4b)。然而,对于方案#3b和#4b,添加bmp4不能诱导在培养第22天和30天测定的foxnl表达(结果未示出)。假设在胸腺器官形成后在tec中也表达的pax9表达不足(manley和condie 2010;hetzer
‑
egger等人2002)可能是foxn1表达差的原因。
[0196]
接下来测试头蛋白的添加是否会增加pax9表达。头蛋白是bmp4拮抗剂和/或抑制剂,其在小鼠中在e9.5处在整个第3pa的间充质中表达,紧邻早期第3pp内胚层(patel等人2006)。bmp4表达在第3pp内胚层的细胞中在e10.5处开始(patel等人2006)。假设头蛋白可刚好在bmp4信号传导出现在这个区域之前从间充质扩散至第3pp内胚层细胞。为模拟这个事件,在方案#3c和#4c中从第16天至第22天用头蛋白取代bmp4(图2a)。在添加头蛋白的两种方案中,pax9表达显著增加(图2d)。
[0197]
与方案#3c相比,在方案#4c(前化期间的fgf8b)中观察到foxn1表达水平高五倍(图2e)。因此,进一步优化方案#4c。为证实所述细胞在bmp4添加后产生foxn1,使用方案#4c在第21天与第30天比较foxn1表达。图2f显示foxn1表达在第30天显著高于第21天,从而证实bmp4暴露在第21天后具有增强foxn1表达的潜力。在方案#4c中,第30天的foxn1水平比第15天高8倍(图2g)。
[0198]
与全人胎儿胸腺裂解物相比的tec标记物在培养第30天的基因表达示于图3a中。尽管胸腺基质样品因胸腺细胞的存在而被稀释,但方案4c实现了胸腺裂解物中所见的76%的foxn1表达。这显著高于进行相同比较的其他组所报道的水平(parent等人2013;sun等人2013;su等人2015)。此外,pax9、pax1、dll4、isl1、eya1、six1、il7、k5、k8和airemrna可在与胎儿胸腺相当或更高的水平上检测到。为确定这个方案在其他hesc系中的再现性,用方案#4c处理人h9 es细胞系。tec标记物isl1、foxn1、k5、k8、dll4、aire和il7(图3b)的表达可在用这个方案分化的h9细胞中得到证明。
[0199]
方案#4c培养物在第15天的免疫染色揭示菌落对pe标记物tbx1、eya、isl1和six呈阳性,该pe标记物还与第3pp标记物epcam共染色(结果未示出)。在培养第30天,这些菌落仍然对epcam(一种通用上皮标记物)、k5和uea
‑
1(其与mtec相关)和k8(其与ctec相关)呈阳性(结果未示出)。还发现了foxn1和gcm2的表达水平之间的强相关性(图3c),gcm2是也在第3pp中发现的甲状旁腺标记物。这表明尽管bmp4暴露,但仍存在注定会向甲状旁腺祖细胞成熟的细胞,从而证明第3pp的不完全远端化(gordon等人2001)。il7是由促进胸腺细胞存活、分化和增殖的tec(zamisch等人2005),以及在ctec中起内吞受体的作用的cd205(shakib等人2009)产生的必需细胞因子。发现il7和cd205表达与foxn1的表达相关(图3c)。
[0200]
实施例4
‑
测定hes
‑
tep的功能能力
[0201]
测试用方案#4c分化的hes
‑
tep支持从植入在人源化小鼠中的人造血干细胞的胸腺生成的能力。未分化多能细胞在培养物中的存留是使用es和ipsc衍生物的主要临床翻译障碍。植入实验揭示了在移植时存在多能细胞,导致来自植入物的细胞快速不受控制地生
长并形成畸胎瘤(结果未示出)。与这些结果一致,oct4(一种多能细胞的标记物)在第30天在hes
‑
tep培养物中被检测到(图4c)(pan等人2002)。然而,培养第30天的tep显示oct4在epcam 细胞中共表达(结果未示出),并且qpcr分析显示foxn1和oct4的表达水平之间的相关性(图4b),从而表明oct4表达可能是tec分化程序的部分。
[0202]
据报道,存活素抑制剂ym155选择性地消除多能细胞(lee等人2013)。测试在最后24小时培养中用ym155处理以观察其是否足以消除多能细胞(图4a)。通过ym155处理,oct4表达显著降低(图4c)。到植入后11周,未处理的第15天hes
‑
tep的植入在所有动物中导致畸胎瘤(图4d)。与第15天植入了tep的未处理对照相比,在存在和不存在ym155的情况下培养至30天的hes
‑
tep显示出减少的畸胎瘤形成,其中在接受ym155处理的细胞的组中15只动物中仅有3只出现畸胎瘤(结果未示出)。
[0203]
nsg宿主的天然胸腺雏形能够支持来自人胎儿肝脏来源的hsc的低水平胸腺生成。开发了一种手术去除来自nsg小鼠的天然胸腺雏形的两个叶,以防止植入有人hsc的胸腺切除的(atx)nsg动物中的t细胞发育的方法(khosravi
‑
maharlooei等人2020)。通过从前纵隔收集结缔组织并测定cd4 cd8 发育中的胸腺细胞的缺失来证实atx小鼠中天然胸腺雏形的完全去除(图5a和5b)。因此,为评定植入的hes来源的tep的功能能力,对所有随后的受体进行胸腺切除。
[0204]
实施例5
‑
使用hes
‑
tep/tmc的功能性胸腺器官形成
[0205]
为测试培养的hes
‑
tep支持胸腺生成的功能能力,将与人胸腺间充质细胞(tmc)混合的hes
‑
tep簇(使用方案#4c产生)或单独的tmc植入至静脉注射有2x105个人hsc的atxnsg小鼠的肾囊下。示出了所有小鼠的外周血中的总人cd45 细胞,其中人嵌合体在人源化后11
‑
31周在植入了hes
‑
tep/tmc的小鼠中平均为61% 21%,在植入了tmc的小鼠中平均为81% 13%(图5c)。人hsc植入导致显性b细胞产生(数据未显示)。早在肾囊下tep植入后9周,在植入有hes
‑
tep/tmc的两只小鼠中检测到人cd3 t细胞占总人血细胞的超过1%,并且最终在7只植入了hes
‑
tep的小鼠中的6只中检测到这一现象,而植入了tmc的对照没有显示出外周t细胞重建(图5d)。t细胞偏向cd4 而不是cd8 谱系,然而,7只植入了hes
‑
tep/tmc的小鼠中有4只产生cd4 和cd8 细胞(图5e和5g)。进一步测定cd4 细胞中幼稚t细胞标记物cd45ra和效应/记忆t细胞标记物cd45ro的表达。在产生cd4 和cd8 t细胞的4只小鼠中,cd4 t细胞具有主要的幼稚表型(cd45ra cd45ro
‑
),与从头胸腺生成一致(图5f)。随着时间的推移,cd4 t细胞转化为效应/记忆表型(cd45ra
‑
cd45ro ),与胸腺生成停滞和淋巴细胞减少性扩增一致。
[0206]
hes
‑
tep/tmc中存在低频率的cd4 cd8 双阳性细胞(图5h)。hes
‑
tep/tmc植入物在体积上稍微扩张并呈现紊乱的架构,其中在苏木精(hematoxylin)和伊红(eosin)染色中没有可辨别的皮质或髓质区域(结果未示出)。此外,来自hes
‑
tec/tmc植入物的细胞似乎穿透肾实质,从而表明体内存在从tep培养的细胞分化的多种细胞类型。尽管架构紊乱,但hes
‑
tec/tmc植入物中的一些细胞被tec标记物epcam、广谱细胞角蛋白(pancytokeratin)和人mhc ii(hla
‑
dr)共染色,表明hes
‑
tec长期终末分化和存活(结果未示出)。
[0207]
实施例6
‑
用于测试hes
‑
tec的影响:整合到猪胸腺植入物中的证据的策略
[0208]
假设hes
‑
tep在体内产生真正胸腺组织的能力可能受到胸腺结构支架或产生功能胸腺所需的其他细胞类型的缺失的限制。为解决这种可能性,研究了在人源化小鼠中注射
from human pluripotent stem cells.nat biotechnol,2014.32(1):p.84
‑
91.
[0230]
kischeuer et al.,xenograft tolerance and immune function of human t cells developing in pig thymus xenografts.j immunol,2014.192(7):p.3442
‑
50.
[0231]
khosravi
‑
maharlooei et al.,rapid thymectomy of nsg mice to analyze the role of native and grafted thymi in humanized mice.eur j immunol,2020.50(1):p.138
‑
141.
[0232]
kopinke et al.,retinoic acid is required for endodermal pouch morphogenesis and not for pharyngeal endoderm specification.developmental dynamics,2006.235(10):p.2695
‑
2709.
[0233]
kubo et al.,development of definitive endoderm from embryonic stem cells in culture.development,2004.131(7):p.1651.
[0234]
lai and jin,generation of thymic epithelial cell progenitors by mouse embryonic stem cells.stem cells,2009.27(12):p.3012
‑
20.
[0235]
lee et al..inhibition of pluripotent stem cell
‑
derived teratoma formation by small molecules.proceedings of the national academy of sciences of the united states of america,2013.110(35):p.e3281
‑
e3290.
[0236]
manley and condie,transcriptional regulation of thymus organogenesis and thymic epithelial cell differentiation,in progress in molecular biology and translational science,a.liston,editor.2010,academic press.p.103
‑
120.
[0237]
scott and manley,differential expression of sonic hedgehog along the anterior
‑
posterior axis regulates patterning of pharyngeal pouch endoderm and pharyngeal endoderm
‑
derived organs.developmental biology,2005.278(2):p.323
‑
335.
[0238]
nauman et al.,reduced positive selection of a human tcr in a swine thymus using a humanized mouse model for xenotolerance induction.xenotransplantation,2019:p.e12558.
[0239]
nikolic and sykes,porcine thymus supports development of human t cells that are tolerant to porcine xenoantigens.transplant proc,1999.31(1
‑
2):p.924.
[0240]
pan et al.,stem cell pluripotency and transcription factor oct4.cell research.2002.12(5):p.321
‑
329.
[0241]
parent et al.,generation of functional thymic epithelium from human embryonic stem cells that supports host t cell development.cell stem cell.2013.13(2):p.10.1016/j.stem.2013.04.004.
[0242]
patel et al.,bmp4 and noggin expression during early thymus and parathyroid organogenesis.gene expression patterns,2006.6(8):p.794
‑
799.
[0243]
probst et al.,shh propagates distal limb bud development by enhancing cyp26b1
‑
mediated retinoic acid clearance via aer
‑
fgf signalling.development(cambridge,england),2011.138(10):p.1913
‑
1923.
[0244]
romano et al.,foxn1:a master regulator gene of thymic epithelial development program.frontiers in immunology,2013.4:p.187
‑
187.
[0245]
saced
ó
n et al.,expression of hedgehog proteins in the human thymus.journal of histochemistry and cytochemistry,2003.51(11):p.1557
‑
1566.
[0246]
et al.,sonic hedgehog regulates thymic epithelial cell differentiation.journal of autoimmunity,2016.68:p.86
‑
97.
[0247]
shakib et al.,checkpoints in the development of thymic cortical epithelial cells.the journal of immunology,2009.182(1):p.130.
[0248]
shimizu et al.,comparison of human t cell repertoire generated in xenogeneic porcine and human thymus grafts.transplantation,2008.86(4):p.601
‑
10.
[0249]
siepe et al.,human neonatal thymus
‑
derived mesenchymal stromal cells:characterization,differentiation,and immunomodulatory properties.tissue eng part a,2009.15(7):p.1787
‑
96.
[0250]
soh et al.,foxn1(gfp/w)reporter hescs enable identification of integrin
‑
β4,hla
‑
dr,and epcam as markers of human psc
‑
derived foxn1( )thymic epithelial progenitors.stem cell reports.2014.2(6):p.925
‑
937.
[0251]
su et al.,efficient in vitro generation of functional thymic epithelial progenitors from human embryonic stem cells.sci rep,2015.5:p.9882.
[0252]
sun et al.,directed differentiation of human embryonic stem cells into thymic epithelial progenitor
‑
like cells reconstitutes the thymic microenvironment in vivo.cell stem cell,2013.13(2):p.230
‑
236.
[0253]
swann et al.,cooperative interaction of bmp signalling and foxnl gene dosage determines the size of the functionally active thymic epithelial compartment.scientific reports,2017.7(1):p.8492
‑
8492.
[0254]
sykes and sachs,transplanting organs from pigs to humans.sciimmunol,2019.4(41).
[0255]
tanahe et al.,role of intrinsic(graft)versus extrinsic(host)factors in the growth of transplanted organs following allogeneic and xenogeneic transplantation.am j transplant,2017.17(7):p.1778
‑
1790.
[0256]
thome et al.,spatial map of human t cell compartmentalization and maintenance over decades of lite.cell,2014.159(4):p.814
‑
28.
[0257]
vitelli et al.,a genetic link between tbx1 and fibroblast growth factor signaling.development,2002.129(19):p.4605.
[0258]
vitelli et al.,partial rescue of the tbxl mutant heart phenotype by fgf8:genetic evidence of impaired tissue response to fgf8.journal of molecular and cellular cardiology,2010.49(5):p.836
‑
840.
[0259]
wallin et al.,pax1 is expressed during development of the thymus epithelium and is required for normal t
‑
cell maturation.development,1996.122
(1):p.23.
[0260]
wendling et al.,retinoid signaling is essential for patterning the endoderm of the third and fourth pharyngeal arches.development,2000.127(8):p.1553.
[0261]
yamada et al.,marked prolongation of porcine renal xenograft survival in baboons through the use of alpha1,3
‑
galactosyltransferase gene
‑
knockout donors and the cotransplantation of vascularized thymic tissue.nat med,2005.11(1):p.32
‑
4.
[0262]
zamisch et al.,ontogeny and regulation of il
‑7‑
expressing thymic epithelial cells.the journal of immunology,2005.174(1):p.60.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
