1.本发明涉及生物技术育种领域,具体涉及一种制备水稻光敏型雄性不育材料的方法及其相关基因。
背景技术:
2.杂交育种技术在提高我国及世界水稻产量中起到了举足轻重的作用,是我国粮食安全和农业可持续发展的重要保障。两系不育系配组自由、制种程序简化,但育性受外界环境影响大,制种存在风险,光温敏雄性不育系的选育是两系法杂交水稻育种技术体系研发和应用的核心,目前生产上广泛利用的是温敏不育系,主要受温度控制,相对多变的温度环境,光照长短在一个特定地区更恒定、年度之间差异更小,因此筛选育性转换稳定的光敏雄性不育系在生产上具有极大的应用前景。近年来,随着功能基因组学研究发展,有关于水稻雄性不育与育性恢复遗传体系的研究不断取得重要进展。但是目前生产中除了这些基因的应用之外,还存在很多的暂未被发现且控制光温敏雄性不育的基因,如果对这些基因能够深入挖掘并进行功能研究,将更加全面的扩展、加深对光温敏雄性不育机制的认识与理解,对于选育和创造新型优良的稳定两系不育系具有重要指导意义与应用价值。
技术实现要素:
3.本发明所要解决的技术问题是如何制备光敏型雄性不育水稻。
4.为解决上述技术问题,本发明首先提供了制备光敏型雄性不育水稻的方法。
5.本发明提供的制备光敏型雄性不育水稻的方法,包括:降低目的水稻中蛋白质rms1的丰度、降低目的水稻中蛋白质rms1的活性或降低目的水稻中蛋白质rms1的含量,得到光敏型雄性不育水稻;
6.所述蛋白质rms1为如下a1)或a2):
7.a1)其氨基酸序列如序列表中seq id no.1所示;
8.a2)与a1)具有98%或99%以上同一性且来源于水稻的同源蛋白质。
9.上述蛋白质中,同一性是指氨基酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gap existence cost,per residue gap cost和lambda ratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
10.所述降低目的水稻中蛋白质rms1的丰度、降低目的水稻中蛋白质rms1的活性或降低目的水稻中蛋白质rms1的含量是通过抑制目的水稻中所述蛋白质rms1的编码基因的表达或敲除目的水稻中所述蛋白质rms1的编码基因实现的。所述敲除包括敲除整个基因,也包括敲除基因的部分区段。
11.所述“降低目的水稻中蛋白质rms1的丰度、降低目的水稻中蛋白质rms1的活性或
降低目的水稻中蛋白质rms1的含量”还可通过沉默蛋白质rms1的编码基因实现。
12.所述“降低目的水稻中蛋白质rms1的丰度、降低目的水稻中蛋白质rms1的活性或降低目的水稻中蛋白质rms1的含量”具体可通过对蛋白质rms1的编码基因进行基因编辑实现。
13.所述蛋白质rms1的编码基因为如下b1)-b4)中任一种:
14.b1)其核苷酸序列为序列表中seq id no.2所示的dna分子;
15.b2)其核苷酸序列为序列表中seq id no.3所示的dna分子;
16.b3)与b1)或b2)限定的核苷酸序列具有75%或75%以上同一性,且编码所述蛋白质rms1的dna分子;
17.b4)在严格条件下与b1)或b2)限定的核苷酸序列杂交,且编码所述蛋白质rms1的dna分子。
18.上述基因中,“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码序列2的氨基酸序列组成的蛋白质的核苷酸序列具有75%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
19.所述严格条件是在2
×
ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次5min,又于0.5
×
ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次15min;或,0.1
×
sspe(或0.1
×
ssc)、0.1%sds的溶液中,65℃条件下杂交并洗膜。
20.上述75%或75%以上同一性,可为80%、85%、90%或95%以上的同一性。
21.上述方法中,使所述抑制rms1基因表达或敲除rms1基因,可采用现有技术中的任何方式,以使基因产生缺失突变、插入突变或碱基变换突变,进而抑制rms1基因表达或敲除rms1基因。
22.上述方法中,使抑制目的水稻中所述蛋白质rms1的编码基因的表达或敲除目的水稻中所述蛋白质rms1的编码基因,可采取化学诱变、物理诱变、rnai、基因定点编辑、同源重组等方法。
23.无论采取哪种方法,既可将rms1基因作为靶标,又可将调控rms1基因表达的各个元件作为靶标,只要能实现抑制rms1基因表达或敲除rms1基因。如可以将rms1基因的第1外显子、第2外显子、第3外显子和/或第4外显子作为靶标。
24.上述基因组定点编辑中,可采用锌指核酸酶(zinc finger nuclease,zfn)技术、类转录激活因子效应物核酸酶(transcription activator-like effectornuclease,talen)技术或成簇的规律间隔的短回文重复序列及其相关系统(clusteredregularly interspaced short palindromic repeats/crispr associated,crispr/cas9 system)技术,以及其它能实现基因组定点编辑的技术。
25.本发明的具体实施例中借助crispr/cas9系统实现对水稻中所述蛋白质rms1的编码基因的敲除,其中涉及的靶序列为ccaaggccggtaagcgccgc,所使用的sgrna(向导rna)的编码基因如序列表中seq id no.4所示。
26.进一步具体的,本发明中使用了能表达向导rna和cas9的重组载体pylcrispr/cas9-mt-rms1。所述重组载体pylcrispr/cas9-mt-rms1为用包含有特异sgrna编码基因和
u3启动子的dna片段替换载体pylcrispr/cas9-mtmono的两个bsaⅰ酶切位点之间的片段并保持pylcrispr/cas9-mtmono的其它核苷酸不变得到的重组载体,具体为用序列表中seq id no.5所示的dna分子替换掉载体pylcrispr/cas9-mtmono的两个bsaⅰ酶切位点之间的片段得到的。上述方法适用于任何水稻,如:水稻粳稻品种(oryza sativa subsp.japonica)或水稻籼稻品种(oryza sativa subsp.indica),只要含有上述靶序列即可。本发明列举的例子是水稻品种武运粳7号(oryza sativa subsp.japonica)。
27.本发明还保护特异sgrna。所述特异sgrna的靶标序列如下:ccaaggccggtaagcgccgc。
28.本发明还保护特异重组质粒。所述特异重组质粒为pylcrispr/cas9-mt-rms1。
29.pylcrispr/cas9-mt-rms1含有cas9蛋白的编码基因和sgrna的编码基因。
30.本发明还保护上述特异sgrna或特异重组质粒在水稻育种中的应用;所述水稻育种的目的为培育光敏型雄性不育水稻。
31.本发明还保护一种制备转基因植物的方法,包括如下步骤:将所述特异sgrna的编码基因和cas9蛋白的编码基因导入受体水稻中,得到光敏型雄性不育水稻。所述特异sgrna的编码基因和cas9蛋白的编码基因具体通过所述重组质粒导入受体水稻。
32.为了解决上述技术问题,本发明又提供了一种蛋白质rms1。
33.所述蛋白质rms1为如下a11)或a12):
34.a11)其氨基酸序列如序列表中seq id no.1所示;
35.a12)与a11)具有98%或99%以上同一性且来源于水稻的同源蛋白质。
36.其中,seq id no.1所示的蛋白质由345个氨基酸残基组成。
37.为了解决上述技术问题,本发明还提供了一种编码蛋白质rms1的基因。
38.本发明所提供的编码蛋白质rms1的基因为如下b11)-b14)中任一种:
39.b 11)其核苷酸序列为序列表中seq id no.2所示的dna分子;
40.b 12)其核苷酸序列为序列表中seq id no.3所示的dna分子;
41.b 13)与b11)或b12)限定的核苷酸序列具有75%或75%以上同一性,且编码蛋白质rms1的dna分子;
42.b14)在严格条件下与b11)或b22)限定的核苷酸序列杂交,且编码蛋白质rms1的dna分子。
43.其中,序列表中seq id no.2由1038个核苷酸组成,且编码序列表中seq id no.1所示的蛋白质。
44.为了解决上述技术问题,本发明又提供了一种蛋白质rms1-4。
45.所述蛋白质rms1-4为如下a21)或a22):
46.a21)其氨基酸序列如序列表中seq id no.6所示;
47.a22)与a21)具有98%或99%以上同一性且来源于水稻的同源蛋白质。
48.其中,seq id no.6所示的蛋白质由359个氨基酸残基组成。
49.为了解决上述技术问题,本发明还提供了一种编码蛋白质rms1-4的基因。
50.本发明所提供的编码蛋白质rms1-4的基因为如下b21)-b24)中任一种:
51.b21)其核苷酸序列为序列表中seq id no.7所示的dna分子;
52.b22)其核苷酸序列为序列表中seq id no.8所示的dna分子;
53.b23)与b21)或b22)限定的核苷酸序列具有75%或75%以上同一性,且编码蛋白质rms1-4的dna分子;
54.b24)在严格条件下与b21)或b22)限定的核苷酸序列杂交,且编码蛋白质rms1-4的dna分子。
55.其中,序列表中seq id no.7由1080个核苷酸组成,编码序列表中seq id no.6所示的蛋白质。
56.为了解决上述技术问题,本发明又提供了一种蛋白质rms1-5。
57.所述蛋白质rms1-5为如下a31)或a32):
58.a31)其氨基酸序列如序列表中seq id no.9所示;
59.a32)与a31)具有98%或99%以上同一性且来源于水稻的同源蛋白质。
60.其中,seq id no.9所示的蛋白质由111个氨基酸残基组成。
61.为了解决上述技术问题,本发明还提供了一种编码蛋白质rms1-5的基因。
62.本发明所提供的编码蛋白质rms1-5的基因为如下b31)-b34)中任一种:
63.b31)其核苷酸序列为序列表中seq id no.10所示的dna分子;
64.b32)其核苷酸序列为序列表中seq id no.11所示的dna分子;
65.b33)与b31)或b32)限定的核苷酸序列具有75%或75%以上同一性,且编码蛋白质rms1-5的dna分子;
66.b34)在严格条件下与b31)或b32)限定的核苷酸序列杂交,且编码蛋白质rms1-5的dna分子。
67.其中,序列表中seq id no.10由336个核苷酸组成,编码序列表中seq id no.9所示的蛋白质。
68.为了解决上述技术问题,本发明又提供了一种蛋白质rms1-11。
69.所述蛋白质rms1-11为如下a41)或a42):
70.a41)其氨基酸序列如序列表中seq id no.12所示;
71.a42)与a41)具有98%或99%以上同一性且来源于水稻的同源蛋白质。
72.其中,seq id no.12所示的蛋白质由360个氨基酸残基组成。
73.为了解决上述技术问题,本发明还提供了一种编码蛋白质rms1-11的基因。
74.本发明所提供的编码蛋白质rms1-11的基因为如下b1)-b4)中任一种:
75.b41)其核苷酸序列为序列表中seq id no.13所示的dna分子;
76.b42)其核苷酸序列为序列表中seq id no.14所示的dna分子;
77.b43)与b41)或b42)限定的核苷酸序列具有75%或75%以上同一性,且编码蛋白质rms1-11的dna分子;
78.b44)在严格条件下与b41)或b42)限定的核苷酸序列杂交,且编码蛋白质rms1-11的dna分子。
79.其中,序列表中seq id no.13由1083个核苷酸组成,编码序列表中seq id no.12所示的蛋白质。
80.为解决上述技术问题,本发明还提供了rms1蛋白质或所述rms1蛋白质的编码基因在调控水稻光周期敏感育性中的应用。
81.为解决上述技术问题,本发明还提供了rms1蛋白质或所述rms1蛋白质的编码基因
在培育光敏型雄性不育水稻中的应用。
82.为解决上述技术问题,本发明还提供了以rms1蛋白质或所述rms1蛋白质的编码基因为靶标培育光敏型雄性不育水稻。
83.本发明中,所述雄性不育体现为花粉育性减弱或花粉败育。
84.本发明中,所述光敏型雄性不育为光敏起主导作用的光温敏雄性不育;所述光温敏雄性不育为光温敏核雄性不育。
85.本发明中,所述光敏型雄性不育水稻为花粉育性随光照时间长短的变化而改变的水稻。
86.本发明利用crispr/cas9技术,定点编辑水稻rms1基因,通过移码突变,敲除水稻rms1基因,使蛋白rsm1失活,获得了光敏型雄性不育的新一代水稻种质(rms1基因敲除水稻)。获得的rms1基因敲除水稻与野生型水稻相比,在营养生长阶段无明显差异,但是花粉育性随光照时间长短的变化而改变,在短光照条件下(光照时长为10.5小时;光照时间段温度为30℃,光照强度30000lx;黑暗时间段温度为24℃),rms1基因敲除水稻的花药泛白且干瘪、花粉粒数量显著下降,跟野生型水稻相比,花粉碘染显示含有大量不育花粉粒,育性明显降低;rms1基因敲除水稻在长光照条件下(光照时长为13.5小时;光照时间段温度为30℃,光照强度30000lx;黑暗时间段温度为24℃),rms1基因敲除水稻的花药呈鲜黄色、形态饱满、花粉粒数量正常,与野生型水稻育性一致,与短光照条件下的突变体相比,育性得到恢复。为了进一步探究rms1突变体材料花粉育性与温度的关系,在短光照条件的基础上设置不同温度进行处理。结果表明,rms1突变体花粉的育性在短光照条件下,不论温度高低,花粉数量及可染率都显著低于野生型水稻,进一步证实短光照环境对rms1突变体的花粉育性具有决定性作用。同时在短光照条件下,低温对rms1突变体花粉育性的减退也具有促进作用,增强了突变体rms1花粉不育的特性。由此说明rms1基因敲除水稻为光敏型雄性不育水稻(光敏型雄性核不育水稻)。该光敏型雄性不育水稻可以作为母本与优势品种配组生产杂交种子。该光敏型雄性不育水稻不仅为水稻两系法杂交育种提供了新的不育系材料,也为其他禾本科作物的杂交育种奠定理论基础。
附图说明
87.图1为中间载体pylgrna-u3的图谱。
88.图2为中间载体pylgrna-u3-rms1表达盒扩增电泳检测图。
89.图3为基因组编辑载体pylcrispr/cas9-mtmono载体图谱。
90.图4为重组载体pylcrispr/cas9-mt-rms1转化大肠杆菌的单克隆菌落的pcr检测结果电泳图。
91.图5为重组载体pylcrispr/cas9-mt-rms1测序比对图。
92.图6为rms1基因突变类型及突变后编码的氨基酸类型;其中,9522
38740-target
为野生型水稻9522;编码蛋白黑色部分为rms1核心结构域,灰色部分为rms1突变后新编码的蛋白区域。
93.图7为野生型水稻品种9522和rms1纯合突变体9522
38740-5
杂交f2代群体表型分析。
94.图8为rms1纯合突变体9522
38740-5
与野生型水稻品种9522在不同光照时长的表型比较;其中,a为长光照处理,b为短光照处理。
95.图9为rms1纯合突变体9522
38740-5
与野生型水稻品种9522在短光照不同温度处理下花粉粒i
2-ki染色效果的比较;其中,a为野生型水稻品种9522在短日高温处理后的花粉粒染色镜检图,b为纯合突变体9522
38740-5
在短日高温处理后的花粉粒染色镜检图;c为野生型水稻品种9522在短日低温处理后的花粉粒染色镜检图,d为纯合突变体9522
38740-5
在短日低温处理后的花粉粒染色镜检图。
具体实施方式
96.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
97.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
98.表达载体pylgrna-u3在文献“史江伟,李懿星,宋书锋,邱牡丹,邓尧,李莉.crispr/cas9定点编辑水稻穗发育osal基因.杂交水稻(hybrid rice),2017,32(3):74-78.”中公开过,公众可从湖南杂交水稻研究中心所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
99.表达载体pylcrispr/cas9-mtmono在文献“史江伟,李懿星,宋书锋,邱牡丹,邓尧,李莉.crispr/cas9定点编辑水稻穗发育osal基因.杂交水稻(hybrid rice),2017,32(3):74-78.”中公开过,公众可从湖南杂交水稻研究中心所获得获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
100.水稻品种武运粳7号(原代号9522)在文献“crispr/cas9定点编辑水稻穗发育osal基因.杂交水稻(hybrid rice),2017,32(3):74-78.”中公开过,公众可从湖南杂交水稻研究中心所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
101.实施例1、水稻rms1基因靶标位点的选择及敲除载体的构建
102.本发明的发明人从水稻武运粳7中发现了一个与光敏型雄性不育相关的基因——rms1(reverse male sterility)基因。其中,rms1基因的编码序列如序列表中seq id no.2所示,编码一个由345个氨基酸残基组成的蛋白质rms1,其氨基酸序列如序列表中seq id no.1所示。rms1基因的gdna全长为2623bp,含有3个外显子和4个内含子,其核苷酸序列如序列表中seq id no.3所示。
103.本实施例通过crispr/cas9基因编辑技术敲除水稻rms1基因,得到具有光敏型雄性不育表型的突变体9522
38740-4
、9522
38740-5
和9522
38740-11
,突变体9522
38740-4
、9522
38740-5
和9522
38740-11
均为rms1基因敲除水稻。具体操作方法如下:
104.1、靶序列的设计
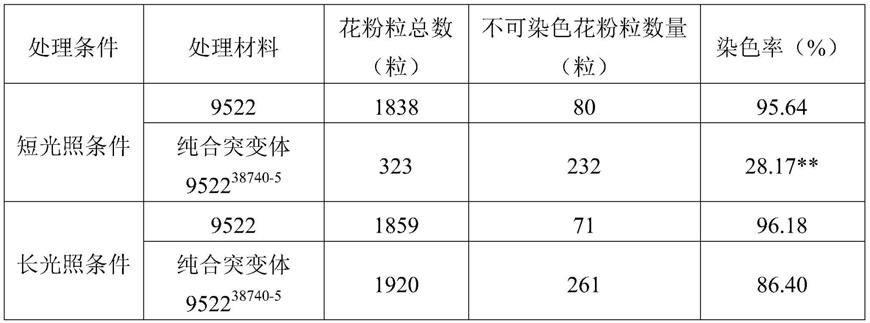
105.所用靶标序列为5
’-
ccaaggccggtaagcgccgc-3’,其位于第1个外显子与第2个内含子序列连接处,即序列3的第384至403位。
106.2、中间载体pylgrna-u3-rms1的构建
107.(1)rms1靶位点接头引物设计及合成
108.靶位点序列确定后,在靶序列正义链5’前加ggca,反义链5’前加aaac,得到靶位点接头引物。靶位点接头引物序列如下:
109.rms1-cas9-f:5
’-
ggcaccaaggccggtaagcgccgc-3’110.rms1-cas9-r:5
’-
aaacgcggcgcttaccggccttgg-3’111.(2)rms1靶位点接头的制备
112.将rms1靶位点接头引物rms1-cas9-f和rms1-cas9-r用ddh2o稀释成浓度为10μm的母液,各取10μl至80μl去离子水中至终体积为100μl,充分混匀后90℃热激30s,移至室温完成退火,获得rms1靶位点接头,标记为rms1-cas9。
113.(3)rms1中间载体的构建
114.将1μl pylgrna-u3载体质粒(如图1所示)、1μl 10
×
t4 dna ligase buffer、1μl靶位点接头rms1-cas9、1μl bsaⅰ限制性内切酶和0.5μl 10
×
t4 dna ligase混合均匀,用pcr仪进行反应,反应条件为:37℃5min,20℃5min,5个循环,获得含有水稻rms1基因靶序列的中间载体,将其命名为pylgrna-u3-rms1。
115.3、rms1定点编辑终载体的构建及转化
116.(1)rms1中间载体表达盒的扩增
117.以中间载体pylgrna-u3-rms1为模板,uctcg-b1(ttcagaggtctctctcgcactggaatcggcagcaaagg)和grcggt-bl(agcgtgggtctcgaccgggtccatccactccaagctc)为引物进行pcr扩增,得到扩增产物。将扩增产物进行凝胶电泳检测,确定其为一条大小约550bp的dna分子(如图2所示),该扩增结果与预期一致。回收纯化该扩增产物,并将其命名为rms1中间载体表达盒。该表达盒包含sgrna编码基因和u3启动子,其中sgrna靶标序列为5
’-
ccaaggccggtaagcgccgc-3’,sgrna编码基因如序列表中seq id no.4所示。
118.(2)rms1定点编辑终载体的构建及转化
119.利用bsaⅰ限制性内切酶和t4 dna ligase,酶切并连接基因编辑载体pylcrispr/cas9-mtmono(如图3所示)和rms1中间载体表达盒,获得rms1基因定点编辑终载体pylcrispr/cas9-mt-rms1。转化大肠杆菌,涂布于含有卡那霉素的平板上,37℃过夜培养。
120.(3)重组载体pylcrispr/cas9-mt-rms1的检测
121.随机挑取步骤(2)中过夜培养的3个单克隆菌落,分别命名为rms1-cas9-1、rms1-cas9-2、rms1-cas9-3,利用pylcrispr/cas9-mtmono载体检测引物sp1(cccgacatagatgcaataacttc)和sp2(gcgcggtgtcatctatgttact)对3个单克隆菌落进行pcr检测。pcr扩增产物进行凝胶电泳,电泳结果(如图4所示)表明,rms1-cas9-2单克隆菌落能扩增出大小为550bp左右的条带,该结果与预期一致。
122.提取rms1-cas9-2单克隆的质粒dna进行测序。测序结果(如图5所示)显示:序列表中seq id no.5所示的dna片段成功替换掉基因编辑载体pylcrispr/cas9-mtmono上两个bsaⅰ酶切位点之间的dna片段。这表明含有u3启动子和sgrna编码基因的表达盒成功构建到基因编辑载体pylcrispr/cas9-mtmono上,即rms1的基因组定点编辑载体构建成功,获得重组载体pylcrispr/cas9-mt-rms1。
123.实施例2rms1突变体水稻材料的获得及其表型分析
124.一、rms1突变体水稻材料的获得
125.利用农杆菌介导转化水稻愈伤组织的方法,将rms1基因定点编辑载体pylcrispr/cas9-mt-rms1转化水稻品种武运粳7号(原代号为9522,以下简称9522)愈伤组织,筛选并鉴定获得阳性突变体。
126.二、定点编辑的检测
127.通过pcr检测获得rms1基因被敲除的3种突变类型的纯合突变体,分别命名为纯合突变体9522
38740-4
、纯合突变体9522
38740-5
、纯合突变体9522
38740-11
。测序结果表明(如图6
示):
128.rms1基因(野生型)在纯合突变体9522
38740-4
中发生了突变,rms1基因cds的第128-129位缺失了2个碱基,该突变导致了rms1基因orf在第126位后发生移位,在rms1 3’utr序列中形成新的终止密码子;将该移码突变后的基因命名为rms1-4基因,rms1-4基因的核苷酸序列如序列表中seq id no.8所示,rms1-4基因的编码序列如序列表中seq id no.7所示,编码一个由359个氨基酸残基组成的蛋白质rms1-4,其氨基酸序列如序列表中seq id no.6所示。
129.rms1基因(野生型)在纯合突变体9522
38740-5
中也发生了突变,rms1基因cds的第127位缺失了1个碱基,该突变导致了rms1基因orf在第126位后发生移位,在rms1基因cds的334-336bp处提前形成一个新的终止密码子,终止翻译;将该移码突变后的基因命名为rms1-5基因;rms1-5基因的核苷酸序列如序列表中seq id no.11所示,rms1-5基因的编码序列如序列表中seq id no.10所示,编码一个由111个氨基酸残基组成的蛋白质rms1-5,其氨基酸序列如序列表中seq id no.9所示。
130.rms1基因(野生型)在纯合突变体9522
38740-11
中发生了突变,rms1基因cds的第127位插入1个碱基,该突变导致了rms1基因orf在第126位后发生移位,在rms1 3’utr序列中形成新的终止密码子;将该移码突变后的基因命名为rms1-11基因;rms1-11基因的核苷酸序列如序列表中seq id no.14所示,rms1-11基因的编码序列如序列表中seq id no.13所示,编码一个由360个氨基酸残基组成的蛋白质rms1-11,其氨基酸序列如序列表中seq id no.12所示。
131.野生型rms1蛋白的2个核心结构域sant分别位于氨基酸序列的第14-61位和第67-112位,由此可知上述位点的突变均导致核心结构域sant的缺失,进而影响到rms1基因的功能。
132.三、rms1突变体f2共分离群体构建及表型分析
133.纯合突变体9522
38740-4
、9522
38740-5
、9522
38740-11
具有相同突变表型和农艺性状。因此,本发明后续实施例中以纯合突变体9522
38740-5
为例进行详细的表型分析。
134.1、f2群体构建
135.以野生型9522作为母本、纯合突变体突变体9522
38740-5
自交得到的t1代单株作为父本进行杂交(种植时间:201806-201810),收获杂交f1种子,f1代群体种植于海南陵水(种植时间:201812-201904);f1代群体自交获得f2代群体,f2代群体种植于湖南长沙(种植时间:201906-201910)。
136.2、表型分析
137.步骤1的f2代分离群体一共42个单株,对该f2分离群体所有单株进行基因型鉴定与分析,共分离到3种基因型,分别为野生型基因型(两条染色单体的相应位置均为来自于野生型水稻的rms1基因)、rms1突变体材料纯合突变体9522
38740-5
纯合基因型(两条染色体的相应位置均为来自于纯合突变体9522
38740-5
的rms1-5基因,后简称9522
38740-5
基因型)、以及野生型与rms1突变体材料纯合突变体9522
38740-5
基因型杂交得到的杂合基因型(即一条染色体的相应位置为来自于野生型水稻的rms1基因,另一条染色体的相应位置为来自于纯合突变体9522
38740-5
的rms1-5基因,后简称杂合基因型)。其中,野生型基因型群体7株,杂合基因型群体26株,9522
38740-5
基因型群体9株,野生型基因型∶杂合基因型∶9522
38740-5
基因型的
分离比为7:26:9,大体符合1:2:1的分离比。
138.种植观察发现,f2代分离群体内各单株株叶形态一致。通过显微观察发现,不同基因型的花药形态不一。f2代分离群体中,野生型群体花药呈鲜黄色、花药形态饱满、花粉粒数目正常,花药镜检可育;杂合基因型群体与野生型群体一致;而9522
38740-5
基因型群体花药异常泛白、花药形态干瘪、花粉粒数目骤然减少,花药镜检结果显示含有大量不育花粉粒(如图7所示)。对应f2群体分离比,说明rms1基因突变导致花药发育异常进而影响受体植株花粉的育性。
139.实施例3rms1突变体水稻材料光敏特性分析
140.1、rms1突变体水稻材料光敏特性分析
141.在海南陵水(18
°
51
′
23
″
n,110
°5′6″
e)自然条件下种植rms1突变体材料纯合突变体9522
38740-4
t2代、纯合突变体9522
38740-5
t2代以及野生型水稻9522,结果发现纯合突变体9522
38740-4
t2代、纯合突变体9522
38740-5
t2代植株结实率低,分别为4.56%和3.13%,而野生型水稻9522的结实率为95.6%(201812-201904);在湖南长沙(28
°
13
′
07
″
n,113
°
15
′
10
″
e)自然条件下种植纯合突变体9522
38740-4
t3代、纯合突变体9522
38740-5
t3代以及野生型水稻9522,结果发现纯合突变体9522
38740-4
t3代、纯合突变体9522
38740-5
t3代突变体结实率分别为35.29%和16.02%,而野生型水稻9522的结实率为96.75%(201906-201910)。相同的rms1突变体水稻株系在不同的地域种植结实率存在明显的差异,认为不同区域的光照长短会影响花粉的育性,从而导致结实率发生变化。
142.为了进一步探究光照对rms1突变体植株花粉育性的影响,在全生育期分别对7株纯合突变体9522
38740-5
t3代植株进行了探索性短光照处理(光照时长为10.5小时,光照强度为30000lx;光照时间段温度30℃,黑暗时间段温度为24℃)与长光照处理(光照时长为13.5小时,光照强度为30000lx;光照时间段温度30℃,黑暗时间段24℃)试验,所有试验均在温度和光照可控的温室中进行。以野生型水稻9522为对照。
143.采集野生型水稻9522和突变体9522
38740-5
t3代植株的成熟花药进行镜检和碘染。碘染时取单株水稻3个小花的花药于载玻片上,用镊子将花药捣碎,使花粉粒释放,再加1-2滴i
2-ki溶液,盖上盖玻片,在显微镜下观察。凡是被染成蓝色的为活力较强的花粉粒,呈黄褐色的为发育不良的花粉粒。每张片子取3个视野,统计花粉的染色率,以染色率表示花粉的育性。
144.结果表明:在短光照条件下野生型水稻9522花药呈鲜黄色、形态饱满,花粉粒数目正常;花粉碘染,染色率为95.64%,表明野生型水稻9522花粉育性正常;同等条件下纯合突变体9522
38740-5
t3代植株的花药泛白且干瘪、花粉粒数量显著下降;花粉碘染染色率仅为28.17%,表明突变体9522
38740-5
t3代植株的花粉育性显著减退(如表1和图8b所示)。
145.在长光照条件下野生型水稻9522的花药呈鲜黄色、形态饱满、花粉粒数目正常;花粉碘染,染色率为96.18%,表明野生型水稻9522花粉育性正常;同等条件下纯合突变体9522
38740-5
t3代植株花药呈鲜黄色、形态饱满、花粉粒数量正常;花粉碘染,染色率为86.40%(如表1和图8a所示)。
146.与短光照条件相比,在长光照条件下,纯合突变体9522
38740-5
t3代植株的花粉粒数目和花粉粒染色率都得到明显恢复,表明纯合突变体9522
38740-5
t3代植株的花粉育性得到恢复。
147.表1不同光照条件下rms1纯合突变体9522
38740-5
t3植株与野生型水稻品种9522的花粉粒i
2-ki染色结果统计
[0148][0149]
注:**p<0.01。
[0150]
由此可知,不同光照条件下,对照材料9522花药颜色、形态、花粉育性镜检均显示一致,说明光照时长不影响受体材料9522花粉的育性。但rms1纯合突变体9522
38740-5
t3代植株的花粉在不同光照时长处理下花药颜色、形态、花粉粒数量等差异明显。在短光照条件下,纯合突变体9522
38740-5
t3代植株的花药颜色泛白、形态干瘪;碘染结果显示,花粉粒数量大幅度减少,且含有大量不育花粉粒,与同等条件下的对照比较差异显著;而在长光照条件下,纯合突变体9522
38740-5
t3代植株的花粉粒的数量及育性都得到显著恢复,纯合突变体9522
38740-5
t3代植株的花药颜色、形态、花粉粒数量等都与同等条件下的对照材料一致。说明rms1突变体材料花粉育性对光照时长敏感,短光照环境下rms1突变体花粉育性骤降,而长光照环境下rms1突变体花粉育性可以得到恢复。
[0151]
2、温度对rms1突变体水稻花粉育性的影响
[0152]
(1)温室条件下温度对rms1突变体水稻育性的影响
[0153]
为了进一步探究rms1突变体材料花粉育性与温度的关系,在12小时短光照条件的基础上设置不同温度进行处理。
[0154]
分别将在大田种植的6株9522
38740-5
t3代植株与6株野生型9522植株在拔节时期移入到培养钵中,以便植株缓和生长。待植株处于孕穗早期再移入到培养箱中进行短光照高低温处理。其中,短光照低温(以下简称短日低温)处理条件为光照时长12小时,光照强度30000lx,温度23℃;短光照高温(以下简称短日高温)处理的条件为光照时长12小时,光照强度30000lx,温度33℃。待植株抽穗后,对不同温度处理下的植株进行花粉镜检。每个单株取3个小花混合镜检。花粉育性镜检方法同上,每张片子取3个视野,统计花粉的染色率,以染色率表示花粉的育性。
[0155]
结果表明:短日高温条件下,野生型水稻9522的花粉碘染可染率为94.41%,同等条件下9522
38740-5
t3代植株的花粉碘染可染率为23.86%;短日低温条件下,野生型水稻9522的花粉碘染可染率为89.75%,同等条件下纯合突变体9522
38740-5
t3代植株的花粉碘染可染率为0(如表2和图9所示)。由此表明,rms1突变体材料纯合突变体9522
38740-5
花粉的育性在短光照条件下,不论温度高低,花粉数量及可染率都显著低于野生型水稻,进一步证实短光照环境对rms1突变体的花粉育性具有决定性作用。同时在短光照条件下,低温对rms1突变体花粉育性的减退也具有促进作用。
[0156]
表2不同温度条件下rms1纯合突变体9522
38740-5
t3植株与野生型水稻品种9522的花粉粒i
2-ki染色结果统计
[0157][0158]
注:**p<0.01。
[0159]
(2)自然环境下温度对rms1突变体水稻花粉育性的影响
[0160]
在海南陵水(18
°
51
′
23
″
n,110
°5′6″
e,201912-202004)自然条件下分两批种植rms1突变体材料纯合突变体9522
38740-5
t4代植株以及野生型水稻9522,第一批次材料播种时间为2019年12月3日,其孕穗期约为2020年2月10至2020年3月5日,该段时间陵水日平均温度为22.2℃,第二批次材料播种时间为2019年12月13日,其孕穗期约为2020年2月20日至2020年3月15日,该段时间陵水日平均温度为23.78℃,两批材料的孕穗期日平均温度相差1.58℃。待植株抽穗后,采集不同批次播种的纯合突变体9522
38740-5
t4代植株以及野生型水稻9522植株的成熟花药进行花粉碘染,每个群体随机挑选3个单株,每个单株取1个视野进行统计。
[0161]
结果发现:第一批次纯合突变体9522
38740-5
t4代植株的花粉镜检可染率为0%,同批次野生型9522花粉镜检可染率为94.87%;而第二批次的纯合突变体9522
38740-5
t4代植株花粉镜检可染率为10.97%,同批次野生型9522花粉镜检可染率为92.19%(如表3所示)。由此表明:同株系突变体材料在同一地点分批次播种出现花粉碘染可染率的变化,说明不同播种时期之间的温度差异可导致花粉育性的变化。
[0162]
表3不同播种批次播种的rms1纯合突变体9522
38740-5
t4植株与野生型水稻品种9522的花粉粒i
2-ki染色结果统计
[0163][0164]
综上,rms1突变体材料的花粉对光照长短反应敏感,具体表现为长日照(长光照)条件下rms1突变体材料的花粉可育;短日照(短光照)rms1突变体材料的花粉的育性显著降
低,且低温可促使突变体rms1花粉完全败育,增强了突变体rms1花粉不育的特性。因此,认为rms1具有反光敏特性,是一个光敏育性相关基因,通过敲除该基因可以获得光敏型雄性不育水稻。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。