1.本发明涉及一种含末端羧基的聚乙二醇的制备方法和活化聚乙二醇的制备方法。
背景技术:
2.近年来,已经积极推动蛋白质和抗体等生物药物的开发。虽然这些生物药物从其特异性和效率的角度来看作为药物具有很高的疗效,但它们的药代动力学较差,诸如从肾脏排泄、被网状内皮系统捕获以及在血液中分解,使得产生体内半衰期短暂的问题。这一问题不仅给药物的临床应用带来了困难,而且也由于药物上市后用药剂量和用药频率的增加,导致患者生活质量显着下降。
3.为了解决上述问题,已经研究了用诸如聚乙二醇(以下称为peg)的水溶性聚合物来修饰药物。通过利用诸如peg的聚合物修饰药物赋予隐身性,能够抑制从肾脏排泄和在血液中分解,并且改善药物在血液中的循环,使得能够延长体内半衰期。因此,已开发出应用了这些特性的peg化生物药物并投放市场。
4.为了用peg修饰生物药物,需要将peg末端转化为与生物药物中存在的氨基、硫醇基等选择性反应的反应性官能团。这种官能团转化之一是将peg末端处的羟基转化为羧基并进一步将其转化为琥珀酰亚胺酯的方法。琥珀酰亚胺酯是蛋白质修饰中最广泛使用的活化基团之一,这是因为该酯在生理条件下与伯胺反应形成稳定的酰胺。
5.然而,对于如上所述的将peg
‑
末端羟基转化为反应性官能团,例如转化为羧基,当末端羟基的化合物在末端官能团从羟基到羧基的转化中保留时,在下一步骤中将琥珀酰亚胺酯引入羧酸末端的反应中,末端羟基未反应而保留为羟基。结果,剩余的羟基与琥珀酰亚胺酯基团反应,这将导致生成多聚peg杂质作为副产物。
6.此外,在诸如peg的高分子化合物中,由于末端官能团对整个分子的物理性质的影响很小,所以从末端羧酸化合物中去除末端羟基化合物通常是困难的,除非进行诸如柱纯化等的收率低的纯化处理。因此,优选从羟基到羧基的转化率高。
7.已知威廉姆森(williamson)醚化反应是将羧基引入在末端处具有羟基的化合物(以下,称为化合物x)中的方法,并且已经应用使分子中具有酯基和离去基团的化合物(以下,称为化合物y)反应并随后水解酯基的方法。
8.下列的专利文献1和2示出威廉姆森醚化反应的合成例。
9.在专利文献1中,在化合物x为硬脂醇且化合物y为卤代烷,使用作为非质子溶剂的甲苯作为溶剂并且使用naoh或koh作为无机碱的情况下进行醚化。
10.另外,在专利文献2中,通过在化合物x为苯基苯酚衍生物并且化合物y为具有末端甲苯磺酰基的低分子量甲氧基peg的情况下,在相转移催化剂的存在下,在甲苯和氢氧化钠水溶液组成的两层系统中进行反应,将化合物y引入化合物x中并使用硅胶柱进行纯化,而以48%收率得到目标产物。
11.现有技术文件
12.专利文献
13.专利文献1:jp
‑
a
‑
62
‑
39537
14.专利文献2:jp
‑
a
‑
2011
‑
84632
技术实现要素:
15.本发明要解决的问题
16.在专利文献1中描述的威廉姆森醚化反应中,当反应混合物中存在水时,由于发生诸如水与化合物y的反应这样的不希望的副反应,所以通过共沸脱水从反应系统中去除水。描述了在共沸蒸馏后系统中的水含量优选小于0.05wt%,并且除非基本上所有的水被蒸馏掉,否则反应不会进行。
17.关于威廉姆森醚化反应的条件,如专利文献1所述,已知一种反应,在例如以甲苯为代表的低质子溶剂中将水含量控制在极低的条件下,使用诸如氢氧化钾或者碳酸钾的无机碱作为催化剂,以抑制不必要的副反应。
18.不必要的副反应包括:在专利文献1作为示例的情况下,在系统中卤代烷由水水解成烯丙醇的反应和作为副产物产生的烯丙醇由卤代烷进一步醚化的反应。
19.然而,在这种通常进行的反应方法中,由于无机碱在非质子溶剂中不溶解并且反应在非均相系统中进行,因此不太可能进行醇化物形成,这是反应的决定速率的因素。
20.如专利文献2中描述的,进行了使用大量水等质子溶剂溶解无机碱的实例,但如上所述,由系统内的水引起的不希望的副反应频繁发生。由于硅胶柱纯化后的收率为48%,因此认为反应获得的目标醚化产物的纯度相应较低。
21.如上所述,尽管含末端羧基的peg是生物制药应用中的重要材料,但是末端羧化的常规制备方法在工业上以良好收率获得高纯度产品方面存在许多问题。
22.本发明的目的在于以良好收率由具有末端羟基的peg制备具有高羧基纯度的peg。
23.本发明的另一个目的是通过使用具有高羧基纯度的peg来制备具有高纯度的用于生物制药应用的活化peg。
24.解决问题的方案
25.本发明人为实现上述目的进行了深入研究,结果发现,在将末端羟基peg溶解在非质子溶剂中后,对于在将水含量控制为低的情况下(基本无水的条件下)常规进行的威廉姆森醚化反应,通过在相对于无机碱存在特定量范围的水的情况下进行醚化反应,能够令人惊讶地获得具有显着高醚化率,即羧酸纯度的peg。
26.由此,本发明如下。
27.(1)一种含末端羧基的聚乙二醇的制备方法,该方法包括下列步骤1和2:
28.步骤1:
29.在含有具有羟基的聚乙二醇、无机碱、非质子溶剂和水的溶液中,使下式(1)的化合物与所述聚乙二醇反应以获得聚乙二醇酯的步骤,其中,在所述溶液中,所述无机碱的质量为所述聚乙二醇的0.5至4倍,所述水的质量相对于所述无机碱为5至20meq,且所述溶液中的所述水的质量为2000ppm以下:
[0030][0031]
其中,在式(1)中,x表示离去基团,a表示4至9的整数,并且r1表示具有1至4个碳原子的烃基;
[0032]
步骤2:
[0033]
水解所述聚乙二醇酯以获得含末端羧基的聚乙二醇的步骤。
[0034]
(2)一种活化聚乙二醇的制备方法,该方法包括下列的步骤1、2和3:
[0035]
步骤1:
[0036]
在含有具有羟基的聚乙二醇、无机碱、非质子溶剂和水的溶液中,使下式(1)的化合物与所述聚乙二醇反应以获得聚乙二醇酯的步骤,其中,在所述溶液中,所述无机碱的质量为所述聚乙二醇的0.5至4倍,所述水的质量相对于所述无机碱为5至20meq,且所述溶液中的所述水的质量为2000ppm以下:
[0037][0038]
其中,在式(1)中,x表示离去基团,a表示4至9的整数,并且r1表示具有1至4个碳原子的烃基;
[0039]
步骤2:
[0040]
水解所述聚乙二醇酯以获得含末端羧基的聚乙二醇的步骤;
[0041]
步骤3:
[0042]
将所述含末端羧基的聚乙二醇的末端羧基转化为活性基团,从而获得具有活性基团的活化聚乙二醇的步骤。
[0043]
发明的有益效果
[0044]
本发明是以良好的收率和高纯度获得用于生物制药应用等的含末端羧基的peg的制备方法。该制备方法不需要常规制备方法所需的无水条件,并且能够以良好的收率提供高纯度的含末端羧基的peg和高纯度的活化peg,而无需进行诸如硅胶柱纯化这样的不适于工业生产的纯化。
附图说明
[0045]
图1是示出相对于无机碱在含水的非质子溶剂的溶液中的水的质量与羧酸的纯度的之间关系的曲线图。
具体实施方式
[0046]
作为通过本发明获得的含末端羧基的聚乙二醇的原料的具有羟基的聚乙二醇优选由下式(2)或(3)表示。
[0047][0048]
在式(2)中,r2表示甲氧基或羟基,n为45至1819。
[0049][0050]
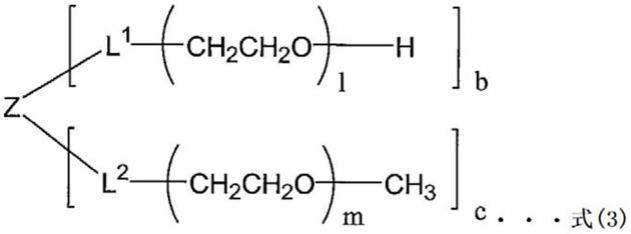
式(3)中,z为具有3至8个活性氢的化合物的残基,l1和l2各自表示
‑
o
‑
或
‑
o
‑
conh
‑
(ch2)3‑
o
‑
,b和c各自为0至8的整数,并且b c=3至8,l表示0或6至606的整数,m表示12至909的整数。
[0051]
在式(2)的具有羟基的聚乙二醇的优选实施例中,式(2)中的r2为甲氧基。
[0052]
此外,在式(2)的具有羟基的聚乙二醇的优选实施例中,式(2)中的r2为羟基。
[0053]
在作为式(3)的具有羟基的聚乙二醇的优选实施例之一的下式(4)中,式(3)中的z为甘油残基,b为3,c为0,l1为
‑
o
‑
,l为15至606。
[0054][0055]
在作为式(3)的具有羟基的聚乙二醇的优选实施例之一的下式(5)中,式(3)中的z为甘油残基,b为1,c为2,l1和l2各自为
‑
o
‑
,l为0,并且m为23至909。或者,b为1,c为2,l1为
‑
o
‑
conh
‑
(ch2)3‑
o
‑
,l2为
‑
o
‑
,l为45至272,并且m为23至773。
[0056][0057]
此外,在式(3)的具有羟基的聚乙二醇的一个优选实施例中,式(3)的z为季戊四醇残基,b为4,c为0,l1为
‑
o
‑
,l为12至454。
[0058]
此外,在作为式(3)的具有羟基的聚乙二醇的优选实施例之一的式(6)中,式(3)中的z为木糖醇残基,b为1,c为4、l1和l2各自为
‑
o
‑
,l为0,并且m为12至454。
[0059][0060]
进一步地,在式(3)的具有羟基的聚乙二醇的一个优选实施例中,式(3)中的z为六甘油残基,b为8,c为0,l1为
‑
o
‑
,并且l为6至227。
[0061]
此外,在式(3)的具有羟基的聚乙二醇的优选实施例中,式(3)中的z为式(7)所示化合物的残基,b为8,c为0,l1为
‑
o
‑
,并且l为6至227。
[0062][0063]
作为式(3)中的z的具有3至8个活性氢的化合物的残基是指甘油、季戊四醇、木糖醇、聚甘油和式(7)表示的化合物中的各自的残基,有助于与其中的聚氧乙烯链结合反应的羟基被去除。
[0064]
(式(1)的化合物)
[0065]
本发明的用于与具有羟基的聚乙二醇反应以得到具有末端羧酸的聚乙二醇酯的化合物如式(1)所示。
[0066][0067]
式(1)地方化合物的结构中包含的x表示离去基团,
‑
(ch2)a
‑
表示烃基,并且r1表示酯基末端处的烃基。
[0068]
离去基团:式(1)的化合物的结构中包含的x为酯化反应中具有脱离性质的官能团,但优选为碘原子、溴原子、氯原子、甲磺酰氧基、p
‑
甲苯磺酰氧基或三氟甲磺酰氧基。作为离去基团,碘原子、溴原子和氯原子是特别优选的。
[0069]
烃基的a:式(1)的化合物的结构中包含的
‑
(ch2)a
‑
表示亚甲基链数,a为4至9,优选为4至6。
[0070]
式(1)的化合物的结构中包含的r1为酯基末端处的烃基。构成r1的烃基优选具有1至4个碳原子,并且更优选具有1至2个碳原子。r1的具体实例优选为甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基和叔丁基,特别优选为甲基和乙基,并且更优选为乙基。
[0071]
通过本发明获得的含末端羧基的聚乙二醇优选由下式(8)或(9)表示。
[0072][0073]
在式(8)中,r3是甲氧基或
‑
o
‑
(ch2)a
‑
cooh,并且a和n具有与上述相同的含义。
[0074]
在式(8)的含末端羧基的聚乙二醇的一个优选实施例中,式中的r3为甲氧基并且a为5。
[0075]
进一步地,在式(8)的含末端羧基的聚乙二醇的优选实施例中,式中的r3为
‑
o
‑
(ch2)a
‑
cooh并且a为5。
[0076][0077]
在式(9)中,a、b、c、l、m、l1、l2和z具有与上述相同的含义。
[0078]
在式(9)的含末端羧基的聚乙二醇的一个优选实施例中,式中的z为甘油残基,a为5,b为3,c为0,l1为
‑
o
‑
,并且l为15至606。
[0079]
进一步地,在式(9)的含末端羧基的聚乙二醇的一个优选实施例中,式中z为甘油残基,a为5,b为1,c为2,l为0,l1和l2各自为
‑
o
‑
,并且m为23至909。
[0080]
此外,在式(9)的含末端羧基的聚乙二醇的一个优选实施例中,式中z为甘油残基,a为5,b为1,c为2,l1为
‑
o
‑
conh
‑
(ch2)3‑
o
‑
,l2为
‑
o
‑
,l为45至272,并且m为23至773。
[0081]
进一步地,在式(9)的含末端羧基的聚乙二醇的一个优选实施例中,式中的z为季戊四醇残基,a为5,b为4,c为0,l1为
‑
o
‑
,并且l为12至454。
[0082]
进一步地,在式(9)的含末端羧基的聚乙二醇的一个优选实施例中,式中的z为木糖醇残基,a为5,b为1,c为4,l1和l2各自为
‑
o
‑
,l为0,并且m为12至454。
[0083]
此外,在式(9)的含末端羧基的聚乙二醇的一个优选实施例中,式中的z为六甘油残基,a为5,b为8,c为0,l1为
‑
o
‑
,且l为6至227。
[0084]
进一步地,在式(9)的含末端羧基的聚乙二醇的一个优选实施例中,式中的z为式(7)所示化合物的残基,a为5,b为8,c为0,l1为
‑
o
‑
,并且l为6至227。
[0085]
通过本发明获得的含末端羧基的聚乙二醇的分子中加成的环氧乙烷单元的总平均摩尔数优选为45以上,更优选为113以上,并且进一步优选为450以上。另外,本发明的在末端处具有羧基的聚乙二醇的分子中加成的环氧乙烷单元的总平均摩尔数优选为1819以下,并且更优选为1023以下。
[0086]
通过本发明获得的含末端羧基的聚乙二醇的重均分子量优选为2000以上,更优选为5000以上,并且进一步优选为20000以上。此外,本发明的末端处具有羧基的聚乙二醇的重均分子量为80000以下,并且更优选为45000以下。
[0087]
本发明获得的含末端羧基的聚乙二醇具有直链或支链结构。支链型为甘油骨架、赖氨酸骨架、季戊四醇骨架、木糖醇骨架、聚甘油骨架或式(4)所示化合物的骨架,并且更优选甘油骨架或季戊四醇骨架。
[0088]
本发明获得的直线型的含末端羧基的聚乙二醇在结构上具有1个或2个羧基,并且支链型具有1个、2个、3个、4个或8个羧基。
[0089]
(步骤1)
[0090]
这是在含有具有羟基的聚乙二醇、质量为聚乙二醇的0.5至4倍的无机碱、非质子溶剂和水的溶液中,使以下式(1)的化合物与聚乙二醇反应以获得聚乙二醇酯的步骤,在所述溶液中水的质量相对于无机碱为5至20meq,且溶液中水的质量为2000ppm以下。
[0091]
作为(步骤1)中使用的无机碱,可以举出氢氧化钠、氢氧化钾、氢化钠、叔丁氧基钾等,氢氧化钠和氢氧化钾是优选的。此外,也可以组合使用无机碱。
[0092]
(步骤1)中使用的无机碱的质量为具有羟基的聚乙二醇的质量的0.5至4倍。当小于0.5质量倍时,具有羟基的聚乙二醇的醇化物形成不能充分进行并且羧酸的纯度可能降低。因此,该量被控制为0.5质量倍以上,但更优选为1质量倍以上。此外,当该量超过4质量倍时,醚化步骤中碱性变得太强,由式(1)表示的化合物中的离去基团可能在反应前分解,并且此外,由于醚化水解后进行的中和操作中使用的酸的量增加并且可能会降低釜效率,所以量控制在4质量倍以下,但更优选为3质量倍以下。
[0093]
(步骤1)中使用的溶剂只要是非质子溶剂就没有特别限制,但从聚乙二醇在本发明的反应温度范围内溶解且不影响反应的角度考虑,优选使用诸如甲苯、二甲苯和甲基叔丁基醚等烃系溶剂。此外,可以组合使用多种这些非质子溶剂。
[0094]
(步骤1)中使用的非质子溶剂是不具有给质子官能团的溶剂。非质子溶剂的量没有特别限制,但在本反应中,只要作为主要原料的具有羟基的聚乙二醇和式(1)表示的化合物溶解在非质子溶剂中,并且无机碱不溶解,使反应在非均相系统中进行即可。因此,为了提高醚化率,需要无机碱充分流动的条件。当非质子溶剂量少时,不能获得充分的流动性,不进行作为反应的决定速率的步骤的聚乙二醇的醇化物形成,并且醚化率变低,使得羧酸的纯度也可能降低。
[0095]
另一方面,当溶剂的量多时,不仅具有羟基的聚乙二醇和式(1)表示的化合物的浓度降低,并且因此,醚化反应速率降低,而且离去基团:式(1)表示的化合物的x由于反应耗时变长而分解且不能有助于反应,使得可能发生醚化率的降低。
[0096]
根据上述观点,待使用的非质子溶剂的量(质量)优选为作为原料的具有羟基的聚乙二醇的质量的5倍以上且30倍以下,更优选为10倍以上且20倍以下。
[0097]
相对于作为原料的具有羟基的聚乙二醇的一个羟基,(步骤1)中使用的式(1)表示的化合物的量优选为5至80摩尔当量,更优选为10至30摩尔当量。
[0098]
必须将(步骤1)中溶液中水的质量控制为水可不分离地溶于非质子溶剂的量。通过将水溶解在非质子溶剂中,无机碱通过自身溶解在非质子溶剂中的水内而被供给到系统中,并且能够促进非质子溶剂中溶解的peg末端的醇化物形成和醚化反应。
[0099]
当溶液中的水的质量相对于无机碱小于5meq时,介导无机碱向非质子溶剂供给的水量减少,使得醇化物生成反应不太可能进行并且羧酸的纯度可能会降低。因此,将非质子溶剂的溶液中的水的质量控制在5meq以上,并且更优选为6meq以上。
[0100]
当溶液中水的质量相对于无机碱大于20meq时,非质子溶剂和水分离,并且供给至非质子溶剂的无机碱量减少,使得醇化物形成和醚化受阻。因此,溶液中的水的质量控制在20meq以下,并且更优选为18meq以下。
[0101]
此外,随着溶液中水的质量变得大于2000ppm,无机碱表面的潮解进一步发展,使得其粘附至反应容器上,反应系统的流动性丧失,并且醇化物形成和醚化不太可能进行。从这点来看,溶液中水的质量被控制在2000ppm以下,但更优选为1500ppm以下。此外,溶液中水的质量的下限不受限制,但优选为100ppm以上,并且更优选为200ppm以上。
[0102]
在本发明的制备方法中,通过在通常为禁水反应的醚化反应中使系统内存在水,能够以良好的收率得到具有高羧基纯度的含羧基peg。
[0103]
(步骤1)中的反应温度没有特别限制,只要它是作为原料的具有羟基的聚乙二醇溶解在非质子溶剂中的温度即可。但是,当反应温度低时,聚乙二醇与式(1)所示化合物的目标醚化反应(以下称为反应a)减慢,并且可能会发生作为与主反应同时发生的副反应的系统中的水与由式(1)表示的化合物的醚化反应(以下称为反应b),使得可能阻碍目标反应a。另一方面,当反应温度高时,作为副反应的反应b比上述目标反应a发生得更快,这同样会阻碍反应a的进行。从这点来看,优选的反应温度为30℃至80℃,并且更优选为30℃至50℃。
[0104]
(步骤2)
[0105]
这是将步骤1中获得的聚乙二醇酯水解以得到含末端羧基的聚乙二醇的步骤。
[0106]
(步骤2)中聚乙二醇酯的水解通过在向(步骤1)中酯化后的反应溶液中加入水并加热来进行。(步骤2)中使用的水的量没有特别限制,但当水量少时,系统的浓度变高,并且未获得充分的搅拌性能,使得水解反应变得不充分并且残留酯化产物,并且因此,羧化率可能会降低。当水的量多时,系统中的碱性降低,并且因此碱水解反应不易进行,使得可能残留酯化产物,并且因此羧化率降低。由上可知,(步骤2)中所使用的水的量优选为具有羟基的聚乙二醇的1至20质量倍。
[0107]
(步骤2)中的水解温度只要水解充分进行就没有特别限定,但是优选为40至100℃。
[0108]
在(步骤2)中水解得到含末端羧基的peg后,通过包括萃取至有机层、浓缩、吸附处理、结晶和干燥中的任一者的步骤来回收含末端羧基的peg。
[0109]
(步骤3)
[0110]
这是制备活化聚乙二醇的方法,其中,通过将(步骤1)和(步骤2)中获得的含末端羧基的聚乙二醇的末端羧基转化为活性基团而制备活化聚乙二醇。
[0111]
描述活化聚乙二醇的定义。
[0112]
本发明中的活化聚乙二醇是将聚乙二醇的末端羧基进行化学转化,从而能够与存在于目标生物药物中的羟基、巯基或者氨基这样的活性基团反应的活化聚乙二醇。
[0113]
作为在(步骤3)中由末端羧基转化的活化基团,可提及琥珀酰亚胺酯基、卤化酰基、重氮乙酰基、丙烯咪唑基等,并且优选为琥珀酰亚胺酯基。
[0114]
(步骤3)中将末端羧基转化为活化基团的方法没有特别限制,但是可以提及将两
分子的含末端羧基的peg在酸性条件下脱水缩合以形成酸酐并引入活化基团的方法、使用缩合剂在转化为活性酯后引入活化基团的方法等,并且优选的是使用缩合剂的方法。
[0115]
用于在(步骤3)中转化为活化基团的缩合剂包括碳二亚胺系缩合剂、咪唑系缩合剂、三嗪系缩合剂、鏻系缩合剂、铀系缩合剂
※
、卤代系缩合剂等。能够没有特别限制地使用这些缩合剂。
[0116]
在(步骤3)中转化为末端羧基的转化反应后,通过包括萃取至有机层、浓缩、吸附处理、结晶、干燥等中的任一者的步骤来回收活化聚乙二醇。
[0117]
本发明的含末端羧基的聚乙二醇是羧基通过碳原子数为4至9的亚烷基结合至聚乙二醇的末端的化合物,并且用于低分子量药物、蛋白质等的修饰。
[0118]
实施例
[0119]
在下文中,将参考实施例更详细地描述本发明。
[0120]
使用以下装置和试剂测量含末端羧基的聚乙二醇的纯度。
[0121]
lc装置:alliance(waters)
[0122]
柱:阴离子交换柱es
‑
502n(asahipak),φ7.5mm
×
100mm
[0123]
流速:1.0ml/分钟
[0124]
柱温:30℃
[0125]
检测器:ri
[0126]
移动相:甲酸铵缓冲液
[0127]
(实施例1)
[0128]
在将101g分子量为5000、一端为羟基并且另一端为甲氧基的直线型peg(来自nof的产品,meh
‑
50h)和1800g甲苯投入5l四颈烧瓶之后,在氮气气氛下升高温度并且在45℃下溶解全部。调整系统内的水含量,并且确认为318ppm(相对于koh的水的量:9.42meq)。在向溶液中加入200g koh(toa kogyo的产品,薄片)后,在40℃的溶液温度下滴加89.2g的6
‑
溴己酸乙酯(tokyo chemical industry co.,ltd.的产品)。在滴加完成后,在40℃下熟化混合物1.5小时。在熟化完成之后,加入700g水,升温至70℃,并且搅拌混合物1小时用以水解。在水解之后,在盐酸的酸性条件下进行分层,并且随后使用有机溶剂从水层中回收末端羧酸peg。在馏出溶剂之后,通过结晶纯化除去低分子量杂质,以获得晶体。
[0129]
获得的含末端羧基的聚乙二醇的纯度为95.8%,并且收率为85.8g(收率:85.8%)。
[0130]
(实施例2)
[0131]
在将41g的分子量为20000、一端为羟基并且另一端为甲氧基的直线型聚乙二醇(来自nof的产品,meh
‑
20t)和323g甲苯投入1l四颈烧瓶并且全部在氮气氛下于110
±
5℃回流1h之后,将系统中的水含量调整为298ppm(水的量相对于koh:5.11meq)。向调整水含量后的溶液中加入82g koh,并且使用滴液漏斗在40℃下滴加9.15g 6
‑
溴己酸乙酯。在滴加完成后,在40℃下熟化混合物4小时。在熟化完成之后,加入287g水,温度升高至70℃,并且进行1小时水解。此后,通过与实施例1相同的操作获得含末端羧酸的聚乙二醇。
[0132]
获得的含末端羧基的聚乙二醇的纯度为97.3%,并且收率为36.1g(收率:88.0%)。
[0133]
(实施例3)
[0134]
在将41g的分子量为20000、一端为羟基并且另一端为甲氧基的直线型聚乙二醇(来自nof的产品,meh
‑
20t)和323g甲苯投入1l四颈烧瓶并且全部在氮气氛下于110
±
5℃回流1h之后,将系统中的水含量调整为513ppm(水的量相对于koh:8.57meq)。向调整水含量后的溶液中加入82g koh,并且使用滴液漏斗在40℃下滴加9.15g 6
‑
溴己酸乙酯。在滴加完成后,在40℃下熟化混合物4小时。在熟化完成之后,加入287g水,温度升高至70℃,并且进行1小时水解。此后,通过与实施例1相同的操作获得含末端羧酸的聚乙二醇。
[0135]
获得的含末端羧基的聚乙二醇的纯度为95.3%,并且收率为35.3g(收率:86.2%)。
[0136]
(比较例1)
[0137]
在将41g的分子量为20000、一端为羟基并且另一端为甲氧基的直线型聚乙二醇(来自nof的产品,meh
‑
20t)和323g甲苯投入1l四颈烧瓶并且全部在氮气氛下于110
±
5℃回流1h之后,测量系统中的水含量并且结果为102ppm(水的量相对于koh:1.75meq)。向溶液中加入82g koh,并且使用滴液漏斗在40℃下滴加9.15g 6
‑
溴己酸乙酯。在滴加完成后,在40℃下熟化混合物4小时。在熟化完成之后,加入287g水,温度升高至70℃,并且进行1小时水解。此后,通过与实施例1相同的操作获得含末端羧酸的聚乙二醇。
[0138]
获得的含末端羧基的聚乙二醇的纯度为61.7%,并且收率为34.7g(收率:84.8%)。
[0139]
在下文中,类似地,具有羟基的聚乙二醇如表1所示地进行描述,并且在表1所示的条件下进行实施例4至6和比较例2和3。在表2中示出结果。
[0140]
[表1]
[0141][0142]
[表2]
[0143]
[0144]
*1:相对于投入的具有羟基的聚乙二醇的投入量的值
[0145]
*2:比较例3中,由于系统内的大量水,所以koh附着在烧瓶壁面,并且完全未获得流动性,使得操作停止。
[0146]
(实施例7)
[0147]
使用40g实施例1中获得的含末端羧基的聚乙二醇,在40℃下溶解于120g甲苯中。通过使用2.03g的n
‑
羟基丁二酰亚胺和3.30g的二环己基碳二亚胺在40℃下进行3小时反应来实现向活化基团的转化。通过结晶纯化去除低分子量杂质,以获得35g活化聚乙二醇。
[0148]
获得的活化聚乙二醇的纯度通过1h
‑
nmr(600mhz、cdcl3)测量,并且结果为95.8%。
[0149]
(实施例8)
[0150]
使用25g实施例5中获得的含末端羧基的聚乙二醇,在45℃下溶解于75g甲苯中。通过使用0.3g的n
‑
羟基丁二酰亚胺和0.5g的二环己基碳二亚胺在40℃下进行3小时反应来实现向活化基团的转化。通过结晶纯化去除低分子量杂质,以获得35g活化聚乙二醇。
[0151]
获得的活化聚乙二醇的纯度通过1h
‑
nmr(600mhz、cdcl3)测量,并且结果为94.3%。
[0152]
(实施例9)
[0153]
使用30g实施例6中获得的含末端羧基的聚乙二醇,在40℃下溶解于90g甲苯中。通过使用1.38g的n
‑
羟基丁二酰亚胺和2.48g的二环己基碳二亚胺在40℃下进行2小时反应来实现向活化基团的转化。通过结晶纯化去除低分子量杂质,以获得25.6g活化聚乙二醇。
[0154]
获得的活化聚乙二醇的纯度通过1h
‑
nmr(600mhz、cdcl3)测量,并且结果为96.3%。
[0155]
表3示出了使用实施例1、5和6中制备的含末端羧基的聚乙二醇制备活化聚乙二醇的结果。
[0156]
[表3]
[0157][0158]
如实施例1至3和表2所示,相比于作为常见情形的水含量控制得低的比较例1的情况以及在水含量控制得超过优选范围的同时进行反应的比较例2的情况,通过本发明的方法获得的含末端羧基的聚乙二醇的羧酸的纯度显著更高。
[0159]
如表3所示,通过使用采用本发明方法获得的含末端羧基的peg,能够获得高纯度的活化peg。
[0160]
综上所述,根据本发明,能够以高纯度和良好的收率在工业上制备含末端羧基的聚乙二醇。另外,本发明是如下的有用方法:通过使用本发明获得的高纯度的含有末端羧基的peg能够得到高纯度的末端活化peg。
[0161]
工业应用性
[0162]
根据本发明,能够提供以良好的收率和高纯度获得用于生物制药应用的含末端羧基的peg的制备方法。
[0163]
虽然已经参考其具体实施例详细地描述了本发明,但对本领域技术人员显而易见的是,能够在不背离本发明的精神和范围的情况下,对本发明进行各种变化或修改。
[0164]
本发明基于2019年3月29日提交的日本专利申请no.2019
‑
066253,该专利的全文作为参考并入本技术。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。