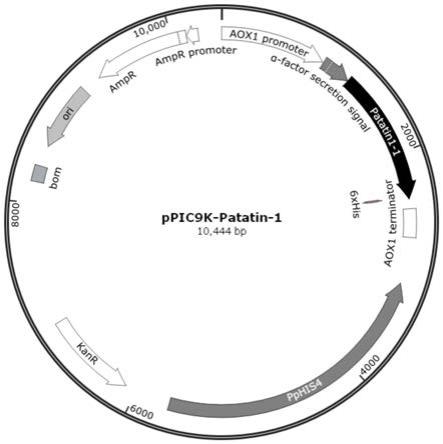
1.本发明属于化学生产和化学合成领域,涉及到酶的分离与应用技术,具体涉及一种类细胞多相乳液光酶体系催化油脂水解脱羧的方法。
背景技术:
2.烷(烯)烃类是在化学生产和化学合成中具有重要角色的化合物、属于不可再生资源,短期内只能通过开采石油和天然气的方式获得。石油作为非可再生资源,其储量十分有限。传统烷(烯)烃制备的方法一般是采用金属离子催化剂、在高压、h2的条件下生成。与传统化学催化相比较,酶催化具有低能耗、低污染、反应条件温和、选择性高等优点,但需要借助昂贵的nadph供能。近年来,beisson及其团队从单细胞绿色小球藻变异菌株nc64a中发现一种以光供能脂肪酸光脱羧酶(cvfap)(beisson,f.science.2017,357,903
‑
907.)以该酶催化为主导,偶联脂肪酶催化技术在蓝光的照射下催化油脂水解脱羧生成相应的烷烃或烯烃,只需简单的光供能,在提高产率、降低催化成本、减少污染排放等方面展示了突出优势,是绿色化学和催化领域最具前景的方向之一。酶催化反应和脂肪酸脱羧反应又是目前全球关注的研究热点,是实现石油替换燃油、废弃资源高值化利用的重要途径。
3.脂肪酸光脱羧酶是一种只依赖于光催化的生物酶,其反应过程必须有光的存在,因此体系的透光是限制其应用的关键因素,而传统的固定化载体催化体系透光性均较差,限制了脂肪酸光脱羧酶的固定化,因而尚未报道有效回用该酶的固定化方法。级联反应与之配套的脂肪酶是一种界面酶,需要有大的界面面积才能发挥其有效催化效率,目前大部分的催化体系均难于能同时满足两种特殊酶的催化需求(高的透光性及催化界面),亟需跳出传统思维,构建与之配套的新型催化体系。
技术实现要素:
4.为解决上述问题,本发明的目的是提供一种类细胞多相乳液光酶体系催化油脂水解脱羧的方法,将脂肪酶和脂肪酸光脱羧酶cvfap同时加入到多相乳液体系中,共表达在一个宿主系统中进行共固定化,脂肪酶催化甘油酯的深度水解,脂肪酸光脱羧酶cvfap催化游离脂肪酸的脱羧,将天然/废弃油脂转化为烷(烯)烃,为开发新一代生物燃料合成技术提供了新的思路。
5.为达到上述目的,本发明采用的技术方案如下:
6.一种类细胞多相乳液光酶体系催化油脂水解脱羧的方法,包含以下步骤:
7.(1)类细胞多相乳液体系的制备
8.向脂肪酶液中加入可溶性盐、聚合物和/或亲水醇、脂肪酸光脱羧酶和油脂,配成类细胞多相乳液体系;
9.或者将可溶性盐、聚合物和/或亲水醇、脂肪酸光脱羧酶和脂肪酸混合均匀,配成类细胞多相乳液体系;
10.(2)将类细胞多相乳液体系于搅拌条件下,在蓝光照射下进行酶催化反应,反应结
束后,加入乙酸乙酯萃取,静置或离心至分为三层,从上自下依次为上液层、中液层和下液层,收集上层液产物,为水解及脱羧后产物。
11.优选地,步骤(1)所述可溶性盐、聚合物和/或亲水醇、油脂、脂肪酸光脱羧酶与脂肪酶质量比为(0.1
‑
20):(0.1
‑
20):(0.1
‑
10):(0.001
‑
20):1;
12.或者步骤(1)所述可溶性盐、聚合物和/或亲水醇、脂肪酸光脱羧酶与脂肪酸质量比为(0.1
‑
20):(0.1
‑
20):(0.002
‑
20):1。
13.优选地,步骤(1)所述可溶性盐、聚合物和/或亲水醇、油脂、脂肪酸光脱羧酶与脂肪酶质量比为(0.2
‑
10):(0.2
‑
10):(0.2
‑
4):(0.005
‑
15):1;
14.或者步骤(1)所述可溶性盐、聚合物和/或亲水醇、脂肪酸光脱羧酶与脂肪酸质量比为(0.2
‑
10):(0.2
‑
10):(0.005
‑
12):1。
15.优选地,步骤(1)所述聚合物和/或亲水醇是聚乙二醇、聚丙二醇、乙醇、正丙醇、异丙醇、正丁醇、异丁醇或乙二醇中的一种或两种以上。
16.优选地,步骤(1)所述聚合物和/或亲水醇是聚乙二醇400或聚乙二醇600。
17.优选地,步骤(1)所述可溶性盐是柠檬酸钠、氯化钠、硫酸钠、硫酸铵、碳酸钠、磷酸钾、磷酸二氢钾和磷酸氢二钾中的一种或两种以上。
18.优选地,步骤(1)所述油脂是食用油、非可食用油、废弃油脂中的一种或两种以上。
19.优选地,步骤(1)所述脂肪酶液中还加入磷脂,磷脂与脂肪酶液质量比为(0.1
‑
10):1。
20.优选地,步骤(1)所述多相乳液体系的ph值为6.5
‑
10.5;步骤(2)的反应条件为:温度30~37℃,反应时间为2h~48h。
21.优选地,步骤(1)所述脂肪酶为脂肪酶ays,浓度为0.005g/ml
‑
0.25g/ml;所述脂肪酸光脱羧酶为人工发酵的全细胞或经简单纯化后的粗酶或经纯化后的纯酶,浓度为0.0002g/ml
‑
1.0g/ml。
22.本发明的有益效果如下:
23.在探索和研究多液相体系的过程中,我们意外发现构成多液相体系的亲水溶剂为聚合物或亲水醇时,其催化效率有大幅提升;而在该体系中加入磷脂等表面活性剂时,其催化效率亦可一步大幅提升。通过对其微观结构的研究,我们发现其在搅拌中形成一种类似生物细胞结构的乳液体系(如图9所示),是引起该高效催化效率的关键。在该结构中,聚合物或亲水醇富集相会包裹疏水相,悬浮于富盐相中(图9a),形成类似于细胞中细胞质包裹细胞核的结构,而磷脂则形成膜状结构包裹聚合物或亲水醇富集相形成一种类似于细胞膜的结构。在该结构中,生物酶聚集于“类细胞质”的聚合物或亲水醇富集相中,其催化活性更为显著,且更为稳定。
24.我们寻找和构建了类似生物液体环境的催化反应体系——“类细胞多相乳液”多酶催化体系,是一类新开发的酶催化体系,该体系拥有大的相界面面积和高透光性,大的界面面积有利于脂肪酶发挥催化作用,高透光性有利于脂肪酸光脱羧酶催化脱羧,该催化体系能同时满足两种特殊酶的催化需求。拥有多个相界面,相界面之间表面张力很低,低表面张力大大降低了反应物质在各相之间的转移速率限制,从而提高转移速率;同时还能为生物酶提供一个类生物细胞环境,有效的维持酶的生物稳定性,保持酶的催化活性,有利于酶的回用,7个批次后酶的相对活力还维持在65%,大幅减少生产成本。又可以利用产物和底
物之间的性质差异实现产物和底物的分离,便于后续的工艺处理。还可以通过调控参数将催化剂和产物分配于不同相,减弱产物抑制效应,加快反应速率,促进反应的正向进行,转化率可高达98.9%。乳液体系水解转化率高于传统体系的转化率,由于传统体系中油水会乳化,影响体系透光性,从而影响转化率。
[0025]“类细胞多相乳液”多酶催化体系与级联催化技术的联合使用为进一步解决能源重生、废弃资源高值化利用领域亟待解决的低效率、高碳排放、高能耗等问题提供科学依据,为拓展酶的级联催化技术应用提供基础数据支持。
附图说明
[0026]
图1(a)为实施例1乳液体系水解后产物经gc检测结果;图1(b)为实施例1传统体系水解后产物经gc检测结果。
[0027]
图2(a)为实施例2乳液体系水解后产物经gc检测结果;图2(b)为实施例2传统体系水解后产物经gc检测结果。
[0028]
图3(a)为实施例3乳液体系水解后产物经gc检测结果;图3(b)为实施例3传统体系水解后产物经gc检测结果。
[0029]
图4(a)为实施例4添加磷脂的乳液体系水解后产物经gc检测结果;图4(b)为乳液体系水解后产物经gc检测结果;图4(c)为实施例4离子液体基多液相乳液体系水解后产物经gc检测结果。
[0030]
图5(a)为实施例5乳液体系水解后产物经gc检测结果;图5(b)为实施例5传统体系水解后产物经gc检测结果。
[0031]
图6(a)为实施例6乳液体系水解后产物经gc检测结果;图6(b)为实施例6传统体系水解后产物经gc检测结果。
[0032]
图7(a)为实施例7乳液体系水解后产物经gc检测结果;图7(b)为实施例7传统体系水解后产物经gc检测结果。
[0033]
图8(a)为实施例8第一批次水解后产物经gc检测结果、8(b)为实施例8第三批次水解后产物经gc检测结果。
[0034]
图9为乳液体系的微观结构,图9a为体系在微观观察结果,绿色为磷脂层,中间被包裹的为油相,酶在界面处;图9b红色的为被染色后的油,蓝色为背景;图9c黄色为上相产物与未被反应的油,蓝色为中间相(peg),界面处的白膜是磷脂和脂肪酶。两个试管分别为加入不同浓度的的成相盐,左边为低浓度,右边为高浓度。
具体实施方式
[0035]
下面结合具体实施例对本发明作进一步具体详细描述,但本发明的实施方式不限于此,对于未特别注明的工艺参数,可参照常规技术进行。
[0036]
脂肪酶ays(lipase ays)购自阿玛诺天野酶制剂商贸有限公司。
[0037]
脂肪酸光脱羧酶的基因序列如下:
[0038]
ttggtttaagcagccgggatctcagtggtggtggtggtggtgctcgagtgcggccgcaagcttttaagcagcaacggtagccggtgcagcagcgctagcaccgatggtcgctttgccggtcagtaaagcagccgcacgttcagcaatcataactaccggagcaccagtctgaccgcccggaattttaggtactacagaagcgtccacgacacgcagaccttcc
acaccatgaacacgcagctggttatcaacaacgctagagctatcacctgcgttacccattttgcaggtaccagtgattgcgttgctagagtgaatgctacgacggatatattcatcgatctggtcatcagatacaacaccggaacctgggaatagttcaccgtccaggtattcagacagcgcagaggaacgtgccacgtcacgcgcccagtggatacctttacgcagggtagccaggtccgcgccgtctttatcggtcaggtagcccggagacagtttcggcggagcgaacggatcagcagatttcagaccaacggaaccagtagactgcggacggcaggcgatcagctgcatagtgataccagaaggccatttaagaccctgagactggaattttgcgaaacgcacgtaggtggatacgccgtccgggtccagtgccatgcccggcacgaaacgtacttgtaaatcgggcaatgcctgaccggcggtgcgaacgaaggcaccacggtcacaaccggtgctagtcaggccaccacgaccgcccaacaggtagctcgcgatcgcgcgtttgcgaatctggcctttttcgttataaatgtggtcgctgatagcgataccatcgtatttttctttaaccggtgctgcagtcaggcatgccggctgatcctgcaggttctgaccaacaccgggccagattggacacaccgggataccgaattccttcagttcagcagacggaccaacactgagtgtttcagtagaacggggtgttgcaccgcacagcgcacatgatcacttcaccacccggcgcagttcgcagacgacgttcgcggtcggacgtcggtgctgacttcaacacccaggtgctggtgctttactggcggcctggtcgatgttaacc
[0039]
将上述基因转入大肠杆菌中,包括以下步骤:
[0040]
1)取商品化的感受态细胞top 10,置于冰上直至溶解;将cvfap质粒也置于冰上预冷,取10μl质粒与100μl top 10感受态细胞充分混匀,置于冰上30分钟。
[0041]
(2)将上述冰浴后的混合物于42℃热激90秒,迅速于冰上放置2~3分钟。
[0042]
(3)将热激后的细胞加入0.5ml lb培养基中,放在摇床中37℃,200rpm条件下活化1小时。
[0043]
(4)将活化后的细胞离心,弃去上清,再加入少量lb培养基重悬细胞,涂布予固体lb抗性平板,做好标记,倒置于37℃恒温培养箱中培养12h后转入试管发酵。
[0044]
将120克大肠杆菌全细胞破碎提取后,经浓缩后可得到约50ml蛋白液(粗酶液),粗酶液浓度为14mg/ml(经蛋白浓度测定),其中光脱羧酶约占10%,约70mg光脱羧酶,即每克大肠杆菌全细胞约含有光脱羧酶0.58mg。
[0045]
在37℃条件下,每分钟消耗1umol脂肪酸所需的酶量定义为1个脱羧酶活力单位u。
[0046][0047]
x为脱羧酶活力u/g;c为脂肪酸浓度mm;v为脂肪酸溶液体积ml;m为酶的用量或全细胞的用量g。
[0048]
根据计算粗酶液酶活为347u/g,大肠杆菌全细胞酶活为808u/g。
[0049]
实施例1
[0050]
取0.05g脂肪酶ays置于透明玻璃瓶中,0.24g磷酸氢二钾,1ml(0.975g)tris
‑
hcl(100mm,ph=8.5)溶液,混匀后,加入1.5ml(约0.6g)大肠杆菌全细胞(内含cvfap)混匀,加入0.233g聚乙二醇400和0.05g餐饮废油,装入缠有能产生蓝光的led灯装置的夹层烧杯中,并置于转速为1000rpm的恒温搅拌器上,控制在30℃下反应12h。反应结束后,加入体系体积2倍的乙酸乙酯萃取,设定12000rpm转速离心3min,分为三层,依次为上液层、中液层和下液层,水解后自由脂肪酸和脱羧产生的长链烷烃、未参与反应的酯主要富集于上液层,收集上液层产物即为产物,所得产物经gc测定(图1a),转换率可达98.9%,产物主要为c11~c17的烷烃类。
[0051]
另取空白玻璃瓶,加入相同质量的脂肪酶ays、tris
‑
hcl缓冲液,1.5ml(约0.6g)大
肠杆菌全细胞(内含cvfap)混匀后加入0.05g餐饮废油,置于相同条件下反应12h,加入体系体积2倍的乙酸乙酯萃取,设定12000rpm转速离心3min,分为两层,为上液层、下液层,水解后自由脂肪酸和脱羧产生的长链烷烃、未参与反应的酯主要富集于上液层,收集上液层产物即为产物。所得产物经gc测定(图1b),转换率仅为37%。
[0052]
实施例2
[0053]
取0.05g脂肪酶ays置于透明玻璃瓶中,0.30g硫酸钠,1ml(0.975g)tris
‑
hcl(100mm,ph=8.5)溶液,混匀后,加入1.5ml(约0.6g)大肠杆菌全细胞(内含cvfap)混匀,加入0.279g聚乙二醇600和0.05g山茶油,装入缠有能产生蓝光的led灯装置的夹层烧杯中,并置于转速为1000rpm的恒温搅拌器上,控制在30℃下反应12h。反应结束后,加入体系体积2倍的乙酸乙酯萃取,设定12000rpm转速离心3min,分为三层,依次为上液层、中液层和下液层,水解后自由脂肪酸和脱羧产生的长链烷烃、未参与反应的酯主要富集于上液层,收集上液层产物即为产物,所得产物经gc测定(图2a),转换率可达95%,产物主要为c11~c17的烷烃类。
[0054]
另取空白玻璃瓶,加入相同质量的脂肪酶ays、tris
‑
hcl缓冲液,1.5ml(约0.6g)大肠杆菌全细胞(内含cvfap)混匀后加入0.05g山茶油,置于相同条件下反应12h,加入体系体积2倍的乙酸乙酯萃取,设定12000rpm转速离心3min,分为两层,为上液层、下液层,水解后自由脂肪酸和脱羧产生的长链烷烃、未参与反应的酯主要富集于上液层,收集上液层产物即为产物。所得产物经gc测定(图2b),转换率仅为76%。
[0055]
实施例3
[0056]
取0.05g脂肪酶ays置于透明玻璃瓶中,0.24g磷酸氢二钾,1ml(0.975g)tris
‑
hcl(100mm,ph=8.5)溶液,混匀后,加入1.5ml(约0.6g)大肠杆菌全细胞(内含cvfap)混匀,加入0.285g聚乙二醇400、0.05g大豆油,装入缠有能产生蓝光的led灯装置的夹层烧杯中,并置于转速为1000rpm的恒温搅拌器上,控制在30℃下反应12h。反应结束后,加入体系体积2倍的乙酸乙酯萃取,设定12000rpm转速离心3min,分为三层,依次为上液层、中液层和下液层,水解后自由脂肪酸和脱羧产生的长链烷烃、未参与反应的酯主要富集于上液层,收集上液层产物即为产物。所得产物经gc测定(图3a),转换率可达82%,产物主要为c11~c17的烷烃类。
[0057]
另取空白玻璃瓶,加入相同质量的脂肪酶ays、tris
‑
hcl缓冲液,1.5ml(约0.6g)大肠杆菌全细胞(内含cvfap)混匀后加入0.05g大豆油,置于相同条件下反应12h,加入体系体积2倍的乙酸乙酯萃取,设定12000rpm转速离心3min,分为两层,为上液层、下液层,水解后自由脂肪酸和脱羧产生的长链烷烃、未参与反应的酯主要富集于上液层,收集上液层产物即为产物。所得产物经gc测定(图3b),转换率仅为53%。
[0058]
实施例4
[0059]
取0.05g脂肪酶ays置于透明玻璃瓶中,0.24g磷酸氢二钾,0.5ml(0.487g)tris
‑
hcl(100mm,ph=8.5)溶液和0.05g磷脂,混匀后,加入粗酶液(内含cvfap)0.487g,混匀后加入0.285g聚乙二醇400和0.05g餐饮废油,装入缠有能产生蓝光的led灯装置的夹层烧杯中,并置于转速为1000rpm的恒温搅拌器上,控制在30℃下反应12h。反应结束后,加入体系体积2倍的乙酸乙酯萃取,设定12000rpm转速离心3min,分为三层,依次为上液层、中液层和下液层,水解后自由脂肪酸和脱羧产生的长链烷烃、未参与反应的酯主要富集于上液层,收集上
液层产物即为产物,所得产物经gc测定(图4a),转换率可达65%,产物主要为c11~c17的烷烃类。
[0060]
再取空白玻璃瓶,加入相同质量的tris
‑
hcl缓冲液、磷酸氢二钾、脂肪酶ays、粗酶液(内含cvfap),混匀后加入0.285g聚乙二醇400和餐饮废油,装入缠有能产生蓝光的led灯装置的夹层烧杯中,并置于转速为1000rpm的恒温搅拌器上,控制在30℃下反应12h。反应结束后,加入体系体积2倍的乙酸乙酯萃取,设定12000rpm转速离心3min后分为三层,依次为上液层、中液层和下液层,水解后自由脂肪酸和脱羧产生的长链烷烃、未参与反应的酯主要富集于上液层,收集上液层产物即为产物,所得产物经gc测定(如图4b),转换率约为55%,产物主要为c11~c17的烷烃类。
[0061]
另取空白玻璃瓶,加入相同质量的脂肪酶ays、磷酸氢二钾、tris
‑
hcl缓冲液、以及0.487g的粗酶液(内含cvfap),混匀后加入[bmim]bf4和0.05g餐饮废油,构成离子液体基多液相乳液体系,置于相同条件下反应12h,加入体系体积2倍的乙酸乙酯萃取,设定12000rpm转速离心3min,分为三层,为上液层、中液层和下液层,水解后自由脂肪酸和脱羧产生的长链烷烃、未参与反应的酯主要富集于上液层,收集上液层产物即为产物。所得产物经gc测定(图4c),转换率仅为35%。其他条件相同,将[bmim]bf4替换为[bmim]br时,转换率仅为32.7%
[0062]
实施例5
[0063]
取0.05g脂肪酶ays置于透明玻璃瓶中,0.24g硫酸钠,1ml(0.975g)tris
‑
hcl(100mm,ph=8.5)溶液,混匀后,加入1.5ml(约0.6g)大肠杆菌全细胞(内含cvfap)混匀后加入0.285g聚乙二醇600、0.05g橄榄油,装入缠有能产生蓝光的led灯装置的夹层烧杯中,并置于转速为1000rpm的恒温搅拌器上,控制在30℃下反应12h。反应结束后,加入体系体积2倍的乙酸乙酯萃取,设定12000rpm转速离心3min,分为三层,依次为上液层、中液层和下液层,水解后自由脂肪酸和脱羧产生的长链烷烃、未参与反应的酯主要富集于上液层,收集上液层产物即为产物。所得产物经gc测定(图5a),转换率可达86%,产物主要为c11~c17的烷烃类。
[0064]
另取空白玻璃瓶,加入相同质量的脂肪酶ays、tris
‑
hcl缓冲液,1.5ml(约0.6g)的大肠杆菌全细胞(内含cvfap)混匀后加入0.05g橄榄油,置于相同条件下反应12h,加入体系体积2倍的乙酸乙酯萃取,设定12000rpm转速离心3min,分为两层,为上液层、下液层,水解后自由脂肪酸和脱羧产生的长链烷烃、未参与反应的酯主要富集于上液层,收集上液层产物即为产物。所得产物经gc测定(图5b),转换率仅为40%。
[0065]
实施例6
[0066]
取0.05g脂肪酶ays置于透明玻璃瓶中,0.24g磷酸氢二钾,1ml(0.975g)tris
‑
hcl(100mm,ph=8.5)溶液,混匀后,加入1.5ml(约0.6g)大肠杆菌全细胞(内含cvfap),混匀后加入0.285g聚乙二醇600和0.05g大豆油,装入缠有能产生蓝光的led灯装置的夹层烧杯中,并置于转速为1000rpm的恒温搅拌器上,控制在30℃下反应12h。反应结束后,加入体系体积2倍的乙酸乙酯萃取,设定12000rpm转速离心3min,分为三层,依次为上液层、中液层和下液层,水解后自由脂肪酸和脱羧产生的长链烷烃、未参与反应的酯主要富集于上液层,收集上液层产物即为产物,所得产物经gc测定(图6a),转换率可达92%,产物主要为c11~c17的烷烃类。
[0067]
另取空白玻璃瓶,加入相同质量的脂肪酶ays、tris
‑
hcl缓冲液,1.5ml(约0.6g)大肠杆菌全细胞(内含cvfap)混匀后加入0.05g大豆油,置于相同条件下反应12h,加入体系体积2倍的乙酸乙酯萃取,设定12000rpm转速离心3min,分为两层,为上液层、下液层,水解后自由脂肪酸和脱羧产生的长链烷烃、未参与反应的酯主要富集于上液层,收集上液层产物即为产物。所得产物经gc测定(图6b),转换率仅为34%。
[0068]
实施例7
[0069]
在透明玻璃瓶中,加入0.24g磷酸氢二钾,1ml(0.975g)tris
‑
hcl(100mm,ph=8.5)溶液,混匀后,加入1.5ml(约0.6g)大肠杆菌全细胞(内含cvfap),混匀后加入0.285g聚乙二醇400和0.05g油酸,装入缠有能产生蓝光的led灯装置的夹层烧杯中,并置于转速为1000rpm的恒温搅拌器上,控制在30℃下反应12h。反应结束后,加入体系体积2倍的乙酸乙酯萃取,设定12000rpm转速离心3min,分为三层,依次为上液层、中液层和下液层,水解后自由脂肪酸和脱羧产生的长链烷烃、未参与反应的酯主要富集于上液层,收集上液层产物即为产物,所得产物经gc测定(图7a),转换率可达100%,产物主要为c11~c17的烷烃类。
[0070]
另取空白玻璃瓶,加入相同质量的tris
‑
hcl缓冲液,1.5ml(约0.6g)大肠杆菌全细胞(内含cvfap)混匀后加入0.05g含油酸,置于相同条件下反应12h,加入体系体积2倍的乙酸乙酯萃取,设定12000rpm转速离心3min,分为两层,为上液层、下液层,水解后自由脂肪酸和脱羧产生的长链烷烃、未参与反应的酯主要富集于上液层,收集上液层产物即为产物。所得产物经gc测定(图7b),转换率仅为56%。
[0071]
实施例8
[0072]
在透明玻璃瓶中,0.24g磷酸氢二钾,1ml(0.975g)tris
‑
hcl(100mm,ph=8.5)溶液,混匀后,加入1.5ml(约0.6g)大肠杆菌全细胞(内含cvfap),混匀后加入0.285g聚乙二醇400和0.05g大豆油,装入缠有能产生蓝光的led灯装置的夹层烧杯中,并置于转速为1000rpm的恒温搅拌器上,控制在30℃下反应4h。反应结束后,加入体系体积2倍的乙酸乙酯萃取,设定12000rpm转速离心3min,分为三层,依次为上液层、中液层和下液层,水解后自由脂肪酸和脱羧产生的长链烷烃、未参与反应的酯主要富集于上液层,将上相完全除去后在重新补入0.05g大豆油,置于相同的反应环境中反应4h。重复7个批次。每个批次的上液层都经gc测定计算相对酶活。以第一批次的反应酶活为100%,后续6批次的活性分别为:95%、86%、72%、70%、68%、65%,7个批次后酶的相对活力还维持在65%。
[0073]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。