:
1.本发明属于化学合成技术领域,具体地说,涉及一种美拉沙星的合成方法。
背景技术:
2.美拉沙星(merafloxacin)是一种含氟喹诺酮结构化合物,于上世纪80年代由美国沃纳兰波特制药公司(warner-lambert)研发,作为含氟喹诺酮类抗感染药物的潜在药物,代号ci-934,但该化合物并未上市。2021年6月,美国《科学》杂志报道了美拉沙星具有抑制病毒复制过程中的“移码”效应,使该化合物重新进入人们的视野,并受到极大关注。病毒生命周期中的一个重要步骤是使用正常细胞的核糖体来合成病毒所需的蛋白质。对于健康的没有感染病毒的细胞,核糖体“按部就班”地沿着rna移动,一次读取三个rna字母,但是,有时核糖体不遵循常规读取三个字母的步骤,而是会漏掉一两个rna字母,核糖体发生的这种错位被称为“移码”。健康细胞中发生“移码”会导致细胞蛋白功能失调,但对于某些病毒,如冠状病毒和hiv病毒,则依赖“移码”来调节病毒蛋白的水平,因此,“移码”对于病毒复制是必不可少的,而具有抑制“移码”作用的化合物,则可能是一种治疗病毒感染的潜在药物。美拉沙星(merafloxacin)分子具有较好抑制“移码”过程,可使新冠病毒的滴度降低3~4个数量级,且对细胞没有毒性,因而具有非常好的发展潜力。
3.目前美拉沙星的合成方法,主要有以下两种:
4.(1)、以3-氧代-3-(2,3,4,5-四氟苯基)丙酸为原料,经缩合、取代、环合、侧链取代等反应合成:
[0005][0006]
该合成方法的不足之处在于,原料价格昂贵,反应总收率较低,原子经济性较差。
[0007]
(2)、以2,4,5-三氟硝基苯为原料,经还原、缩合、环合、乙基取代、水解、侧链取代等反应合成:
[0008][0009]
该合成方法的不足之处在于,原料与试剂价格较高,反应步骤较长,反应条件较苛刻,反应总收率较低,原子经济性较差。
技术实现要素:
[0010]
本发明的目的在于提供一种原料价廉易得、合成步骤短、操作简单、反应条件温和、合成收率高、产品质量好、适合工业化应用的美拉沙星的合成方法。
[0011]
本发明采用的技术方案如下:
[0012]
一种美拉沙星的合成方法,其特征在于,包括以下步骤:
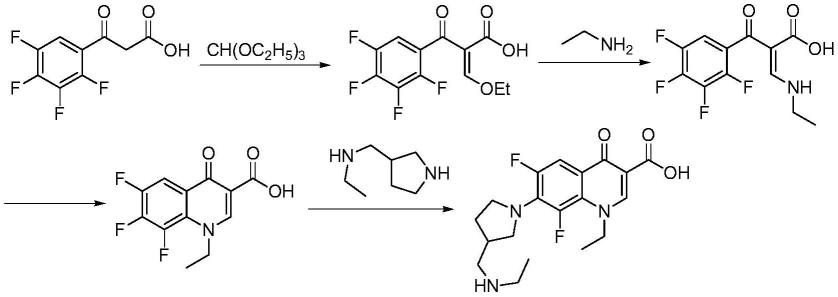
[0013]
(1)、2,3,4,5-四氟苯甲酰氯(i)与n,n-二甲氨基丙烯酸乙酯(ii)反应,得到2-(2,3,4,5-四氟苯甲酰基)-3-(二甲氨基)丙烯酸乙酯(iii);
[0014]
(2)、步骤(1)所得的2-(2,3,4,5-四氟苯甲酰基)-3-(二甲氨基)丙烯酸乙酯(iii)与乙胺(iv)反应,得到2-(2,3,4,5-四氟苯甲酰基)-3-乙氨基丙烯酸乙酯(v);
[0015]
(3)、步骤(2)所得的2-(2,3,4,5-四氟苯甲酰基)-3-乙氨基丙烯酸乙酯(v),经关环反应,得到1-乙基-4-氧代-6,7,8-三氟-1,4-二氢喹啉-3-羧酸乙酯(vi);
[0016]
(4)、步骤(3)所得的1-乙基-4-氧代-6,7,8-三氟-1,4-二氢喹啉-3-羧酸乙酯(vi),与3-(乙氨基甲基)吡咯烷(vii)反应,得到1-乙基-4-氧代-6,8-二氟-7-[3-(乙氨基甲基)吡咯烷-1-基]-1,4-二氢喹啉-3-羧酸乙酯(viii);
[0017]
(5)、步骤(4)所得的1-乙基-4-氧代-6,8-二氟-7-[3-(乙氨基甲基)吡咯烷-1-基]-1,4-二氢喹啉-3-羧酸乙酯(viii),经水解反应,得到美拉沙星(ix)。
[0018]
本发明采用的合成路线可用如下反应式表示:
[0019]
。
[0020]
本发明的进一步设置如下:
[0021]
步骤(1)中:
[0022]
2,3,4,5-四氟苯甲酰氯(i)与n,n-二甲氨基丙烯酸乙酯(ii)的物质的量之比为:1:(1~2)。
[0023]
反应需在适当的缚酸剂存在下才能顺利进行。缚酸剂,不仅用于中和反应过程中生成的氯化氢,同时还起着催化反应的作用。缚酸剂,可以是有机碱类化合物,如三乙胺、吡啶等,也可以是无机碱类化合物,如碳酸钠、碳酸钾等。优选的缚酸剂为有机碱类化合物,选自以下一种或几种:烷基叔胺,结构式如下:
[0024][0025]
其中:r1、r2、r3分别为c1~c6直链、支链或环状烷基,代表性化合物有:三甲胺、三乙胺、三正丙胺、三异丙胺、三正丁胺、三异丁胺、三仲丁胺、三正戊胺、三正己胺、甲基二乙胺、甲基二正丙胺、甲基二异丙胺、二甲基乙胺、二甲基正丙胺、二甲基异丙胺、乙基二正丙胺、乙基二异丙胺、二乙基正丙胺、二乙基异丙胺、n-甲基吡咯烷、n-甲基吗啉、n-甲基哌啶、dbu等;和(或)吡啶及其衍生物,结构式如下:
[0026][0027]
其中:r4为h、c1~c6直链或支链烷基、c1~c4直链或支链烷基取代仲胺基,代表性化合物有:吡啶、2-甲基吡啶、2-乙基吡啶、3-甲基吡啶、3-乙基吡啶、4-甲基吡啶、4-乙基吡啶、4-二甲氨基吡啶、2,6-二甲基吡啶等。缚酸剂与2,3,4,5-四氟苯甲酰氯(i)的物质的量之比为:(1~3):1。
[0028]
反应在适当的有机溶剂中进行,选用的有机溶剂,可以是醚类溶剂、芳烃类溶剂、卤代芳烃类溶剂、卤代烷烃类溶剂、腈类溶剂、极性非质子性溶剂等,可以是单一溶剂,也可以是一种或几种有机溶剂组成的混合溶剂。代表性有机溶剂,选自以下一种或几种:四氢呋喃、2-甲基四氢呋喃、1,4-二氧六环、异丙醚、甲基叔丁基醚、乙二醇二甲醚、二乙二醇二甲醚、苯甲醚、苯乙醚、二苯醚、苯、甲苯、乙苯、二甲苯、氯苯、二氯苯、三氯苯、二氯甲烷、三氯甲烷、四氯化碳、1,2-二氯乙烷、乙腈、丙腈、苯甲腈、n,n-二甲基甲酰胺、二甲基亚砜、环丁砜、n-甲基吡咯烷酮等。有机溶剂用量为2,3,4,5-四氟苯甲酰氯(i)质量的1~20倍。
[0029]
反应温度为0~150℃,优选的反应温度为30~120℃。
[0030]
反应结束后的体系,可不经任何纯化操作,直接进行步骤(2)的反应,亦可进行适当处理,在获得纯度更高的的化合物(iii)后,再进行步骤(2)的反应。优选方式为:不进行纯化处理,直接进行步骤(2)的反应,以简化操作流程,提升合成效率,减少操作损失,提高反应总收率。
[0031]
步骤(2)中:
[0032]
乙胺(iv)与化合物(iii)的物质的量之比为:(1~3):1。
[0033]
反应在适当的有机溶剂中进行,选用的有机溶剂,可以是醚类溶剂、芳烃类溶剂、卤代芳烃类溶剂、卤代烷烃类溶剂、腈类溶剂、极性非质子性溶剂等,可以是单一溶剂,也可以是一种或几种有机溶剂组成的混合溶剂。代表性有机溶剂,选自以下一种或几种:四氢呋喃、2-甲基四氢呋喃、1,4-二氧六环、异丙醚、甲基叔丁基醚、乙二醇二甲醚、二乙二醇二甲醚、苯甲醚、苯乙醚、二苯醚、苯、甲苯、乙苯、二甲苯、氯苯、二氯苯、三氯苯、二氯甲烷、三氯甲烷、四氯化碳、1,2-二氯乙烷、乙腈、丙腈、苯甲腈、n,n-二甲基甲酰胺、二甲基亚砜、环丁砜、n-甲基吡咯烷酮等。有机溶剂用量为化合物(iii)质量的1~10倍。
[0034]
反应温度为-20~80℃,优选的反应温度为-10~60℃。
[0035]
反应结束后的体系,可通过纯化处理,得到高纯度化合物(v),再进行步骤(3)的反应,亦可仅经简单后处理,即进行步骤(3)的反应。优先方式为:对反应体系进行简单的洗涤操作,如水洗、酸洗等,将反应过程中生成的有机胺盐等副产物洗除,得到化合物(v)溶液,即进行步骤(3)的反应,最大限度简化操作流程,提升合成效率,减少操作损失,提高反应总收率。
[0036]
步骤(3)中:
[0037]
反应在适当的有机溶剂中进行,选用的有机溶剂,可以是醚类溶剂、芳烃类溶剂、卤代芳烃类溶剂、卤代烷烃类溶剂、腈类溶剂、极性非质子性溶剂等,可以是单一溶剂,也可以是一种或几种有机溶剂组成的混合溶剂。代表性有机溶剂,选自以下一种或几种:四氢呋喃、2-甲基四氢呋喃、1,4-二氧六环、异丙醚、甲基叔丁基醚、乙二醇二甲醚、二乙二醇二甲醚、苯甲醚、苯乙醚、二苯醚、苯、甲苯、乙苯、二甲苯、氯苯、二氯苯、三氯苯、二氯甲烷、三氯甲烷、四氯化碳、1,2-二氯乙烷、乙腈、丙腈、苯甲腈、n,n-二甲基甲酰胺、二甲基亚砜、环丁砜、n-甲基吡咯烷酮等。有机溶剂用量为化合物(v)质量的1~10倍。
[0038]
反应需在适当的缚酸剂存在下才能顺利进行。缚酸剂,可以是有机碱类化合物,也可以是无机碱类化合物。缚酸剂为有机碱类化合物时,选自以下一种或几种:烷基叔胺,结构式如下:
[0039][0040]
其中:r1、r2、r3分别为c1~c6直链、支链或环状烷基,代表性化合物有:三甲胺、三乙胺、三正丙胺、三异丙胺、三正丁胺、三异丁胺、三仲丁胺、三正戊胺、三正己胺、甲基二乙胺、甲基二正丙胺、甲基二异丙胺、二甲基乙胺、二甲基正丙胺、二甲基异丙胺、乙基二正丙胺、乙基二异丙胺、二乙基正丙胺、二乙基异丙胺、n-甲基吡咯烷、n-甲基吗啉、n-甲基哌啶、dbu等;和(或)吡啶及其衍生物,结构式如下:
[0041][0042]
其中:r4为h、c1~c6直链或支链烷基、c1~c4直链或支链烷基取代仲胺基,代表性化合物有:吡啶、2-甲基吡啶、2-乙基吡啶、3-甲基吡啶、3-乙基吡啶、4-甲基吡啶、4-乙基吡啶、4-二甲氨基吡啶、2,6-二甲基吡啶等。
[0043]
缚酸剂为无机碱类化合物时,选自以下一种或几种:氢化锂、氢化钠、氢化钾、氢化钙、碳酸锂、碳酸氢锂、碳酸钠、碳酸氢钠、碳酸钾、碳酸氢钾、碳酸铯、碳酸氢铯、磷酸锂、磷酸钠、磷酸钾等。
[0044]
缚酸剂与化合物(v)的物质的量之比为:(0.5~3):1。
[0045]
反应的温度为0~150℃,优选的反应温度为0~130℃。
[0046]
反应结束后的体系,可通过纯化处理,得到高纯度化合物(vi),再进行步骤(4)的反应,亦可不经任何纯化操作,直接进行步骤(4)的反应。优先方式为:不进行纯化处理,直接进行步骤(4)的反应,以简化操作流程,提升合成效率,减少操作损失,提高反应总收率。
[0047]
步骤(4)中:
[0048]
1-乙基-4-氧代-6,7,8-三氟-1,4-二氢喹啉-3-羧酸乙酯(vi)与3-(乙氨基甲基)吡咯烷(vii)的物质的量之比为:1:(1~3)。
[0049]
反应在适当的有机溶剂中进行,选用的有机溶剂,可以是醚类溶剂、芳烃类溶剂、卤代芳烃类溶剂、卤代烷烃类溶剂、腈类溶剂、极性非质子性溶剂等,可以是单一溶剂,也可以是一种或几种有机溶剂组成的混合溶剂。代表性有机溶剂,选自以下一种或几种:四氢呋喃、2-甲基四氢呋喃、1,4-二氧六环、异丙醚、甲基叔丁基醚、乙二醇二甲醚、二乙二醇二甲醚、苯甲醚、苯乙醚、二苯醚、苯、甲苯、乙苯、二甲苯、氯苯、二氯苯、三氯苯、二氯甲烷、三氯甲烷、四氯化碳、1,2-二氯乙烷、乙腈、丙腈、苯甲腈、n,n-二甲基甲酰胺、二甲基亚砜、环丁砜、n-甲基吡咯烷酮等。有机溶剂用量为化合物(vi)质量的1~10倍。
[0050]
反应优选在缚酸剂存在下进行。缚酸剂,主要用于中和反应过程中生成的氟化氢,可以是有机碱类化合物,也可以是无机碱类化合物。缚酸剂为有机碱类化合物时,选自以下一种或几种:烷基叔胺,结构式如下:
[0051][0052]
其中:r1、r2、r3分别为c1~c6直链、支链或环状烷基,代表性化合物有:三甲胺、三乙胺、三正丙胺、三异丙胺、三正丁胺、三异丁胺、三仲丁胺、三正戊胺、三正己胺、甲基二乙胺、甲基二正丙胺、甲基二异丙胺、二甲基乙胺、二甲基正丙胺、二甲基异丙胺、乙基二正丙胺、乙基二异丙胺、二乙基正丙胺、二乙基异丙胺、n-甲基吡咯烷、n-甲基吗啉、n-甲基哌啶、dbu等;和(或)吡啶及其衍生物,结构式如下:
[0053][0054]
其中r4为h、c1~c6直链或支链烷基、c1~c4直链或支链烷基取代仲胺基,代表性化合物有:吡啶、2-甲基吡啶、2-乙基吡啶、3-甲基吡啶、3-乙基吡啶、4-甲基吡啶、4-乙基吡
啶、4-二甲氨基吡啶、2,6-二甲基吡啶等。
[0055]
缚酸剂为无机碱类化合物时,选自以下一种或几种:氢化锂、氢化钠、氢化钾、氢化钙、碳酸锂、碳酸氢锂、碳酸钠、碳酸氢钠、碳酸钾、碳酸氢钾、碳酸铯、碳酸氢铯、磷酸锂、磷酸钠、磷酸钾等。
[0056]
缚酸剂与化合物(vi)的物质的量之比为:(0.5~3):1。
[0057]
反应的温度为-20~130℃,优选的反应的温度为0~100℃。
[0058]
反应结束后的体系,可通过纯化处理,得到高纯度化合物(viii),再进行步骤(5)的反应,亦可仅经简单后处理,即进行步骤(5)的反应。优先方式为:对反应体系进行简单的过滤、漂洗等操作,得到化合物(viii)固体,即进行步骤(5)的反应,最大限度简化操作流程,提升合成效率,减少操作损失,提高反应总收率。
[0059]
步骤(5)中:
[0060]
所述的水解反应,在含水溶液中进行,所用的含水溶液可以是单一水作溶剂,亦可是水与有机溶剂组成的均相或非均相混合溶液作溶剂。当以水与有机溶剂组成的混合溶液作为反应溶剂时,有机溶剂选自以下一种或几种:醇类溶剂、醚类溶剂、芳烃类溶剂、卤代芳烃类溶剂、卤代烷烃类溶剂、腈类溶剂、极性非质子性溶剂等,优选的有机溶剂选自以下一种或几种:醇类溶剂、芳烃类溶剂、卤代芳烃类溶剂等。代表性有机溶剂,选自以下一种或几种:甲醇、乙醇、正丙醇、异丙醇、四氢呋喃、2-甲基四氢呋喃、1,4-二氧六环、异丙醚、甲基叔丁基醚、乙二醇二甲醚、二乙二醇二甲醚、苯甲醚、苯乙醚、二苯醚、苯、甲苯、乙苯、二甲苯、氯苯、二氯苯、三氯苯、二氯甲烷、三氯甲烷、四氯化碳、1,2-二氯乙烷、乙腈、丙腈、苯甲腈、n,n-二甲基甲酰胺、二甲基亚砜、环丁砜、n-甲基吡咯烷酮等,优选的代表性有机溶剂,选自以下一种或几种:甲醇、乙醇、正丙醇、异丙醇、苯、甲苯、乙苯、二甲苯、氯苯、二氯苯、三氯苯等。溶剂用量为化合物(viii)质量的1~15倍。
[0061]
水解反应,可以在酸性条件下进行,也可以在碱性条件下进行。在酸性条件下水解时,所用的酸选自以下一种或几种:盐酸、氢溴酸、硫酸、磷酸、甲酸、乙酸、三氟乙酸、甲磺酸等。酸在水解反应中起着加快水解反应速度的作用,反应过程中自身并不消耗,因此用量无严格限制,但过少的酸用量,会导致反应时间延长,不利于提升合成效率,而过多的酸用量,则会导致合成成本上升和废水量增加。在碱性条件下水解时,所用的碱选自以下一种或几种:氢氧化锂、氢氧化钠、氢氧化钾、碳酸锂、碳酸钠、碳酸钾、碳酸氢锂、碳酸氢钠、碳酸氢钾、磷酸锂、磷酸钠、磷酸钾等,碱与化合物(viii)的物质的量之比为:(0.5~6):1。
[0062]
反应温度为10~150℃,优选的反应温度为20~120℃。
[0063]
反应结束后的体系,经必要的分离纯化操作,即可得到美拉沙星(ix),反应总收率80%以上,产物纯度99.5%以上。
[0064]
本发明与现有技术相比,其有益的效果体现在:
[0065]
(1)、原料与试剂更加价廉易得:反应所用原料与试剂,均为成熟的市售产品,价格低廉,供应稳定,可确保工业化生产稳定的原材料供应;
[0066]
(2)反应步骤更短:从主原料2,3,4,5-四氟苯甲酰氯(i)出发,仅需五步反应,即可得到产品,与传统合成路线相比,反应步骤更短,有利于降低生产成本;
[0067]
(3)、操作过程更加简便:各步反应之间,采用最简洁的方式进行衔接,使得整个反应过程更加流畅,有利于提升合成效率,提高反应总收率;
[0068]
(4)、原子经济性更优:整个反应过程,仅有少量离去基团,且离去基团均为常见小分子化合物,价值较低,体现出合成路线较高的原子经济性;
[0069]
(5)、反应收率更高,产品质量更好:反应总收率80%以上,产品含量99.5%以上,较传统合成工艺,反应总收率提升20%以上,产物纯度提升0.5%以上。
[0070]
以下结合具体实施方式对本发明作进一步说明。在此需要说明的是,下列实施方式,仅用于帮助理解本发明,并不构成对本发明的限定。具体实施方式不可能权尽本发明所有技术特征,只要说明书中所涉及的技术特征,彼此不构成冲突,相互间均可组合,组成新的实施方式。
具体实施方式:
[0071]
实施例一
[0072]
反应瓶中加入n,n-二甲氨基丙烯酸乙酯50克、甲苯340克、三乙胺38.5克,室温搅拌,慢慢滴加2,3,4,5-四氟苯甲酰氯67.5克,滴加完毕后,升温至70~75℃,保温反应9小时,停反应,降温。
[0073]
反应体系降至室温,慢慢滴加乙胺15.8克,滴加完毕后,室温搅拌反应2小时,停反应。向体系中加入水80克,搅拌10分钟,静置分层,分除水相。有机相依次用60克10%硫酸溶液、80克水洗涤,得化合物(v)的甲苯溶液。
[0074]
反应瓶中加入甲苯30克、60%氢化钠14克,室温搅拌,慢慢滴加上述化合物(v)的甲苯溶液,滴加完毕后,升温至50~55℃,保温反应6小时,停反应,降温。
[0075]
反应体系降至室温,加入60%氢化钠14克,慢慢滴加化合物(vii)44.8克,滴加完毕后,室温搅拌反应15小时,停反应。反应体系滴加水100克,室温搅拌15分钟,过滤,滤饼依次用甲苯、水漂洗,得化合物(viii)湿品固体。
[0076]
反应瓶中加入水600克、氢氧化钠19克,室温搅拌溶解,加入化合物(viii)湿品固体,搅拌升温至50~55℃,保温反应10小时,停反应,降温。反应体系降至室温,用50%硫酸溶液调ph至4,室温搅拌30分钟,过滤,滤饼经漂洗、干燥,得美拉沙星(ix)98.9克,收率82.1%,纯度99.8%。
[0077]
实施例二
[0078]
反应瓶中加入n,n-二甲氨基丙烯酸乙酯48.5克、2-甲基四氢呋喃360克、三正丙胺60克,室温搅拌,慢慢滴加2,3,4,5-四氟苯甲酰氯60克,滴加完毕后,升温至60~65℃,保温反应12小时,停反应,降温。
[0079]
反应体系降温至10~15℃,慢慢滴加乙胺16.5克,滴加完毕后,于10~15℃搅拌反应4小时,停反应。向体系中加入水80克,搅拌15分钟,静置分层,分除水相。有机相用100克水洗涤,得化合物(v)的2-甲基四氢呋喃溶液。
[0080]
反应瓶中加入化合物(v)的2-甲基四氢呋喃溶液、碳酸钾58克,搅拌升温至回流,保温反应15小时,停反应,降温。
[0081]
反应体系降温至50~55℃,加入碳酸钠50克,慢慢滴加化合物(vii)47克,滴加完毕后,升温至回流,保温反应15小时,停反应,降温。反应体系降至室温,加入水120克,搅拌15分钟,过滤,滤饼用水漂洗,得化合物(viii)湿品固体。
[0082]
反应瓶中加入化合物(viii)湿品固体、20%硫酸溶液460克、乙醇60克,搅拌升温
至100~105℃,保温反应15小时,停反应,降温。反应体系降至室温,用30%氢氧化钠溶液调ph至4,室温搅拌30分钟,过滤,滤饼用300克水室温打浆2小时,过滤,滤饼经漂洗、干燥,得美拉沙星(ix)86.6克,收率80.9%,纯度99.9%。
[0083]
实施例三
[0084]
反应瓶中加入n,n-二甲氨基丙烯酸乙酯35.5克、氯苯400克、乙基二异丙胺39.5克,室温搅拌,慢慢滴加2,3,4,5-四氟苯甲酰氯50克,滴加完毕后,升温至80~85℃,保温反应8小时,停反应,降温。
[0085]
反应体系降至室温,慢慢滴加乙胺12.7克与20克氯苯的混合溶液,滴加完毕后,室温搅拌反应2小时,停反应。向体系中加入水100克,搅拌10分钟,静置分层,分除水相。有机相依次用80克10%盐酸、100克水洗涤,得化合物(v)的氯苯溶液。
[0086]
反应瓶中加入化合物(v)的氯苯溶液、吡啶24克,搅拌升温至100~105℃,保温反应12小时,停反应,降温。
[0087]
反应体系降温至60~65℃,加入吡啶24克,慢慢滴加化合物(vii)36.2克,滴加完毕后,于60~65℃保温反应15小时,停反应,降温。反应体系降至室温,加入水100克,搅拌15分钟,过滤,滤饼依次用氯苯、水漂洗,得化合物(viii)湿品固体。
[0088]
反应瓶中加入化合物(viii)湿品固体、10%盐酸溶液480克,搅拌升温至80~85℃,保温反应20小时,停反应,降温。反应体系降至室温,用20%氢氧化钠溶液调ph至4,室温搅拌30分钟,过滤,滤饼经漂洗、干燥,得美拉沙星(ix)72.8克,收率81.5%,纯度99.8%。
[0089]
实施例四
[0090]
反应瓶中加入n,n-二甲氨基丙烯酸乙酯31克、1,2-二氯乙烷360克、吡啶16.4克,搅拌升温至50~55℃,慢慢滴加2,3,4,5-四氟苯甲酰氯40克,滴加完毕后,继续升温至回流,保温反应10小时,停反应,降温。
[0091]
反应体系降温至0~5℃,慢慢滴加乙胺10.6克,滴加完毕后,于0~5℃搅拌反应6小时,停反应。向体系中加入水80克,搅拌30分钟,静置分层,分除水相。有机相依次用70克20%硫酸溶液、100克水洗涤,得化合物(v)的1,2-二氯乙烷溶液。
[0092]
反应瓶中加入化合物(v)的1,2-二氯乙烷溶液、磷酸钾40克,搅拌升温至回流,保温反应15小时,停反应,降温。
[0093]
反应体系降温至50~55℃,加入磷酸钾40克,慢慢滴加化合物(vii)33.8克,滴加完毕后,升温至回流,保温反应15小时,停反应,降温。反应体系降至室温,加入水120克,搅拌15分钟,过滤,滤饼依次用1,2-二氯乙烷、水漂洗,得化合物(viii)湿品固体。
[0094]
反应瓶中加入水300克、氢氧化钾13.7克,室温搅拌溶解,加入化合物(viii)湿品固体,搅拌升温至60~65℃,保温反应10小时,停反应,降温。反应体系降至室温,用20%硫酸溶液调ph至4,室温搅拌30分钟,过滤,滤饼经漂洗、干燥,得美拉沙星(ix)58.8克,收率82.3%,纯度99.8%。
[0095]
实施例五
[0096]
反应瓶中加入n,n-二甲氨基丙烯酸乙酯48克、二甲苯385克、n-甲基吡咯烷31克,室温搅拌,慢慢滴加2,3,4,5-四氟苯甲酰氯55克,滴加完毕后,升温至90~95℃,保温反应6小时,停反应,降温。
[0097]
反应体系降至室温,慢慢滴加乙胺13.4克,滴加完毕后,升温至40~45℃,保温反
应2小时,停反应。向体系中加入水100克,搅拌10分钟,静置分层,分除水相。有机相依次用80克15%硫酸溶液、100克水洗涤,得化合物(v)的二甲苯溶液。
[0098]
反应瓶中加入化合物(v)的二甲苯溶液、碳酸钠46.6克,搅拌升温至110~115℃,保温反应15小时,停反应,降温。
[0099]
反应体系降温至50~55℃,加入碳酸钾53.6克,慢慢滴加化合物(vii)49.8克,滴加完毕后,于50~55℃保温反应15小时,停反应,降温。反应体系降至室温,加入水150克,搅拌15分钟,过滤,滤饼依次用二甲苯、水漂洗,得化合物(viii)湿品固体。
[0100]
反应瓶中加入化合物(viii)湿品固体、碳酸钠55克、水315克、甲苯315克,搅拌升温至70~75℃,保温反应12小时,停反应,降温。反应体系降至室温,用浓盐酸调ph至4,室温搅拌30分钟,过滤,滤饼用甲苯与水的混合溶液打浆2小时,经过滤、漂洗、干燥,得美拉沙星(ix)80.4克,收率81.9%,纯度99.9%。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。