1.本发明涉及药学领域,具体涉及一类含2-芳杂环取代的脲类化合物、其制备和用途。更具体而言,本发明涉及能抑制周期蛋白依赖性激酶(特别是cdk9)的抑制剂化合物、该类化合物的制备方法以及使用该类化合物或组合物用于cdk9相关的疾病的预防和/或治疗用途。
背景技术:
2.细胞周期蛋白依赖性激酶(cyclin dependent kinase,cdk)是一类丝氨酸/苏氨酸蛋白激酶,其活性依赖于细胞周期蛋白(cyclin)伴侣的结合和激活,是细胞周期进程和基因转录的关键调控因子。cdk家族至今已被发现和鉴定21个亚型,并且这些cdk蛋白激酶功能结构域具有高度的进化保守性。根据cdk功能的差异可以分为细胞周期调控cdks(如cdk1,2,4,6)和转录功能cdks(如cdk7,8,9,12,13)(lim s,kaldis p.development 2013,140:3079-3093.)。细胞周期调控cdks通过磷酸化细胞周期相关蛋白底物直接调节细胞周期的进展。转录功能cdks通过磷酸化rna聚合酶ii复合物来调节基因转录进程。临床研究表明,在许多恶性肿瘤细胞中(如急性髓细胞白血病、皮肤癌、黑色素瘤、肺癌、胃癌、乳腺癌、胰腺癌等)发现不同程度的cdks频繁地发生基因突变、扩增和过表达,这些变异与肿瘤的发生、发展以及病人存活期和耐药性具有密切的联系。此外,大量的基础研究也发现cdks蛋白激酶高度活化导致细胞周期调控和基因转录的异常,从而驱动肿瘤的发生,而抑制cdks能够有效地抑制肿瘤体内外生长(chou j,et al.,cancer discov.2020,10(3):351-370.)。近年来的研究发现cdk4/5/6具有肿瘤免疫调节功能,选择性抑制cdk4/5/6具有增强肿瘤免疫治疗的效果。因此,靶向cdks的激酶抑制剂已成为一种重要的癌症治疗策略,特别是三个已上市cdk4/6抑制剂(palbociclib,ribociclib,abemaciclib)充分证明了靶向cdks蛋白激酶开发药物的科学合理性及商业可行性。虽然许多不同类型的cdks抑制剂已进行了广泛的临床前及临床研究,但绝大部分cdks抑制剂具有亚型选择性差,毒副作用大,治疗窗口窄等问题。至今只有cdk4/6选择性抑制剂(palbociclib,ribociclib,abemaciclib)获批上市,并仅成功应用于雌激素受体阴性,her2阴性的晚期或复发性乳腺癌的临床治疗。因此,发展新型的、低毒的、高效的cdk亚型选择性激酶抑制剂具有重要的意义。越来越多的研究表明,非选择性cdks抑制剂的抗肿瘤效益是通过抑制cdk9介导的转录调控途径所产生的,因此针对cdk9的选择性抑制剂的研究受到人们的关注(chen r,et al.,blood,2009,113:4637-4645.;maccallum de,et al.,cancer res.,2005,65:5399-5407.;gregory gp,et al.,leukemia,2015,29:1437-1441.;krystof v.,et al.,cell cycle,2016,15:519-527.)。
3.cdk9和周期调控cdks不同,它只在转录延伸阶段发挥作用,不参与细胞周期的调控。cdk9与细胞周期蛋白(t、k)形成异源二聚体复合物作为正性转录延长因子b(positive transcription elongation factor b,p-tefb),后者通过磷酸化rna聚合酶ii的碳端结构域的ser-2来促进转录延伸。p-tefb复合物中cdk9激酶活性的异常活化与多种人类疾病的
病理进程相关,如过度增殖性疾病(如癌症)、病毒诱导的感染性疾病和心血管疾病(krystof v.,et al.,cell cycle,2016,15:519-527.;shudong wang and peter m.fischer,trends pharmacol.sci.,2008,29:302-313.)。研究表明,在多种人类血液瘤(如多发性骨髓瘤、急性髓性白血病、淋巴瘤、慢性淋巴细胞白血病等)及实体瘤(如肺癌、肝癌、乳腺癌、前列腺癌等)中均存在cdk9信号通路的异常活化,影响抗凋亡蛋白表达、促进肿瘤细胞增殖等发生。当选择性的抑制cdk9激酶抑制rna聚合酶ii的转录活性,下调多种与肿瘤存活相关的短时程的抗凋亡蛋白的rna转录,例如c-myc,nf-κb应答基因转录物、有丝分裂激酶,并影响抗凋亡bcl-2家族蛋白表达特别是mcl-1和xiap表达下降,进而诱导肿瘤细胞发生凋亡来发挥抗肿瘤效应(shudong wang and peter m.fischer,trends pharmacol.sci.,2008,29:302-313.)。总之,多种证据表明选择性抑制cdk9是抗肿瘤治疗的一种重要策略,该肿瘤类型包括但不限于恶性血液瘤(如急性髓细胞白血病、多发性骨髓瘤、慢性淋巴细胞性白血病、弥漫性大b细胞淋巴瘤、伯基特氏淋巴瘤(burkitt
′
slymphoma)、滤泡性淋巴瘤)以及实体瘤(例如前列腺癌、乳癌、肺癌、成神经细胞瘤和结肠癌)。此外,cdk9抑制剂还可能具有在其他疾病(包括心脏性疾病、病毒性疾病、炎症和疼痛)中的治疗效果。
4.迄今为止,全球尚无高选择性cdk9抑制剂获批上市,目前仅有cdk9选择性抑制剂azd4573、bay1251152、bay1143572、kb0742及gfh009进入临床研究。虽然这些化合物已体现出了较好的cdk9激酶选择性及体内外抗肿瘤效果,然而临床急需的高效、低毒的高选择性cdk9抑制剂仍未被满足。同时,针对目前在研的cdk9选择性抑制剂的不足,激酶选择性、活性以及成药性仍需进一步提高。本专利揭露的化合物具有cdk9高活性及选择性,在预防和/或治疗cdk9介导的疾病中具有广阔应用前景。
技术实现要素:
5.本发明的目的是提供一种特异性好、活性高的新型小分子化合物,其可作为细胞周期蛋白依赖性激酶9(cdk9)抑制剂,用于预防和/或治疗由cdk9激酶介导的疾病,特别是过度增殖性疾病和/或病毒诱导的感染性疾病和/或心血管疾病的药物中。
6.本发明涉及一类新型的含2-芳杂环取代脲的化合物,其能够强效的抑制cdk9表达阳性的淋巴瘤细胞wsu-dlcl2和多种不同肿瘤细胞的体外生长,其ic
50
值可达低纳摩尔甚至皮摩尔浓度。具体而言,本发明提供式(i)的含2-芳杂环取代的脲类化合物,其对映体、非对映体、外消旋体或其混合物,或其药学上可接受的盐、溶剂化物、代谢物或前药:
[0007][0008]
其中
[0009]
a1、a2各自独立地选自n或c-r1;
[0010]
a3选自o或s;
[0011]
m选自未取代或取代的5-8元芳基、未取代或取代的5-8元杂芳基、未取代或取代的5-10元杂环基;所述取代是指上述基团各自独立地被1-5个r2基团取代;或者两个r2与其各自相连的两个原子形成5-7元环烷基、杂环基或螺环基团,并进一步被0-5个r’基团取代;其中上述的一个或多个环ch2基团任选地被相应数目的c(o)基团替代,一个或多个环内s或环内n原子任选地被氧化形成s-氧化物或n-氧化物;
[0012]
w选自未取代或取代的c1-c6烷基、未取代或取代的3-7元环烷基、未取代或取代的3-7元杂环烷基、未取代或取代的5-10元杂环基、未取代或取代的-(c
1-6
烷基)-(3-7元环烷基)、未取代或取代的-(c
1-6
烷基)-(3-7元杂环烷基)、未取代或取代的4-8元环烯基、未取代或取代的4-8元杂环烯基、未取代或取代的-(c
1-6
烷基)-(4-8元环烯基)、未取代或取代的-(c
1-6
烷基)-(4-8元杂环烯基)、未取代或取代的5-8元芳基、未取代或取代的5-8杂芳基、未取代或取代的-(c
1-6
烷基)-(5-8元杂芳基)、未取代或取代的-(5-8元杂芳基)-(c
1-6
烷基)、未取代或取代的-(5-8元杂芳基)-(3-7元环烷基)、未取代或取代的-(5-8元杂芳基)-(3-7元杂环烷基)、未取代或取代的-(c
1-6
烷基)-(5-10元杂环基);所述取代为各自独立地被1-5个r4基团取代;或者两个r4与其各自相连的两个原子形成环烷基或杂环基并进一步被0-5个r’基团取代;其中上述的一个或多个环ch2基团任选地被相应数目的c(o)基团替代,一个或多个环内s或环内n原子任选地被氧化形成s-氧化物或n-氧化物;
[0013]
r1选自氢、卤素、氰基或c
1-3
烷基、c
3-6
环烷基;
[0014]
r2每次出现时各自独立地选自卤素、羟基、氨基、氰基、c
1-4
烷基、c
1-4
杂烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、3-6元杂环烷基、4-8元环烯基、4-8元杂环烯基、-o(c
1-6
烷基)、-o(c
3-6
环烷基)、-nh(c
1-6
烷基)、-nh(c
3-6
环烷基)、-c(o)(c
1-4
烷基)、-c(o)(c
3-6
环烷基);其中上述取代基进一步被0-5个选自以下的取代基所取代:卤素、羟基、氰基、5-7元芳基、5-7元杂芳基、c
3-6
环烷基、3-6元杂环烷基、3-6元杂环烷基、-c
1-4
烷基-r3、-or3、-nhr3、-n(r3)2、-nhc
1-4
烷基-r3、-oc
1-4
烷基-r3、-conhr3、-con(r3)2、-sr3、-sor3、-so2r3;
[0015]
r3选自5-7元芳基、5-7元杂芳基、c
3-6
环烷基、3-6元杂环烷基、3-6元杂环烷基;所述的取代基进一步被0-5个选自以下的基团所取代:卤素、羟基、c
1-4
烷基、-o(c
1-4
烷基)、氨基、-nh(c
1-4
烷基)、-c(o)(c
1-4
烷基)、-nhc(o)(c
1-4
烷基);
[0016]
r4每次出现时各自独立地选自卤素、羰基、氰基、硝基、c
1-6
烷基、c
1-6
杂烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、3-6元杂环烷基、4-8元环烯基、4-8元杂环烯基、5-7元芳基、5-7元杂芳基、(c
1-6
烷基)-o-(c
1-6
烷基)、or5、sr5、s(o)r5、so2r5、c(o)r5、c(o)n(r5)2、c(o)nr5or5、c(o)nr5so2r5、co(o)r5、n(r5)2、nr5c(o)r5、nr5so2r5、nr5so2nr5c(o)or5、nr5c(o)n(r5)2、oc(o)r5、oc(o)or5、oc(o)n(r5)2、oc(o)nr5so2r5、so2n(r5)2、so2nr5c(o)r5、nr5s(o)2r5、nr5c(o)or5、so2nr5c(o)or5、oso2n(r5)2;其中所述的任意烷基、环烷基、杂环烷基、烯基、炔基、环烯基、杂环烯基、芳基及杂芳基进一步被0-5个r5基团取代;
[0017]
r5每次出现时各自独立地选自氢、卤素、羟基、氨基、羧基、醛基、羰基、氰基、硝基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、3-6元杂环烷基、-o(c
1-6
烷基)、(c
1-6
烷基)-o-(c
1-6
烷基);上述烷基、烯基、炔基、环烷基以及杂环烷基被0-5个r’基团取代;或者两个r5基团连同它们所连接的两个原子一起形成3-6元环烷基或杂环烷基并被0-5个r’基团取代;
[0018]r′
每次出现时独立地选自h、卤素、氰基、羟基、-o-(c
1-6
烷基)、-c(o)r
″
、-c(o)or
″
、
(c
1-6
烷基)-(4-8元杂环烯基)、未取代或取代的5-8元芳基、未取代或取代的5-8杂芳基、未取代或取代的-(c
1-6
烷基)-(5-8元杂芳基)、未取代或取代的-(5-8元杂芳基)-(c
1-6
烷基)、未取代或取代的-(5-8元杂芳基)-(3-7元环烷基)、未取代或取代的-(5-8元杂芳基)-(3-7元杂环烷基)、未取代或取代的-(c
1-6
烷基)-(5-10元杂环基);所述取代为各自独立地被1-5个r4基团取代;或者两个r4与其各自相连的两个原子形成环烷基或杂环基并进一步被0-5个r’基团取代;其中上述的一个或多个环ch2基团任选地被相应数目的c(o)基团替代,一个或多个环内s或环内n原子任选地被氧化形成s-氧化物或n-氧化物;
[0026]
r1选自氢、卤素、氰基或c
1-3
烷基、c
3-6
环烷基;优选氢或卤素。
[0027]
r2每次出现时各自独立地选自卤素、羟基、氨基、氰基、c
1-4
烷基、c
1-4
杂烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、3-6元杂环烷基、4-8元环烯基、4-8元杂环烯基、-o(c
1-6
烷基)、-o(c
3-6
环烷基)、-nh(c
1-6
烷基)、-nh(c
3-6
环烷基)、-c(o)(c
1-4
烷基)、-c(o)(c
3-6
环烷基);其中上述取代基进一步被0-5个选自以下的取代基所取代:卤素、羟基、氰基、5-7元芳基、5-7元杂芳基、c
3-6
环烷基、3-6元杂环烷基、3-6元杂环烷基、-c
1-4
烷基-r3、-or3、-nhr3、-n(r3)2、-nhc
1-4
烷基-r3、-oc
1-4
烷基-r3、-conhr3、-con(r3)2、-sr3、-sor3、-so2r3;
[0028]
r3选自5-7元芳基、5-7元杂芳基、c
3-6
环烷基、3-6元杂环烷基、3-6元杂环烷基;所述的取代基进一步被0-5个选自以下的基团所取代:卤素、羟基、c
1-4
烷基、-o(c
1-4
烷基)、氨基、-nh(c
1-4
烷基)、-c(o)(c
1-4
烷基)、-nhc(o)(c
1-4
烷基);
[0029]
r4每次出现时各自独立地选自卤素、羰基、氰基、硝基、c
1-6
烷基、c
1-6
杂烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、3-6元杂环烷基、4-8元环烯基、4-8元杂环烯基、5-7元芳基、5-7元杂芳基、(c
1-6
烷基)-o-(c
1-6
烷基)、or5、sr5、s(o)r5、so2r5、c(o)r5、c(o)n(r5)2、c(o)nr5or5、c(o)nr5so2r5、co(o)r5、n(r5)2、nr5c(o)r5、nr5so2r5、nr5so2nr5c(o)or5、nr5c(o)n(r5)2、oc(o)r5、oc(o)or5、oc(o)n(r5)2、oc(o)nr5so2r5、so2n(r5)2、so2nr5c(o)r5、nr5s(o)2r5、nr5c(o)or5、so2nr5c(o)or5、oso2n(r5)2;其中所述的任意烷基、环烷基、杂环烷基、烯基、炔基、环烯基、杂环烯基、芳基及杂芳基进一步被0-5个r5基团取代;
[0030]
r5每次出现时各自独立地选自氢、卤素、羟基、氨基、羧基、醛基、羰基、氰基、硝基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、3-6元杂环烷基、-o(c
1-6
烷基)、(c
1-6
烷基)-o-(c
1-6
烷基);上述烷基、烯基、炔基、环烷基以及杂环烷基被0-5个r’基团取代;或者两个r5基团连同它们所连接的两个原子一起形成3-6元环烷基或杂环烷基并被0-5个r’基团取代;
[0031]r′
每次出现时独立地选自h、卤素、氰基、羟基、-o-(c
1-6
烷基)、-c(o)r
″
、-c(o)or
″
、c
1-6
烷基、c
3-6
环烷基、c
1-6
卤代烷基、c
1-6
杂烷基、羟基c
1-6
烷基、-n(r
″
)(r
″
)、nhc(o)-(c
1-3
烷基)、未取代或取代的环烷基;或者,两个r’连同它们所连接的原子一起形成3-6元环烷基或杂环烷基;其中所述烷基、环烷基及杂环烷基被0-5个r
″
基团取代;
[0032]r″
每次出现时独立地选自氢、羟基和c
1-6
烷基;
[0033]
在本发明中,
[0034]
所述“烷基”是指脂肪族烃基团,可以是支链或直链的烷基。根据结构,烷基可以是单价基团或双价基团(即亚烷基),例如,在“羟基c
1-6
烷基”中,所述c
1-6
烷基实际为二价基团(亚烷基)。在本发明中,烷基优选是具有1-6个碳原子的“低级烷基”,甚至更优选具有1-3个碳原子的“低级烷基”。典型的烷基包括但不限于甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、戊基、己基等。
[0035]
所述“卤素”为f、cl、br、i;
[0036]
所述“卤代烷基”为烷基中至少一个氢原子被卤原子置换。在某些实施例方式中,如果两个或更多氢原子被卤原子置换,所述卤原子彼此相同或不同;
[0037]
所述“杂烷基”为烷基中至少一个骨架c原子被杂原子(n、o、s)置换。在某些实施例方式中,如果两个或更多c原子被杂原子置换,所述杂原子彼此相同或不同;
[0038]
所述“环烷基”为饱和或不饱和的3-10元单环或多环脂环,同时可以是单价基团或双价基团(及亚环烷基);
[0039]
所述“杂环烷基”为环上含有选自n、o、s中一个或一个以上杂原子的饱和或不饱和的3-10元单环或多环脂杂环,同时可以是单价基团或双价基团(即亚杂环烷基);
[0040]
所述“芳基”是指芳香基环中每一个构成环的原子都是碳原子,包括单环或稠环多环,同时可以是单价基团或双价基团(即亚芳基)。在本发明中,芳基环优选5-10个碳原子,更优选具有5-7个碳原子的芳基。
[0041]
所述“芳烷基”是指烷基中一个或多个氢原子被芳基置换。例如苄基、苯乙基。
[0042]
所述“杂芳基”为环上含有选自n、o、s中一个或一个以上杂原子的芳香基。根据结构,杂芳基可以是单价基团或双价基团(即亚杂芳基)。杂芳基的实施例包括但不限于吡啶基、嘧啶基、咪唑基、吡唑基、吡嗪基、三唑基、四唑基、噻吩基、噻唑基、呋喃基、噁唑基、异噁唑基、吡咯基、喹啉基、异喹啉基、吲哚基、苯并咪唑基、苯并呋喃基、吲唑基、吲嗪基、酞嗪基、哒嗪基、异吲哚基、蝶碇基、嘌呤基、噁二唑基、噻二唑基、呋咱基、苯并呋咱基、苯并噻吩基、苯并噻唑基、苯并噁唑基、喹唑啉基等。
[0043]
所述“杂环基”为单环或多环,并且至少一个为具有一个或多个杂原子的饱和或部分饱和(非芳香性)环。代表性的杂环基包括以下三种情况:1)每个环均为非芳香环,并且至少一个环具有杂原子;2)至少一个环是包含杂原子的非芳香环,同时至少有另外一个环是芳香性碳环;3)至少一个环是包含杂原子的非芳香性环,同时至少有另一个环是芳杂环。
[0044]
优选地,根据上述的式(i)化合物或其氘代化合物或其医药上可接受的盐或前药选自下式化合物:
[0045]
[0046]
[0047]
[0048]
[0049]
[0050]
[0051]
。
[0052]
在上表列出的本发明的优选化合物的结构中,在环己基或环丁基上分别与对位两个取代基连接的两个碳原子不是手性中心(环状基团上没有取代基时),和/或的化学键表示法仅为了表示与对位两个取代基连接的两个化学键相对于环己基和环丁基基团呈反式或顺式结构,因此将这两个化学键和彼此交换而表示的化合物同样落在本发明的保护范围。而为与顺反的区别,本发明用和化学键表示该碳原子的具体手性构型。根据《有机化合物中文命名原则2017》第274页“按照cip规则,“假不对称碳原子”可用小写字体r或s表示它们构型”,以及第284页“根据cip优先系统,用斜体r,s符号(r,s分别原子拉丁文rectus,sinister的首字母,意为“右”、“左”)标识手性中心、轴和面诸因素的构型。[现更广泛地称“立体异构源(stereogenic)”诸因素构型表示的方法]”,本技术中用小写r,s配合表示顺反异构,大写r,s表示手性中心的绝对构型,并结合化学式来表示各种异构体的特定结构。但应该了解的是,对映体、非对映体、外消旋体及其混合物均在本发明的保护范围内。
[0053]
本发明还提供一种制备上述的式(i)化合物或其氘代化合物或其药学上可接受的盐或前药的方法,其主要包括如下步骤:
[0054][0055]
其中,a1、a2、a3、m及w的定义各自独立地如上述所述;l1、l2为氨基或羧基;x为溴或氯;
[0056]
步骤1:在溶剂中,化合物m1和化合物m2反应形成脲/硫脲连接的中间体m3。具体而言,当l1,l2为氨基时合成方法是:化合物m1(或化合物m2)先形成异(硫)氰酸酯或氯甲酸酯,然后与中间体胺m2(或m1)反应形成(硫)脲连接的中间体m3;当l1及l2各自为氨基和羧基时,脲连接中间体m3还可使用以下合成方法制备:在无水甲苯中,化合物m1、化合物m2、dppa及碱(优选et3n,dipea)的作用下,微波反应形成中间体m3。
[0057]
步骤2:在溶剂中,在碱、钯催化剂和配体的作用下,中间体m3和硼酸/硼酸频那醇酯m4发生偶联反应,得到通式(i)的化合物,所述溶剂优选1,4-二氧六环、四氢呋喃、甲苯、n,n-二甲基甲酰胺、乙醇、乙二醇二甲醚和水中的一种或多种;所述钯金属催化剂为pd(pph3)4、pd2(dba)3、pd(oac)2和(dppf)pdcl2中的任意一种;所述碱为k2co3、cs2co3、kf、k2hpo4、k3po4、nahco3和na2co3中的任意一种;所述配体为x-phos和pcy3中的任意一种。
[0058]
进一步优选地,本发明提供两个指导性的合成方案(如合成路线i,ii所示)。应当理解的是,可以利用有机化学的一般知识对合成方案中所示的试剂/反应条件进行修改或优化,以制备本发明中不同的化合物。
[0059][0060]
合成路线i
[0061]
合成路线i包括以下合成步骤:
[0062]
步骤1:将中间体1-a溶于合适的无水溶剂中,冰浴下滴加三光气(或硫光气),随后滴加碱,室温反应得到异(硫)氰酸酯中间体1-b。所述溶剂优选二氯甲烷和四氢呋喃;碱优选三乙胺或n,n-二异丙基乙胺。
[0063]
步骤2:将中间体1-b、中间体1-c及碱加入合适的溶剂中,加热回流反应得到中间体1-d。所述溶剂优选四氢呋喃或甲苯;碱优选三乙胺或n,n-二异丙基乙胺。
[0064]
步骤3:将中间体1-d和相应的硼酸或硼酸频那醇酯1-e加入合适的溶剂中,加入金属钯催化剂、配体、碱,氩气保护下,加热反应得到重要中间体1-f。所述溶剂优选1,4-二氧六环、四氢呋喃、甲苯、n,n-二甲基甲酰胺、乙醇、乙二醇二甲醚和水中的一种或多种;所述钯金属催化剂为pd(pph3)4、pd2(dba)3、pd(oac)2和(dppf)pdcl2中的任意一种;所述碱为k2co3、cs2co3、kf、k2hpo4、k3po4、nahco3和na2co3中的任意一种;所述配体为x-phos、dppf和pcy3中的任意一种。
[0065]
步骤4:将中间体1-f加入合适的溶剂中,加入酸,室温反应得到氨基脱保护的中间1-g。所述溶剂优选二氯甲烷或乙酸乙酯;酸优选三氟乙酸或盐酸溶液(如二氧六环、乙酸乙酯、甲醇或水溶液)。
[0066]
步骤5:一方面,当进行亲核反应时,将具有裸露氨基的中间体1-g溶于合适的溶剂中,加入相应的卤代物及碱,室温反应得到目标产物;所述溶剂优选极性非质子溶剂如dmf、dmac、dmso或nmp;所述碱优选k2co3,cs2co3,et3n或dipea。另一方面,当进行缩合反应时,将中间体1-g、相应的酸、缩合剂及碱溶于合适的溶剂,室温反应得目标产物;或者将中间体1-g与相应的酰氯及碱溶于合适的溶剂,室温反应得到目标产物。所述溶剂优选dmf或thf;缩合剂优选hatu、hbtu、tbtu或edci;碱优选et3n或dipea。
[0067]
进一步优选地,合成路线i包括以下合成步骤:
[0068]
步骤1:向圆底三颈瓶中加入三光气(0.34eq)或硫光气(1.0eq)和无水dcm,冰浴滴加1-a(1.0eq)的二氯甲烷溶液,随后滴加et3n(2.5-5.0eq),冰浴或室温反应2-4小时后,减压旋蒸除掉溶剂即得中间体1-b。
[0069]
步骤2:向圆底烧瓶中加入中间体1-b(1.0eq)、1-c(1.0eq)、et3n(2.5-5.0eq)及无
水甲苯,加热回流反应6-12小时。反应结束后,冷却至室温,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并用饱和nacl水溶液洗涤2-3次,经无水na2so4干燥后,减压旋蒸除去有机溶剂,经过柱层析分离纯化即可得到中间体1-d。
[0070]
步骤3:向圆底烧瓶中加入中间体1-d(1.0eq)、1-e(1.0-1.5eq)、pd(oac)2(0.1eq)、x-phos(0.1-0.2eq)、k2co3(2.5-3.0eq)及1,4-二氧六环/水(5/1,v/v),氩气保护下,加热90℃反应4-12小时。反应结束后,冷却至室温,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并用饱和nacl水溶液洗涤2-3次,经无水na2so4干燥后,减压旋蒸除去有机溶剂,经过柱层析分离纯化即可得到中间体1-f。
[0071]
步骤4:向圆底烧瓶中加入中间体1-f(1.0eq)和dcm,加入过量的盐酸二氧六环溶液,室温反应过夜。反应结束后,减压旋蒸去除溶剂后即可得到中间体1-g的盐酸盐,可直接用于下一步的反应。
[0072]
步骤5:对于亲核反应:向圆底烧瓶中加入中间体1-g(1.0eq)、相应的卤代物(1.0-1.5eq)、k2co3(3.0-5.0eq)和dmf,室温反应12小时。反应结束后,冷却至室温,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并分别用水、饱和nacl水溶液各洗涤3次,经无水na2so4干燥后,减压旋蒸除去有机溶剂,经过柱层析分离纯化即可得到目标产物。
[0073]
对于缩合反应:向圆底烧瓶中加入中间体1-g(1.0eq)、相应酸(1.0eq)、缩合剂hatu(1.0-1.3eq)、dipea(2.5-3.0eq)和dmf,室温反应12小时。反应结束后,冷却至室温,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并分别用水、饱和nacl水溶液各洗涤3次,经无水na2so4干燥后,减压旋蒸除去有机溶剂,经过柱层析分离纯化即可得到目标产物。
[0074][0075]
合成路线ii
[0076]
合成路线ii包括以下合成步骤:
[0077]
步骤1:中间体酸2-b在合适的无水溶剂中,在叠氮磷酸二苯酯(dppa)及碱的作用下,微波反应发生重排,然后与中间体胺2-a微波反应形成中间体2-c。所述溶剂优选甲苯;碱优选et3n或dipea。
[0078]
步骤2:将中间体2-c和相应的硼酸或硼酸频那醇酯2-d加入合适的溶剂中,加入金属钯催化剂、配体、碱,氩气保护下,加热反应得到重要中间体2-e。所述溶剂优选1,4-二氧六环、四氢呋喃、甲苯、n,n-二甲基甲酰胺、乙醇、乙二醇二甲醚和水中的一种或多种;所述
钯金属催化剂为pd(pph3)4,pd2(dba)3,pd(oac)2和(dppf)pdcl2中的任意一种;所述碱为k2co3,cs2co3,kf,k2hpo4,k3po4,nahco3和na2co3中的任意一种;所述配体为x-phos、dppf和pcy3中的任意一种。
[0079]
步骤3:将中间体2-e加入合适的溶剂中,加入酸,室温反应得到氨基脱保护的中间2-f。所述溶剂优选二氯甲烷或乙酸乙酯;酸优选三氟乙酸或盐酸溶液(如二氧六环、乙酸乙酯、甲醇或水溶液)。
[0080]
步骤4:一方面,当进行亲核反应时,将具有裸露氨基的中间体2-f溶于合适的溶剂中,加入相应的卤代物及碱,室温反应得到目标产物;所述溶剂优选极性非质子溶剂如dmf、dmac、dmso或nmp;所述碱优选k2co3,cs2co3,et3n或dipea。另一方面,当进行缩合反应时,将中间体2-f、相应的酸、缩合剂及碱溶于合适的溶剂,室温反应得目标产物;或者将中间体2-f与相应的酰氯及碱溶于合适的溶剂,室温反应得到目标产物。所述溶剂优选dmf或thf;缩合剂优选hatu、hbtu、tbtu或edci;碱优选et3n或dipea。
[0081]
进一步优选地,合成路线ii包括以下合成步骤:
[0082]
步骤1:向微波反应管中加入中间体2-b(1.2-1.5eq)、dppa(1.3-1.5eq)及et3n(3.0-5.0eq),100℃微波反应2-5分钟。然后加入中间体2-a(1.0eq),100℃微波反应5-30分钟。反应结束后,冷却至室温,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并用饱和nacl水溶液洗涤2-3次,经无水na2so4干燥后,减压旋蒸除去有机溶剂,经过柱层析分离纯化即可得到中间体2-c。
[0083]
步骤2:向圆底烧瓶中加入中间体2-c(1.0eq)、2-d(1.0-1.5eq)、pd(oac)2(0.1eq)、x-phos(0.1-0.2eq)、k2co3(2.5-3.0eq)及1,4-二氧六环/水(5/1,v/v),氩气保护下,加热90℃反应4-12小时。反应结束后,冷却至室温,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并用饱和nacl水溶液洗涤2-3次,经无水na2so4干燥后,减压旋蒸除去有机溶剂,经过柱层析分离纯化即可得到中间体2-e。
[0084]
步骤3:向圆底烧瓶中加入中间体2-e(1.0eq)和dcm,加入过量的盐酸二氧六环溶液,室温反应过夜。反应结束后,减压旋蒸去除溶剂后即可得到中间体2-f的盐酸盐,可直接用于下一步的反应。
[0085]
步骤4:对于亲核反应:向圆底烧瓶中加入中间体2-f(1.0eq)、相应的卤代物(1.0-1.5eq)、k2co3(3.0-5.0eq)和dmf,室温反应12小时。反应结束后,冷却至室温,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并分别用水、饱和nacl水溶液各洗涤3次,经无水na2so4干燥后,减压旋蒸除去有机溶剂,经过柱层析分离纯化即可得到目标产物。
[0086]
对于缩合反应:向圆底烧瓶中加入中间体2-f(1.0eq)、相应酸(1.0eq)、缩合剂hatu(1.0-1.3eq)、dipea(2.5-3.0eq)和dmf,室温反应12小时。反应结束后,冷却至室温,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并分别用水、饱和nacl水溶液各洗涤3次,经无水na2so4干燥后,减压旋蒸除去有机溶剂,经过柱层析分离纯化即可得到目标产物。
[0087]
本发明还提供一种药物组合物,其特征在于,包括上述的式(i)化合物或其氘代化合物或其药学上可接受的盐或前药中的一种或多种以及药学上可接受的辅料。
[0088]
本发明还提供上述的式(i)化合物或其氘代化合物或其医药上可接受的盐或前药
或者上述的药物组合物在制备cdk抑制剂(特别是cdk9抑制剂)中的用途。
[0089]
式(i)化合物或其氘代化合物或其药学上可接受的盐或前药,或其药物组合物可用于治疗、预防或改善由丝氨酸激酶活性调节的或者受其影响的或者其中涉及细胞周期蛋白依赖性激酶活性的疾病、障碍或病症的药物中的用途。其中,该疾病、障碍或病症优选自过度增殖性疾病(如肿瘤)、病毒诱导的感染性疾病和心血管疾病。
[0090]
本发明所述式(i)化合物或其氘代化合物或其药学上可接受的盐或前药,或其药物组合物优选地用于治疗、预防或改善肿瘤的药物用途,所述肿瘤选自恶性血液瘤(包括但不限于急性髓细胞白血病、多发性骨髓瘤、慢性淋巴细胞性白血病、弥漫性大b细胞淋巴瘤、伯基特氏淋巴瘤(burkitt
′
s lymphoma)、滤泡性淋巴瘤),和实体瘤(包括但不限于成神经细胞瘤、皮肤癌、黑色素瘤、肺癌、胃癌、乳腺癌或肠癌)。
[0091]
本发明所述的式(i)化合物具有对cdk9的抑制活性,且代表性化合物对cdk9高表达肿瘤细胞具有显著的体外抗肿瘤活性。代表性化合物具有血浆稳定性和低的清除率。
附图说明
[0092]
图1显示出化合物47对对wsu-dlcl2细胞中cdk9信号通路活化的影响。
具体实施方式
[0093]
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于示例性地对本发明进行说明,并不用于限制本发明。
[0094]
(一)化合物制备实施例
[0095]
实施例1
[0096]
叔丁基((1r,4r)-4-(3-(4-(4-氟-2-甲氧基苯基)吡啶-2-基)脲基)环己基)氨基甲酸酯(化合物1)的制备
[0097][0098]
步骤1:向圆底三颈瓶中加入三光气(583mg,1.97mmol)和无水dcm(40ml),冰浴下滴加化合物1-a(1.0g,5.78mmol)的dcm溶液(10ml),随后滴加无水et3n(3.21ml,
23.12mmol),继续搅拌2小时后停止反应。减压蒸干溶剂后即得黄色固体1-b,无需进一步纯化,可直接用于下一步反应。
[0099]
步骤2:向圆底烧瓶中加入步骤1所得中间体1-b、1-c(1.24g,5.78mmol)、et3n(2.41ml,17.34mmol)及无水甲苯(60ml),加热回流反应过夜。反应结束后,冷却至室温,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并用饱和nacl水溶液洗涤3次,经无水na2so4干燥后,减压蒸干溶剂,柱层析纯化得浅黄色固体1-d(1.1g,产率46.05%)。1h nmr(400mhz,氯仿-d)δ8.99(s,1h),8.00(d,j=5.9hz,2h),7.03(dd,j=5.5,1.6hz,1h),7.00(s,1h),4.44(d,j=7.9hz,1h),3.78
–
3.66(m,1h),3.53
–
3.40(m,1h),2.15
–
1.97(m,4h),1.44(s,9h),1.42
–
1.26(m,4h).ms 413.1(m 1).
[0100]
步骤3:向圆底烧瓶中加入中间体1-d(340mg,0.823mmol)、1-e(210mg,1.23mmol)、pd(oac)2(18.5mg,0.082mmol)、x-phos(78.4mg,0.165mmol)、k2co3(284mg,2.06mmol)及thf/h2o(12/4ml),氩气保护下,80℃反应4小时。反应结束后,冷却至室温,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并用饱和nacl水溶液洗涤3次,经无水na2so4干燥后,减压蒸干溶剂,柱层析纯化得目标化合物1为一浅黄色固体(349mg,产率92.52%)。1h nmr(400mhz,氯仿-d)δ9.28(br s,1h),8.17(d,j=5.4hz,1h),7.45(br s,1h),7.29
–
7.24(m,1h),7.00(dd,j=5.4,1.4hz,1h),6.84(s,1h),6.79
–
6.69(m,2h),4.43(d,j=8.2hz,1h),3.81(s,3h),3.78
–
3.65(m,1h),3.55
–
3.40(m,1h),2.16
–
1.99(m,4h),1.45(s,9h),1.42
–
1.23(m,4h).ms 459.2(m 1).
[0101]
实施例2
[0102]
1-((1r,4r)-4-氨基环己基)-3-(4-(4-氟-2-甲氧基苯基)吡啶-2-基)脲(化合物2)的制备
[0103]
向圆底烧瓶中加入化合物1(300mg,0.654mmol)和dcm(5ml),加入4.0m盐酸二氧六环溶液(0.5ml),室温反应过夜。反应结束后,减压蒸干有机溶剂,加人dcm重新溶解,冰浴下滴加1.0m naoh水溶液调ph至弱碱性,dcm/h2o萃取,合并有机相并用饱和nacl水溶液洗涤两次,经无水na2so4na2so4干燥后,减压蒸干溶剂,柱层析分离得白色固体2(223mg,产率95.1%)。1h nmr(400mhz,氯仿-d)δ9.21(s,1h),8.12(d,j=5.4hz,1h),7.86(s,1h),7.24(dd,j=6.8,1.5hz,1h),6.97(dd,j=5.4,1.4hz,1h),6.93(s,1h),6.75
–
6.65(m,2h),3.79(s,3h),3.76
–
3.63(m,1h),2.87
–
2.77(m,1h),2.35
–
2.15(m,2h),2.17
–
2.07(m,2h),2.02
–
1.90(m,2h),1.42
–
1.32(m,4h).ms 359.1(m 1).
[0104]
实施例3
[0105]
1-(4-(4-氟-2-甲氧基苯基)吡啶-2-基)-3-((1r,4r)-4-((2-甲氧基乙基)氨基)环己基)脲(化合物3)的制备
[0106]
向圆底烧瓶中加入化合物2(100mg,0.279mmol)、溴乙基甲基醚(78mg,0.558mmol)、k2co3(116mg,0.837mmol)及dmf(4ml),50℃反应过夜。反应结束后,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并依次用水、饱和nacl水溶液洗涤3次,经无水na2so4干燥后,减压蒸干溶剂,柱层析纯化得白色固体3(73mg,产率62.82%)。1h nmr(400mhz,氯仿-d)δ9.29(d,j=7.8hz,1h),8.15(d,j=5.4hz,1h),7.36(s,1h),7.27(dd,j=6.9,1.5hz,1h),6.99(dd,j=5.4,1.5hz,1h),6.83(s,1h),6.78
–
6.69(m,2h),3.82(s,3h),3.74(dd,j=7.4,3.9hz,1h),3.57
–
3.49(m,2h),3.37(s,3h),2.83(t,
j=5.1hz,2h),2.52(dt,j=10.5,4.9hz,1h),2.19
–
2.10(m,2h),2.03
–
1.95(m,2h),1.39
–
1.28(m,4h).ms 417.2(m 1).
[0107]
实施例4
[0108]
n-((1r,4r)-4-(3-(4-(4-氟-2-甲氧基苯基)吡啶-2-基)脲基)环己基)乙酰胺(化合物4)的制备
[0109]
向圆底烧瓶中加入化合物2(80mg,0.223mmol)、et3n(56mg,0.56mmol)和dcm(5ml),冰浴下滴加乙酸酐(30mg,0.29mmol),室温搅拌1小时。反应结束后,加入少量水淬灭反应,倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并用饱和nacl水溶液洗涤2次,经无水na2so4干燥后,减压蒸干溶剂,柱层析纯化得白色固体4(72mg,80.55%)。1h nmr(400mhz,dmso-d6)δ9.17(s,1h),8.23(d,j=4.9hz,1h),7.97(d,j=2.3hz,1h),7.74
–
7.68(m,1h),7.25(dd,j=4.8,2.2hz,1h),7.15(dd,j=8.0,2.2hz,1h),7.00(m,1h),6.56(s,1h),5.48(s,1h),4.20
–
4.14(m,1h),3.81(s,3h),3.31
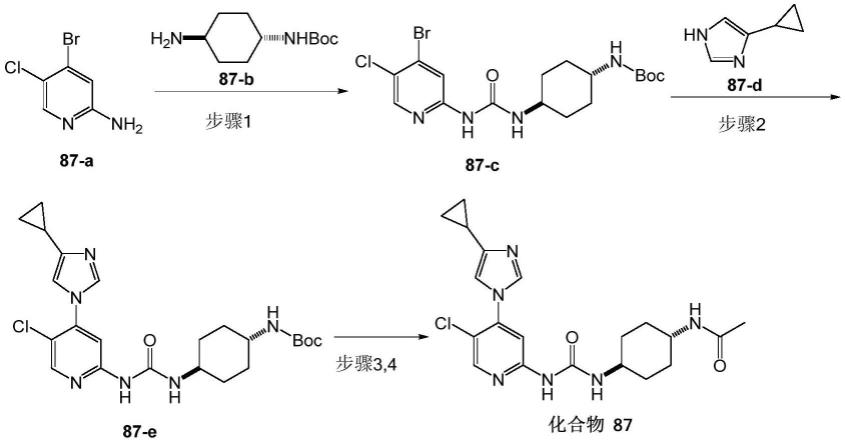
–
3.23(m,1h),1.99(s,3h),1.80
–
1.64(m,2h),1.58
–
1.38(m,2h),1.34-1.24(m,4h).ms 401.2(m 1).
[0110]
实施例5
[0111]
1-((1r,4r)-4-氨基环己基)-3-(4-(4,5-二氟-2-甲氧基苯基)吡啶-2-基)脲(化合物5)的制备
[0112][0113]
除用4,5-二氟-2-甲氧基苯硼酸代替4-氟-2-甲氧基苯硼酸(化合物1-e)外,合成方法与实施例2相同。1h nmr(400mhz,dmso-d6)δ9.15(s,1h),8.19(d,j=4.9hz,1h),7.93(d,j=2.3hz,1h),7.60(dd,j=8.0,4.9hz,1h),7.21(dd,j=4.8,2.2hz,1h),7.09(dd,j=8.0,5.0hz,1h),6.49(s,1h),3.77(s,3h),3.28
–
3.09(m,1h),2.61
–
2.43(m,1h),1.79
–
1.61(m,2h),1.55
–
1.37(m,2h),1.31
–
1.15(m,4h),1.08
–
0.89(m,2h).ms 377.1(m 1).
[0114]
实施例6
[0115]
1-((1r,4r)-4-氨基环己基)-3-(4-(4-氟-3-甲氧基苯基)吡啶-2-基)脲(化合物6)的制备
[0116][0117]
除用4-氟-3-甲氧基苯硼酸代替4-氟-2-甲氧基苯硼酸外,合成方法与实施例2相同。1h nmr(400mhz,dmso-d6)δ9.16(s,1h),8.20(d,j=4.9hz,1h),8.11(d,j=2.3hz,1h),7.94(t,j=8.0hz,1h),7.60(dd,j=4.8,2.2hz,1h),7.23(dd,j=4.9,1.8hz,1h),7.11
–
7.02(m,1h),6.51(s,1h),3.80(s,3h),3.30
–
3.11(m,1h),2.62
–
2.44(m,1h),1.56
–
1.41(m,2h),1.33
–
1.14(m,6h),1.06
–
0.87(m,2h).ms 359.1(m 1).
[0118]
实施例7
[0119]
1-((1r,4r)-4-氨基环己基)-3-(4-(2,4-二氟-5-甲氧基苯基)吡啶-2-基)脲(化合物7)的制备
[0120][0121]
除用2,4-二氟-5-甲氧基苯硼酸代替4-氟-2-甲氧基苯硼酸外,合成方法与实施例2相同。1h nmr(400mhz,氯仿-d)δ9.17(s,1h),8.41(s,1h),8.28(d,j=4.8hz,1h),7.43(dt,j=4.8,2.2hz,1h),7.06(t,j=8.0hz,1h),6.87(s,1h),5.71(s,1h),4.82(s,2h),3.81(s,3h),3.24(br s,1h),2.57-2.49(m,1h),1.89
–
1.76(m,2h),1.67
–
1.59(m,2h),1.36
–
1.25(m,4h).ms 377.1(m 1).
[0122]
实施例8
[0123]
1-((1r,4r)-4-氨基环己基)-3-(4-(4-氟-苯并呋喃-7-基)吡啶-2-基)脲(化合物8)的制备
[0124][0125]
除用4-氟-苯并呋喃-7-硼酸代替4-氟-2-甲氧基苯硼酸外,合成方法与实施例2相同。1h nmr(400mhz,dmso-d6)δ9.16(s,1h),8.23(d,j=4.9hz,1h),7.97(d,j=2.3hz,1h),7.91(d,j=1.3hz,1h),7.74(dd,j=7.9,5.1hz,1h),7.25(dd,j=4.8,2.2hz,1h),7.07
–
6.99(m,1h),6.97(dd,j=4.9,1.4hz,1h),6.56(s,1h),3.32
–
3.15(m,1h),2.65
–
2.49(m,1h),1.80
–
1.66(m,2h),1.55
–
1.43(m,2h),1.38
–
1.20(m,6h).ms 369.1(m 1).
[0126]
实施例9
[0127]
1-((1r,4r)-4-氨基环己基)-3-(4-(3-异丙基-2-甲基-2h-吲唑-5-基)吡啶-2-基)脲(化合物9)的制备
[0128][0129]
除用3-异丙基-2-甲基-2h-吲唑-5-硼酸频那醇酯代替4-氟-2-甲氧基苯硼酸外,合成方法与实施例2相同。1h nmr(400mhz,dmso-d6)δ9.14(s,1h),8.21(d,j=4.9hz,1h),8.19(d,j=2.4hz,1h),8.03
–
7.94(m,2h),7.45
–
7.39(m,1h),7.25(dd,j=4.8,2.2hz,1h),6.56(s,1h),3.79(s,3h),3.32
–
3.11(m,2h),2.65
–
2.49(m,1h),1.82
–
1.63(m,2h),1.57
–
1.41(m,2h),1.34
–
1.22(m,5h),1.21(d,j=4.8hz,6h),1.08
–
0.95(m,2h).ms407.2(m 1).
[0130]
实施例10
[0131]
1-((1r,4r)-4-氨基环己基)-3-(4-(2-氯-4-氟苯基)吡啶-2-基)脲(化合物10)的制备
[0132][0133]
除用2-氯-4-氟苯硼酸代替4-氟-2-甲氧基苯硼酸外,合成方法与实施例2相同。1hnmr(400mhz,甲醇-d4)δ8.24(d,j=5.3hz,1h),7.48
–
7.31(m,2h),7.21(td,j=8.4,2.6hz,1h),7.16(d,j=1.5hz,1h),7.02(dd,j=5.4,1.6hz,1h),3.67-3.53(m,1h),3.14-3.01(m,1h),2.26
–
1.99(m,4h),1.65
–
1.37(m,4h).ms 363.1(m 1).
[0134]
实施例11
[0135]
1-(4-(2-氯-4-氟苯基)吡啶-2-基)-3-((1r,4r)-4-((2-甲氧乙基)氨基)环己基)脲(化合物11)的制备
[0136][0137]
除用2-氯-4-氟苯硼酸代替4-氟-2-甲氧基苯硼酸外,合成方法与实施例3相同。1hnmr(400mhz,氯仿-d)δ9.21(d,j=7.5hz,1h),8.20(d,j=5.3hz,1h),7.76(s,1h),7.33
–
7.19(m,2h),7.07(td,j=8.2,2.6hz,1h),6.92(dd,j=5.4,1.5hz,1h),6.77(s,1h),3.87
–
3.63(m,1h),3.62
–
3.44(t,j=5.1hz,2h),3.37(s,3h),2.83(t,j=5.1hz,2h),2.61
–
2.41(m,1h),2.24
–
2.06(m,2h),2.05
–
1.91(m,2h),1.45
–
1.14(m,5h).ms 421.1(m 1).
[0138]
实施例12
[0139]
1-((1r,4r)-4-氨基环己基)-3-(4-(4-氟-2-三氟甲氧基)苯基)吡啶-2-基)脲(化合物12)的制备
[0140][0141]
除用4-氟-2-三氟甲氧基苯硼酸代替4-氟-2-甲氧基苯硼酸外,合成方法与实施例2相同。1h nmr(400mhz,dmso-d6)δ9.18(s,1h),8.23(d,j=4.9hz,1h),7.97(d,j=2.3hz,1h),7.71(dd,j=8.4,5.0hz,1h),7.25(dd,j=4.8,2.2hz,1h),7.15(dd,j=8.0,2.0hz,1h),7.00(m,1h),6.58(s,1h),3.32
–
3.21(m,1h),2.85
–
2.74(m,1h),1.89
–
1.74(m,2h),1.55
–
1.45(m,2h),1.33
–
1.05(m,6h).ms 413.1(m 1).
[0142]
实施例13
[0143]
1-((1r,4r)-4-氨基环己基)-3-(4-(1-甲基-1h-吡唑-4-基)吡啶-2-基)脲(化合物13)的制备
[0144][0145]
除用1-甲基-1h-吡唑-4-硼酸频哪醇酯代替4-氟-2-甲氧基苯硼酸外,合成方法与实施例2相同。1h nmr(400mhz,dmso-d6)δ9.19(s,1h),8.23(s,1h),8.18(brs,1h),8.09(d,j=5.4hz,1h),7.87(s,1h),7.48(s,1h),7.11(d,j=5.4hz,1h),3.88(s,3h),3.45-3.30(m,2h),3.17(brs,1h),3.02-2.90(m,1h),1.96-1.82(m,4h),1.59
–
1.19(m,4h).ms 315.2(m 1).
[0146]
实施例14
[0147]
1-((1r,4r)-4-((2-甲氧乙基)氨基)环己基)-3-(4-(1-甲基-1h-吡唑-4-基)吡啶-2-基)脲(化合物14)的制备
[0148][0149]
除用1-甲基-1h-吡唑-4-硼酸频哪醇酯代替4-氟-2-甲氧基苯硼酸外,合成方法与实施例3相同。1h nmr(400mhz,甲醇-d4)δ8.14
–
8.06(m,2h),7.92(brs,1h),7.20(brs,1h),7.13(dd,j=5.5,1.6hz,1h),3.94(s,3h),3.65-3.58(m,1h),3.60(t,j=5.7,4.5hz,2h),3.40(s,3h),3.08(t,j=5.1hz,2h),2.91-2.80(m,1h),2.23
–
2.07(m,4h),1.53-1.40(m,4h).ms 373.2(m 1).
[0150]
实施例15
[0151]
1-((1r,4r)-4-氨基环己基)-3-(4-(5,5-二甲基-5,6-二氢-4h-吡咯[1,2-b]吡唑-3-基)吡啶-2-基)脲(化合物15)的制备
[0152][0153]
步骤1:向圆底三颈瓶中加入三光气(422mg,1.97mmol)和无水dcm(40ml),冰浴下滴加化合物15-j(1.0g,5.78mmol)的dcm溶液(20ml),随后滴加无水et3n(4.02ml,28.90mmol),继续搅拌2小时后停止反应。减压旋蒸除去有机溶剂后即得浅黄色固体。向圆底烧瓶中加入上述中间体、15-k(1.24g,5.78mmol)、et3n(3.21ml,23.12mmol)及无水甲苯(70ml),加热回流反应过夜。反应结束后,冷却至室温,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并用饱和nacl水溶液洗涤3次,经无水na2so4干燥后,减压蒸干溶剂,柱层析纯化得浅黄色固体15-l(1.5g,产率62.79%)。1h nmr(400mhz,
氯仿-d)δ8.99(s,1h),8.00(d,j=5.9hz,2h),7.03(dd,j=5.5,1.6hz,1h),7.00(s,1h),4.44(d,j=7.9hz,1h),3.78
–
3.66(m,1h),3.53
–
3.40(m,1h),2.15
–
1.97(m,4h),1.44(s,9h),1.42
–
1.26(m,4h).ms 413.1(m 1).
[0154]
步骤2:向圆底烧瓶中加入中间体15-l(150mg,0.36mmol)、15-i(114mg,0.44mmol)、pd2dba3(12mg,0.054mmol)、x-phos(34.6mg,0.073mmol)、k2hpo4(190mg,1.09mmol)及二氧六环/h2o(10/2ml),氩气保护下,85℃反应6小时。反应结束后,冷却至室温,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并用饱和nacl水溶液洗涤3次,经无水na2so4干燥后,减压蒸干溶剂,柱层析纯化得浅黄色固体15-m(80mg,产率47.04%)。1h nmr(400mhz,dmso-d6)δ9.20(s,1h),8.23(d,j=5.0hz,1h),8.15(s,1h),7.95(d,j=2.2hz,1h),7.26(dd,j=4.9,2.2hz,1h),6.64(s,1h),3.95(s,2h),3.33
–
3.16(m,1h),2.94(s,2h),2.67
–
2.52(m,1h),1.92
–
1.78(m,2h),1.67
–
1.53(m,2h),1.46
–
1.34(m,11h),1.30(s,6h),1.28
–
1.09(m,4h).ms 469.3(m 1).
[0155]
步骤3:向圆底烧瓶中加入化合物15-m(80mg,0.17mmol)和dcm(5ml),加入4.0m盐酸二氧六环溶液(0.3ml),室温反应过夜。反应结束后,减压蒸干有机溶剂,加甲醇重新溶解,冰浴下滴加1.0m naoh水溶液调ph至弱碱性,减压蒸干溶剂,柱层析分离得白色固体15(50mg,产率79.48%)。1h nmr(400mhz,dmso-d6)δ9.21(s,1h),8.23(d,j=4.9hz,1h),8.16(s,1h),7.97(d,j=2.3hz,1h),7.25(dd,j=4.8,2.2hz,1h),6.56(s,1h),3.91(s,2h),3.33
–
3.16(m,1h),2.91(s,2h),2.66
–
2.50(m,1h),1.92
–
1.78(m,2h),1.67
–
1.52(m,2h),1.46
–
1.37(m,4h),1.29(s,6h),1.23
–
1.12(m,2h).ms 369.2(m 1).
[0156]
其中,中间体5,5-二甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂戊硼烷-2-基)-5,6-二氢-4h-吡咯并[1,2-b]吡唑(15-i)的制备如下所示:
[0157][0158]
步骤1:向圆底烧瓶中加入中间体15-a(25.0g,171.02mmol)、et3n(34.61g,342.03mmol)、dmap(1.04g,8.55mmol)和无水thf(200ml),冰浴下,分三批加入tscl(35.86g,188.12mmol)。升温至室温,随后80℃回流反应过夜。反应结束后,减压旋蒸除掉大部分溶剂,倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次。合并有机相并用饱和nacl水溶液洗涤2次,无水na2so4干燥,减压蒸干溶剂,柱层析纯化得无色油状物15-b(31.0g,产率60.35%)。1h nmr(400mhz,氯仿-d)δ7.77(d,j=8.3hz,1h),7.34(d,j=8.1hz,1h),4.07(q,j=7.1hz,1h),4.00(s,1h),2.45(s,2h),1.19(t,j=7.0hz,1h),1.17(s,6h).ms 301.1(m 1).
[0159]
步骤2:向圆底烧瓶中加入中间体15-b(31.0g,103.21mmol)、吡唑(9.13g,134.17mmol)、碳酸铯(100.88g,309.62mmol)无水dmf(100ml),100℃反应过夜。反应结束后
冷却至室温,减压蒸干大部分溶剂后将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次。合并有机相并依次用水、饱和nacl水溶液洗涤3次,无水na2so4干燥,减压蒸干溶剂,柱层析纯化得无色油状物15-d(11.2g,产率55.3%)。1h nmr(400mhz,氯仿-d)δ7.44(s,1h),7.34(d,j=2.3hz,1h),6.19(t,j=2.4hz,1h),4.27(s,2h),4.13(q,j=7.3hz,2h),1.23(t,j=7.1hz,4h),1.17(s,6h).ms 197.1(m 1).
[0160]
步骤3:向圆底烧瓶中加入15-d(11.2g,57.07mmol)和甲醇(60ml),滴加naoh水溶液(5m,22.83ml,114.14mmol),50℃反应过夜。反应结束后,冷却至室温,冰浴下用6m盐酸调节ph=3,减压蒸干溶剂,柱层析分离得浅黄色油状物,静置后固化成白色晶体状固体15-e(9.2g,产率95.8%)。1h nmr(400mhz,dmso-d6)δ12.47(s,1h),7.61(d,j=2.3hz,1h),7.41(d,j=1.8hz,1h),6.22(t,j=2.1hz,1h),4.24(s,2h),1.05(s,6h).ms169.1(m 1).
[0161]
步骤4:向圆底三颈瓶中加入中间体15-e(9.2g,54.7mmol)和无水thf(100ml),-78℃滴加n-buli(1.6m,70.08ml,112.13mmol),搅拌30分钟,升温至-45℃搅拌2小时,然后升温至15℃搅拌1小时后结束反应。0℃下滴加饱和nh4cl水溶液淬灭反应,将反应液倒入饱和nh4cl水溶液中,分离有机相,水相用乙酸乙酯萃取3次,合并有机相并用饱和nacl水溶液洗涤2次,减压蒸干得黄色油状物15-f(3.21g,产率39.08%)。1h nmr(400mhz,氯仿-d)δ7.79(s,1h),6.65(s,1h),4.28(s,2h),1.38(s,6h).ms 151.1(m 1).
[0162]
步骤5:向圆底烧瓶中加入中间体15-f(3.21g,21.37mmol)、85%水合肼(6.11ml,106.87mmol)及二乙二醇(45ml),180℃反应1小时。减压旋蒸将多余的水合肼除去后加入koh,150℃反应3小时。冷却至室温,加入50ml水稀释,冰浴下用2n盐酸水溶液调节ph至4.5,乙醚萃取(5x50ml),合并有机相并依次用水(3x20ml)、饱和nacl水溶液(2x20ml)洗涤,经无水na2so4干燥后过滤,减压蒸干溶剂即得黄色油状产物15-g(1.84g,产率63.3%)。1h nmr(400mhz,氯仿-d)δ7.48(d,j=1.8hz,1h),5.92(s,1h),3.86(s,2h),2.67(s,2h),1.27(s,6h).ms 137.1(m 1).
[0163]
步骤6:向圆底烧瓶中加入中间体15-g(1.84g,13.51mmol)和dcm(20ml),冰浴下加入nbs(2.4g,13.51mmol),室温反应过夜。反应结束后加入dcm(20ml)稀释反应液,依次用水(2x20ml)和饱和nacl水溶液洗(2x20ml)洗,经无水na2so4干燥后过滤,减压蒸干溶剂得黄色油状产物15-h(1.93g,产率66.28%)。1h nmr(400mhz,氯仿-d)δ7.41(s,1h),3.89(s,2h),2.64(s,2h),1.29(s,6h).215.1(m 1).
[0164]
步骤7:向圆底烧瓶中加入中间体15-h(1.93g,8.95mmol),acok(2.2g,22.39mmol)和1,4-二氧六环(25ml),氩气保护下充分除氧,加入pcy3(502mg,1.79mmol)及pd(oac)2(201mg,0.90mol),充分除氧气,90℃反应3小时。反应液冷却至室温后倒入水中,乙酸乙酯萃取,合并有机相并用饱和nacl水溶液洗涤2次,无水na2so4干燥,减压蒸干溶剂,柱层析分离纯化得黄色半固体状产物15-i(1.9g,产率80.94%)。1h nmr(400mhz,氯仿-d)δ7.42(s,1h),3.90(s,2h),2.64(s,2h),1.29(s,6h).263.2(m 1).
[0165]
实施例16
[0166]
1-((1r,4r)-4-(3-(4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2基)脲基)环己基)乙酰胺(化合物16)的制备
[0167][0168]
除用化合物15代替化合物2外,合成方法与实施例4相同。1h nmr(400mhz,dmso-d6)δ9.19(s,1h),8.21(d,j=4.9hz,1h),8.16(s,1h),7.97(d,j=2.3hz,1h),7.25(dd,j=4.8,2.2hz,1h),6.56(s,1h),5.50(s,1h),4.11-4.02(m,1h),3.79(s,2h),3.24-3.12(m,1h),2.81(s,2h),2.04(s,3h),1.88
–
1.71(m,4h),1.34
–
1.26(m,4h),1.24(s,6h).ms411.2(m 1).
[0169]
实施例17
[0170]
1-(4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2基)-3-((1r,4r)-4-((2-甲氧基乙基)氨基)环己基)脲(化合物17)的制备
[0171][0172]
除用化合物15代替化合物2外,合成方法与实施例3相同。1h nmr(400mhz,dmso-d6)δ9.20(s,1h),8.23(d,j=4.9hz,1h),8.16(s,1h),7.97(d,j=2.3hz,1h),7.25(dd,j=4.8,2.2hz,1h),6.53(s,1h),3.89(s,2h),3.74
–
3.68(m,1h),3.53(t,j=5.4hz,2h),3.27(s,3h),3.26
–
3.18(m,1h),2.84(s,2h),2.76(dt,j=6.4,5.5hz,2h),2.50
–
2.35(m,1h),1.81
–
1.69(m,2h),1.56
–
1.44(m,4h),1.32(s,6h),1.24
–
1.09(m,2h).ms 427.1(m 1).
[0173]
实施例18
[0174]
1-((1r,4r)-4-氨基环己基)-3-(5-氯-4-(4-氟-2-甲氧基苯基)吡啶-2-基)脲(化合物18)的制备
[0175][0176]
除用5-氯-4-溴-2-氨基吡啶代替4-溴-2-氨基吡啶(化合物1-a)外,合成方法与实施例2相同。1h nmr(400mhz,dmso-d6)δ9.25(s,1h),8.26(s,1h),7.84(brs,2h),7.56-7.48(m,2h),7.21(dd,j=8.4,6.8hz,1h),7.08(dd,j=11.4,2.5hz,1h),6.90(td,j=8.4,2.5hz,1h),3.76(s,3h),3.53
–
3.38(m,1h),3.10-3.07(m,1h),1.94(d,j=11.2hz,4h),1.61
–
1.14(m,4h).ms 393.1(m 1).
[0177]
实施例19
[0178]
1-(5-氯-4-(4-氟-2-甲氧基苯基)吡啶-2-基)-3-((1r,4r)-4-((2-甲氧基乙基)氨基)环己基)脲(化合物19)的制备
[0179][0180]
除用5-氯-4-溴-2-氨基吡啶代替4-溴-2-氨基吡啶外,合成方法与实施例3相同。1hnmr(400mhz,甲醇-d4)δ8.22(s,1h),7.18(dd,j=8.4,6.6hz,1h),7.10(s,1h),6.92(dd,j=11.1,2.4hz,1h),6.80(td,j=8.3,2.4hz,1h),3.80(s,3h),3.71
–
3.57(m,3h),3.43(s,3h),3.22(t,j=5.0hz,2h),3.17
–
3.03(m,1h),2.24-2.11(m,5h),1.66
–
1.36(m,4h).ms451.1(m 1).
[0181]
实施例20
[0182]
1-(5-氯-4-(4-氟-2-甲氧基苯基)吡啶-2-基)-3-((1r,4r)-4-((2-羟乙基)氨基)环己基)脲(化合物20)的制备
[0183][0184]
除用5-氯-4-溴-2-氨基吡啶代替4-溴-2-氨基吡啶和用2-溴代乙醇代替2-溴乙基甲基醚外,合成方法与实施例3相同。1h nmr(400mhz,dmso-d6)δ9.22(s,1h),8.27(s,1h),7.56-7.47(m,2h),7.21(dd,j=8.4,6.8hz,1h),7.08(dd,j=11.4,2.5hz,1h),6.91(m,1h),4.80(t,j=6.4hz,1h),3.95
–
3.87(m,2h),3.81(s,3h),3.75
–
3.67(m,1h),3.33
–
3.18(m,1h),2.78(td,j=7.5,6.6hz,2h),2.51
–
2.38(m,1h),1.81
–
1.60(m,4h),1.24
–
1.09(m,4h).ms 437.1(m 1).
[0185]
实施例21
[0186]
1-(5-氯-4-(4-氟-2-甲氧基苯基)吡啶-2-基)-3-((1r,4r)-4-((1-甲氧基丙烷-2-基)氨基)环己基)脲(化合物21)的制备
[0187][0188]
除用5-氯-4-溴-2-氨基吡啶代替4-溴-2-氨基吡啶和用2-溴-1-甲氧基丙烷代替2-溴乙基甲基醚外,合成方法与实施例3相同。1h nmr(400mhz,dmso-d6)δ9.21(s,1h),8.26(s,1h),8.16(s,1h),7.71(dd,j=8.5,5.0hz,1h),7.15(dd,j=8.0,2.2hz,1h),7.00(td,j=8.2,2.2hz,1h),6.56(s,1h),3.81(s,3h),3.72(br s,1h),3.47(d,j=7.0hz,2h),3.27(s,3h),3.26
–
3.18(m,1h),2.97
–
2.89(m,1h),2.43
–
2.35(m,1h),1.78
–
1.70(m,2h),1.53
–
1.44(m,2h),1.19
–
1.10(m,2h),0.94(d,j=6.6hz,3h),0.92
–
0.85(m,2h).ms 465.2(m 1).
[0189]
实施例22
[0190]
n-((1r,4r)-4-(3-(5-氯-4-(4-氟-2-甲氧基苯基)吡啶-2-基)脲基)环己基)乙酰胺(化合物22)的制备
[0191][0192]
除用5-氯-4-溴-2-氨基吡啶代替4-溴-2-氨基吡啶外,合成方法与实施例4相同。1hnmr(400mhz,dmso-d6)δ9.21(s,1h),8.40(s,1h),8.17(s,1h),7.72(dd,j=8.5,5.0hz,1h),7.15(dd,j=8.0,2.2hz,1h),7.02
–
6.95(m,1h),6.64(s,1h),5.71(s,1h),4.21
–
4.06(m,1h),3.81(s,3h),3.36
–
3.19(m,1h),1.99(s,3h),1.79
–
1.70(m,2h),1.54
–
1.45(m,2h),1.34
–
1.23(m,4h).ms 435.1(m 1).
[0193]
实施例23
[0194]
1-(5-氯-4-(4-氟-2-甲氧基苯基)吡啶-2-基)-3-((1r,4r)-4-(异丙氨基)环己基)脲(化合物23)的制备
[0195][0196]
除用5-氯-4-溴-2-氨基吡啶代替4-溴-2-氨基吡啶和用2-溴丙烷代替2-溴乙基甲基醚外,合成方法与实施例3相同。1h nmr(400mhz,dmso-d6)δ9.15(s,1h),8.38(s,1h),8.16(s,1h),7.69(dd,j=8.5,5.1hz,1h),7.15(d,j=8.0hz,1h),7.07
–
6.93(m,1h),6.56(s,1h),3.81(s,3h),3.32
–
3.18(m,1h),2.87
–
2.76(m,1h),2.46
–
2.33(m,1h),1.80
–
1.68(m,2h),1.56
–
1.43(m,3h),1.32(d,j=4.9hz,6h),1.21
–
1.09(m,4h).ms 435.2(m 1).
[0197]
实施例24
[0198]
1-(5-氯-4-(4-氟-2-甲氧基苯基)吡啶-2-基)-3-((1r,4r)-4-(环丙基氨基)环己基)脲(化合物24)的制备
[0199][0200]
除用5-氯-4-溴-2-氨基吡啶代替4-溴-2-氨基吡啶和用溴代环丙烷代替2-溴乙基甲基醚外,合成方法与实施例3相同。1h nmr(400mhz,dmso-d6)δ9.16(s,1h),8.42(s,1h),8.15(s,1h),7.69(dd,j=8.3,4.9hz,1h),7.15(dd,j=8.0,2.2hz,1h),6.98(td,j=8.2,2.0hz,1h),6.59(s,1h),3.80(s,3h),3.35
–
3.29(m,1h),2.49
–
2.30(m,2h),1.93
–
1.66(m,5h),1.42
–
1.37(m,4h),0.58
–
0.34(m,4h).ms 433.1(m 1).
[0201]
实施例25
[0202]
1-(5-氯-4-(4-氟-2-甲氧基苯基)吡啶-2-基)-3-((1r,4r)-4-((四氢呋喃-3-基)氨基)环己基)脲(化合物25)的制备
[0203][0204]
除用5-氯-4-溴-2-氨基吡啶代替4-溴-2-氨基吡啶和用3-溴代四氢呋喃代替2-溴乙基甲基醚外,合成方法与实施例3相同。1h nmr(400mhz,dmso-d6)δ9.18(s,1h),8.26(s,1h),8.13(s,1h),7.82
–
7.72(m,1h),7.22(dd,j=8.0,2.2hz,1h),7.14
–
7.01(m,1h),6.61(s,1h),4.07
–
3.98(m,2h),3.88
–
3.73(m,6h),3.39
–
3.26(m,1h),3.10
–
3.00(m,1h),2.53
–
2.41(m,1h),2.17
–
1.92(m,4h),1.72
–
1.61(m,2h),1.27
–
1.16(m,4h).ms 463.2(m 1).
[0205]
实施例26
[0206]
1-(5-氯-4-(4-氟-2-甲氧基苯基)吡啶-2-基)-3-((1r,4r)-4-((3,3,3-三氟丙基)氨基)环己基)脲(化合物26)的制备
[0207][0208]
除用5-氯-4-溴-2-氨基吡啶代替4-溴-2-氨基吡啶和用3,3,3-三氟-1-溴丙烷代替2-溴乙基甲基醚外,合成方法与实施例3相同。1h nmr(400mhz,dmso-d6)δ9.21(s,1h),8.28(s,1h),8.16(s,1h),7.71(dd,j=8.5,5.0hz,1h),7.17
–
6.95(m,2h),6.59(s,1h),3.81(s,3h),3.30
–
3.18(m,1h),2.59
–
2.51(m,2h),2.49
–
2.37(m,1h),2.01
–
1.88(m,2h),1.80
–
1.40(m,5h),1.32
–
1.03(m,4h).ms 489.1(m 1).
[0209]
实施例27
[0210]
1-(5-氯-4-(4-氟-2-甲氧基苯基)吡啶-2-基)-3-((1r,4r)-4-((2-(二甲氨基)乙基)氨基)环己基)脲(化合物27)的制备
[0211][0212]
除用5-氯-4-溴-2-氨基吡啶代替4-溴-2-氨基吡啶和用(2-溴甲基)二甲胺代替2-溴乙基甲基醚外,合成方法与实施例3相同。1h nmr(400mhz,dmso-d6)δ9.18(s,1h),8.27(s,1h),8.17(s,1h),7.72(m,1h),7.20
–
6.98(m,2h),6.55(br s,1h),3.82(s,3h),3.32
–
3.20(m,1h),2.58(s,6h),2.55
–
2.37(m,5h),1.81
–
1.39(m,5h),1.31
–
1.09(m,4h).ms 464.2(m 1).
[0213]
实施例28
[0214]
n-((1r,4r)-4-(3-(5-氯-4-(4-氟-2-甲氧基苯基)吡啶-2-基)脲基)环己基)-2-(二甲氨基)乙酰胺(化合物28)的制备
[0215][0216]
向圆底烧瓶中加入化合物n,n-二甲基甘氨酸(32mg,0.31mmol)、hatu(126mg,0.33mmol)和dipea(0.21ml,1.27mmol)和无水dmf(3ml),室温搅拌10分钟后,加入化合物18(100mg,0.25mmol),室温继续反应4小时后结束反应。将反应液倒入水中,用乙酸乙酯萃取,合并有机相并依次用水(3x10ml)和饱和nacl水溶液(2x10ml)洗涤,无水na2so4干燥,减压蒸干溶剂,柱层析分离得浅黄色固体28(35mg,产率28.77%)。1hnmr(400mhz,dmso-d6)δ9.23(s,1h),8.26(s,1h),8.17(s,1h),7.70(dd,j=8.5,5.1hz,1h),7.46(s,1h),7.24
–
6.96(m,2h),6.55(br s,1h),4.19
–
4.04(m,1h),3.83(s,3h),3.44(s,2h),3.21
–
3.16(m,1h),2.62(s,6h),1.82
–
1.66(m,4h),1.36
–
1.07(m,4h).ms 478.2(m 1).
[0217]
实施例29
[0218]
1-(4-(4-氟-2-甲氧基苯基)-5-甲基吡啶-2-基)-3-((1r,4r)-4-((2-甲氧基乙基)氨基)环己基)脲(化合物29)的制备
[0219][0220]
除用4-溴-5-甲基吡啶-2胺代替4-溴-吡啶-2-胺外,合成方法与实施例3相同。1h nmr(400mhz,dmso-d6)δ9.16(s,1h),8.08(s,1h),7.88(s,1h),7.71(dd,j=8.5,5.0hz,1h),7.15(dd,j=8.0,2.2hz,1h),7.00(td,j=8.2,2.2hz,1h),6.54(br s,1h),3.81(s,3h),3.74
–
3.68(m,1h),3.53(t,j=5.4hz,2h),3.27(s,3h),3.26
–
3.19(m,1h),2.76(t,j=5.4hz,,2h),2.53
–
2.39(m,1h),2.36(s,3h),1.80
–
1.61(m,4h),1.35
–
1.06(m,4h).ms 431.2(m 1).
[0221]
实施例30
[0222]
n-((1r,4r)-4-(3-(5-氟-4-(4-氟-2-甲氧基苯基)吡啶-2-基)脲基)环己基)乙酰胺(化合物30)的制备
[0223][0224]
除用4-溴-5-氟吡啶-2胺代替4-溴-吡啶-2-胺外,合成方法与实施例4相同。1h nmr(400mhz,dmso-d6)δ9.30(s,1h),8.72(d,j=8.0hz,1h),7.95(d,j=4.9hz,1h),7.75
–
7.67(m,1h),7.15(dd,j=8.0,2.2hz,1h),7.00(td,j=8.2,2.2hz,1h),6.56(br s,1h),5.50(br s,1h),4.21
–
4.05(m,1h),3.81(s,3h),3.36
–
3.18(m,1h),1.99(s,3h),1.81
–
1.69(m,2h),1.55
–
1.43(m,2h),1.37
–
1.08(m,4h).ms 419.1(m 1).
[0225]
实施例31
[0226]
n-((1r,4r)-4-(3-(5-甲基-4-(4-氟-2-甲氧基苯基)吡啶-2-基)脲基)环己基)乙酰胺(化合物31)的制备
[0227][0228]
除用4-溴-5-甲基吡啶-2胺代替4-溴-吡啶-2-胺外,合成方法与实施例4相同。1h nmr(400mhz,dmso-d6)δ9.18(s,1h),8.05(s,1h),7.85(s,1h),7.68(dd,j=8.5,5.0hz,1h),7.12
–
6.99(m,2h),6.51(br s,1h),5.46(s,1h),4.17
–
4.04(m,1h),3.78(s,3h),3.30
–
3.16(m,1h),2.33(s,3h),1.96(s,3h),1.74
–
1.65(m,2h),1.49
–
1.37(m,2h),1.30
–
1.06(m,4h).ms 415.2(m 1).
[0229]
实施例32
[0230]
n-((1r,4r)-4-(3-(5-氰基-4-(4-氟-2-甲氧基苯基)吡啶-2-基)脲基)环己基)乙酰胺(化合物32)的制备
[0231][0232]
除用4-氯-5-氰基吡啶-2胺代替4-溴-吡啶-2-胺外,合成方法与实施例4相同。1h nmr(400mhz,dmso-d6)δ9.34(s,1h),9.01(s,1h),8.40(s,1h),7.71(dd,j=8.5,5.0hz,1h),7.15(dd,j=8.0,2.2hz,1h),7.00(td,j=8.2,2.2hz,1h),6.56(s,1h),5.50(s,1h),4.21
–
4.01(m,1h),3.81(s,3h),3.41
–
3.12(m,1h),1.99(s,3h),1.83
–
1.62(m,2h),1.57
–
1.37(m,2h),1.37
–
1.08(m,4h).ms 426.2(m 1).
[0233]
实施例33
[0234]
1-(4-(4-氟-2-甲氧基苯基)吡啶-2-基)-3-(6-氟吡啶-3-基)脲(化合物33)的制备
[0235][0236]
除用6-氟吡啶-3-胺代替n-boc-反式-1,4-环己二胺(化合物1-c)外,合成方法与实施例1相同。1h nmr(600mhz,氯仿-d)δ12.11(s,1h),8.30(s,1h),8.29
–
8.22(m,2h),7.37(brs,1h),7.30(dd,j=8.4,6.6hz,1h),7.12(dd,j=5.4,1.5hz,1h),6.98
–
6.88(m,2h),6.84
–
6.70(m,2h),3.85(s,3h).ms 357.1(m 1).
[0237]
实施例34
[0238]
1-(4-(4-氟-2-甲氧基苯基)吡啶-2-基)-3-(3-((2-甲氧基乙基)氨基)丙基)脲(化合物34)的制备
[0239][0240]
除用n-boc-1,3-丙二胺代替n-boc-反式-1,4-环己二胺外,合成方法与实施例3相同。1h nmr(400mhz,dmso-d6)δ9.21(s,1h),8.23(d,j=4.9hz,1h),7.97(d,j=2.3hz,1h),7.71(dd,j=8.4,5.0hz,1h),7.25(dd,j=4.8,2.2hz,1h),7.19
–
7.07(m,2h),7.05
–
6.93(m,1h),3.81(s,3h),3.61
–
3.47(m,5h),3.27(s,3h),2.82
–
2.69(m,2h),2.56
–
2.44(m,2h),1.99(p,j=6.0hz,2h).ms 377.2(m 1).
[0241]
实施例35
[0242]
1-((1r,3r)-3-氨基环丁基)-3-(4-(4-氟-2-甲氧基苯基)吡啶-2-基)脲(化合物35)的制备
[0243][0244]
除用n-boc-反式-1,3-环丁二胺代替n-boc-反式-1,4-环己二胺外,合成方法与实施例2相同。1h nmr(400mhz,dmso-d6)δ9.18(s,1h),8.25(d,j=4.9hz,1h),7.99(d,j=2.3hz,1h),7.73(dd,j=8.4,4.8hz,1h),7.27(dd,j=4.8,2.2hz,1h),7.17(dd,j=8.0,2.1hz,1h),7.02(td,j=8.2,2.2hz,1h),6.56(d,j=10.3hz,1h),4.40
–
4.25(m,1h),3.83(s,3h),3.11(ttd,j=9.2,7.0,2.3hz,1h),2.54(dt,j=12.4,9.3hz,2h),2.43(br s,2h),2.37
–
2.25(m,2h).ms 331.1(m 1).
[0245]
实施例36
[0246]
1-(4-(4-氟-2-甲氧基苯基)吡啶-2-基)-3-((1r,3r)-3-羟基环丁基)脲(化合物36)的制备
[0247][0248]
除用(1r,3r)-3-氨基环丁烷-1-醇代替n-boc-反式-1,4-环己二胺外,合成方法与实施例1相同。1h nmr(400mhz,dmso-d6)δ9.21(s,1h),8.23(d,j=4.9hz,1h),7.97(d,j=2.3hz,1h),7.71(dd,j=8.4,5.0hz,1h),7.25(dd,j=4.8,2.2hz,1h),7.15(dd,j=8.0,2.2hz,1h),7.00(td,j=8.2,2.2hz,1h),6.54(d,j=10.3hz,1h),4.52
–
4.38(m,1h),3.81(s,3h),3.45(d,j=6.8hz,1h),3.40
–
3.28(m,1h),2.67
–
2.54(m,2h),2.42
–
2.28(m,2h).ms332.1(m 1).
[0249]
实施例37
[0250]
1-(氮杂环庚烷-4-基)-3-(4-(4-氟-2-甲氧基苯基)吡啶-2-基)脲(化合物37)的制备
[0251][0252]
除用4-氨基氮杂环庚烷-1-羧酸叔丁酯代替n-boc-反式-1,4-环己二胺外,合成方法与实施例2相同。1h nmr(400mhz,甲醇-d4)δ8.18(dd,j=5.5,0.8hz,1h),7.37(dd,j=8.5,6.6hz,1h),7.20(s,1h),7.10(dd,j=5.4,1.5hz,1h),6.93(dd,j=11.1,2.5hz,1h),6.80(td,j=8.3,2.4hz,1h),4.04
–
3.96(m,1h),3.85(s,3h),3.44
–
3.33(m,2h),3.29
–
3.19(m,2h),2.35
–
2.13(m,2h),2.10
–
1.97(m,2h),1.96-1.82(m,2h).ms 359.2(m 1).
[0253]
实施例38
[0254]
1-((1r,4r)-4-氨基环己基)-3-(4-(4-氟-2-甲氧基苯基)吡啶-2-基)硫脲(化合物38)的制备
[0255][0256]
步骤1:向圆底烧瓶中加入化合物38-a(1.0g,5.78mmol)、38-b(1.47g,8.67mmol)、pd(oac)2(130mg,0.578mml)、x-phos(551mg,1.16mmol)、k2co3(2.0g,14.45mmol)及thf/h2o(40/10ml),氩气保护下,85℃反应3小时。反应结束后,冷却至室温,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并用饱和nacl水溶液洗涤3次,经无水na2so4干燥后,减压蒸干溶剂,柱层析纯化得白色固体38-c(896mg,产率71.1%)。1h nmr(400mhz,氯仿-d)δ8.01(d,j=5.3hz,1h),7.52
–
7.44(m,1h),7.29
–
7.26(m,1h),6.81
–
6.78(m,1h),6.76
–
6.70(m,2h),4.82(br s,2h),3.82(s,3h).ms 219.1(m 1).
[0257]
步骤2:圆底烧瓶中加入化合物38-d(280mg,1.28mmol)和无水dcm(10ml),冰浴下滴加化合物38-c的dcm溶液(10ml),随后滴加无水et3n(0.36ml,2.57mmol),继续搅拌1时后停止反应。减压蒸干溶剂后得到深棕色固体38-e,无需进一步纯化,可直接用于下一步反应。
[0258]
步骤3:向底烧瓶中加入步骤2所得中间体38-e、化合物38-f(275mg,1.28mmol)、无水et3n(0.36ml,2.57mmol)及无水甲苯(20ml),加热回流反应过夜。反应结束后冷却至室
温,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并用饱和nacl水溶液洗涤3次,经无水na2so4干燥后,减压蒸干溶剂,柱层析纯化得白色固体38-g(89mg,产率14.6%)。1h nmr(400mhz,氯仿-d)δ11.66(d,j=7.9hz,1h),8.30(s,1h),8.17(d,j=5.4hz,1h),7.30
–
7.24(m,1h),7.07(d,j=4.9hz,1h),6.87(s,1h),6.80
–
6.68(m,2h),4.49
–
4.38(m,1h),4.33
–
4.16(m,1h),3.83(s,3h),3.57
–
3.41(m,1h),2.33
–
2.20(m,2h),2.12
–
1.99(m,2h),1.45(s,9h),1.36
–
1.16(m,4h).ms 475.2(m 1).
[0259]
步骤4:向圆底烧瓶中加入化合物38-g(79mg,0.167mmol)以及二氯甲烷(5ml),滴加4.0m hcl二氧六环溶液(0.5ml),常温搅拌过夜。反应结束后减压蒸干溶剂,随后滴加1m naoh水溶液调节ph至弱碱性,减压蒸干溶剂,柱层析分离得白色固体38(57.8mg,57.8%)。1h nmr(400mhz,dmso-d6)δ11.68(d,j=7.6hz,1h),10.56(s,1h),8.19(d,j=5.4hz,1h),7.79(s,2h),7.37(dd,j=8.6,6.8hz,1h),7.33(d,j=1.5hz,1h),7.14(dd,j=5.5,1.5hz,1h),7.09(dd,j=11.4,2.5hz,1h),6.91(td,j=8.4,2.5hz,1h),4.09(s,1h),3.81(s,3h),3.05(s,1h),2.14
–
1.98(m,4h),1.50
–
1.34(m,4h).ms 375.1(m 1).
[0260]
实施例39
[0261]
叔丁基-((1r,4r)-4-(3-(6-(4-氟-2-甲氧基苯基)嘧啶-4-基)脲基)环己基)氨基甲酸酯(化合物39)的制备
[0262][0263]
步骤1:向微波管中加入化合物39-b(939mg,2.87mmol)、dppa(1.03g,3.74mmol)、无水et3n(1.2ml,8.62mmol)以及无水甲苯(5ml),微波110℃反应5分钟后,加入化合物39-a(500mg,2.87mmol),继续110℃微波反应30分钟。反应结束后,冷却至室温,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并用饱和nacl水溶液洗涤3次,经无水na2so4干燥后,减压蒸干溶剂,柱层析纯化得白色固体39-c(179mg,产率15.0%)。1h nmr(400mhz,dmso-d6)δ8.98(s,1h),8.80(s,1h),8.70(s,1h),7.47(s,1h),4.52
–
4.37(m,1h),3.90(s,3h),3.78
–
3.67(m,1h),3.56
–
3.40(m,1h),2.19
–
1.95(m,4h),1.45(s,9h),1.33
–
1.17(m,4h).ms 414.1(m 1).
[0264]
步骤2:向圆底烧瓶中加入化合物39-c(100mg,0.27mmol)、39-d(82mg,0.48mmol)、pd(oac)2(6mg,0.027mml)、x-phos(26mg,0.054mmol)、k2co3(83.40mg,0.60mmol)及thf/h2o(8/2ml),氩气保护下,85℃反应3小时。反应结束后,冷却至室温,将反应液倒入水中,乙酸
乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并用饱和nacl水溶液洗涤3次,经无水na2so4干燥后,减压蒸干溶剂,柱层析纯化得白色固体39(92.05mg,产率83.0%)。1h nmr(400mhz,氯仿-d)δ9.04(br s,1h),8.81(s,1h),8.05(dd,j=8.8,6.9hz,1h),7.98(s,1h),7.38(s,1h),6.80(td,j=8.2,2.4hz,1h),6.73(dd,j=10.8,2.4hz,1h),4.43(d,j=8.1hz,1h),3.90(s,3h),3.71(m,1h),3.49(s,1h),2.19-2.01(m,4h),1.45(s,9h),1.33
–
1.14(m,4h).ms 460.2(m 1).
[0265]
实施例40
[0266]
n-((1r,4r)-4-(3-(6-(4-氟-2-甲氧基苯基)嘧啶-4-基)脲基)环己基)乙酰胺(化合物40)的制备
[0267]
向圆底烧瓶中加入化合物39(82mg,0.178mmol)以及dcm(5ml),滴加4.0m hcl二氧六环溶液(0.5ml),常温搅拌过夜。反应结束后减压蒸干溶剂得白色固体。向上述圆底烧瓶中加入et3n(124μl,0.89mmol)和无水dcm(3ml),滴加乙酸酐(15μl,0.27mmol),室温反应2小时。反应结束后,减压蒸干溶剂,柱层析分离得白色固体40(60mg,产率83.76%)。1h nmr(400mhz,dmso-d6)δ9.24(s,1h),8.34(d,j=1.5hz,1h),7.86(br s,1h),7.71(dd,j=9.4,5.0hz,1h),7.15(dd,j=8.0,2.2hz,1h),7.10(d,j=1.3hz,1h),7.05
–
6.95(m,1h),5.53(s,1h),4.22
–
4.03(m,1h),3.81(s,3h),3.43
–
3.14(m,1h),1.99(s,3h),1.95
–
1.68(m,4h),1.35
–
1.07(m,4h).ms 402.1(m 1).
[0268]
实施例41
[0269]
n-((1r,4r)-4-(3-(4-(4-氟-2-甲氧基苯基)嘧啶-2-基)脲基)环己基)乙酰胺(化合物41)的制备
[0270][0271]
除用4-溴嘧啶-2-胺代替6-氯嘧啶-4-胺(39-a)外,合成方法与实施例40相同。1h nmr(400mhz,dmso-d6)δ9.27(s,1h),8.16(d,j=4.8hz,1h),7.75
–
7.67(m,2h),7.15(dd,j=8.0,2.2hz,1h),7.05
–
6.95(m,1h),6.56(s,1h),5.52(s,1h),4.19
–
4.03(m,1h),3.81(s,3h),3.35
–
3.13(m,1h),1.99(s,3h),1.92
–
1.45(m,2h),1.35
–
1.12(m,4h).ms 402.1(m 1).
[0272]
实施例42
[0273]
1-((1r,4r)-4氨基环己基)-3-(5-氯-4-(1,5-二甲基-1h-吡唑-4-基)-吡啶-2基)脲(化合物42)的制备
[0274][0275]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺(1-a)和用1,5-二甲基-1h-吡唑-4-硼酸频哪醇酯代替4-氟-2-甲氧基苯硼酸(1-e)外,合成方法与实施例2相同。1h nmr(400mhz,dmso-d6)δ9.21(s,1h),8.25(s,1h),7.97(s,2h),7.56-7.41(m,3h),3.79(s,3h),
3.55
–
3.37(m,1h),3.05
–
2.89(m,1h),2.25(s,3h),1.93-1.61(m,4h),1.53
–
1.10(m,4h).ms363.2(m 1).
[0276]
实施例43
[0277]
n-((1r,4r)-4-(3-(5-氯-4-(1,5-二甲基-1h-吡唑-4-基)吡啶-2-基)脲基)环己基)乙酰胺(化合物43)的制备
[0278][0279]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用1,5-二甲基-1h-吡唑-4-硼酸频哪醇酯代替4-氟-2-甲氧基苯硼酸外,合成方法与实施例4相同。1h nmr(400mhz,dmso-d6)δ9.20(s,1h),8.25(s,1h),7.97(s,1h),7.56-7.41(m,2h),5.60(s,1h),4.11-3.92(m,1h),3.79(s,3h),3.24-3.02(m,1h),2.26(s,3h),1.99(s,3h),1.90-1.62(m,4h),1.58
–
1.13(m,4h).ms 405.1(m 1).
[0280]
实施例44
[0281]
1-((1r,4r)-4-氨基环己基)-3-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)脲(化合物44)的制备
[0282][0283]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺外,合成方法与实施例15相同。1h nmr(400mhz,甲醇-d4)δ8.20(s,1h),8.01(s,1h),7.37(s,1h),3.97(s,2h),3.72
–
3.56(m,1h),3.35(s,1h),2.95(s,2h),2.23
–
1.86(m,4h),1.47
–
1.37(m,4h),1.34(s,6h).ms 403.2(m 1).
[0284]
实施例45
[0285]
1-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)-3-((1r,4r)-4-羟基环己基)脲(化合物45)的制备
[0286][0287]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用(1r,4r)-4-氨基环己烷-1-醇代替n-boc-反式-1,4-环己二胺(15-k)外,合成方法与实施例15相同。1h nmr(400mhz,dmso-d6)δ9.25(s,1h),8.46(s,1h),8.16(s,1h),7.96(s,1h),6.54(s,1h),3.95(s,2h),3.88
–
3.75(m,1h),3.32
–
3.17(m,1h),2.87(s,2h),2.23
–
1.90(m,2h),1.80
–
1.64(m,4h),
1.55(d,j=8.6hz,1h),1.53
–
1.43(m,2h),1.31(s,6h).ms 404.1(m 1).
[0288]
实施例46
[0289]
1-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)-3-((1r,4r)-4((2-甲氧基)氨基)环己基)脲(化合物46)的制备
[0290][0291]
除用化合物44代替化合物2外,合成方法与实施例3相同。1h nmr(400mhz,氯仿-d)δ8.77(s,1h),8.40(s,1h),8.14(s,1h),7.96(s,1h),6.92(s,1h),3.95(s,2h),3.79-3.67(m,1h),3.57(t,j=5.1hz,2h),3.35(s,3h),2.91(d,j=5.3hz,2h),2.89(s,2h),2.63(br s,1h),2.22
–
1.95(m,4h),1.57
–
1.34(m,4h),1.32(s,6h).ms 461.2(m 1).
[0292]
实施例47
[0293]
n-((1r,4r)-4-(3-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)脲基)环己基)乙酰胺(化合物47)的制备
[0294][0295]
除用化合物44代替化合物2外,合成方法与实施例4相同。1h nmr(400mhz,氯仿-d)δ8.71(s,1h),8.62(s,1h),8.16(s,1h),7.92(s,1h),6.97(s,1h),5.66(d,j=8.1hz,1h),3.95(s,2h),3.76
–
3.61(m,2h),2.87(s,2h),2.14
–
2.00(m,4h),1.98(s,3h),1.48-1.35(m,2h),1.32(s,6h),1.30
–
1.22(m,2h).ms 445.1(m 1).
[0296]
实施例48
[0297]
n-((1r,4r)-4-(3-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)脲基)环己基)-2-(二甲氨基)乙酰胺(化合物48)的制备
[0298][0299]
除用化合物44代替化合物18外,合成方法与实施例28相同。1h nmr(600mhz,丙酮-d6)δ8.57(s,1h),8.19(s,1h),7.98(s,2h),7.57(s,1h),7.25(d,j=8.4hz,1h),3.95(s,2h),3.77
–
3.70(m,1h),3.68
–
3.60(m,1h),2.97(s,2h),2.91(s,2h),2.29(s,6h),1.95
–
1.90(m,2h),1.49
–
1.35(m,6h),1.34(s,6h).ms 488.3(m 1).
[0300]
实施例49
[0301]
n-((1r,4r)-4-(3-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)脲基)环己基)-2-(二甲氨基)环丙基甲酰胺(化合物49)的制备
[0302][0303]
除用化合物44代替化合物18和用环丙甲酸代替n,n-二甲基甘氨酸外,合成方法与实施例28相同。1h nmr(400mhz,dmso-d6)δ9.24(s,1h),8.46(s,1h),8.16(s,1h),7.96(s,1h),7.44(s,1h),6.54(d,j=11.9hz,1h),4.19
–
4.03(m,1h),3.93(s,2h),3.32
–
3.13(m,1h),2.87(s,2h),1.80
–
1.64(m,3h),1.55
–
1.48(m,2h),1.41
–
1.35(m,4h),1.30(s,6h),1.00
–
0.84(m,4h).ms 471.1(m 1).
[0304]
实施例50
[0305]
n-((1r,4r)-4-(3-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)脲基)环己基)氧杂环丁烷-3-甲酰胺(化合物50)的制备
[0306][0307]
除用化合物44代替化合物18和用氧杂环丁烷-3-甲酸代替n,n-二甲基甘氨酸外,合成方法与实施例28相同。1h nmr(400mhz,dmso-d6)δ9.14(s,1h),8.50(s,1h),8.24(s,1h),7.97(s,1h),7.44(s,1h),6.95(d,j=11.1hz,1h),5.09(dd,j=12.4,7.2hz,2h),4.84(dd,j=12.4,7.0hz,2h),4.17
–
4.04(m,1h),3.94(s,2h),3.73
–
3.62(m,1h),3.31
–
3.16(m,1h),2.87(s,2h),1.80
–
1.65(m,4h),1.42
–
1.30(m,4h),1.26(s,6h).ms 487.2(m 1).
[0308]
实施例51
[0309]
n-((1r,4r)-4-(3-(4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)-5-氟吡啶-2-基)脲基)环己基)乙酰胺(化合物51)的制备
[0310][0311]
除用化合物5-氟-4-溴吡啶-2-胺代替4-溴吡啶-2-胺外,合成方法与实施例16相同。1hnmr(400mhz,dmso-d6)δ9.21(s,1h),8.72(d,j=8.0hz,1h),8.16(s,1h),7.98(d,j=4.9hz,1h),7.47(s,1h),5.65(d,j=11.2hz,1h),4.18
–
4.06(m,1h),3.97(s,2h),3.33
–
3.15(m,1h),2.83(s,2h),1.99(s,3h),1.81
–
1.65(m,4h),1.55
–
1.36(m,4h),1.31(s,6h).ms 429.1(m 1).
[0312]
实施例52
[0313]
n-((1r,4r)-4-(3-(4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)-5-甲基吡啶-2-基)脲基)环己基)乙酰胺(化合物52)的制备
[0314][0315]
除用化合物5-甲基-4-溴吡啶-2-胺代替4-溴吡啶-2-胺外,合成方法与实施例16相同。1h nmr(400mhz,dmso-d6)δ9.20(s,1h),8.46(s,1h),8.14(s,1h),7.93(s,1h),7.40(s,1h),6.49(br s,1h),3.93(s,2h),3.32
–
3.13(m,2h),2.87(s,2h),2.51(s,1h),1.80
–
1.60(m,4h),1.47
–
1.29(m,4h),1.25(s,6h).ms 425.2(m 1).
[0316]
实施例53
[0317]
n-((1r,4r)-4-(3-(4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)-5-环丙基吡啶-2-基)脲基)环己基)乙酰胺(化合物53)的制备
[0318][0319]
除用化合物5-环丙基-4-溴吡啶-2-胺代替4-溴吡啶-2-胺外,合成方法与实施例16相同。1h nmr(400mhz,dmso-d6)δ9.21(s,1h),8.16(s,1h),8.08(s,1h),7.88(s,1h),6.54(d,j=11.9hz,1h),5.49(brs,1h),4.19
–
4.03(m,1h),3.93(s,2h),3.33
–
3.08(m,2h),2.79(s,2h),1.99(s,3h),1.83
–
1.65(m,4h),1.55
–
1.40(m,4h),1.31(s,6h),0.76
–
0.39(m,4h).ms 451.3(m 1).
[0320]
实施例54
[0321]
n-((1r,4r)-4-(3-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)脲基)环己基)乙酰胺-2,2,2-d3(化合物54)的制备
[0322][0323]
向圆底烧瓶中加入化合物44(60mg,0.149mmol)、dipea(62μl,0.372mmol)和无水dmf(1ml),冰浴下滴加乙酰氯-d3(13μl,0.179mmol),室温反应2小时。反应结束后,加入甲醇淬灭反应,减压蒸干溶剂,柱层析分离得到白色固体54(16mg,23.98%)。1h nmr(400mhz,dmso-d6)δ9.23(s,1h),8.46(s,1h),8.16(s,1h),7.93(s,1h),7.43(d,j=11.4hz,1h),6.54(d,j=11.9hz,1h),4.18
–
4.04(m,1h),3.95(s,2h),3.31
–
3.16(m,1h),2.82(s,2h),1.80
–
1.62(m,4h),1.44
–
1.27(m,2h),1.23(s,6h).ms 448.2(m 1).
[0324]
实施例55
[0325]
1-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)-3-((1r,4r)-4-((1-甲氧基丙烷-2-基)氨基)环己基)脲(化合物55)的制备
3-((1r,4r)-4-((2-(甲氧基-d3)乙基)氨基)环己基)脲(化合物58)的制备
[0338][0339]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用1-溴-2-(甲氧基-d3)乙烷代替1-溴-2-甲氧基乙烷外,合成方法与实施例17相同。1h nmr(400mhz,dmso-d6)δ9.18(s,1h),8.44(s,1h),8.16(s,1h),7.93(s,1h),6.54(d,j=11.9hz,1h),3.93(s,2h),3.75
–
3.64(m,1h),3.51(t,j=5.4hz,2h),3.32
–
3.15(m,1h),2.76(dt,j=6.4,5.5hz,2h),2.49
–
2.42(m,1h),2.41(s,2h),1.86
–
1.64(m,4h),1.54
–
1.34(m,4h),1.30(s,6h).ms 464.3(m 1).
[0340]
实施例59
[0341]
1-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)-3-((1r,4r)-4-(乙氨基)环己基)脲(化合物59)的制备
[0342][0343]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用溴乙烷代替1-溴-2-甲氧基乙烷外,合成方法与实施例17相同。1h nmr(400mhz,氯仿-d)δ8.84(s,1h),8.70(s,1h),8.12(s,1h),7.99(s,1h),7.16(s,1h),3.93(s,2h),3.81
–
3.65(m,1h),3.01
–
2.81(m,5h),2.26
–
2.11(m,4h),1.65
–
1.43(m,4h),1.36(t,j=7.2hz,3h),1.32(s,6h).ms 431.2(m 1).
[0344]
实施例60
[0345]
1-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)-3-((1r,4r)-4-(异丙基氨基)环己基)脲(化合物60)的制备
[0346][0347]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用2-溴丙烷代替1-溴-2-甲氧基乙烷外,合成方法与实施例17相同。1h nmr(400mhz,dmso-d6)δ9.15(s,1h),8.46(s,1h),8.13(s,1h),7.91(s,1h),6.54(s,1h),3.94(s,2h),3.24
–
3.08(m,1h),2.87(s,2h),2.80(m,1h),2.41
–
2.34(m,1h),1.83
–
1.67(m,5h),1.54
–
1.42(m,4h),1.32(d,j=4.9hz,6h),1.25(s,6h).ms 445.2(m 1).
[0348]
实施例61
[0349]
1-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)-3-((1r,4r)-4-((2-氟代乙基)氨基)环己基)脲(化合物61)的制备
[0350][0351]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用1-溴-2-氟乙烷代替1-溴-2-甲氧基乙烷外,合成方法与实施例17相同。1h nmr(400mhz,dmso-d6)δ9.20(s,1h),8.44(s,1h),8.18(s,1h),7.90(s,1h),6.86(d,j=11.9hz,1h),4.68
–
4.46(m,2h),3.97(s,2h),3.30
–
3.19(m,1h),2.84(s,2h),2.82
–
2.64(m,2h),2.50
–
2.42(m,1h),1.81
–
1.62(m,5h),1.52
–
1.34(m,4h),1.20(s,6h).ms 449.2(m 1).
[0352]
实施例62
[0353]
1-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)-3-((1r,4r)-4-((2-羟乙基)氨基)环己基)脲(化合物62)的制备
[0354][0355]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用2-溴乙醇代替1-溴-2-甲氧基乙烷外,合成方法与实施例17相同。1h nmr(400mhz,dmso-d6)δ9.18(s,1h),8.46(s,1h),8.16(s,1h),7.87(s,1h),6.56(br s,1h),4.80(t,j=6.4hz,1h),3.95(s,2h),3.90(td,j=7.5,6.3hz,2h),3.76
–
3.64(m,1h),3.32(br s,1h),2.86(s,2h),2.83
–
2.72(m,2h),2.49
–
2.42(m,1h),1.80
–
1.62(m,4h),1.55
–
1.33(m,4h),1.22(s,6h).ms 447.1(m 1).
[0356]
实施例63
[0357]
1-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)-3-((1r,4r)-4-((氧杂丁烷-3-基氨基)环己基)脲(化合物63)的制备
[0358][0359]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用3-溴氧杂环丁烷代替1-溴-2-甲氧基乙烷外,合成方法与实施例17相同。1h nmr(400mhz,dmso-d6)δ9.23(s,1h),8.47(s,1h),8.16(s,1h),7.90(s,1h),6.59(br s,1h),5.02
–
4.71(m,4h),3.96(s,2h),3.91
–
3.80(m,1h),3.74
–
3.65(m,1h),3.30
–
3.16(m,1h),2.89(s,2h),2.40
–
2.33(m,1h),1.81
–
1.60(m,4h),1.54
–
1.32(m,4h),1.24(s,6h).ms 459.2(m 1).
[0360]
实施例64
[0361]
叔丁基-((1s,4s)-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶2-基)脲基)环己基)氨基甲酸酯(化合物64)的制备
[0362][0363]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用n-boc-顺式-1,4-环己二胺代替n-boc-反式-1,4-环己二胺外,合成方法与实施例15-m相同。1h nmr(400mhz,氯仿-d)δ9.34(s,1h),8.76(s,1h),8.18(s,1h),8.02(s,1h),6.81(s,1h),4.55(d,j=7.7hz,1h),4.02(s,1h),3.97(s,2h),3.58(s,1h),2.91(s,2h),1.82-1.67(m,6h),1.62
–
1.49(m,2h),1.46(s,9h),1.34(s,6h).ms 503.3(m 1).
[0364]
实施例65
[0365]
1-((1s,4s)-4-氨基环己基)-3-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)脲(化合物65)的制备
[0366][0367]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用n-boc-顺式-1,4-环己二胺代替n-boc-反式-1,4-环己二胺外,合成方法与实施例15相同。1h nmr(400mhz,氯仿-d)δ9.44(s,1h),9.38(s,1h),8.18(s,1h),8.02(s,1h),6.94(s,1h),4.12
–
4.01(m,1h),3.95(s,2h),2.91(s,2h),2.86
–
2.75(m,1h),1.96
–
1.51(m,8h),1.33(s,6h).ms 403.1(m 1).
[0368]
实施例66
[0369]
1-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)-3-((1s,4s)-4-((2-甲氧乙基)氨基)环己基)脲(化合物66)的制备
[0370][0371]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用n-boc-顺式-1,4-环己二胺代替n-boc-反式-1,4-环己二胺外,合成方法与实施例17相同。1h nmr(400mhz,氯仿-d)δ9.24(s,1h),9.15(s,1h),8.18(s,1h),8.01(s,1h),6.99(s,1h),4.05(s,1h),3.95(s,2h),3.56(t,j=5.1hz,2h),3.36(s,3h),2.92(s,2h),2.90
–
2.85(m,2h),2.66(s,1h),2.54(s,1h),1.86
–
1.70(m,4h),1.68
–
1.42(m,4h),1.33(s,6h).ms 461.2(m 1).
[0372]
实施例67
[0373]
n-((1s,4s)-4-(3-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)脲基)环己基)乙酰胺(化合物67)的制备
[0374][0375]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用n-boc-顺式-1,4-环己二胺代替n-boc-反式-1,4-环己二胺外,合成方法与实施例16相同。1h nmr(400mhz,氯仿-d)δ9.75(s,1h),9.50(s,1h),8.17(s,1h),8.05(s,1h),6.91(s,1h),5.54(d,j=7.9hz,1h),4.07(s,1h),3.96(s,2h),3.92
–
3.81(m,1h),2.92(s,2h),2.00(s,3h),1.90
–
1.83(m,4h),1.78
–
1.69(m,2h),1.54
–
1.37(m,2h),1.33(s,6h).ms 445.2(m 1).
[0376]
实施例68
[0377]
1-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)-3-(哌啶-4-基)脲(化合物68)的制备
[0378][0379]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用n-boc-哌啶-4-胺代替n-boc-反式-1,4-环己二胺外,合成方法与实施例15相同。1h nmr(400mhz,dmso-d6)δ9.14(s,1h),8.50(s,1h),8.24(s,1h),7.97(s,1h),7.73(d,j=11.1hz,2h),3.94(s,2h),3.84
–
3.76(m,1h),3.22(d,j=12.6hz,2h),2.97(t,j=11.9hz,2h),2.87(s,2h),2.10
–
1.92(m,2h),1.58
–
1.46(m,2h),1.26(s,6h).ms 389.2(m 1).
[0380]
实施例69
[0381]
1-(氮杂庚烷-4-基)-3-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)脲(化合物69)的制备
[0382][0383]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用n-boc-氮杂庚烷-4-胺代替n-boc-反式-1,4-环己二胺外,合成方法与实施例15相同。1h nmr(400mhz,dmso-d6)δ9.18(s,1h),8.46(s,1h),8.16(s,1h),7.94(s,1h),6.54(d,j=10.8hz,1h),3.93(s,2h),3.47
–
3.35(m,1h),3.34
–
3.11(m,4h),2.89(s,2h),276
–
2.68(m,1h),1.93
–
1.32(m,6h),1.26(s,6h).ms 403.1(m 1).
[0384]
实施例70
[0385]
1-(4-氨基环庚基)-3-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)脲(化合物70)的制备
[0386][0387]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用n-boc-1,4-环庚二胺代替n-boc-反式-1,4-环己二胺外,合成方法与实施例15相同。1h nmr(400mhz,dmso-d6)δ9.23(s,1h),8.46(s,1h),8.14(s,1h),7.95(s,1h),6.54(d,j=11.0hz,1h),3.95(s,2h),3.47
–
3.34(m,1h),2.87(s,2h),2.50
–
2.42(m,1h),1.87
–
1.68(m,2h),1.62
–
1.56(m,4h),1.41
–
1.26(m,6h),1.20(s,6h).ms 417.2(m 1).
[0388]
实施例71
[0389]
叔丁基-(3-(3-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)脲基)丙基)氨基甲酸酯(化合物71)的制备
[0390][0391]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用n-boc-1,3-丙二胺代替n-boc-反式-1,4-环己二胺外,合成方法与化合物15m相同。1h nmr(400mhz,氯仿-d)δ9.04(s,1h),8.35(s,1h),8.18(s,1h),8.00(s,1h),6.82(s,1h),5.08(s,1h),3.96(s,2h),3.45(q,j=6.2hz,2h),3.26
–
3.14(m,2h),2.91(s,2h),1.78
–
1.62(m,2h),1.41(s,9h),1.34(s,6h).ms463.2(m 1).
[0392]
实施例72
[0393]
1-(3-氨基丙基)-3-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)脲(化合物72)的制备
[0394][0395]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用n-boc-1,3-丙二胺代替n-boc-反式-1,4-环己二胺外,合成方法与化合物15相同。1h nmr(400mhz,甲醇-d4)δ8.23(s,1h),7.99(s,1h),7.27(s,1h),3.97(s,2h),3.42(t,j=6.6hz,3h),3.06
–
2.86(m,4h),1.90(p,j=6.9hz,2h),1.34(s,6h).ms 363.1(m 1).
[0396]
实施例73
[0397]
1-((1s,3s)-3-氨基环戊基)-3-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)脲(化合物73)的制备
[0398][0399]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用(1s,3s)-3-氨基环戊基氨基甲酸叔丁酯代替n-boc-反式-1,4-环己二胺外,合成方法与化合物15相同。1h nmr(400mhz,甲醇-d4)δ8.21(s,1h),8.00(s,1h),7.35(s,1h),4.31(p,j=6.3hz,1h),3.97(s,2h),3.68(p,j=6.7hz,1h),2.95(s,2h),2.29
–
2.16(m,2h),2.10
–
1.92(m,3h),1.67
–
1.48(m,2h),1.34(s,6h).ms 389.1(m 1).
[0400]
实施例74
[0401]
n-((1s,3s)-3-(3-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)脲基)环戊基)乙酰胺(化合物74)的制备
[0402][0403]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用(1s,3s)-3-氨基环戊基氨基甲酸叔丁酯代替n-boc-反式-1,4-环己二胺外,合成方法与化合物16相同。1h nmr(400mhz,氯仿-d)δ9.02(s,1h),8.71(s,1h),8.16(s,1h),7.95(s,1h),7.07(s,1h),6.08(d,j=7.4hz,1h),4.48
–
4.31(m,2h),3.95(s,2h),2.89(s,2h),2.30
–
2.17(m,2h),2.10
–
1.99(m,1h),1.97(s,3h),1.93
–
1.84(m,1h),1.66
–
1.52(m,1h),1.51
–
1.40(m,1h),1.32(s,6h).ms431.1(m 1).
[0404]
实施例75
[0405]
n-((1r,3r)-3-(3-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)脲基)环丁基)乙酰胺(化合物75)的制备
[0406][0407]
除用 5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用n-boc-反式-1,3-环丁二胺代替n-boc-反式-1,4-环己二胺外,合成方法与化合物16相同。1h nmr(400mhz,dmso-d6)δ9.31(s,1h),8.46(s,1h),8.16(s,1h),7.95(s,1h),6.58
–
6.47(m,1h),5.53
–
5.46(m,1h),4.35
–
4.23(m,2h),3.95(s,2h),2.86(s,2h),2.57
–
2.47(m,2h),2.34
–
2.20(m,2h),1.99(s,3h),1.27(s,6h).ms 417.1(m 1).
[0408]
实施例76
2-基)脲基)环己基)乙酰胺(化合物79)的制备
[0422][0423]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用n-boc-1,3-环己二胺代替n-boc-反式-1,4-环己二胺外,合成方法与化合物16相同。1h nmr(400mhz,氯仿-d)δ8.98(s,1h),8.36(s,1h),8.13(s,1h),7.99(s,1h),7.08(s,1h),5.90(s,1h),3.95(s,2h),3.91
–
3.70(m,2h),2.89(s,2h),2.33(d,j=11.5hz,1h),2.06(d,j=15.3hz,1h),1.87
–
1.76(m,4h),1.58
–
1.40(m,2h),1.33(s,6h).ms 445.2(m 1).
[0424]
实施例80
[0425]
1-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)-3-(3-((2-甲氧基乙基)氨基)环己基)脲(化合物80)的制备
[0426][0427]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用n-boc-1,3-环己二胺代替n-boc-反式-1,4-环己二胺外,合成方法与化合物17相同。1h nmr(400mhz,dmso-d6)δ9.24(s,1h),8.44(s,1h),8.16(s,1h),7.94(s,1h),6.54(d,j=10.3hz,1h),3.94(s,2h),3.75
–
3.66(m,2h),3.51
–
3.36(m,2h),3.27(s,3h),2.88(s,2h),2.84
–
2.76(m,2h),2.49
–
2.42(m,1h),1.94
–
1.46(m,6h),1.42
–
1.31(m,2h),1.22(s,6h).ms 461.2(m 1).
[0428]
实施例81
[0429]
n-((1r,4r)-4-(3-(5-氯-4-(4’h,6’h-螺[环丙烷-1,5
’‑
吡咯并[1,2-b]吡唑]-3
’‑
基)吡啶-2-基)脲基)环己基)乙酰胺(化合物81)的制备
[0430][0431]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用4’,6
’‑
二氢螺[环丙烷-1,5
’‑
吡咯并[1,2-b]吡唑]-3
’‑
硼酸频哪醇酯代替化合物15-i外,合成方法与化合物16相同。1h nmr(400mhz,dmso-d6)δ9.23(s,1h),8.46(s,1h),8.17(s,1h),7.92(s,1h),6.94(s,1h),5.64(br s,1h),4.19
–
4.01(m,1h),3.97(s,2h),3.31
–
3.16(m,1h),2.84(s,2h),2.03(s,3h),1.85
–
1.56(m,4h),1.46
–
1.26(m,4h),0.44
–
0.12(m,4h).ms 443.1(m 1).
[0432]
实施例82
[0433]
n-((1r,4r)-4-(3-(5-氯-4-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-3-基)吡啶-2-基)脲基)环己基)乙酰胺(化合物82)的制备
[0434][0435]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-3-硼酸频哪醇酯代替化合物15-i外,合成方法与实施例16相同。1h nmr(400mhz,dmso-d6)δ9.20(s,1h),8.45(s,1h),8.14(s,1h),8.12(s,1h),6.84(s,1h),5.69(s,1h),4.63(s,2h),4.19
–
4.00(m,1h),3.93
–
3.78(m,4h),3.34
–
3.11(m,1h),1.98(s,3h),1.82
–
1.61(m,4h),1.36
–
1.16(m,4h).ms 433.2(m 1).
[0436]
实施例83
[0437]
n-((1r,4r)-4-(3-(5-氯-4-(6,7-二氢-4h-吡唑并[5,1-c][1,4]噁嗪-3-基)吡啶-2-基)脲基)环己基)乙酰胺(化合物83)的制备
[0438][0439]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用5-甲基-4,5,6,7-四氢吡唑并[1,5-a]吡嗪-3-硼酸频哪醇酯代替化合物15-i外,合成方法与实施例16相同。1h nmr(400mhz,dmso-d6)δ9.21(s,1h),8.44(s,1h),8.13(s,1h),8.10(s,1h),6.54(d,j=11.7hz,1h),5.47(d,j=11.2hz,1h),4.20
–
4.04(m,1h),4.02
–
3.91(m,2h),3.80(s,2h),3.34
–
3.15(m,1h),3.08
–
2.96(m,2h),2.45(s,3h),1.98(s,3h),1.84
–
1.62(m,4h),1.47
–
1.24(m,4h).ms 446.2(m 1).
[0440]
实施例84
[0441]
n-((1r,4r)-4-(3-(5-氯-4-(5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)脲基)环己基)乙酰胺(化合物84)的制备
[0442][0443]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺以及用溴丙酸乙酯代替化合物15-b外,合成方法与实施例16相同。1h nmr(400mhz,dmso-d6)δ9.17(s,1h),8.46(s,1h),8.16(s,2h),6.57(s,1h),5.49(s,1h),4.21
–
4.02(m,1h),3.71(t,j=7.0hz,2h),3.36
–
3.16(m,1h),2.95
–
2.81(t,j=7.1hz,2h),2.68
–
2.50(m,2h),1.99(s,3h),1.80
–
1.63(m,4h),1.57
–
1.40(m,4h).ms 417.1(m 1).
[0444]
实施例85
[0445]
n-((1r,4r)-4-(3-(5-氯-4-(1-异丙基-2-甲基-1h-咪唑-5-基)吡啶-2-基)脲基)环己基)乙酰胺(化合物85)的制备
[0446][0447]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺以及用1-异丙基-2-甲基-1h-咪唑-5-硼酸频哪醇酯代替化合物15-i外,合成方法与实施例16相同。1h nmr(400mhz,dmso-d6)δ9.16(s,1h),8.46(s,1h),8.15(s,1h),6.94(br s,1h),6.75(s,1h),5.52(s,1h),4.85(hept,j=4.2hz,1h),4.20
–
3.98(m,1h),3.34
–
3.13(m,1h),2.52(s,3h),1.99(s,3h),1.80
–
1.66(m,4h),1.57(d,j=4.4hz,6h),1.53
–
1.37(m,4h).ms 433.2(m 1).
[0448]
实施例86
[0449]
n-((1r,4r)-4-(3-(5-氯-4-(6,6-二甲基-6,7-二氢-5h-吡咯[1,2-a]咪唑-3-基)吡啶-2-基)脲基)环己基)乙酰胺(化合物86)的制备
[0450][0451]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用6,6-二甲基-6,7-二氢-5h-吡咯[1,2-a]咪唑-3-硼酸频哪醇酯代替化合物15-i外,合成方法与实施例16相同。1h nmr(400mhz,dmso-d6)δ9.21(s,1h),8.46(s,1h),8.16(s,1h),6.65(s,1h),6.56(br s,1h),5.49(br s,1h),4.20
–
4.04(m,1h),3.96(s,2h),3.37
–
3.12(m,1h),2.87(s,2h),1.99(s,3h),1.80
–
1.67(m,4h),1.55
–
1.42(m,4h),1.30(s,6h).ms 445.1(m 1).
[0452]
实施例87
[0453]
n-((1r,4r)-4-(3-(5-氯-4-(4-环丙基-1h-咪唑-1-基)吡啶-2-基)脲基)环己基)乙酰胺(化合物87)的制备
[0454][0455]
步骤1:向圆底三颈瓶中加入三光气(973mg,3.28mmol)和无水dcm(50ml),冰浴下
滴加化合物87-a(2.0g,9.64mmol)的dcm溶液(30ml),随后滴加无水et3n(5.36ml,28.90mmol),继续搅拌2小时后停止反应。减压蒸干溶剂后即得棕色固体,无需进一步纯化,直接用于下一步反应。向圆底烧瓶中加入上述所得中间体、87-b(2.07g,9.64mmol)、et3n(4.02ml,28.92mmol)及无水甲苯(80ml),加热回流反应过夜。反应结束后,冷却至室温,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并用饱和nacl水溶液洗涤3次,经无水na2so4干燥后,减压蒸干溶剂,柱层析纯化得浅黄色固体87-c(2.7g,产率62.55%)。1h nmr(400mhz,dmso-d6)δ9.22(s,1h),8.34(s,1h),8.09(s,1h),7.08(d,j=7.6hz,1h),6.74(d,j=8.0hz,1h),3.37(d,j=3.8hz,1h),3.23
–
3.09(m,1h),1.93
–
1.70(m,4h),1.37(s,9h),1.28
–
1.13(m,4h).ms 447.1(m 1).
[0456]
步骤2:向圆底烧瓶中加入中间体87-c(400mg,0.893mmol)、4-环丙基-1h-咪唑(126mg,1.16mmol)、cs2co3(437mg,1.34mmol)、cuo(7mg,0.089mmol)、4,7-二甲氧基-1,10-菲咯啉(43mg,0.179mmol)、peg-3350(200mg)和丁氰(10ml),120℃反应16小时。反应结束后,冷却至室温,将反应液倒入水中,乙酸乙酯萃取,水相重复用乙酸乙酯萃取2-3次,合并有机相并用饱和nacl水溶液洗涤3次,经无水na2so4干燥后,减压蒸干溶剂,柱层析纯化得黄色固体87-e(110mg,产率25.92%)。1h nmr(400mhz,dmso-d6)δ9.20(s,1h),8.26(s,1h),8.11(s,1h),7.80(s,1h),7.16(d,j=1.9hz,1h),6.59(br s,1h),5.45
–
5.32(m,1h),4.23
–
4.04(m,1h),3.30
–
3.11(m,1h),2.35
–
2.20(m,1h),1.89
–
1.78(m,2h),1.69
–
1.49(m,2h),1.46(s,9h),1.34
–
1.11(m,6h),1.09
–
0.95(m,2h).ms 475.2(m 1).
[0457]
步骤3-4:向圆底烧瓶中加入中间体87-e(100mg,0.21mmol)和dcm(5ml),滴加4.0m盐酸二氧六环溶液(0.5ml),室温反应过夜。反应结束后,减压蒸干溶剂得黄色固体。向圆底烧瓶中加入dcm(5ml)和et3n(146ml,1.05mmol)使上述中间体重新溶解,冰浴下滴加乙酸酐(18μl,0.32mmol),室温反应2小时。反应结束后,减压蒸干溶剂,柱层析分离纯化得化合物87(45mg,两步产率:51.27%)。1h nmr(400mhz,dmso-d6)δ9.23(s,1h),8.27(s,1h),8.10(s,1h),7.80(s,1h),7.16(d,j=2.1hz,1h),6.54(s,1h),5.49(s,1h),4.21
–
4.02(m,1h),3.32
–
3.14(m,1h),2.19
–
2.10(m,1h),1.99(s,3h),1.78
–
1.68(m,2h),1.54
–
1.41(m,2h),1.34
–
1.11(m,6h),1.09
–
0.95(m,2h).ms 417.2(m 1).
[0458]
实施例88
[0459]
1-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)-3-((1r,4r)-4-(甲胺基)环己基)脲(化合物88)的制备
[0460][0461]
向圆底烧瓶中加入化合物88-a(60mg,0.12mmol)和无水thf(5ml),冰浴下加入lialh4(14mg,0.26mmol),室温搅拌10分钟后,升温至75℃反应4小时。反应结束后,冷却至室温,冰浴滴加酒石酸钾钠水溶液,室温剧烈搅拌10分钟,有大量白色固体产生,减压过滤,滤饼用乙酸乙酯洗涤。收集滤液并减压蒸干溶剂,柱层析分离纯化得浅黄色固体88(20mg,产率40.22%)。1h nmr(400mhz,氯仿-d)δ8.56(br s,1h),8.14(s,1h),7.99(s,1h),7.07
(br s,1h),5.46
–
5.38(m,1h),3.94(s,2h),3.82
–
3.67(m,1h),2.93(s,2h),2.87
–
2.77(m,2h),2.64(s,3h),2.24
–
2.19(m,2h),1.76
–
1.68(m,2h),1.48
–
1.38(m,4h),1.32(s,6h).ms 417.2(m 1).
[0462]
实施例89
[0463]
1-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)-3-((1r,4r)-4-(二甲胺基)环己基)脲(化合物89)的制备
[0464][0465]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用n,n-二甲基反式-1,4-环己二胺代替n-boc-反式-1,4-环己二胺外,合成方法与实施例15相同。1h nmr(400mhz,氯仿-d)δ8.79(s,1h),8.47(s,1h),8.16(s,1h),7.93(s,1h),7.02(br s,1h),3.95(s,2h),3.72
–
3.64(m,1h),3.25
–
3.19(m,1h),2.91(s,2h),2.52(s,6h),2.24
–
2.01(m,4h),1.60
–
1.45(m,4h),1.32(s,6h).ms 431.2(m 1).
[0466]
实施例90-91
[0467]
1-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)-3-((1r,4r)-4-((2-甲氧基乙基)(甲基)氨基)环己基)脲(化合物90)和(1r,4r)-4-(3-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)脲基)-n-(2-甲氧基乙基)-n,n-二甲基环己基-1-季铵盐(化合物91)的制备
[0468][0469]
向双颈圆底烧瓶中加入化合物46(100mg,0.217mmol)、dipea(90μl,0.542mmol)和无水thf(5ml),冰浴下滴加碘甲烷(14μl,0.217mmol),继续搅拌2小时。继续滴加碘甲烷(14μl,0.217mmol),升温至室温反应2小时。加入naoh水溶液(0.2ml)淬灭反应,减压蒸干溶剂后柱层析分离纯化得浅黄色固体90(18mg,产率17.47%)和黄色固体91(8mg,产率7.53%)。化合物90:1h nmr(400mhz,氯仿-d)δ8.75(br s,1h),8.48(s,1h),8.14(s,1h),7.93(s,1h),6.98(s,1h),3.94(s,2h),3.80
–
3.75(m,2h),3.72
–
3.64(m,1h),3.38(s,3h),3.22
–
3.15(m,1h),3.10(t,j=5.4hz,2h),2.90(s,2h),2.65(s,3h),2.26
–
2.12(m,4h),1.59
–
1.51(m,4h),1.32(s,6h).ms 475.2(m 1).化合物91:1h nmr(400mhz,氯仿-d)δ8.97(br s,1h),8.14(s,1h),7.96(s,1h),7.23(br s,1h),4.13
–
4.01(m,1h),3.92(s,2h),3.90
–
3.85(m,2h),3.84
–
3.77(m,2h),3.39(s,3h),3.30(s,6h),2.91(s,2h),2.42
–
2.21(m,4h),1.86
–
1.77(m,2h),1.66
–
1.54(m,2h),1.30(s,6h).ms 490.3(m 1).
[0470]
实施例92
[0471]
1-(5-氯-4-(5,5-二甲基-5,6-二氢-4h-吡咯并[1,2-b]吡唑-3-基)吡啶-2-基)-3-((1r,4r)-4-吗啡啉基环己基)脲(化合物92)的制备
[0472][0473]
除用5-氯-4-溴吡啶-2-胺代替4-溴吡啶-2-胺和用(1r,4r)-4-吗啡啉基环己基-1-胺代替n-boc-反式-1,4-环己二胺外,合成方法与实施例15相同。1h nmr(400mhz,dmso-d6)δ9.20(s,1h),8.46(s,1h),8.16(s,2h),6.59(br s,1h),3.95(s,2h),3.60
–
3.52(m,4h),3.32
–
3.15(m,1h),2.88(s,2h),2.64
–
2.51(m,1h),2.49
–
2.41(m,4h),2.30
–
2.11(m,2h),1.97
–
1.83(m,4h),1.59
–
1.45(m,2h),1.30(s,6h).ms 473.2(m 1).
[0474]
(二)、生物活性检测实施例
[0475]
实验例一:分子水平cdk酶活抑制活性评价实验
[0476]
实验方法:重组人cdk9/cyclin t1(carna bioscience,cat#04-110)用稀释缓冲液(20mm tris hcl(ph 7.5),0.02%triton x-100,0.01%bsa,2mm dtt,0.5mm na3vo4,10%glycerol)稀释到2.5ng/μl,底物cdk7/9tide(thermofisher,cat#pv5090)和atp(sigmaaldrich,cat#a1852)用测试缓冲液(25mm tris hcl(ph7.5),10mm mgcl2,0.5mm egta(ph 8),0.5mm na3vo4,5mmb-glycerol phosphate,0.1%triton x-100,2.5mm dtt)稀释到终浓度分别为100μm和10μm,分装后备用。向384孔板中加入2μl稀释的重组人cdk9/cyclin t1,1μl受试化合物,2μl含有atp的稀释的底物cdk7/9tide,37℃孵育120min后加入5μl adp-glo(promega adp-glo kinase assay kit,cat#v9102),室温孵育45min后加入10μl激酶检测试剂(promega adp-glo kinase assay kit,cat#v9102),在室温下孵育30min后用biotek酶标仪测定发光。阳性对照为酶和底物共孵育的孔,阴性对照为稀释缓冲液和底物共孵育的孔,抑制率按以下公式计算。
[0477][0478]
cdk1,4,6,7酶(cdk1/cyclin b,cdk4/cyclin d1,cdk6/cyclin d1,cdk7/cyclin h)活性测定,同样采用5μl酶体系(50mm hepes、10mm mgcl2、1mm egta、2mm dtt and 0.01%tween 20、适当酶),2.5μl化合物,2.5μl的底物和atp的混合液(底物终浓度50nm,atp终浓度200μm),室温避光孵育60min。随后每孔加入5μl 1xdetection buffer稀释的edta终止液(终浓度6mm),然后加入1xdetection buffer稀释的抗体(终浓度2nm)室温避光孵育1h,测定后计算相应酶活性抑制率或ic
50
。
[0479]
实验结果:本发明制备实施例制备的化合物、以及阳性对照化合物azd4573和阳性对照化合物dinaciclib对cdk9酶活抑制活性见表1。
[0480]
表1.化合物对cdk9酶活的抑制效果
[0481]
[0482][0483]
[0484]
注:化合物对激酶底物磷酸化抑制率/ic
50
值独立重复两次,以平均值表示。
[0485]
实验结论:由表1可知,在生物活性评价中,本发明的2-芳杂环取代脲类化合物对cdk9均具有较高的抑制活性,在较低浓度100nm下对cdk9酶活抑制率均大于50%,其中有39个化合物对cdk9均有强效的抑制活性(酶活抑制率》50%@10nm),体现出该类化合物具有很好的cdk9抑制活性优势。
[0486]
化合物2、化合物3、化合物46、化合物47和化合物67对cdk9、cdk1、cdk4、cdk6和cdk7酶活抑制活性如表2所示。结果显示2-芳杂环取代脲类化合物具有cdk9亚型选择性高的优点。
[0487]
表2.化合物不同亚型cdk的抑制活性
[0488][0489]
实验例二:代表性化合物对cdk9表达阳性的肿瘤细胞生长抑制实验
[0490]
实验方法:状态良好的wsu-dlcl2细胞以两万/孔种于96孔板中。受试化合物用pbs梯度稀释之后加入到孔中,与细胞共孵育72h后向每孔中加入10μl cck-8试剂,再继续孵育后在460nm下测定吸光度,利用softmax pro软件的4参数拟合曲线计算出受试化合物的增殖抑制ic
50
。
[0491]
表3.化合物47和azd4573体外对肿瘤细胞增殖抑制活性
[0492][0493]
表3结果显示本发明代表性化合物47对多种肿瘤细胞体外生长具有强效的抑制活性,ic
50
值可达低纳摩尔甚至皮摩尔水平,并优于目前处于临床二期阳性化合物azd4573。特别对pfeiffer及422细胞的生长抑制ic
50
值达到皮摩尔级别,分别优于阳性化合物46.67及20.33倍,充分体现了本发明的2-芳杂环取代脲化合物具有显著的体外抗肿瘤活性的优势。
[0494]
实验例三:优选化合物47对肿瘤细胞中cdk9信号通路活化的影响
[0495]
免疫印迹杂交(western blot)检测化合物对wsu-dlcl2细胞中cdk9信号通路活化的影响。
[0496]
实验方法:适量wsu-dlcl2细胞种板于6孔板,受试化合物作用24小时后离心收集细胞,加入相应量的1x上样缓冲液(50mm tris-hcl(ph6.8),2%sds,0.1%溴酚蓝,10%甘油),裂解后100℃煮样。吸取相同体积的样品,sds-page电泳结束后,将凝胶上的蛋白质转移到硝酸纤维素膜上,根据蛋白的大小剪下相应的条带,用含有5%脱脂奶粉的tbst(20mm tris-hcl,150mm nacl,0.1%tween20,调ph至7.4)封闭1h,4℃孵育一抗过夜。用tbst洗脱
多余一抗,每次十分钟共三次,在室温下孵育二抗1h,再用tbst洗脱多余二抗,每次十分钟共三次。最后利用bio-rad发色仪对条带进行发色和拍照。
[0497]
实验结果如图1所示,优选化合物47在作用24小时后浓度依赖地抑制pol ii s2位的磷酸化,表明其在细胞水平同样能对cdk9活性显著抑制,该化合物50nm作用后与对照组相比pol ii s2位磷酸化即有显著下调,100nm浓度时该位点磷酸化基本完全被抑制。此外,我们也可以看到相应的受cdk9转录调控的下游蛋白mcl-1其表达也同样浓度依赖地被抑制,在化合物50nm浓度作用下,mcl-1有显著下降,当化合物作用浓度提高至100nm,mcl-1表达几乎被完全阻碍。
[0498]
实验例四:初步的体内代谢结果
[0499]
化合物46、化合物47和阳性化合物azd4573分别静脉(i.v.)和口服(p.o.)给药小鼠后,于不同时间点采集血样,lc-ms/ms测定给予受试物后小鼠血浆中化合物的浓度并计算相关药代参数,考察化合物在小鼠体内的口服生物利用度情况及药代属性,结果见表4。
[0500]
表4化合物46、47和azd4573小鼠体内的pk参数
[0501][0502]
由表4可知,化合物46和47的血浆暴露量及口服生物利用度比阳性化合物azd4573更优,且血浆清除率更低,具有更优的成药性。
[0503]
进一步地,化合物47与阳性化合物azd4573在小鼠血浆中的代谢产物鉴定结果(如以下化学反应式和表5
–
6所示)表明了化合物47与阳性化合物相比,具有更高的血浆稳定性,体内清除率更低,成药性更优。
[0504][0505]
化合物47在小鼠血浆中的代谢途径
[0506]
表5.化合物47在小鼠血浆中的代谢产物
[0507][0508][0509]
注:glu:葡萄糖醛酸化。
[0510]
化合物azd4573在小鼠血浆中的代谢途径
[0511]
表6.化合物azd4573在小鼠血浆中的代谢产物
[0512][0513]
综上可知,本发明实施例的含2-芳杂环取代脲的化合物具有对cdk9抑制活性优,同时具有cdks亚型选择性高的优点,成药性更佳,有望能解决目前临床cdk抑制剂因选择性差而引起的脱靶毒性问题和成药性问题。本发明的代表性化合物(实施例47)对多种cdk9表达阳性的恶性肿瘤细胞的体外增殖具有非常强的抑制效果,ic
50
值可达低纳摩尔甚至皮摩尔级别,显著优于临床在研的化合物azd4573,体现了2-芳杂环取代脲类化合物具有很好的抗肿瘤活性优势。此外,初步的药代数据表明了本发明的代表性化合物(实施例47)具有比阳性化合物azd4573更优的成药性,如具有更高的血浆稳定性,更高的血浆暴露量和更低的清除率。
[0514]
以上结合附图详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这种简单变型均属于本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。