1.本发明涉及有机中间体合成领域,具体而言,涉及一种合成亚烷基二元酸单酯的方法。
背景技术:
2.长链脂肪二元酸及其衍生物是精细化工中的重要中间体,常用于合成药物、高级香料、航空润滑油、高性能尼龙工程塑料等材料,同时也被用作药物和杀虫剂的重要材料(j. chem. research-s. 2000, 282-283)。
3.当前在医药领域中,长链脂肪二元酸单酯常被用于开发药代动力学表现更优良的药物,其中,长链亚烷基二元酸单叔丁酯是其中一种颇具代表性的药物合成中间体。例如,用于医药研发和合成的十六烷基二酸单叔丁酯,是合成德谷胰岛素的中间体,通过谷氨酸连接子引入十六碳脂肪二酸侧链后,使得胰岛素分子在血液循环种能与白蛋白可逆性结合,大大增加降低血糖的作用时效。同类的十八烷基二酸单叔丁酯,则是合成胰高血糖素样肽glp-1的类似物(索马鲁肽)所需的重要中间体(j. med. chem. 2015, 58 (18), 7370
−
7380)。
4.最近thomas等人,也在关于口服超长效胰岛素类似物的报道(j. med. chem. 2021, 64, 616
−
628)中提出,将由十八烷二元酸或二十碳二元酸制备的白蛋白结合侧链,连接到b29位置的赖氨酸上,可使药物获得超长药代动力学曲线,成为新型胰岛素替代药物(临床ii期)开发起到关键作用。在该项研究中,二十碳二酸单叔丁酯是重要的反应原料。
5.在有机合成中,羧酸的酯化是一类十分重要的反应,然而使用简单、温和条件选择性单酯化二羧酸的报道数量仍较为有限。中国专利申请201910081610.1报道了一种高选择性的方法制备脂肪二元酸的单叔丁酯,可使单叔丁酯的收率达70%,但该方法共需要四步合成,同时也需要以浓硫酸为催化剂,操作过程及后处理较为繁琐。专利ep 3199546a1报道了长链二元酸的单酯化,但主要缺点在于收率低,仅33%。
6.专利wo2016/077518中报道了十八烷二酸单酯化方法,用于十八烷二酸-1-(苯基甲基)酯,收率为49%。该反应是通过在甲苯中回流十八烷二酸至完全溶解,再加入n,n-二甲基甲酰胺二叔丁基缩醛过夜回流进行制备。
7.公开号为cn112939771a中国专利申请提供了一种合成方法,以长链亚烷基二酸为底物,先与草酰氯反应生成单酰氯,再用叔丁醇与酰氯基团发生反应,生成长链烷基二酸单叔丁酯。以制备十八烷基二酸单叔丁酯为例,粗品收率为70%,柱层析后产品纯度可达98.8%。该合成方法需使用具有高毒性和腐蚀性的草酰氯、浓硫酸作催化剂,需要使用thf、dcm、dmf等有机溶剂,同时涉及低温、加热、惰性气体保护等反应条件。
8.而酶催化转化这一工业生物技术有望实现工艺上的改善,用于开发简单、温和、高效的方法来合成单酯。在silvia等人的报道中,固定化水解酶被用于酯化乙二醇获得单酯及二酯(enzyme mrcrob. technol., 1997, vol. 20, 102-106)。在叔丁醇和二甲基亚砜混合溶剂(dmso/butoh =1:9 v/v)、60度条件下,固定化酶也被用于低聚果糖单酯的制备
(food chemistry. 2013, 138, 1884
–
1891)。
9.但这些研究中,均未涵盖长链脂肪二元酸。因较高的合成难度,亚烷基二酸单酯类中间体,市场价格普遍很高。因此,开发将长链烷基二元酸进行单酯化的合成方法及工艺,具有重要的研究及应用价值。
技术实现要素:
10.本发明的主要目的在于提供一种合成亚烷基二元酸单酯的方法,以解决现有技术中亚烷基二元酸单酯合成难度大、成本较高的问题。
11.为了实现上述目的,根据本发明的一个方面,提供了一种合成亚烷基二元酸单酯的方法,该方法具体为:在水解酶的作用下,使亚烷基二元羧酸与酯供体发生反应,得到亚烷基二元酸单酯;酯供体为饱和脂肪醇和/或相应的酯。
12.进一步地,亚烷基二元羧酸含有8个或者以上碳原子;优选的,亚烷基二元羧酸为单链亚烷基二元羧酸;更优选的,亚烷基二元羧酸含有12~25个碳原子。
13.进一步地,酯供体为碳原子数为2~6的饱和脂肪醇或者相应的酯,更优选的,酯供体为叔丁醇、甲酸叔丁酯和乙酸叔丁酯中的任意一种或者多种,更进一步优选酯供体为叔丁醇。
14.进一步地,水解酶包括cala,优选的, cala选自novocor adl和merck-62287中的任意一种或者多种;优选的,水解酶的重量为亚烷基二元羧酸重量的0.13~0.8倍。
15.进一步地,水解酶为固定化水解酶,优选的,固定化水解酶的载体选自lx109s环氧树脂、lx1000ha树脂、nka9大孔树脂中的任意一种或者多种;优选的,每克载体上水解酶的负载量为60mg~80mg。
16.进一步地,水解酶选自cala,载体选自lx109s环氧树脂。
17.进一步地,固定化水解酶的重量为亚烷基二元羧酸重量的2~10倍。
18.进一步地,酯供体的摩尔量为亚烷基二元羧酸摩尔量的10~370倍。
19.进一步地,反应在溶剂中进行,溶剂选自包括甲叔醚、正庚烷、叔丁醇、乙酸叔丁酯和环己烷中的任意一种或者多种,更进一步优选溶剂为叔丁醇。
20.优选的,溶剂的体积为亚烷基二元羧酸体积的20~100倍。
21.进一步地,反应的温度为20~60℃,优选为25~40℃;优选的,反应时间为20~100h。
22.应用本发明的技术方案,利用生物酶催化技术,采用酶将亚烷基二元羧酸类底物进行高选择性地转换,获得亚烷基二酸单酯,这种酶催化合成方法的工艺条件稳定,反应条件温和,合成过程操作简单、容易实施、污染较低,且反应选择性良好,能够避免产生不需要的二酯副产物,易于分离提纯。
具体实施方式
23.需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。下面将结合实施例来详细说明本发明。
24.如本技术背景技术所分析的,现有技术中存在亚烷基二元酸单酯合成难度大、成本较高的问题,为了解决该问题,本技术提供了一种合成亚烷基二元酸单酯的方法,即在水解酶的作用下,使亚烷基二元羧酸与酯供体发生反应,得到亚烷基二元酸单酯;其中酯供体
为饱和脂肪醇和/或相应的酯。
25.本技术利用生物酶催化技术,采用酶将亚烷基二元羧酸类底物进行高选择性地转换,获得亚烷基二酸单酯,这种酶催化合成方法的工艺条件稳定,反应条件温和,合成过程操作简单、容易实施、污染较低,且反应选择性良好,能够避免产生不需要的二酯副产物,易于分离提纯。
26.在一些典型的实施例中,上述亚烷基二元羧酸含有8个或者以上碳原子,考虑到亚烷基二元酸单酯的应用价值,优选上述亚烷基二元羧酸为单链亚烷基二元羧酸,制得的亚烷基二酸单酯可以广泛用于药物的合成开发;更优选的,所述亚烷基二元羧酸含有12~25个碳原子,即具有如下式(1)所示结构的二元酸,其中n为8~21的整数。
27.ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
式(1)上述酯供体可以从现有技术中选择,在本技术的一些实施例中,考虑到便于目标产物的后续应用,酯供体为碳原子数为2~6的饱和脂肪醇或者相应的酯,优选的,酯供体为碳原子数为2~6的饱和脂肪醇,考虑到目标产物的应用价值,更优选的,酯供体为叔丁醇、甲酸叔丁酯、乙酸叔丁酯、丙烯酸叔丁酯,异丁酸叔丁酯,二碳酸二叔丁酯,更进一步优选酯供体为叔丁醇,应用较为广泛,且具有较好的转化率。
28.上述水解酶可以从现有技术中进行选择,在本技术的一些优选的实施例中,水解酶选自cala,比如诺维信的novocor adl和默克公司的merck-62287。
29.在本技术的一些典型的实施例中,上述水解酶为固定化水解酶,在本技术的研究过程中发现,载体种类对酶催化该反应的转化率影响显著,优选的,固定化酶的载体选自lx109s环氧树脂、lx1000ha树脂、nka9大孔树脂中的任意一种或者多种,尤其是选择lx109s环氧树脂作为载体时,该反应目标产物的收率显著提升;优选的,每克载体上上述酶的负载量为60mg~80mg。
30.固定化水解酶的制备方法可以参考现有技术,在本技术的一些实施例中,上述固定化酶的载体为环氧基树脂,比如lx-109s环氧树脂,相应的固定化水解酶的制备方包括:步骤s1,将第一磷酸盐缓冲液与水解酶混合形成缓冲酶液;步骤s2,将缓冲酶液与环氧基树脂混合进行固定化反应后用第二磷酸盐缓冲液洗涤,得到固定化酶;其中缓冲液与环氧基树脂的体积比为4:1;第一磷酸盐缓冲液的ph为7.0~8.0,第一磷酸盐缓冲液中含有氯化钠,优选的,第一磷酸盐缓冲液中氯化钠的浓度为1mol/l;第二磷酸盐缓冲液的ph为7.0~8.0,第二磷酸盐缓冲液中不含氯化钠。
31.在本技术的一些典型的实施例中,采用固定化水解酶,水解酶选自cala,载体选自lx109s环氧树脂,目标产物的收率较高,尤其是酯供体为叔丁醇或者叔丁醇酯时,该固定化水解酶的效果提升尤为显著。
32.在本技术的一些实施例中,水解酶的重量为亚烷基二元羧酸重量的0.13~0.80倍,本领域的技术人员可以方便的算出固定化水解酶的添加量。在一些实施例中,上述固定化水解酶的重量为所述亚烷基二元羧酸重量的2~10倍。
33.上述酯供体与亚烷基二元羧酸的比例可参考反应的化学计量比,在本技术的一些实施例中,酯供体的摩尔量为亚烷基二元羧酸摩尔量的10~370倍,酯供体除了进行反应之
外,还可以作为溶剂,使酸和水解酶可以均匀的分散在反应体系中,保持良好接触,提高目标产物收率。
34.在本技术的一些实施例中,上述反应在溶剂中进行,即反应体系中含有酯供体以外的有机溶剂,该有机溶剂包括不限于甲叔醚、正庚烷、四氢呋喃、环己烷、甲苯、二氯甲烷、氯仿、二氧六环、二甲基四氢呋喃;其中,当溶剂选自甲叔醚、正庚烷、叔丁醇、乙酸叔丁酯和环己烷时,目标产物收率较高;优选的,溶剂的体积为亚烷基二羧酸体积的20~100倍。
35.在本技术的一些典型的实施例中,上述反应的温度为20~60℃。该反应中亚烷基二元酸单酯的收率会随着反应时间的增加逐渐提高,但一定时间之后,收率增长不再明显,优选的,反应时间为20~100h,目标产物收率较高,无明显副产物生成。
36.在本技术的一些典型的实施例中,将该反应置于摇床中进行,本领域的技术人员可以容易的根据现有技术选择适宜的反应装置,在此不多赘述。
37.上述催化反应体系由于反应的选择性高,副产物较少,对产物亚烷基二羧酸单酯的分离提纯,可以根据现有技术的常用手段进行,比如在弱碱性条件下水洗可移除未反应完的亚烷基二元羧酸。
38.下面将结合实施例和对比例进一步说明本技术可以实现的技术效果。
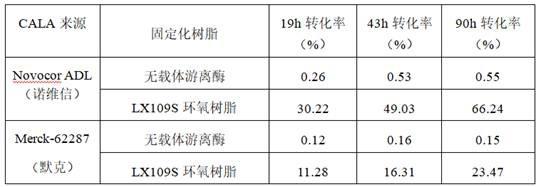
39.实施例1本实施例采用的酶为cala,分别为购自诺维信的novocor adl(novocor adl是源于南极洲念珠菌 (cala)的一种非特异性脂肪酶)和默克公司的merck-62287(62287是来源于米曲霉的南极假丝酵母脂肪酶a)。分别采用上述酶的固定化酶和无载体游离酶催化制备十八烷二酸单叔丁酯。
40.固定化酶的载体均为lx109s环氧树脂,每克lx109s环氧树脂上cala酶的负载量为60mg,具体制备方法如下:步骤s1,将第一磷酸盐缓冲液与水解酶混合形成缓冲酶液,第一磷酸盐缓冲液的ph为7.0~8.0,且含有氯化钠,氯化钠的浓度为1mol/l;步骤s2,将体积比为4:1的缓冲酶液与lx-109s环氧树脂混合进行固定化反应,然后用ph为7.0~8.0的不含氯化钠的第二磷酸盐缓冲液洗涤,得到固定化酶。
41.向10 ml反应瓶中,加入2 ml叔丁醇,同时做为酯供体及溶剂;随后加入20 mg原料十八烷二酸(结构式:),并充分振荡分散;随后加入10 wt(10wt表示相对于相应二元酸的10倍重量,下同)的上述固定化水解酶或同等酶量的cala游离酶(粗酶粉12mg,0.6wt)。将上述反应体系置于摇床中升温至30℃,于200 rpm条件下进行反应。反应19 h、43 h和90 h跟踪体系,使用高效液相色谱仪(thermo)-cad检测器检测单酯产品的转化率(转化率计算公式如下,下同),结果如下表1,未检测到二叔丁酯副产物的生成。
42.,其中,area
产品
和area
原料
分别表示原料和产品的峰面积。
43.表1
实施例2本实施例采用的酶为cala(novocor adl),载体为nka9大孔树脂,每克载体上cala酶的负载量为60mg,固定化水解酶的制备方法如下:步骤s1,将ph为7.0~8.0的磷酸盐缓冲液与水解酶混合形成缓冲酶液;步骤s2,将体积比为4:1的缓冲酶液与nka9大孔树脂混合进行固定化反应,然后用ph为7.0~8.0的磷酸盐缓冲液洗涤,得到固定化酶。
44.向10 ml反应瓶中,加入2 ml叔丁醇,同时做酯供体及溶剂;随后加入20 mg原料十八烷二酸,并充分振荡分散;随后加入10 wt的上述固定化酶,将上述反应体系置于摇床中升温至30℃,于200 rpm条件下进行反应。检测反应体系中反应43h后单酯产品的转化率为35.51%,未检测到二叔丁酯副产物的生成。
45.实施例3本实施例采用的酶为cala(novocor adl)载体为lx1000ha氨基树脂,每克载体上cala酶的负载量为80mg,固定化水解酶的制备方法如下:步骤s1,将lx1000ha氨基树脂与ph为7.0~8.0的磷酸盐缓冲液混合进行载体活化后用磷酸盐缓冲液洗涤,得到活化后的氨基树脂;步骤s2,将ph为7.0~8.0的磷酸盐缓冲液与水解酶混合形成缓冲酶液;步骤s3,将体积比为4:1的缓冲酶液与活化后的氨基树脂混合进行固定化反应后用磷酸盐缓冲液洗涤,得到固定化酶。
46.反应条件参照实施例1,检测反应体系中反应43h后单酯产品的转化率为19.57%,未检测到二叔丁酯副产物的生成。
47.实施例4仍然以十八烷二酸为原料,固定化水解酶同实施例1的novocor adl固定化酶,固定化酶的用量为2 wt,酯供体的用量为10 eq(即原料烷二酸摩尔量的10倍,下同),加入溶剂的量为使反应体系的体积为原料十八烷二酸体积的50倍,酯供体和溶剂的种类如下表2所示,反应体系置于30℃摇床、200 rpm反应,反应41h检测的单酯产品转化率结果如下表2,均未检测到二酯副产物。
48.表2
实施例5仍然以十八烷二酸为原料,加入量为30mg,固定化水解酶同实施例1 的novocor adl固定化酶,固定化酶的用量为2 wt,酯供体及反应溶剂叔丁醇的量为如下表3所示,反应体系置于30℃摇床、200 rpm反应,反应41h检测的单酯产品转化率结果如下表3,未检测到二酯副产物。
49.表3实施例6仍然以十八烷二酸为原料,加入量为20mg,固定化水解酶同实施例1 的cala(novocor adl)固定化酶,固定化酶的用量为2 wt,酯供体及反应溶剂叔丁醇的量为使反应体系的体积为原料十八烷二酸的50倍,反应温度如下表4所示,反应体系置于相应温度的200 rpm摇床反应,反应41h检测的单酯产品转化率结果如下表4,未检测到二酯副产物。
50.表4
实施例7向10 ml反应瓶中,加入2 ml叔丁醇,随后加入20 mg原料十六烷二酸(结构式为),并充分振荡分散;随后加入10 wt.的固定化水解酶,固定化水解酶的种类见下表5,其制备方法同前述实施例。将上述反应体系置于摇床中升温至30℃,于200 rpm条件下反应对反应体系进行跟踪,反应19h及43 h检测单叔丁酯产品的转化率。固定化水解酶的种类和相应的测试结果见下表5。
51.表5实施例8向10 ml反应瓶中,加入2 ml叔丁醇,随后加入20 mg原料二十烷二酸(结构式为),并充分振荡分散;随后加入10 wt.的固定化水解酶。将反应体系置于摇床中升温至30℃,于200 rpm条件下反应。对反应体系进行跟踪,反应19 h及43 h检测单叔丁酯产品的转化率。固定化水解酶的种类和相应的测试结果见下表6。
52.表6实施例9向10 ml反应瓶中,加入2 ml叔丁醇,随后加入20 mg原料亚烷基二酸,并充分振荡分散;随后加入10 wt.的固定化水解酶,固定化水解酶同实施例1的 cala(novocor adl)固定化酶。将反应体系置于摇床中升温30℃,于200 rpm条件下反应。反应43 h跟踪体系,检测单叔丁酯产品的转化率,测试结果和亚烷基二酸的底物种类如下表7所示。
53.表7
对比例1采用如下表8中的酶和载体制备而成的固定化酶,表中的酶均为市售商业化酶(其中牌号以asym开头的生产厂家均为凯莱英医药集团),每克载体上酶的负载量为80mg,固定化酶的制备方法参见实施例1~3,其中表中载体标注为
“‑”
的表示直接采用商业化酶,未查询到是否包含载体或者载体种类信息,反应条件与实施例1相同,各种酶与载体的固定化方法参见实施例1~3,检测各反应体系反应43h后单酯的转化率,检测结果如下表。
54.表8
从以上的描述中,可以看出,本发明上述的实施例实现了如下技术效果:利用生物酶催化技术,采用酶将亚烷基二元羧酸类底物进行高选择性地转换,获得亚烷基二酸单酯,
这种酶催化合成方法的工艺条件稳定,反应条件温和,合成过程操作简单、容易实施、污染较低,且反应选择性良好,能够避免产生不需要的二酯副产物,易于分离提纯。
55.以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。