工程化溶瘤腺病毒
背景技术:
1.通过工程化修饰,将腺病毒改造成为一种对正常细胞的毒性极小、特异性靶向肿瘤细胞的溶瘤病毒。使用各种腺病毒突变体在数以万计的患者中进行了大量临床试验,结果证实了这种溶瘤病毒的安全性。然而,以往的腺病毒突变体评价临床试验大多被设计成靶向p53基因,该基因功能异常是癌症患者中的常见现象。dl1520(onyx-015;δe1b55k和δe3b)是首个用于临床治疗的溶瘤腺病毒。h101是一种类似的腺病毒突变体,已在中国获批用于治疗癌症(上海三维生物技术有限公司,中国)。这些突变体的肿瘤选择性虽然已得到证实,但仅在与化疗联用时才具有疗效。之后研究发现,删除的e1b55k基因和e3b基因具有各自的重要功能(例如,分别为病毒晚期rna的转运和对抗宿主的免疫防御机制),会导致此类病毒的效力减弱。
2.腺病毒逃避宿主免疫监视的能力是决定其效力持久性的重要因素。先前已经描述了由人腺病毒e3区编码的四种免疫调节蛋白。其中之一是gp19k(又称e3/19k),其能够与主要组织相容性复合体(mhc)i类抗原的重链结合,并抑制其向细胞表面转运。因此,e3gp19k参与了逃避宿主免疫系统细胞毒性t淋巴细胞(ctl)识别和消除受感染细胞的过程。
3.人腺病毒(hadv/ad),特别是c5型(hadv-c5/ad5)已用于研发病毒治疗药物。现已明确掌握了体外ad5细胞摄取和趋向性机制。细胞病毒摄取是通过ad5纤维蛋白与柯萨奇-腺病毒受体(car)结合进行的。然而,虽然car广泛表达于人体组织(包括红细胞)中以及各种肿瘤细胞表面上,而许多研究报告又明确记载了car在肿瘤中的表达丧失。因此,基于利用car的载体的病毒疗法可能不是高效靶向肿瘤的理想选择,对其他受体趋向性的评估有待探索。
4.在本技术中,发明人报告了通过整合a20fmdv2肽、消除car结合、表达il21制成的新型突变体ad5-3del-a20t-il21,实现了最佳复制选择性、癌症靶向和免疫刺激。ad5-3del-a20t-il21具有很高的效力,并且保留了在各种癌细胞中传播所必需的所有病毒功能。我们预期这些发现将为进一步优化溶瘤腺病毒的全身递送提供参考,从而改善癌症患者的治疗效果。
技术实现要素:
5.本技术实现了删除三个病毒基因组合、修饰纤维区域以及携带免疫调节基因il21。
6.本技术的第一实施方式包括使用线性化供体表达盒制成重组腺病毒,从而避免了繁琐的选择用于携带供体表达盒的克隆载体。
7.本技术的第二实施方式包括使用核苷酸的多接头(在此情况下使用限制性内切酶swai)来填充去除抗生素抗性基因后留下的孔隙,使得多基因的修饰能够可行。
8.本技术的第三实施方式包括利用第一和第二实施方式中描述的技术构建出删除三个基因(即e1acr2、e1b19k、e3gp19k)的骨架腺病毒。
9.本技术的第四实施方式包括产生一种重组腺病毒,该重组腺病毒备有插入到
e3gp19k中的人il-21基因。
10.本技术的第五实施方式包括在通过第四实施方式产生的病毒的基础上,构建出具有y477a突变、删除tayt、rgd肽a20fmdv2插入到腺病毒纤维中的重组腺病毒。
11.此外,第五实施方式的a20fmdv2是精确的20肽。
12.在本技术的第六实施方式中,在第五实施方式产生的病毒中没有附着额外的肽。
13.在本技术的第七实施方式中,通过本技术任一实施方式产生的病毒用于治疗表达αvβ6整联蛋白的癌症,包括但不限于胰腺癌、头颈癌和卵巢癌。
14.在本技术的第八实施方式中,通过本技术任一实施方式产生的病毒用于经由静脉注射治疗癌症。
15.此外,在本技术的任一实施方式中,所述病毒为腺病毒。
16.本技术的第九实施方式提供了一种pi3kδ抑制剂与静脉注射权利要求5中产生的经修饰的病毒的组合,用于提高所述经修饰的病毒的抗肿瘤效力。
17.本技术的第九实施方式提供了一种检查点抑制剂与通过本技术任一实施方式产生的经修饰的病毒的组合,用于提高所述经修饰的病毒的抗肿瘤效力。
18.本技术实施方式的特点:
19.1.该产品实现了删除三个病毒基因组合、修饰纤维区域以及携带免疫调节基因il21。
20.2.删除e1acr2基因使突变病毒能够在肿瘤细胞中选择性复制,而不会影响正常细胞。
21.e1acr2区域负责prb的结合和失活,从而释放e2f以诱导细胞周期的s期。然而,在增殖的正常细胞中以及在细胞周期控制失调(主要是prb和p16的改变)的肿瘤细胞中,e1acr2区域的功能是多余的。
22.3.删除e1b19k基因。
23.已经证实,δe1b19k突变体的治疗指数增加并且在体内的肝毒性降低,同时保持了抗肿瘤效力。抗凋亡e1b19k蛋白通过阻断bax-bak寡聚化和类似于细胞bcl-2同源物的线粒体成孔来 促进病毒复制和传播。与主要抑制p53依赖性通路的e1b55k蛋白相比,e1b19k通过p53依赖性机制和p53非依赖性机制来抑制死亡受体和内在诱导的细胞凋亡两者。删除e1b19k基因和e1acr2区域且具有完整的e3区域的腺病毒突变体,无论是作为单药使用还是与标准化疗药物联用,都能够提高疗效和选择性。
24.4.删除e3gp19k。
25.腺病毒e3-gp19k是一种位于内质网(er)的跨膜糖蛋白,其与主要组织相容性复合体(mhc)i类抗原形成复合体并将其保留在er中,从而防止被细胞毒性t淋巴细胞(ctl)的溶解。gp19k的er腔结构域(残基1至107)已知足以与i类抗原结合;跨膜和细胞质er保留结构域分别位于aa 108至127残基位点和128至142残基位点。
26.5.纤维区域的y477a突变和tayt删除。
27.ad5突变体具有一组纤维突变(y477a和tayt删除),被认为是消除与因子ix(fix)和c4b结合蛋白(c4bp)的结合。该突变体在静脉内递送后会显示出显著降低的肝转导和毒性、低水平的细胞因子诱导。
28.6.a20
29.αvβ6整联蛋白在许多实体瘤中高度表达,但在正常细胞中不表达。腺病毒突变体经工程化修饰为表达源自口蹄疫病毒(fmdv)的20氨基酸肽a20fmdv2,该肽通过arg-gly-asp(rgd)结构域与αvβ6选择性结合。
30.7.病毒携带白细胞介素21(il-21)基因。
31.与白细胞介素12一样,白细胞介素21也激活nk和杀伤性t细胞。在免疫激活过程中,il-21晚于il-12发挥作用,两种白细胞介素协同激活免疫细胞。治疗基因被插入到e3gp19k中。
32.一方面,本发明提供了一种经修饰的病毒ad5,其中所述经修饰的病毒ad5能够表达细胞因子,并且所述经修饰的病毒ad5能够表达a20。
33.在某些实施方式中,所述细胞因子源自于人。
34.在某些实施方式中,所述细胞因子包括白细胞介素、肿瘤坏死因子、干扰素、趋化因子、淋巴因子和/或生长因子。
35.在某些实施方式中,所述细胞因子包括il12、il2、il15和/或il8。
36.在某些实施方式中,所述细胞因子包括il-21。
37.在某些实施方式中,将编码所述细胞因子的基因掺入到所述经修饰的病毒ad5的基因组中。
38.在某些实施方式中,所述a20源自于口蹄疫病毒(fmdv)。
39.在某些实施方式中,编码所述a20的基因具有seq id no.4中所示的核酸序列。
40.在某些实施方式中,将编码所述a20的基因整合到所述经修饰的病毒ad5的基因组中。
41.在某些实施方式中,将编码所述a20的基因整合到经修饰的病毒ad5的hi环中。
42.在某些实施方式中,所述整合使用基因编辑法和/或基因重组法。
43.在某些实施方式中,所述经修饰的病毒ad5具有至少一个纤维区域中的改造。
44.在某些实施方式中,所述纤维区域中的修饰包括氨基酸取代y477a。
45.在某些实施方式中,所述纤维区域中的修饰包括在489-492残基位点删除氨基酸tayt。
46.在某些实施方式中,与野生型病毒ad5相比,e1acr2基因的表达和/或活性在所述经修饰的病毒ad5中被下调。
47.在某些实施方式中,与野生型病毒ad5相比,e1b19k基因的表达和/或活性在所述经修饰的病毒ad5中被下调。
48.在某些实施方式中,与野生型病毒ad5相比,e3gp19k基因的表达和/或活性在所述经修饰的病毒ad5中被下调。
49.在某些实施方式中,与野生型病毒ad5相比,所述e1acr2基因、所述e1b19k基因和所述e3gp19k基因的表达和/或活性在所述经修饰的病毒ad5中被下调。
50.在某些实施方式中,所述下调使用基因编辑法和/或基因重组法。
51.在某些实施方式中,所述基因编辑使用反义rna、sirna、shrna和/或crispr/cas系统。
52.在某些实施方式中,编码所述e1acr2基因的至少一部分、所述e1b19k基因的至少一部分和所述e3gp19k的至少一部分基因被删除。
53.在某些实施方式中,所述编码细胞因子的基因被整合到所述e1acr2基因、所述e1b19k基因或所述e3gp19k基因的位点中。
54.在某些实施方式中,所述经修饰的病毒ad5能够表达靶向t细胞的基因和/或配体、靶向肿瘤细胞的基因和/或配体、和/或治疗基因。
55.在某些实施方式中,所述治疗基因选自下组:编码免疫共刺激通路激活分子的基因、编码检查点抑制剂的基因、编码细胞毒素的基因、编码肿瘤抑制基因的基因和血管生成抑制基因。
56.在某些实施方式中,所述免疫共刺激通路激活分子选自下组:cd40配体(cd40l)、icos配体、gitr配体、4-1bb配体、ox40配体、tl1a、cd30配体、cd27和flt3配体或它们的变体。
57.在某些实施方式中,所述检查点抑制剂选自下组:pd-1抑制剂、pd-l1抑制剂和ctla-4抑制剂。
58.在某些实施方式中,所述肿瘤抑制基因包括hic1基因。
59.在另一方面,本技术提供了一种分离的核酸分子,其编码本技术的经修饰的病毒ad5。
60.在另一方面,本技术提供了一种载体,其包含本技术的经修饰的病毒ad5,和/或本技术的分离的核酸分子。
61.在另一方面,本技术提供了一种细胞,其包含本技术的经修饰的病毒ad5、本技术的分离的核酸分子和/或本技术的载体。
62.在另一方面,本技术提供了一种药物组合物,其中所述药物组合物包含本技术的经修饰的病毒ad5和药学上可接受的佐剂。
63.在另一方面,本技术提供了一种疾病和/或病症的治疗方法,其包括向有需要的受试者施用本技术的经修饰的病毒ad5、本技术的分离的核酸分子、本技术的载体、本技术的细胞、和/或本技术的药物组合物。
64.在某些实施方式中,所述的方法包括以至少一种药剂的组合向有需要的受试者施用本技术的经修饰的病毒ad5,并且所述药剂选自下组:抗癌剂、激动剂、拮抗剂、化疗剂和放射剂。
65.在某些实施方式中,所述疾病包括肿瘤。
66.在某些实施方式中,所述疾病包括表达αvβ6整联蛋白的肿瘤。
67.在某些实施方式中,所述疾病包括胰腺癌、头颈癌和/或卵巢癌。
68.根据以下具体实施方式,本领域技术人员将显而易知本技术的其他方面和优势,在具体实施方式中仅示出和描述本技术的示例性实施方式。如将认识到,本技术能够具有其它不同的实施方式,其若干细节可以在各种明显的方面进行修改,但均不脱离本公开。因此,附图和说明书在本质上均被视为是示例性的而非限制性的。
69.通过引用并入
70.在本说明书中提及的所有出版物、专利和专利申请均通过引用并入本文,其引用程度如同各个单独的出版物、专利或专利申请被具体地并且分别地指出以引用的方式并入一样。
附图说明
71.本发明的新颖特征在所附权利要求书中详细阐述。通过参考阐述使用本发明原理的示例性实施方式的以下具体实施方式以及附图,将更好地理解本发明的特征和优势,在附图(在本文中也称为“图(figure)”和“图(fig.)”)中:
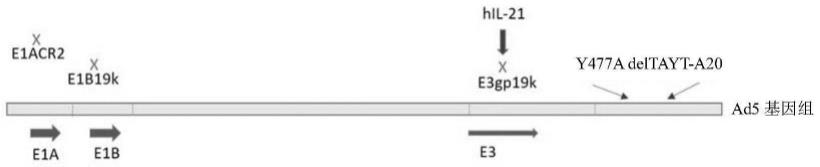
72.图1是产品的示意图。
73.图2a至图2c是用于修饰ad5的穿梭表达盒。a:用于删除e3gp19k的穿梭表达盒。左臂靶向e3gp19k基因的左侧,并且右臂靶向e3gp19k的右侧。氯霉素及其启动子位于左臂和右臂之间。将穿梭表达盒克隆到puc57载体的ecorv位点。b:用于删除e3gp19k的穿梭表达盒。左臂靶向e3gp19k基因的左侧,并且右臂靶向e3gp19k的右侧。人il-21(hil-21)使用e3gp19k的启动子,同时氯霉素及其启动子位于左臂和右臂之间。将穿梭表达盒克隆到puc57载体的ecorv位点。c:用于y477a突变、删除tayt、插入a20的穿梭表达盒。将穿梭表达盒克隆到puc57载体的ecorv位点。
74.图3是删除e3gp19k的示意图。1)通过载体中穿梭表达盒和骨架病毒基因组的组合,采用同源重组的方法删除e3gp19k。筛选得到的重组体并在lb平板上以氯霉素培养,挑取菌落、培养并提取质粒,然后进行测序来确认e3gp19k的删除情况。2)使用swai从已确认删除e3gp19k的重组质粒中切除氯霉素,并且3)重新连接以获得所需的重组质粒,该重组质粒将用于构建经修饰的腺病毒。
75.图4是hil-21取代e3gp19k的示意图。1)通过穿梭表达盒和骨架病毒基因组的组合,在载体中通过同源重组用hil-21取代e3gp19k。筛选得到的重组体并在lb平板上以氯霉素培养,挑取菌落、培养并提取质粒,然后进行测序来确认e3gp19k的删除情况。2)使用swai从已确认插入hil-21来取代e3gp19k的重组质粒中切除氯霉素,并且3)重新连接以获得所需的重组质粒,该重组质粒将用于构建经修饰的腺病毒。
76.图5是对缺失三个基因的腺病毒进行y477a突变、tayt删除和a20插入的示意图。1)通过载体中穿梭表达盒和骨架病毒基因组的组合,采用同源重组的方法实现y477a的突变、tayt的删除和a20的插入。筛选得到的重组体并在lb平板上以氯霉素培养,挑取菌落、培养并提取质粒,然后进行测序来确认y477a的突变、tayt的删除和a20的插入的情况。2)使用swai从已确认的重组质粒中切除氯霉素,并且3)重新连接以获得所需的重组质粒,该重组质粒将用于构建经修饰的腺病毒。
77.图6是在备有hil-21的腺病毒中进行y477a的突变、tayt的删除和a20的插入的示意图。1)通过载体中穿梭表达盒和骨架病毒基因组的组合,采用同源重组的方法实现y477a的突变、tayt的删除和a20的插入。筛选得到的重组体并在lb平板上以氯霉素培养,挑取菌落、培养并提取质粒,然后进行测序来确认y477a的突变、tayt的删除和a20的插入的情况。2)使用swai从已确认的重组质粒中切除氯霉素,并且3)重新连接以获得所需的重组质粒,该重组质粒将用于构建经修饰的腺病毒。
78.图7是用于删除e3gp19k的表达盒序列。
79.图8是用于通过取代e3gp19k而将人il-21插入到e3gp19k区域的表达盒序列。
80.图9是用于y477a的突变、tayt的删除和rdg肽a20插入到纤维区域的表达盒序列。
81.图10是删除e3gp19k的pad-c对照病毒结构体的测序结果。如上图对比所示,在atga(28372)与tttact(29212)之间删除了e3gp19k。在使用swai限制性内切酶去除氯仿后,
将cccatcatttgaagcttcaaattacggg序列插入到atga(28372)和tttact(29212)之间,然后用接头序列填充。
82.图11是对pad-c对照病毒结构体的修饰。测序结果证明了y477a突变和tayt删除。
83.图12是通过插入rgd序列a20在纤维区域中对ad-c对照病毒结构体的修饰。a20序列:
84.aacgcagtacctaacttgagaggagatctacaggtgttggcacagaaggtcgcacgtact
85.图13是在ad-c对照病毒结构体中使用swai限制性内切酶去除氯仿后的测序结果。
86.图14是在病毒结构体pad-il21的e3gp19k区域中插入人il-21。人il-21被插入在腺病毒基因组的atga和ataat之间。
87.图15是在病毒ad-il21中使用swai限制性内切酶去除氯仿后的测序结果。ataat是病毒基因组中剩余的额外序列。
88.图16是对病毒结构体pad-il21的修饰。测序结果证明了y477a突变和tayt删除。
89.图17是通过插入rgd序列a20在纤维区域中对病毒结构体pad-il21的修饰。
90.图18是在病毒结构体pad-il21中使用swai限制性内切酶去除氯仿后的测序结果。atttaaat是留在病毒基因组中的额外序列。
91.图19是经修饰的腺病毒对人il-21的表达。从感染了经修饰的腺病毒的293t细胞中收集细胞培养基,通过elisa测定细胞培养基中的人il21。
92.图20是本技术的经修饰的病毒ad5能够特异性靶向并杀死肿瘤细胞。
具体实施方式
93.虽然本文已展示和描述本发明的各种实施方式,但对本领域的技术人员显而易见的是,这些实施方式仅仅通过示例的方式提供。在不脱离本发明的情况下,本领域技术人员可以想到许多变化、改变和替换。应当理解,可以采用本文所述的本发明实施方式的各种替代方式。
94.在本文中,术语“ad5”一般是指一种人腺病毒(hadv/ad),也可以称为人腺病毒种类c型5,或hadv-c5。hadv-c5是一种病原体,可能会导致包括急性、轻度和无(即无症状)在内的不同严重程度的呼吸道症状(echavarria,2009;edwards等人,1985;fox等人,1969;garnett等人,2009)。ad5通常用于基因转移实验,因为它能够感染广泛的不同细胞类型,并且能够在其基因组中包含通过同源重组技术整合的大基因。
95.在本文中,术语“细胞因子”通常是指可影响免疫系统细胞的一大类生物分子。细胞因子可以包括局部起作用或者可在血液中循环以调控或调节个体对癌症的免疫反应的生物分子。例如,细胞因子可以包括干扰素α(ifn-α)、干扰素β(ifn-β)和干扰素γ(ifn-γ)、白介素(例如,il-1至il-29,特别是,il-2、il-5、il-6、il-7、il-10、il-12、il-15和il-18)、肿瘤坏死因子(例如,tnf-α和tnf-β)、促红细胞生成素(epo)、mip3a、单核细胞趋化蛋白(mcp)-1、细胞内粘附分子(icam)、巨噬细胞集落刺激因子(m-csf)、粒细胞集落刺激因子(g-csf)和粒细胞-巨噬细胞集落刺激因子(gm-csf)。
96.在本文中,术语“il-21”通常是指对广泛的淋巴细胞、骨髓细胞和上皮细胞起作用的多效性细胞因子。il-21可以在b细胞向浆细胞的分化中以及在滤泡辅助性t细胞的发育中发挥关键作用,从而促发功能性生发中心并促进免疫球蛋白的产生。例如,il-21可以在
cd8
t细胞中诱导提高存活率、抗病毒活性和抗肿瘤活性的功能程序。il-21可以调节先天性免疫反应和适应性免疫反应两者,并且可以在抗肿瘤以及自身免疫性疾病和炎症性病症的发展中发挥关键作用。人il-21的基因标识符(gene id)可以为59067。
97.在本文中,术语“a20”通常是指a20fmdv2肽。a20可以来源于口蹄疫病毒。a20可以具有seq id no.5:(navpnlrgdlqvlaqkvart)中所示的氨基酸序列。a20可以对肿瘤相关的αvβ6整联蛋白表现出较高的选择性和亲和力。
98.在本文中,术语“纤维区域”通常是指腺病毒(ad)的纤维结构。ad可以具有由三种主要暴露的结构蛋白组成的衣壳、六邻体、纤维和五邻体基质。纤维区域的主要作用可以是经由其与细胞受体的相互作用而将病毒衣壳束缚在细胞表面。纤维区域可以具有:n端尾部、由重复序列组成的中心轴和c端球状旋钮结构域。纤维的前约45个残基在不同血清型中可能高度保守。对于纤维区域的突变,可以参考表2“腺病毒纤维结构和功能对基因治疗载体开发的影响”。
99.在本技术中,术语“e1acr2基因”一般是指ad5的基因。临床前研究显示,删除e1acr2的各种突变体可能非常有效(cancer res.[癌症研究]2002年10月15日;62(20):5736-42.)。由e1acr2基因编码的e1acr2可以负责prb的结合和失活,从而释放e2f以诱导s期。而且,e1acr2可以提高体内安全性,但也可以响应于细胞毒性药物诱导的细胞凋亡而促进细胞死亡。
[0100]
在本文中,术语“e1b19k基因”一般是指ad5的基因。由e1b19k基因编码的e1b19k可以通过阻断bax-bak寡聚化和类似于细胞bcl-2同源物的线粒体成孔来促进病毒复制和传播。而且,δe1b19k突变体可以具有较高治疗指数和较低的体内肝毒性(clin cancer res.[临床癌症研究]2010年1月15日;16(2):541
–
553.)。
[0101]
在本文中,术语“e3gp19k基因”一般是指ad5的基因。由e3gp19k基因编码的e3gp19k是一种跨膜糖蛋白,可以防止被细胞毒性t淋巴细胞(ctl)溶解。删除e3gp19k基因可以促进肿瘤抗原呈递并刺激靶向于受感染和未受感染癌细胞的免疫反应,这可能是肿瘤介导的免疫检查点抑制的优势(oncolytic virother.[溶瘤病毒治疗]2016;5:45-57.)。
[0102]
在本文中,术语“基因编辑”通常是指一种基因工程,其中在活生物体的基因组中进行dna的插入、删除、修饰或取代。在本技术中,基因编辑可以使用酶进行,例如已被工程化修饰成靶向于特定dna序列的核酸酶,其中它们可以在dna链中引入切割,从而能够移除现有dna并插入取代的dna。基因编辑可以通过crispr/cas系统进行。
[0103]
在本文中,术语“基因重组”通常是指多条染色体之间和/或同一染色体的不同区域之间的遗传物质交换。基因重组可以通过同源性进行介导;也就是说,染色体的同源区域排成一列以准备进行交换,并且可能需要某种程度的序列同一性。
[0104]
在本文中,术语“αvβ6整联蛋白”通常是指上皮特异性整联蛋白,其是细胞外基质(ecm)蛋白纤连蛋白、玻连蛋白、腱生蛋白、和tgf-β的潜在型结合肽(lap)的受体。αvβ6整联蛋白实际上可以促进癌症进展。αvβ6整联蛋白在乳腺癌、肺癌、口腔癌和皮肤鳞状细胞癌(scc)、结肠癌、胃癌和子宫内膜癌等中可能被大幅上调。
[0105]
本技术的一个实施方式提供了一种序列,其包括以下至少一项:
[0106]
seq id no:1中所示的序列;
[0107]
seq id no:2中所示的序列;
[0108]
seq id no:3中所示的序列;
[0109]
seq id no:4中所示的序列;
[0110]
部分或完全删除e1acr2;
[0111]
部分或完全删除e1b19k;
[0112]
部分或完全删除e3gp19k;
[0113]
il-21;
[0114]
突变ad5纤维蛋白;
[0115]
αvβ6整联蛋白的配体;
[0116]
治疗基因或经修饰的治疗基因;或
[0117]
靶向t细胞的配体或抗体。
[0118]
本技术的一个实施方式提供了一种病毒,其包括以下至少一项:
[0119]
seq id no:1中所示的序列;
[0120]
seq id no:2中所示的序列;
[0121]
seq id no:3中所示的序列;
[0122]
seq id no:4中所示的序列;
[0123]
部分或完全删除e1acr2;
[0124]
部分或完全删除e1b19k;
[0125]
部分或完全删除e3gp19k;
[0126]
il-21;
[0127]
突变ad5纤维蛋白;
[0128]
αvβ6整联蛋白的配体;
[0129]
治疗基因或经修饰的治疗基因;或
[0130]
靶向t细胞的配体或抗体。
[0131]
本技术的一个实施方式提供了一种序列,其包括以下至少一项:
[0132]
所述e1acr2、e1b19k或e3gp19k的一部分或全部被il-21取代;
[0133]
所述e1acr2、e1b19k或e3gp19k的一部分或全部被突变ad5纤维蛋白取代;
[0134]
所述e1acr2、e1b19k或e3gp19k的一部分或全部被αvβ6整联蛋白的配体取代;
[0135]
所述e1acr2、e1b19k或e3gp19k的一部分或全部被seq id no:4中所示的序列取代;
[0136]
所述e1acr2、e1b19k或e3gp19k的一部分或全部被靶向t细胞的配体或抗体取代;
[0137]
所述e1acr2、e1b19k或e3gp19k的一部分或全部被肿瘤靶向基因取代;或者
[0138]
所述e1acr2、e1b19k或e3gp19k的一部分或全部被治疗基因或经修饰的治疗基因取代。
[0139]
本技术的一个实施方式提供了一种病毒,其包括以下至少一项:
[0140]
所述e1acr2、e1b19k或e3gp19k的一部分或全部被il-21取代;
[0141]
所述e1acr2、e1b19k或e3gp19k的一部分或全部被突变ad5纤维蛋白取代;
[0142]
所述e1acr2、e1b19k或e3gp19k的一部分或全部被αvβ6整联蛋白的配体取代;
[0143]
所述e1acr2、e1b19k或e3gp19k的一部分或全部被seq id no:4中所示的序列取代;
[0144]
所述e1acr2、e1b19k或e3gp19k的一部分或全部被靶向t细胞的配体或抗体取代;
[0145]
所述e1acr2、e1b19k或e3gp19k的一部分或全部被肿瘤靶向基因取代;或者
[0146]
所述e1acr2、e1b19k或e3gp19k的一部分或全部被治疗基因或经修饰的治疗基因取代。
[0147]
在本技术的上述实施方式中,ad5纤维蛋白可以包括y477a突变和tayt删除。αvβ6整联蛋白的配体可以是通过arg-gly-asp(rgd)-结构域与αvβ6选择性结合的肽。
[0148]
在本技术的上述实施方式中,病毒可以是腺病毒,尤其是腺病毒5型。
[0149]
在本技术的上述实施方式中,序列还可以包括治疗基因,包括免疫调节剂、免疫共刺激通路激活分子、检查点抑制剂、细胞毒基因、肿瘤抑制基因、抗血管生成基因等。
[0150]
免疫调节基因可以包括细胞因子基因(例如il12、il21、il2、il15、il8)或其任何经修饰的形式。
[0151]
免疫共刺激通路激活分子可以包括基因编码cd40配体(cd40l)、icos配体、gitr配体、4-1bb配体、ox40配体、tl1a、cd30配体、cd27或flt3配体或其任何经修饰的形式。
[0152]
检查点抑制剂可以包括pd-1抑制剂、pd-l1抑制剂、ctla-4抑制剂或其任何经修饰的形式。
[0153]
肿瘤抑制基因可以包括hic1等或其任何经修饰的形式。
[0154]
本技术中使用的基因可以从ncbi基因库中获得。
[0155]
本技术的一个实施方式提供了一种包含上述任一序列的表达载体或宿主细胞。
[0156]
治疗策略
[0157]
本技术的一个实施方式提供了一种用于人体或动物体治疗方法的病毒,该方法包括以下至少一项:
[0158]
单独用作单一疗法;或者
[0159]
与一种或多种药物组合使用。
[0160]
本技术实施方式的药物可以是已知的抗癌剂、抑制剂、激动剂、拮抗剂、化疗剂、放射剂,尤其是pi3kδ抑制剂或免疫检查点抑制剂。
[0161]
本技术的一个实施方式提供了一种用于制备治疗人体或动物体的药物的病毒。
[0162]
本技术的一个实施方式提供了一种用于诱导癌细胞死亡、调节癌细胞的生物活性、调节免疫反应、增强t细胞的增殖和/或细胞毒性的病毒。
[0163]
本技术的一个实施方式提供了一种用于在制备用于抑制癌细胞生长、诱导癌细胞死亡和/或调节癌细胞的生物活性的药物中使用的病毒。
[0164]
癌细胞的生物活性包括抑制癌细胞复制、抑制癌细胞分裂、抑制癌细胞dna修复、抑制癌细胞迁移或促进癌死亡。
[0165]
本技术的一个实施方式提供了一种在无菌小瓶、安瓿或注射器中包含病毒的制备产品。
[0166]
本技术的一个实施方式提供了一种包含本技术实施方式的病毒的药物组合物。
[0167]
在本技术的一个实施方式中,该药物组合物还包含抗癌剂和/或抗体。
[0168]
在本技术的一个实施方式中,该药物组合物还包含药学上可接受的载体、稀释剂和/或赋形剂。
[0169]
本发明的药物组合物可以通过本领域熟知的方法制备,例如,通过常规的混合、溶
解、制粒、糖衣丸制作、磨细、乳化、包封、包埋或冻干方法。
[0170]
因此,根据本发明使用的药物组合物可以使用一种或多种生理学上可接受的载体以常规方式配制,该生理学上可接受的载体包括赋形剂和助剂,其便于将活性成分加工成可药用的制剂。合适的制剂取决于所选择的施用途径。
[0171]
适当的施用途径可以包括例如瘤内、口腔、直肠、经粘膜(尤其是经鼻)、肠或肠胃外递送,包括肌肉内、皮下和髓内注射以及鞘内、直接心室内、心脏内(例如进入右侧或左侧心室腔、进入冠状动脉)、静脉内、腹膜内、鼻内或眼内注射。
[0172]
本技术的一个实施方式提供了一种疾病的治疗方法,其包括施用有效量的序列、表达载体、宿主细胞、病毒、药物组合物或药物。
[0173]
示例性疾病包括癌症、增殖性疾病、自身免疫性疾病等。
[0174]
一方面,本发明提供了一种经修饰的病毒ad5,其中所述经修饰的病毒ad5能够表达细胞因子,并且所述经修饰的病毒ad5能够表达a20。
[0175]
在本技术中发现,与不能表达本技术的细胞因子的病毒ad5相比,本技术中的经修饰的病毒ad5可具有增强的调节免疫细胞(例如,t细胞、nk细胞)免疫反应活性的能力。
[0176]
在本技术中发现,与不能表达本技术的a20的病毒ad5相比,本技术中的经修饰的病毒ad5可具有增强的靶向肿瘤细胞和/或杀伤肿瘤细胞的能力。例如,与能够表达除本技术的a20以外的、靶向整联蛋白的蛋白的病毒ad5相比,本技术中的经修饰的病毒ad5可具有增强的靶向肿瘤细胞和/或杀伤肿瘤细胞的能力。例如,与能够表达靶向肿瘤微环境中其他靶点的蛋白的病毒ad5相比,本技术中的经修饰的病毒ad5可具有增强的靶向肿瘤细胞和/或杀死肿瘤细胞的能力。在本技术中,肿瘤可以包括本技术中的癌症。
[0177]
例如,细胞因子可以源自于人。
[0178]
例如,该细胞因子可以包括白细胞介素、肿瘤坏死因子、干扰素、趋化因子、淋巴因子和/或生长因子。
[0179]
例如,该细胞因子可以包括il12、il2、il15和/或il8。
[0180]
例如,该细胞因子可以包括il-21。
[0181]
在本技术中发现,与能够表达除il-21以外的细胞因子的病毒ad5相比,本技术的表达il-21的经修饰的病毒ad5可以显著降低对施用了病毒ad5的受试者的毒性。例如,可以在动物模型中在体内测定毒性。例如,可以使用动物模型中被施药动物的体重来说明毒性程度。
[0182]
例如,可以将细胞因子的编码基因掺入到经修饰的病毒ad5的基因组中。
[0183]
例如,a20可以源自于口蹄疫病毒(fmdv)。
[0184]
例如,a20的编码基因可以具有seq id no.4中所示的核酸序列。例如,a20可以具有seq id no.5中所示的氨基酸序列。
[0185]
例如,可以将a20的编码基因整合到经修饰的病毒ad5的基因组中。在本技术中,可以将a20的编码基因整合到经修饰的病毒ad5的基因组的任何位置,只要经修饰的病毒ad5的内源启动子可以用于表达a20即可。例如,可以将a20的编码基因整合到待删除原始基因(例如,e1acr2基因、e1b19k基因或e3gp19k基因)的位点。
[0186]
例如,可以将a20的编码基因整合到经修饰的病毒ad5的hi环中。
[0187]
例如,该掺入可以使用基因编辑法和/或基因重组法。
[0188]
例如,经改造的病毒ad5可以具有至少一个纤维区域中的修饰。
[0189]
例如,该纤维区域中的修饰可以包括氨基酸取代y477a。
[0190]
例如,该纤维区域中的修饰可以包括在489-492残基位点删除氨基酸tayt。
[0191]
在本技术中,纤维区域中的修饰可以包括氨基酸取代y477a和489-492残基位点删除氨基酸taty。例如,残基489-492处的taty可以意指从纤维区域n端开始的第489-492个氨基酸残基。
[0192]
例如,与野生型病毒ad5相比,e1acr2基因的表达和/或活性在所述经修饰的病毒ad5中可以被下调。
[0193]
例如,与野生型病毒ad5相比,e1b19k基因的表达和/或活性在所述经修饰的病毒ad5中可以被下调。
[0194]
例如,与野生型病毒ad5相比,e3gp19k基因的表达和/或活性在所述经修饰的病毒ad5中可以被下调。
[0195]
例如,与野生型病毒ad5相比,e1acr2基因、e1b19k基因和e3gp19k基因的表达和/或活性在经修饰的病毒ad5中可以被下调。例如,e1acr2基因、e1b19k基因和e3gp19k基因的表达水平在经修饰的病毒ad5中可能被显著下调,或者几乎检测不到。例如,e1acr2、e1b19k和e3gp19k的表达水平在经修饰的病毒ad5中可能被显著下调,或者几乎检测不到。例如,e1acr2、e1b19k和e3gp19k的活性和/或功能在经修饰的病毒ad5中可能被显著下调,或者几乎检测不到。
[0196]
例如,该下调可以使用基因编辑法和/或基因重组法。
[0197]
例如,基因编辑可以使用反义rna、sirna、shrna和/或crispr/cas系统。例如,基因编辑可以使用crispr/cas9系统。
[0198]
例如,编码e1acr2基因的至少一部分、e1b19k基因的至少一部分和e3gp19k的至少一部分基因可以删除。
[0199]
例如,可以将编码细胞因子的基因整合到e1acr2基因、e1b19k基因或e3gp19k基因的位点中。
[0200]
例如,在经修饰的病毒ad5中,可以删除e1acr2基因、e1b19k基因和e3gp19k基因,并且可以整合编码细胞因子的基因和编码a20的基因。
[0201]
例如,在经修饰的病毒ad5中,可以删除e1acr2基因、e1b19k基因和e3gp19k基因,并且可以整合编码il-21(例如,人il-21)的基因和编码a20的基因。
[0202]
例如,在经修饰的病毒ad5中,可以删除e1acr2基因、e1b19k基因和e3gp19k基因,可以整合编码il-21(例如,人il-21)的基因和编码a20的基因,并且其纤维区域中的修饰可以包括氨基酸取代y477a和在489-492残基位点删除氨基酸tayt。例如,经修饰的病毒ad5可以命名为kmad1。
[0203]
例如,可以将编码il-21的基因掺入到e3gp19k基因的原始位点中。
[0204]
在本技术中,经修饰的病毒ad5能够表达外源基因和/或外源蛋白。例如,经修饰的病毒ad5能够表达靶向t细胞的基因和/或配体、靶向肿瘤细胞的基因和/或配体、和/或治疗基因。
[0205]
例如,该治疗基因可以选自下组:编码免疫共刺激通路激活分子的基因、编码检查点抑制剂的基因、编码细胞毒素的基因、编码肿瘤抑制基因的基因和血管生成抑制基因。
[0206]
例如,该免疫共刺激通路激活分子可以选自下组:cd40配体(cd40l)、icos配体、gitr配体、4-1bb配体、ox40配体、tl1a、cd30配体、cd27和flt3配体或它们的变体。
[0207]
例如,该检查点抑制剂可以选自下组:pd-1抑制剂、pd-l1抑制剂和ctla-4抑制剂。
[0208]
例如,该肿瘤抑制基因可以包括hic1基因。
[0209]
在另一方面,本技术提供了一种分离的核酸分子,其编码本技术的经修饰的病毒ad5。
[0210]
该一种或多种分离的核酸可以使用本领域已知的重组技术合成。例如,该一种或多种分离的核酸可以使用自动化dna合成仪合成。标准重组dna和分子克隆技术包括由sambrook,j.,fritsch,e.f.and maniatis,t.molecular cloning:a laboratory manual(《分子克隆:实验室手册》),冷泉港实验室出版社:冷泉港,(1989)(maniatis)和t.j.silhavy,m.l.bennan,和l.w.enquist,experiments with gene fusions(《基因融合实验》),冷泉港实验室出版社:冷泉港,纽约(1984)以及ausubel,f.m.等人,current protocols in molecular biology(《分子生物学实验指南》),格林出版协会和美国威力出版公司出版(1987)描述的那些技术。简言之,本公开核酸可以由基因组dna片段、cdna和rna制备,基因组dna片段、cdna和rna都可以直接从细胞提取或通过包含但不限于pcr和rt-pcr的各种扩增工艺以重组方式产生。
[0211]
在另一方面,本技术提供了一种载体,其包含本技术的经修饰的病毒ad5,和/或本技术的分离的核酸分子。
[0212]
表达载体可以适用于特定类型的宿主细胞而不适用于其它类型。例如,表达载体可以引入到宿主生物体,接着监测载体内所含的任何基因/多核苷酸的活力和表达。表达载体还可能含有一个或多个可选标记基因,所述可选标记基因在表达时赋予可用于选择或以其它方式识别携带表达载体的宿主细胞的一个或多个表型性状。
[0213]
在另一方面,本技术提供了一种细胞,其包含本技术的经修饰的病毒ad5、本技术的分离的核酸分子和/或本技术的载体。
[0214]
该细胞可以是真核细胞或原核细胞。
[0215]
在另一方面,本技术提供了一种药物组合物,其中该药物组合物可以包含本技术的经修饰的病毒ad5和药学上可接受的佐剂。
[0216]
在另一方面,本技术提供了一种试剂盒,其包含本技术的经修饰的病毒ad5。
[0217]
例如,药物组合物可以是适合施用的形式。本技术的药物组合物可以包含治疗有效量的本技术的经修饰的病毒ad5。
[0218]
在本技术中,药学上可接受的佐剂可以包括脱粘剂、消泡剂、缓冲剂、聚合物、抗氧化剂、防腐剂、螯合剂、粘度调节剂、增强剂(tonicifier)、调味剂、着色剂、增味剂、遮光剂、悬浮剂、粘合剂、填充剂、增塑剂、润滑剂和/或它们的混合物。
[0219]
在另一方面,本技术提供了一种疾病和/或病症的治疗方法,其包括向有需要的受试者施用本技术的经修饰的病毒ad5、本技术的分离的核酸分子、本技术的载体、本技术的细胞、和/或本技术的药物组合物。
[0220]
在另一方面,本技术提供了本技术的经修饰的病毒ad5、本技术的分离的核酸分子、本技术的载体、本技术的细胞、和/或本技术的药物组合物在治疗疾病和/或病症中的用途。
[0221]
在另一方面,本技术提供了本技术的经修饰的病毒ad5、本技术的分离的核酸分子、本技术的载体、本技术的细胞、和/或本技术的药物组合物用于制备用于治疗疾病和/或病症的药物。
[0222]
例如,该方法包括以至少一种药剂的组合向有需要的受试者施用本技术的经修饰的病毒ad5,并且该药剂选自下组:抗癌剂、激动剂、拮抗剂、化疗剂和放射剂。
[0223]
例如,该疾病可以包括肿瘤。
[0224]
例如,该疾病可以包括表达αvβ6整联蛋白的肿瘤。
[0225]
例如,该疾病可以包括胰腺癌、头颈癌和/或卵巢癌。
[0226]
虽然本文已展示和描述本公开的优选实施方式,但本领域的技术人员将显而易见的是,这些实施方式仅仅通过示例的方式提供。本领域技术人员将会想到不脱离本公开的众多变化、改变和替换。应理解,本文所描述的本公开实施方式的各种替代方式可以用于实践本公开。随附权利要求书旨在限定本公开的范围,并且借此涵盖这些权利要求范围内的方法和结构以及其等效物。
[0227]
实施例
[0228]
阐述以下实施例是为了向本领域普通技术人员提供如何制造和使用本发明的完整公开和描述,并非旨在限制本发明人认为是其发明的范围,也并非旨在表示下面的实验是所有或唯一进行的实验。已努力确保所用数字(例如,数量、温度等)的准确性,但应该考虑一定的实验误差和偏差。除非另有说明,否则份数是重量份,分子量是重均分子量,温度是摄氏度,压力为大气压或接近大气压。可以使用标准缩写,例如bp:一个或多个碱基对;kb:一千或数千碱基;pl:一或数皮升;s或sec:一或数秒;min:一或数分钟;h或hr:一或数小时;aa:一个或多个氨基酸;nt:一个或多个核苷酸;i.m.:肌内(地);i.p.:腹膜内(地);s.c.:皮下(地);等等。
[0229]
产品设计与构建
[0230]
1.使用pad2d作为骨架来制成经进一步修饰的ad5病毒。
[0231]
pad2d质粒有两种修饰方案,即删除e1acr2和删除e1b19k。
[0232]
2.删除pad2d质粒中的e3bgp19k
[0233]
表达盒的设计如下(示意图见图3、图4):
[0234]
左臂-启动子-氯霉素-右臂
[0235]
2.人白细胞介素21(hil-21)和氯霉素整合到e3bgp19k区域
[0236]
表达盒的设计如下(示意图见图3、图4):
[0237]
左臂-hil-21-启动子-氯霉素-右臂
[0238]
3.纤维区域的y477a突变和tayt删除
[0239]
表达盒的设计如下(示意图见图5):
[0240]
具有y477a突变和tayt删除的纤维区域-启动子-氯霉素
[0241]
4.得到的最终产物的结构在图1中示出:
[0242]
材料和方法:
[0243]
细胞系:使用的所有肿瘤细胞系均来自atcc或由合作方提供。所有人类癌细胞系均通过str分析进行基因分型。本研究中使用的小鼠肿瘤细胞系包括:结肠直肠癌细胞系mc38来源于c57b/6小鼠。
[0244]
骨架病毒基因:删除e1acr2和e1b19k的质粒pad2d是来自合作方的赠予。
[0245]
ps-e3gp19k穿梭载体的构建:
[0246]
ps-e3gp19k穿梭载体包括靶向e3gp19k基因左侧的e3gp19k左臂和靶向e3gp19k基因右侧的e3gp19k右臂。氯霉素基因及其启动子位于e3gp19k的左臂和右臂之间。以上所有序列均由本公司拼接在一起合成,并克隆到puc57载体的ecorv位点(参见图2a)。
[0247]
ps-e3il21穿梭载体的构建:
[0248]
ps-e3il21穿梭载体包括靶向e3gp19k基因左侧的e3gp19k左臂和靶向e3gp19k基因右侧的e3gp19k右臂。人il-21基因和带有其启动子的氯霉素基因位于e3gp19k的左臂和右臂之间。人il-21基因在e3gp19k的启动子下。以上所有序列均由本公司拼接在一起合成,并克隆到puc57载体的ecorv位点(参见图2b)。
[0249]
ps-a20穿梭载体的构建:
[0250]
ps-a20穿梭载体包括具有y477a突变、tayt删除和a20插入的纤维基因。以上所有序列均由本公司拼接在一起合成,并克隆到puc57载体的ecorv位点(参见图2c)。
[0251]
同源重组:
[0252]
使用电感受态大肠杆菌bj5183细胞进行同源重组。通过ecorv限制性内切酶从各个基于puc57的结构体中实现重组穿梭表达盒片段,并从琼脂糖凝胶中纯化。通过电穿孔将pad2d和线性化穿梭表达盒片段转移到20ml电感受态bj5183细胞中,该电穿孔是在bio-rad gene pulser电穿孔仪中以2,500v、200ohm和25μl在2.0mm比色皿中进行的。立即将细胞置于500μl lb肉汤培养基中,并在37℃下培养20分钟。然后将125ml细胞悬液分别接种到四个10cm皮氏培养皿中,每个培养皿中含有l琼脂和25μg/ml氯霉素。在37℃下培养16-20小时后,每个培养皿通常得到10-25个菌落。挑选较小的菌落(其通常代表重组体)并在含有25μg/ml氯霉素的2ml l肉汤培养基中培养。使用小量提取试剂盒提取质粒。
[0253]
重组质粒的扩增
[0254]
将从bj5183细胞中提取的10ug质粒转化到含有25μg/ml氯霉素的top10化学感受态细胞中,培养18小时,然后从细菌中提取质粒。
[0255]
获得不含氯霉素的重组质粒
[0256]
使用swai限制性内切酶从重组质粒中释放氯霉素,然后纯化大片段的重组体,重新连接,然后转化到top10感受态细胞中,这些细胞在lb肉汤培养基中培养18小时,然后提取质粒。
[0257]
确认基因修饰
[0258]
使用相应引物通过dna测序对重组质粒中的基因修饰进行确认。e3测序引物:5
’‑
gggttggggttattctct-3’(seq id no.6),纤维区域测序引物:5
’‑
gacagcacaggtgccattaca3’(seq id no.7)。
[0259]
腺病毒包装
[0260]
使用paci限制性内切酶从质粒中得到腺病毒基因组,并从琼脂糖凝胶中纯化。根据制造商的说明,使用effectene转染试剂将2μg线性化腺病毒基因组转化到6孔板中的一个含有293t细胞的孔中。将转化的293t细胞置于细胞培养箱中培养10天,使腺病毒出现。
[0261]
病毒扩增:
[0262]
确认重组病毒是所需的重组病毒后,将50μl病毒裂解物添加到含有293t细胞的
t175烧瓶中,并在约30ml细胞培养基中培养至80-90%融合度。48小时后,刮去细胞和培养基并保存“原代病毒扩增物”。
[0263]
大规模病毒制备:
[0264]
将上面的原代病毒扩增物快速冷冻和解冻一次,并稀释到需要感染含有293t细胞的36个t175烧瓶(80-90%融合度)的细胞培养所需的体积。48小时后,通过刮取收获受感染的293t细胞,并通过以2,000rpm(4℃)重复离心数轮来进行收集。在pbs中洗涤沉淀物,重悬于12ml 10mm tris-hcl(ph 9)缓冲液中并储存在-80℃以供以后纯化。
[0265]
腺病毒的纯化
[0266]
如前所述。在37℃解冻病毒浓缩物,然后通过将样品在液氮和37℃水浴之间转移,另外将其冷冻/解冻2次。在6000rpm/室温下旋转病毒悬浮液10分钟。将离心管中的上清液转移到50ml管中,并立即将上清液置于cscl上来形成条带。平衡后,在15℃以25,000rpm旋转2小时。病毒应在cscl步骤之间形成条带。通常可以看到三个条带;最高的是细胞碎片,中间条带是空的腺病毒颗粒,最低的条带是成功封装的感染性颗粒。将超速离心管放在装有vikron的烧杯上方的夹具中(最好具有蓝色夹具,以便更易于看到病毒条带)。然后使用安装在10ml注射器上的19g针头,在最低条带的正下方(下方约1cm)刺穿离心管,请注意只刺穿其中一侧。然后在最少量的cscl中小心取出病毒条带,并转移到带标记的15ml管中。将所有条带合并后,将其分层到1/2x2"离心管(小贝克曼管)中的2.5ml 1.35g/ml cscl溶液上。根据合并后总体积,这可以在两个或三个超速离心管之间平均分配。这些试管如之前般平衡,然后在optima le-80k超速离心机中,使用beckman sw55ti摆动转子组合在15℃以40,000rpm旋转15小时(过夜)。如之前般收集病毒条带(应位于管中心),然后转移到带标记的15ml管中。如果少量病毒仅补足至9ml,则用tsg(大约2-3倍稀释)将体积补足至12ml。对于每个已进行旋转的管,使用新的针头和新的注射器。然后,使用提供的18g(绿色尖头)针头和20ml注射器,将病毒/tsg混合物注入到slide-a-lyzer透析盒(粉色透析盒)中。将病毒从12ml管转移到小型烧杯中,否则注射器过大。在注射病毒时,还需要从slide-a-lyzer透析盒中去除多余的空气,这是使用放置在其余三个注射端口之一中的注射器完成的。每个端口只能使用一次;因此,使用时需要对每个端口进行标记。小心地注射所有收获的病毒后,取下注射器并丢弃到可高压灭菌的锐器箱中。病毒周围的透明膜具有半透性,因此透析缓冲液可以进出该膜,而病毒却不能。这一步是将病毒放置在正确的储存缓冲区中。然后将slide-a-lyzer透析盒放置在合适大小的浮子中并转移到含有21份透析溶液的51烧杯中(见下文)。然后将烧杯放置在冷藏室中的磁力搅拌器上并让病毒透析24小时。将slide-a-lyzer透析盒倒置在缓冲液中,浮在上面,检查缓冲液是否被不时地搅拌。透析后,将slide-a-lyzer透析盒转移到组织培养罩中,使用注射器取出病毒并转移到带标记的15ml管(橙色帽)中。将整个病毒分装成1ml等分试样,在试管上标记病毒名称、日期(用作批号)、体积和首字母缩写。将等分试样储存在-80℃冰箱中。稍后使用一小份进行病毒验证(表征),以确定颗粒计数(用于tcid50)。
[0267]
腺病毒的滴定
[0268]
以每孔1
×
104个293t细胞接种到96孔板中。纯化后的病毒连续10倍稀释至10-12稀释度。开始滴定,取10-6稀释度的稀释病毒,向96孔板的每孔加入20ul,一共一整排12个孔。10-12稀释度是用于滴定的最低稀释度。
[0269]
酶联免疫吸附试验:
[0270]
根据试剂制造商的说明,通过酶联免疫吸附试验(elisa)对hil-21的表达进行检测。
[0271]
病毒复制的测定:
[0272]
根据生长速率,将细胞以每孔2
×
105至4
×
105个细胞接种在含有细胞培养基的6孔板的3个孔中,并在第二天以每个细胞1pfu病毒进行感染。分别在感染后24小时、48小时和72小时收集感染的细胞及其培养液。然后确定病毒浓度。
[0273]
体外病毒细胞毒性评价:
[0274]
根据生长速率,以每孔1
×
103和1
×
104个细胞将细胞接种在96孔板中,并在16-18小时后用病毒感染。在病毒感染后的第6天,通过mts试验确定细胞活力,并如前所述计算ec50值(病毒剂量杀死50%的肿瘤细胞),所有试验至少进行3次。
[0275]
比较不同advs的体内功效实验:
[0276]
通过皮下注射1
×
106至5
×
106个癌细胞,在每个治疗组10只小鼠的背部皮下形成肿瘤,直径为0.4-0.5cm,小鼠然后按肿瘤大小重新分组并在第1天、第2天、第3天、第4天和第5天接受1
×
108pfu(免疫能力强的小鼠)或pbs。每周测量两次肿瘤体积(体积=(长
×
宽2
×
π)/6),直到肿瘤面积达到1.69cm2时处死小鼠。使用的小鼠为4-5周的balb/c和c57bl/6品系雄性小鼠。
[0277]
统计分析:
[0278]
除非另有说明,否则使用graphpad prism 5进行比较统计分析。使用非配对t检验进行双重条件比较。对于多个条件的附加变量,分别执行1或2次单因素方差分析(anova)。生存数据表示为kaplan-meier图,其中采用对数秩分析来绘制各组之间的任何差异是否具有统计学意义。
[0279]
构建缺失三个区域的ad5突变体
[0280]
使用携带缺失e1acr2和e1b19k的ad5基因组的载体pad2d为骨架,进行e3b gp19k基因的删除。使用限制性内切酶ecorv从puc57的克隆载体中释放由靶向e1b19k基因左侧的左臂、氯霉素和e3b gp19k基因右侧组成的表达盒,并从琼脂糖凝胶中纯化。通过电穿孔将pad2d和线性化穿梭片段转移到20ml电感受态大肠杆菌bj5183细胞中,电穿孔是在bio-rad gene pulser电穿孔仪中以2,500v、200ohm和25μf在2.0mm比色皿中进行的。立即将细胞置于500μl lb肉汤培养基中,并在37℃下培养20分钟。然后将125ml细胞悬液分别接种到四个10cm皮氏培养皿中,每个培养皿中含有l琼脂和25μg/ml氯霉素。在37℃下培养16-20小时后,每个培养皿通常得到10-25个菌落。挑选较小的菌落(其通常代表重组体)并在含有25μg/ml氯霉素的2ml l肉汤培养基中培养。使用小量提取试剂盒提取质粒,将10ug质粒转化到含有25μg/ml氯霉素的top10化学感受态细胞中,培养18小时,然后从细菌中提取质粒。使用swai限制性内切酶从结构体中释放氯霉素,然后纯化大片段的重组体,重新连接,然后转化到top10感受态细胞中,这些细胞在lb肉汤培养基中培养18小时,然后提取质粒。通过dna测序确认了重组体中的e3b gp19k基因已删除。
[0281]
构建缺失三个区域并备有人il-21的ad5突变体
[0282]
使用携带缺失e1acr2和e1b19k的ad5基因组的载体pad2d作为骨架,用人il-21取代e3b gp19k基因。使用限制性内切酶ecorv从puc57的克隆载体中释放由靶向e1b19k基因
左侧的左臂、人il-21、氯霉素和e3b gp19k基因右侧组成的表达盒,并从琼脂糖凝胶中纯化。通过电穿孔将pad2d和线性化穿梭片段转移到20ml电感受态大肠杆菌bj5183细胞中,电穿孔是在bio-rad gene pulser电穿孔仪中以2,500v、200ohm和25μf在2.0mm比色皿中进行的。立即将细胞置于500μl lb肉汤培养基中,并在37℃下培养20分钟。然后将125ml细胞悬液分别接种到四个10cm皮氏培养皿中,每个培养皿中含有l琼脂和25μg/ml氯霉素。在37℃下培养16-20小时后,每个培养皿通常得到10-25个菌落。挑选较小的菌落(其通常代表重组体)并在含有25μg/ml氯霉素的2ml l肉汤培养基中培养。使用小量提取试剂盒提取质粒,将10ug质粒转化到含有25μg/ml氯霉素的top10化学感受态细胞中,培养18小时,然后从细菌中提取质粒。使用swai限制性内切酶从结构体中释放氯霉素,然后纯化大片段的重组体,重新连接,然后转化到top10感受态细胞中,这些细胞在lb肉汤培养基中培养18小时,然后提取质粒。通过dna测序确认重组体中e3b gp19k基因被人il-21取代。
[0283]
构建的缺失三个区域并备有人il-21、y477a、del tayt、ad5-3del-a20t的ad5突变体也可以命名为kmad1。
[0284]
kmad1已于2020年3月25日收藏于cctcc,cctcc编号为v202024。kmad1已保存在表达αvβ6整联蛋白的宿主细胞中,例如人胰腺癌细胞suit-2。并且在包含10%胎牛血清的dmem细胞培养基中对人胰腺癌细胞suit-2进行培养。
[0285]
使用携带缺失e1acr2和e1b19k的ad5基因组、e3b gp19k被人il-21取代的载体pad2d作为骨架,用于构建具有y477a、deltayta20的重组体。使用限制性内切酶ecorv从puc57的克隆载体中释放由靶向纤维基因左侧的左臂、y477a突变、tayt缺失和a20肽、氯霉素和e3b gp19k基因右侧组成的表达盒,并从琼脂糖凝胶中纯化。通过电穿孔将pad2d和线性化穿梭片段转移到20ml电感受态大肠杆菌bj5183细胞中,电穿孔是在bio-rad gene pulser电穿孔仪中以2,500v、200ohm和25μf在2.0mm比色皿中进行的。立即将细胞置于500μl lb肉汤培养基中,并在37℃下培养20分钟。然后将125ml细胞悬液分别接种到四个10cm皮氏培养皿中,每个培养皿中含有l琼脂和25μg/ml氯霉素。在37℃下培养16-20小时后,每个培养皿通常得到10-25个菌落。挑选较小的菌落(其通常代表重组体)并在含有25μg/ml氯霉素的2ml l肉汤培养基中培养。使用小量提取试剂盒提取质粒,将10ug质粒转化到含有25μg/ml氯霉素的top10化学感受态细胞中,培养18小时,然后从细菌中提取质粒。使用swai限制性内切酶从结构体中释放氯霉素,然后纯化大片段的重组体,重新连接,然后转化到top10感受态细胞中,这些细胞在lb肉汤培养基中培养18小时,然后提取质粒。通过dna测序确认重组体中e3b gp19k基因被人il-21取代。
[0286]
实施例
[0287]
实施例1通过对照病毒结构体pad-c中的dna测序确认e3gp19k已删除
[0288]
图10显示了对照病毒结构体pad-c中的e3gp19k已删除,通过dna测序进行确认。
[0289]
实施例2对照病毒结构体pad-c的修饰
[0290]
图11的测序结果示出了对照病毒结构体pad-c中y477a突变、tayt删除。图13为在对照病毒结构体ad-c中使用swai限制性内切酶去除氯仿后的测序结果。
[0291]
实施例3将人il-21基因插入到病毒结构体pad3d-hil21中腺病毒基因组的e3gp19k区域
[0292]
图14示出了人il-21基因取代腺病毒基因组的e3gp19k区域。去除氯仿后,在病毒
结构体pad-il21中留下了额外的序列atttaaat(图18)。
[0293]
实施例4病毒结构体pad3d-hil21的修饰
[0294]
测序结果证实了y477a突变、tyat删除和a20插入(图16、图17)。
[0295]
去除氯仿后,在病毒结构体pad-il21中留下了额外的序列ataat(图15)。
[0296]
实施例5hil-21在经修饰的腺病毒中的表达
[0297]
通过elisa在来自ad-hil-21、ad-hil-21-a20病毒的细胞培养基中测量hil-21的表达(图19)。
[0298]
实施例6对照病毒和a20病毒感染αvβ6整联蛋白阴性或阳性肿瘤细胞
[0299]
实施例7本技术的经修饰的病毒ad5能够特异性靶向并杀死肿瘤细胞
[0300]
经修饰的病毒ad5 kmad1转染多种肿瘤细胞,未施用病毒的肿瘤细胞作为对照。
[0301]
温育3天后,细胞用结晶紫染色,结果在图20中示出。结果显示本技术的经修饰的病毒ad5能够特异性结合和/或杀死αvβ6整联蛋白阳性肿瘤细胞。
[0302]
虽然本文已展示和描述本发明的优选实施方式,但本领域技术人员将显而易见的是,这些实施方式仅仅通过示例的方式提供。本发明不受说明书中提供的具体实施例的限制。虽然已参考前述说明书对本发明进行描述,但本文中对实施方式的描述和示例并非是限制性。在不脱离本发明的情况下,本领域技术人员将会想到诸多变型、变化和替换。此外,将理解的是,本发明的所有方面均不限于本文所阐述的具体叙述、配置或相对比例,这些取决于各种条件和变量。应理解的是,可以采用本文所描述的本发明实施方式的各种替代方式来实践本发明。因此,设想本发明应同样涵盖任何此类替代方式、修改、变型或等效物。随附权利要求书旨在限定本发明的范围,并且借此涵盖这些权利要求的范围内的方法和结构及其等效物。
[0303]
前述详细说明是以解释和举例的方式提供的,并非要限制所附权利要求的范围。目前本技术所列举的实施方式的多种变化对本领域普通技术人员来说是显而易见的,且保留在所附的权利要求和其等同方式的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。