1.本技术涉及细胞培养技术领域,特别是涉及一种用于细胞培养的微载体及其制备方法。
背景技术:
2.细胞大规模培养是生物制药行业的基础技术,悬浮细胞的大规模培养相对较为简单,直接将细胞置于培养液中进行悬浮培养即可。但是,并非所有细胞都可以悬浮培养;实际上,对于大部分动物细胞而言,都需要贴壁培养。贴壁细胞的大规模培养则较为复杂,要么将贴壁细胞驯化为悬浮培养,要么提供足够大的表面积使之贴壁生长。后者有两种技术路线:一种方案是,增大培养皿的表面积,例如赛默飞的细胞工厂,是3-5层的培养皿叠加而成;另一种方案是,用微载体提供更大的贴附面积。
3.所谓微载体,实际上就是细小的微球,让贴壁细胞贴附在微球的表面进行贴壁培养和生长,而作为微载体的微球本身则是悬浮或分散在生物反应器中,起到类似悬浮培养的效果,从而可以在大规模的生物反应器中培养。目前,市面上现有的微载体一般有塑料微球(如聚苯乙烯)、胶原蛋白微球、水凝胶微球等。
4.现有的微载体都是有机材料为基础,存在以下缺点或不足:(1)会产生有环境污染的垃圾,例如,比较常见的塑料微球微载体,使用完成后,会产生塑料垃圾;有例如,水凝胶微球微载体,其在水凝胶的制作过程中就会产生垃圾。(2)成本高,无论是塑料微球、水凝胶微球,还是胶原蛋白微球,都是需要进行特殊的生产加工,增加了细胞培养的成本。(3)现有的微载体,在换液时比较麻烦,需要先离心或通过截留装置截留微载体,去除培养液后,再更换新的培养液,操作繁琐。(4)不适合普通小规模的细胞培养,例如六孔板、10cm培养皿、t75培养瓶等。
5.因此,如何研发一种更环保、低成本的细胞培养微载体,仍然是细胞培养技术领域的研究重点。
技术实现要素:
6.本技术的目的是提供一种新的用于细胞培养的微载体及其制备方法。
7.为了实现上述目的,本技术采用了以下技术方案:本技术的一方面公开了一种用于细胞培养的微载体,该微载体为天然或半天然的无机颗粒;天然或半天然的无机颗粒选自以下材料中的至少一种:(1)细沙;(2)岩石、矿石、硅藻土、贝壳、蛋壳、螺壳、海星骨骼和珊瑚骨骼中的至少一种研磨而成的颗粒;(3)石英砂或漂珠。
8.其中,贝壳、螺壳和珊瑚骨骼等物质中可能含有少量有机物质,但是仍然是以无机物质为主;因此,本技术将其研磨获得的颗粒统一称为无机颗粒。本技术中,岩石是由一种
或几种矿物和天然玻璃组成的,具有稳定外形的固态集合体;矿石是指可从中提取有用组分或其本身具有某种可被利用的性能的矿物集合体;漂珠包括灰漂珠和白漂珠。
9.需要说明的是,本技术的关键在于,创造性的发现天然或半天然的无机颗粒可以直接或者经过简单的研磨加工后作为细胞培养的微载体。本技术采用天然或半天然的无机颗粒作为微载体,材料来源广、价格低;并且,更为重要的是,由于都是天然或半天然的材料,极大的减少了污染,例如避免了制备过程的污染,使用完成后,这些天然或半天然的材料本身也不会对环境造成污染。此外,本技术的一种实现方式中,例如采用海沙作为微载体,可以很方便的适用于小规模的细胞培养体系,如小规模的微孔板培养。本技术的一种实现方式中,具体是在48孔板中进行培养,可以理解,既然能够适用于48孔板,自然也能够适用于更大孔或体积的六孔板、10cm培养皿、t75培养瓶等。
10.本技术的一种实现方式中,细沙为海沙或河沙。
11.本技术的一种实现方式中,矿石为钾长石、白云石和方解石中的至少一种。
12.本技术的一种实现方式中,天然或半天然的无机颗粒的粒径为1μm-5mm。
13.本技术的一种实现方式中,微载体由天然或半天然的无机颗粒经过促贴附处理而成;促贴附处理包括,采用含有促进细胞贴壁的物质的溶液对天然或半天然的无机颗粒进行恒温浸泡,浸泡完成,即获得本技术的微载体。
14.需要说明的是,本技术的关键在于研究发现,天然或半天然的无机颗粒能够作为细胞培养的微载体;在本技术的一种实现方式中,直接采用天然或半天然的无机颗粒即可实现细胞的贴壁培养;但是,为了提高培养效率和质量,本技术的一种优选方案中,优选的对无机颗粒进行促贴附处理后,在作为微载体使用。促贴附处理,主要是利用促进细胞贴壁的物质对无机颗粒进行表面改性,使得细胞能够更好的贴附在无机颗粒表面。其中,促进细胞贴壁的物质可以参考现有技术,包括但不仅限于多聚赖氨酸、胶原蛋白。
15.本技术的另一面公开了一种天然或半天然的无机颗粒作为细胞培养的微载体的应用或在制备细胞培养的微载体中的应用,该天然或半天然的无机颗粒选自以下材料中的至少一种:(1)细沙;(2)岩石、矿石、硅藻土、贝壳、蛋壳、螺壳、海星骨骼和珊瑚骨骼中的至少一种研磨而成的颗粒;(3)石英砂或漂珠。
16.本技术的应用中,细沙为海沙或河沙。
17.本技术的应用中,矿石为钾长石、白云石和方解石中的至少一种。
18.本技术的应用中,天然或半天然的无机颗粒的粒径为1μm-5mm。
19.需要说明的是,本技术的应用,在将无机颗粒制成微载体时,除了需要进行简单的研磨、过筛、清洗、灭菌以外,还可以对无机理解进行促贴附处理,以增强细胞贴壁的效率和质量。
20.本技术的再一面公开了本技术的微载体的制备方法,包括获取天然或半天然的无机颗粒,根据所需的粒径大小,对无机颗粒进行过筛;对过筛获得的所需粒径大小的无机颗粒进行清洗、灭菌,即获得作为微载体的无机颗粒。
21.需要说明的是,本技术的制备方法中,获取天然或半天然的无机颗粒,如果是细
沙、石英砂或漂珠,可以直接获取进行过筛即可,如果是岩石、矿物质、贝壳、蛋壳、螺壳和珊瑚骨骼等,则需要预先进行简单的研磨,然后在进行过筛。至于研磨的参数,以能够获得足够量的所需尺寸的无机颗粒为准,在此不作具体限定。至于清洗和灭菌,主要是考虑无机颗粒为天然或半天然材料,清洗去除其他杂质,并通过灭菌确保细胞培养不受其他微生物的污染。
22.本技术的一种实现方式中,本技术的制备方法还包括对灭菌后的无机颗粒进行促贴附处理,具体的,促贴附处理包括,采用含有促进细胞贴壁的物质的溶液对天然或半天然的无机颗粒进行恒温浸泡,浸泡完成,即获得本技术的微载体。
23.本技术的一种实现方式中,恒温浸泡的温度为37℃,浸泡时间为至少10h。
24.需要说明的是,促贴附处理的主要作用是,使促进细胞贴壁的物质能够吸附或修饰在无机颗粒表面,在细胞培养时,起到促进细胞贴壁的作用。因此,具体的恒温浸泡温度和浸泡时间,可以根据所采用的无机颗粒和促进细胞贴壁的物质而定。
25.本技术的一种实现方式中,促贴附处理还包括,浸泡完成后,采用pbs溶液对浸泡后的无机颗粒进行清洗。
26.本技术的一种实现方式中,对过筛获得的所需粒径大小的无机颗粒进行清洗,包括水洗、酸洗和碱洗中的至少一种。
27.由于采用以上技术方案,本技术的有益效果在于:本技术用于细胞培养的微载体,直接采用天然或半天然的无机颗粒,材料来源广、价格低、污染小;并且,能够适用于小规模的细胞培养;为细胞贴壁培养提供了一种新的方案和途径。
附图说明
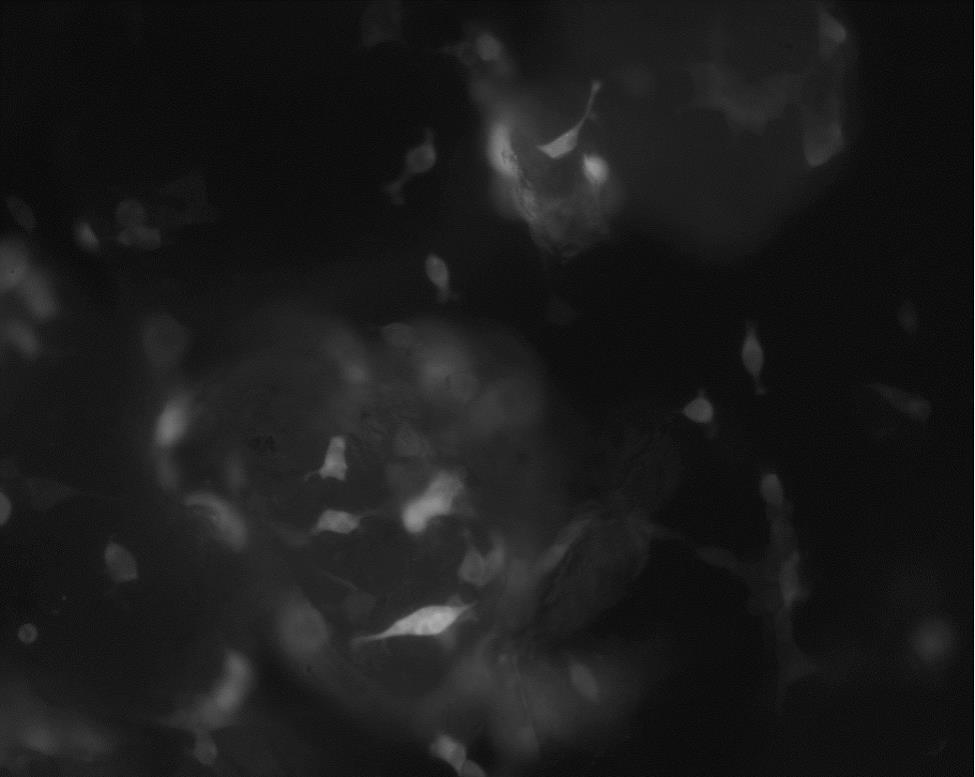
28.图1为本技术实施例中海沙微载体的细胞培养显微镜观察结果图;图2为本技术实施例中漂珠微载体的细胞培养显微镜观察结果图;图3为本技术实施例中硅藻土微载体的细胞培养显微镜观察结果图;图4为本技术实施例中钾长石微载体的细胞培养显微镜观察结果图。
具体实施方式
29.现有的微载体主要是采用有机材料制备,微载体的制备或者使用都会产生垃圾,且成本高。本技术创造性的发现,一些天然材料,例如细沙(包括海沙、河沙等),岩石、矿石、硅藻土、贝壳、蛋壳、螺壳、海星骨骼和珊瑚骨骼等研磨的颗粒,以及半天然材料,如石英砂、漂珠等,也可以作为细胞培养的微载体;这些天然或半天然的无机颗粒直接过筛、清洗、灭菌后即可使用,材料来源广、获取容易、成本低,为细胞培养提供了一种新的方案和途径。
30.下面通过具体实施例对本技术作进一步详细说明。以下实施例仅对本技术进行进一步说明,不应理解为对本技术的限制。
31.实施例一本例采用海沙进行细胞培养试验,试验用海沙为取自深圳市杨梅坑的过30-60目网筛的海沙,过筛的海沙用自来水清洗干净后,蒸馏水清洗3遍,160℃干热灭菌2小时后备用。试验用培养细胞为稳定表达增强型绿色荧光蛋白标记的293t细胞(293t-egfp),293t细
胞购自于武汉普诺赛生命科技有限公司,293t-egfp稳转细胞株以表达egfp的piggybac转座子转染构建。
32.取0.05ml海沙,加3000个稳定表达增强型绿色荧光蛋白标记的293t细胞(293t-egfp),例如密度为10万个/ml的细胞悬浮液,取30微升,混合均匀后在1.5毫升离心管内,37℃孵育4小时后全部转入48孔板培养的一个微孔中,该微孔中预先加入培养基0.5毫升,培养基为dmem高糖培养基加10%胎牛血清。将48孔板置于37℃静置培养,培养环境的co2浓度为5%。培养5天后,用奥林巴斯ix51倒置相差荧光显微镜拍照,观察细胞在海沙上的生长情况。
33.细胞生长的部分显微镜拍照结果如图1所示。图1的结果显示,稳定表达egfp的293t细胞与30-60目海沙共培养5天后,可见细胞已经贴附在海沙上生长;因此,海沙能够作为细胞培养微载体使用。
34.实施例二本例采用不同目数的海沙进行细胞培养试验,海沙来源与实施例一相同,都是取自于深圳市杨梅坑的海沙,本例采用细胞与实施例一相同。具体的,不同目数的海沙分别为,用不同目数筛选为小于60目,60-75目,75-100目,100-150目及大于150目的海沙,所有海沙用自来水清洗干净后,蒸馏水清洗3遍,160℃干热灭菌2小时后备用。并设置不添加海沙的培养组作为对照。
35.每组设置3个孔,每孔分别取各组海沙0.05ml,分别加50000个稳定表达增强型绿色荧光蛋白标记的293t细胞(293t-egfp),例如密度为100万个/ml的细胞悬浮液,取50微升,混合均匀后在1.5毫升离心管内,37℃孵育4小时后全部转入48孔板培养的一个微孔中,该微孔中预先加入培养基0.5毫升,培养基为dmem高糖培养基加10%胎牛血清。将48孔板置于37℃静置培养,培养环境的co2浓度为5%。培养7天后,用胰酶消化收集细胞计数,台盼蓝染色计算细胞活率。具体的,吸去培养基之后,以0.5毫升pbs清洗一遍,加入0.1毫升的0.25%胰酶,37度孵育5分钟,然后加入0.2毫升完全培养基终止消化,充分吹打均匀后,取20微升细胞悬浮液,加20微升0.04%的台盼蓝,混合均匀后等3分钟取20微升于血细胞计数板上制片计数活细胞和死细胞数目,并计算出细胞活率。
36.各组海沙3孔的细胞计数和活率的平均值如表1所示。
37.表1293t细胞在不同目数海沙共培养时的细胞增长情况
材料无海沙小于60目60-75目75-100目100-150目大于150目接种细胞293t293t293t293t293t293t接种细胞(万/孔)0.355555收获细胞(万/孔)1547.547.530.533.525.2活率(%)9997.498.398.410096
需要说明的是,无海沙组只接种3000个细胞是因为由于没有海沙,48孔板的孔表面积较小,如果接种5万或3万个细胞,则很快长满。经多次试验发现,对于无海沙的微孔接种3000个细胞,在相同的培养时间内,长满的时间和程度与其他微孔相当。本例只是比较最终能够获得的细胞的数量。
38.表1的结果显示,大部分海沙里面细胞的增长倍数为6-10倍,且细胞总数超过了没有海沙的孔,因为海沙提供了额外的生长面积。而无海沙组,由于微孔的表面积较小,虽然
生长速度较快,但是最终能够收获的细胞数量少很多。表1的结果显示,60目左右的海沙更利于细胞生长;海沙粒径太大,如果大到影响整体表面积的程度,则会减少细胞数量;海沙粒径太小,例如大于150目,虽然整体表面积增加,但是最终收获的细胞数量减少,分析可能的原因是,海沙粒径太少导致海沙之间的间隙减小,阻碍营养物质的交换,从而导致收获的细胞数量减少。
39.实施例三本例分别采用不同的无机颗粒进行细胞培养试验,具体的,分别取不同目数河沙、石英砂、钾长石、白云石、方解石、漂珠、硅藻土按照实施例一的方法清洗干净,灭菌后备用。
40.其中,钾长石、白云石、方解石、硅藻土等需研磨后,过筛获得相应目数的无机颗粒。
41.每组设置3个孔,每孔分别取各组无机颗粒0.05ml,加50000稳定表达增强型绿色荧光蛋白标记的293t细胞(293t-egfp),例如密度为100万个/ml的细胞悬浮液,取50微升,混合均匀后在1.5毫升离心管内,37℃孵育4小时后全部转入48孔板培养的一个微孔中,该微孔中预先加入培养基0.5毫升,培养基为dmem高糖培养基加10%胎牛血清。将48孔板置于37℃静置培养,培养环境的co2浓度为5%。培养5天后,采用实施例二相同的方法进行胰酶消化和台盼蓝染色计算细胞活率。并采用奥林巴斯ix51倒置相差荧光显微镜观察细胞的生长情况。
42.各组3孔无机颗粒的细胞数目和活率的平均值如表2所示,部分显微镜观察结果如图2至图4所示。图2为漂珠作为微载体的细胞培养结果图,图3为硅藻土作为微载体的细胞培养结果图,图4为钾长石作为微载体的细胞培养结果图。
43.表2293t细胞在不同的无机物颗粒共培养时的细胞增长情况
材料河沙60-75目石英砂60-75目钾长石60-75目白云石75-100目方解石75-100目漂珠75-150目硅藻土75-100目接种细胞(万/孔)5555555收获细胞(万/孔)46.85348.585464446.5活率(%)9810095.897.69997.796.8
表2的结果显示,293t细胞可以贴附在不同的无机物颗粒表面生长,因而这些颗粒可以作为293t细胞贴壁培养的微载体。图2至图4的结果显示,稳定表达egfp的293t细胞与灰漂珠、硅藻土和钾长石共培养5天后,可见细胞已经贴附在相应颗粒上生长。其余无机颗粒作为微载体进行细胞培养5天后,其显微镜观察结果也能够明显看到细胞已经贴附在相应颗粒上生长。
44.实施例四本例分别采用不同的细胞,在海沙微载体中进行细胞培养。本例的海沙与实施例一相同,即30-60目海沙按照实施例一的方法清洗干净,灭菌后备用。本例的细胞分别为293a、c2c12细胞、cho细胞和hela细胞,细胞都是购自于武汉普诺赛生命科技有限公司。
45.每组3孔,每孔取0.05ml海沙,总计为4组,每组每孔分别加50000个293a、c2c12细胞、cho细胞和hela细胞,混合均匀后在1.5毫升离心管内,37℃孵育4小时后转入48孔板培养,微孔中预先加入培养基0.5毫升,培养基为dmem高糖培养基加10%胎牛血清。将48孔板置于37℃静置培养,培养环境的co2浓度为5%。培养7天后,采用实施例二相同的方法进行细胞活率计算。
46.各组的细胞计数和活率均值如表3所示。
47.表3293t细胞在不同的无机物颗粒共培养时的细胞增长情况材料海沙30-60目海沙30-60目海沙30-60目海沙30-60目接种细胞(5万/孔)293ac2c12chohela收获细胞(万/孔)36.2285225活率(%)98.510099.8100表3的结果显示,除了293t细胞之外,293a细胞、c2c12、cho、hela细胞等多种常见的哺乳动物细胞都可以贴附在海沙上面生长;由此可见,海沙可以作为多种细胞的微载体。
48.实施例五本例分别采用贝壳、鸡蛋壳、海螺壳、海星骨骼和珊瑚骨骼研磨的颗粒作为微载体,进行细胞培养试验。本例具体的,研磨完成后,过筛获得30-60目的粉末,用自来水清洗干净后,用0.15m的稀盐酸60℃浸泡一小时,然后去掉稀盐酸,自来水冲洗干净,再用1m的naoh在60℃浸泡1小时,去掉naoh,自来水冲洗5遍,蒸馏水清洗3遍,160℃干热灭菌2小时后备用。
49.每组3孔,每孔取各组颗粒0.05ml,分别加50000个稳定表达增强型绿色荧光蛋白标记的293t细胞(293t-egfp)混合均匀后在1.5毫升离心管内,37℃孵育4小时后转入48孔板培养,微孔中预先加入培养基0.5毫升,培养基为dmem高糖培养基加10%胎牛血清。将48孔板置于37℃静置培养,培养环境的co2浓度为5%。培养7天后,采用实施例二相同的方法进行胰酶消化和台盼蓝染色计算细胞活率。
50.各组微载体的细胞计数和活率均值如表4所示。
51.表4细胞在含有微量有机物的天然材料做成的微载体中的增长情况材料贝壳粉鸡蛋壳海星骨骼珊瑚骨骼海螺壳接种细胞(万/孔)55555收获细胞(万/孔)3835564829活率(%)100999897.2100表4的结果显示,293t细胞可以贴附在贝壳粉、鸡蛋壳、海星骨骼、珊瑚骨骼、海螺壳的微粒上面生长,因而这些材料也都可以作为293t细胞贴壁培养的微载体。
52.实施例六本例在实施例一的基础上,对海沙进行促贴附处理,然后采用促贴附处理的海沙作为微载体进行细胞培养试验。
53.具体的,取100目的海沙,自来水清洗干净后,用0.15m的稀盐酸60℃浸泡1小时,然后去掉稀盐酸,自来水冲洗干净,再用1m的naoh于60℃浸泡1小时,去掉naoh,自来水冲洗5遍,蒸馏水清洗3遍,160℃干热灭菌2小时后备用。
54.取两组0.5ml的海沙,分别加入无菌的1mg/ml、10mg/ml的多聚赖氨酸溶液1ml,37℃孵育过夜,之后去掉多聚赖氨酸溶液,pbs清洗三次备用。取未用多聚赖氨酸包被的海沙、用1mg/ml多聚赖氨酸包被的海沙、10mg/ml多聚赖氨酸包被的海沙加入48孔板,每组3孔每孔分别放入对应处理的海沙0.05ml,加20000个稳定表达标记细胞核的红色荧光蛋白293t细胞(293t-nls.mscarlet-i),加0.5毫升dmem高糖培养基加10%胎牛血清,混合均匀后放入37℃、5%的co2培养箱培养,3天后拍照观察细胞贴附情况,培养7天后,采用实施例二相同的方法进行胰酶消化和台盼蓝染色计算细胞活率。结果如表5所示。
55.表5细胞在经过促贴附处理的海沙表面增长倍数
材料无促贴附处理多聚赖氨酸促贴附处理(1mg/ml)多聚赖氨酸促贴附处理(10mg/ml)接种细胞(万/孔)222收获细胞(万/孔)38.345.656活率(%)95.69899.3
表5的结果显示,经过3天的培养之后,经过促贴附处理的海沙有较多的细胞停留在顶部,细胞在整个沙粒表面分布更为均匀,而未经促贴附处理的海沙大部分细胞停留在底部,而顶部很少。因此,经过7天的培养后,未经贴附处理的沙子底部完全长满,细胞增长受限,而经过促贴附处理的海沙细胞有更大的生长面积,因而细胞增长倍数更高。
56.以上内容是结合具体的实施方式对本技术所作的进一步详细说明,不能认定本技术的具体实施只局限于这些说明。对于本技术所属技术领域的普通技术人员来说,在不脱离本技术构思的前提下,还可以做出若干简单推演或替换。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。