1.本发明涉及生物医药技术领域,具体涉及一种鼻黏膜的体外培养方法和培养液。
背景技术:
2.鼻腔作为吸入空气的主要通道,它不仅充当前线呼吸防御机制,还是呼吸道病原体感染与复制的主要场所。从解剖学上讲,人类的鼻腔里有一层一种假复层纤毛上皮,散布有微管蛋白 分泌粘液的杯状细胞,由基底细胞分化而来来自p63 上皮的干细胞层。人鼻粘膜上皮是多种上呼吸道病毒易感组织。
3.现有技术中,鼻腔的病毒感染研究通常是用动物模型完成,通过小鼠、兔等动物感染病毒后,处死后观察鼻腔的病理改变。但是,由于有的病毒呈现种属特性,如新冠病毒,易感染人类。如果用动物实验,难以复制人鼻黏膜的病毒感染情况。如果用人体进行实验,则违反伦理。如果采用鼻黏膜进行实验,往往离体后短时间就出现组织细胞死亡,根本无法完成感染的实验过程。
4.因此,亟需一种鼻黏膜离体存活系统,能够顺利进行鼻黏膜病毒感染,完成实验过程。
技术实现要素:
5.本发明的目的是提供一种鼻黏膜的体外培养方法,以及用于体外培养的培养液,本发明提供的培养液和培养方法可将鼻黏膜进行体外培养,可以保持至少2周的活性,并拥有完整的上皮屏障与免疫系统,能够复制人体内的病毒感染过程,从而可以实现离体鼻黏膜病毒感染实验。
6.本发明采用的技术方案是提供一种鼻黏膜的体外培养液,所述培养液的成分包括:
[0007][0008]
优选所述培养液的成分由以下组分组成:
[0009][0010][0011]
优选地,所述dmem/f12培养基中含有l-谷氨酰胺和15mm hepes缓冲剂。
[0012]
优选地,所述wnt/β-catenin信号通路激活剂为r-spondin1蛋白、wnt-3a蛋白、fh535中的一种或多种,wnt/β-catenin信号通路激活剂是促分化、诱导更新的生长因子。优选为r-spondin1蛋白。
[0013]
优选地,所述成纤维细胞生长因子为fgf7、fgf10、fgf-4中的一种或两种,成纤维细胞生长因子可以促进上皮细胞生长。
[0014]
优选地,所述tgf-β抑制剂为noggin、a83-01、compound c dihydrochloride中的
一种或两种,其中,优选noggin是骨形态发生蛋白的内源性抑制剂,a83-01是tgf-βⅰ型受体抑制剂,调节细胞分化、增殖和凋亡。
[0015]
优选地,所述rock抑制剂包括y27632、s1049y-27632 2hcl、zinc00881524、gsk269962a、m20594、y-33075中的一种或多种,优选y27632。rock抑制剂可防止细胞凋亡。
[0016]
优选地,所述p38 mapk抑制剂包括sb202190、sb431542、birb796中的一种或多种,优选sb202190。p38 mapk抑制剂诱导细胞分化。
[0017]
优选地,所述无血清添加剂为b27,可抗氧化。
[0018]
n-乙酰半胱氨酸可以抗氧化损伤,抗坏死。
[0019]
烟酰胺/维生素b3是辅酶前体,可调节蛋白、糖代谢。
[0020]
glutamax添加剂为二肽营养素,为细胞生长提供营养。
[0021]
抗生素青霉素、链霉素、primocin可杀灭细菌和真菌。
[0022]
进一步地,优选所述鼻黏膜的体外培养液的成分包括:
[0023]
更优选地,所述鼻黏膜的体外培养液的成分包括:
[0024]
[0025][0026]
本发明还提供了一种利用所述体外培养液体外培养鼻黏膜的方法,所述方法包括以下步骤:
[0027]
步骤(1):组织收集;
[0028]
将鼻黏膜离体后,浸泡在生理盐水中保存;
[0029]
步骤(2):清洗;
[0030]
用磷酸盐缓冲液(pbs)清洗离体的鼻粘膜,除去血块、粘液和骨片;
[0031]
步骤(3):培养液中培养;
[0032]
将清洗后的鼻黏膜置入体外培养液中,在细胞培养箱中培养。体外培养的鼻黏膜组织可进行后续实验。
[0033]
优选地,所述步骤(1)中,鼻黏膜浸泡在生理盐水中保存的时间小于6小时
[0034]
优选地,所述步骤(3)中,鼻黏膜离体后12小时内尽快置入体外培养液中培养。
[0035]
优选地,所述步骤(3)中,细胞培养箱中的培养环境为37℃、5%co2。
[0036]
优选地,所述步骤(2)中,以鼻黏膜的完整性作为活性标准,在显微镜下观察到纤毛摆动,视为上皮细胞仍有活性。在本发明的培养液中,鼻黏膜可体外培养2周,仍然完整有活性。
[0037]
优选地,本发明提供的体外培养的鼻黏膜,可用于体外病毒感染实验。
[0038]
本发明还提供了一种利用体外培养的鼻黏膜进行体外病毒感染实验的方法,所述体外培养的鼻黏膜利用上述的鼻黏膜的体外培养液进行体外培养。
[0039]
本发明提供了一种体外培养液,可将鼻黏膜进行体外培养,可以保持至少2周的活性,并拥有完整的上皮屏障与免疫系统,能够复制人体内的病毒感染过程,我们的研究表明,病毒能够成功感染培养的鼻黏膜,并通过切片观察到病毒蛋白的表达,从而可以实现离体鼻黏膜病毒感染实验。
附图说明
[0040]
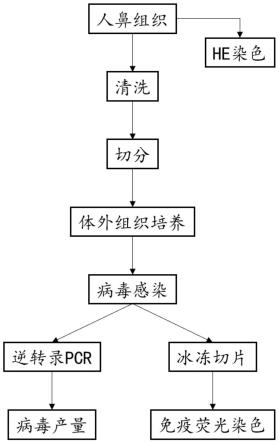
图1为鼻粘膜组织培养和新型冠状病毒(sars-cov-2)感染流程示意图。
[0041]
图2为鼻粘膜组织培养的第1、4和7天的显微镜明场下观察的照片。
[0042]
图3为鼻粘膜组织培养第7天dapi和he染色图,其中c图是dapi染色图,d图是he染色图。
[0043]
图4为鼻粘膜组织未感染和感染病毒后72小时的显微镜照片。
[0044]
图5为鼻粘膜组织未感染和感染病毒后72小时dapi和he染色图。
[0045]
图6为鼻粘膜组织未感染和感染病毒24小时,新型冠状病毒核衣壳蛋白(sars-cov-2n蛋白)和病毒受体血管紧张素转换酶2(ace2)的免疫荧光染色图。
[0046]
图7为鼻粘膜组织未感染和感染病毒48小时的he染色图和病毒感染48小时后sars-cov-2n蛋白和病毒受体ace2的免疫荧光染色图。
[0047]
图8为sars-cov-2n蛋白和纤毛细胞特异性标志物微管蛋白的免疫荧光染色图。
具体实施方式
[0048]
下面通过具体实施例对本发明的技术方案进行详细说明,但本发明的保护范围不限于此。
[0049]
实施例1
[0050]
体外培养液的成分如下表1所示。
[0051]
表1:
[0052][0053]
[0054]
鼻粘膜组织培养和sars-cov-2感染流程示意图如图1所示。具体步骤如下:
[0055]
(1)组织收集:将鼻黏膜离体后,浸泡在生理盐水中暂时保存,保存时间2小时;
[0056]
(2)清洗切分:用磷酸盐缓冲液(pbs)清洗离体的鼻粘膜,小心夹除血块、粘液和骨片;用剪刀小心分为2mm见方的小块,将每份组织放入24孔板中;
[0057]
(3)培养液中培养:每孔中加入2ml体外培养液,在37℃、5%co2的细胞培养箱中培养。鼻黏膜组织离体到加入体外培养液,总时间不超过12小时。本实施例中为6小时。
[0058]
(4)感染病毒:新型冠状病毒(pubmed np:mt627325)分离于海军军医大学生物安全三级实验室,用非洲猴肾细胞(vero e6)扩增后冻存于-80℃,使用前恢复至室温,以1*105的滴度加入培养液感染鼻黏膜。收集感染后的鼻黏膜,经trizol法提取rna,用逆转录pcr检测病毒产量和感染情况。
[0059]
所述步骤(3)中,以鼻黏膜的完整性作为活性标准,在显微镜下观察到纤毛摆动,视为上皮细胞仍有活性。
[0060]
进行鼻粘膜组织培养的第1、4和7天的显微镜明场下观察照片如图2所示,图2可以看出,在第7天也能清晰地检测到纤毛。
[0061]
如图3所示,dapi和he染色证实了第7天鼻粘膜组织培养物的结构完整性。
[0062]
体外培养两周后,显微镜下观察到纤毛摆动,结果表明鼻黏膜仍然完整有活性。
[0063]
通过光学显微镜明场下观察,未感染和感染的组织在病毒感染后72小时照片如图4所示,可见鼻黏膜组织大体完好。
[0064]
如图5所示,dapi和he染色显示,病毒感染72小时后鼻黏膜组织相比对照组,黏膜下层部分缺损,病毒感染造成了鼻粘膜破坏。
[0065]
图6结果表明,感染24小时病毒感染主要局限于上皮层和血管。鼻黏膜组织中的上皮和血管高表达病毒受体ace2,箭头表示上皮层和血管附近的病毒感染。
[0066]
图7显示,病毒感染48小时后的鼻黏膜上皮层he染色显示鼻黏膜结构有恶化的迹象。免疫荧光染色图显示了断裂的上皮层和黏膜中的sars-cov-2n蛋白,显示了病毒的破坏作用。
[0067]
图8显示sars-cov-2n蛋白和微管蛋白在人鼻粘膜中的免疫荧光共染色,微管蛋白为鼻黏膜上皮(假复层柱状上皮)中的纤毛细胞特异性标志物,表示病毒感染了上皮的纤毛细胞。
[0068]
图1~图8中,比例尺=100μm,图2和图4除外(比例尺=200μm)。
[0069]
比较例1
[0070]
改变体外培养液的组分,如下表2所示。
[0071]
表2
[0072]
成分表abcdefgr-spondin1///500ng/ml500ng/ml500ng/ml500ng/mlfgf7//25ng/ml/25ng/ml25ng/ml25ng/mlfgf10//100ng/ml/100ng/ml100ng/ml100ng/mlnoggin//100ng/ml100ng/ml/100ng/ml100ng/mla83-01//500nmol/l500nmol/l/500nmol/l500nmol/ly-27632//5umol/l5umol/l5umol/l/5umol/lsb202190//500nmol/l500nmol/l500nmol/l500nmol/l/b27/1x1x1x1x1x1x
n-acetylcysteine/1.25mmol/l1.25mmol/l1.25mmol/l1.25mmol/l1.25mmol/l1.25mmol/lnicotinamide/5mmol/l5mmol/l5mmol/l5mmol/l5mmol/l5mmol/lglutamax 100x/1x1x1x1x1x1xpenicillin/100u/ml100u/ml100u/ml100u/ml100u/ml100u/mlstreptomycin/100ug/ml100ug/ml100ug/ml100ug/ml100ug/ml100ug/mlprimocin/50ug/ml50ug/ml50ug/ml50ug/ml50ug/ml50ug/mldmem/f121x1x1x1x1x1x1x
[0073]
体外培养鼻黏膜组织的步骤如下:
[0074]
(1)组织收集:将鼻黏膜离体后,浸泡在生理盐水中暂时保存,保存时间1小时;
[0075]
(2)清洗切分:用磷酸盐缓冲液(pbs)清洗离体的鼻粘膜,小心夹除血块、粘液和骨片;用剪刀小心分为2mm见方的小块,将每份组织放入24孔板中;
[0076]
(3)培养液中培养:每孔中加入2ml表2中不同的体外培养液,在37℃、5%co2的细胞培养箱中培养。鼻黏膜组织离体到加入体外培养液,总时间不超过12小时。本实施例中为6小时。
[0077]
第一天每8小时,一天后每天用显微镜观察,结果表明,a组培养液第2天组织纤毛无法检测,上皮细胞丧失活性。无法进行病毒感染实验。
[0078]
b组培养液第4天组织纤毛无法检测,上皮细胞丧失活性。无法进行病毒感染实验。
[0079]
c组培养液第10天组织纤毛无法检测,上皮细胞丧失活性。无法进行病毒感染实验。
[0080]
d组培养液第9天组织纤毛无法检测,上皮细胞丧失活性。无法进行病毒感染实验。
[0081]
e组培养液第11天组织纤毛无法检测,上皮细胞丧失活性。无法进行病毒感染实验。
[0082]
f组培养液第8天组织纤毛无法检测,上皮细胞丧失活性。无法进行病毒感染实验。
[0083]
g组培养液第10天组织纤毛无法检测,上皮细胞丧失活性。无法进行病毒感染实验。
[0084]
以上所述,仅为本技术的较佳实施例,并非对本技术任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本技术方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本技术实施例所述的保护范围。凡熟悉本专业的技术人员,在不脱离本技术的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本技术的等效实施例;同时,凡依据本技术的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本技术的技术方案的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。